Method Article
نظام خلايا ثلاثي الثقافة نمذجة حاجز الدم والدماغ البشري
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول طريقة لإنشاء حاجز دموي دماغي بشري (BBB) في نموذج المختبر . يتم زرع الخلايا البطانية والخلايا المحيطة على كل جانب من جوانب مرشح الإدراج (حجرة الدم) ، ويتم زرع الخلايا النجمية في البئر السفلي (حجرة الدماغ). تم استخدام النموذج المميز لتجارب نقل الجسيمات النانوية.
Abstract
لا يزال توصيل الأدوية إلى الدماغ يمثل تحديا بسبب الخصائص المحددة والمقيدة للغاية للحاجز الدموي الدماغي (BBB) ، والتي تتحكم في الوصول إلى حمة الدماغ وتقيد الوصول إليها. ومع ذلك ، مع تطور تقنيات النانو ، تم تطوير لوحات كبيرة من المواد النانوية الجديدة لتحسين توصيل الأدوية ، مما يسلط الضوء على الحاجة إلى أنظمة دقيقة موثوقة في المختبر للتنبؤ باختراق الدماغ في إطار الفحوصات قبل السريرية. فيما يلي طريقة مباشرة لإعداد نظام فسيولوجي دقيق لنمذجة BBB باستخدام الخلايا البشرية فقط. في تكوينه ، يتكون النموذج من ثقافة ثلاثية بما في ذلك الخلايا البطانية الشبيهة بالدماغ (BLECs) ، والخلايا المحيطة ، والخلايا النجمية ، وهي الجهات الفاعلة الخلوية الرئيسية الثلاثة BBB اللازمة لحث وتنظيم خصائص BBB بطريقة فسيولوجية أكثر دون الحاجة إلى تشديد المركبات. يتميز النموذج الذي تم تطويره في شكل لوحة من 12 بئرا ، جاهزا بعد 6 أيام من الثقافة الثلاثية ، بالخصائص الفيزيائية والجينات وتعبيرات البروتين ويستخدم لقياس نقل nanogel البوليمري. يمكن استخدام النموذج لمجموعة واسعة من التجارب في الحالات الصحية والمرضية ويمثل أداة قيمة للتقييمات قبل السريرية لنقل الجزيئات والجسيمات ، وكذلك الاتجار بين الخلايا وداخلها.
Introduction
BBB ، المترجمة على مستوى الخلايا البطانية الشعرية في الدماغ (ECs) ، تتحكم في الوصول إلى حمة الدماغ وتنظمها ، وهو أمر بالغ الأهمية للحفاظ على توازن الدماغ ووظيفة الخلايا العصبية 1,2. ومع ذلك ، في حالة أمراض الدماغ ، يمثل عدم الوصول إلى حمة الدماغ عقبة حقيقية أمام تطوير استراتيجيات علاجية.
تمتلك BBB ECs مجموعة معقدة من الخصائص ، بما في ذلك بروتينات التقاطع الضيق (TJ) ، التي تغلق الفضاء بين الخلايا ، المرتبط بنظام من مضخات التدفق السائلة ، والناقلات المحددة ، والمستقبلات ، التي تتحكم في المسار عبر الخلوي1،2،3. علاوة على ذلك ، يتم تحفيز كل هذه الخصائص والحفاظ عليها ، وذلك بفضل الاتصالات مع الخلايا المحيطة المضمنة في الغشاء السفلي BBB EC والخلايا النجمية ، التي تحيط أقدامها النهائية بالشعيرات الدموية في الدماغ1،2،3. وبالتالي ، فإن دراسة BBB في المختبر تمثل تحديا بالنظر إلى تعقيد بنيتها والاتصالات بين أنواع الخلايا المختلفة التي تشكل وحدة الأوعية الدموية العصبية (NVU)2. علاوة على ذلك ، فإن أنواع الخلايا المختلفة ضرورية لتحريض وصيانة خصائص BBB وبالتالي تؤثر على التنبؤ بالعبور عبر BBB. تم بالفعل اختبار استراتيجيات مختلفة لتوصيل الدواء إلى الدماغ باستخدام مجموعة كبيرة من التكتيكات لتجاوز خصائص BBB المقيدة4. في الآونة الأخيرة ، مع تقدم تقنيات النانو ، يتم تطوير مواد جديدة للتطبيقات كناقلات للأدوية 5,6. بالإضافة إلى حمولتها الأعلى ، وانخفاض سميتها ، وزيادة التوافر البيولوجي للأدوية ، يمكن تشغيل هذه المواد النانوية الجديدة لاستراتيجية حصان طروادة لعبور BBB واستهداف الخلايا على وجه التحديد في حمة 5,6. من بين الأنواع المختلفة من المواد النانوية التي يتم تقييمها ، جذبت المواد الهلامية النانوية اهتماما كبيرا ، ويرجع ذلك أساسا إلى خصائصها الغروية وقدرتها على تكييف التركيب الكيميائي لإدخال خصائص تستجيب للمحفزات7،8،9،10،11،12،13،14،15.
يتم الآن تطوير نماذج في المختبر للدراسات قبل السريرية باستخدام الخلايا البشرية للتنبؤ باختراق الدماغ للأدوية16. تتوفر إعدادات مختلفة لهذه النماذج ، من الطبقات الأحادية من ECs الدماغية إلى أنظمة الخلايا المتعددة16. بالنظر إلى أهمية خلايا NVU في تحريض BBB وصيانته والاستجابة المنسقة للبيئة المرضية ، تحتاج نماذج BBB في المختبر إلى النظر في كل هؤلاء الأبطال لتحسين أهمية التنبؤ 2,17.
تصف الطريقة الحالية إعداد نموذج ثلاثي للزراعة في المختبر ل BBB البشري ، والذي تم تطويره بالكامل مع الخلايا البشرية لدراسة آليات جزيئية خلوية وبشرية محددة. لكي يكون النموذج ذا صلة فسيولوجية ، يتكون من الجهات الفاعلة الخلوية الثلاثة الرئيسية ل BBB (ECs ، pericytes ، والخلايا النجمية) اللازمة للحث على خصائص BBB والحفاظ عليها ، دون استخدام مركبات التشديد وعرض مجموعة من الخصائص المطلوبة للنظر فيها كنموذج BBB في المختبر 16,18. تم إعداد النموذج في تكوين يحدد حجرة الدم والدماغ ، وهو مناسب للدراسات قبل السريرية لنقل الأدوية والجسيمات للتنبؤ باختراق الدماغ. يتم توضيح فائدة النموذج من خلال قياس نقل المواد الهلامية النانوية البوليمرية.
Protocol
تمت الموافقة على البروتوكول من قبل وزارة التعليم العالي والبحث الفرنسي (المرجع: CODECOH DC2011-1321) ومن قبل مجلس مراجعة التحقيق المحلي (مستشفى بيتون للولادة، بيوفري، فرنسا). للحصول على الخلايا البطانية (ECs) ، تم الحصول على موافقة خطية ومستنيرة من والدي المتبرع لجمع دم الحبل السري ، وفقا للتشريع الفرنسي. يتم توفير الخلايا المحيطية من قبل البروفيسور تاكاشي كاندا (قسم علم الأعصاب وعلم الأعصاب السريري ، كلية الدراسات العليا في الطب بجامعة ياماغوتشي ، أوبي ، اليابان) التي تم عزلها وفقا للمرجع19. يتم شراء الخلايا النجمية الأولية لقشرة الدماغ البشرية من مزود تجاري (انظر جدول المواد).
1. زراعة الخلايا
- زراعة الخلايا البطانية
ملاحظة: الخلايا البطانية (ECs) مشتقة من الخلايا الجذعية المكونة للدم CD34+ المعزولة من دم الحبل السري البشري ، وفقا للطريقة التي وصفها Pedroso et al.20. تم وصف النمط الظاهري البطاني ل ECs في Pedroso et al.20.- زراعة ECs البشرية باستخدام وسط الخلايا البطانية المكمل ب 5٪ من مصل ربلة الساق الجنينية (FCS) ، و 0.5٪ من الجنتاميسين ، و 1٪ من ملحق نمو الخلايا البطانية (ECM) (انظر جدول المواد).
- بالنسبة ل ECs دون الاستزراع ، قبل يومين من إعداد النموذج ، قم بتغطية طبق واحد ب 10 مل من الجيلاتين بنسبة 2٪ لمدة 15 دقيقة عند 37 درجة مئوية ثم استبدله ب 20 مل من ECM الدافئ. قم بإذابة قارورة واحدة من ECs تحتوي على مليون خلية (تم حساب الخلايا يدويا كما هو موضح في الخطوة 2.3.3 قبل تجميد الخلايا) في طبق زراعة الخلايا المطلي مسبقا.
- بعد 3 ساعات عند 37 درجة مئوية ، قم بتجديد الوسط والحفاظ على الخلايا حتى وضع الزراعة الثلاثية في جو رطب داخل حاضنة عند 37 درجة مئوية تحت 5٪ CO 2 و 21٪ O2.
- زراعة الخلايا المحيطة
ملاحظة: يتم عزل الخلايا المحيطة عن الدماغ البشري وفقا للبروتوكول الذي نشره Shimizu et al.19 ، والذي يتبع إجراء عزله الطريقة التي نشرها Kanda et al.21 مع التعديلات.- قم بزراعة الخلايا المحيطة باستخدام وسط النسر المعدل من دولبيكو مع 4.5 جم / لتر من الجلوكوز (DMEM HG) ، و 10٪ من FCS ، و 1٪ من البنسلين / الستربتومايسين ، و 1٪ من L-glutamine (انظر جدول المواد).
- بالنسبة للزراعة الفرعية للخلايا ، قبل خمسة أيام من إعداد النموذج ، قم بتغطية طبقين ب 8 مل / طبق من 100 ميكروغرام / مل من محلول الكولاجين من النوع الأول في 0.02 N حمض الخليك لمدة 1 ساعة في درجة حرارة الغرفة (RT) ثم اغسله مرتين باستخدام RT DMEM HG. قم بإذابة قارورة واحدة من الخلايا المحيطة التي تحتوي على مليون خلية في أنبوب مخروطي يحتوي على 10 مل من الوسط الدافئ وطرد مركزي التعليق لمدة 5 دقائق عند 190 × g عند 20 درجة مئوية.
- أعد تعليق الكريات في 10 مل من الوسط الدافئ والبذور في أطباق زراعة الخلايا المغلفة مسبقا المليئة مسبقا ب 15 مل من الوسط / الطبق الدافئ. يتم تجديد الوسط بعد 3 أيام ، ويتم الحفاظ على الخلايا حتى إعداد الزراعة الثلاثية في حاضنة رطبة عند 37 درجة مئوية تحت 5٪ CO 2 و 21٪ O2.
- زراعة الخلايا النجمية
- زراعة الخلايا النجمية باستخدام وسط الخلايا النجمية مع استكمال 20 ٪ من FCS ، و 1 ٪ من ملحق نمو الخلايا النجمية ، و 1 ٪ من محلول البنسلين / الستربتومايسين (AM) (انظر جدول المواد).
- لزراعة الخلايا النجمية الفرعية ، قبل أسبوع واحد من إعداد النموذج ، قم بتغطية قارورة واحدة من ثقافة الخلايا T75 ب 10 مل من 2 ميكروغرام / سم2 بولي إل ليسين (PLL) لمدة 1 ساعة عند 37 درجة مئوية واغسلها مرتين بالماء المعقم RT. قم بإذابة قارورة واحدة من الخلايا النجمية تحتوي على 1 مليون خلية في 20 مل من الوسط الدافئ والبذور في قارورة زراعة الخلايا T75 المطلية مسبقا.
ملاحظة: تؤكد قوارير الخلايا التي تم الحصول عليها تجاريا وجود حوالي 1 مليون خلية ، لذلك لم يتم إجراء عد الخلايا هنا. - الحفاظ على الخلايا في حاضنة رطبة عند 37 درجة مئوية تحت 5٪ CO 2 و 21٪ O2. يتم تجديد الوسط بعد 24 ساعة ثم كل يومين حتى وضع الاستزراع الثلاثي.
2. إعداد نموذج الثقافة الثلاثية
ملاحظة: يتم تنفيذ تجميع أنواع الخلايا الثلاثة في نفس اليوم. في اليوم السابق لوضع الزراعة الثلاثية ، قم بإجراء طلاء الكولاجين من النوع الأول على مرشحات الإدراج المعادة (انظر جدول المواد) وزرع الخلايا النجمية في الآبار المطلية مسبقا ب PLL للوحة من 12 بئرا.
- بذر الخلايا النجمية في الآبار
- قم بتغطية الآبار بمحلول 500 ميكرولتر من محلول 2 ميكروغرام / سم 2 PLL كما هو موضح في الخطوة 1.3.2.
- اغسل الخلايا مرة واحدة ب 10 مل من محلول ملحي دافئ مخزن للفوسفات - خال من الكالسيوم والمغنيسيوم 1X (1X PBS-CMF) (الجدول 1) قبل احتضانها لمدة 3 دقائق عند 37 درجة مئوية مع 10 مل من محلول التربسين الدافئ 20٪ / EDTA (T / E) وافصل الخلايا ميكانيكيا عن القارورة. انقل التعليق إلى أنبوب مخروطي يحتوي على 5 مل من FCS الدافئ غير المخفف.
ملاحظة: وفقا لبروتوكول المزود22 ، يمكن تحسين مجموعة الخلايا النجمية عن طريق وضع القارورة في الحاضنة لمدة 1 دقيقة والنقر على القارورة للمساعدة في إكمال الانفصال. يجب جمع الخلايا المتبقية باستخدام 5 مل من محلول تحييد T / E ووضعها في الأنبوب المخروطي المحتوي على FCS. - جهاز طرد مركزي التعليق لمدة 5 دقائق عند 20 درجة مئوية عند 190 × جم.
- أعد تعليق بيليه الخلية في 5 مل من AM الدافئ. عد الخلايا عن طريق تخفيف 20 ميكرولتر من تعليق الخلية في 80 ميكرولتر من 1X PBS-CMF باستخدام غرفة عد يدوية تحت المجهر (انظر جدول المواد). لوحة حوالي 40000 خلية / سم2 في كل بئر مطلية مسبقا PLL في حجم 1.5 مل من AM الدافئة.
- بذر الخلايا المحيطة على مرشحات الإدراج المعادة
- أضف 250 ميكرولتر من محلول الكولاجين من النوع الأول (100 ميكروغرام / مل) على مرشحات الإدراج المعادة ، الموضوعة على محيط طبق مغطى بارتفاع 25 مم (انظر جدول المواد) باستخدام ملاقط معقمة. اترك الطلاء لمدة 1 ساعة في RT تحت ظروف معقمة.
ملاحظة: يجب أن يكون الطبق المستخدم مرتفعا بما يكفي لضمان الحفاظ على العقم عند الخروج من الغطاء وتجنب التلامس بين المحاليل الموجودة على الفلتر المعاد وغطاء الطبق. - قم بإزالة محلول الكولاجين من النوع الأول بعناية باستخدام ماصة زجاجية متصلة بنظام شفط. اغسل مرتين باستخدام 250 ميكرولتر من RT DMEM HG ثم قم بإزالة كل المحلول بعناية من مرشحات الإدراج. اترك مرشحات الإدراج المطلية في RT تحت ظروف معقمة حتى بذر الخلايا.
ملاحظة: أثناء إجراء الطلاء، احرص على عدم لمس الفلتر لتجنب تلف الغشاء. بمجرد طلائها بالكولاجين من النوع الأول ، يمكن تخزين مرشحات الإدراج بين عشية وضحاها في RT. - في يوم إعداد الزراعة الثلاثية ، اغسل الخلايا المحيطة مرتين ب 10 مل من 1X PBS-CMF الدافئ واحتضن الخلايا ب 2 مل من التربسين الدافئ. مراقبة عمل التربسين من خلال مراقبة الخلايا تحت المجهر. بمجرد أن تبدأ الخلايا في الانفصال ، قم بإزالة التربسين وإضافة 5 مل من ECM الدافئ قبل التفكك الميكانيكي.
- عد الخلايا عن طريق تخفيف 20 ميكرولتر من تعليق الخلية في 80 ميكرولتر من 1X PBS-CMF باستخدام غرفة عد يدوية تحت المجهر ، وزرع 44500 خلية / سم2 على مرشحات الإدراج المرتجعة المغلفة مسبقا بحجم 250 ميكرولتر.
- قم بإرجاع مرشحات الإدراج بعناية باستخدام ملاقط معقمة في صفيحة من 12 بئرا تحتوي على 1.5 مل من ECM / بئر دافئ. مرشحات الإدراج جاهزة الآن للطلاء على الجانب الآخر.
- أضف 250 ميكرولتر من محلول الكولاجين من النوع الأول (100 ميكروغرام / مل) على مرشحات الإدراج المعادة ، الموضوعة على محيط طبق مغطى بارتفاع 25 مم (انظر جدول المواد) باستخدام ملاقط معقمة. اترك الطلاء لمدة 1 ساعة في RT تحت ظروف معقمة.
- بذر الخلايا البطانية على مرشحات الإدراج
- قم بتغطية الجانب العلوي من مرشحات الإدراج ب 500 ميكرولتر من الهيدروجيل القائم على المصفوفة خارج الخلية (1/48 v / v) (انظر جدول المواد). بعد 1 ساعة ، في حاضنة رطبة عند 37 درجة مئوية تحت 5٪ CO 2 و 21٪ O2 ، اغسل مرة واحدة ب 500 ميكرولتر من RT DMEM HG.
- يغسل مرة واحدة مع 10 مل من 1X PBS-CMF الدافئ واحتضان الخلايا مع 2 مل من التربسين الدافئ. بمجرد أن تبدأ الخلايا في الانفصال ، قم بإزالة التربسين وإضافة 5 مل من ECM الدافئ قبل التفكك الميكانيكي.
- عد الخلايا عن طريق تخفيف 20 ميكرولتر من تعليق الخلية في 80 ميكرولتر من 1X PBS-CMF باستخدام غرفة عد يدوية تحت المجهر وزرع ECs بكثافة 71500 خلية / سم2 على مرشحات الإدراج المغلفة مسبقا بحجم 500 ميكرولتر من ECM الدافئ.
- استبدل AM ب 1.5 مل من ECM / بئر دافئ ثم انقل مرشحات الإدراج البذرية (ECs + pericytes) على الآبار التي تحتوي على الخلايا النجمية.
- ضع أنظمة خلايا الزراعة الثلاثية في حاضنة رطبة عند 37 درجة مئوية تحت 5٪ CO 2 و 21٪ O2.
- الحفاظ على زراعة الخلايا الثلاثية لتحريض خصائص BBB
ملاحظة: لتحريض خصائص BBB في ECs ، من الضروري 6 أيام من الثقافة الثلاثية.- قم بتجديد الوسط كل يومين حتى اليوم 6 ، وقم بخلع الوسط بعناية من المقصورة العلوية والسفلية باستخدام ماصة زجاجية متصلة بنظام الشفط.
- استبدل بسرعة ب ECM دافئ بحجم 500 ميكرولتر في المقصورة العلوية و 1.5 مل في المقصورة السفلية ، وأعد الخلايا في حاضنة رطبة عند 37 درجة مئوية تحت 5٪ CO 2 و 21٪ O2.
3. التحقق من صحة النمط الظاهري BBB
ملاحظة: بعد 6 أيام من الثقافة الثلاثية ، وهو الوقت اللازم لتحفيز النمط الظاهري BBB في ECs ، يكون نموذج BBB البشري جاهزا للتجارب. يتم تصور السلامة الجسدية للخلايا البطانية الشبيهة بالدماغ (BLECs) من خلال تلطيخ التألق المناعي لبروتينات TJ التي تم تقييمها باستخدام اختبار النفاذية لعلامات سلامة BBB. يتضمن التحقق من صحة النمط الظاهري BBB أيضا تحليل التعبير عن الجينات / البروتينات ووظائف مضخات التدفق السائلة وفقا للإجراء الموضح في Deligne et al.,23. يتم تصور الخلايا المحيطة والخلايا النجمية بواسطة علامات التلطيخ ذات الصلة وفقا للإجراء الموصوف في Deligne et al. 202023.
- تلطيخ التألق المناعي
- قم بإصلاح مرشحات الإدراج والخلايا النجمية في الميثانول / الأسيتون البارد (50/50 فولت / فولت) لمدة دقيقة واحدة واغسلها مرتين باستخدام RT 1X PBS-CMF.
- افصل الفلتر بعناية عن الإدراج عن طريق قطع الغشاء باستخدام مشرط. إجراء الكيمياء المناعية على الغشاء والآبار السفلية وفقا ل Deligne et al.23.
ملاحظة: بالنسبة لخطوة الحظر، استخدم 250 ميكرولتر من المخزن المؤقت لحظر كتلة SEA (راجع جدول المواد) لمدة 30 دقيقة في RT.
- فحص سلامة BBB
- قم بتقييم السلامة الفيزيائية ل BLECs من خلال فحص النفاذية باستخدام علامات سلامة BBB ذات الأوزان الجزيئية المختلفة ، مثل فلوريسين الصوديوم (NaF) و 20 kDa Dextran (FD20) (انظر جدول المواد).
ملاحظة: يمكن إجراء التجربة وفقا للإجراء الموضح في Deligne et al.23.
- قم بتقييم السلامة الفيزيائية ل BLECs من خلال فحص النفاذية باستخدام علامات سلامة BBB ذات الأوزان الجزيئية المختلفة ، مثل فلوريسين الصوديوم (NaF) و 20 kDa Dextran (FD20) (انظر جدول المواد).
- وظيفة مضخة التدفق السائلة
- تقييم وظائف البروتين السكري P (P-GP) والبروتين المقاوم لسرطان الثدي (BCRP) عن طريق قياس التراكم داخل الخلايا للرودامين 123 (R123) مع وبدون Elacridar ، وهو مثبط P-GP و BCRP (انظر جدول المواد).
ملاحظة: يمكن إجراء التجربة وفقا للإجراء الموضح في Deligne et al.23.
- تقييم وظائف البروتين السكري P (P-GP) والبروتين المقاوم لسرطان الثدي (BCRP) عن طريق قياس التراكم داخل الخلايا للرودامين 123 (R123) مع وبدون Elacridar ، وهو مثبط P-GP و BCRP (انظر جدول المواد).
- التعبيرات الجينية والبروتينية
- قم بإجراء جمع عينات من الجينات والبروتين على الجليد بعد غسلها بسرعة باستخدام Ringer HEPES (RH) البارد (الجدول 1) للخلايا. قبل جمع عينات EC ، قم بكشط الخلايا المحيطة من مرشحات الإدراج المقلوبة20.
4. نقل نانوجيل
ملاحظة: لتقدير مرور المواد الهلامية النانوية البوليمرية (NGs) من المقصورة المضيئة إلى المقصورة المضيئة لنموذج BLEC ثلاثي الاستزراع، تمت إضافة 0.1 ملغم/مل من محلول NG في اليوم 6 على المقصورة المضيئة لمدة 24 ساعة. تم وضع علامة على NGs المدروسة بشكل فلوري N-Isopropylacrylamide (NIPAM) مع متوسط حجم 8-10 نانومتر (انظر جدول المواد).
- وزن مسحوق نانوجيل وذوبته في ECM بتركيز 1 ملغ / مل. قم بإلغاء صوت المحلول لمدة 10 دقائق وقم بالتصفية باستخدام مرشح PTFE بحجم 0.2 ميكرومتر.
ملاحظة: قم بإعداد حل NG جديد في يوم التجربة. - قم بتغيير الوسط في المقصورة المضيئة وأضف 50 ميكرولتر من محلول NGs في المقصورة العلوية للحصول على تركيز نهائي قدره 0.1 مجم / مل.
ملاحظة: قم بإجراء تخفيف بنسبة 1:10 من الحل الأصلي. - بعد 24 ساعة من الحضانة ، اجمع الأليكوتات من مقصورات مضيئة (20 ميكرولتر) ومضيئة (200 ميكرولتر) وضعها في لوحة سوداء من 96 بئرا.
- حدد كمية التألق باستخدام قارئ الفلورسنت متعدد الصفائح (انظر جدول المواد) مع لوحة سوداء من 96 بئرا باستخدام إعداد الأطوال الموجية للإثارة / الانبعاثات عند 477/540 نانومتر. احسب النسبة المئوية للعبور المشار إليه إلى حل العمل الأولي المضاف في الوقت = 0 h (t0) 6,15.
ملاحظة: لإعداد لوحة 96 بئرا لقياس التألق، أضف 200 ميكرولتر من المحلول من المقصورة المضيئة و20 ميكرولتر من المحلول من المقصورة المضيئة وإعداد t0 (أضف 180 ميكرولتر من ECM للوصول إلى حجم نهائي قدره 200 ميكرولتر). قم أيضا بتضمين منحنى معايرة وفراغ في لوحة القراءة. المعلمات المفيدة: طريقة الكشف - التألق ، الموضع البصري - الأعلى ، نوع القراءة - نقطة النهاية ، الطول الموجي للإثارة - 477 نانومتر ، الطول الموجي للانبعاثات - 540 نانومتر ، الحساسية - 100 ، اهتزاز - مدار مزدوج لمدة 5 ثوان.
النتائج
إعداد نموذج BBB للثقافة الثلاثية البشرية
البروتوكول المطلوب لإعداد نموذج BBB البشري في المختبر موصوف في الشكل 1 ويتضمن خطوات متتالية يجب احترام ترتيبها بدقة. أولا ، يتم زراعة أنواع الخلايا الثلاثة بشكل فردي في أطباق زراعة الخلايا (الشكل 1A) قبل تجميعها في نظام مرشح إدراج. يبدأ إعداد الاستزراع الثلاثي ببذر نوع الخلايا الأول ، الخلايا النجمية ، في البئر السفلي المطلي مسبقا. في اليوم التالي ، يتم زرع الخلايا المحيطة و ECs على الأسطح المضيئة والمضيئة المطلية مسبقا بمرشح الإدراج ، على التوالي. ثم يتم نقل مرشح الإدراج فوق الخلايا النجمية. يتم الحفاظ على النموذج في الثقافة لمدة 6 أيام ، وهو الوقت اللازم لتحفيز خصائص BBB في ECs ، مع تجديد الوسط كل يومين وفقا لنموذج الثقافة المشتركة24 الحاصل على براءة اختراع. ثم يعاد تسمية الجماعات الأوروبية باسم BLECs (الشكل 1B).
توصيف نموذج BBB البشري
تم تمييز نموذج زراعة الخلايا الثلاثية لوجود مجموعة من الخصائص الخاصة ب BBB. بادئ ذي بدء ، أكدت بيانات الكيمياء المناعية التعبير عن العلامات التقليدية مثل مستقبلات عامل النمو المشتقة من الصفائح الدموية β (PDGFR-β)25,26 و desmin للخلايا المحيطة والبروتين الحمضي الليفي الدبقي (GFAP)26 للخلايا النجمية (الشكل 2A). وبالتالي ، بعد 6 أيام من الثقافة مع الخلايا المحيطة والخلايا النجمية ، تعرض الطبقة الأحادية من BLECs ، التي تم تصورها مع تلطيخ التقاطع الملتصق ب VE-Cadherin ، توطينا مستمرا لبروتينات TJ ، Claudin-5 و ZO-1 ، على حدود الخلية (الشكل 2A). يرتبط إعداد TJs بمعاملات نفاذية شبه خلوية منخفضة تم قياسها باستخدام علامات سلامة BBB ذات الوزن الجزيئي المنخفض ، أي NaF (376 Da)16,27 والوزن الجزيئي العالي ، أي FD20 (20 kDa)27 ، كما هو موضح في الشكل 2B. القيم المقاسة قابلة للمقارنة مع نماذج BBB في المختبر التي تم التحقق من صحتها باستخدام المصدر الدقيق ل ECs23,24,28. إجمالا ، تسلط هذه النتائج الضوء على النفاذية شبه الخلوية المنخفضة للطبقة الأحادية BLEC الثلاثية ، والتي تتميز بها BBB في الجسم الحي. بالإضافة إلى ذلك ، أظهر تراكم R123 داخل الخلايا في BLECs زيادة كبيرة في وجود مثبط مضخة التدفق السائلة Elacridar 23,24 مقارنة بحالة التحكم مع غيابه (الشكل 2C). وهذا يشير إلى وجود جزيئات مضخة التدفق السائلة النشطة ، وهي P-gp و BCRP ، في BLECs.
لمزيد من توصيف BLECs ، تمت دراسة التعبير الجيني ومستوى البروتين لميزات BBB الرئيسية (الشكل 3). تمت مقارنة البيانات التي تم الحصول عليها باستخدام نموذج الثقافة الثلاثية مع نموذج الثقافة المشتركة الذي تم التحقق منه والحاصل على براءة اختراع والذي يتكون من ECs و pericytes24 المستخدم كنموذج تحكم. تمثل الخلايا النجمية نوع الخلايا الثالث المضاف في نموذج الزراعة المشتركة الأولي في نموذج الاستزراع الثلاثي. ومن ثم، أظهر تحليل التعبير الجيني (الشكل 3A) ل BLECs ذات الثقافة الثلاثية، مقارنة ب BLECs ذات الثقافة المشتركة، الحفاظ على التعبير عن السمات الرئيسية ل BBB مثل بروتينات TJ (كلودين-5 وزونولا أوكلودينز-1) ومضخات التدفق السائلة (P-gp و BCRP)، وتنظيم معظم ناقلات BBB المدروسة (ناقل الجلوكوز 1) والمستقبلات (مستقبلات الترانسفيرين). ووجد أن بيانات تحديد كمية البروتين (الشكل 3 ب) تتماشى مع نتائج النسخ. بشكل عام ، تدعم هذه البيانات الحث الإيجابي لخصائص BBB في طبقة BLEC ثلاثية الثقافة على غرار نموذج الثقافة المشتركة الذي تم التحقق منه. إجمالا ، يعرض نموذج الثقافة الثلاثية الخصائص الفيزيائية والأيضية المطلوبة لنظام الفيزيولوجيا الدقيقة في المختبر لنمذجة BBB.
قابلية التطبيق على استراتيجيات توصيل الأدوية - قياس نقل النوجيل
لتقييم إمكانية استخدام نموذج الثقافة الثلاثية لدراسة استراتيجيات توصيل الدماغ الجديدة ، تم تقييم نقل NGs المحايدة القائمة على NIPAM الموسومة بالفلورسنت 6,15. وفي الوقت 0، وضعت النواتج الوطنية في المقصورة المضيئة بتركيز 0.1 ملغم/مل (الشكل 4 ألف). بعد 24 ساعة من الحضانة ، تم العثور على 5.82٪ من NGs في المقصورة المضيئة (الشكل 4B) ، مما يثبت قدرتها على عبور BLECs.
وتبين النتائج مدى ملاءمة النموذج لقياس نفاذية المركبات الصغيرة والكبيرة، كما هو موضح بعلامات النزاهة، وتقييم نقل المواد النانوية مثل النواتج الوطنية البوليمرية.
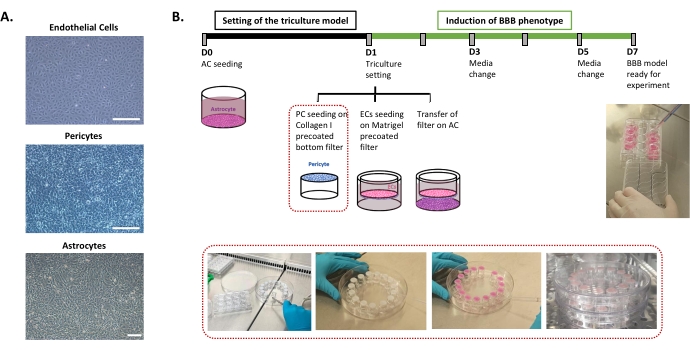
الشكل 1: تمثيل الخطوات الحاسمة لإعداد نموذج الزراعة الثلاثية في المختبر ل BBB البشري. (A) صور تباين الطور للمكونات الخلوية الثلاثة لنموذج BBB: الخلايا البطانية (EC) ، pericytes (PC) ، والخلايا النجمية (AC). شريط المقياس = 250 ميكرومتر (B) جدول زمني تخطيطي وتوضيحي لإعداد نموذج BBB البشري للثقافة الثلاثية في المختبر. يمثل المربع المميز إجراء الطلاء لمرشح الإدراج المقلوب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
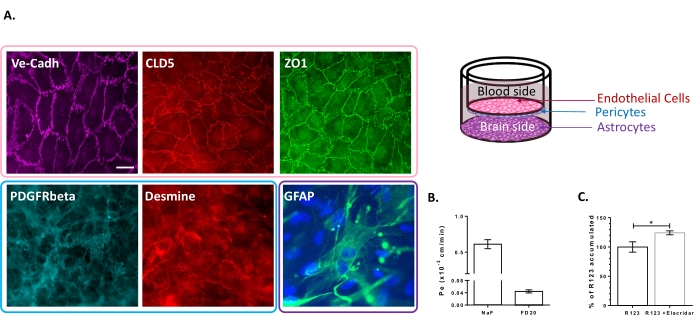
الشكل 2: تقييم خصائص نموذج BBB للثقافة الثلاثية. (أ) صور التلطيخ المناعي التمثيلي للعلامات المميزة ل BLECs (Claudin-5: CLD5 ، Zona Occludens-1: ZO1 و VE-Cadherin: Ve-Cadh) ، pericytes (مستقبلات عامل النمو المشتقة من الصفائح الدموية - β: PDGFR-β و desmin) ، والخلايا النجمية (البروتين الحمضي الليفي الدبقي: GFAP). شريط المقياس = 10 ميكرومتر (B) نفاذية الخلايا شبه الخلوية ل BLECs إلى علامات سلامة BBB الفلورية ، فلوريسين الصوديوم (NaF ، 376 Da ، Pe: 0.61 ± 0.062) و FITC-Dextran (FD20 ، 20 kDa ، Pe: 0.04 ± 0.005). N = 3; ن = 9. تم تقييم متوسط ± وظائف SEM. (C) P-gp و BCRP في ECs من خلال تحديد R123 داخل الخلايا بنسبة (124.2٪ ± 3.39٪) وبدون (100٪ ± 8.79٪) Elacridar. N = 4; ن = 12. متوسط ± SEM. p = 0.017 باستخدام اختبار t غير مقترن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
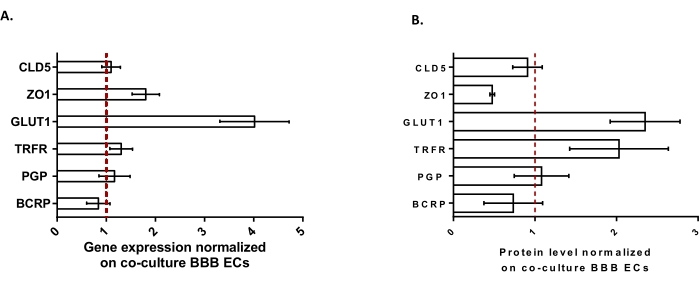
الشكل 3: تقييم التعبير الجيني BLEC ومستوى البروتين للعلامات المميزة في نموذج الثقافة الثلاثية مقارنة بنموذج BBB للثقافة المشتركة. (A) التعبير الجيني لبروتينات الوصلة الضيقة (Claudin-5: CLD5 ، و Zona Occludens-1: ZO1) ، والناقلات (ناقل الجلوكوز-1: GLUT1 ، والبروتين السكري: PGP ، والبروتين المقاوم لسرطان الثدي: BCRP) ، ومستقبلات الجزيئات الكبيرة (مستقبلات الترانسفيرين: TRFR) ، التي تم تطبيعها من خلال التعبير عن RPLP0. N = 3; ن = 9. (ب) مستوى البروتين من بروتينات الوصلة الضيقة (CLD5 و ZO1) ، والناقلات (GLUT1 ، PGP ، و BCRP) ، ومستقبلات الجزيئات الكبيرة (TRFR) ، التي يتم تطبيعها عن طريق التعبير عن β-actin. N = 3; ن = 9. يعني ± SEM. بالنسبة لل (A) و (B) ، تتوافق القيم >1 مع ارتفاع مستويات التعبير الجيني أو البروتين في نموذج الثقافة الثلاثية. يتوافق الخط الأحمر مع قيمة 1 حيث يكون مستوى التعبير (الجينات أو البروتينات) للنموذجين متساويا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
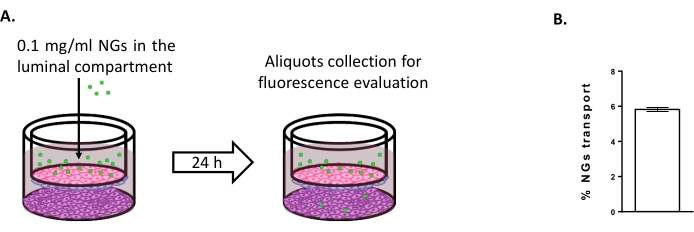
الشكل 4: قياس انتقال النوجيل في نموذج الاستزراع الثلاثي. (أ) التمثيل التخطيطي لفحص نقل النوجل. (ب) النسبة المئوية لنقل الهلام النانوي بعد 24 ساعة من الحضانة في نموذج الاستزراع الثلاثي (5.82٪ ± 0.09٪). N = 2; ن = 6. يعني ± SEM. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| اسم المخزن المؤقت | تكوين | ملاحظه | ||||
| وزن جزيئي | ||||||
| محلول ملحي عازل من الفوسفات، خال من الكالسيوم والمغنيسيوم | PBS-CMF | كلوريد الصوديوم | 8 جم/لتر | 58.4 | أضف كل المركب إلى الماء المعقم وانتظر الذوبان الكامل. يجب أن يكون الرقم الهيدروجيني للمحلول الذي تم الحصول عليه في حدود 7.3-7.4. قم بترشيح المحلول باستخدام غشاء 0.22 ميكرومتر وتخزين المحلول المعقم عند 4 درجات مئوية. | |
| كيه سي ال | 0.2 جم/لتر | 74.55 | ||||
| KH2PO4 | 0.2 جم/لتر | 136.09 | ||||
| ناهبو4-12 ح2س | 2.87 جم/لتر | 358.14 | ||||
| الماء | ||||||
| رينجر هيبس | الصحة الإنجابية | كلوريد الصوديوم | 8.8 جم/لتر | 58.4 | أضف كل المركب إلى الماء المعقم وانتظر الذوبان الكامل. اضبط الرقم الهيدروجيني على 7.4 (بدء حل الأس الهيدروجيني حوالي 6.8). قم بترشيح المحلول باستخدام غشاء 0.22 ميكرومتر وتخزين المحلول المعقم عند 4 درجات مئوية. | |
| كيه سي ال | 0.387 جم/لتر | 74.55 | ||||
| كاكل2 | 0.244 غ/لتر | 110.99 | ||||
| MgCl 2 6H2 O | 0.0406 جم/لتر | 203.3 | ||||
| ناهكو3 | 0.504 جم/لتر | 84.1 | ||||
| هيبس | 1.19 جم/لتر | 238.3 | ||||
| الجلوكوز | 0.504 جم/لتر | 180.16 | ||||
| الماء | ||||||
الجدول 1: تكوين المخازن المؤقتة المختلفة المستخدمة في البروتوكول.
Discussion
لا يزال علاج أمراض الدماغ يمثل تحديا بالنظر إلى صعوبة الأدوية في التغلب على BBB للوصول إلى أهدافها الخلوية والجزيئية في حمة الدماغ.
يظهر تطوير الأدوية لأمراض الدماغ حاليا معدل نجاح منخفض لأن معظم الأدوية التي تعرض نتائج واعدة في النماذج قبل السريرية فشلت في إظهار أي فائدة عند استخدامها في العيادة. باتباع "قاعدة 3R" ، التي تهدف إلى تقليل عدد الحيوانات المستخدمة في التجريب ، يتم تطوير نماذج في المختبر من BBB لدراسة أمراض الدماغ والتنبؤ باختراق الدماغ للعقاقير29. تم تطوير نماذج BBB في المختبر بشكل رئيسي باستخدام الخلايا الحيوانية وأصبحت أكثر تطورا لتحسين أهمية النتائج التي تم الحصول عليها16. أحد التطورات الهامة في استخدام الخلايا البشرية ، والتي تجلب رؤية جديدة لا يمكن إنكارها والمزيد من التحديد ، على المستويين الخلوي والجزيئي ، لدراسة آليات الأمراض البشرية16. ومع ذلك ، فإن تطوير النماذج ذات الصلة يتطلب النظر في تحسين إعدادات نموذج BBB في المختبر والمعرفة الناشئة ، وذلك بفضل النماذج الحيوانية. وبالتالي ، فإنه يحتاج إلى النظر في تعقيد بنية BBB وأهمية الاتصالات الخلوية الخلوية لدراسة BBB في ظل الظروف الفسيولوجية والمرضية30.
يصف البروتوكول المعروض هنا طريقة لإعداد نموذج BBB البشري الكامل في المختبر الذي يضم أنواع الخلايا الرئيسية الثلاثة ل BBB ، دون قيود على الوصول إلى أنسجة المخ. كنظام متعدد الخلايا ، فإن الحث والحفاظ على خصائص BBB ، دون الاستخدام الاصطناعي لمركبات التشديد ، ولكن بدلا من ذلك تسببه اتصالات الخلايا الخلوية أكثر ملاءمة من الناحية الفسيولوجية ويتماشى مع الحث في الجسم الحي لخصائص BBB31. ومن ثم، فإن احترام التسلسل الزمني للبروتوكول يكتسي أهمية قصوى لنجاح البروتوكول. علاوة على ذلك ، تمثل أوقات الحضانة أثناء إعداد الثقافة الثلاثية وبمجرد تجميع أنواع الخلايا الثلاثة الخطوات الحاسمة الرئيسية للبروتوكول.
يتم تحفيز خصائص BBB في ECs من خلال الثقافة المشتركة مع pericytes ، كما هو موضح لنموذج الثقافة المشتركة24. وبالتالي ، فإن ثقافة pericytes في الجانب الخلفي من مرشح الإدراج هي النقطة الأكثر أهمية وتتطلب اتباع البروتوكول بدقة في خطر عدم وجود ما يكفي من pericytes لتحريض خصائص BBB. بادئ ذي بدء ، أثناء إجراء الطلاء وكذلك بذر الخلايا ، يجب الانتباه إلى عدم ملامسة غطاء طبق بتري للطلاء وكذلك الوسط بمجرد زرع الخلايا لضمان طلاء جيد للمرشح وعدم فقدان الخلايا (الخطوتان 2.2.1 و 2.2.4). علاوة على ذلك ، بمجرد زرع الخلايا المحيطة ، من الضروري الانتظار في الوقت المحدد لربط الخلايا المحيطة (الخطوة 2.2.4) قبل الرجوع إلى مرشح الإدراج لطلاء وبذر ECs على الجانب الآخر (الخطوتان 2.2.5 و 2.3). بمجرد البذر ، هناك حاجة إلى ستة أيام لتحفيز خصائص BBB من خلال اتصالات الخلايا الخلوية (الخطوة 2.4).
يتم التحقق من صحة النموذج من حيث النفاذية المقيدة (المرتبطة بإعداد التقاطعات الضيقة) نظرا لأن ECs لنموذج الثقافة الثلاثية تعرض قيم نفاذية لعلامات سلامة BBB مماثلة لنموذج الاستزراع المشترك الذي تم التحقق منه ويتم قياسه أيضا في النماذج الحيوانية أو البشرية التي تم التحقق منها16،27،32. علاوة على ذلك ، يتطلب التحقق من صحة نموذج BBB في المختبر ، بالإضافة إلى النفاذية المحدودة ، الاستجابة لأنواع الخلايا الأخرى من NVU والتعبير عن المستقبلات الوظيفية والناقلات16. بالإضافة إلى ذلك ، فإن النموذج قابل للتكرار وينتج العديد من مرشحات الإدراج والآبار لإجراء العديد من التحليلات (التعبير الجيني والبروتيني ، تلطيخ الفلورسنت ، اختبارات السمية) على كل نوع من الخلايا على حدة دون الحاجة إلى طريقة فرز الخلايا.
تم تطوير النموذج باستخدام مرشح بحجم المسام 0.4 ميكرومتر ليكون له نوع خلية واحد على كل جانب من جوانب مرشح الإدراج. سمح نظام مرشح الإدراج بدراسة الاتصالات الخلوية الخلوية في الظروف الفسيولوجية عن طريق نقلها على الخلايا النجمية المحتوية بشكل جيد. يمثل وجود الخلايا النجمية في النظام قيمة زائدة مقارنة بالزراعة المشتركة الأولية في المختبر نموذج24. في الواقع ، بالنظر إلى أهمية الخلايا النجمية في فسيولوجيا BBB ، فإن هذا النوع الثالث من الخلايا يسمح بمزيد من الفهم لاتصالات الخلايا الخلوية داخل BBB. علاوة على ذلك ، يمكن أيضا دراسة نظام زراعة الخلايا الثلاثية في الحالات المرضية مثل السكتة الدماغية ، حيث تلعب الخلايا النجمية دورا أساسيا33،34،35. بالإضافة إلى ذلك ، يمكن بسهولة وضع تصميم BLECs / pericytes على جانبي مرشح الإدراج على أنواع الخلايا الأخرى لتقليد الحالات المرضية مثل سرطان الدماغ23.
يمكن أن يؤدي حجم مسام مرشح الإدراج إلى فرض قيود مع بعض التجارب، مثل ترحيل الخلايا عبر BBB. ومع ذلك ، فإن تطوير النموذج بحجم مسام أكبر يتطلب تكييف البروتوكول لضمان تكوين طبقة أحادية فسيولوجية من ECs وليس طبقات متعددة ، والتي ليست ذات صلة فسيولوجية لتقليد BBB36.
وقد تم إثبات قابلية تطبيق النموذج باستخدام تجربة نقل NGs التي تظهر إمكانية إجراء تجربة نقل باستخدام نظام متعدد الخلايا. ومع ذلك ، ينبغي للمرء أن يكون على دراية بالصعوبات في وجود مركب أو جزيء تحكم لتجربة النقل ، وتقاسم خصائص مماثلة مع NGs لأن كل بنية نانوية تظهر مجموعة فريدة من الخصائص (الوزن الجزيئي ، الشحنة ، الشكل ، الخصائص الفيزيائية ، تكوين كورونا البروتين).
أحد قيود النموذج هو عدم وجود إجهاد القص ، والذي ثبت أنه يؤثر على تمايز ECs والتعبير عن بروتينات TJ37. ومع ذلك ، فإن تطوير نظام سائل يحاكي الشعيرات الدموية في الدماغ يمثل تحديا بالنظر إلى تعقيد إضافة جزء سائل ، يتطلب جهازا معينا ، في نظام متعدد الخلايا. علاوة على ذلك ، عادة ما يكون الجهاز المعين غير متاح تجاريا ولا يسمح بالعديد من النسخ المتماثلة ، مما يجعل الأنظمة المائعة أقل تكيفا للاستخدام عالي الإنتاجية.
باختصار ، هذا النظام الثلاثي للزراعة الذي يتكون من خلايا بشرية يستنسخ في المختبر بنية BBB. يسمح بتوليد العديد من الإدخالات التي يمكن استخدامها لفحص شامل للمركبات.
Disclosures
ويعلن صاحبا البلاغ أنه ليس لديهما تضارب في المصالح.
Acknowledgements
يتم منح هذا العمل من قبل برنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي بموجب اتفاقية المنحة No 764958 ، كجزء من مشروع NANOSTEM ، وهي شبكة ماري سكلودوفسكا-كوري للتدريب المبتكر (ITN) (زمالة إليونورا ريزي). وتمنح هذه الدراسة من قبل "المجلس الإقليمي لبلدان الشمال - باس - دو كاليه" (زمالة كليمانس ديلين)، و "الجمعية الفرنسية لمكافحة السرطان و لوسيمات الطفل والمراهقين" (SFCE)، وجمعية "النجم دي مارتن" وجمعية "كاساندرا لمكافحة الليوسيمي".
Materials
| Name | Company | Catalog Number | Comments |
| Cell Culture | |||
| Astocyte Medium (AM) | ScienCell | 1801 | |
| Astrocyte Growth Supplement | ScienCell | 1852 | Astrocyte Growth Supplement is provided in the AM set. |
| Cell culture dish 100 mm | Corning | 430293 | 100 mm x 20 mm; dish used for the thawing of ECs and PCs before the triculture setting |
| Cell culture dish 150 mm | Corning | 430599 | The height of these dishes (25 mm) allows the seeding of PCs in the reverted insert for the setting of the triculture model. |
| Collagen I | Corning | 354236 | Rat tail |
| Dulbecco's Modified Eagle Medium | Gibco | 31600-083 | Powder |
| Endothelial Cell Growth Supplement | ScienCell | 1051 | Endothelial Cell Growth Supplement is provided in the ECM set. |
| Endothelial Cell Medium (ECM) | ScienCell | 1001 | |
| Fetal Calf Serum | Sigma | F7524 | |
| Gelatin | Sigma | G2500 | 2% gelatin from porcine skin in PBS-CMF |
| Gentamicin | BiochromA6 | A-2712 | |
| Glucose | Sigma | G6152 | Powder |
| Glutamine | Merck | 1002891000 | |
| Human Brain Cortex Astrocytes | ScienCell | 1800-SC | |
| Malassez cell counting chamber | vWR | HECH40453702 | The count was performed manually. |
| Matrigel | Corning | 354230 | Extracellular matrix-based hydrogel |
| Penicillin/Streptomycin | ScienCell | 0503 | Penicillin/Streptomycin solution is provided in the ECM and AM sets. |
| Poly-L-lysine | ScienCell | 0413 | |
| Steritop | Millipore System | SCGPT0SRE | 0.22 µm pore size |
| Transwell insert | Corning | 3401 | 0.4 µm pore polycarbonate filter |
| Trypsin/EDTA neutralization solution | ScienCell | 0113 | |
| Trypsin/EDTA solution | ScienCell | 0103 | |
| Immunocytochemistry | |||
| SEA BLOCK blocking buffer | ThermoScientific | 37527 | |
| Alexa Fluor 568 anti-Mouse secondary antibody | Thermofisher | A11031 | Dilution 1:500 |
| Alexa Fluor 568 anti-Rabbit secondary antibody | Thermofisher | A11036 | Dilution 1:500 |
| Anti-Claudin-5 primary antibody | InVitrogen | 34-1600 | Dilution 1:100 |
| Anti-Desmin primary antibody | Abcam | ab6322 | Dilution 1:200 |
| Anti-Glial Fibrillary Acidic Protein primary antibody | Dako | Z0334 | Dilution 1:500 |
| Anti-Platelet-Derived Growth Factor-β primary antibody | Abcam | ab51090 | Dilution 1:200 |
| Anti-VE-cadherin primary antibody | Abcam | ab207732 | Dilution 1:200 |
| Anti-Zona Occludens-1 primary antibody | InVitrogen | 61-7300 | Dilution 1:200 |
| Normal Goat Serum | Sigma | G6767 | |
| ProLong Diamond Antifade Mountant with DAPI | Invitrogen | P36962 | |
| Gene expression | |||
| NucleoSpin Rna/Protein Macherey Nagel Kit | Macherey-Nagel | 740,933,250 | |
| 96 multiplate well | Biorad | HSP9601 | |
| iSCRIPT | Biorad | 1708841 | |
| Sealer sheet | Biorad | MSB1001 | |
| SsoFast EvaGreen Supermix | Biorad | 172-5201 | |
| Protein expression | |||
| 2x Laemli Sample Buffer | Biorad | 161-0737 | Add 50 µL of bMercaptoetanol to 950 µL of Laemmli Buffer and store at -20°C. Dilute 1:1 with the protein sample for the assay. |
| Anti-Breast Cancer Resistance Protein primary antibody | Abcam | ab207732 | Pre-treatment 15 minutes at RT under agitation; dilution 1:1000, O.N. at 4°C |
| Anti-Claudin-5 primary antibody | Abcam | ab15106 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Glucose Transporter 1 primary antibody | Millipore | 07-1401 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Mouse secondary antibody | Dako | P0447 | Dilution 1:5000 in TBS-Tween |
| Anti-P-glycoprotein primary antibody | Genetex | GTX23364 | Pre-treatment 15 minutes at RT under agitation; dilution 1:400, 3 hours at RT |
| Anti-Rabbit secondary antibody | Dako | P0448 | Dilution 1:8000 in TBS-Tween |
| Anti-Transferrin Receptor primary antibody | Abcam | ab84036 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Zona occludens-1 primary antibody | Abcam | ab216880 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Criterion TGX Gel | Biorad | 5678083 | |
| ECL Prime Solution | Amersham | RPN2236 | Revelation solution to keep in the dark |
| Phospatase inhibitor cocktail 2 | Sigma | P5726 | |
| Phospatase inhibitor cocktail 3 | Sigma | P0044 | |
| Protease Inhibitor | Sigma | P8340 | |
| Protein Standards | Biorad | 161-0373 | Molecular weight markers |
| RIPA 10x | Millipore | 20-188 | |
| TBS 10x | Biorad | 1706435 | |
| TRIS-Glycine | Biorad | 1610771 | |
| Tween | Biorad | 1706531 | |
| BBB integrity assay | |||
| Sodium Fluorescein | Ampresco | 0681 | λex= 490 nm; λem= 525 nm |
| Elacridar | Sigma | SML0486 | GF120918 |
| FITC-Dextran 20 kDa | Sigma | FD-20S | λex= 490 nm; λem= 525 nm |
| Rhodamine 123 | Sigma | R8004 | λex= 501 nm; λem= 538 nm |
| SynergyTM H1 | BioTek Instruments | Fluorescent multiplate reader | |
| Nanogel Transport | |||
| Syringe | Terumo | SS+01T1 | 1 mL syringe |
| Filter | FisherScientific | 15161499 | 0.2 µm PTFE membrane filter, 15 mm diameter |
| N-Isopropylacrylamide (NIPAM)-based hydrogels | The nanogels (NGs) used in the study are provided by our collaborator in Queen Mary University London, Department of Chemistry. The NGs are covalently tagged with a fluorescent molecule (λex= 477 nm; λem= 540 nm). NGs are freeze dried and shipped as powder, in this state they are stable at room temperature for long period of time. |
References
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37, 13-25 (2010).
- Profaci, C. P., Munji, R. N., Pulido, R. S., Daneman, R. The blood-brain barrier in health and disease: Important unanswered questions. The Journal of Experimental Medicine. 217 (4), 20190062 (2020).
- Abbott, N. J. Blood-brain barrier structure and function and the challenges for CNS drug delivery. Journal of Inherited Metabolic Disease. 36 (3), 437-449 (2013).
- Kreuter, J. Drug delivery to the central nervous system by polymeric nanoparticles: What do we know. Advanced Drug Delivery Reviews. 71, 2-14 (2014).
- Zhang, W., Mehta, A., Tong, Z., Esser, L. . L.Advanced science. 8 (10), 2003937 (2021).
- Vashist, A., et al. Nanogels as potential drug nanocarriers for CNS drug delivery. Drug Discovery Today. 23 (7), 1436-1443 (2018).
- Lombardo, S. M., Schneider, M., Türeli, A. E., Günday Türeli, N. Key for crossing the BBB with nanoparticles: The rational design. Beilstein Journal of Nanotechnology. 11, 866-883 (2020).
- Bernardo-Castro, S., et al. Therapeutic nanoparticles for the different phases of ischemic stroke. Life. 11 (6), 482 (2021).
- Salinas, Y., Castilla, A. M., Resmini, M. An L-proline based thermoresponsive and pH-switchable nanogel as a drug delivery vehicle. Polymer Chemistry. 9 (17), 2271-2280 (2018).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353 (2019).
- Preman, N. K., Jain, S., Johnson, R. P. ”Smart” polymer nanogels as pharmaceutical carriers: A versatile platform for programmed delivery and diagnostics. ACS Omega. 6 (8), 5075-5090 (2021).
- Cuggino, J. C., Blanco, E. R. O., Gugliotta, L. M., Alvarez Igarzabal, C. I., Calderón, M. Crossing biological barriers with nanogels to improve drug delivery performance. Journal of Controlled Release Official Journal of the Controlled Release Society. 307, 221-246 (2019).
- Basso, J., et al. Hydrogel-based drug delivery nanosystems for the treatment of brain tumors. Gels. 4 (3), 62 (2018).
- Harilal, S., et al. Revisiting the blood-brain barrier: A hard nut to crack in the transportation of drug molecules. Brain Research Bulletin. 160, 121-140 (2020).
- Papadimitriou, S. A., Robin, M. P., Ceric, D., O'Reilly, R. K., Marino, S., Resmini, M. Fluorescent polymeric nanovehicles for neural stem cell modulation. Nanoscale. 8 (39), 17340-17349 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Cecchelli, R., et al. Modelling of the blood-brain barrier in drug discovery and development. Nature Reviews Drug Discovery. 6 (8), 650-661 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. An overview of in vitro techniques for blood-brain barrier studies. Methods in Molecular Medicine. 89, 307-324 (2003).
- Shimizu, F., et al. Peripheral nerve pericytes modify the blood-nerve barrier function and tight junctional molecules through the secretion of various soluble factors. Journal of Cellular Physiology. 226 (1), 255-266 (2011).
- Pedroso, D. C., et al. Improved survival, vascular differentiation and wound healing potential of stem cells co-cultured with endothelial cells. PLoS One. 6 (1), 16114 (2011).
- Kanda, T., Iwasaki, T., Yamawaki, M., Ikeda, K. Isolation and culture of bovine endothelial cells of endoneurial origin. Journal of Neuroscience Research. 49 (6), 769-777 (1997).
- Data sheet on human astrocytes culture. Technical resources from ScienCell Available from: https://www.sciencellonline.com/human-astrocytes.html#product_tabs_technicalresources (2021)
- Deligne, C., et al. Development of a human in vitro blood-brain tumor barrier model of diffuse intrinsic pontine glioma to better understand the chemoresistance. Fluids and Barriers of the CNS. 17 (1), 37 (2020).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), 99733 (2014).
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-Brain Barrier: From physiology to disease and back. Physiological Reviews. 99 (1), 21-78 (2019).
- Daneman, R., Prat, A. The Blood-Brain Barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), 020412 (2015).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability studies on in vitro blood-brain barrier models: Physiology, pathology, and pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Heymans, M., Figueiredo, R., Dehouck, L., Francisco, D., Sano, Y., Shimizu, F., Kanda, T., Bruggmann, R., Engelhardt, B., Winter, P., Gosselet, F., Maxime, C. Contribution of brain pericytes in blood-brain barrier formation and maintenance: A transcriptomic study of co-cultured human endothelial cells derived from hematopoietic stem cells. Fluids Barriers CNS. 17, 48 (2020).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Neuhaus, W. In Vitro Models of the Blood-Brain Barrier. Handbook of Experimental Pharmacology. 265, 75-110 (2021).
- Hoheisel, D., Nitz, T., Franke, H., Wegener, J., Hakvoort, A., Tilling, T., Galla, H. J. Hydrocortisone reinforces the blood-brain properties in a serum free cell culture system. Biochemical and Biophysical Research Communications. 247 (2), 312-315 (1998).
- Drolez, A., et al. Selection of a relevant in vitro blood-brain barrier model to investigate pro-metastatic features of human breast cancer cell lines. PloS One. 11 (3), 0151155 (2016).
- Neuhaus, W., Gaiser, F., Mahringer, A., Franz, J., Riethmüller, C., Förster, C. The pivotal role of astrocytes in an in vitro stroke model of the blood-brain barrier. Frontiers in Cellular Neuroscience. 8, 352 (2014).
- Mysiorek, C., et al. Peroxisome proliferator-activated receptor-α activation protects brain capillary endothelial cells from oxygen-glucose deprivation-induced hyperpermeability in the blood-brain barrier. Current Neurovascular Research. 6 (3), 181-193 (2009).
- Culot, M., et al. Cerebrovascular protection as a possible mechanism for the protective effects of NXY-059 in preclinical models: An in vitro study. Brain Research. 1294, 144-152 (2009).
- Vandenhaute, E., Drolez, A., Sevin, E., Gosselet, F., Mysiorek, C., Dehouck, M. -. P. Adapting co-culture in vitro models of the blood-brain barrier for use in cancer research: Maintaining an appropriate endothelial monolayer for the assessment of transendothelial migration. Laboratory Investigation. 96 (5), 588-598 (2016).
- Cucullo, L., Hossain, M., Puvenna, V., Marchi, N., Janigro, D. The role of shear stress in Blood-Brain Barrier endothelial physiology. BMC Neuroscience. 12, 40 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved