Method Article
Клеточная система тройной культуры, моделирующая гематоэнцефалический барьер человека
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает метод установления модели гематоэнцефалического барьера человека (ГЭБ) in vitro . Эндотелиальные клетки и перициты высеваются с каждой стороны вставного фильтра (кровяного отсека), а астроциты высеваются в нижний колодец (мозговой отсек). Охарактеризованная модель использовалась для экспериментов по переносу наночастиц.
Аннотация
Доставка лекарств в мозг остается проблемой из-за высокоспецифичных и ограничительных свойств гематоэнцефалического барьера (ГЭБ), которые контролируют и ограничивают доступ к паренхиме мозга. Однако с развитием нанотехнологий были разработаны большие панели новых наноматериалов для улучшения доставки лекарств, подчеркивая необходимость надежных микросистем in vitro для прогнозирования проникновения в мозг в рамках доклинических анализов. Вот простой метод создания микрофизиологической системы для моделирования ГЭБ с использованием исключительно клеток человека. В своей конфигурации модель состоит из тройной культуры, включающей мозгоподобные эндотелиальные клетки (БЛЕК), перициты и астроциты, три основных клеточных субъекта ГЭБ, необходимых для индуцирования и регулирования свойств ГЭБ более физиологическим образом без необходимости подтягивания соединений. Модель, разработанная в формате пластины с 12 лунками, готовая через 6 дней тройной культуры, характеризуется физическими свойствами, экспрессией генов и белков и используется для измерения переноса полимерных наногелей. Модель может быть использована для широкого спектра экспериментов в здоровых и патологических состояниях и представляет собой ценный инструмент для доклинических оценок транспорта молекул и частиц, а также меж- и внутриклеточного трафика.
Введение
ГЭБ, локализованный на уровне эндотелиальных клеток капилляров мозга (ЭК), контролирует и регулирует доступ к паренхиме мозга, что имеет решающее значение для поддержания гомеостаза мозга и функции нервных клеток 1,2. Однако в случае патологии головного мозга отсутствие доступа к паренхиме головного мозга представляет собой реальное препятствие для разработки терапевтических стратегий.
BBB EC обладают сложным набором свойств, включая белки плотного соединения (TJ), которые герметизируют межклеточное пространство, связанное с системой эффлюксных насосов, специфических транспортеров и рецепторов, которые контролируют трансклеточный путь 1,2,3. Более того, все эти свойства индуцируются и поддерживаются, благодаря связям с перицитами, встроенными в базальную мембрану BBB EC и астроцитами, чьи конечные ноги окружают капилляры мозга 1,2,3. Следовательно, изучение BBB in vitro является проблемой, учитывая сложность его архитектуры и связи между различными типами клеток, составляющими нейрососудистую единицу (NVU)2. Кроме того, различные типы клеток имеют решающее значение для индукции и поддержания свойств ГЭБ и, следовательно, влияют на прогнозирование пересечения через ГЭБ. Различные стратегии доставки лекарств в мозг уже были протестированы с использованием большой панели тактик для обхода ограниченных свойств ГЭБ4. В последнее время, с развитием нанотехнологий, разрабатываются новые материалы для применения в качестве носителей лекарств 5,6. В дополнение к их более высокой нагрузке, снижению токсичности и повышению биодоступности лекарств, эти новые наноматериалы могут быть функционализированы для стратегии троянского коня, чтобы пересечь ГЭБ и специфически нацеливать клетки в паренхиме 5,6. Среди различных типов оцениваемых наноматериалов наногели привлекли значительное внимание, главным образом из-за их коллоидных свойств и способности адаптировать химическую структуру для введения чувствительных к стимулам свойств 7,8,9,10,11,12,13,14,15.
В настоящее время разрабатываются модели in vitro для доклинических исследований с использованием клеток человека для прогнозирования проникновения в мозг лекарств16. Доступны различные настройки этих моделей, от монослоев ЭК мозга до нескольких клеточных систем16. Учитывая важность клеток NVU в индукции и поддержании BBB и скоординированном ответе на патологическую среду, модели BBB in vitro должны учитывать все эти протагонисты, чтобы повысить актуальность прогноза 2,17.
Текущий метод описывает создание модели тройной культуры in vitro человеческого ГЭБ, которая полностью разработана с клетками человека для изучения специфических клеточных и молекулярных механизмов человека. Чтобы быть физиологически значимой, модель состоит из трех основных клеточных акторов ГЭБ (ЭК, перицитов и астроцитов), необходимых для индуцирования и поддержания свойств ГЭБ, без использования подтягивающих соединений и отображения набора свойств, необходимых для рассмотрения в качестве модели BBB in vitro 16,18. Модель настроена в конфигурации, разграничивающей кровоток и мозговой компартмент, подходящей для доклинических исследований транспорта лекарств и частиц для прогнозирования проникновения в мозг. Полезность модели иллюстрируется измерением переноса полимерных наногелей.
протокол
Протокол был одобрен Министерством высшего образования и научных исследований Франции (ссылка: CODECOH DC2011-1321) и местным наблюдательным советом по расследованиям (родильный дом Бетюн, Бёври, Франция). Для получения эндотелиальных клеток (ЭК) было получено письменное и информированное согласие родителей донора на сбор пуповинной крови в соответствии с французским законодательством. Перициты предоставлены профессором Такаси Канда (кафедра неврологии и клинической неврологии, Высшая школа медицины Университета Ямагути, Убэ, Япония), которые были выделены в соответствии со ссылкой19. Первичные астроциты коры головного мозга человека приобретаются у коммерческого поставщика (см. Таблицу материалов).
1. Клеточная культура
- Культивирование эндотелиальных клеток
ПРИМЕЧАНИЕ: Эндотелиальные клетки (EC) получены из CD34+ гемопоэтических стволовых клеток, выделенных из пуповинной крови человека, в соответствии с методом, описанным Pedroso et al.20. Эндотелиальный фенотип ЭК описан в Pedroso et al.20.- Культивируйте ЭК человека с использованием эндотелиальной клеточной среды, дополненной 5% сыворотки для телят плода (FCS), 0,5% гентамицина и 1% добавки для роста эндотелиальных клеток (ECM) (см. Таблицу материалов).
- Для субкультирования EC за два дня до установки модели нанесите на одно блюдо 10 мл 2% желатина в течение 15 мин при 37 °C, а затем замените его 20 мл теплого ECM. Разморозьте один флакон ЭК, содержащий 1 миллион клеток (клетки были подсчитаны вручную, как описано на этапе 2.3.3, перед замораживанием клеток) в чашке с предварительно покрытыми клеточными культурами.
- Через 3 ч при 37 °C обновляют среду и поддерживают клетки до заведения трикультуры во увлажненную атмосферу внутри инкубатора при 37 °C при 5% CO2 и 21% O2.
- Культивирование перицитов
ПРИМЕЧАНИЕ: Перициты выделены из человеческого мозга в соответствии с протоколом, опубликованным Shimizu et al.19, процедура изоляции которого следует методу, опубликованному Kanda et al.21 с изменениями.- Культивируйте перициты, используя модифицированную среду Eagle от Dulbecco, дополненную 4,5 г / л глюкозы (DMEM HG), 10% FCS, 1% де пенициллина / стрептомицина и 1% L-глутамина (см. Таблицу материалов).
- Для субкультурирования перицитов за пять дней до установки модели обмазать две посуды 8 мл/тарелку 100 мкг/мл раствора коллагена I типа в 0,02 N уксусной кислоты в течение 1 ч при комнатной температуре (RT) и затем дважды промыть RT DMEM HG. Разморозить один флакон перицитов, содержащих 1 млн клеток, в конической трубке, содержащей 10 мл теплой среды, и центрифугировать суспензию в течение 5 мин при 190 х г при 20 °С.
- Повторно суспендировать гранулы в 10 мл теплой среды и семена в предварительно покрытых клеточной культурой чашках, предварительно заполненных 15 мл теплой среды/блюдо. Среду обновляют через 3 дня, и клетки поддерживают до схватывания трикультуры в увлажненном инкубаторе при 37 °C при 5% CO2 и 21% O2.
- Культивирование астроцитов
- Культивируют астроциты с использованием астроцитарной среды, дополненной 20% FCS, 1% добавки для роста астроцитов и 1% раствора пенициллина / стрептомицина (AM) (см. Таблицу материалов).
- Для субкультуризации астроцитов за неделю до установки модели покрывают одну колбу для культуры клеток Т75 10 мл 2 мкг/см2 поли-L-лизина (ФАПЧ) в течение 1 ч при 37 °C и дважды промывают стерильной водой RT. Разморозьте один флакон астроцитов, содержащий 1 миллион клеток в 20 мл теплой среды и семена в предварительно покрытой колбе для культивирования клеток Т-75.
ПРИМЕЧАНИЕ: Коммерчески полученные клеточные флаконы подтверждают наличие ~1 миллиона клеток, поэтому подсчет клеток здесь не проводился. - Поддерживайте клетки в увлажненном инкубаторе при 37 °C при 5% CO2 и 21% O2. Среду обновляют через 24 ч, а затем каждые 2 дня до схватывания трикультуры.
2. Настройка модели тройной культуры
ПРИМЕЧАНИЕ: Сборка трех типов клеток выполняется в один и тот же день. За день до схватывания трикультуры выполняют коллагеновое покрытие типа I на реверсивных вставных фильтрах (см. Таблицу материалов) и засевают астроциты в скважины с ФАПЧ-покрытием из 12-луночной пластины.
- Посев астроцитов в лунки
- Покройте скважины 500 мкл раствора ФАПЧ 2 мкг/см2 , как описано на этапе 1.3.2.
- Промыть клетки один раз 10 мл теплого фосфатного буферного физиологического раствора - кальция и магния 1X (1X PBS-CMF) (Таблица 1) перед инкубацией в течение 3 мин при 37 °C с 10 мл теплого 20% раствора трипсина / ЭДТА (T / E) и механически отделить клетки от колбы. Переложить суспензию в коническую трубку, содержащую 5 мл теплой неразбавленной ФТС.
ПРИМЕЧАНИЕ: В соответствии с протоколом22 поставщика, сбор астроцитов может быть оптимизирован путем помещения колбы в инкубатор на 1 мин и постукивания колбой, чтобы помочь завершить отсоединение. Остальные клетки следует собрать 5 мл раствора нейтрализации T/E и поместить в FCS-содержащую коническую трубку. - Центрифугировать суспензию в течение 5 мин при 20 °С при 190 х г.
- Повторно суспендировать ячейку гранулы в 5 мл теплого АМ. Подсчитайте клетки, разбавив 20 мкл клеточной суспензии в 80 мкл 1X PBS-CMF с помощью ручной счетной камеры под микроскопом (см. Таблицу материалов). Пластинчатая около 40 000 клеток/см2 в каждой фапч-покрытой скважине в объеме 1,5 мл теплого АМ.
- Посев перицитов на возвратные вставные фильтры
- Добавьте 250 мкл раствора коллагена типа I (100 мкг/мл) на восстановленные вставные фильтры, размещенные на периферии закрытой тарелки высотой 25 мм (см. Таблицу материалов) с помощью стерильного пинцета. Оставьте покрытие на 1 ч при РТ в стерильных условиях.
ПРИМЕЧАНИЕ: Используемая посуда должна быть достаточно высокой, чтобы обеспечить поддержание стерильности вне вытяжки и избежать контакта между растворами на перевернутом фильтре и крышкой тарелки. - Осторожно удалите раствор коллагена типа I стеклянной пипеткой, подключенной к аспирационной системе. Дважды промыть 250 мкл RT DMEM HG, а затем аккуратно удалить весь раствор из вставных фильтров. Оставьте вставные фильтры с покрытием на RT в стерильных условиях до посева клеток.
ПРИМЕЧАНИЕ: Во время процедуры нанесения покрытия будьте осторожны, чтобы не коснуться фильтра, чтобы избежать повреждения мембраны. После покрытия коллагеном типа I вставные фильтры могут храниться в течение ночи в RT. - В день установки трикультуры дважды промыть перициты 10 мл теплого 1X PBS-CMF и инкубировать клетки 2 мл теплого трипсина. Следите за действием трипсина, наблюдая за клетками под микроскопом. Как только клетки начнут отделяться, удалите трипсин и добавьте 5 мл теплого ECM перед механической диссоциацией.
- Подсчитайте клетки, разбавив 20 мкл клеточной суспензии в 80 мкл 1X PBS-CMF с помощью ручной счетной камеры под микроскопом, и посадите 44 500 клеток/см2 на предварительно покрытые возвратные вставные фильтры в объеме 250 мкл. Держите вставные фильтры в увлажненном инкубаторе при 37 °C в течение 3 ч при 5% CO2 и 21% O2.
- Осторожно верните вставные фильтры с помощью стерильного пинцета в 12-луночной пластине, содержащей 1,5 мл теплого ECM/well. Теперь вставные фильтры готовы к покрытию с другой стороны.
- Добавьте 250 мкл раствора коллагена типа I (100 мкг/мл) на восстановленные вставные фильтры, размещенные на периферии закрытой тарелки высотой 25 мм (см. Таблицу материалов) с помощью стерильного пинцета. Оставьте покрытие на 1 ч при РТ в стерильных условиях.
- Посев эндотелиальных клеток на вставные фильтры
- Покрытие верхней стороны вставных фильтров 500 мкл гидрогеля на основе внеклеточного матрикса (1/48 в/об) (см. Таблицу материалов). Через 1 ч, в увлажненном инкубаторе при 37 °C при 5% CO2 и 21%O2, промыть однократно с 500 мкл RT DMEM HG.
- Один раз промыть 10 мл теплого 1X PBS-CMF и инкубировать клетки с 2 мл теплого трипсина. Как только клетки начнут отделяться, удалите трипсин и добавьте 5 мл теплого ECM перед механической диссоциацией.
- Подсчитайте клетки путем разбавления 20 мкл клеточной суспензии в 80 мкл 1X PBS-CMF с использованием ручной счетной камеры под микроскопом и засейте ЭК при плотности 71 500 клеток/см2 на предварительно покрытых вставных фильтрах в объеме 500 мкл теплого ECM.
- Замените AM на 1,5 мл теплого ECM/well, а затем перенесите засеянные вставные фильтры (EC + перициты) на скважины, содержащие астроциты.
- Поместите клеточные системы трикультуры в увлажненный инкубатор при 37 °C при 5% CO2 и 21% O2.
- Поддержание тройной клеточной культуры для индукции свойств ГЭБ
ПРИМЕЧАНИЕ: Для индукции свойств ГЭБ в ЕС необходимо 6 дней тройной культуры.- Обновляйте среду через день до 6-го дня, осторожно снимая среду из верхнего и нижнего отсеков с помощью стеклянной пипетки, соединенной с системой аспирации.
- Быстро заменить на теплый ECM в объеме 500 мкл в верхнем отсеке и 1,5 мл в нижнем отсеке и поместить обратно ячейки в увлажненный инкубатор при 37 °C при 5% CO2 и 21% O2.
3. Проверка фенотипа ГЭБ
ПРИМЕЧАНИЕ: После 6 дней тройной культуры, времени, необходимого для индуцирования фенотипа ГЭБ в ЕС, модель ГЭБ человека готова к экспериментам. Физическая целостность мозгоподобных эндотелиальных клеток (БЛЕК) визуализируется иммунофлуоресцентным окрашиванием белков TJ, оцениваемых с использованием анализа проницаемости на маркеры целостности ГЭБ. Валидация фенотипа ГЭБ также включает анализ экспрессии генов/белков и функциональность эффлюксных насосов в соответствии с процедурой, описанной в Deligne et al.,23. Перициты и астроциты визуализируются соответствующими маркерами окрашивания в соответствии с процедурой, описанной в Deligne et al. 202023.
- Иммунофлуоресцентное окрашивание
- Зафиксируйте вставные фильтры и астроциты в ледяном метаноле/ацетоне (50/50 в/об) в течение 1 мин и дважды промыть RT 1X PBS-CMF.
- Тщательно отделите фильтр от вставки, разрезав мембрану скальпелем. Выполняют иммуноцитохимию мембранных и донных скважин согласно Deligne et al.23.
ПРИМЕЧАНИЕ: Для этапа блокировки используйте 250 мкл буфера блокировки SEA BLOCK (см. Таблицу материалов) в течение 30 мин при RT.
- Анализ целостности BBB
- Оцените физическую целостность БЛЕК с помощью анализа проницаемости с использованием маркеров целостности ГЭБ с различными молекулярными массами, таких как флуоресцеин натрия (NaF) и декстран 20 кДа (FD20) (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Эксперимент может быть выполнен в соответствии с процедурой, описанной в Deligne et al.23.
- Оцените физическую целостность БЛЕК с помощью анализа проницаемости с использованием маркеров целостности ГЭБ с различными молекулярными массами, таких как флуоресцеин натрия (NaF) и декстран 20 кДа (FD20) (см. Таблицу материалов).
- Функциональность эффлюксного насоса
- Оценить функциональность P-гликопротеина (P-gp) и белка резистентности к раку молочной железы (BCRP) путем измерения внутриклеточного накопления родамина 123 (R123) с Элакридаром и без него, ингибитором P-gp и BCRP (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Эксперимент может быть выполнен в соответствии с процедурой, описанной в Deligne et al.23.
- Оценить функциональность P-гликопротеина (P-gp) и белка резистентности к раку молочной железы (BCRP) путем измерения внутриклеточного накопления родамина 123 (R123) с Элакридаром и без него, ингибитором P-gp и BCRP (см. Таблицу материалов).
- Экспрессия генов и белков
- Производят забор образцов генов и белков на льду после быстрой промывки холодным Ringer HEPES (RH) (таблица 1) клеток. Перед отбором проб ЕС соскоблите перициты с перевернутых вставных фильтров20.
4. Транспортировка наногелей
ПРИМЕЧАНИЕ: Для оценки прохождения полимерных наногелей (НГ) из люминального в аблюминальный компартмент модели BLEC трикультуры на 6-й день в люминальном отсеке в течение 24 ч добавляли 0,1 мг/мл раствора ПГ. Исследуемые НГ представляли собой флуоресцентно помеченные гидрогели на основе N-изопропилакриламида (НИПАМ) со средним размером 8-10 нм (см. Таблицу материалов).
- Взвесьте наногель-порошок и солюбилизируйте его в ECM в концентрации 1 мг/мл. Настаивайте раствор ультразвуком в течение 10 минут и фильтруйте с помощью фильтра из PTFE 0,2 мкм.
ПРИМЕЧАНИЕ: Приготовьте свежий раствор ПГ в день эксперимента. - Изменить среду в просветном отсеке и добавить 50 мкл раствора НГ в верхнем отсеке для конечной концентрации 0,1 мг/мл.
ПРИМЕЧАНИЕ: Выполните разбавление 1:10 от исходного раствора. - После 24 ч инкубации собирают аликвоты из просветного (20 мкл) и аблюминального (200 мкл) отсеков и помещают их в черную 96-луночную пластину.
- Количественное определение флуоресценции с помощью флуоресцентного многопластинного считывателя (см. Таблицу материалов) с черной 96-луночной пластиной, используя настройку длин волн возбуждения/излучения на уровне 477/540 нм. Рассчитайте процент пересечения, относящийся к исходному рабочему раствору, добавленному во времени = 0 ч (t0)6,15.
ПРИМЕЧАНИЕ: Для подготовки 96-луночной пластины для измерения флуоресценции добавляют 200 мкл раствора из аблюминального компартмента и 20 мкл раствора из просветного отсека и препарат t0 (добавляют 180 мкл ECM для достижения конечного объема 200 мкл). Включите также калибровочную кривую и заготовку к считывающей пластине. Инструментальные параметры: метод обнаружения - флуоресценция, оптическая позиция - верхняя, тип считывания - конечная точка, длина волны возбуждения - 477 нм, длина волны излучения - 540 нм, чувствительность - 100, встряхивание - двойная орбиталь в течение 5 с.
Результаты
Установка модели BBB тройной культуры человека
Протокол, необходимый для установки модели ГЭБ in vitro человека, описан на рисунке 1 и включает последовательные шаги, порядок которых должен строго соблюдаться. Во-первых, три типа клеток культивируются индивидуально в чашках для клеточных культур (рисунок 1A) перед сборкой в системе вставного фильтра. Установка тройной культуры начинается с посева первого типа клеток, астроцитов, в предварительно покрытую нижнюю лунку. На следующий день перициты и ЭК высеваются на предварительно покрытые аблюминальной и просветной поверхностями фильтра вставки соответственно. Затем вставной фильтр переносится на астроциты. Модель поддерживается в культуре в течение 6 дней, времени, необходимого для индуцирования свойств ГЭБ в ЕС, с обновлением среды через день в соответствии с запатентованной моделью кокультуры24. Затем EC переименовываются в BLEC (рисунок 1B).
Характеристика модели ГЭБ человека
Модель тройной клеточной культуры была охарактеризована наличием набора свойств, специфичных для ГЭБ. Прежде всего, данные иммуноцитохимии подтвердили экспрессию обычных маркеров, таких как рецептор фактора роста тромбоцитов, полученный β (PDGFR-β)25,26 и десмин для перицитов и глиальный фибриллярный кислый белок (GFAP)26 для астроцитов (рисунок 2A). Следовательно, после 6 дней культивирования с перицитами и астроцитами монослой БЛЕК, визуализируемый с адгептным окрашиванием соединения VE-Кадгерина, демонстрирует непрерывную локализацию TJ-белков, Клодина-5 и ЗО-1, на границах клеток (Рисунок 2А). Настройка TJs коррелирует с низкими параклеточными коэффициентами проницаемости, измеренными с использованием маркеров целостности BBB с низкой молекулярной массой, т.е. NaF (376 Da)16,27 и высокой молекулярной массой, т.е. FD20 (20 кДа)27, как показано на фиг.2B. Измеренные значения сопоставимы с проверенными моделями BBB in vitro с использованием точного источника ЕС 23,24,28. В целом, эти результаты подчеркивают низкую параклеточную проницаемость монослоя тройной культуры BLEC, который характерен для in vivo BBB. Кроме того, внутриклеточное накопление R123 в БЛЕКах демонстрировало значительное увеличение присутствия ингибитора эффлюксного насоса Elacridar23,24 по сравнению с контрольным состоянием при его отсутствии (рис. 2С). Это указывает на наличие в БЛЕКах активных молекул эффлюксного насоса, а именно P-gp и BCRP.
Для дальнейшей характеристики БЛЕК были изучены экспрессия генов и уровень белка ключевых признаков ГЭБ (рисунок 3). Данные, полученные с помощью модели тройной культуры, сравнивали с валидированной и запатентованной моделью кокультуры, состоящей из ЭК и перицитов24 , используемой в качестве контрольной модели. Астроциты представляют собой третий тип клеток, добавленный в исходную модель кокультуры в модели тройной культуры. Следовательно, анализ экспрессии генов (рисунок 3A) трехкультурных БЛЕК по сравнению с кокультурными БЛЕК показал поддержание экспрессии ключевых признаков ГЭБ, таких как белки TJ (claudin-5 и zonula occludens-1) и эффлюксные насосы (P-gp и BCRP), а также повышение регуляции наиболее изученных транспортеров BBB (транспортер глюкозы 1) и рецепторов (рецептор трансферина). Было обнаружено, что данные количественной оценки белка (рисунок 3B) соответствуют результатам транскрипции. В целом, эти данные подтверждают положительную индукцию свойств ГЭБ в тройном культурном слое BLEC, аналогичном проверенной модели совместной культуры. В целом, модель тройной культуры отображает необходимые физические и метаболические свойства для микрофизиологической системы in vitro для моделирования ГЭБ.
Применимость к стратегиям доставки лекарств - измерение переноса наногелей
Чтобы оценить возможность использования модели тройной культуры для изучения новых стратегий доставки мозга, транспорт флуоресцентно помеченных нейтральных НГ на основе NIPAM оценивался 6,15. В момент 0 НГ помещали в просветный отсек в концентрации 0,1 мг/мл (рисунок 4А). После 24 ч инкубации 5,82% НГ были обнаружены в аблюминальном компартменте (рисунок 4B), доказывая их способность пересекать БЛЕК.
Результаты демонстрируют пригодность модели для измерения проницаемости малых и более крупных соединений, как описано с помощью маркеров целостности, и оценки переноса наноматериалов, таких как полимерные НГ.
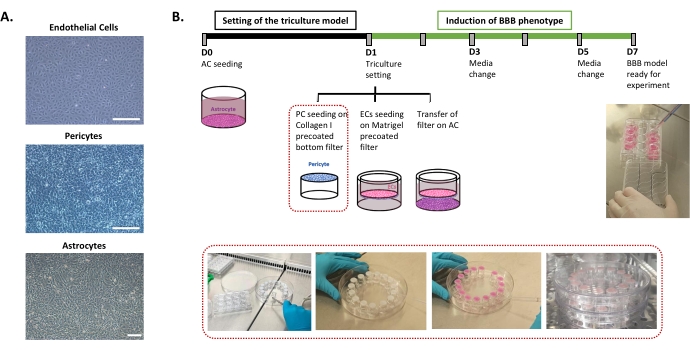
Рисунок 1: Представление критических этапов для установки модели тройной культуры in vitro человека BBB. (A) Фазоконтрастные изображения трех клеточных компонентов модели BBB: эндотелиальных клеток (EC), перицитов (PC) и астроцитов (AC). Шкала = 250 мкм. (B) Схематическая и иллюстративная временная шкала для установки тройной культуры человеческой модели BBB in vitro . Выделенное поле представляет процедуру нанесения покрытия для перевернутого вставного фильтра. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
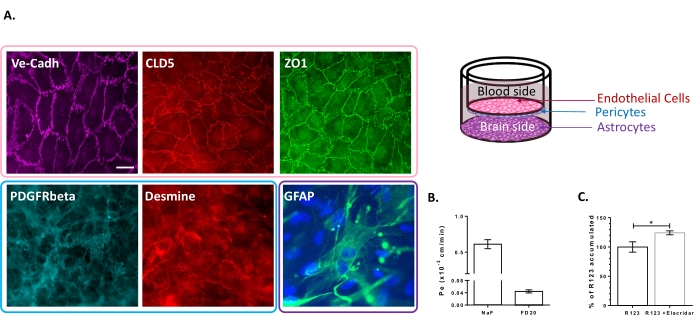
Рисунок 2: Оценка свойств модели BBB тройной культуры. (A) Репрезентативные иммуноокрашивающие изображения отличительных маркеров для БЛЕК (Claudin-5: CLD5, Zona Occludens-1: ZO1 и VE-Cadherin: Ve-Cadh), перицитов (рецептор фактора роста тромбоцитов-β: PDGFR-β и desmin) и астроцитов (глиальный фибриллярный кислый белок: GFAP). Шкала bar = 10 мкм. (B) Параклеточная проницаемость БЛЕК к флуоресцентным маркерам целостности ГЭБ, флуоресцеин натрия (NaF, 376 Да, Pe: 0,61 ± 0,062) и FITC-Декстран (FD20, 20 кДа, Pe: 0,04 ± 0,005). N = 3; n = 9. Средняя ± SEM. (C) P-gp и BCRP функциональности в EC оценивалась путем количественной оценки внутриклеточного R123 с (124,2% ± 3,39%) и без (100% ± 8,79%) Elacridar. N = 4; n = 12. Среднее ± SEM. p = 0,017 с использованием непарного t-теста. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
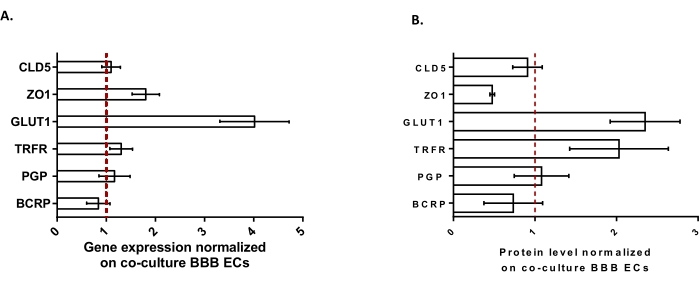
Рисунок 3: Оценка экспрессии гена BLEC и уровня белка отличительных маркеров в модели тройной культуры по сравнению с моделью совместной культуры BBB. (A) Экспрессия генов белков плотного соединения (Claudin-5: CLD5 и Zona Occludens-1: ZO1), транспортеров (транспортер глюкозы-1: GLUT1, P-гликопротеин: PGP и белок устойчивости к раку молочной железы: BCRP) и больших молекул-рецепторов (рецептор трансферрина: TRFR), нормализованных экспрессией RPLP0. N = 3; n = 9. (B) Уровень белка плотного соединения белков (CLD5 и ZO1), транспортеров (GLUT1, PGP и BCRP) и крупных молекул-рецепторов (TRFR), нормализованный экспрессией β-актина. N = 3; n = 9. Среднее ± SEM. Для (A) и (B) значения>1 соответствуют более высокой экспрессии генов или уровням белка в модели тройной культуры. Красная линия соответствует значению 1, где уровень экспрессии (гены или белки) двух моделей эквивалентен. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
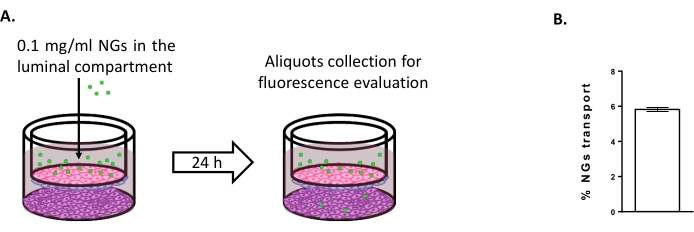
Рисунок 4: Измерение переноса наногелей в модели тройной культуры. (A) Схематическое представление анализа переноса наногелей. (B) Процентная доля переноса наногелей после 24 ч инкубации в модели тройной культуры (5,82% ± 0,09%). N = 2; n = 6. Среднее значение ± SEM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Имя буфера | Состав | Заметка | ||||
| Молекулярная масса | ||||||
| Фосфатный буферный физиологический раствор, без магния кальция | ПБС-СМФ | НаКл | 8 г/л | 58.4 | Добавьте все соединение в стерильную воду и дождитесь полной солюбилизации. рН полученного раствора должен находиться в пределах 7,3-7,4. Фильтруют раствор с помощью мембраны 0,22 мкм и хранят стерильный раствор при 4 °C. | |
| ККл | 0,2 г/л | 74.55 | ||||
| KH2PO4 | 0,2 г/л | 136.09 | ||||
| НаХПО4-12 Ч2О | 2,87 г/л | 358.14 | ||||
| Вода | ||||||
| Звонарь HEPES | Относительная влажность | НаКл | 8,8 г/л | 58.4 | Добавьте все соединение в стерильную воду и дождитесь полной растворимости. Отрегулируйте рН до 7,4 (рН исходного раствора около 6,8). Фильтруют раствор с помощью мембраны 0,22 мкм и хранят стерильный раствор при 4 °C. | |
| ККл | 0,387 г/л | 74.55 | ||||
| КаКл2 | 0,244 г/л | 110.99 | ||||
| MgCl2 6H2O | 0,0406 г/л | 203.3 | ||||
| НаХКО3 | 0,504 г/л | 84.1 | ||||
| ХЕПЕС | 1,19 г/л | 238.3 | ||||
| Глюкоза | 0,504 г/л | 180.16 | ||||
| Вода | ||||||
Таблица 1: Состав различных буферов, используемых в протоколе.
Обсуждение
Лечение заболеваний головного мозга остается проблемой, учитывая сложность того, что препараты преодолевают ГЭБ для достижения своих клеточных и молекулярных целей в паренхиме мозга.
Разработка лекарств для лечения заболеваний головного мозга в настоящее время демонстрирует низкий уровень успеха, поскольку большинство препаратов, демонстрирующих многообещающие результаты в доклинических моделях, не показали никакой пользы при использовании в клинике. Следуя «правилу 3R», которое направлено на сокращение числа животных, используемых для экспериментов, разработаны модели BBB in vitro для изучения патологий головного мозга и прогнозирования проникновения в мозг лекарств29. Модели BBB in vitro в основном были разработаны с использованием клеток животных и стали более изощренными для повышения актуальности полученных результатов16. Один из значительных достижений в использовании клеток человека, который приносит неоспоримое новое понимание и большую специфичность, на клеточном и молекулярном уровнях, для изучения механизмов заболеваний человека16. Однако разработка соответствующих моделей требует рассмотрения вопроса об улучшении настроек модели BBB in vitro и знаний, возникающих благодаря моделям животных. Следовательно, необходимо учитывать сложность архитектуры ГЭБ и важность клеточно-клеточных коммуникаций для изучения ГЭБ в физиологических и патологических условиях30.
Протокол, представленный здесь, описывает метод создания полной человеческой модели ГЭБ in vitro , включающей три основных типа клеток ГЭБ, без ограничения доступа к мозговой ткани. Как многоклеточная система, индукция и поддержание свойств ГЭБ, без искусственного использования затягивающих соединений, но вместо этого индуцированных клеточно-клеточными коммуникациями, более физиологически значимы и соответствуют индукции in vivo свойств ГЭБ31. Таким образом, соблюдение хронологии протокола имеет первостепенное значение для успеха протокола. Кроме того, время инкубации во время схватывания тройной культуры и после сборки трех типов клеток представляет собой основные критические этапы протокола.
Свойства ГЭБ в ЕС индуцируются совместной культурой с перицитами, как описано для модели кокультуры24. Следовательно, культивирование перицитов на обратной стороне вставного фильтра является наиболее критической точкой и требует строгого соблюдения протокола с риском отсутствия достаточного количества перицитов для индукции свойств ГЭБ. Прежде всего, во время процедуры нанесения покрытия, а также посева клеток, необходимо уделять внимание тому, чтобы крышка чашки Петри не контактировала с покрытием, а также со средой после посева клеток, чтобы обеспечить хорошее покрытие фильтра и не потерять клетки (этапы 2.2.1 и 2.2.4). Кроме того, после засева перицитов необходимо дождаться указанного времени для прикрепления перицитов (этап 2.2.4), прежде чем возвращать вставной фильтр для покрытия и посева ЕС с другой стороны (этапы 2.2.5 и 2.3). После посева требуется шесть дней, чтобы индуцировать свойства ГЭБ посредством клеточной связи (этап 2.4).
Модель проверяется с точки зрения ограниченной проницаемости (связанной с установкой плотных соединений), поскольку ЭК модели тройной культуры отображают значения проницаемости для маркеров целостности ГЭБ, аналогичных проверенной модели совместной культуры, а также измеренные в проверенных моделях животных или человека 16,27,32. Кроме того, валидация модели BBB in vitro требует, помимо ограниченной проницаемости, чувствительности к другим типам клеток NVU и экспрессии функциональных рецепторов и транспортеров16. Кроме того, модель является воспроизводимой и производит несколько вставных фильтров и скважин для выполнения многочисленных анализов (экспрессия генов и белков, флуоресцентное окрашивание, тесты на токсичность) для каждого типа клеток отдельно, не требуя метода сортировки клеток.
Модель была разработана с использованием фильтра размером пор 0,4 мкм, чтобы иметь один тип ячейки на каждой стороне вставного фильтра. Вставная фильтрующая система позволяла изучать клеточно-клеточные коммуникации в физиологических условиях путем переноса ее на хорошо содержащие астроциты. Наличие астроцитов в системе представляет собой плюсовое значение по сравнению с исходной кокультурой in vitro модели24. Действительно, учитывая важность астроцитов в физиологии ГЭБ, этот третий тип клеток позволяет лучше понять связь между клетками в пределах ГЭБ. Кроме того, система тройной клеточной культуры также может быть изучена при патологических состояниях, таких как инсульт, при котором астроциты играют существенную роль 33,34,35. Кроме того, конструкция БЛЕК/перицитов с обеих сторон вставного фильтра может быть легко размещена на других типах клеток для имитации патологических состояний, таких как рак мозга23.
Размер пор вставного фильтра может привести к ограничениям в некоторых экспериментах, таких как трансмиграция клеток через ГЭБ. Однако разработка модели с большим размером пор требует адаптации протокола для обеспечения образования физиологического монослоя ЕС, а не нескольких слоев, что физиологически не имеет отношения к имитации ГЭБ36.
Применимость модели была продемонстрирована с помощью транспортного эксперимента НГ, демонстрирующего возможность проведения транспортного эксперимента с использованием многоклеточной системы. Тем не менее, следует знать о трудностях, связанных с наличием контрольного соединения или молекулы для транспортного эксперимента, разделяя сопоставимые свойства с НГ, поскольку каждая наноструктура проявляет уникальный набор свойств (молекулярная масса, заряд, форма, физические свойства, образование короны белка).
Одним из ограничений модели является отсутствие напряжения сдвига, которое, как было продемонстрировано, влияет на дифференцировку ЭК и экспрессию белков TJ37. Тем не менее, разработка жидкостной системы, имитирующей капилляр мозга, является сложной задачей, учитывая сложность добавления текучей части, требующей конкретного устройства, в многоклеточную систему. Кроме того, конкретное устройство обычно не является коммерчески доступным и не допускает многих реплик, что делает жидкостные системы менее приспособленными для использования с высокой пропускной способностью.
Таким образом, эта система тройной культуры, состоящая из клеток человека, воспроизводит in vitro архитектуру ГЭБ. Это позволяет генерировать множество вставок, которые могут быть использованы для обширного скрининга соединений.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Эта работа предоставляется исследовательской и инновационной программой Европейского Союза Horizon 2020 в рамках грантового соглашения No 764958 в рамках проекта NANOSTEM, Сети инновационного обучения Марии Склодовской-Кюри (ITN) (стипендия Элеоноры Рицци). Это исследование проводится "Французским обществом по борьбе с раком и детьми в области развития и подростков" (SFCE), Ассоциацией "l'étoile de Martin" и Ассоциацией "Cassandra contre la leucémie".
Материалы
| Name | Company | Catalog Number | Comments |
| Cell Culture | |||
| Astocyte Medium (AM) | ScienCell | 1801 | |
| Astrocyte Growth Supplement | ScienCell | 1852 | Astrocyte Growth Supplement is provided in the AM set. |
| Cell culture dish 100 mm | Corning | 430293 | 100 mm x 20 mm; dish used for the thawing of ECs and PCs before the triculture setting |
| Cell culture dish 150 mm | Corning | 430599 | The height of these dishes (25 mm) allows the seeding of PCs in the reverted insert for the setting of the triculture model. |
| Collagen I | Corning | 354236 | Rat tail |
| Dulbecco's Modified Eagle Medium | Gibco | 31600-083 | Powder |
| Endothelial Cell Growth Supplement | ScienCell | 1051 | Endothelial Cell Growth Supplement is provided in the ECM set. |
| Endothelial Cell Medium (ECM) | ScienCell | 1001 | |
| Fetal Calf Serum | Sigma | F7524 | |
| Gelatin | Sigma | G2500 | 2% gelatin from porcine skin in PBS-CMF |
| Gentamicin | BiochromA6 | A-2712 | |
| Glucose | Sigma | G6152 | Powder |
| Glutamine | Merck | 1002891000 | |
| Human Brain Cortex Astrocytes | ScienCell | 1800-SC | |
| Malassez cell counting chamber | vWR | HECH40453702 | The count was performed manually. |
| Matrigel | Corning | 354230 | Extracellular matrix-based hydrogel |
| Penicillin/Streptomycin | ScienCell | 0503 | Penicillin/Streptomycin solution is provided in the ECM and AM sets. |
| Poly-L-lysine | ScienCell | 0413 | |
| Steritop | Millipore System | SCGPT0SRE | 0.22 µm pore size |
| Transwell insert | Corning | 3401 | 0.4 µm pore polycarbonate filter |
| Trypsin/EDTA neutralization solution | ScienCell | 0113 | |
| Trypsin/EDTA solution | ScienCell | 0103 | |
| Immunocytochemistry | |||
| SEA BLOCK blocking buffer | ThermoScientific | 37527 | |
| Alexa Fluor 568 anti-Mouse secondary antibody | Thermofisher | A11031 | Dilution 1:500 |
| Alexa Fluor 568 anti-Rabbit secondary antibody | Thermofisher | A11036 | Dilution 1:500 |
| Anti-Claudin-5 primary antibody | InVitrogen | 34-1600 | Dilution 1:100 |
| Anti-Desmin primary antibody | Abcam | ab6322 | Dilution 1:200 |
| Anti-Glial Fibrillary Acidic Protein primary antibody | Dako | Z0334 | Dilution 1:500 |
| Anti-Platelet-Derived Growth Factor-β primary antibody | Abcam | ab51090 | Dilution 1:200 |
| Anti-VE-cadherin primary antibody | Abcam | ab207732 | Dilution 1:200 |
| Anti-Zona Occludens-1 primary antibody | InVitrogen | 61-7300 | Dilution 1:200 |
| Normal Goat Serum | Sigma | G6767 | |
| ProLong Diamond Antifade Mountant with DAPI | Invitrogen | P36962 | |
| Gene expression | |||
| NucleoSpin Rna/Protein Macherey Nagel Kit | Macherey-Nagel | 740,933,250 | |
| 96 multiplate well | Biorad | HSP9601 | |
| iSCRIPT | Biorad | 1708841 | |
| Sealer sheet | Biorad | MSB1001 | |
| SsoFast EvaGreen Supermix | Biorad | 172-5201 | |
| Protein expression | |||
| 2x Laemli Sample Buffer | Biorad | 161-0737 | Add 50 µL of bMercaptoetanol to 950 µL of Laemmli Buffer and store at -20°C. Dilute 1:1 with the protein sample for the assay. |
| Anti-Breast Cancer Resistance Protein primary antibody | Abcam | ab207732 | Pre-treatment 15 minutes at RT under agitation; dilution 1:1000, O.N. at 4°C |
| Anti-Claudin-5 primary antibody | Abcam | ab15106 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Glucose Transporter 1 primary antibody | Millipore | 07-1401 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Mouse secondary antibody | Dako | P0447 | Dilution 1:5000 in TBS-Tween |
| Anti-P-glycoprotein primary antibody | Genetex | GTX23364 | Pre-treatment 15 minutes at RT under agitation; dilution 1:400, 3 hours at RT |
| Anti-Rabbit secondary antibody | Dako | P0448 | Dilution 1:8000 in TBS-Tween |
| Anti-Transferrin Receptor primary antibody | Abcam | ab84036 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Zona occludens-1 primary antibody | Abcam | ab216880 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Criterion TGX Gel | Biorad | 5678083 | |
| ECL Prime Solution | Amersham | RPN2236 | Revelation solution to keep in the dark |
| Phospatase inhibitor cocktail 2 | Sigma | P5726 | |
| Phospatase inhibitor cocktail 3 | Sigma | P0044 | |
| Protease Inhibitor | Sigma | P8340 | |
| Protein Standards | Biorad | 161-0373 | Molecular weight markers |
| RIPA 10x | Millipore | 20-188 | |
| TBS 10x | Biorad | 1706435 | |
| TRIS-Glycine | Biorad | 1610771 | |
| Tween | Biorad | 1706531 | |
| BBB integrity assay | |||
| Sodium Fluorescein | Ampresco | 0681 | λex= 490 nm; λem= 525 nm |
| Elacridar | Sigma | SML0486 | GF120918 |
| FITC-Dextran 20 kDa | Sigma | FD-20S | λex= 490 nm; λem= 525 nm |
| Rhodamine 123 | Sigma | R8004 | λex= 501 nm; λem= 538 nm |
| SynergyTM H1 | BioTek Instruments | Fluorescent multiplate reader | |
| Nanogel Transport | |||
| Syringe | Terumo | SS+01T1 | 1 mL syringe |
| Filter | FisherScientific | 15161499 | 0.2 µm PTFE membrane filter, 15 mm diameter |
| N-Isopropylacrylamide (NIPAM)-based hydrogels | The nanogels (NGs) used in the study are provided by our collaborator in Queen Mary University London, Department of Chemistry. The NGs are covalently tagged with a fluorescent molecule (λex= 477 nm; λem= 540 nm). NGs are freeze dried and shipped as powder, in this state they are stable at room temperature for long period of time. |
Ссылки
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37, 13-25 (2010).
- Profaci, C. P., Munji, R. N., Pulido, R. S., Daneman, R. The blood-brain barrier in health and disease: Important unanswered questions. The Journal of Experimental Medicine. 217 (4), 20190062 (2020).
- Abbott, N. J. Blood-brain barrier structure and function and the challenges for CNS drug delivery. Journal of Inherited Metabolic Disease. 36 (3), 437-449 (2013).
- Kreuter, J. Drug delivery to the central nervous system by polymeric nanoparticles: What do we know. Advanced Drug Delivery Reviews. 71, 2-14 (2014).
- Zhang, W., Mehta, A., Tong, Z., Esser, L. . L.Advanced science. 8 (10), 2003937 (2021).
- Vashist, A., et al. Nanogels as potential drug nanocarriers for CNS drug delivery. Drug Discovery Today. 23 (7), 1436-1443 (2018).
- Lombardo, S. M., Schneider, M., Türeli, A. E., Günday Türeli, N. Key for crossing the BBB with nanoparticles: The rational design. Beilstein Journal of Nanotechnology. 11, 866-883 (2020).
- Bernardo-Castro, S., et al. Therapeutic nanoparticles for the different phases of ischemic stroke. Life. 11 (6), 482 (2021).
- Salinas, Y., Castilla, A. M., Resmini, M. An L-proline based thermoresponsive and pH-switchable nanogel as a drug delivery vehicle. Polymer Chemistry. 9 (17), 2271-2280 (2018).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353 (2019).
- Preman, N. K., Jain, S., Johnson, R. P. ”Smart” polymer nanogels as pharmaceutical carriers: A versatile platform for programmed delivery and diagnostics. ACS Omega. 6 (8), 5075-5090 (2021).
- Cuggino, J. C., Blanco, E. R. O., Gugliotta, L. M., Alvarez Igarzabal, C. I., Calderón, M. Crossing biological barriers with nanogels to improve drug delivery performance. Journal of Controlled Release Official Journal of the Controlled Release Society. 307, 221-246 (2019).
- Basso, J., et al. Hydrogel-based drug delivery nanosystems for the treatment of brain tumors. Gels. 4 (3), 62 (2018).
- Harilal, S., et al. Revisiting the blood-brain barrier: A hard nut to crack in the transportation of drug molecules. Brain Research Bulletin. 160, 121-140 (2020).
- Papadimitriou, S. A., Robin, M. P., Ceric, D., O'Reilly, R. K., Marino, S., Resmini, M. Fluorescent polymeric nanovehicles for neural stem cell modulation. Nanoscale. 8 (39), 17340-17349 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Cecchelli, R., et al. Modelling of the blood-brain barrier in drug discovery and development. Nature Reviews Drug Discovery. 6 (8), 650-661 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. An overview of in vitro techniques for blood-brain barrier studies. Methods in Molecular Medicine. 89, 307-324 (2003).
- Shimizu, F., et al. Peripheral nerve pericytes modify the blood-nerve barrier function and tight junctional molecules through the secretion of various soluble factors. Journal of Cellular Physiology. 226 (1), 255-266 (2011).
- Pedroso, D. C., et al. Improved survival, vascular differentiation and wound healing potential of stem cells co-cultured with endothelial cells. PLoS One. 6 (1), 16114 (2011).
- Kanda, T., Iwasaki, T., Yamawaki, M., Ikeda, K. Isolation and culture of bovine endothelial cells of endoneurial origin. Journal of Neuroscience Research. 49 (6), 769-777 (1997).
- Data sheet on human astrocytes culture. Technical resources from ScienCell Available from: https://www.sciencellonline.com/human-astrocytes.html#product_tabs_technicalresources (2021)
- Deligne, C., et al. Development of a human in vitro blood-brain tumor barrier model of diffuse intrinsic pontine glioma to better understand the chemoresistance. Fluids and Barriers of the CNS. 17 (1), 37 (2020).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), 99733 (2014).
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-Brain Barrier: From physiology to disease and back. Physiological Reviews. 99 (1), 21-78 (2019).
- Daneman, R., Prat, A. The Blood-Brain Barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), 020412 (2015).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability studies on in vitro blood-brain barrier models: Physiology, pathology, and pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Heymans, M., Figueiredo, R., Dehouck, L., Francisco, D., Sano, Y., Shimizu, F., Kanda, T., Bruggmann, R., Engelhardt, B., Winter, P., Gosselet, F., Maxime, C. Contribution of brain pericytes in blood-brain barrier formation and maintenance: A transcriptomic study of co-cultured human endothelial cells derived from hematopoietic stem cells. Fluids Barriers CNS. 17, 48 (2020).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Neuhaus, W. In Vitro Models of the Blood-Brain Barrier. Handbook of Experimental Pharmacology. 265, 75-110 (2021).
- Hoheisel, D., Nitz, T., Franke, H., Wegener, J., Hakvoort, A., Tilling, T., Galla, H. J. Hydrocortisone reinforces the blood-brain properties in a serum free cell culture system. Biochemical and Biophysical Research Communications. 247 (2), 312-315 (1998).
- Drolez, A., et al. Selection of a relevant in vitro blood-brain barrier model to investigate pro-metastatic features of human breast cancer cell lines. PloS One. 11 (3), 0151155 (2016).
- Neuhaus, W., Gaiser, F., Mahringer, A., Franz, J., Riethmüller, C., Förster, C. The pivotal role of astrocytes in an in vitro stroke model of the blood-brain barrier. Frontiers in Cellular Neuroscience. 8, 352 (2014).
- Mysiorek, C., et al. Peroxisome proliferator-activated receptor-α activation protects brain capillary endothelial cells from oxygen-glucose deprivation-induced hyperpermeability in the blood-brain barrier. Current Neurovascular Research. 6 (3), 181-193 (2009).
- Culot, M., et al. Cerebrovascular protection as a possible mechanism for the protective effects of NXY-059 in preclinical models: An in vitro study. Brain Research. 1294, 144-152 (2009).
- Vandenhaute, E., Drolez, A., Sevin, E., Gosselet, F., Mysiorek, C., Dehouck, M. -. P. Adapting co-culture in vitro models of the blood-brain barrier for use in cancer research: Maintaining an appropriate endothelial monolayer for the assessment of transendothelial migration. Laboratory Investigation. 96 (5), 588-598 (2016).
- Cucullo, L., Hossain, M., Puvenna, V., Marchi, N., Janigro, D. The role of shear stress in Blood-Brain Barrier endothelial physiology. BMC Neuroscience. 12, 40 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены