Method Article
ヒト血液脳関門をモデル化した三重培養細胞系
* これらの著者は同等に貢献しました
要約
このプロトコルは、ヒト血液脳関門(BBB) インビトロ モデルを確立する方法を記載する。内皮細胞と周皮細胞はインサートフィルター(血液コンパートメント)の両側に播種され、星状細胞は下部ウェル(脳コンパートメント)に播種されます。特性評価されたモデルは、ナノ粒子輸送実験に使用された。
要約
脳実質へのアクセスを制御および制限する血液脳関門(BBB)の非常に特異的で制限的な特性のために、脳への薬物の送達は依然として課題です。しかし、ナノテクノロジーの開発に伴い、薬物送達を改善するために新しいナノ材料の大規模なパネルが開発され、前臨床アッセイの枠組みで脳の浸透を予測するための信頼性の高い in vitro マイクロシステムの必要性が浮き彫りになりました。これは、ヒト細胞のみを使用してBBBをモデル化するための微生物学的システムを設定する簡単な方法です。その構成では、モデルは、脳様内皮細胞(BREC)、周皮細胞、および星状細胞を含む3つの主要なBBB細胞アクターを含むトリプル培養で構成されており、化合物を引き締める必要なしに、より生理学的な方法でBBB特性を誘導および調節するために必要な。12ウェルプレートフォーマットで開発されたモデルは、6日間のトリプルカルチャーで準備が整い、物理的特性、遺伝子、およびタンパク質発現が特徴付けられ、ポリマーナノゲル輸送測定に使用されます。このモデルは、健康および病理学的条件での広範な実験に使用でき、分子および粒子輸送、ならびに細胞間および細胞内輸送の前臨床評価のための貴重なツールとなります。
概要
脳毛細血管内皮細胞(EC)のレベルで局在するBBBは、脳の恒常性と神経細胞の機能を維持するために重要な脳実質へのアクセスを制御および調節します1,2。しかしながら、脳病理学の場合、脳実質へのアクセスの欠如は、治療戦略を開発する上での本当の障害を表す。
BBB ECは、細胞間空間を密閉するタイトジャンクション(TJ)タンパク質を含む複雑な一連の特性を有し、排出ポンプ、特異的トランスポーター、および経細胞経路を制御する受容体のシステムに関連しています1,2,3。さらに、BBB EC基底膜に埋め込まれた周皮細胞および脳毛細血管を端足が囲む星状細胞とのコミュニケーションのおかげで、これらすべての特性が誘導および維持される1,2,3。したがって、BBBをin vitroで研究することは、その構造の複雑さと、神経血管ユニット(NVU)を構成するさまざまな細胞タイプ間のコミュニケーションを考慮すると課題です2。さらに、異なる細胞タイプはBBB特性の誘導と維持に不可欠であり、その結果、BBBを通過する予測に影響を与えます。脳への薬物送達のためのさまざまな戦略は、BBBの制限された特性をバイパスするための戦術の大規模なパネルを使用してすでにテストされています4。最近では、ナノテクノロジーの進歩に伴い、薬物キャリアとしての用途のための新しい材料が開発されています5,6。これらの新しいナノ材料は、それらのより高い負荷、毒性の低下、および薬物のバイオアベイラビリティの増加に加えて、BBBを通過し、実質5,6の細胞を特異的に標的とするトロイの木馬戦略のために機能化することができます。評価されているさまざまな種類のナノ材料の中で、ナノゲルは、主にコロイド特性と化学構造を調整して刺激応答特性を導入する能力のためにかなりの注目を集めています7、8、9、10、11、12、13、14、15。
in vitroモデルは現在、薬物の脳内浸透を予測するためにヒト細胞を使用する前臨床試験用に開発されています16。これらのモデルの異なる設定は、脳ECの単層から複数の細胞系まで、利用可能です16。BBBの誘導と維持におけるNVU細胞の重要性、および病理学的環境への協調的な応答を考慮すると、BBBのin vitroモデルは、予測の関連性を改善するためにこれらすべての主人公を考慮する必要があります2,17。
現在の方法では、特定の細胞およびヒトの分子メカニズムを研究するために、ヒト細胞で完全に開発されたヒトBBBのトリプル培養in vitroモデルを設定することが説明されています。生理学的に関連性があるために、このモデルは、BBB特性を誘導および維持するために必要なBBBの主要な3つの細胞アクター(EC、周皮細胞、および星状細胞)で構成され、引き締め化合物を使用せずに、in vitroBBBモデルと見なすために必要な一連の特性を表示します16,18。このモデルは、血液と脳のコンパートメントを区切る構成で設定され、脳の浸透を予測するための薬物と粒子輸送の前臨床試験に適しています。モデルの有用性は、ポリマーナノゲルの輸送を測定することによって示される。
プロトコル
このプロトコルは、フランスの高等教育研究省(参照:CODECOH DC2011-1321)および地元の治験審査委員会(フランス、ブーヴリーのベテューヌ産科病院)によって承認されました。内皮細胞(EC)を取得するために、フランスの法律に準拠して、臍帯血を収集するために、ドナーの両親から書面およびインフォームドコンセントが得られました。周皮細胞は、神田隆教授(山口大学大学院医学系研究科神経内科学・臨床神経科学分野)によって提供され、参考文献19に従って分離されました。初代ヒト脳皮質星状細胞は、商業プロバイダーから購入されます( 材料の表を参照)。
1. 細胞培養
- 内皮細胞の培養
注:内皮細胞(EC)は、Pedrosoら20に記載されている方法に従って、ヒト臍帯血から単離されたCD34+造血幹細胞に由来します。ECの内皮表現型は、Pedrosoら20に記載されている。- 5%のウシ胎児血清(FCS)、0.5%のゲンタマイシン、および1%の内皮細胞増殖サプリメント(ECM)を添加した内皮細胞培地を使用して、ヒトECを培養します( 材料の表を参照)。
- 継代培養ECの場合、モデルの設定の2日前に、1つの皿に10 mLの2%ゼラチンを37°Cで15分間コーティングし、20 mLの温かいECMと交換します。100万個の細胞を含むECの1つのバイアル(細胞凍結前のステップ2.3.3に記載されているように細胞を手動で計数した細胞)をプレコート細胞培養皿に解凍する。
- 37°Cで3時間後、培地を更新し、5%CO2及び21%O2下で37°Cのインキュベーター内で加湿雰囲気中で三培養の硬化まで細胞を維持する。
- 周皮細胞の培養
注:周皮細胞は、清水らが発表したプロトコルに従ってヒトの脳から単離されます19、その分離手順は、神田らによって公開された方法に従います 21 修正を加えたもの。- 4.5 g / Lのグルコース(DMEM HG)、10%のFCS、1%のデペニシリン/ストレプトマイシン、および1%のL-グルタミンを添加したダルベッコの改変イーグル培地を使用して周皮細胞を培養します( 材料の表を参照)。
- 周皮細胞継代培養では、モデルの設定の5日前に、0.02 N酢酸中のコラーゲンI型溶液100 μg/mLを室温(RT)で1時間8 mL/皿で2皿コーティングし、RT DMEM HGで2回洗浄します。10 mLの温かい培地を含むコニカルチューブで100万個の細胞を含む周皮細胞の1つのバイアルを解凍し、懸濁液を20°Cで190 x g で5分間遠心分離します。
- ペレットを10 mLの温かい培地に再懸濁し、15 mLの温かい培地/ディッシュを事前に充填したプレコート細胞培養ディッシュにシードします。培地を3日後に更新し、細胞を5%CO2および21%O2下で37°Cの加湿インキュベーター内で三培養液にセットするまで維持する。
- アストロサイトの培養
- 20%のFCS、1%のアストロサイト増殖サプリメント、および1%のペニシリン/ストレプトマイシン溶液(AM)を添加したアストロサイト培地を使用してアストロサイトを培養します( 材料の表を参照)。
- アストロサイトを継代培養するには、モデルの設定の1週間前に、1つのT75細胞培養フラスコに10 mLの2 μg/cm 2ポリ-L-リジン(PLL)を37°Cで1時間コーティングし、RT滅菌水で2 回洗浄します。100万個の細胞を含むアストロサイトの1バイアルを20 mLの温かい培地で解凍し、プレコートT75細胞培養フラスコにシードします。
注:市販の細胞バイアルは~100万個の細胞の存在を確認するため、ここでは細胞のカウントは行われませんでした。 - 細胞を加湿インキュベーター内で、5%CO2および21%O2下で37°Cに維持する。培地は24時間後に更新され、その後、三培養の設定まで2日ごとに更新されます。
2. トリプルカルチャーモデル設定
注:3つのセルタイプの組み立ては同じ日に実行されます。三培養の設定の前日に、戻したインサートフィルター( 材料表を参照)でコラーゲンタイプIコーティングを行い、12ウェルプレートのPLLプレコートウェルにアストロサイトを播種します。
- ウェルへの星状細胞の播種
- ステップ1.3.2の説明に従って、500 μLの2 μg/cm2 PLL溶液でウェルをコーティングします。
- 10 mLの温かいリン酸緩衝生理食塩水-カルシウムおよびマグネシウムを含まない1X(1X PBS-CMF)(表1)で細胞を1回洗浄してから、10 mLの温かい20%トリプシン/ EDTA(T/E)溶液で37°Cで3分間インキュベートし、細胞をフラスコから機械的に剥離します。懸濁液を、5mLの温かい非希釈FCSを含む円錐形のチューブに移します。
注:プロバイダーのプロトコル22によると、アストロサイトの収集は、フラスコをインキュベーターに1分間置き、フラスコをタップして剥離を完了させることで最適化できます。残りの細胞は5 mLのT / E中和溶液で収集し、FCSを含む円錐形チューブに入れる必要があります。 - 懸濁液を190 x gで20°Cで5分間遠心分離します。
- 細胞ペレットを5 mLの温かいAMに再懸濁します。顕微鏡下で手動計数チャンバーを使用して、20 μLの細胞懸濁液を80 μLの1X PBS-CMFで希釈することにより、細胞をカウントします( 材料の表を参照)。各PLLプレコートウェルに約40,000細胞/cm2 を1.5 mLの温かいAMの容量でプレートします。
- 元に戻されたインサートフィルターへの周皮細胞の播種
- 250 μLのコラーゲンタイプI溶液(100 μg/mL)を、滅菌ピンセットを使用して高さ25 mmのカバー付き皿( 材料の表を参照)の周囲に置きます。コーティングを無菌条件下でRTで1時間放置します。
注意: 使用する皿は、フードの外で無菌性を維持し、元に戻したフィルターの溶液と皿のカバーとの接触を避けるために十分に高くする必要があります。 - 吸引システムに接続されたガラスピペットでコラーゲンタイプI溶液を慎重に取り除きます。250 μLのRT DMEM HGで2回洗浄し、インサートフィルターからすべての溶液を慎重に取り除きます。コーティングされたインサートフィルターは、細胞の播種まで無菌条件下でRTのままにします。
注意: コーティング手順中は、膜の損傷を防ぐためにフィルターに触れないように注意してください。コラーゲンタイプIでコーティングされたインサートフィルターは、RTで一晩保管できます。 - 三培養設定の日に、10 mLの温かい1X PBS-CMFで周皮細胞を2回洗浄し、2 mLの温かいトリプシンで細胞をインキュベートします。顕微鏡下で細胞を観察することにより、トリプシンの作用をモニターする。細胞が剥離し始めたら、トリプシンを除去し、機械的解離の前に5 mLの温かいECMを追加します。
- 顕微鏡下で手動計数チャンバーを使用して、20 μLの細胞懸濁液を80 μLの1X PBS-CMFで希釈して細胞をカウントし、250 μLの容量でプレコートされたリバートインサートフィルターに44,500細胞/cm2を播種します。 インサートフィルターを加湿インキュベーターに37°C、5%CO2および21%O2下で3時間保持します。
- 1.5 mLの温かいECM/ウェルを含む12ウェルプレートで滅菌ピンセットを使用して、インサートフィルターを慎重に元に戻します。これで、インサートフィルターを反対側にコーティングする準備が整いました。
- 250 μLのコラーゲンタイプI溶液(100 μg/mL)を、滅菌ピンセットを使用して高さ25 mmのカバー付き皿( 材料の表を参照)の周囲に置きます。コーティングを無菌条件下でRTで1時間放置します。
- インサートフィルターへの内皮細胞の播種
- インサートフィルターの上面を500 μLの細胞外マトリックスベースのヒドロゲル(1/48 v / v)でコーティングします(材料の表を参照)。1時間後、加湿インキュベーター内で、5%CO2および21%O2下で37°C、500μLのRT DMEM HGで1回洗浄する。
- 10 mLの温かい1X PBS-CMFで1回洗浄し、2 mLの温かいトリプシンで細胞をインキュベートします。細胞が剥離し始めたら、トリプシンを除去し、機械的解離の前に5 mLの温かいECMを追加します。
- 顕微鏡下で手動計数チャンバーを使用して、20 μLの細胞懸濁液を80 μLの1X PBS-CMFで希釈して細胞をカウントし、500 μLの温かいECMの容量のプレコートインサートフィルター上に71,500細胞/cm2 の密度でECをシードします。
- AMを1.5 mLの温かいECM/ウェルに交換し、播種したインサートフィルター(EC+周皮細胞)をアストロサイトを含むウェルに移します。
- 三培養細胞系を、5%CO2および21%O2下で37°Cの加湿インキュベーターに入れます。
- BBB特性の誘導のためのトリプルセル培養の維持
注:ECでBBB特性を誘導するには、6日間の三重培養が必要です。- 培地を6日目まで1日おきに更新し、吸引システムに接続されたガラスピペットを使用して上部と下部のコンパートメントから培地を注意深く取り出します。
- 上部コンパートメントに500 μL、下部コンパートメントに1.5 mLの容量の温かいECMとすばやく交換し、5%CO2 および21%O2の下で37°Cの加湿インキュベーターに細胞を戻します。
3. BBB表現型検証
注:6日間の三重培養の後、ECでBBB表現型を誘導するのに必要な時間、ヒトBBBモデルは実験の準備ができています。脳様内皮細胞(BLEC)の物理的完全性は、BBB完全性マーカーに対する透過性アッセイを使用して評価されたTJタンパク質の免疫蛍光染色によって視覚化されます。BBB表現型検証には、Deligne et al.,23に記載されている手順に従って、遺伝子/タンパク質発現分析と排出ポンプの機能も含まれます。周皮細胞および星状細胞は、Deligne らに記載の手順に従ってそれぞれの染色マーカーによって視覚化される。202023.
- 免疫蛍光染色
- インサートフィルターとアストロサイトを氷冷メタノール/アセトン(50/50 v/v)に1分間固定し、RT 1X PBS-CMFで2回洗浄します。
- メスを使用してメンブレンを切断することにより、フィルターをインサートから慎重に分離します。Deligneら23に従って、メンブレンウェルおよびボトムウェルで免疫細胞化学を実行します。
注意: ブロッキングステップには、250 μLのSEA BLOCKブロッキングバッファー( 材料表を参照)をRTで30分間使用します。
- BBB完全性アッセイ
- フルオレセインナトリウム(NaF)や20 kDaデキストラン(FD20)など、分子量の異なるBBB完全性マーカーを使用した透過性アッセイにより、BLECの物理的完全性を評価します( 材料の表を参照)。
注:実験は、Deligne et al.23に記載されている手順に従って実行できます。
- フルオレセインナトリウム(NaF)や20 kDaデキストラン(FD20)など、分子量の異なるBBB完全性マーカーを使用した透過性アッセイにより、BLECの物理的完全性を評価します( 材料の表を参照)。
- 排水ポンプの機能
- P-gpおよびBCRP阻害剤であるエラクリダールの有無にかかわらず、ローダミン123(R123)の細胞内蓄積を測定することにより、P糖タンパク質(P-gp)および乳がん耐性タンパク質(BCRP)の機能を評価します( 材料の表を参照)。
注:実験は、Deligne et al.23に記載されている手順に従って実行できます。
- P-gpおよびBCRP阻害剤であるエラクリダールの有無にかかわらず、ローダミン123(R123)の細胞内蓄積を測定することにより、P糖タンパク質(P-gp)および乳がん耐性タンパク質(BCRP)の機能を評価します( 材料の表を参照)。
- 遺伝子とタンパク質の発現
- 細胞の冷たいリンガーHEPES(RH)(表1)で素早く洗浄した後、氷上で遺伝子およびタンパク質サンプル収集を実行します。ECサンプル採取前に、倒立インサートフィルタ20から周皮細胞を削り取る。
4. ナノゲル輸送
注:三培養BLECモデルの管腔から腺コンパートメントへのポリマーナノゲル(NG)の通過を推定するために、0.1 mg / mLのNG溶液を6日目に管腔コンパートメントに24時間追加しました。研究されたNGは、平均サイズが8〜10 nmの蛍光タグ付きN-イソプロピルアクリルアミド(NIPAM)ベースのヒドロゲルでした( 材料の表を参照)。
- ナノゲル粉末を秤量し、ECMに1 mg/mLの濃度で可溶化します。溶液を10分間超音波処理し、0.2μmのPTFEフィルターを使用してろ過します。
注:実験当日に新鮮なNG溶液を調製してください。 - 管腔コンパートメントの培地を交換し、上部コンパートメントに50 μLのNGs溶液を加えて、最終濃度0.1 mg/mLにします。
注意: 元の溶液から1:10の希釈を実行します。 - 24時間のインキュベーション後、管腔(20 μL)および管腔(200 μL)コンパートメントからアリコートを収集し、黒色の96ウェルプレートに入れます。
- 477/540 nmでの励起/発光波長の設定を使用して、黒い96ウェルプレートを備えた蛍光マルチプレートリーダー(材料の表を参照)を使用して蛍光を定量します。時間= 0時間(t0)6,15に添加された最初の作業溶液に対する交差の割合を計算します。
注:蛍光測定用の96ウェルプレートを準備するには、アブミナルコンパートメントから200 μLの溶液と管腔コンパートメントから20 μLの溶液を追加し、t0調製します(180 μLのECMを追加して、最終容量200 μLに到達します)。検量線とブランクも読み取りプレートに含めます。機器パラメータ:検出方法-蛍光、光学位置-トップ、読み取りタイプ-エンドポイント、励起波長-477nm、発光波長-540nm、感度-100、振とう-5秒間の二重軌道。
結果
ヒト三重培養BBBモデルの設定
ヒトBBB インビトロ モデルの設定に必要なプロトコルは、 図1 に記載されており、順序が厳密に尊重されなければならない連続したステップを含む。まず、3種類の細胞を細胞培養皿で個別に培養してから(図1A)、インサートフィルターシステムで組み立てます。トリプルカルチャーセッティングは、プレコートされたボトムウェルに最初の細胞型であるアストロサイトを播種することから始まります。翌日、周皮細胞とECをインサートフィルターのプレコートされたアブミナル表面と管腔表面にそれぞれ播種します。次に、インサートフィルターを星状細胞上に移動します。このモデルは、ECにおいてBBB特性を誘導するのに必要な時間、特許取得済みの共培養モデル24に従って1日おきに培地の更新を伴う6日間培養中に維持される。その後、ECの名前がBLECに変更されます(図1B)。
ヒトBBBモデルの特性評価
トリプルセル培養モデルは、BBB特異的特性のセットの存在について特徴付けられている。まず、免疫細胞化学データにより、血小板由来成長因子受容体β(PDGFR-β)25,26、周皮細胞ではデスミン、アストロサイトではグリア線維性酸性タンパク質(GFAP)26などの従来のマーカーの発現が確認されました(図2A)。したがって、周皮細胞およびアストロサイトによる6日間の培養後、VE-カドヘリンの接着接合染色で可視化されたBLECの単層は、細胞境界におけるTJタンパク質Claudin-5およびZO-1の連続的な局在を示します(図2A)。図2Bに示すように、TJのセットアップは、低分子量のBBB完全性マーカー、すなわちNaF(376 Da)16,27および高分子量のFD20(20 kDa)27を使用して測定された低傍細胞透過係数と相関しています。測定された値は、ECの正確なソース23、24、28を使用した検証済みのBBBインビトロモデルと同等です。全体として、これらの結果は、in vivo BBBの特徴である三重培養BLEC単層の低い傍細胞透過性を浮き彫りにしている。さらに、BLECにおけるR123細胞内蓄積は、排出ポンプ阻害剤Elacridar 23,24の存在において、その不在を有する対照条件と比較して有意な増加を示した(図2C)。これは、BLEC中に活性排出ポンプ分子、すなわちP-gpおよびBCRPが存在することを示しています。
BLECをさらに特徴付けるために、主要なBBB機能の遺伝子発現とタンパク質レベルを調べました(図3)。三重培養モデルで得られたデータを、対照モデルとして使用したECと周皮細胞24 からなる検証済みで特許取得済みの共培養モデルと比較した。アストロサイトは、トリプルカルチャーモデルの初期共培養モデルで追加された3番目の細胞タイプを表します。したがって、三重培養BLECの遺伝子発現解析(図3A)は、共培養BLECと比較して、TJタンパク質(クローディン-5および小帯オクルーデン-1)および排出ポンプ(P-gpおよびBCRP)などの主要なBBB機能の発現の維持、および最も研究されているBBBトランスポーター(グルコーストランスポーター1)および受容体(トランスフェリン受容体)のアップレギュレーションを示しました。タンパク質定量データ(図3B)は、転写結果と一致していることがわかった。全体として、これらのデータは、検証された共培養モデルと同様のトリプル培養BLEC層におけるBBB特性の正の誘導を支持しています。全体として、トリプル培養モデルは、BBBをモデル化するための in vitro マイクロ生理学的システムに必要な物理的および代謝的特性を表示します。
薬物送達戦略への適用性 - ナノゲル輸送の測定
新しい脳送達戦略を研究するために三重培養モデルを使用する可能性を評価するために、蛍光タグ付きNIPAMベースの中性NGの輸送を評価しました6,15。時間0において、NGは0.1mg/mLの濃度で管腔コンパートメントに入れられた(図4A)。24時間のインキュベーション後、NGの5.82%がアブミナルコンパートメントに見つかり(図4B)、BLECを通過する能力が証明されました。
結果は、完全性マーカーで説明されているように、大小の化合物の透過性を測定し、ポリマーNGなどのナノ材料の輸送を評価するためのモデルの適合性を示しています。
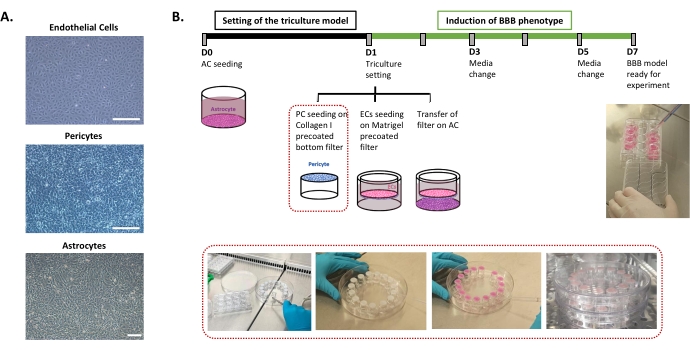
図1:ヒトBBBの三重培養 インビトロ モデルの設定のための重要なステップの表現 。 (A)BBBモデルの3つの細胞成分(内皮細胞(EC)、周皮細胞(PC)、およびアストロサイト(AC)の位相差画像。スケールバー= 250μm。 (B)ヒトBBB インビトロ モデルの三重培養の設定のための概略図および例示的なタイムライン。強調表示されたボックスは、逆インサートフィルターのコーティング手順を表します。 この図の拡大版を表示するには、ここをクリックしてください。
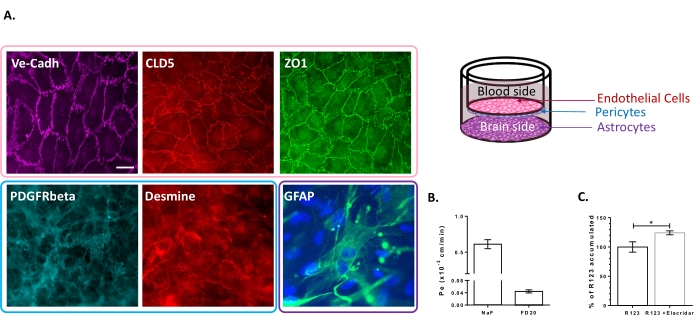
図2:三重培養BBBモデルの特性の評価 。 (A)BLECs(クローディン-5:CLD5、オックスクルーデンス帯-1:ZO1およびVE-カドヘリン:Ve-Cadh)、周皮細胞(血小板由来成長因子受容体-β:PDGFR-βおよびデスミン)、およびアストロサイト(グリア線維性酸性タンパク質:GFAP)の特徴的なマーカーの代表的な免疫染色画像。スケールバー = 10 μm。 (B)蛍光BBB完全性マーカー、フルオレセインナトリウム(NaF、376 Da、Pe:0.61±0.062)およびFITCデキストラン(FD20、20 kDa、Pe:0.04±0.005)に対するBLECの傍細胞透過性。N = 3;n = 9。(C)ECにおけるP-gpおよびBCRP機能は、エラクリダール(124.2%±3.39%)およびなし(100%±8.79%)の細胞内R123を定量することによって評価した。±N = 4;n = 12。対応のないt検定を使用した平均±SEM = 0.017。 この図の拡大版を表示するには、ここをクリックしてください。
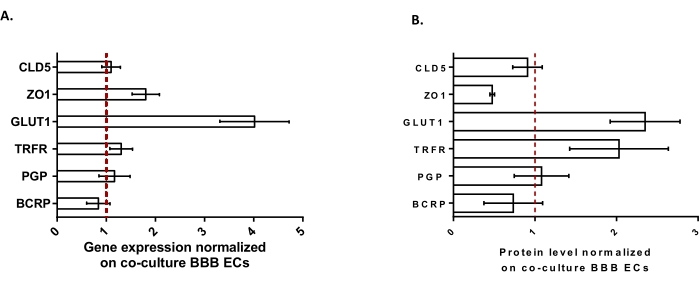
図3:共培養BBBモデルと比較したトリプルカルチャーモデルにおけるBLEC遺伝子発現および特徴的なマーカーのタンパク質レベルの評価 。 (A)タイトジャンクションタンパク質(クローディン-5:CLD5、ゾナオクルーデン-1:ZO1)、トランスポーター(グルコーストランスポーター-1:GLUT1、P糖タンパク質:PGP、乳がん抵抗性タンパク質:BCRP)、および高分子受容体(トランスフェリン受容体:TRFR)の遺伝子発現をRPLP0の発現によって正規化します。N = 3;n = 9。(B)タイトジャンクションタンパク質(CLD5およびZO1)、トランスポーター(GLUT1、PGP、およびBCRP)、および高分子受容体(TRFR)のタンパク質レベルを、β-アクチンの発現によって正規化します。N = 3;n = 9。SEM±平均します。(A)および(B)の場合、値>1は、トリプルカルチャーモデルにおけるより高い遺伝子発現またはタンパク質レベルに対応する。赤い線は、2つのモデルの発現レベル(遺伝子またはタンパク質)が同等である値1に対応します。 この図の拡大版を表示するには、ここをクリックしてください。
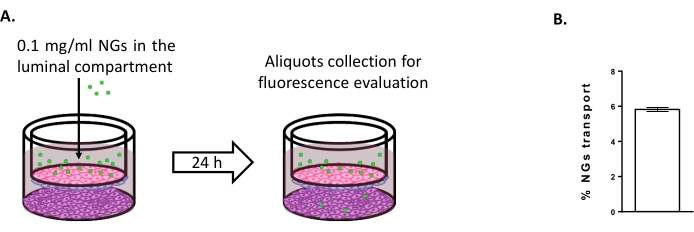
図4:三重培養モデルにおけるナノゲル輸送の測定。 (a)ナノゲル輸送アッセイの概略図。(B)三重培養モデルにおける24時間のインキュベーション後のナノゲル輸送の割合(5.82%±0.09%)。N = 2;n = 6。SEM±平均します。 この図の拡大版を表示するには、ここをクリックしてください。
| バッファの名前 | 組成 | 手記 | ||||
| 分子量 | ||||||
| リン酸緩衝生理食塩水、カルシウムマグネシウムフリー | PBS-CMF | ナトリウム | 8グラム/リットル | 58.4 | すべての化合物を滅菌水に加え、完全に可溶化するのを待ちます。得られた溶液のpHは7.3〜7.4の範囲でなければならない。0.22 μmメンブレンを用いて溶液をろ別し、滅菌溶液を4°Cで保存します。 | |
| KCl | 0.2グラム/リットル | 74.55 | ||||
| KH2PO4 | 0.2グラム/リットル | 136.09 | ||||
| NaHPO4-12 H2O | 2.87グラム/リットル | 358.14 | ||||
| 水 | ||||||
| リンガーヘペス | 相対湿度 | ナトリウム | 8.8グラム/リットル | 58.4 | すべての化合物を滅菌水に加え、完全に可溶化するのを待ちます。pHを7.4に調整します(開始溶液のpHは約6.8)。0.22 μmメンブレンを用いて溶液をろ別し、滅菌溶液を4°Cで保存します。 | |
| KCl | 0.387グラム/リットル | 74.55 | ||||
| 塩化カルシウム2 | 0.244グラム/リットル | 110.99 | ||||
| MgCl 2 6H2 O | 0.0406 g/L | 203.3 | ||||
| ナトリウム3 | 0.504グラム/リットル | 84.1 | ||||
| ヘペス | 1.19グラム/リットル | 238.3 | ||||
| グルコース | 0.504グラム/リットル | 180.16 | ||||
| 水 | ||||||
表1:プロトコルで使用されるさまざまなバッファーの構成。
ディスカッション
脳疾患の治療は、脳実質の細胞および分子標的に到達するためにBBBを超える薬剤の難しさを考えると、依然として課題です。
脳疾患の医薬品開発は、前臨床モデルで有望な結果を示すほとんどの薬剤が臨床で使用しても効果を示さなかったため、現在低い成功率を示しています。実験に使用する動物の数を減らすことを目的とした「3Rルール」に従って、BBBの in vitro モデルは、脳の病状を研究し、薬物の脳浸透を予測するために開発されています29。BBBの インビトロ モデルは、主に動物細胞を用いて開発されており、得られた結果の関連性を改善するためにより洗練されている16。ヒト細胞の使用における重要な進歩の1つは、ヒト疾患メカニズムを研究するために、細胞および分子レベルで否定できない新しい洞察とより特異性をもたらします16。ただし、関連するモデルの開発には、BBB のin vitro モデル設定の改善と、動物モデルのおかげで得られる知識を考慮する必要があります。したがって、BBBアーキテクチャの複雑さと、生理学的および病理学的条件下でBBBを研究するための細胞間コミュニケーションの重要性を考慮する必要があります30。
ここに提示されるプロトコルは、脳組織へのアクセスを制限することなく、BBBの3つの主要な細胞型を含む完全ヒトBBB インビトロ モデルをセットアップする方法を記載する。多細胞系として、BBB特性の誘導および維持は、引き締め化合物の人為的な使用なしに、代わりに細胞間コミュニケーションによって誘導されるが、より生理学的に関連性があり、BBB特性の インビボ 誘導と一致している31。したがって、プロトコルの年表を尊重することは、プロトコルの成功にとって最も重要です。さらに、三重培養の設定中および3つの細胞タイプが組み立てられた後のインキュベーション時間は、プロトコルの主要な重要なステップを表しています。
ECにおけるBBB特性は、共培養モデル24について記載されるように、周皮細胞との共培養によって誘導される。したがって、インサートフィルターの裏側での周皮細胞の培養は最も重要なポイントであり、BBB特性の誘導に十分な周皮細胞がないリスクがあるため、プロトコルに厳密に従う必要があります。まず、コーティング手順および細胞播種中に、ペトリ皿のカバーがコーティングと接触しないように注意し、細胞を播種した後の培地にも、フィルターの良好なコーティングを確保し、細胞を失わないように注意する必要があります(ステップ2.2.1および2.2.4)。さらに、周皮細胞が播種されたら、周皮細胞が付着するまで指示された時間待ってから(ステップ2.2.4)、反対側のECのコーティングと播種のためのインサートフィルターを元に戻すことが不可欠です(ステップ2.2.5および2.3)。播種すると、細胞間通信を介してBBB特性を誘導するのに6日かかります(ステップ2.4)。
トリプル培養モデルのECは、検証された共培養モデルと同様のBBB完全性マーカーへの透過性値を表示し、検証済みの動物またはヒトモデルでも測定されるため、モデルは制限された透過性(タイトジャンクションの設定に関連する)の観点から検証されます16、27、32。さらに、インビトロBBBモデルの検証には、制限された透過性に加えて、NVUの他の細胞型に対する応答性、ならびに機能的受容体および輸送体の発現16が必要である。さらに、このモデルは再現性があり、複数のインサートフィルターとウェルを生成して、細胞ソーティング方法を必要とせずに、各細胞タイプで多数の分析(遺伝子およびタンパク質発現、蛍光染色、毒性試験)を個別に実行します。
このモデルは、0.4 μmの孔径フィルターを使用して開発され、インサートフィルターの両側に1つの細胞タイプがあります。インサートフィルターシステムは、十分に含有する星状細胞に細胞間コミュニケーションを移すことによって、生理学的条件下での細胞間コミュニケーションの研究を可能にしました。系内の星状細胞の存在は、インビトロモデル24の初期共培養と比較したプラス値を表す。実際、BBBの生理機能における星状細胞の重要性を考慮すると、この第3の細胞型は、BBB内の細胞間コミュニケーションのさらなる理解を可能にする。さらに、トリプルセル培養システムは、アストロサイトが不可欠な役割を果たす脳卒中などの病理学的状態でも研究することができます33、34、35。さらに、インサートフィルターの両側にあるBREC/周皮細胞の設計は、脳腫瘍23などの病理学的状態を模倣するために他の細胞型に簡単に配置できます。
インサートフィルターの孔径は、BBBを横切る細胞移動など、一部の実験では制限をもたらす可能性があります。しかしながら、より大きな孔径を有するモデルの開発は、BBB36を模倣するのに生理学的に関連しない、多重層ではなくECの生理学的単層の形成を確実にするためのプロトコルの適応を必要とする。
このモデルの適用性は、多細胞システムを用いた輸送実験を行う可能性を示すNGs輸送実験を用いて実証されている。それにもかかわらず、各ナノ構造は独自の特性(分子量、電荷、形状、物理的特性、タンパク質コロナ形成)を示すため、輸送実験用の対照化合物または分子を持つことの難しさに注意する必要があります。
このモデルの1つの制限は、せん断応力がないことであり、これはECの分化およびTJタンパク質の発現に影響を与えることが実証された37。しかし、脳の毛細血管を模倣した流体システムの開発は、複数の細胞系に特定のデバイスを必要とする流体部分を追加することの複雑さを考えると困難です。さらに、特定のデバイスは通常市販されておらず、多くの反復を許可しないため、流体システムはハイスループットの使用にあまり適していません。
要約すると、ヒト細胞からなるこの三重培養系は、BBBの構造を in vitro で再現する。これにより、化合物の広範なスクリーニングに使用できる多くのインサートを生成できます。
開示事項
著者は、利益相反がないことを宣言します。
謝辞
この研究は、NANOSTEMプロジェクトの一環として、マリー・スクウォドフスカ・キュリー・イノベーティブ・トレーニング・ネットワーク(ITN)(フェローシップ・エレオノーラ・リッツィ)の一環として、助成金契約No 764958の下で欧州連合のHorizon 2020研究およびイノベーションプログラムによって付与されます。この研究は、「クレマンス・ド・リーニュのフェローシップ」、「ソシエテ・フランセーズ・デ・ルッテ・コントレ・レ・レ・キャンサーズ・エ・レ・ランファンと思春期」(SFCE)、「レトワール・ド・マーティン」協会、および「カサンドラ・コントレ・ラ・ロイセミー」協会によって付与されています。
資料
| Name | Company | Catalog Number | Comments |
| Cell Culture | |||
| Astocyte Medium (AM) | ScienCell | 1801 | |
| Astrocyte Growth Supplement | ScienCell | 1852 | Astrocyte Growth Supplement is provided in the AM set. |
| Cell culture dish 100 mm | Corning | 430293 | 100 mm x 20 mm; dish used for the thawing of ECs and PCs before the triculture setting |
| Cell culture dish 150 mm | Corning | 430599 | The height of these dishes (25 mm) allows the seeding of PCs in the reverted insert for the setting of the triculture model. |
| Collagen I | Corning | 354236 | Rat tail |
| Dulbecco's Modified Eagle Medium | Gibco | 31600-083 | Powder |
| Endothelial Cell Growth Supplement | ScienCell | 1051 | Endothelial Cell Growth Supplement is provided in the ECM set. |
| Endothelial Cell Medium (ECM) | ScienCell | 1001 | |
| Fetal Calf Serum | Sigma | F7524 | |
| Gelatin | Sigma | G2500 | 2% gelatin from porcine skin in PBS-CMF |
| Gentamicin | BiochromA6 | A-2712 | |
| Glucose | Sigma | G6152 | Powder |
| Glutamine | Merck | 1002891000 | |
| Human Brain Cortex Astrocytes | ScienCell | 1800-SC | |
| Malassez cell counting chamber | vWR | HECH40453702 | The count was performed manually. |
| Matrigel | Corning | 354230 | Extracellular matrix-based hydrogel |
| Penicillin/Streptomycin | ScienCell | 0503 | Penicillin/Streptomycin solution is provided in the ECM and AM sets. |
| Poly-L-lysine | ScienCell | 0413 | |
| Steritop | Millipore System | SCGPT0SRE | 0.22 µm pore size |
| Transwell insert | Corning | 3401 | 0.4 µm pore polycarbonate filter |
| Trypsin/EDTA neutralization solution | ScienCell | 0113 | |
| Trypsin/EDTA solution | ScienCell | 0103 | |
| Immunocytochemistry | |||
| SEA BLOCK blocking buffer | ThermoScientific | 37527 | |
| Alexa Fluor 568 anti-Mouse secondary antibody | Thermofisher | A11031 | Dilution 1:500 |
| Alexa Fluor 568 anti-Rabbit secondary antibody | Thermofisher | A11036 | Dilution 1:500 |
| Anti-Claudin-5 primary antibody | InVitrogen | 34-1600 | Dilution 1:100 |
| Anti-Desmin primary antibody | Abcam | ab6322 | Dilution 1:200 |
| Anti-Glial Fibrillary Acidic Protein primary antibody | Dako | Z0334 | Dilution 1:500 |
| Anti-Platelet-Derived Growth Factor-β primary antibody | Abcam | ab51090 | Dilution 1:200 |
| Anti-VE-cadherin primary antibody | Abcam | ab207732 | Dilution 1:200 |
| Anti-Zona Occludens-1 primary antibody | InVitrogen | 61-7300 | Dilution 1:200 |
| Normal Goat Serum | Sigma | G6767 | |
| ProLong Diamond Antifade Mountant with DAPI | Invitrogen | P36962 | |
| Gene expression | |||
| NucleoSpin Rna/Protein Macherey Nagel Kit | Macherey-Nagel | 740,933,250 | |
| 96 multiplate well | Biorad | HSP9601 | |
| iSCRIPT | Biorad | 1708841 | |
| Sealer sheet | Biorad | MSB1001 | |
| SsoFast EvaGreen Supermix | Biorad | 172-5201 | |
| Protein expression | |||
| 2x Laemli Sample Buffer | Biorad | 161-0737 | Add 50 µL of bMercaptoetanol to 950 µL of Laemmli Buffer and store at -20°C. Dilute 1:1 with the protein sample for the assay. |
| Anti-Breast Cancer Resistance Protein primary antibody | Abcam | ab207732 | Pre-treatment 15 minutes at RT under agitation; dilution 1:1000, O.N. at 4°C |
| Anti-Claudin-5 primary antibody | Abcam | ab15106 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Glucose Transporter 1 primary antibody | Millipore | 07-1401 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Mouse secondary antibody | Dako | P0447 | Dilution 1:5000 in TBS-Tween |
| Anti-P-glycoprotein primary antibody | Genetex | GTX23364 | Pre-treatment 15 minutes at RT under agitation; dilution 1:400, 3 hours at RT |
| Anti-Rabbit secondary antibody | Dako | P0448 | Dilution 1:8000 in TBS-Tween |
| Anti-Transferrin Receptor primary antibody | Abcam | ab84036 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Zona occludens-1 primary antibody | Abcam | ab216880 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Criterion TGX Gel | Biorad | 5678083 | |
| ECL Prime Solution | Amersham | RPN2236 | Revelation solution to keep in the dark |
| Phospatase inhibitor cocktail 2 | Sigma | P5726 | |
| Phospatase inhibitor cocktail 3 | Sigma | P0044 | |
| Protease Inhibitor | Sigma | P8340 | |
| Protein Standards | Biorad | 161-0373 | Molecular weight markers |
| RIPA 10x | Millipore | 20-188 | |
| TBS 10x | Biorad | 1706435 | |
| TRIS-Glycine | Biorad | 1610771 | |
| Tween | Biorad | 1706531 | |
| BBB integrity assay | |||
| Sodium Fluorescein | Ampresco | 0681 | λex= 490 nm; λem= 525 nm |
| Elacridar | Sigma | SML0486 | GF120918 |
| FITC-Dextran 20 kDa | Sigma | FD-20S | λex= 490 nm; λem= 525 nm |
| Rhodamine 123 | Sigma | R8004 | λex= 501 nm; λem= 538 nm |
| SynergyTM H1 | BioTek Instruments | Fluorescent multiplate reader | |
| Nanogel Transport | |||
| Syringe | Terumo | SS+01T1 | 1 mL syringe |
| Filter | FisherScientific | 15161499 | 0.2 µm PTFE membrane filter, 15 mm diameter |
| N-Isopropylacrylamide (NIPAM)-based hydrogels | The nanogels (NGs) used in the study are provided by our collaborator in Queen Mary University London, Department of Chemistry. The NGs are covalently tagged with a fluorescent molecule (λex= 477 nm; λem= 540 nm). NGs are freeze dried and shipped as powder, in this state they are stable at room temperature for long period of time. |
参考文献
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37, 13-25 (2010).
- Profaci, C. P., Munji, R. N., Pulido, R. S., Daneman, R. The blood-brain barrier in health and disease: Important unanswered questions. The Journal of Experimental Medicine. 217 (4), 20190062 (2020).
- Abbott, N. J. Blood-brain barrier structure and function and the challenges for CNS drug delivery. Journal of Inherited Metabolic Disease. 36 (3), 437-449 (2013).
- Kreuter, J. Drug delivery to the central nervous system by polymeric nanoparticles: What do we know. Advanced Drug Delivery Reviews. 71, 2-14 (2014).
- Zhang, W., Mehta, A., Tong, Z., Esser, L. . L.Advanced science. 8 (10), 2003937 (2021).
- Vashist, A., et al. Nanogels as potential drug nanocarriers for CNS drug delivery. Drug Discovery Today. 23 (7), 1436-1443 (2018).
- Lombardo, S. M., Schneider, M., Türeli, A. E., Günday Türeli, N. Key for crossing the BBB with nanoparticles: The rational design. Beilstein Journal of Nanotechnology. 11, 866-883 (2020).
- Bernardo-Castro, S., et al. Therapeutic nanoparticles for the different phases of ischemic stroke. Life. 11 (6), 482 (2021).
- Salinas, Y., Castilla, A. M., Resmini, M. An L-proline based thermoresponsive and pH-switchable nanogel as a drug delivery vehicle. Polymer Chemistry. 9 (17), 2271-2280 (2018).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353 (2019).
- Preman, N. K., Jain, S., Johnson, R. P. ”Smart” polymer nanogels as pharmaceutical carriers: A versatile platform for programmed delivery and diagnostics. ACS Omega. 6 (8), 5075-5090 (2021).
- Cuggino, J. C., Blanco, E. R. O., Gugliotta, L. M., Alvarez Igarzabal, C. I., Calderón, M. Crossing biological barriers with nanogels to improve drug delivery performance. Journal of Controlled Release Official Journal of the Controlled Release Society. 307, 221-246 (2019).
- Basso, J., et al. Hydrogel-based drug delivery nanosystems for the treatment of brain tumors. Gels. 4 (3), 62 (2018).
- Harilal, S., et al. Revisiting the blood-brain barrier: A hard nut to crack in the transportation of drug molecules. Brain Research Bulletin. 160, 121-140 (2020).
- Papadimitriou, S. A., Robin, M. P., Ceric, D., O'Reilly, R. K., Marino, S., Resmini, M. Fluorescent polymeric nanovehicles for neural stem cell modulation. Nanoscale. 8 (39), 17340-17349 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Cecchelli, R., et al. Modelling of the blood-brain barrier in drug discovery and development. Nature Reviews Drug Discovery. 6 (8), 650-661 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. An overview of in vitro techniques for blood-brain barrier studies. Methods in Molecular Medicine. 89, 307-324 (2003).
- Shimizu, F., et al. Peripheral nerve pericytes modify the blood-nerve barrier function and tight junctional molecules through the secretion of various soluble factors. Journal of Cellular Physiology. 226 (1), 255-266 (2011).
- Pedroso, D. C., et al. Improved survival, vascular differentiation and wound healing potential of stem cells co-cultured with endothelial cells. PLoS One. 6 (1), 16114 (2011).
- Kanda, T., Iwasaki, T., Yamawaki, M., Ikeda, K. Isolation and culture of bovine endothelial cells of endoneurial origin. Journal of Neuroscience Research. 49 (6), 769-777 (1997).
- Data sheet on human astrocytes culture. Technical resources from ScienCell Available from: https://www.sciencellonline.com/human-astrocytes.html#product_tabs_technicalresources (2021)
- Deligne, C., et al. Development of a human in vitro blood-brain tumor barrier model of diffuse intrinsic pontine glioma to better understand the chemoresistance. Fluids and Barriers of the CNS. 17 (1), 37 (2020).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), 99733 (2014).
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-Brain Barrier: From physiology to disease and back. Physiological Reviews. 99 (1), 21-78 (2019).
- Daneman, R., Prat, A. The Blood-Brain Barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), 020412 (2015).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability studies on in vitro blood-brain barrier models: Physiology, pathology, and pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Heymans, M., Figueiredo, R., Dehouck, L., Francisco, D., Sano, Y., Shimizu, F., Kanda, T., Bruggmann, R., Engelhardt, B., Winter, P., Gosselet, F., Maxime, C. Contribution of brain pericytes in blood-brain barrier formation and maintenance: A transcriptomic study of co-cultured human endothelial cells derived from hematopoietic stem cells. Fluids Barriers CNS. 17, 48 (2020).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Neuhaus, W. In Vitro Models of the Blood-Brain Barrier. Handbook of Experimental Pharmacology. 265, 75-110 (2021).
- Hoheisel, D., Nitz, T., Franke, H., Wegener, J., Hakvoort, A., Tilling, T., Galla, H. J. Hydrocortisone reinforces the blood-brain properties in a serum free cell culture system. Biochemical and Biophysical Research Communications. 247 (2), 312-315 (1998).
- Drolez, A., et al. Selection of a relevant in vitro blood-brain barrier model to investigate pro-metastatic features of human breast cancer cell lines. PloS One. 11 (3), 0151155 (2016).
- Neuhaus, W., Gaiser, F., Mahringer, A., Franz, J., Riethmüller, C., Förster, C. The pivotal role of astrocytes in an in vitro stroke model of the blood-brain barrier. Frontiers in Cellular Neuroscience. 8, 352 (2014).
- Mysiorek, C., et al. Peroxisome proliferator-activated receptor-α activation protects brain capillary endothelial cells from oxygen-glucose deprivation-induced hyperpermeability in the blood-brain barrier. Current Neurovascular Research. 6 (3), 181-193 (2009).
- Culot, M., et al. Cerebrovascular protection as a possible mechanism for the protective effects of NXY-059 in preclinical models: An in vitro study. Brain Research. 1294, 144-152 (2009).
- Vandenhaute, E., Drolez, A., Sevin, E., Gosselet, F., Mysiorek, C., Dehouck, M. -. P. Adapting co-culture in vitro models of the blood-brain barrier for use in cancer research: Maintaining an appropriate endothelial monolayer for the assessment of transendothelial migration. Laboratory Investigation. 96 (5), 588-598 (2016).
- Cucullo, L., Hossain, M., Puvenna, V., Marchi, N., Janigro, D. The role of shear stress in Blood-Brain Barrier endothelial physiology. BMC Neuroscience. 12, 40 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved