Method Article
Un sistema celular de triple cultivo que modela la barrera hematoencefálica humana
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe un método para establecer un modelo in vitro de barrera hematoencefálica humana (BHE). Las células endoteliales y los pericitos se siembran a cada lado de un filtro de inserción (compartimento sanguíneo), y los astrocitos se siembran en el pozo inferior (compartimento cerebral). El modelo caracterizado se utilizó para experimentos de transporte de nanopartículas.
Resumen
La administración de medicamentos al cerebro sigue siendo un desafío debido a las propiedades altamente específicas y restrictivas de la barrera hematoencefálica (BBB), que controlan y restringen el acceso al parénquima cerebral. Sin embargo, con el desarrollo de las nanotecnologías, se desarrollaron grandes paneles de nuevos nanomateriales para mejorar la administración de fármacos, destacando la necesidad de microsistemas in vitro confiables para predecir la penetración cerebral en el marco de ensayos preclínicos. Aquí hay un método sencillo para configurar un sistema microfisiológico para modelar la barrera hematoencefálica utilizando únicamente células humanas. En su configuración, el modelo consiste en un triple cultivo que incluye células endoteliales similares al cerebro (BLC), pericitos y astrocitos, los tres principales actores celulares BBB necesarios para inducir y regular las propiedades de BBB de una manera más fisiológica sin el requisito de apretar compuestos. El modelo desarrollado en un formato de placa de 12 pocillos, listo después de 6 días de triple cultivo, se caracteriza por propiedades físicas, expresiones genéticas y proteicas y se utiliza para la medición del transporte de nanogel polimérico. El modelo se puede utilizar para una amplia gama de experimentos en condiciones saludables y patológicas y representa una herramienta valiosa para las evaluaciones preclínicas del transporte de moléculas y partículas, así como el tráfico inter e intracelular.
Introducción
La BHE, localizada a nivel de las células endoteliales capilares cerebrales (CE), controla y regula el acceso al parénquima cerebral, que es crucial para mantener la homeostasis cerebral y la función de las células neuronales 1,2. Sin embargo, en el caso de la patología cerebral, la falta de acceso al parénquima cerebral representa un obstáculo real para desarrollar estrategias terapéuticas.
Las CE BBB poseen un conjunto complejo de propiedades, incluyendo proteínas de unión estrecha (TJ), que sellan el espacio intercelular, asociadas con un sistema de bombas de elujo, transportadores específicos y receptores, que controlan la vía transcelular 1,2,3. Además, todas estas propiedades son inducidas y mantenidas, gracias a las comunicaciones con los pericitos incrustados en la membrana basal de BBB EC y los astrocitos, cuyos patas terminales rodean los capilares cerebrales 1,2,3. Por lo tanto, el estudio de la BHE in vitro es un desafío considerando la complejidad de su arquitectura y las comunicaciones entre los diferentes tipos celulares que constituyen la unidad neurovascular (NVU)2. Además, los diferentes tipos de células son cruciales para la inducción y el mantenimiento de las propiedades de la BHE y, en consecuencia, afectan la predicción del cruce a través de la BHE. Diferentes estrategias para la administración de fármacos al cerebro ya fueron probadas utilizando un gran panel de tácticas para eludir las propiedades restringidas de BBB4. Más recientemente, con el progreso de las nanotecnologías, se están desarrollando nuevos materiales para aplicaciones como portadores de fármacos 5,6. Además de su mayor carga, menor toxicidad y mayor biodisponibilidad de los fármacos, estos nuevos nanomateriales pueden ser funcionalizados para una estrategia de caballo de Troya para cruzar la barrera hematoencefálica y dirigirse específicamente a las células en el parénquima 5,6. Entre los diferentes tipos de nanomateriales que se están evaluando, los nanogeles han atraído considerable atención, principalmente debido a sus propiedades coloidales y su capacidad para adaptar la estructura química para introducir propiedades sensibles a estímulos 7,8,9,10,11,12,13,14,15.
Ahora se desarrollan modelos in vitro para estudios preclínicos con células humanas para predecir la penetración cerebral de fármacos16. Diferentes configuraciones de estos modelos están disponibles, desde monocapas de CE cerebrales hasta sistemas celulares múltiples16. Teniendo en cuenta la importancia de las células NVU en la inducción y mantenimiento de la BHE y la respuesta coordinada al ambiente patológico, los modelos in vitro de BHE necesitan considerar todos estos protagonistas para mejorar la relevancia de la predicción 2,17.
El método actual describe la creación de un modelo de triple cultivo in vitro de la barrera hematoencefálica humana, que está completamente desarrollado con células humanas para estudiar mecanismos moleculares celulares y humanos específicos. Para ser fisiológicamente relevante, el modelo consiste en los tres principales actores celulares de la BHE (CE, pericitos y astrocitos) necesarios para inducir y mantener las propiedades de la BHE, sin el uso de compuestos tensores y mostrando un conjunto de propiedades requeridas para ser considerado como un modelo de BBB in vitro 16,18. El modelo se configura en una configuración que delimita el compartimento sanguíneo y cerebral, adecuado para estudios preclínicos de transporte de fármacos y partículas para predecir la penetración cerebral. La utilidad del modelo se ilustra midiendo el transporte de nanogeles poliméricos.
Protocolo
El protocolo fue aprobado por el Ministerio francés de Educación Superior e Investigación (referencia: CODECOH DC2011-1321) y por la junta local de revisión de investigación (Hospital de Maternidad de Béthune, Beuvry, Francia). Para la obtención de las células endoteliales (CE), se obtuvo el consentimiento escrito e informado de los padres del donante para recolectar sangre del cordón umbilical, de conformidad con la legislación francesa. Los pericitos son proporcionados por el profesor Takashi Kanda (Departamento de Neurología y Neurociencia Clínica, Facultad de Medicina de la Universidad de Yamaguchi, Ube, Japón) que fueron aislados según la Referencia19. Los astrocitos primarios de la corteza cerebral humana se compran a un proveedor comercial (consulte la Tabla de materiales).
1. Cultivo celular
- Cultivo de células endoteliales
NOTA: Las células endoteliales (CE) se derivan de células madre hematopoyéticas CD34+ aisladas de sangre del cordón umbilical humano, según el método descrito por Pedroso et al.20. El fenotipo endotelial de las CE se describe en Pedroso et al.20.- Cultivar CE humanas utilizando medio de células endoteliales suplementado con 5% de suero fetal de ternera (FCS), 0,5% de gentamicina y 1% de suplemento de crecimiento celular endotelial (ECM) (ver Tabla de materiales).
- Para el subcultivo de AE, dos días antes del fraguado del modelo, cubra un plato con 10 ml de gelatina al 2% durante 15 minutos a 37 °C y luego reemplácelo con 20 ml de ECM tibia. Descongele un vial de AE que contiene 1 millón de células (las células se contaron manualmente como se describe en el paso 2.3.3 antes de la congelación celular) en la placa de cultivo celular prerecubierta.
- Después de 3 h a 37 °C, renovar el medio y mantener las células hasta el cuajado del tricultivo en atmósfera humidificada dentro de una incubadora a 37 °C bajo 5% de CO2 y 21% deO2.
- Cultivo de pericitos
NOTA: Los pericitos son aislados del cerebro humano según el protocolo publicado por Shimizu et al.19, cuyo procedimiento de aislamiento sigue el método publicado por Kanda et al.21 con modificaciones.- Cultive los pericitos usando el medio Eagle modificado de Dulbecco suplementado con 4.5 g / L de glucosa (DMEM HG), 10% de FCS, 1% de penicilina / estreptomicina y 1% de L-glutamina (ver Tabla de materiales).
- Para el subcultivo de pericitos, cinco días antes del ajuste del modelo, cubra dos platos con 8 ml / plato de 100 μg / ml de solución de colágeno tipo I en ácido acético 0.02 N durante 1 h a temperatura ambiente (RT) y luego lave dos veces con RT DMEM HG. Descongele un vial de pericitos que contenga 1 millón de células en un tubo cónico que contenga 10 ml de medio caliente y centrifugar la suspensión durante 5 min a 190 x g a 20 °C.
- Resuspender el pellet en 10 ml de medio caliente y sembrar en las placas de cultivo celular prerecubiertas precargadas con 15 ml de medio/plato caliente. El medio se renueva después de 3 días, y las células se mantienen hasta el ajuste del tricultivo en una incubadora humidificada a 37 °C bajo 5% CO2 y 21%O2.
- Cultivo de astrocitos
- Cultive los astrocitos usando un medio de astrocito suplementado con 20% de FCS, 1% de suplemento de crecimiento de astrocitos y 1% de solución de penicilina/estreptomicina (AM) (ver Tabla de materiales).
- Para el subcultivo de los astrocitos, una semana antes del fraguado del modelo, encubrir un matraz de cultivo celular T75 con 10 ml de poli-L-lisina (PLL) de 2 μg/cm2 durante 1 h a 37 °C y lavar dos veces con agua estéril RT. Descongele un vial de astrocitos que contenga 1 millón de células en 20 ml de medio caliente y semilla en el matraz de cultivo celular T75 prerecubierto.
NOTA: Los viales celulares obtenidos comercialmente confirman la presencia de ~ 1 millón de células, por lo que el recuento de células no se realizó aquí. - Mantener las células en una incubadora humidificada a 37 °C bajo 5% de CO2 y 21% deO2. El medio se renueva después de 24 h y luego cada 2 días hasta el cuajado de la tricultura.
2. Configuración del modelo de cultivo triple
NOTA: El ensamblaje de los tres tipos de celdas se realiza el mismo día. El día antes del ajuste del tricultivo, realice el recubrimiento de colágeno tipo I en los filtros de inserción revertidos (consulte la Tabla de materiales) y siembre los astrocitos en los pocillos prerecubiertos de PLL de una placa de 12 pocillos.
- Siembra de astrocitos en los pozos
- Cubrir los pocillos con 500 μL de solución de PLL de 2 μg/cm2 como se describe en el paso 1.3.2.
- Lavar las células una vez con 10 ml de solución salina tampón fosfato caliente - 1X (1X PBS-CMF) sin calcio y magnesio (Tabla 1) antes de incubar durante 3 min a 37 °C con 10 ml de solución tibia de tripsina/EDTA (T/E) al 20% y separar mecánicamente las células del matraz. Transfiera la suspensión a un tubo cónico que contenga 5 ml de FCS no diluido caliente.
NOTA: De acuerdo con el protocolo22 del proveedor, la recolección de astrocitos se puede optimizar colocando el matraz en la incubadora durante 1 minuto y golpeando el matraz para ayudar a completar el desprendimiento. Las células restantes deben recogerse con 5 ml de solución de neutralización T/E y colocarse en el tubo cónico que contiene FCS. - Centrifugar la suspensión durante 5 min a 20 °C a 190 x g.
- Resuspender el pellet celular en 5 ml de AM caliente. Contar las células diluyendo 20 μL de la suspensión celular en 80 μL de 1X PBS-CMF usando una cámara de conteo manual bajo un microscopio (ver Tabla de materiales). Coloque alrededor de 40,000 células / cm2 en cada pocillo prerecubierto con PLL en un volumen de 1.5 ml de AM caliente.
- Siembra de pericitos en los filtros de inserción revertidos
- Agregue 250 μL de solución de colágeno tipo I (100 μg/ml) en los filtros de inserción invertidos, colocados en la periferia de un plato cubierto de 25 mm de altura (ver Tabla de materiales) utilizando pinzas estériles. Dejar el recubrimiento durante 1 h en RT en condiciones estériles.
NOTA: El plato usado debe ser lo suficientemente alto como para garantizar el mantenimiento de la esterilidad cuando está fuera de la campana y evitar el contacto entre las soluciones en el filtro invertido y la cubierta del plato. - Retire cuidadosamente la solución de colágeno tipo I con una pipeta de vidrio conectada a un sistema de aspiración. Lavar dos veces con 250 μL de RT DMEM HG y luego retirar con cuidado toda la solución de los filtros de plaquita. Deje los filtros de inserción recubiertos en RT en condiciones estériles hasta la siembra de las células.
NOTA: Durante el procedimiento de recubrimiento, tenga cuidado de no tocar el filtro para evitar daños en la membrana. Una vez recubiertos con colágeno tipo I, los filtros de inserción se pueden almacenar durante la noche en RT. - El día del ajuste del tricultivo, lavar los pericitos dos veces con 10 ml de PBS-CMF 1X tibio e incubar las células con 2 ml de tripsina tibia. Monitoree la acción de la tripsina observando las células bajo el microscopio. Una vez que las células comiencen a desprenderse, retire la tripsina y agregue 5 ml de ECM caliente antes de la disociación mecánica.
- Contar las células diluyendo 20 μL de la suspensión celular en 80 μL de 1X PBS-CMF utilizando una cámara de conteo manual bajo un microscopio, y sembrar 44.500 células/cm2 en los filtros de inserción revertidos pre-recubiertos en un volumen de 250 μL. Mantener los filtros de inserción en una incubadora humidificada a 37 °C durante 3 h bajo 5% de CO2 y 21% deO2.
- Revierta cuidadosamente los filtros de inserción utilizando pinzas estériles en una placa de 12 pocillos que contenga 1,5 ml de ECM/pocillo caliente. Los filtros de inserción ahora están listos para ser recubiertos en el otro lado.
- Agregue 250 μL de solución de colágeno tipo I (100 μg/ml) en los filtros de inserción invertidos, colocados en la periferia de un plato cubierto de 25 mm de altura (ver Tabla de materiales) utilizando pinzas estériles. Dejar el recubrimiento durante 1 h en RT en condiciones estériles.
- Siembra de células endoteliales en los filtros de inserción
- Cubra la parte superior de los filtros de inserción con 500 μL de hidrogel extracelular basado en matriz (1/48 v/v) (consulte la Tabla de materiales). Después de 1 h, en una incubadora humidificada a 37 °C bajo 5% de CO2 y 21% deO2, lavar una vez con 500 μL de RT DMEM HG.
- Lavar una vez con 10 ml de 1X PBS-CMF tibio e incubar las células con 2 ml de tripsina tibia. Una vez que las células comiencen a desprenderse, retire la tripsina y agregue 5 ml de ECM caliente antes de la disociación mecánica.
- Contar las células diluyendo 20 μL de la suspensión celular en 80 μL de 1X PBS-CMF utilizando una cámara de conteo manual bajo microscopio y sembrar los CE a una densidad de 71.500 células/cm2 en los filtros de inserción prerecubiertos en un volumen de 500 μL de ECM caliente.
- Reemplace AM con 1.5 ml de ECM caliente / pocillo y luego transfiera los filtros de inserción sembrados (EC + pericitos) sobre los pocillos que contienen los astrocitos.
- Colocar los sistemas celulares de tricultivo en una incubadora humidificada a 37 °C por debajo de 5% de CO2 y 21% deO2.
- Mantenimiento del cultivo de triple célula para la inducción de las propiedades de la BHE
NOTA: Para la inducción de las propiedades BBB en los ECs, son necesarios 6 días de triple cultivo.- Renueve el medio cada dos días hasta el día 6, retirando cuidadosamente el medio del compartimento superior e inferior utilizando una pipeta de vidrio conectada con un sistema de aspiración.
- Reemplace rápidamente con ECM caliente en un volumen de 500 μL en el compartimento superior y 1,5 ml en el compartimiento inferior, y vuelva a colocar las celdas en una incubadora humidificada a 37 °C bajo 5% de CO2 y 21% deO2.
3. Validación del fenotipo BBB
NOTA: Después de 6 días de triple cultivo, el tiempo necesario para inducir el fenotipo BBB en los CE, el modelo BBB humano está listo para experimentos. La integridad física de las células endoteliales similares al cerebro (BLC) se visualiza mediante tinción de inmunofluorescencia de proteínas TJ evaluadas mediante un ensayo de permeabilidad a los marcadores de integridad BBB. La validación del fenotipo BBB también incluye el análisis de expresión de genes/proteínas y la funcionalidad de las bombas de eflujo según el procedimiento descrito en Deligne et al.23. Los pericitos y astrocitos se visualizan mediante marcadores de tinción respectivos de acuerdo con el procedimiento descrito en Deligne et al. 202023.
- Tinción por inmunofluorescencia
- Fije los filtros de inserción y los astrocitos en metanol/acetona helado (50/50 v/v) durante 1 minuto y lave dos veces con RT 1X PBS-CMF.
- Separe cuidadosamente el filtro del inserto cortando la membrana con un bisturí. Realizar inmunocitoquímica en la membrana y pocillos del fondo según Deligne et al.23.
NOTA: Para el paso de bloqueo, utilice 250 μL de búfer de bloqueo SEA BLOCK (consulte la Tabla de materiales) durante 30 minutos en RT.
- Ensayo de integridad BBB
- Evaluar la integridad física de los BLECs mediante un ensayo de permeabilidad utilizando marcadores de integridad BBB con diferentes pesos moleculares, como fluoresceína de sodio (NaF) y dextrano de 20 kDa (FD20) (ver Tabla de materiales).
NOTA: El experimento puede realizarse de acuerdo con el procedimiento descrito en Deligne et al.23.
- Evaluar la integridad física de los BLECs mediante un ensayo de permeabilidad utilizando marcadores de integridad BBB con diferentes pesos moleculares, como fluoresceína de sodio (NaF) y dextrano de 20 kDa (FD20) (ver Tabla de materiales).
- Funcionalidad de la bomba de eflujo
- Evaluar la funcionalidad de la glicoproteína P (P-gp) y la proteína de resistencia al cáncer de mama (BCRP) midiendo la acumulación intracelular de rodamina 123 (R123) con y sin elacridar, un inhibidor de P-gp y BCRP (ver Tabla de materiales).
NOTA: El experimento puede realizarse de acuerdo con el procedimiento descrito en Deligne et al.23.
- Evaluar la funcionalidad de la glicoproteína P (P-gp) y la proteína de resistencia al cáncer de mama (BCRP) midiendo la acumulación intracelular de rodamina 123 (R123) con y sin elacridar, un inhibidor de P-gp y BCRP (ver Tabla de materiales).
- Expresiones génicas y proteicas
- Realizar la recolección de muestras de genes y proteínas en hielo después de un lavado rápido con Ringer HEPES frío (RH) (Tabla 1) de las células. Antes de la recolección de muestras AE, raspe los pericitos de los filtros de inserción invertidos20.
4. Transporte de nanogel
NOTA: Para estimar el paso de nanogeles poliméricos (NGs) del compartimento luminal al abluminal del modelo BLEC de tricultivo, se agregaron 0,1 mg/mL de solución de NG al día 6 en el compartimento luminal durante 24 h. Los NG estudiados fueron marcados fluorescentemente con hidrogeles a base de N-isopropilacrilamida (NIPAM) con un tamaño promedio de 8-10 nm (ver Tabla de materiales).
- Pesar el polvo de nanogel y solubilizarlo en ECM a una concentración de 1 mg/ml. Sonicar la solución durante 10 minutos y filtrar con un filtro de PTFE de 0,2 μm.
NOTA: Prepare una solución fresca de NG el día del experimento. - Cambie el medio en el compartimento luminal y agregue 50 μL de solución de NG en el compartimento superior para una concentración final de 0,1 mg/ml.
NOTA: Realice una dilución de 1:10 de la solución original. - Después de 24 h de incubación, recoger las alícuotas de los compartimentos luminal (20 μL) y abluminal (200 μL) y colocarlas en una placa negra de 96 pocillos.
- Cuantifique la fluorescencia utilizando un lector fluorescente multiplaca (consulte la Tabla de materiales) con una placa negra de 96 pocillos utilizando el ajuste de longitudes de onda de excitación/emisión a 477/540 nm. Calcular el porcentaje de cruce referido a la solución de trabajo inicial añadida en el tiempo = 0 h (t0)6,15.
NOTA: Para preparar la placa de 96 pocillos para la medición de fluorescencia, añadir 200 μL de solución del compartimento abluminal y 20 μL de solución del compartimento luminal y la preparación t0 (añadir 180 μL de ECM para alcanzar un volumen final de 200 μL). Incluya también una curva de calibración y un espacio en blanco en la placa de lectura. Parámetros instrumentales: Método de detección - Fluorescencia, Posición óptica - Superior, Tipo de lectura - Punto final, Longitud de onda de excitación - 477 nm, Longitud de onda de emisión - 540 nm, Sensibilidad - 100, Agitación - Orbital doble durante 5 s.
Resultados
Ajuste del modelo de BBB de triple cultivo humano
El protocolo requerido para el ajuste del modelo in vitro de BBB humano se describe en la figura 1 e incluye pasos sucesivos cuyo orden debe respetarse estrictamente. Primero, los tres tipos de células se cultivan individualmente en placas de cultivo celular (Figura 1A) antes de ensamblarse en un sistema de filtro de inserto. El ajuste de cultivo triple comienza con la siembra del primer tipo de célula, los astrocitos, en el pozo inferior prerecubierto. Al día siguiente, los pericitos y los CE se siembran en las superficies abluminal y luminal prerecubiertas del filtro de inserto, respectivamente. El filtro de inserción se transfiere sobre los astrocitos. El modelo se mantiene en cultivo durante 6 días, el tiempo necesario para inducir las propiedades BBB en CE, con una renovación del medio cada dos días según el modelo patentado de cocultivo24. A continuación, se cambia el nombre de los CE como BLEC (Figura 1B).
Caracterización del modelo de BBB humano
El modelo de cultivo celular triple se ha caracterizado por la presencia de un conjunto de propiedades específicas de BBB. En primer lugar, los datos de inmunocitoquímica confirmaron la expresión de marcadores convencionales como el receptor del factor de crecimiento derivado de plaquetas β (PDGFR-β)25,26 y la desmina para pericitos y la proteína ácida fibrilar glial (GFAP)26 para astrocitos (Figura 2A). Así, después de los 6 días de cultivo con los pericitos y astrocitos, la monocapa de BLECs, visualizada con la tinción de unión adherente de VE-Cadherina, muestra una localización continua de las proteínas TJ, Claudina-5 y ZO-1, en los bordes celulares (Figura 2A). La configuración de los TJ se correlaciona con bajos coeficientes de permeabilidad paracelular medidos utilizando marcadores de integridad BBB de bajo peso molecular, es decir, NaF (376 Da)16,27 y alto peso molecular, es decir, FD20 (20 kDa)27, como se muestra en la Figura 2B. Los valores medidos son comparables con los modelos in vitro de BBB validados utilizando la fuente exacta de CEs23,24,28. En conjunto, estos resultados resaltan la baja permeabilidad paracelular de la monocapa BLEC de triple cultivo, que es característica de la barrera hematoencefálica in vivo. Además, la acumulación intracelular de R123 en BLECs mostró un aumento significativo en la presencia del inhibidor de la bomba de eflujo Elacridar 23,24 en comparación con la condición de control con su ausencia (Figura 2C). Esto indica la presencia de moléculas activas de la bomba de eflujo de salida, a saber, P-gp y BCRP, en los BLC.
Para caracterizar aún más los BLC, se estudió la expresión génica y el nivel de proteína de las características clave de BBB (Figura 3). Los datos obtenidos con el modelo de triple cultivo se compararon con el modelo de cocultivo validado y patentado que consiste en CE y pericitos24 utilizados como modelo de control. Los astrocitos representan el tercer tipo de célula añadido en el modelo inicial de cocultivo en el modelo de triple cultivo. Por lo tanto, el análisis de expresión génica (Figura 3A) de los BLEC de triple cultivo, en comparación con los BLEC de cocultivo, mostró el mantenimiento de la expresión de características clave de BBB como las proteínas TJ (claudina-5 y zonula occludens-1) y las bombas de eflujo (P-gp y BCRP), y la regulación positiva de los transportadores de BBB más estudiados (transportador de glucosa 1) y receptores (receptor de transferrina). Se encontró que los datos de cuantificación de proteínas (Figura 3B) estaban en línea con los resultados transcripcionales. En general, estos datos apoyan la inducción positiva de propiedades BBB en la capa BLEC de triple cultivo similar al modelo de cocultivo validado. En conjunto, el modelo de triple cultivo muestra las propiedades físicas y metabólicas requeridas para que un sistema microfisiológico in vitro modele la barrera hematoencefálica.
Aplicabilidad a las estrategias de administración de fármacos: medición del transporte de nanogel
Para evaluar la posibilidad de utilizar el modelo de triple cultivo para estudiar nuevas estrategias de entrega cerebral, se evaluó el transporte de NGs neutros basados en NIPAM marcados con fluorescencia 6,15. En el momento 0, los NG se colocaron en el compartimiento luminal a una concentración de 0,1 mg/ml (Figura 4A). Después de 24 h de incubación, el 5,82% de los NG se encontraron en el compartimiento abluminal (Figura 4B), lo que demuestra su capacidad para cruzar los BLEC.
Los resultados demuestran la idoneidad del modelo para medir la permeabilidad de compuestos pequeños y grandes, como se describe con los marcadores de integridad, y evaluar el transporte de nanomateriales como los NG poliméricos.
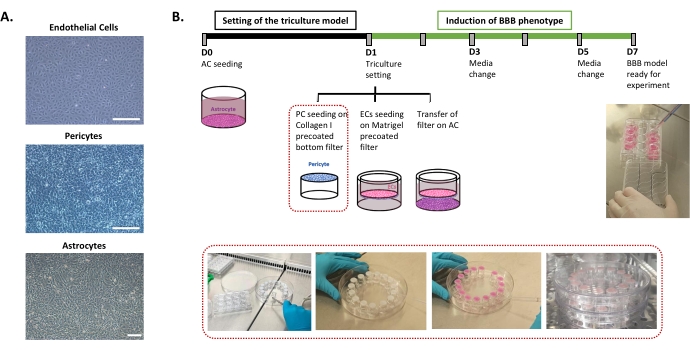
Figura 1: Representación de pasos críticos para el ajuste del modelo de triple cultivo in vitro de la barrera hematoencefálica humana. (A) Imágenes de contraste de fase de los tres componentes celulares del modelo BBB: células endoteliales (EC), pericitos (PC) y astrocitos (AC). Barra de escala = 250 μm. (B) Línea de tiempo esquemática e ilustrativa para el ajuste del modelo in vitro de BBB humano de triple cultivo. El cuadro resaltado representa el procedimiento de recubrimiento para el filtro de inserción invertido. Haga clic aquí para ver una versión más grande de esta figura.
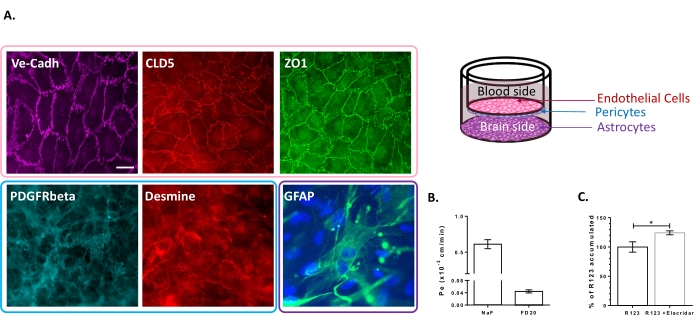
Figura 2: Evaluación de las propiedades del modelo de triple cultivo BBB. (A) Imágenes representativas de inmunotinción de los marcadores distintivos para BLECs (Claudina-5: CLD5, Zona Occludens-1: ZO1 y VE-Cadherin: Ve-Cadh), pericitos (Platelet-Derived Growth Factor Receptor-β: PDGFR-β y desmina) y astrocitos (Glial Fibrillary Acidic Protein: GFAP). Barra de escala = 10 μm. (B) Permeabilidad paracelular de BLECs a marcadores fluorescentes de integridad BBB, fluoresceína de sodio (NaF, 376 Da, Pe: 0.61 ± 0.062) y FITC-Dextrano (FD20, 20 kDa, Pe: 0.04 ± 0.005). N = 3; n = 9. La media ± SEM. (C) La funcionalidad de P-gp y BCRP en CE se evaluó cuantificando R123 intracelular con (124,2% ± 3,39%) y sin (100% ± 8,79%) Elacridar. N = 4; n = 12. Media ± SEM. p = 0,017 utilizando una prueba t no pareada. Haga clic aquí para ver una versión más grande de esta figura.
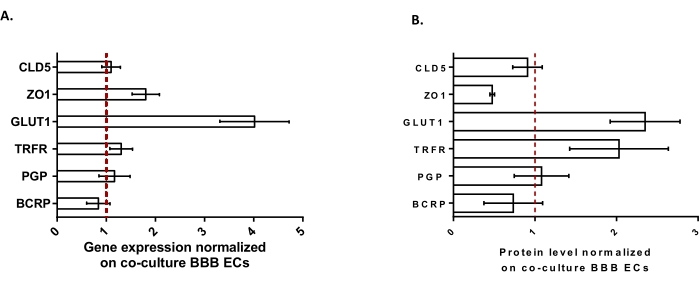
Figura 3: Evaluación de la expresión génica BLEC y el nivel de proteína de marcadores distintivos en el modelo de triple cultivo comparado con el modelo de cocultivo BBB. (A) Expresión génica de proteínas de unión estrecha (Claudina-5: CLD5 y Zona Occludens-1: ZO1), transportadores (Transportador de glucosa-1: GLUT1, P-glicoproteína: PGP y Proteína de resistencia al cáncer de mama: BCRP) y receptores de moléculas grandes (Receptor de transferrina: TRFR), normalizados por la expresión de RPLP0. N = 3; n = 9. (B) Nivel proteico de proteínas de unión estrecha (CLD5 y ZO1), transportadores (GLUT1, PGP y BCRP) y receptores de moléculas grandes (TRFR), normalizados por la expresión de β-actina. N = 3; n = 9. Media ± SEM. Para (A) y (B), los valores>1 corresponden a mayores niveles de expresión génica o proteína en el modelo de triple cultivo. La línea roja corresponde a un valor de 1 donde el nivel de expresión (genes o proteínas) de los dos modelos es equivalente. Haga clic aquí para ver una versión más grande de esta figura.
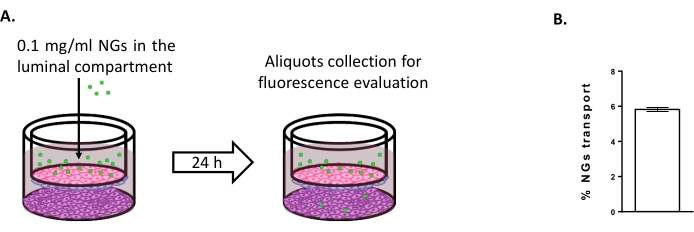
Figura 4: Medición del transporte de nanogel en el modelo de triple cultivo. (A) Representación esquemática del ensayo de transporte de nanogel. (B) Porcentaje de transporte de nanogel después de 24 h de incubación en el modelo de triple cultivo (5,82% ± 0,09%). N = 2; n = 6. Media ± SEM. Haga clic aquí para ver una versión más grande de esta figura.
| Nombre del búfer | Composición | Nota | ||||
| Peso molecular | ||||||
| Solución salina tampón fosfato, libre de calcio y magnesio | PBS-CMF | NaCl | 8 g/L | 58.4 | Agregue todo el compuesto al agua estéril y espere la solubilización completa. El pH de la solución obtenida debe estar en el rango de 7.3-7.4. Filtrar la solución con una membrana de 0,22 μm y conservar la solución estéril a 4 °C. | |
| Kcl | 0,2 g/L | 74.55 | ||||
| KH2PO4 | 0,2 g/L | 136.09 | ||||
| NaHPO4-12 h2o | 2,87 g/L | 358.14 | ||||
| Agua | ||||||
| Timbre HEPES | RH | NaCl | 8,8 g/L | 58.4 | Agregue todo el compuesto al agua estéril y espere a que se complete la solublización. Ajuste el pH a 7.4 (pH inicial de la solución alrededor de 6.8). Filtrar la solución con una membrana de 0,22 μm y conservar la solución estéril a 4 °C. | |
| Kcl | 0,387 g/L | 74.55 | ||||
| CaCl2 | 0,244 g/L | 110.99 | ||||
| MgCl 2 6H2 O | 0,0406 g/L | 203.3 | ||||
| NaHCO3 | 0,504 g/L | 84.1 | ||||
| HEPES | 1,19 g/L | 238.3 | ||||
| Glucosa | 0,504 g/L | 180.16 | ||||
| Agua | ||||||
Tabla 1: Composición de los diferentes buffers utilizados en el protocolo.
Discusión
El tratamiento de las enfermedades cerebrales sigue siendo un desafío teniendo en cuenta la dificultad de los fármacos para superar la barrera hematoencefálica para alcanzar sus objetivos celulares y moleculares en el parénquima cerebral.
El desarrollo de fármacos para enfermedades cerebrales actualmente exhibe una baja tasa de éxito ya que la mayoría de los medicamentos que muestran resultados prometedores en modelos preclínicos no mostraron ningún beneficio cuando se usan en la clínica. Siguiendo la "regla de las 3R", que tiene como objetivo reducir el número de animales utilizados para la experimentación, se desarrollan modelos in vitro de la BBB para estudiar patologías cerebrales y predecir la penetración cerebral de drogas29. Los modelos in vitro de BBB se han desarrollado principalmente utilizando células animales y se han vuelto más sofisticados para mejorar la relevancia de los resultados obtenidos16. Uno de los avances significativos en el uso de células humanas, que aporta una nueva visión innegable y más especificidad, a nivel celular y molecular, para estudiar los mecanismos de la enfermedad humana16. Sin embargo, el desarrollo de modelos relevantes requiere considerar la mejora de la configuración del modelo in vitro de BBB y el conocimiento que surge, gracias a los modelos animales. Por lo tanto, es necesario considerar la complejidad de la arquitectura BBB y la importancia de las comunicaciones célula-célula para estudiar la BBB en condiciones fisiológicas y patológicas30.
El protocolo presentado aquí describe un método para establecer un modelo completo de BBB en vivo humano que comprende los tres tipos principales de células de la BBB, sin limitación de acceso al tejido cerebral. Como sistema celular múltiple, la inducción y el mantenimiento de las propiedades de la BHE, sin el uso artificial de compuestos tensores, sino inducidos por las comunicaciones célula-célula es fisiológicamente más relevante y en línea con la inducción in vivo de las propiedades de la BHE31. Por lo tanto, el respeto de la cronología del protocolo es primordial de importancia para el éxito del protocolo. Además, los tiempos de incubación durante el ajuste del triple cultivo y una vez que se ensamblan los tres tipos de células representan los principales pasos críticos del protocolo.
Las propiedades de BBB en CE son inducidas por el cocultivo con pericitos, como se describe para el modelo de cocultivo24. Por lo tanto, el cultivo de pericitos en el reverso del filtro de inserción es el punto más crítico y requiere seguir estrictamente el protocolo a riesgo de no tener suficientes pericitos para la inducción de las propiedades de BBB. En primer lugar, durante el procedimiento de recubrimiento y también la siembra celular, se debe tener cuidado de no tener la cubierta de la placa de Petri en contacto con el recubrimiento y también el medio una vez que las células están sembradas para garantizar un buen recubrimiento del filtro y no perder células (pasos 2.2.1 y 2.2.4). Además, una vez sembrados los pericitos, es esencial esperar el tiempo indicado para la unión de los pericitos (paso 2.2.4) antes de revertir el filtro de inserción para el recubrimiento y siembra de CE en el otro lado (pasos 2.2.5 y 2.3). Una vez sembrado, se requieren seis días para inducir las propiedades de la barrera hematoencefálica a través de las comunicaciones célula-célula (paso 2.4).
El modelo se valida en términos de permeabilidad restringida (asociada al ajuste de las uniones estrechas) ya que las CE del modelo de triple cultivo muestran valores de permeabilidad a los marcadores de integridad BBB similares al modelo de cocultivo validado y también medidos en modelos animales o humanos validados 16,27,32. Además, la validación de un modelo de BBB in vitro requiere, además de la permeabilidad restringida, la capacidad de respuesta a otros tipos celulares de la NVU y la expresión de receptores y transportadores funcionales16. Además, el modelo es reproducible y produce múltiples filtros de inserción y pocillos para realizar numerosos análisis (expresión génica y proteica, tinción fluorescente, pruebas de toxicidad) en cada tipo de célula por separado sin requerir un método de clasificación celular.
El modelo se desarrolló utilizando un filtro de tamaño de poro de 0,4 μm para tener un tipo de celda a cada lado del filtro de inserto. El sistema de filtro de inserción permitió el estudio de las comunicaciones célula-célula en condiciones fisiológicas transfiriéndolo sobre astrocitos que contenían bien. La presencia de astrocitos en el sistema representa un valor positivo en comparación con el modelo inicial de cocultivo in vitro 24. De hecho, teniendo en cuenta la importancia de los astrocitos en la fisiología de la BHE, este tercer tipo de célula permite una mayor comprensión de las comunicaciones célula-célula dentro de la BHE. Además, el sistema de cultivo celular triple también puede ser estudiado en condiciones patológicas como el accidente cerebrovascular, en el que los astrocitos juegan un papel esencial33,34,35. Además, el diseño de BLECs/pericitos en ambos lados del filtro de inserción se puede colocar fácilmente sobre otros tipos de células para imitar condiciones patológicas como el cáncer cerebral23.
El tamaño de poro del filtro de inserción puede traer limitaciones con algunos experimentos, como la transmigración celular a través de la barrera hematoencefálica. Sin embargo, el desarrollo del modelo con un tamaño de poro mayor requiere la adaptación del protocolo para asegurar la formación de una monocapa fisiológica de EC y no de múltiples capas, lo cual no es fisiológicamente relevante para imitar la BBB36.
La aplicabilidad del modelo se ha demostrado utilizando el experimento de transporte NG que muestra la posibilidad de realizar un experimento de transporte utilizando un sistema multicelular. Sin embargo, uno debe ser consciente de las dificultades de tener un compuesto de control o molécula para el experimento de transporte, compartiendo propiedades comparables con NG ya que cada nanoestructura exhibe un conjunto único de propiedades (peso molecular, carga, forma, propiedades físicas, formación de corona de proteínas).
Una limitación del modelo es la ausencia de esfuerzo cortante, que se demostró que influye en la diferenciación de las CE y en la expresión de proteínas TJ37. Sin embargo, desarrollar un sistema fluídico que imite el capilar cerebral es un desafío considerando la complejidad de agregar una parte fluídica, que requiere un dispositivo específico, en un sistema de múltiples células. Además, el dispositivo en particular generalmente no está disponible comercialmente y no permite muchas réplicas, lo que hace que los sistemas fluídicos estén menos adaptados para el uso de alto rendimiento.
En resumen, este sistema de triple cultivo formado por células humanas reproduce in vitro la arquitectura de la BBB. Permite la generación de muchos insertos que se pueden utilizar para el cribado extensivo de compuestos.
Divulgaciones
Los autores declaran que no tienen ningún conflicto de intereses.
Agradecimientos
Este trabajo es otorgado por el programa de investigación e innovación Horizonte 2020 de la Unión Europea bajo el acuerdo de subvención No 764958, como parte del proyecto NANOSTEM, una Red de Formación Innovadora Marie Skłodowska-Curie (ITN) (Beca Eleonora Rizzi). Este estudio es concedido por el «Conseil régional du Nord-Pas-de-Calais» (Beca de Clémence Deligne), la "Société Française de lutte contre les Cancers et les leucémies de l'Enfant et de l'adolescent" (SFCE), la Association "l'étoile de Martin" y la Association "Cassandra contre la leucémie".
Materiales
| Name | Company | Catalog Number | Comments |
| Cell Culture | |||
| Astocyte Medium (AM) | ScienCell | 1801 | |
| Astrocyte Growth Supplement | ScienCell | 1852 | Astrocyte Growth Supplement is provided in the AM set. |
| Cell culture dish 100 mm | Corning | 430293 | 100 mm x 20 mm; dish used for the thawing of ECs and PCs before the triculture setting |
| Cell culture dish 150 mm | Corning | 430599 | The height of these dishes (25 mm) allows the seeding of PCs in the reverted insert for the setting of the triculture model. |
| Collagen I | Corning | 354236 | Rat tail |
| Dulbecco's Modified Eagle Medium | Gibco | 31600-083 | Powder |
| Endothelial Cell Growth Supplement | ScienCell | 1051 | Endothelial Cell Growth Supplement is provided in the ECM set. |
| Endothelial Cell Medium (ECM) | ScienCell | 1001 | |
| Fetal Calf Serum | Sigma | F7524 | |
| Gelatin | Sigma | G2500 | 2% gelatin from porcine skin in PBS-CMF |
| Gentamicin | BiochromA6 | A-2712 | |
| Glucose | Sigma | G6152 | Powder |
| Glutamine | Merck | 1002891000 | |
| Human Brain Cortex Astrocytes | ScienCell | 1800-SC | |
| Malassez cell counting chamber | vWR | HECH40453702 | The count was performed manually. |
| Matrigel | Corning | 354230 | Extracellular matrix-based hydrogel |
| Penicillin/Streptomycin | ScienCell | 0503 | Penicillin/Streptomycin solution is provided in the ECM and AM sets. |
| Poly-L-lysine | ScienCell | 0413 | |
| Steritop | Millipore System | SCGPT0SRE | 0.22 µm pore size |
| Transwell insert | Corning | 3401 | 0.4 µm pore polycarbonate filter |
| Trypsin/EDTA neutralization solution | ScienCell | 0113 | |
| Trypsin/EDTA solution | ScienCell | 0103 | |
| Immunocytochemistry | |||
| SEA BLOCK blocking buffer | ThermoScientific | 37527 | |
| Alexa Fluor 568 anti-Mouse secondary antibody | Thermofisher | A11031 | Dilution 1:500 |
| Alexa Fluor 568 anti-Rabbit secondary antibody | Thermofisher | A11036 | Dilution 1:500 |
| Anti-Claudin-5 primary antibody | InVitrogen | 34-1600 | Dilution 1:100 |
| Anti-Desmin primary antibody | Abcam | ab6322 | Dilution 1:200 |
| Anti-Glial Fibrillary Acidic Protein primary antibody | Dako | Z0334 | Dilution 1:500 |
| Anti-Platelet-Derived Growth Factor-β primary antibody | Abcam | ab51090 | Dilution 1:200 |
| Anti-VE-cadherin primary antibody | Abcam | ab207732 | Dilution 1:200 |
| Anti-Zona Occludens-1 primary antibody | InVitrogen | 61-7300 | Dilution 1:200 |
| Normal Goat Serum | Sigma | G6767 | |
| ProLong Diamond Antifade Mountant with DAPI | Invitrogen | P36962 | |
| Gene expression | |||
| NucleoSpin Rna/Protein Macherey Nagel Kit | Macherey-Nagel | 740,933,250 | |
| 96 multiplate well | Biorad | HSP9601 | |
| iSCRIPT | Biorad | 1708841 | |
| Sealer sheet | Biorad | MSB1001 | |
| SsoFast EvaGreen Supermix | Biorad | 172-5201 | |
| Protein expression | |||
| 2x Laemli Sample Buffer | Biorad | 161-0737 | Add 50 µL of bMercaptoetanol to 950 µL of Laemmli Buffer and store at -20°C. Dilute 1:1 with the protein sample for the assay. |
| Anti-Breast Cancer Resistance Protein primary antibody | Abcam | ab207732 | Pre-treatment 15 minutes at RT under agitation; dilution 1:1000, O.N. at 4°C |
| Anti-Claudin-5 primary antibody | Abcam | ab15106 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Glucose Transporter 1 primary antibody | Millipore | 07-1401 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Mouse secondary antibody | Dako | P0447 | Dilution 1:5000 in TBS-Tween |
| Anti-P-glycoprotein primary antibody | Genetex | GTX23364 | Pre-treatment 15 minutes at RT under agitation; dilution 1:400, 3 hours at RT |
| Anti-Rabbit secondary antibody | Dako | P0448 | Dilution 1:8000 in TBS-Tween |
| Anti-Transferrin Receptor primary antibody | Abcam | ab84036 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Zona occludens-1 primary antibody | Abcam | ab216880 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Criterion TGX Gel | Biorad | 5678083 | |
| ECL Prime Solution | Amersham | RPN2236 | Revelation solution to keep in the dark |
| Phospatase inhibitor cocktail 2 | Sigma | P5726 | |
| Phospatase inhibitor cocktail 3 | Sigma | P0044 | |
| Protease Inhibitor | Sigma | P8340 | |
| Protein Standards | Biorad | 161-0373 | Molecular weight markers |
| RIPA 10x | Millipore | 20-188 | |
| TBS 10x | Biorad | 1706435 | |
| TRIS-Glycine | Biorad | 1610771 | |
| Tween | Biorad | 1706531 | |
| BBB integrity assay | |||
| Sodium Fluorescein | Ampresco | 0681 | λex= 490 nm; λem= 525 nm |
| Elacridar | Sigma | SML0486 | GF120918 |
| FITC-Dextran 20 kDa | Sigma | FD-20S | λex= 490 nm; λem= 525 nm |
| Rhodamine 123 | Sigma | R8004 | λex= 501 nm; λem= 538 nm |
| SynergyTM H1 | BioTek Instruments | Fluorescent multiplate reader | |
| Nanogel Transport | |||
| Syringe | Terumo | SS+01T1 | 1 mL syringe |
| Filter | FisherScientific | 15161499 | 0.2 µm PTFE membrane filter, 15 mm diameter |
| N-Isopropylacrylamide (NIPAM)-based hydrogels | The nanogels (NGs) used in the study are provided by our collaborator in Queen Mary University London, Department of Chemistry. The NGs are covalently tagged with a fluorescent molecule (λex= 477 nm; λem= 540 nm). NGs are freeze dried and shipped as powder, in this state they are stable at room temperature for long period of time. |
Referencias
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37, 13-25 (2010).
- Profaci, C. P., Munji, R. N., Pulido, R. S., Daneman, R. The blood-brain barrier in health and disease: Important unanswered questions. The Journal of Experimental Medicine. 217 (4), 20190062 (2020).
- Abbott, N. J. Blood-brain barrier structure and function and the challenges for CNS drug delivery. Journal of Inherited Metabolic Disease. 36 (3), 437-449 (2013).
- Kreuter, J. Drug delivery to the central nervous system by polymeric nanoparticles: What do we know. Advanced Drug Delivery Reviews. 71, 2-14 (2014).
- Zhang, W., Mehta, A., Tong, Z., Esser, L. . L.Advanced science. 8 (10), 2003937 (2021).
- Vashist, A., et al. Nanogels as potential drug nanocarriers for CNS drug delivery. Drug Discovery Today. 23 (7), 1436-1443 (2018).
- Lombardo, S. M., Schneider, M., Türeli, A. E., Günday Türeli, N. Key for crossing the BBB with nanoparticles: The rational design. Beilstein Journal of Nanotechnology. 11, 866-883 (2020).
- Bernardo-Castro, S., et al. Therapeutic nanoparticles for the different phases of ischemic stroke. Life. 11 (6), 482 (2021).
- Salinas, Y., Castilla, A. M., Resmini, M. An L-proline based thermoresponsive and pH-switchable nanogel as a drug delivery vehicle. Polymer Chemistry. 9 (17), 2271-2280 (2018).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353 (2019).
- Preman, N. K., Jain, S., Johnson, R. P. ”Smart” polymer nanogels as pharmaceutical carriers: A versatile platform for programmed delivery and diagnostics. ACS Omega. 6 (8), 5075-5090 (2021).
- Cuggino, J. C., Blanco, E. R. O., Gugliotta, L. M., Alvarez Igarzabal, C. I., Calderón, M. Crossing biological barriers with nanogels to improve drug delivery performance. Journal of Controlled Release Official Journal of the Controlled Release Society. 307, 221-246 (2019).
- Basso, J., et al. Hydrogel-based drug delivery nanosystems for the treatment of brain tumors. Gels. 4 (3), 62 (2018).
- Harilal, S., et al. Revisiting the blood-brain barrier: A hard nut to crack in the transportation of drug molecules. Brain Research Bulletin. 160, 121-140 (2020).
- Papadimitriou, S. A., Robin, M. P., Ceric, D., O'Reilly, R. K., Marino, S., Resmini, M. Fluorescent polymeric nanovehicles for neural stem cell modulation. Nanoscale. 8 (39), 17340-17349 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Cecchelli, R., et al. Modelling of the blood-brain barrier in drug discovery and development. Nature Reviews Drug Discovery. 6 (8), 650-661 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. An overview of in vitro techniques for blood-brain barrier studies. Methods in Molecular Medicine. 89, 307-324 (2003).
- Shimizu, F., et al. Peripheral nerve pericytes modify the blood-nerve barrier function and tight junctional molecules through the secretion of various soluble factors. Journal of Cellular Physiology. 226 (1), 255-266 (2011).
- Pedroso, D. C., et al. Improved survival, vascular differentiation and wound healing potential of stem cells co-cultured with endothelial cells. PLoS One. 6 (1), 16114 (2011).
- Kanda, T., Iwasaki, T., Yamawaki, M., Ikeda, K. Isolation and culture of bovine endothelial cells of endoneurial origin. Journal of Neuroscience Research. 49 (6), 769-777 (1997).
- Data sheet on human astrocytes culture. Technical resources from ScienCell Available from: https://www.sciencellonline.com/human-astrocytes.html#product_tabs_technicalresources (2021)
- Deligne, C., et al. Development of a human in vitro blood-brain tumor barrier model of diffuse intrinsic pontine glioma to better understand the chemoresistance. Fluids and Barriers of the CNS. 17 (1), 37 (2020).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), 99733 (2014).
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-Brain Barrier: From physiology to disease and back. Physiological Reviews. 99 (1), 21-78 (2019).
- Daneman, R., Prat, A. The Blood-Brain Barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), 020412 (2015).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability studies on in vitro blood-brain barrier models: Physiology, pathology, and pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Heymans, M., Figueiredo, R., Dehouck, L., Francisco, D., Sano, Y., Shimizu, F., Kanda, T., Bruggmann, R., Engelhardt, B., Winter, P., Gosselet, F., Maxime, C. Contribution of brain pericytes in blood-brain barrier formation and maintenance: A transcriptomic study of co-cultured human endothelial cells derived from hematopoietic stem cells. Fluids Barriers CNS. 17, 48 (2020).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Neuhaus, W. In Vitro Models of the Blood-Brain Barrier. Handbook of Experimental Pharmacology. 265, 75-110 (2021).
- Hoheisel, D., Nitz, T., Franke, H., Wegener, J., Hakvoort, A., Tilling, T., Galla, H. J. Hydrocortisone reinforces the blood-brain properties in a serum free cell culture system. Biochemical and Biophysical Research Communications. 247 (2), 312-315 (1998).
- Drolez, A., et al. Selection of a relevant in vitro blood-brain barrier model to investigate pro-metastatic features of human breast cancer cell lines. PloS One. 11 (3), 0151155 (2016).
- Neuhaus, W., Gaiser, F., Mahringer, A., Franz, J., Riethmüller, C., Förster, C. The pivotal role of astrocytes in an in vitro stroke model of the blood-brain barrier. Frontiers in Cellular Neuroscience. 8, 352 (2014).
- Mysiorek, C., et al. Peroxisome proliferator-activated receptor-α activation protects brain capillary endothelial cells from oxygen-glucose deprivation-induced hyperpermeability in the blood-brain barrier. Current Neurovascular Research. 6 (3), 181-193 (2009).
- Culot, M., et al. Cerebrovascular protection as a possible mechanism for the protective effects of NXY-059 in preclinical models: An in vitro study. Brain Research. 1294, 144-152 (2009).
- Vandenhaute, E., Drolez, A., Sevin, E., Gosselet, F., Mysiorek, C., Dehouck, M. -. P. Adapting co-culture in vitro models of the blood-brain barrier for use in cancer research: Maintaining an appropriate endothelial monolayer for the assessment of transendothelial migration. Laboratory Investigation. 96 (5), 588-598 (2016).
- Cucullo, L., Hossain, M., Puvenna, V., Marchi, N., Janigro, D. The role of shear stress in Blood-Brain Barrier endothelial physiology. BMC Neuroscience. 12, 40 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados