Method Article
Ein Dreifachkulturzellsystem, das die menschliche Blut-Hirn-Schranke modelliert
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine Methode zur Etablierung eines menschlichen Blut-Hirn-Schranken-Modells (BBB). Die Endothelzellen und Perizyten werden auf jeder Seite eines Einsatzfilters (Blutkompartiment) ausgesät, und Astrozyten werden in der unteren Vertiefung (Gehirnkompartiment) ausgesät. Das charakterisierte Modell wurde für Nanopartikeltransportexperimente verwendet.
Zusammenfassung
Die Abgabe von Medikamenten an das Gehirn bleibt aufgrund der hochspezifischen und restriktiven Eigenschaften der Blut-Hirn-Schranke (BBB), die den Zugang zum Hirnparenchym kontrolliert und einschränkt, eine Herausforderung. Mit der Entwicklung von Nanotechnologien wurden jedoch große Panels neuer Nanomaterialien entwickelt, um die Arzneimittelabgabe zu verbessern, was die Notwendigkeit zuverlässiger In-vitro-Mikrosysteme zur Vorhersage der Hirnpenetration im Rahmen präklinischer Assays unterstreicht. Hier ist eine einfache Methode, um ein mikrophysiologisches System einzurichten, um die BHS ausschließlich mit menschlichen Zellen zu modellieren. In seiner Konfiguration besteht das Modell aus einer Dreifachkultur, die hirnähnliche Endothelzellen (BLECs), Perizyten und Astrozyten umfasst, die drei wichtigsten zellulären BBB-Akteure, die notwendig sind, um die BBB-Eigenschaften auf physiologischere Weise zu induzieren und zu regulieren, ohne dass Verbindungen angezogen werden müssen. Das in einem 12-Well-Plattenformat entwickelte Modell, das nach 6 Tagen Dreifachkultur fertig ist, wird in physikalischen Eigenschaften, Gen- und Proteinexpressionen charakterisiert und für die polymere Nanogel-Transportmessung verwendet. Das Modell kann für eine Vielzahl von Experimenten unter gesunden und pathologischen Bedingungen verwendet werden und stellt ein wertvolles Werkzeug für präklinische Bewertungen des Molekül- und Partikeltransports sowie des inter- und intrazellulären Transports dar.
Einleitung
Die BBB, lokalisiert auf der Ebene der Hirnkapillarendothelzellen (ECs), kontrolliert und reguliert den Zugang zum Hirnparenchym, das für die Aufrechterhaltung der Gehirnhomöostase und die Funktion von Nervenzellen entscheidend ist 1,2. Im Falle der Hirnpathologie stellt der fehlende Zugang zum Hirnparenchym jedoch ein echtes Hindernis für die Entwicklung therapeutischer Strategien dar.
Die BBB-ECs besitzen eine komplexe Reihe von Eigenschaften, einschließlich Tight Junction (TJ) -Proteinen, die den Interzellularraum abdichten, verbunden mit einem System von Effluxpumpen, spezifischen Transportern und Rezeptoren, die den transzellulären Weg 1,2,3 steuern. Darüber hinaus werden alle diese Eigenschaften induziert und aufrechterhalten, dank der Kommunikation mit den Perizyten, die in die BBB-EC-Basalmembran eingebettet sind, und den Astrozyten, deren Endfüße die Hirnkapillaren umgeben 1,2,3. Daher ist die Untersuchung der BHS in vitro angesichts der Komplexität ihrer Architektur und der Kommunikation zwischen den verschiedenen Zelltypen, die die neurovaskuläre Einheit (NVU)2 bilden, eine Herausforderung. Darüber hinaus sind die verschiedenen Zelltypen entscheidend für die Induktion und Aufrechterhaltung der BBB-Eigenschaften und beeinflussen folglich die Vorhersage der Kreuzung durch die BHS. Verschiedene Strategien für die Medikamentenabgabe an das Gehirn wurden bereits mit einem großen Panel von Taktiken getestet, um die BBB-eingeschränkten Eigenschaften zu umgehen4. In jüngerer Zeit, mit dem Fortschritt der Nanotechnologien, werden neue Materialien für Anwendungen als Wirkstoffträger entwickelt 5,6. Zusätzlich zu ihrer höheren Belastung, reduzierten Toxizität und erhöhter Bioverfügbarkeit von Medikamenten können diese neuen Nanomaterialien für eine Trojanische Pferdestrategie funktionalisiert werden, um die BHS zu durchqueren und spezifisch auf Zellen im Parenchym 5,6 zu zielen. Unter den verschiedenen Arten von Nanomaterialien, die bewertet werden, haben Nanogele beträchtliche Aufmerksamkeit erregt, hauptsächlich aufgrund ihrer kolloidalen Eigenschaften und der Fähigkeit, die chemische Struktur anzupassen, um stimuli-responsive Eigenschaften einzuführen 7,8,9,10,11,12,13,14,15.
In-vitro-Modelle werden nun für präklinische Studien mit menschlichen Zellen entwickelt, um die Hirnpenetration von Medikamenten vorherzusagen16. Verschiedene Einstellungen dieser Modelle sind verfügbar, von Monoschichten von Gehirn-ECs bis hin zu mehreren Zellsystemen16. In Anbetracht der Bedeutung der NVU-Zellen für die BBB-Induktion und -Aufrechterhaltung und der koordinierten Reaktion auf die pathologische Umgebung müssen BBB-In-vitro-Modelle all diese Protagonisten berücksichtigen, um die Relevanz der Vorhersage zu verbessern 2,17.
Die aktuelle Methode beschreibt den Aufbau eines Dreifachkultur-In-vitro-Modells der menschlichen BHS, das vollständig mit menschlichen Zellen entwickelt ist, um spezifische zelluläre und menschliche molekulare Mechanismen zu untersuchen. Um physiologisch relevant zu sein, besteht das Modell aus den drei wichtigsten zellulären Akteuren der BHS (ECs, Perizyten und Astrozyten), die notwendig sind, um die BBB-Eigenschaften zu induzieren und aufrechtzuerhalten, ohne die Verwendung von Straffungsverbindungen und eine Reihe von Eigenschaften aufzuzeigen, die erforderlich sind, um als In-vitro-BBB-Modell 16,18 betrachtet zu werden. Das Modell ist in einer Konfiguration aufgebaut, die das Blut- und Gehirnkompartiment begrenzt und für präklinische Studien des Arzneimittel- und Partikeltransports geeignet ist, um die Hirnpenetration vorherzusagen. Die Nützlichkeit des Modells wird durch die Messung des Transports von polymeren Nanogelen veranschaulicht.
Protokoll
Das Protokoll wurde vom französischen Ministerium für Hochschulbildung und Forschung (Referenz: CODECOH DC2011-1321) und vom lokalen Prüfungsausschuss (Béthune Maternity Hospital, Beuvry, Frankreich) genehmigt. Für die Gewinnung der Endothelzellen (ECs) wurde die schriftliche und informierte Zustimmung der Eltern des Spenders zur Entnahme von Nabelschnurblut in Übereinstimmung mit der französischen Gesetzgebung eingeholt. Die Perizyten werden von Professor Takashi Kanda (Department of Neurology and Clinical Neuroscience, Yamaguchi University Graduate School of Medicine, Ube, Japan) zur Verfügung gestellt, die gemäß Referenz19 isoliert wurden. Primäre menschliche Hirnkortex-Astrozyten werden von einem kommerziellen Anbieter gekauft (siehe Materialtabelle).
1. Zellkultur
- Kultivierung von Endothelzellen
HINWEIS: Endothelzellen (ECs) stammen aus CD34+ hämatopoetischen Stammzellen, die aus menschlichem Nabelschnurblut nach der von Pedroso et al.20 beschriebenen Methode isoliert wurden. Der endotheliale Phänotyp der ECs ist in Pedroso et al.20 beschrieben.- Kultivieren Sie menschliche ECs mit Endothelzellmedium, ergänzt mit 5% fetalem Kälberserum (FCS), 0,5% Gentamicin und 1% Endothelzellwachstumsergänzung (ECM) (siehe Materialtabelle).
- Für die Subkultivierung von ECs beschichten Sie zwei Tage vor dem Setzen des Modells eine Schale mit 10 ml 2% Gelatine für 15 min bei 37 °C und ersetzen Sie sie dann durch 20 ml warme ECM. Eine Durchstechflasche mit ECs mit 1 Million Zellen (die Zellen wurden vor dem Einfrieren der Zellen manuell gezählt, wie in Schritt 2.3.3 beschrieben) in der vorbeschichteten Zellkulturschale auftauen.
- Nach 3 h bei 37 °C erneuern Sie das Medium und halten Sie die Zellen bis zum Absetzen der Trikultur in einer befeuchteten Atmosphäre in einem Inkubator bei 37 °C unter 5% CO2 und 21%O2.
- Kultivierung von Perizyten
ANMERKUNG: Die Perizyten werden aus dem menschlichen Gehirn gemäß dem von Shimizu et al.19 veröffentlichten Protokoll isoliert, dessen Isolierungsverfahren der von Kanda et al.21 veröffentlichten Methode mit Modifikationen folgt.- Kultivieren Sie die Perizyten mit dem modifizierten Eagle-Medium von Dulbecco, ergänzt mit 4,5 g / L Glukose (DMEM HG), 10% FCS, 1% de Penicillin / Streptomycin und 1% L-Glutamin (siehe Materialtabelle).
- Für die Perizyten-Subkultur, fünf Tage vor dem Setzen des Modells, beschichten Sie zwei Schalen mit 8 ml / Schale von 100 μg / ml Kollagen Typ I Lösung in 0,02 N Essigsäure für 1 h bei Raumtemperatur (RT) und waschen Sie dann zweimal mit RT DMEM HG. Eine Durchstechflasche mit Perizyten mit 1 Million Zellen in einem konischen Röhrchen mit 10 ml warmem Medium auftauen und die Suspension 5 min bei 190 x g bei 20 °C zentrifugieren.
- Resuspendieren Sie das Pellet in 10 ml warmem Medium und saaten Sie in den vorbeschichteten Zellkulturschalen, die mit 15 ml warmem Medium/Schale vorgefüllt sind. Das Medium wird nach 3 Tagen erneuert und die Zellen werden bis zum Absetzen der Trikultur in einem befeuchteten Inkubator bei 37 °C unter 5% CO2 und 21%O2 gehalten.
- Kultivierung von Astrozyten
- Kultivieren Sie die Astrozyten mit einem Astrozytenmedium, das mit 20% FCS, 1% Astrozytenwachstumsergänzung und 1% Penicillin / Streptomycin-Lösung (AM) ergänzt wird (siehe Materialtabelle).
- Zur Subkulturierung der Astrozyten wird eine Woche vor dem Setzen des Modells ein T75-Zellkulturkolben mit 10 ml 2 μg/cm2 Poly-L-Lysin (PLL) für 1 h bei 37 °C beschichtet und zweimal mit sterilem RT-Wasser gewaschen. Eine Durchstechflasche mit Astrozyten mit 1 Million Zellen in 20 ml warmem Medium auftauen und im vorbeschichteten T75-Zellkulturkolben aussäen.
HINWEIS: Die kommerziell erhältlichen Zellfläschchen bestätigen das Vorhandensein von ~1 Million Zellen, so dass die Zählung der Zellen hier nicht durchgeführt wurde. - Die Zellen werden in einem befeuchteten Inkubator bei 37 °C unter 5% CO2 und 21%O2 gehalten. Das Medium wird nach 24 h und dann alle 2 Tage bis zum Setzen der Trikultur erneuert.
2. Dreifache Kulturmodelleinstellung
HINWEIS: Die Montage der drei Zelltypen erfolgt am selben Tag. Führen Sie am Tag vor dem Setzen der Trikultur die Kollagen-Typ-I-Beschichtung auf den umgekehrten Einsatzfiltern durch (siehe Materialtabelle) und säen Sie die Astrozyten in die PLL-vorbeschichteten Vertiefungen einer 12-Well-Platte.
- Aussaat von Astrozyten in den Vertiefungen
- Beschichten Sie die Vertiefungen mit 500 μL 2 μg/cm 2 PLL-Lösung wie in Schritt 1.3.2 beschrieben.
- Die Zellen werden einmal mit 10 ml warmer Phosphatpuffer-Kochsalzlösung - calcium- und magnesiumfrei 1X (1X PBS-CMF) (Tabelle 1) gewaschen, bevor sie 3 min bei 37 °C mit 10 ml warmer 20%iger Trypsin/EDTA (T/E)-Lösung inkubieren und die Zellen mechanisch aus dem Kolben lösen. Die Suspension wird in ein konisches Röhrchen mit 5 ml warmem, unverdünntem FCS überführt.
HINWEIS: Gemäß dem Protokoll22 des Anbieters kann die Sammlung von Astrozyten optimiert werden, indem der Kolben für 1 Minute in den Inkubator gestellt und der Kolben angeklopft wird, um die Ablösung zu vervollständigen. Die verbleibenden Zellen sollten mit 5 ml T/E-Neutralisationslösung gesammelt und in das FCS-haltige konische Röhrchen gegeben werden. - Die Suspension 5 min bei 20 °C bei 190 x g zentrifugieren.
- Resuspendieren Sie das Zellpellet in 5 ml warmem AM. Zählen Sie die Zellen, indem Sie 20 μL der Zellsuspension in 80 μL 1X PBS-CMF mit einer manuellen Zählkammer unter einem Mikroskop verdünnen (siehe Materialtabelle). Plate ca. 40.000 Zellen/cm2 in jeder PLL-vorbeschichteten Vertiefung in einem Volumen von 1,5 ml warmem AM.
- Aussaat von Perizyten auf den revertierten Einsatzfiltern
- 250 μL Kollagen Typ I Lösung (100 μg/ml) auf die umgedrehten Einsatzfilter geben, die am Rand einer abgedeckten 25 mm hohen Schale (siehe Materialtabelle) mit einer sterilen Pinzette platziert werden. Lassen Sie die Beschichtung 1 h bei RT unter sterilen Bedingungen stehen.
HINWEIS: Die verwendete Schale muss hoch genug sein, um die Aufrechterhaltung der Sterilität außerhalb der Haube zu gewährleisten und den Kontakt zwischen den Lösungen auf dem umgedrehten Filter und dem Deckel der Schale zu vermeiden. - Entfernen Sie die Kollagenlösung Typ I vorsichtig mit einer Glaspipette, die an ein Ansaugsystem angeschlossen ist. Zweimal mit 250 μL RT DMEM HG waschen und dann vorsichtig die gesamte Lösung aus den Einsatzfiltern entfernen. Lassen Sie die beschichteten Einsatzfilter unter sterilen Bedingungen bis zur Aussaat der Zellen bei RT.
HINWEIS: Achten Sie während des Beschichtungsvorgangs darauf, den Filter nicht zu berühren, um Membranschäden zu vermeiden. Einmal mit Kollagen Typ I beschichtet, können die Einsatzfilter über Nacht bei RT gelagert werden. - Am Tag der Trikultur-Einstellung die Perizyten zweimal mit 10 ml warmem 1X PBS-CMF waschen und die Zellen mit 2 ml warmem Trypsin inkubieren. Überwachen Sie die Wirkung des Trypsins, indem Sie die Zellen unter dem Mikroskop beobachten. Sobald sich die Zellen zu lösen beginnen, entfernen Sie das Trypsin und fügen Sie 5 ml warme ECM vor der mechanischen Dissoziation hinzu.
- Zählen Sie die Zellen, indem Sie 20 μL der Zellsuspension in 80 μL 1X PBS-CMF unter Verwendung einer manuellen Zählkammer unter einem Mikroskop verdünnen und 44.500 Zellen/cm2 auf die vorbeschichteten revertierten Einsatzfilter in einem Volumen von 250 μL säen. Halten Sie die Einsatzfilter in einem befeuchteten Inkubator bei 37 °C für 3 h unter 5% CO2 und 21%O2.
- Wenden Sie die Einsatzfilter vorsichtig mit einer sterilen Pinzette in einer 12-Well-Platte mit 1,5 ml warmem ECM / Well um. Die Einsatzfilter können nun auf der anderen Seite beschichtet werden.
- 250 μL Kollagen Typ I Lösung (100 μg/ml) auf die umgedrehten Einsatzfilter geben, die am Rand einer abgedeckten 25 mm hohen Schale (siehe Materialtabelle) mit einer sterilen Pinzette platziert werden. Lassen Sie die Beschichtung 1 h bei RT unter sterilen Bedingungen stehen.
- Aussaat von Endothelzellen auf den Einlegefiltern
- Beschichten Sie die Oberseite der Einsatzfilter mit 500 μL Hydrogel auf Basis der extrazellulären Matrix (1/48 v/v) (siehe Materialtabelle). Nach 1 h in einem befeuchteten Inkubator bei 37 °C unter 5% CO2 und 21%O2 einmal mit 500 μL RT DMEM HG waschen.
- Einmal mit 10 ml warmem 1X PBS-CMF waschen und die Zellen mit 2 mL warmem Trypsin inkubieren. Sobald sich die Zellen zu lösen beginnen, entfernen Sie das Trypsin und fügen Sie 5 ml warme ECM vor der mechanischen Dissoziation hinzu.
- Zählen Sie die Zellen, indem Sie 20 μL der Zellsuspension in 80 μL 1X PBS-CMF unter Verwendung einer manuellen Zählkammer unter dem Mikroskop verdünnen und die ECs mit einer Dichte von 71.500 Zellen/cm2 auf den vorbeschichteten Einsatzfiltern in einem Volumen von 500 μL warmer ECM aussäen.
- Ersetzen Sie AM durch 1,5 ml warme ECM / Vertiefung und übertragen Sie dann die ausgesäten Einsatzfilter (ECs + Perizyten) auf die Vertiefungen, die die Astrozyten enthalten.
- Platzieren Sie die Trikulturzellensysteme in einem befeuchteten Inkubator bei 37 °C unter 5% CO2 und 21%O2.
- Pflege der Dreifachzellkultur zur Induktion der BBB-Eigenschaften
HINWEIS: Für die Induktion der BBB-Eigenschaften in den ECs sind 6 Tage Dreifachkultur notwendig.- Erneuern Sie das Medium jeden zweiten Tag bis zum 6. Tag, und entfernen Sie das Medium vorsichtig aus dem oberen und unteren Fach mit einer Glaspipette, die mit einem Aspirationssystem verbunden ist.
- Schnell durch warmes ECM in einem Volumen von 500 μL im oberen Fach und 1,5 ml im unteren Fach ersetzen und die Zellen in einen befeuchteten Inkubator bei 37 °C unter 5% CO2 und 21%O2 zurücklegen.
3. Validierung des BBB-Phänotyps
HINWEIS: Nach 6 Tagen Dreifachkultur, der Zeit, die benötigt wird, um den BBB-Phänotyp in den ECs zu induzieren, ist das menschliche BBB-Modell bereit für Experimente. Die physikalische Integrität der hirnähnlichen Endothelzellen (BLECs) wird durch Immunfluoreszenzfärbung von TJ-Proteinen visualisiert, die mit einem Permeabilitätstest für BBB-Integritätsmarker bewertet wurden. Die BBB-Phänotypvalidierung umfasst auch die Gen-/Proteinexpressionsanalyse und die Effluxpumpenfunktionalität gemäß dem in Deligne et al.,23 beschriebenen Verfahren. Perizyten und Astrozyten werden durch entsprechende Färbemarker nach dem in Deligne et al. beschriebenen Verfahren visualisiert. 202023.
- Immunfluoreszenzfärbung
- Die Einsatzfilter und Astrozyten in eiskaltem Methanol/Aceton (50/50 V/V) für 1 min fixieren und zweimal mit RT 1X PBS-CMF waschen.
- Trennen Sie den Filter vorsichtig vom Einsatz, indem Sie die Membran mit einem Skalpell schneiden. Führen Sie Immunzytochemie an den Membran- und Bodenmulden gemäß Deligne et al.23 durch.
HINWEIS: Verwenden Sie für den Blockierungsschritt 250 μL SEA BLOCK Blocking Buffer (siehe Materialtabelle) für 30 Minuten bei RT.
- BBB-Integritätstest
- Beurteilung der physikalischen Integrität der BLECs durch einen Permeabilitätstest unter Verwendung von BBB-Integritätsmarkern mit unterschiedlichen Molekulargewichten wie Natriumfluorescein (NaF) und 20 kDa Dextran (FD20) (siehe Materialtabelle).
HINWEIS: Das Experiment kann nach dem in Deligne et al.23 beschriebenen Verfahren durchgeführt werden.
- Beurteilung der physikalischen Integrität der BLECs durch einen Permeabilitätstest unter Verwendung von BBB-Integritätsmarkern mit unterschiedlichen Molekulargewichten wie Natriumfluorescein (NaF) und 20 kDa Dextran (FD20) (siehe Materialtabelle).
- Efflux-Pumpen-Funktionalität
- Beurteilung der Funktionalität von P-Glykoprotein (P-gp) und Brustkrebsresistenzprotein (BCRP) durch Messung der intrazellulären Akkumulation von Rhodamin 123 (R123) mit und ohne Elacridar, einem P-gp- und BCRP-Inhibitor (siehe Materialtabelle).
HINWEIS: Das Experiment kann nach dem in Deligne et al.23 beschriebenen Verfahren durchgeführt werden.
- Beurteilung der Funktionalität von P-Glykoprotein (P-gp) und Brustkrebsresistenzprotein (BCRP) durch Messung der intrazellulären Akkumulation von Rhodamin 123 (R123) mit und ohne Elacridar, einem P-gp- und BCRP-Inhibitor (siehe Materialtabelle).
- Gen- und Proteinexpressionen
- Führen Sie die Entnahme von Gen- und Proteinproben auf Eis nach einer schnellen Wäsche mit kaltem Ringer HEPES (RH) (Tabelle 1) der Zellen durch. Vor der Entnahme der EC-Probe die Perizyten aus den invertierten Einsatzfilternabkratzen 20.
4. Nanogel-Transport
HINWEIS: Um den Durchgang von polymeren Nanogelen (NGs) vom luminalen zum abluminalen Kompartiment des Trikultur-BLEC-Modells abzuschätzen, wurden 0,1 mg/ml NG-Lösung an Tag 6 für 24 h in das luminale Kompartiment gegeben. Die untersuchten NGs waren fluoreszierend markierte N-Isopropylacrylamid (NIPAM)-basierte Hydrogele mit einer durchschnittlichen Größe von 8-10 nm (siehe Materialtabelle).
- Wiegen Sie das Nanogelpulver und lösen Sie es in ECM in einer Konzentration von 1 mg / ml. Die Lösung 10 min lang beschallen und mit einem 0,2 μm PTFE-Filter filtrieren.
HINWEIS: Bereiten Sie am Tag des Experiments eine frische NG-Lösung vor. - Wechseln Sie das Medium im luminalen Kompartiment und fügen Sie 50 μL NGs-Lösung in das obere Kompartiment für eine Endkonzentration von 0,1 mg/ml hinzu.
HINWEIS: Führen Sie eine Verdünnung von 1:10 von der ursprünglichen Lösung durch. - Nach 24 Stunden Inkubation Aliquots aus luminalen (20 μL) und abluminalen (200 μL) Kompartimenten sammeln und in eine schwarze 96-Well-Platte legen.
- Quantifizieren Sie die Fluoreszenz mit einem fluoreszierenden Multiplattenleser (siehe Materialtabelle) mit einer schwarzen 96-Well-Platte unter Einstellung der Anregungs-/Emissionswellenlängen bei 477/540 nm. Berechnen Sie den Prozentsatz der Kreuzung bezogen auf die ursprüngliche Arbeitslösung, die zum Zeitpunkt hinzugefügt wurde = 0 h (t0)6,15.
HINWEIS: Um die 96-Well-Platte für die Fluoreszenzmessung vorzubereiten, fügen Sie 200 μL Lösung aus dem abluminalen Kompartiment und 20 μL Lösung aus dem luminalen Kompartiment und t0-Präparation hinzu (fügen Sie 180 μL ECM hinzu, um ein Endvolumen von 200 μL zu erreichen). Fügen Sie auch eine Kalibrierkurve und einen Rohling zur Leseplatte hinzu. Instrumentelle Parameter: Detektionsmethode - Fluoreszenz, optische Position - oben, Lesetyp - Endpunkt, Anregungswellenlänge - 477 nm, Emissionswellenlänge - 540 nm, Empfindlichkeit - 100, Schütteln - Doppelorbital für 5 s.
Ergebnisse
Einstellung des menschlichen Triple-Kultur-BBB-Modells
Das für die Einstellung des humanen BBB-In-vitro-Modells erforderliche Protokoll ist in Abbildung 1 beschrieben und umfasst aufeinanderfolgende Schritte, deren Reihenfolge strikt eingehalten werden muss. Zunächst werden die drei Zelltypen einzeln in Zellkulturschalen kultiviert (Abbildung 1A), bevor sie in einem Einsatzfiltersystem zusammengebaut werden. Die Dreifachkultureinstellung beginnt mit der Aussaat des ersten Zelltyps, der Astrozyten, in der vorbeschichteten Bodenmulde. Am nächsten Tag werden Perizyten und ECs auf die vorbeschichteten abluminalen bzw. luminalen Oberflächen des Einsatzfilters ausgesät. Der Einsatzfilter wird dann über die Astrozyten übertragen. Das Modell wird 6 Tage lang in Kultur gehalten, die Zeit, die erforderlich ist, um die BBB-Eigenschaften in ECs zu induzieren, mit einer Erneuerung des Mediums jeden zweiten Tag gemäß dem patentierten Kokulturmodell24. Die ECs werden dann in BLECs umbenannt (Abbildung 1B).
Charakterisierung des humanen BBB-Modells
Das Dreifachzellkulturmodell wurde für das Vorhandensein einer Reihe von BBB-spezifischen Eigenschaften charakterisiert. Zunächst bestätigten immunzytochemische Daten die Expression herkömmlicher Marker wie Thrombozyten-abgeleiteter Wachstumsfaktorrezeptor β (PDGFR-β)25,26 und Desmin für Perizyten und Gliafibrillensäureprotein (GFAP)26 für Astrozyten (Abbildung 2A). Daher zeigt die Monoschicht von BLECs, visualisiert mit der adhärenten Verbindungsfärbung von VE-Cadherin, nach den 6 Tagen Kultur mit den Perizyten und Astrozyten eine kontinuierliche Lokalisation der TJ-Proteine, Claudin-5 und ZO-1, an den Zellgrenzen (Abbildung 2A). Der Aufbau der TJs korreliert mit niedrigen parazellulären Permeabilitätskoeffizienten, die unter Verwendung von BBB-Integritätsmarkern mit niedrigem Molekulargewicht, d. h. NaF (376 Da)16,27, und hohem Molekulargewicht, d. h. FD20 (20 kDa)27, gemessen wurden, wie in Abbildung 2B gezeigt. Die gemessenen Werte sind vergleichbar mit validierten BBB-In-vitro-Modellen unter Verwendung der genauen Quelle von ECs23,24,28. Insgesamt unterstreichen diese Ergebnisse die geringe parazelluläre Permeabilität der BLEC-Monoschicht der Dreifachkultur, die für die in vivo BBB charakteristisch ist. Darüber hinaus zeigte die intrazelluläre Akkumulation von R123 in BLECs einen signifikanten Anstieg der Anwesenheit des Effluxpumpeninhibitors Elacridar 23,24 im Vergleich zum Kontrollzustand mit dessen Abwesenheit (Abbildung 2C). Dies deutet auf das Vorhandensein aktiver Ausflusspumpmoleküle, nämlich P-gp und BCRP, in den BLECs hin.
Um die BLECs weiter zu charakterisieren, wurden die Genexpression und der Proteingehalt der wichtigsten BBB-Merkmale untersucht (Abbildung 3). Die mit dem Triple-Kultur-Modell erhaltenen Daten wurden mit dem validierten und patentierten Kokulturmodell bestehend aus ECs und Perizyten24 verglichen, das als Kontrollmodell verwendet wurde. Die Astrozyten stellen den dritten Zelltyp dar, der im ursprünglichen Kokulturmodell im Triple-Kulturmodell hinzugefügt wurde. Daher zeigte die Genexpressionsanalyse (Abbildung 3A) von Dreifachkultur-BLECs im Vergleich zu Kokultur-BLECs die Aufrechterhaltung der Expression von Schlüssel-BBB-Merkmalen wie TJ-Proteinen (Claudin-5 und Zonola occludens-1) und Effluxpumpen (P-gp und BCRP) sowie die Hochregulierung der am meisten untersuchten BBB-Transporter (Glukosetransporter 1) und Rezeptoren (Transferrinrezeptor). Die Proteinquantifizierungsdaten (Abbildung 3B) stimmten mit den Transkriptionsergebnissen überein. Insgesamt unterstützen diese Daten die positive Induktion von BBB-Eigenschaften in der BLEC-Schicht der Dreifachkultur, ähnlich dem validierten Kokulturmodell. Insgesamt zeigt das Triple-Kultur-Modell die erforderlichen physikalischen und metabolischen Eigenschaften für ein in vitro mikrophysiologisches System zur Modellierung der BHS.
Anwendbarkeit auf Drug Delivery Strategien - Messung des Nanogeltransports
Um die Möglichkeit der Verwendung des Triple-Kultur-Modells zur Untersuchung neuer Gehirnlieferstrategien zu bewerten, wurde der Transport von fluoreszenzmarkierten NIPAM-basierten neutralen NGs bewertet 6,15. Zum Zeitpunkt 0 wurden NGs in einer Konzentration von 0,1 mg/ml in das luminale Kompartiment gegeben (Abbildung 4A). Nach 24 Stunden Inkubation wurden 5,82% der NGs im abluminalen Kompartiment gefunden (Abbildung 4B), was ihre Fähigkeit beweist, die BLECs zu kreuzen.
Die Ergebnisse zeigen die Eignung des Modells, um die Permeabilität von kleinen und größeren Verbindungen, wie mit den Integritätsmarkern beschrieben, zu messen und den Transport von Nanomaterialien wie polymeren NGs zu bewerten.
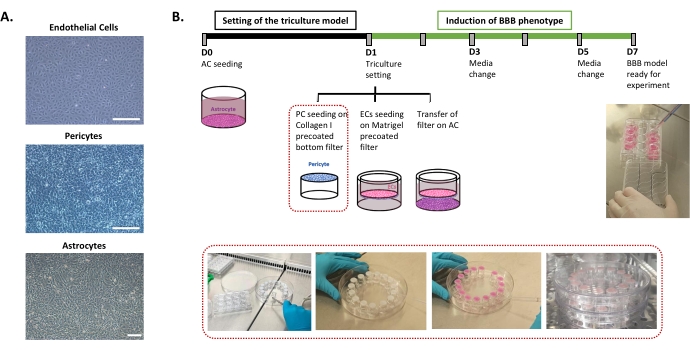
Abbildung 1: Darstellung kritischer Schritte für die Einstellung des Dreifachkultur-In-vitro-Modells der menschlichen BHS. (A) Phasenkontrastbilder der drei Zellkomponenten des BBB-Modells: Endothelzellen (EC), Perizyten (PC) und Astrozyten (AC). Maßstabsbalken = 250 μm. (B) Schematische und illustrative Zeitleiste für die Einstellung des humanen BBB-In-vitro-Modells der Dreifachkultur. Das hervorgehobene Feld stellt das Beschichtungsverfahren für den invertierten Einsatzfilter dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
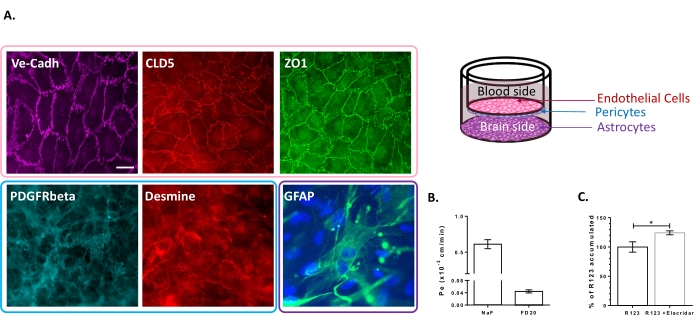
Abbildung 2: Bewertung der Eigenschaften des Triple-Kultur-BBB-Modells. (A) Repräsentative immunfärbende Bilder der charakteristischen Marker für BLECs (Claudin-5: CLD5, Zona Occludens-1: ZO1 und VE-Cadherin: Ve-Cadh), Perizyten (Platelet-Derived Growth Factor Receptor-β: PDGFR-β und Desmin) und Astrozyten (Glial Fibrillary Acidic Protein: GFAP). Maßstabsbalken = 10 μm. (B) Parazelluläre Permeabilität von BLECs für fluoreszierende BBB-Integritätsmarker, Natriumfluorescein (NaF, 376 Da, Pe: 0,61 ± 0,062) und FITC-Dextran (FD20, 20 kDa, Pe: 0,04 ± 0,005). N = 3; n = 9. Mittelwert ± REM. (C) Die P-gp- und BCRP-Funktionalität in ECs wurde durch Quantifizierung von intrazellulärem R123 mit (124,2% ± 3,39%) und ohne (100% ± 8,79%) Elacridar bewertet. N = 4; n = 12. Mittelwert ± SEM. p = 0,017 unter Verwendung eines ungepaarten t-Tests. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
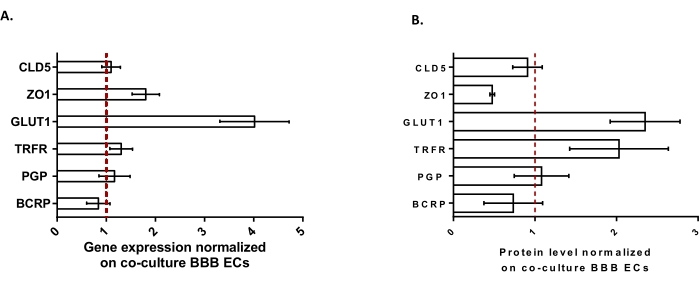
Abbildung 3: Bewertung der BLEC-Genexpression und des Proteingehalts von markanten Markern im Triple-Kultur-Modell im Vergleich zum Kokultur-BBB-Modell. (A) Genexpression von Tight-Junction-Proteinen (Claudin-5: CLD5 und Zona Occludens-1: ZO1), Transportern (Glucose Transporter-1: GLUT1, P-Glykoprotein: PGP und Brustkrebsresistenzprotein: BCRP) und großen Molekülrezeptoren (Transferrin-Rezeptor: TRFR), normalisiert durch die Expression von RPLP0. N = 3; n = 9. (B) Proteingehalt von Tight-Junction-Proteinen (CLD5 und ZO1), Transportern (GLUT1, PGP und BCRP) und großen Molekülrezeptoren (TRFR), normalisiert durch die Expression von β-Aktin. N = 3; n = 9. Mean ± SEM. Für (A) und (B) entsprechen die Werte>1 höheren Genexpressions- oder Proteinspiegeln im Triple-Kulturmodell. Die rote Linie entspricht einem Wert von 1, wobei das Expressionsniveau (Gene oder Proteine) der beiden Modelle äquivalent ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
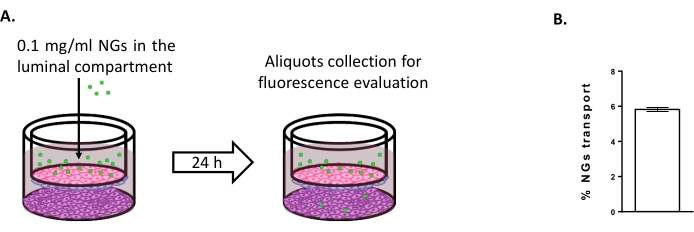
Abbildung 4: Messung des Nanogeltransports im Triple-Kulturmodell. (A) Schematische Darstellung des Nanogel-Transportassays. (B) Prozentsatz des Nanogeltransports nach 24 Stunden Inkubation im Triple-Kultur-Modell (5,82% ± 0,09%). N = 2; n = 6. Mean ± SEM. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Name des Puffers | Zusammensetzung | Anmerkung | ||||
| Molekulargewicht | ||||||
| Phosphatpuffer-Kochsalzlösung, Calcium-Magnesium-frei | PBS-CMF | NaCl | 8 g/L | 58.4 | Fügen Sie die gesamte Verbindung zu sterilem Wasser hinzu und warten Sie auf die vollständige Solubilisierung. Der pH-Wert der erhaltenen Lösung muss im Bereich von 7,3-7,4 liegen. Filtrieren Sie die Lösung mit einer 0,22 μm Membran und lagern Sie die sterile Lösung bei 4 °C. | |
| Kcl | 0,2 g/L | 74.55 | ||||
| KH2PO4 | 0,2 g/L | 136.09 | ||||
| NaHPO4-12 H2O | 2,87 g/L | 358.14 | ||||
| Wasser | ||||||
| Ringer HEPES | RH | NaCl | 8,8 g/L | 58.4 | Fügen Sie die gesamte Verbindung zu sterilem Wasser hinzu und warten Sie auf die vollständige Solublisierung. Stellen Sie den pH-Wert auf 7,4 ein (Ausgangslösungs-pH-Wert etwa 6,8). Filtrieren Sie die Lösung mit einer 0,22 μm Membran und lagern Sie die sterile Lösung bei 4 °C. | |
| Kcl | 0,387 g/L | 74.55 | ||||
| CaCl2 | 0,244 g/L | 110.99 | ||||
| MgCl26H2O | 0,0406 g/L | 203.3 | ||||
| NaHCO3 | 0,504 g/L | 84.1 | ||||
| HEPES | 1,19 g/L | 238.3 | ||||
| Traubenzucker | 0,504 g/L | 180.16 | ||||
| Wasser | ||||||
Tabelle 1: Zusammensetzung der verschiedenen im Protokoll verwendeten Puffer.
Diskussion
Die Behandlung von Hirnerkrankungen bleibt eine Herausforderung, wenn man bedenkt, wie schwierig es ist, die BHS zu überwinden, um ihre zellulären und molekularen Ziele im Hirnparenchym zu erreichen.
Die Medikamentenentwicklung für Hirnerkrankungen weist derzeit eine geringe Erfolgsrate auf, da die meisten Medikamente mit vielversprechenden Ergebnissen in präklinischen Modellen keinen Nutzen zeigten, wenn sie in der Klinik eingesetzt wurden. Nach der "3R-Regel", die darauf abzielt, die Anzahl der für Experimente verwendeten Tiere zu reduzieren, werden In-vitro-Modelle der BBB entwickelt, um Hirnpathologien zu untersuchen und die Hirnpenetration von Medikamenten vorherzusagen29. In-vitro-Modelle von BBB wurden hauptsächlich unter Verwendung tierischer Zellen entwickelt und sind ausgefeilter geworden, um die Relevanz der erzielten Ergebnisse zu verbessern16. Einer der bedeutenden Fortschritte bei der Verwendung menschlicher Zellen, der unbestreitbare neue Erkenntnisse und mehr Spezifität auf zellulärer und molekularer Ebene zur Untersuchung menschlicher Krankheitsmechanismen bringt16. Die Entwicklung relevanter Modelle erfordert jedoch die Berücksichtigung der Verbesserung der BBB-In-vitro-Modelleinstellungen und des Wissens, das dank Tiermodellen entsteht. Daher muss die Komplexität der BBB-Architektur und die Bedeutung der Zell-Zell-Kommunikation berücksichtigt werden, um die BHS unter physiologischen und pathologischen Bedingungen zu untersuchen30.
Das hier vorgestellte Protokoll beschreibt eine Methode zum Aufbau eines vollständigen menschlichen BBB-In-vitro-Modells , das die drei Hauptzelltypen der BHS umfasst, ohne den Zugang zum Hirngewebe einzuschränken. Als Mehrzellsystem ist die Induktion und Aufrechterhaltung der BBB-Eigenschaften ohne den künstlichen Einsatz von Straffungsverbindungen, sondern durch Zell-Zell-Kommunikation induziert physiologisch relevanter und steht im Einklang mit der in vivo Induktion der BBB-Eigenschaften31. Daher ist die Einhaltung der Chronologie des Protokolls von größter Bedeutung für den Erfolg des Protokolls. Darüber hinaus stellen die Inkubationszeiten während der Einstellung der Dreifachkultur und nach dem Zusammenbau der drei Zelltypen die wichtigsten kritischen Schritte des Protokolls dar.
Die BBB-Eigenschaften in ECs werden durch die Kokultur mit Perizyten induziert, wie für das Kokulturmodell24 beschrieben. Daher ist die Kultur der Perizyten auf der Rückseite des Einsatzfilters der kritischste Punkt und erfordert die strikte Einhaltung des Protokolls auf die Gefahr, nicht genügend Perizyten für die Induktion der BBB-Eigenschaften zu haben. Zunächst muss bei der Beschichtung und auch bei der Zellaussaat darauf geachtet werden, dass die Abdeckung der Petrischale nicht mit der Beschichtung und auch das Medium nach der Aussaat der Zellen in Kontakt kommt, um eine gute Beschichtung des Filters zu gewährleisten und keine Zellen zu verlieren (Schritte 2.2.1 und 2.2.4). Darüber hinaus ist es nach der Aussaat der Perizyten wichtig, die angegebene Zeit für die Anheftung der Perizyten abzuwarten (Schritt 2.2.4), bevor der Einsatzfilter für die Beschichtung und Aussaat von ECs auf der anderen Seite zurückgesetzt wird (Schritte 2.2.5 und 2.3). Nach der Aussaat werden sechs Tage benötigt, um die BBB-Eigenschaften durch Zell-Zell-Kommunikation zu induzieren (Schritt 2.4).
Das Modell wird in Bezug auf die eingeschränkte Permeabilität (im Zusammenhang mit der Einstellung der Tight Junctions) validiert, da die ECs des Dreifachkulturmodells Permeabilitätswerte für BBB-Integritätsmarker ähnlich dem validierten Kokulturmodell aufweisen und auch in validierten Tier- oder Humanmodellengemessen werden 16,27,32. Darüber hinaus erfordert die Validierung eines in vitro BBB-Modells neben der eingeschränkten Permeabilität die Reaktionsfähigkeit auf andere Zelltypen der NVU und die Expression funktioneller Rezeptoren und Transporter16. Darüber hinaus ist das Modell reproduzierbar und erzeugt mehrere Einlegefilter und Vertiefungen, um zahlreiche Analysen (Gen- und Proteinexpression, Fluoreszenzfärbung, Toxizitätstests) an jedem Zelltyp separat durchzuführen, ohne dass eine Zellsortiermethode erforderlich ist.
Das Modell wurde unter Verwendung eines 0,4 μm Porengrößenfilters entwickelt, um einen Zelltyp auf jeder Seite des Einsatzfilters zu haben. Das Insert-Filtersystem ermöglichte die Untersuchung der Zell-Zell-Kommunikation unter physiologischen Bedingungen, indem es auf gut enthaltende Astrozyten übertragen wurde. Das Vorhandensein von Astrozyten im System stellt einen Pluswert im Vergleich zum ursprünglichen Kokultur-In-vitro-Modell 24 dar. In Anbetracht der Bedeutung von Astrozyten für die Physiologie der BHS ermöglicht dieser dritte Zelltyp ein weiteres Verständnis der Zell-Zell-Kommunikation innerhalb der BHS. Darüber hinaus kann das Dreifachzellkultursystem auch bei pathologischen Zuständen wie Schlaganfall untersucht werden, bei denen die Astrozyten eine wesentliche Rolle spielen33,34,35. Darüber hinaus kann das Design von BLECs / Perizyten auf beiden Seiten des Einsatzfilters leicht auf andere Zelltypen gelegt werden, um pathologische Zustände wie Hirntumor nachzuahmen23.
Die Porengröße des Einsatzfilters kann bei einigen Experimenten, wie z. B. der Zelltransmigration über die BHS, Einschränkungen mit sich bringen. Die Entwicklung des Modells mit einer größeren Porengröße erfordert jedoch die Anpassung des Protokolls, um die Bildung einer physiologischen Monoschicht von ECs und nicht mehrerer Schichten sicherzustellen, was physiologisch nicht relevant ist, um die BBB36 nachzuahmen.
Die Anwendbarkeit des Modells wurde anhand von NGs Transportexperiment demonstriert, das die Möglichkeit zeigt, Transportexperimente mit einem mehrzelligen System durchzuführen. Dennoch sollte man sich der Schwierigkeiten bewusst sein, eine Kontrollverbindung oder ein Kontrollmolekül für das Transportexperiment zu haben, das vergleichbare Eigenschaften mit NGs aufweist, da jede Nanostruktur eine einzigartige Reihe von Eigenschaften aufweist (Molekulargewicht, Ladung, Form, physikalische Eigenschaften, Proteinkoronabildung).
Eine Einschränkung des Modells ist das Fehlen von Scherspannungen, die nachweislich die Differenzierung von ECs und die Expression von TJ-Proteinen beeinflusst37. Die Entwicklung eines fluidischen Systems, das die Gehirnkapillare nachahmt, ist jedoch eine Herausforderung, wenn man bedenkt, wie komplex es ist, einen fluidischen Teil hinzuzufügen, der ein bestimmtes Gerät in einem Mehrzellensystem erfordert. Darüber hinaus ist das jeweilige Gerät in der Regel nicht kommerziell erhältlich und erlaubt nicht viele Replikate, wodurch fluidische Systeme weniger für den Einsatz mit hohem Durchsatz geeignet sind.
Zusammenfassend lässt sich sagen, dass dieses aus menschlichen Zellen bestehende Dreifachkultursystem in vitro die Architektur der BHS reproduziert. Es ermöglicht die Erzeugung vieler Inserts, die für das umfangreiche Screening von Compounds verwendet werden können.
Offenlegungen
Die Autoren erklären, dass sie keinen Interessenkonflikt haben.
Danksagungen
Diese Arbeit wird vom Forschungs- und Innovationsprogramm Horizon 2020 der Europäischen Union im Rahmen der Finanzhilfevereinbarung Nr. 764958 im Rahmen des NANOSTEM Projekts, einem Marie Skłodowska-Curie Innovative Training Network (ITN) (Fellowship Eleonora Rizzi), gewährt. Diese Studie wird vom "Conseil régional du Nord-Pas-de-Calais" (Stipendium für Clémence Deligne), der "Société Française de lutte contre les Cancers et les leucémies de l'Enfant et de l'adolescent" (SFCE), der Association "l'étoile de Martin" und der Association "Cassandra contre la leucémie" gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| Cell Culture | |||
| Astocyte Medium (AM) | ScienCell | 1801 | |
| Astrocyte Growth Supplement | ScienCell | 1852 | Astrocyte Growth Supplement is provided in the AM set. |
| Cell culture dish 100 mm | Corning | 430293 | 100 mm x 20 mm; dish used for the thawing of ECs and PCs before the triculture setting |
| Cell culture dish 150 mm | Corning | 430599 | The height of these dishes (25 mm) allows the seeding of PCs in the reverted insert for the setting of the triculture model. |
| Collagen I | Corning | 354236 | Rat tail |
| Dulbecco's Modified Eagle Medium | Gibco | 31600-083 | Powder |
| Endothelial Cell Growth Supplement | ScienCell | 1051 | Endothelial Cell Growth Supplement is provided in the ECM set. |
| Endothelial Cell Medium (ECM) | ScienCell | 1001 | |
| Fetal Calf Serum | Sigma | F7524 | |
| Gelatin | Sigma | G2500 | 2% gelatin from porcine skin in PBS-CMF |
| Gentamicin | BiochromA6 | A-2712 | |
| Glucose | Sigma | G6152 | Powder |
| Glutamine | Merck | 1002891000 | |
| Human Brain Cortex Astrocytes | ScienCell | 1800-SC | |
| Malassez cell counting chamber | vWR | HECH40453702 | The count was performed manually. |
| Matrigel | Corning | 354230 | Extracellular matrix-based hydrogel |
| Penicillin/Streptomycin | ScienCell | 0503 | Penicillin/Streptomycin solution is provided in the ECM and AM sets. |
| Poly-L-lysine | ScienCell | 0413 | |
| Steritop | Millipore System | SCGPT0SRE | 0.22 µm pore size |
| Transwell insert | Corning | 3401 | 0.4 µm pore polycarbonate filter |
| Trypsin/EDTA neutralization solution | ScienCell | 0113 | |
| Trypsin/EDTA solution | ScienCell | 0103 | |
| Immunocytochemistry | |||
| SEA BLOCK blocking buffer | ThermoScientific | 37527 | |
| Alexa Fluor 568 anti-Mouse secondary antibody | Thermofisher | A11031 | Dilution 1:500 |
| Alexa Fluor 568 anti-Rabbit secondary antibody | Thermofisher | A11036 | Dilution 1:500 |
| Anti-Claudin-5 primary antibody | InVitrogen | 34-1600 | Dilution 1:100 |
| Anti-Desmin primary antibody | Abcam | ab6322 | Dilution 1:200 |
| Anti-Glial Fibrillary Acidic Protein primary antibody | Dako | Z0334 | Dilution 1:500 |
| Anti-Platelet-Derived Growth Factor-β primary antibody | Abcam | ab51090 | Dilution 1:200 |
| Anti-VE-cadherin primary antibody | Abcam | ab207732 | Dilution 1:200 |
| Anti-Zona Occludens-1 primary antibody | InVitrogen | 61-7300 | Dilution 1:200 |
| Normal Goat Serum | Sigma | G6767 | |
| ProLong Diamond Antifade Mountant with DAPI | Invitrogen | P36962 | |
| Gene expression | |||
| NucleoSpin Rna/Protein Macherey Nagel Kit | Macherey-Nagel | 740,933,250 | |
| 96 multiplate well | Biorad | HSP9601 | |
| iSCRIPT | Biorad | 1708841 | |
| Sealer sheet | Biorad | MSB1001 | |
| SsoFast EvaGreen Supermix | Biorad | 172-5201 | |
| Protein expression | |||
| 2x Laemli Sample Buffer | Biorad | 161-0737 | Add 50 µL of bMercaptoetanol to 950 µL of Laemmli Buffer and store at -20°C. Dilute 1:1 with the protein sample for the assay. |
| Anti-Breast Cancer Resistance Protein primary antibody | Abcam | ab207732 | Pre-treatment 15 minutes at RT under agitation; dilution 1:1000, O.N. at 4°C |
| Anti-Claudin-5 primary antibody | Abcam | ab15106 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Glucose Transporter 1 primary antibody | Millipore | 07-1401 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Mouse secondary antibody | Dako | P0447 | Dilution 1:5000 in TBS-Tween |
| Anti-P-glycoprotein primary antibody | Genetex | GTX23364 | Pre-treatment 15 minutes at RT under agitation; dilution 1:400, 3 hours at RT |
| Anti-Rabbit secondary antibody | Dako | P0448 | Dilution 1:8000 in TBS-Tween |
| Anti-Transferrin Receptor primary antibody | Abcam | ab84036 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Zona occludens-1 primary antibody | Abcam | ab216880 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Criterion TGX Gel | Biorad | 5678083 | |
| ECL Prime Solution | Amersham | RPN2236 | Revelation solution to keep in the dark |
| Phospatase inhibitor cocktail 2 | Sigma | P5726 | |
| Phospatase inhibitor cocktail 3 | Sigma | P0044 | |
| Protease Inhibitor | Sigma | P8340 | |
| Protein Standards | Biorad | 161-0373 | Molecular weight markers |
| RIPA 10x | Millipore | 20-188 | |
| TBS 10x | Biorad | 1706435 | |
| TRIS-Glycine | Biorad | 1610771 | |
| Tween | Biorad | 1706531 | |
| BBB integrity assay | |||
| Sodium Fluorescein | Ampresco | 0681 | λex= 490 nm; λem= 525 nm |
| Elacridar | Sigma | SML0486 | GF120918 |
| FITC-Dextran 20 kDa | Sigma | FD-20S | λex= 490 nm; λem= 525 nm |
| Rhodamine 123 | Sigma | R8004 | λex= 501 nm; λem= 538 nm |
| SynergyTM H1 | BioTek Instruments | Fluorescent multiplate reader | |
| Nanogel Transport | |||
| Syringe | Terumo | SS+01T1 | 1 mL syringe |
| Filter | FisherScientific | 15161499 | 0.2 µm PTFE membrane filter, 15 mm diameter |
| N-Isopropylacrylamide (NIPAM)-based hydrogels | The nanogels (NGs) used in the study are provided by our collaborator in Queen Mary University London, Department of Chemistry. The NGs are covalently tagged with a fluorescent molecule (λex= 477 nm; λem= 540 nm). NGs are freeze dried and shipped as powder, in this state they are stable at room temperature for long period of time. |
Referenzen
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37, 13-25 (2010).
- Profaci, C. P., Munji, R. N., Pulido, R. S., Daneman, R. The blood-brain barrier in health and disease: Important unanswered questions. The Journal of Experimental Medicine. 217 (4), 20190062(2020).
- Abbott, N. J. Blood-brain barrier structure and function and the challenges for CNS drug delivery. Journal of Inherited Metabolic Disease. 36 (3), 437-449 (2013).
- Kreuter, J. Drug delivery to the central nervous system by polymeric nanoparticles: What do we know. Advanced Drug Delivery Reviews. 71, 2-14 (2014).
- Zhang, W., Mehta, A., Tong, Z., Esser, L. L.Advanced science. 8 (10), Weinheim, Baden-Wurttemberg, Germany. 2003937(2021).
- Vashist, A., et al. Nanogels as potential drug nanocarriers for CNS drug delivery. Drug Discovery Today. 23 (7), 1436-1443 (2018).
- Lombardo, S. M., Schneider, M., Türeli, A. E., Günday Türeli, N. Key for crossing the BBB with nanoparticles: The rational design. Beilstein Journal of Nanotechnology. 11, 866-883 (2020).
- Bernardo-Castro, S., et al. Therapeutic nanoparticles for the different phases of ischemic stroke. Life. 11 (6), Basel, Switzerland. 482(2021).
- Salinas, Y., Castilla, A. M., Resmini, M. An L-proline based thermoresponsive and pH-switchable nanogel as a drug delivery vehicle. Polymer Chemistry. 9 (17), 2271-2280 (2018).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353(2019).
- Preman, N. K., Jain, S., Johnson, R. P. ”Smart” polymer nanogels as pharmaceutical carriers: A versatile platform for programmed delivery and diagnostics. ACS Omega. 6 (8), 5075-5090 (2021).
- Cuggino, J. C., Blanco, E. R. O., Gugliotta, L. M., Alvarez Igarzabal, C. I., Calderón, M. Crossing biological barriers with nanogels to improve drug delivery performance. Journal of Controlled Release Official Journal of the Controlled Release Society. 307, 221-246 (2019).
- Basso, J., et al. Hydrogel-based drug delivery nanosystems for the treatment of brain tumors. Gels. 4 (3), Basel, Switzerland. 62(2018).
- Harilal, S., et al. Revisiting the blood-brain barrier: A hard nut to crack in the transportation of drug molecules. Brain Research Bulletin. 160, 121-140 (2020).
- Papadimitriou, S. A., Robin, M. P., Ceric, D., O'Reilly, R. K., Marino, S., Resmini, M. Fluorescent polymeric nanovehicles for neural stem cell modulation. Nanoscale. 8 (39), 17340-17349 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Cecchelli, R., et al. Modelling of the blood-brain barrier in drug discovery and development. Nature Reviews Drug Discovery. 6 (8), 650-661 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. An overview of in vitro techniques for blood-brain barrier studies. Methods in Molecular Medicine. 89, 307-324 (2003).
- Shimizu, F., et al. Peripheral nerve pericytes modify the blood-nerve barrier function and tight junctional molecules through the secretion of various soluble factors. Journal of Cellular Physiology. 226 (1), 255-266 (2011).
- Pedroso, D. C., et al. Improved survival, vascular differentiation and wound healing potential of stem cells co-cultured with endothelial cells. PLoS One. 6 (1), 16114(2011).
- Kanda, T., Iwasaki, T., Yamawaki, M., Ikeda, K. Isolation and culture of bovine endothelial cells of endoneurial origin. Journal of Neuroscience Research. 49 (6), 769-777 (1997).
- Data sheet on human astrocytes culture. Technical resources from ScienCell. , Available from: https://www.sciencellonline.com/human-astrocytes.html#product_tabs_technicalresources (2021).
- Deligne, C., et al. Development of a human in vitro blood-brain tumor barrier model of diffuse intrinsic pontine glioma to better understand the chemoresistance. Fluids and Barriers of the CNS. 17 (1), 37(2020).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), 99733(2014).
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-Brain Barrier: From physiology to disease and back. Physiological Reviews. 99 (1), 21-78 (2019).
- Daneman, R., Prat, A. The Blood-Brain Barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), 020412(2015).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability studies on in vitro blood-brain barrier models: Physiology, pathology, and pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Heymans, M., Figueiredo, R., Dehouck, L., Francisco, D., Sano, Y., Shimizu, F., Kanda, T., Bruggmann, R., Engelhardt, B., Winter, P., Gosselet, F., Maxime, C. Contribution of brain pericytes in blood-brain barrier formation and maintenance: A transcriptomic study of co-cultured human endothelial cells derived from hematopoietic stem cells. Fluids Barriers CNS. 17, 48(2020).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. , (1959).
- Neuhaus, W. In Vitro Models of the Blood-Brain Barrier. Handbook of Experimental Pharmacology. 265, 75-110 (2021).
- Hoheisel, D., Nitz, T., Franke, H., Wegener, J., Hakvoort, A., Tilling, T., Galla, H. J. Hydrocortisone reinforces the blood-brain properties in a serum free cell culture system. Biochemical and Biophysical Research Communications. 247 (2), 312-315 (1998).
- Drolez, A., et al. Selection of a relevant in vitro blood-brain barrier model to investigate pro-metastatic features of human breast cancer cell lines. PloS One. 11 (3), 0151155(2016).
- Neuhaus, W., Gaiser, F., Mahringer, A., Franz, J., Riethmüller, C., Förster, C. The pivotal role of astrocytes in an in vitro stroke model of the blood-brain barrier. Frontiers in Cellular Neuroscience. 8, 352(2014).
- Mysiorek, C., et al. Peroxisome proliferator-activated receptor-α activation protects brain capillary endothelial cells from oxygen-glucose deprivation-induced hyperpermeability in the blood-brain barrier. Current Neurovascular Research. 6 (3), 181-193 (2009).
- Culot, M., et al. Cerebrovascular protection as a possible mechanism for the protective effects of NXY-059 in preclinical models: An in vitro study. Brain Research. 1294, 144-152 (2009).
- Vandenhaute, E., Drolez, A., Sevin, E., Gosselet, F., Mysiorek, C., Dehouck, M. -P. Adapting co-culture in vitro models of the blood-brain barrier for use in cancer research: Maintaining an appropriate endothelial monolayer for the assessment of transendothelial migration. Laboratory Investigation. 96 (5), 588-598 (2016).
- Cucullo, L., Hossain, M., Puvenna, V., Marchi, N., Janigro, D. The role of shear stress in Blood-Brain Barrier endothelial physiology. BMC Neuroscience. 12, 40(2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten