Method Article
מערכת תאי תרבית משולשת המדגימה את מחסום הדם-מוח האנושי
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר שיטה להקמת מחסום דם-מוח אנושי (BBB) במודל מבחנה . תאי האנדותל והפריציטים נזרעים בכל צד של מסנן הכנסה (תא דם), ואסטרוציטים נזרעים בבאר התחתונה (תא המוח). המודל שאפיין שימש לניסויים בהובלת ננו-חלקיקים.
Abstract
אספקת תרופות למוח נותרה אתגר בשל התכונות הספציפיות והמגבילות של מחסום הדם-מוח (BBB), השולטות ומגבילות את הגישה לפרנכימה המוחית ומגבילות אותה. עם זאת, עם התפתחות הננו-טכנולוגיות, פותחו פאנלים גדולים של ננו-חומרים חדשים כדי לשפר את אספקת התרופות, מה שמדגיש את הצורך במיקרו-מערכות אמינות במבחנה כדי לחזות חדירה למוח במסגרת של מבחנים פרה-קליניים. הנה שיטה פשוטה להקמת מערכת מיקרופיזיולוגית שתדגים את ה-BBB תוך שימוש בתאים אנושיים בלבד. בתצורתו, המודל מורכב מתרבית משולשת הכוללת תאי אנדותל דמויי מוח (BLECs), פריסיטים ואסטרוציטים, שלושת השחקנים התאיים העיקריים של BBB הדרושים כדי לגרום ולווסת את תכונות ה-BBB באופן פיזיולוגי יותר ללא צורך בתרכובות מתהדקות. המודל שפותח בפורמט של 12 לוחות, מוכן לאחר 6 ימים של תרבית משולשת, מאופיין בתכונות פיזיקליות, ביטויי גנים וחלבונים ומשמש למדידת הובלת ננו-ג'ל פולימרי. המודל יכול לשמש למגוון רחב של ניסויים בתנאים בריאים ופתולוגיים ומייצג כלי רב ערך להערכות פרה-קליניות של הובלת מולקולות וחלקיקים, כמו גם לסחר בין-תאי ותוך-תאי.
Introduction
ה-BBB, הממוקם ברמה של תאי אנדותל נימיים במוח (ECs), שולט ומווסת את הגישה לפרנכימה של המוח, שהיא חיונית לשמירה על הומאוסטזיס במוח ועל תפקודם של תאים עצביים 1,2. עם זאת, במקרה של פתולוגיה במוח, חוסר גישה לפרנכימה המוח מייצג מכשול אמיתי לפיתוח אסטרטגיות טיפוליות.
ל-BBB ECs יש מערכת מורכבת של תכונות, כולל חלבוני צומת הדוקים (TJ), האוטמים את החלל הבין-תאי, הקשורים למערכת של משאבות efflux, טרנספורטרים ספציפיים וקולטנים, השולטים במסלול הטרנס-תאי 1,2,3. יתר על כן, כל התכונות הללו מושרות ומתוחזקות, הודות לתקשורת עם הפריסיטים המוטבעים בקרום המרתף BBB EC והאסטרוציטים, שרגליהם הסופיות מקיפות את נימי המוח 1,2,3. לפיכך, חקר ה-BBB במבחנה הוא אתגר בהתחשב במורכבות הארכיטקטורה שלו ובתקשורת בין סוגי התאים השונים המרכיבים את היחידה הנוירו-וסקולרית (NVU)2. יתר על כן, סוגי התאים השונים חיוניים לאינדוקציה ולתחזוקה של תכונות BBB וכתוצאה מכך משפיעים על חיזוי המעבר דרך ה- BBB. אסטרטגיות שונות להעברת תרופות למוח כבר נבדקו באמצעות פאנל גדול של טקטיקות כדי לעקוף את התכונות המוגבלות של BBB4. לאחרונה, עם התקדמות הננוטכנולוגיה, מפותחים חומרים חדשים ליישומים כנשאי תרופות 5,6. בנוסף לעומס הגבוה יותר שלהם, רעילות מופחתת וזמינות ביולוגית מוגברת של תרופות, ננו-חומרים חדשים אלה יכולים לתפקד עבור אסטרטגיית סוס טרויאני לחצות את ה-BBB ולתקוף באופן ספציפי תאים בפרנכימה 5,6. מבין הסוגים השונים של ננו-חומרים המוערכים, ננו-ג'לים משכו תשומת לב רבה, בעיקר בשל תכונותיהם הקולואידיות ויכולתם להתאים את המבנה הכימי כדי להציג תכונות מגיבות לגירויים 7,8,9,10,11,12,13,14,15.
מודלים במבחנה מפותחים כיום למחקרים פרה-קליניים המשתמשים בתאים אנושיים כדי לחזות חדירה מוחית של תרופות16. קיימות הגדרות שונות של מודלים אלה, החל ממונו-שכבות של ECs במוח ועד למערכות תאים מרובות16. בהתחשב בחשיבותם של תאי NVU באינדוקציה ובתחזוקה של BBB ובתגובה המתואמת לסביבה הפתולוגית, מודלים של BBB במבחנה צריכים לשקול את כל הגיבורים האלה כדי לשפר את הרלוונטיות של החיזוי 2,17.
השיטה הנוכחית מתארת הקמת תרבית משולשת במבחנה של ה-BBB האנושי, אשר מפותח במלואו עם תאים אנושיים כדי לחקור מנגנונים מולקולריים תאיים ואנושיים ספציפיים. כדי להיות רלוונטי מבחינה פיזיולוגית, המודל מורכב משלושת השחקנים התאיים העיקריים של ה- BBB (ECs, פריציטים ואסטרוציטים) הדרושים כדי לגרום ולתחזק את תכונות ה- BBB, ללא שימוש בתרכובות הידוק והצגת סט של תכונות הנדרשות להיחשב כמודל BBB במבחנה 16,18. המודל מוגדר בתצורה התוחמת את תא הדם והמוח, ומתאים למחקרים פרה-קליניים של הובלת תרופות וחלקיקים כדי לחזות חדירה למוח. התועלת של המודל מודגמת על ידי מדידת ההובלה של ננו-ג'לים פולימריים.
Protocol
הפרוטוקול אושר על ידי המשרד הצרפתי להשכלה גבוהה ומחקר (הפניה: CODECOH DC2011-1321) ועל ידי הוועדה המקומית לבדיקה חקירתית (בית החולים ליולדות Béthune, Beuvry, צרפת). לצורך קבלת תאי האנדותל (ECs), התקבלה הסכמה בכתב ובכוונה מהורי התורם לאיסוף דם טבורי, בהתאם לחקיקה הצרפתית. הפריסיטים מסופקים על ידי פרופסור טקאשי קנדה (המחלקה לנוירולוגיה ומדעי המוח הקליניים, בית הספר לרפואה של אוניברסיטת יאמאגוצ'י, אובה, יפן) שבודדו לפי הפניה19. אסטרוציטים ראשוניים של קליפת המוח האנושית נרכשים מספק מסחרי (ראו טבלת חומרים).
1. תרבית תאים
- התרבות של תאי אנדותל
הערה: תאי אנדותל (ECs) מופקים מתאי גזע המטופויאטיים CD34+ שבודדו מדם טבורי אנושי, על פי השיטה המתוארת על ידי Pedroso et al.20. הפנוטיפ האנדותל של ה- ECs מתואר ב- Pedroso et al.20.- לטפח ECs אנושיים באמצעות מדיום תאי אנדותל בתוספת 5% של סרום עגל עוברי (FCS), 0.5% של gentamicin, ו 1% של תוסף צמיחת תאי אנדותל (ECM) (ראה טבלת חומרים).
- עבור ECs תת-תרבותיים, יומיים לפני קביעת הדגם, מצפים מנה אחת עם 10 מ"ל של 2% ג'לטין במשך 15 דקות ב 37 מעלות צלזיוס ולאחר מכן להחליף אותו עם 20 מ"ל של ECM חם. הפשרה של בקבוקון אחד של ECs המכיל מיליון תאים (תאים נספרו ידנית כמתואר בשלב 2.3.3 לפני הקפאת תאים) בצלחת תרבית התאים המצופה מראש.
- לאחר 3 שעות ב-37 מעלות צלזיוס, חדשו את המדיום ושמרו על התאים עד לקביעת הטריקולטורה באטמוספירה לחה בתוך אינקובטור בטמפרטורה של 37 מעלות צלזיוס תחת 5% CO 2 ו-21% O2.
- גידול של פריציטים
הערה: הפריסיטים מבודדים מהמוח האנושי על פי הפרוטוקול שפורסם על ידי Shimizu et al.19, אשר הליך הבידוד שלהם עוקב אחר השיטה שפורסמה על ידי Kanda et al.21 עם שינויים.- טפחו את הפריסיטים באמצעות מדיום הנשר המעובד של דולבקו, בתוספת 4.5 גרם/ליטר גלוקוז (DMEM HG), 10% מ-FCS, 1% דה פניצילין/סטרפטומיצין ו-1% מ-L-גלוטמין (ראו טבלת חומרים).
- עבור תת-תרבות של פריציטים, חמישה ימים לפני קביעת הדגם, מצפים שתי מנות ב-8 מ"ל/מנה של 100 מיקרוגרם/מ"ל של תמיסת קולגן מסוג I ב-0.02 N חומצה אצטית למשך שעה אחת בטמפרטורת החדר (RT) ולאחר מכן שוטפים פעמיים עם RT DMEM HG. להפשיר בקבוקון אחד של פריסיטים המכיל 1 מיליון תאים בצינור חרוטי המכיל 10 מ"ל של בינוני חם צנטריפוגה את המתלה במשך 5 דקות ב 190 x גרם ב 20 מעלות צלזיוס.
- יש לתלות את הכדור ב-10 מ"ל של מדיום חם וזרעים במנות תרבית התאים המצופות מראש במילוי 15 מ"ל של מדיום/מנה חמים. המדיום מתחדש לאחר 3 ימים, והתאים נשמרים עד לקביעת הטריקולטורה באינקובטור לח בטמפרטורה של 37 מעלות צלזיוס תחת 5% CO 2 ו-21% O2.
- תרבות של אסטרוציטים
- טפחו את האסטרוציטים באמצעות מדיום אסטרוציטים בתוספת 20% של FCS, 1% של תוסף גידול אסטרוציטים ו-1% של תמיסת פניצילין/סטרפטומיצין (AM) (ראו טבלת חומרים).
- לתת-תרבות של האסטרוציטים, שבוע לפני קביעת הדגם, מצפים בקבוק תרבית תאי T75 אחד ב-10 מ"ל של 2 מיקרוגרם/ס"מ2 פולי-ל-ליזין (PLL) למשך שעה אחת ב-37 מעלות צלזיוס ושוטפים פעמיים במים סטריליים RT. הפשרת בקבוקון אחד של אסטרוציטים המכיל מיליון תאים ב-20 מ"ל של תווך חם וזרעים בבקבוקון תרבית תאי T75 המצופה מראש.
הערה: בקבוקוני התאים שהתקבלו באופן מסחרי מאשרים את נוכחותם של ~ 1 מיליון תאים, כך שספירת התאים לא בוצעה כאן. - שמור על התאים באינקובטור לח ב 37 מעלות צלזיוס תחת 5% CO 2 ו 21% O2. המדיום מתחדש לאחר 24 שעות ולאחר מכן כל יומיים עד הגדרת הטריקולטורה.
2. הגדרת מודל תרבות משולשת
הערה: ההרכבה של שלושת סוגי התאים מתבצעת באותו יום. יום לפני קביעת הטריקולטורה, בצעו את ציפוי הקולגן מסוג I על מסנני ההוספה שהוחזרו (ראו טבלת חומרים) וזרעו את האסטרוציטים בבארות המצופות מראש של PLL של צלחת בת 12 בארות.
- זריעת אסטרוציטים בבארות
- מצפים את הבארות ב-500 μL של 2 מיקרוגרם/ס" מ 2 תמיסת PLL כמתואר בשלב 1.3.2.
- שטפו את התאים פעם אחת עם 10 מ"ל של מלח פוספט חם - ללא סידן ומגנזיום 1X (1X PBS-CMF) (טבלה 1) לפני הדגירה למשך 3 דקות בטמפרטורה של 37 מעלות צלזיוס עם 10 מ"ל של תמיסת טריפסין/EDTA (T/E) חמה של 20% ונתקו באופן מכני את התאים מהבקבוקון. מעבירים את ההשעיה לצינור חרוטי המכיל 5 מ"ל של FCS חם ולא מדולל.
הערה: על פי פרוטוקול22 של הספק, ניתן לייעל את איסוף האסטרוציטים על ידי הצבת הבקבוקון באינקובטור למשך דקה אחת והקשה על הבקבוקון כדי לסייע בהשלמת הניתוק. את התאים הנותרים יש לאסוף עם 5 מ"ל של תמיסת נטרול T/E ולהציב בצינור החרוטי המכיל FCS. - צנטריפוגה המתלים במשך 5 דקות ב 20 מעלות צלזיוס ב 190 x גרם.
- להשעות את כדור התא ב 5 מ"ל של AM חם. ספירת התאים על ידי דילול 20 μL של תרחיף התא ב-80 μL של 1X PBS-CMF באמצעות תא ספירה ידני תחת מיקרוסקופ (ראו טבלת חומרים). צלחת סביב 40,000 תאים לס"מ2 בכל PLL מצופה מראש היטב בנפח של 1.5 מ"ל של AM חם.
- זריעה של פריסיטים על מסנני ההוספה שהוחזרו
- הוסף 250 μL של תמיסת קולגן מסוג I (100 מיקרוגרם למ"ל) על מסנני ההכנסה שהוחזרו, המונחים בשולי צלחת מכוסה בגובה 25 מ"מ (ראו טבלת חומרים) באמצעות פינצטה סטרילית. השאירו את הציפוי למשך שעה אחת ב-RT בתנאים סטריליים.
הערה: המנה המשומשת צריכה להיות גבוהה מספיק כדי להבטיח שמירה על סטריליות כאשר היא מחוץ למכסה המנוע ולמנוע מגע בין התמיסות על המסנן שהוחזר לבין כיסוי המנה. - הסירו בזהירות את תמיסת הקולגן מסוג I בעזרת פיפטה מזכוכית המחוברת למערכת שאפתנית. לשטוף פעמיים עם 250 μL של RT DMEM HG ולאחר מכן להסיר בזהירות את כל הפתרון מן המסננים להוסיף. השאירו את מסנני ההכנסה המצופים ב-RT בתנאים סטריליים עד לזריעת התאים.
הערה: במהלך הליך הציפוי, יש להיזהר שלא לגעת במסנן כדי למנוע נזק לממברנה. לאחר הציפוי בקולגן מסוג I, ניתן לאחסן את מסנני התוסף למשך הלילה ב-RT. - ביום של הגדרת triculture, לשטוף את pericytes פעמיים עם 10 מ"ל של חם 1X PBS-CMF ולדגור את התאים עם 2 מ"ל של טריפסין חם. עקוב אחר פעולת הטריפסין על ידי התבוננות בתאים שמתחת למיקרוסקופ. ברגע שהתאים מתחילים להתנתק, הסר את הטריפסין והוסף 5 מ"ל של ECM חם לפני דיסוציאציה מכנית.
- ספירת התאים על ידי דילול 20 μL של תרחיף התא ב 80 μL של 1X PBS-CMF באמצעות תא ספירה ידני תחת מיקרוסקופ, וזרע 44,500 תאים / ס"מ 2 על מסנני ההכנסה המצופים מראש בנפח של 250 μL. שמור את מסנני ההוספה באינקובטור לח בטמפרטורה של 37 מעלות צלזיוס למשך 3 שעות מתחת ל-5% CO 2 ו-21% O2.
- החזירו בזהירות את מסנני ההחדרה באמצעות פינצטה סטרילית בצלחת של 12 בארות המכילה 1.5 מ"ל של ECM/באר חם. מסנני ההוספה מוכנים כעת לציפוי בצד השני.
- הוסף 250 μL של תמיסת קולגן מסוג I (100 מיקרוגרם למ"ל) על מסנני ההכנסה שהוחזרו, המונחים בשולי צלחת מכוסה בגובה 25 מ"מ (ראו טבלת חומרים) באמצעות פינצטה סטרילית. השאירו את הציפוי למשך שעה אחת ב-RT בתנאים סטריליים.
- זריעה של תאי אנדותל על מסנני ההוספה
- מצפים את הצד העליון של מסנני ההוספה ב-500 μL של הידרוג'ל מבוסס מטריצה חוץ-תאית (1/48 v/v) (ראו טבלת חומרים). לאחר שעה אחת, באינקובטור לח בטמפרטורה של 37 מעלות צלזיוס מתחת ל-5% CO 2 ו-21% O2, יש לשטוף פעם אחת עם 500 μL של RT DMEM HG.
- לשטוף פעם אחת עם 10 מ"ל של 1X PBS-CMF חם לדגור את התאים עם 2 מ"ל של טריפסין חם. ברגע שהתאים מתחילים להתנתק, הסר את הטריפסין והוסף 5 מ"ל של ECM חם לפני דיסוציאציה מכנית.
- לספור את התאים על ידי דילול 20 μL של תרחיף התא ב 80 μL של 1X PBS-CMF באמצעות תא ספירה ידני תחת מיקרוסקופ ולזרוע את ECs בצפיפות של 71,500 תאים / ס"מ2 על מסנני הכנסה מצופים מראש בנפח של 500 μL של ECM חם.
- החלף AM ב-1.5 מ"ל של ECM/באר חמים ולאחר מכן העבר את מסנני ההוספה שנזרעו (ECs + pericytes) על הבארות המכילות את האסטרוציטים.
- מקם את מערכות תאי הטריקולטורה באינקובטור לח בטמפרטורה של 37 מעלות צלזיוס מתחת ל-5% CO 2 ו-21% O2.
- תחזוקה של תרבית התאים המשולשת להשראת תכונות BBB
הערה: עבור אינדוקציה של תכונות BBB ב ECs, 6 ימים של תרבית משולשת נחוצים.- מחדשים את המדיום אחת ליומיים עד יום 6, מורידים בזהירות את המדיום מהתא העליון והתחתון באמצעות פיפטה מזכוכית המחוברת למערכת שאיפות.
- החלף במהירות עם ECM חם בנפח של 500 μL בתא העליון ו 1.5 מ"ל בתא התחתון, והחזיר את התאים באינקובטור לח ב 37 °C תחת 5% CO 2 ו 21% O2.
3. אימות פנוטיפ BBB
הערה: לאחר 6 ימים של תרבית משולשת, הזמן הדרוש כדי לגרום לפנוטיפ BBB ב- ECs, מודל ה- BBB האנושי מוכן לניסויים. השלמות הפיזית של תאי האנדותל דמויי המוח (BLECs) מדומה על ידי צביעה אימונופלואורסצנטית של חלבוני TJ המוערכת באמצעות בדיקת חדירות לסמני שלמות BBB. אימות הפנוטיפ BBB כולל גם ניתוח ביטוי גנים/חלבונים ופונקציונליות של משאבות efflux בהתאם להליך המתואר ב- Deligne et al.,23. פריסיטים ואסטרוציטים מוצגים על ידי סמני צביעה בהתאמה על פי הנוהל המתואר ב- Deligne et al. 202023.
- צביעה אימונופלואורסצנטית
- תקן את מסנני ההוספה והאסטרוציטים במתנול/אצטון קר כקרח (50/50 וולט/וולט) למשך דקה אחת ושטוף פעמיים עם RT 1X PBS-CMF.
- בזהירות להפריד את המסנן מן התוספת על ידי חיתוך הממברנה באמצעות אזמל. בצע אימונוציטוכימיה על הממברנה והבארות התחתונות על פי Deligne et al.23.
הערה: עבור שלב החסימה, השתמש ב- 250 μL של מאגר חסימת SEA BLOCK (ראה טבלת חומרים) למשך 30 דקות ב- RT.
- בדיקת תקינות BBB
- הערך את השלמות הפיזית של ה- BLECs על ידי בדיקת חדירות באמצעות סמני שלמות BBB עם משקלים מולקולריים שונים, כמו נתרן פלואורסצין (NaF) ו- 20 kDa Dextran (FD20) (ראה טבלת חומרים).
הערה: ניתן לבצע את הניסוי בהתאם להליך המתואר ב- Deligne et al.23.
- הערך את השלמות הפיזית של ה- BLECs על ידי בדיקת חדירות באמצעות סמני שלמות BBB עם משקלים מולקולריים שונים, כמו נתרן פלואורסצין (NaF) ו- 20 kDa Dextran (FD20) (ראה טבלת חומרים).
- פונקציונליות משאבת Efflux
- הערך את הפונקציונליות של P-גליקופרוטאין (P-gp) וחלבון עמידות לסרטן השד (BCRP) על-ידי מדידת ההצטברות התוך-תאית של רודמין 123 (R123) עם ובלי אלקרידר, מעכב P-gp ו-BCRP (ראו טבלת חומרים).
הערה: ניתן לבצע את הניסוי בהתאם להליך המתואר ב- Deligne et al.23.
- הערך את הפונקציונליות של P-גליקופרוטאין (P-gp) וחלבון עמידות לסרטן השד (BCRP) על-ידי מדידת ההצטברות התוך-תאית של רודמין 123 (R123) עם ובלי אלקרידר, מעכב P-gp ו-BCRP (ראו טבלת חומרים).
- ביטויי גנים וחלבונים
- בצע איסוף דגימות גנים וחלבונים על קרח לאחר שטיפה מהירה עם Ringer HEPES קר (RH) (טבלה 1) של התאים. לפני איסוף דגימות EC, גרד את הפריסיטים ממסנני ההוספה ההפוכה20.
4. הובלת ננו-ג'ל
הערה: כדי להעריך את המעבר של ננו-ג'לים פולימריים (NGs) מהלומינל לתא האבלומינלי של מודל BLEC של טריקולטורה, 0.1 מ"ג/מ"ל של תמיסת NG נוספה ביום 6 על התא הזוהר למשך 24 שעות. NGs שנחקרו תויגו פלואורסצנטית כהידרוג'לים מבוססי N-איזופרופילקרילאמיד (NIPAM) בגודל ממוצע של 8-10 ננומטר (ראו טבלת חומרים).
- שוקלים את אבקת הננוג'ל ומסיסים אותה ב-ECM בריכוז של 1 מ"ג/מ"ל. ניתן לונתק את הפתרון למשך 10 דקות ולסנן באמצעות מסנן PTFE של 0.2 מיקרומטר.
הערה: הכינו תמיסת גז טבעי טרי ביום הניסוי. - החלף את המדיום בתא הלומינלי והוסף 50 μL של תמיסת NGs בתא העליון לקבלת ריכוז סופי של 0.1 מ"ג/מ"ל.
הערה: בצע דילול של 1:10 מהפתרון המקורי. - לאחר 24 שעות של דגירה, אספו אליקוטים מתאי לומינל (20 μL) ואבלומינל (200 μL) והניחו אותם בלוח שחור של 96 בארות.
- כימות הפלואורסצנציה באמצעות קורא פלואורסצנטי מרובה לוחות (ראו טבלת חומרים) עם לוח שחור בעל 96 בארות באמצעות הגדרת אורכי גל עירור/פליטה ב-477/540 ננומטר. חישוב אחוז המעבר המופנה לפתרון העבודה הראשוני שנוסף בזמן = 0 שעות (t0)6,15.
הערה: כדי להכין את צלחת 96 הבאר למדידת הפלואורסצנציה, הוסף 200 μL של תמיסה מתא האבלומינלי ו- 20 μL של תמיסה מתא האלומיניום והכנת t0 (הוסף 180 μL של ECM כדי להגיע לנפח סופי של 200 μL). כלול גם עקומת כיול וריק ללוח הקריאה. פרמטרים אינסטרומנטליים: שיטת גילוי - פלואורסצנציה, מיקום אופטי - למעלה, סוג קריאה - נקודת קצה, אורך גל עירור - 477 ננומטר, אורך גל פליטה - 540 ננומטר, רגישות - 100, טלטול - אורביטל כפול במשך 5 שניות.
תוצאות
הגדרת מודל BBB של התרבות המשולשת האנושית
הפרוטוקול הנדרש לקביעת מודל ה-BBB במבחנה האנושי מתואר באיור 1 וכולל שלבים עוקבים שאת סדרם יש לכבד בקפדנות. ראשית, שלושת סוגי התאים מעובדים בנפרד בכלים של תרביות תאים (איור 1A) לפני שהם מורכבים במערכת מסנני הוספה. הגדרת התרבית המשולשת מתחילה בזריעת סוג התא הראשון, אסטרוציטים, בבאר התחתונה המצופה מראש. למחרת, פריציטים ו- ECs נזרעים על המשטחים האבלומינליים והלומינליים המצופים מראש של מסנן ההוספה, בהתאמה. מסנן ההוספה מועבר לאחר מכן מעל האסטרוציטים. המודל נשמר בתרבות במשך 6 ימים, הזמן הדרוש להשראת תכונות BBB ב- ECs, עם חידוש המדיום כל יומיים על פי מודל התרבות המשותפת24 המוגן בפטנט. לאחר מכן שמם של ה-ECs שונה ל-BLECs (איור 1B).
אפיון מודל ה-BBB האנושי
מודל תרבית התאים המשולשת אופיין בנוכחות של קבוצה של תכונות ספציפיות ל- BBB. ראשית, נתוני אימונוציטוכימיה אישרו את הביטוי של סמנים קונבנציונליים כגון β קולטן גורם גדילה שמקורו בטסיות (PDGFR-β)25,26 ודסמין עבור פריסיטים וחלבון חומצי פיברילרי גלי (GFAP)26 עבור אסטרוציטים (איור 2A). לפיכך, לאחר 6 ימים של תרבית עם הפריסיטים והאסטרוציטים, המונו-שכבה של BLECs, שהומחשה עם צביעת הצומת הדביקה של VE-Cadherin, מציגה לוקליזציה רציפה של חלבוני TJ, Claudin-5 ו- ZO-1, בגבולות התא (איור 2A). ההגדרה של TJs מתואמת עם מקדמי חדירות על-תאית נמוכים שנמדדו באמצעות סמני שלמות BBB בעלי משקל מולקולרי נמוך, כלומר NaF (376 Da)16,27 ומשקל מולקולרי גבוה, כלומר FD20 (20 kDa)27, כפי שמוצג באיור 2B. הערכים שנמדדו דומים למודלים מאומתים של BBB במבחנה תוך שימוש במקור המדויק שלECs 23,24,28. בסך הכל, תוצאות אלה מדגישות את החדירות העל-תאית הנמוכה של התרבית המשולשת BLEC monolayer, האופיינית ל- in vivo BBB. בנוסף, הצטברות תוך-תאית של R123 ב-BLECs הראתה עלייה משמעותית בנוכחות מעכב משאבת השטף Elacridar 23,24 בהשוואה למצב הבקרה בהיעדרו (איור 2C). זה מצביע על נוכחות של מולקולות משאבת efflux פעיל, כלומר P-gp ו- BCRP, ב- BLECs.
כדי לאפיין עוד יותר את ה-BLECs, נחקרו ביטוי גנים ורמת חלבון של תכונות BBB מרכזיות (איור 3). הנתונים שהתקבלו עם מודל התרבית המשולשת הושוו למודל התרבות המשותפת המאומת והפטנט המורכב מ- ECs ו- pericytes24 המשמש כמודל בקרה. האסטרוציטים מייצגים את סוג התא השלישי שנוסף במודל הקו-תרבית הראשוני במודל התרבית המשולשת. לפיכך, ניתוח ביטוי הגנים (איור 3A) של BLECs בתרבית משולשת, בהשוואה ל-BLECs של תרבית משותפת, הראה את השמירה על ביטוי של תכונות BBB מרכזיות כגון חלבוני TJ (claudin-5 ו-zonula occludens-1) ומשאבות efflux (P-gp ו-BCRP), ואת הוויסות של רוב מובילי ה-BBB הנחקרים (מוביל גלוקוז 1) וקולטנים (קולטן טרנספרין). נתוני כימות חלבונים (איור 3B) נמצאו תואמים לתוצאות השעתוק. בסך הכל, נתונים אלה תומכים בהשראה חיובית של תכונות BBB בשכבת ה- BLEC המשולשת בדומה למודל התרבות המשותפת המאומת. בסך הכל, מודל התרבית המשולשת מציג את התכונות הפיזיקליות והמטבוליות הנדרשות עבור מערכת מיקרופיזיולוגית במבחנה כדי ליצור מודל של BBB.
תחולה לאסטרטגיות אספקת תרופות - מדידת הובלת ננו-ג'ל
כדי להעריך את האפשרות להשתמש במודל התרבית המשולשת כדי לחקור אסטרטגיות חדשות להעברת המוח, הוערכההובלה של NGs ניטרליים מבוססי NIPAM המתויגים באופן פלואורסצנטי 6,15. בזמן 0, NGs הונחו בתא הלומינלי בריכוז של 0.1 מ"ג/מ"ל (איור 4A). לאחר 24 שעות של דגירה, 5.82% מה-NGs נמצאו בתא האבמינלי (איור 4B), מה שמוכיח את יכולתם לחצות את ה-BLECs.
התוצאות מדגימות את התאמת המודל למדידת החדירות של תרכובות קטנות וגדולות יותר, כפי שמתואר בסמני השלמות, ולהעריך את ההובלה של ננו-חומרים כגון NGs פולימריים.
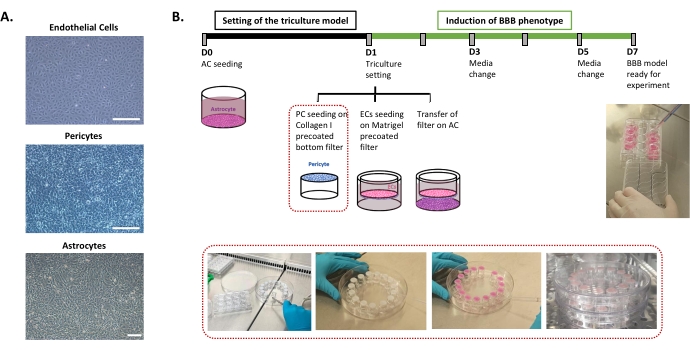
איור 1: ייצוג של שלבים קריטיים לקביעת התרבית המשולשת במבחנה של ה-BBB האנושי. (A) תמונות ניגודיות פאזה של שלושת מרכיבי התאים במודל BBB: תאי אנדותל (EC), פריציטים (PC) ואסטרוציטים (AC). סרגל קנה מידה = 250 מיקרומטר. (B) ציר זמן סכמטי וממחיש לקביעת מודל BBB במבחנה האנושי בתרבית משולשת. התיבה המסומנת מייצגת את הליך הציפוי של מסנן ההוספה ההפוך. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
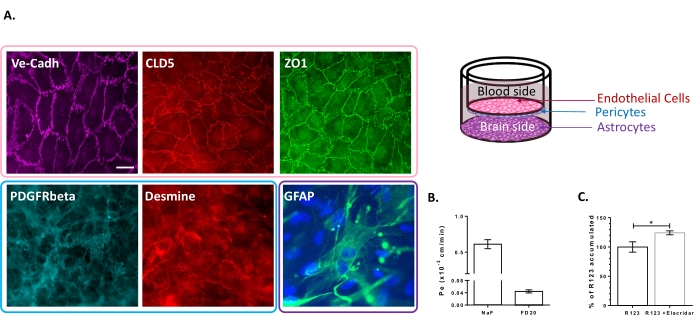
איור 2: הערכת התכונות של מודל BBB בתרבית משולשת. (A) תמונות אימונוסטיקינג מייצגות של הסמנים הייחודיים ל-BLECs (Claudin-5: CLD5, Zona Occludens-1: ZO1 ו-VE-cadherin: Ve-Cadh), פריסיטים (קולטן גורם גדילה שמקורו בטסיות-β: PDGFR-β ודמין), ואסטרוציטים (חלבון חומצי גליאלי פרברי: GFAP). סרגל קנה מידה = 10 מיקרומטר. (B) חדירות פארא-תאית של BLECs לסמני שלמות BBB פלואורסצנטיים, נתרן פלואורסצין (NaF, 376 Da, Pe: 0.61 ± 0.062) ו- FITC-Dextran (FD20, 20 kDa, Pe: 0.04 ± 0.005). N = 3; n = 9. ממוצע ± SEM. (C) פונקציונליות P-gp ו- BCRP ב- ECs הוערכה על ידי כימות R123 תוך-תאי עם (124.2% ± 3.39%) וללא (100% ± 8.79%) אלקרידר. N = 4; n = 12. ממוצע ± SEM. p = 0.017 באמצעות מבחן t לא מזווג. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
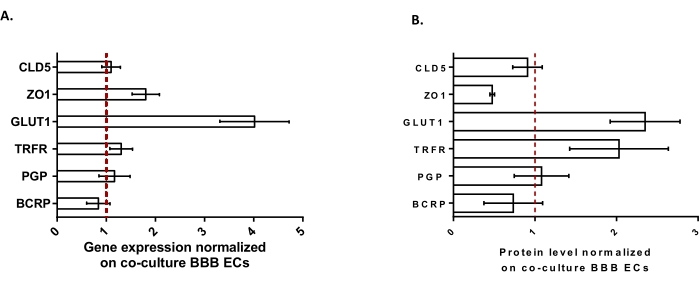
איור 3: הערכה של ביטוי גנים BLEC ורמת חלבון של סמנים ייחודיים במודל התרבית המשולשת בהשוואה למודל BBB של תרבית משותפת. (A) ביטוי גנים של חלבוני צומת הדוקים (Claudin-5: CLD5, ו- Zona Occludens-1: ZO1), טרנספורטרים (טרנספורטר גלוקוז-1: GLUT1, P-גליקופרוטאין: PGP, וחלבון עמידות לסרטן השד: BCRP), וקולטני מולקולות גדולות (קולטן טרנספרין: TRFR), מנורמל על ידי הביטוי של RPLP0. N = 3; n = 9. (B) רמת החלבון של חלבוני צומת הדוקים (CLD5 ו-ZO1), טרנספורטרים (GLUT1, PGP ו-BCRP) וקולטני מולקולות גדולות (TRFR), המנורמלים על-ידי ביטוי של β-אקטין. N = 3; n = 9. מתכוון ± SEM. עבור (A) ו-(B), ערכים>1 תואמים לביטוי גנים גבוה יותר או לרמות חלבון גבוהות יותר במודל התרבית המשולשת. הקו האדום מתאים לערך של 1 כאשר רמת הביטוי (גנים או חלבונים) של שני המודלים שקולה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
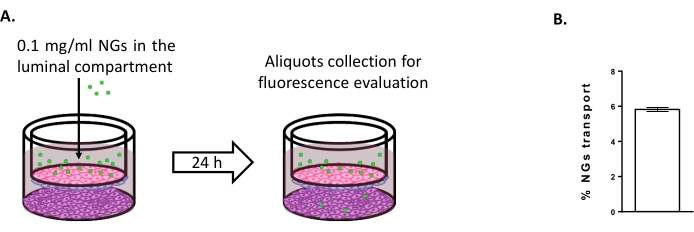
איור 4: מדידת הובלת ננו-ג'ל במודל התרבית המשולשת. (A) ייצוג סכמטי של בדיקת הובלת ננו-ג'ל. (B) אחוז הובלת ננו-ג'ל לאחר 24 שעות של דגירה במודל התרבית המשולשת (5.82% ± 0.09%). N = 2; n = 6. מתכוון ± SEM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| שם החיץ | הרכב | הערה | ||||
| משקל מולקולרי | ||||||
| מאגר פוספט מלוחים, ללא סידן מגנזיום | PBS-CMF | נאקל | 8 גר'/ל' | 58.4 | מוסיפים את כל התרכובת למים סטריליים וממתינים לסילוק מלא. ה- pH של הפתרון המתקבל צריך להיות בטווח של 7.3-7.4. לסנן את התמיסה באמצעות קרום 0.22 מיקרומטר ולאחסן את התמיסה הסטרילית ב 4 מעלות צלזיוס. | |
| KCl | 0.2 גר'/ל' | 74.55 | ||||
| ח"כ2ת.ד.4 | 0.2 גר'/ל' | 136.09 | ||||
| NaHPO4-12 H2O | 2.87 גר'/ל' | 358.14 | ||||
| מים | ||||||
| רינגר האפס | ר.ה. | נאקל | 8.8 גר'/ל' | 58.4 | מוסיפים את כל התרכובת למים סטריליים וממתינים למסיסים מלאה. התאם את ה- pH ל- 7.4 (pH של פתרון התחלתי בסביבות 6.8). לסנן את התמיסה באמצעות קרום 0.22 מיקרומטר ולאחסן את התמיסה הסטרילית ב 4 מעלות צלזיוס. | |
| KCl | 0.387 גר'/ל' | 74.55 | ||||
| קק"ל2 | 0.244 גר'/ל' | 110.99 | ||||
| MgCl 2 6H2 O | 0.0406 גר'/ל' | 203.3 | ||||
| נאהו3 | 0.504 גר'/ליטר | 84.1 | ||||
| האפס | 1.19 גר'/ל' | 238.3 | ||||
| גלוקוז | 0.504 גר'/ליטר | 180.16 | ||||
| מים | ||||||
טבלה 1: הרכב המאגרים השונים המשמשים בפרוטוקול.
Discussion
הטיפול במחלות מוח נותר אתגר בהתחשב בקושי של התרופות לעבור את ה-BBB כדי להגיע ליעדים התאיים והמולקולריים שלהן בפרנכימה של המוח.
פיתוח תרופות למחלות מוח מציג כיום אחוזי הצלחה נמוכים מכיוון שרוב התרופות המציגות תוצאות מבטיחות במודלים פרה-קליניים לא הראו תועלת כלשהי כאשר נעשה בהן שימוש במרפאה. בעקבות "כלל 3R", שמטרתו להפחית את מספר בעלי החיים המשמשים לניסויים, מודלים חוץ גופיים של BBB מפותחים כדי לחקור פתולוגיות מוחיות ולחזות חדירה מוחית של תרופות29. מודלים חוץ-גופיים של BBB פותחו בעיקר באמצעות תאים של בעלי חיים והפכו מתוחכמים יותר כדי לשפר את הרלוונטיות של התוצאות שהושגו16. אחת ההתפתחויות המשמעותיות בשימוש בתאים אנושיים, המביאה תובנה חדשה שאין להכחישה, ברמה התאית והמולקולרית, לחקר מנגנוני מחלות אנושיים16. עם זאת, פיתוח מודלים רלוונטיים מחייב התחשבות בשיפור הגדרות המודלים של BBB במבחנה והידע הנובע, הודות למודלים של בעלי חיים. לפיכך, עליו לקחת בחשבון את המורכבות של ארכיטקטורת ה-BBB ואת החשיבות של תקשורת התא-תא כדי לחקור את ה-BBB בתנאים פיזיולוגיים ופתולוגיים30.
הפרוטוקול המוצג כאן מתאר שיטה להקמת מודל BBB במבחנה אנושי מלא הכולל את שלושת סוגי התאים העיקריים של ה-BBB, ללא הגבלה של גישה לרקמת המוח. כמערכת מרובת תאים, האינדוקציה והתחזוקה של תכונות BBB, ללא שימוש מלאכותי בתרכובות מתהדקות, אלא המושרות על ידי תקשורת בין תאים, רלוונטית יותר מבחינה פיזיולוגית ותואמת את אינדוקציה in vivo של תכונות BBB31. לפיכך, כיבוד הכרונולוגיה של הפרוטוקול הוא בעל חשיבות עליונה להצלחת הפרוטוקול. יתר על כן, זמני הדגירה במהלך הגדרת התרבית המשולשת ולאחר הרכבת שלושת סוגי התאים מייצגים את השלבים הקריטיים העיקריים של הפרוטוקול.
תכונות ה- BBB ב- ECs מושרות על ידי התרבות המשותפת עם פריציטים, כפי שתואר עבור מודל התרבות המשותפת24. לפיכך, תרבות הפריסיטים בצד האחורי של מסנן ההוספה היא הנקודה הקריטית ביותר ומחייבת הקפדה על הפרוטוקול בסיכון שלא יהיו מספיק פריסיטים להשראת תכונות ה- BBB. קודם כל, במהלך הליך הציפוי וגם זריעת תאים, יש לשים לב לא לקבל את הכיסוי של צלחת פטרי במגע עם הציפוי וגם את המדיום ברגע שהתאים נזרעו כדי להבטיח ציפוי טוב של המסנן ולא לאבד תאים (שלבים 2.2.1 ו 2.2.4). יתר על כן, לאחר פריציטים הם זרעו, חיוני לחכות את הזמן המצוין עבור ההתקשרות של pericytes (שלב 2.2.4) לפני החזרת מסנן להוסיף עבור ציפוי וזריעה של ECs בצד השני (שלבים 2.2.5 ו 2.3). לאחר הזריעה, נדרשים שישה ימים כדי להשרות את תכונות ה-BBB באמצעות תקשורת בין תאים (שלב 2.4).
המודל מאומת במונחים של חדירות מוגבלת (הקשורה לקביעת הצמתים ההדוקים) שכן ה- ECs של מודל התרבית המשולשת מציגים ערכי חדירות לסמני שלמות BBB הדומים למודל התרבות המשותפת המאומת ונמדדים גם במודלים מאומתים של בעלי חיים או בני אדם 16,27,32. יתר על כן, אימות של מודל BBB במבחנה דורש, בנוסף לחדירות המוגבלת, את ההיענות לסוגי תאים אחרים של NVU ואת הביטוי של קולטנים פונקציונליים ומובילים16. בנוסף, המודל ניתן לשחזור ומייצר מספר מסנני הכנסה ובארות לביצוע ניתוחים רבים (ביטוי גנים וחלבונים, צביעה פלואורסצנטית, בדיקות רעילות) על כל סוג תא בנפרד ללא צורך בשיטת מיון תאים.
המודל פותח באמצעות מסנן בגודל נקבוביות של 0.4 מיקרומטר כדי שיהיה סוג תא אחד בכל צד של מסנן ההוספה. מערכת סינון ההחדרה אפשרה לחקור תקשורת בין תאים בתנאים פיזיולוגיים על ידי העברתה על אסטרוציטים המכילים היטב. נוכחות האסטרוציטים במערכת מייצגת ערך פלוס בהשוואה לתרבית המשותפת הראשונית במבחנה מודל24. ואכן, בהתחשב בחשיבותם של אסטרוציטים בפיזיולוגיה של ה-BBB, סוג תא שלישי זה מאפשר הבנה נוספת של תקשורת התא-תא בתוך ה-BBB. יתר על כן, מערכת תרבית התאים המשולשת יכולה להיחקר גם בתנאים פתולוגיים כגון שבץ, שבו האסטרוציטים ממלאים תפקיד חיוני33,34,35. בנוסף, ניתן למקם בקלות את התכנון של BLECs/ pericytes משני צידי מסנן ההחדרה על סוגי תאים אחרים כדי לחקות מצבים פתולוגיים כגון סרטן המוח23.
גודל הנקבוביות של מסנן ההוספה יכול להביא למגבלות בניסויים מסוימים, כגון העברת תאים על פני ה- BBB. עם זאת, פיתוח המודל עם גודל נקבוביות גדול יותר דורש התאמה של הפרוטוקול כדי להבטיח היווצרות של מונולאייר פיזיולוגי של ECs ולא שכבות מרובות, אשר אינו רלוונטי מבחינה פיזיולוגית כדי לחקות את BBB36.
תחולת המודל הוכחה באמצעות ניסוי תובלה של NGs המציג את האפשרות לבצע ניסוי הובלה באמצעות מערכת רב-תאית. עם זאת, יש להיות מודעים לקשיים בקיום תרכובת בקרה או מולקולה לניסוי ההובלה, החולקת תכונות דומות עם NGs מכיוון שכל ננו-מבנה מציג סט תכונות ייחודי (משקל מולקולרי, מטען, צורה, תכונות פיזיקליות, היווצרות חלבון קורונה).
מגבלה אחת של המודל היא היעדר לחץ גזירה, שהוכח כמשפיע על ההתמיינות של ECs ועל הביטוי של חלבוני TJ37. עם זאת, פיתוח מערכת נוזלית המחקה את נימי המוח הוא מאתגר בהתחשב במורכבות של הוספת חלק נוזלי, הדורש מכשיר מסוים, במערכת מרובת תאים. יתר על כן, המכשיר המסוים בדרך כלל אינו זמין מסחרית ואינו מאפשר שכפולים רבים, ובכך הופך את המערכות הנוזליות לפחות מותאמות לשימוש בתפוקה גבוהה.
לסיכום, מערכת התרבית המשולשת הזו המורכבת מתאים אנושיים משחזרת במבחנה את הארכיטקטורה של ה- BBB. זה מאפשר יצירת תוספות רבות שניתן להשתמש בהן לסינון נרחב של תרכובות.
Disclosures
המחברים מצהירים כי אין להם ניגוד עניינים.
Acknowledgements
עבודה זו מוענקת על ידי תוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי במסגרת הסכם מענקים No 764958, כחלק מפרויקט NANOSTEM, רשת הכשרה חדשנית של מארי סקלודובסקה-קירי (ITN) (מלגת אלאונורה ריצי). מחקר זה מוענק על ידי "Conseil régional du Nord-Pas-de-Calais" (מלגה לקלמנס דליגן), "Société Française de lutte contre les Cancers et les leucémies de l'Enfant et de l'teencent" (SFCE), האגודה "l'étoile de Martin" והאגודה "Cassandra contre la leucémie".
Materials
| Name | Company | Catalog Number | Comments |
| Cell Culture | |||
| Astocyte Medium (AM) | ScienCell | 1801 | |
| Astrocyte Growth Supplement | ScienCell | 1852 | Astrocyte Growth Supplement is provided in the AM set. |
| Cell culture dish 100 mm | Corning | 430293 | 100 mm x 20 mm; dish used for the thawing of ECs and PCs before the triculture setting |
| Cell culture dish 150 mm | Corning | 430599 | The height of these dishes (25 mm) allows the seeding of PCs in the reverted insert for the setting of the triculture model. |
| Collagen I | Corning | 354236 | Rat tail |
| Dulbecco's Modified Eagle Medium | Gibco | 31600-083 | Powder |
| Endothelial Cell Growth Supplement | ScienCell | 1051 | Endothelial Cell Growth Supplement is provided in the ECM set. |
| Endothelial Cell Medium (ECM) | ScienCell | 1001 | |
| Fetal Calf Serum | Sigma | F7524 | |
| Gelatin | Sigma | G2500 | 2% gelatin from porcine skin in PBS-CMF |
| Gentamicin | BiochromA6 | A-2712 | |
| Glucose | Sigma | G6152 | Powder |
| Glutamine | Merck | 1002891000 | |
| Human Brain Cortex Astrocytes | ScienCell | 1800-SC | |
| Malassez cell counting chamber | vWR | HECH40453702 | The count was performed manually. |
| Matrigel | Corning | 354230 | Extracellular matrix-based hydrogel |
| Penicillin/Streptomycin | ScienCell | 0503 | Penicillin/Streptomycin solution is provided in the ECM and AM sets. |
| Poly-L-lysine | ScienCell | 0413 | |
| Steritop | Millipore System | SCGPT0SRE | 0.22 µm pore size |
| Transwell insert | Corning | 3401 | 0.4 µm pore polycarbonate filter |
| Trypsin/EDTA neutralization solution | ScienCell | 0113 | |
| Trypsin/EDTA solution | ScienCell | 0103 | |
| Immunocytochemistry | |||
| SEA BLOCK blocking buffer | ThermoScientific | 37527 | |
| Alexa Fluor 568 anti-Mouse secondary antibody | Thermofisher | A11031 | Dilution 1:500 |
| Alexa Fluor 568 anti-Rabbit secondary antibody | Thermofisher | A11036 | Dilution 1:500 |
| Anti-Claudin-5 primary antibody | InVitrogen | 34-1600 | Dilution 1:100 |
| Anti-Desmin primary antibody | Abcam | ab6322 | Dilution 1:200 |
| Anti-Glial Fibrillary Acidic Protein primary antibody | Dako | Z0334 | Dilution 1:500 |
| Anti-Platelet-Derived Growth Factor-β primary antibody | Abcam | ab51090 | Dilution 1:200 |
| Anti-VE-cadherin primary antibody | Abcam | ab207732 | Dilution 1:200 |
| Anti-Zona Occludens-1 primary antibody | InVitrogen | 61-7300 | Dilution 1:200 |
| Normal Goat Serum | Sigma | G6767 | |
| ProLong Diamond Antifade Mountant with DAPI | Invitrogen | P36962 | |
| Gene expression | |||
| NucleoSpin Rna/Protein Macherey Nagel Kit | Macherey-Nagel | 740,933,250 | |
| 96 multiplate well | Biorad | HSP9601 | |
| iSCRIPT | Biorad | 1708841 | |
| Sealer sheet | Biorad | MSB1001 | |
| SsoFast EvaGreen Supermix | Biorad | 172-5201 | |
| Protein expression | |||
| 2x Laemli Sample Buffer | Biorad | 161-0737 | Add 50 µL of bMercaptoetanol to 950 µL of Laemmli Buffer and store at -20°C. Dilute 1:1 with the protein sample for the assay. |
| Anti-Breast Cancer Resistance Protein primary antibody | Abcam | ab207732 | Pre-treatment 15 minutes at RT under agitation; dilution 1:1000, O.N. at 4°C |
| Anti-Claudin-5 primary antibody | Abcam | ab15106 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Glucose Transporter 1 primary antibody | Millipore | 07-1401 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Mouse secondary antibody | Dako | P0447 | Dilution 1:5000 in TBS-Tween |
| Anti-P-glycoprotein primary antibody | Genetex | GTX23364 | Pre-treatment 15 minutes at RT under agitation; dilution 1:400, 3 hours at RT |
| Anti-Rabbit secondary antibody | Dako | P0448 | Dilution 1:8000 in TBS-Tween |
| Anti-Transferrin Receptor primary antibody | Abcam | ab84036 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Zona occludens-1 primary antibody | Abcam | ab216880 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Criterion TGX Gel | Biorad | 5678083 | |
| ECL Prime Solution | Amersham | RPN2236 | Revelation solution to keep in the dark |
| Phospatase inhibitor cocktail 2 | Sigma | P5726 | |
| Phospatase inhibitor cocktail 3 | Sigma | P0044 | |
| Protease Inhibitor | Sigma | P8340 | |
| Protein Standards | Biorad | 161-0373 | Molecular weight markers |
| RIPA 10x | Millipore | 20-188 | |
| TBS 10x | Biorad | 1706435 | |
| TRIS-Glycine | Biorad | 1610771 | |
| Tween | Biorad | 1706531 | |
| BBB integrity assay | |||
| Sodium Fluorescein | Ampresco | 0681 | λex= 490 nm; λem= 525 nm |
| Elacridar | Sigma | SML0486 | GF120918 |
| FITC-Dextran 20 kDa | Sigma | FD-20S | λex= 490 nm; λem= 525 nm |
| Rhodamine 123 | Sigma | R8004 | λex= 501 nm; λem= 538 nm |
| SynergyTM H1 | BioTek Instruments | Fluorescent multiplate reader | |
| Nanogel Transport | |||
| Syringe | Terumo | SS+01T1 | 1 mL syringe |
| Filter | FisherScientific | 15161499 | 0.2 µm PTFE membrane filter, 15 mm diameter |
| N-Isopropylacrylamide (NIPAM)-based hydrogels | The nanogels (NGs) used in the study are provided by our collaborator in Queen Mary University London, Department of Chemistry. The NGs are covalently tagged with a fluorescent molecule (λex= 477 nm; λem= 540 nm). NGs are freeze dried and shipped as powder, in this state they are stable at room temperature for long period of time. |
References
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37, 13-25 (2010).
- Profaci, C. P., Munji, R. N., Pulido, R. S., Daneman, R. The blood-brain barrier in health and disease: Important unanswered questions. The Journal of Experimental Medicine. 217 (4), 20190062 (2020).
- Abbott, N. J. Blood-brain barrier structure and function and the challenges for CNS drug delivery. Journal of Inherited Metabolic Disease. 36 (3), 437-449 (2013).
- Kreuter, J. Drug delivery to the central nervous system by polymeric nanoparticles: What do we know. Advanced Drug Delivery Reviews. 71, 2-14 (2014).
- Zhang, W., Mehta, A., Tong, Z., Esser, L. . L.Advanced science. 8 (10), 2003937 (2021).
- Vashist, A., et al. Nanogels as potential drug nanocarriers for CNS drug delivery. Drug Discovery Today. 23 (7), 1436-1443 (2018).
- Lombardo, S. M., Schneider, M., Türeli, A. E., Günday Türeli, N. Key for crossing the BBB with nanoparticles: The rational design. Beilstein Journal of Nanotechnology. 11, 866-883 (2020).
- Bernardo-Castro, S., et al. Therapeutic nanoparticles for the different phases of ischemic stroke. Life. 11 (6), 482 (2021).
- Salinas, Y., Castilla, A. M., Resmini, M. An L-proline based thermoresponsive and pH-switchable nanogel as a drug delivery vehicle. Polymer Chemistry. 9 (17), 2271-2280 (2018).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353 (2019).
- Preman, N. K., Jain, S., Johnson, R. P. ”Smart” polymer nanogels as pharmaceutical carriers: A versatile platform for programmed delivery and diagnostics. ACS Omega. 6 (8), 5075-5090 (2021).
- Cuggino, J. C., Blanco, E. R. O., Gugliotta, L. M., Alvarez Igarzabal, C. I., Calderón, M. Crossing biological barriers with nanogels to improve drug delivery performance. Journal of Controlled Release Official Journal of the Controlled Release Society. 307, 221-246 (2019).
- Basso, J., et al. Hydrogel-based drug delivery nanosystems for the treatment of brain tumors. Gels. 4 (3), 62 (2018).
- Harilal, S., et al. Revisiting the blood-brain barrier: A hard nut to crack in the transportation of drug molecules. Brain Research Bulletin. 160, 121-140 (2020).
- Papadimitriou, S. A., Robin, M. P., Ceric, D., O'Reilly, R. K., Marino, S., Resmini, M. Fluorescent polymeric nanovehicles for neural stem cell modulation. Nanoscale. 8 (39), 17340-17349 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Cecchelli, R., et al. Modelling of the blood-brain barrier in drug discovery and development. Nature Reviews Drug Discovery. 6 (8), 650-661 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. An overview of in vitro techniques for blood-brain barrier studies. Methods in Molecular Medicine. 89, 307-324 (2003).
- Shimizu, F., et al. Peripheral nerve pericytes modify the blood-nerve barrier function and tight junctional molecules through the secretion of various soluble factors. Journal of Cellular Physiology. 226 (1), 255-266 (2011).
- Pedroso, D. C., et al. Improved survival, vascular differentiation and wound healing potential of stem cells co-cultured with endothelial cells. PLoS One. 6 (1), 16114 (2011).
- Kanda, T., Iwasaki, T., Yamawaki, M., Ikeda, K. Isolation and culture of bovine endothelial cells of endoneurial origin. Journal of Neuroscience Research. 49 (6), 769-777 (1997).
- Data sheet on human astrocytes culture. Technical resources from ScienCell Available from: https://www.sciencellonline.com/human-astrocytes.html#product_tabs_technicalresources (2021)
- Deligne, C., et al. Development of a human in vitro blood-brain tumor barrier model of diffuse intrinsic pontine glioma to better understand the chemoresistance. Fluids and Barriers of the CNS. 17 (1), 37 (2020).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), 99733 (2014).
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-Brain Barrier: From physiology to disease and back. Physiological Reviews. 99 (1), 21-78 (2019).
- Daneman, R., Prat, A. The Blood-Brain Barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), 020412 (2015).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability studies on in vitro blood-brain barrier models: Physiology, pathology, and pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Heymans, M., Figueiredo, R., Dehouck, L., Francisco, D., Sano, Y., Shimizu, F., Kanda, T., Bruggmann, R., Engelhardt, B., Winter, P., Gosselet, F., Maxime, C. Contribution of brain pericytes in blood-brain barrier formation and maintenance: A transcriptomic study of co-cultured human endothelial cells derived from hematopoietic stem cells. Fluids Barriers CNS. 17, 48 (2020).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Neuhaus, W. In Vitro Models of the Blood-Brain Barrier. Handbook of Experimental Pharmacology. 265, 75-110 (2021).
- Hoheisel, D., Nitz, T., Franke, H., Wegener, J., Hakvoort, A., Tilling, T., Galla, H. J. Hydrocortisone reinforces the blood-brain properties in a serum free cell culture system. Biochemical and Biophysical Research Communications. 247 (2), 312-315 (1998).
- Drolez, A., et al. Selection of a relevant in vitro blood-brain barrier model to investigate pro-metastatic features of human breast cancer cell lines. PloS One. 11 (3), 0151155 (2016).
- Neuhaus, W., Gaiser, F., Mahringer, A., Franz, J., Riethmüller, C., Förster, C. The pivotal role of astrocytes in an in vitro stroke model of the blood-brain barrier. Frontiers in Cellular Neuroscience. 8, 352 (2014).
- Mysiorek, C., et al. Peroxisome proliferator-activated receptor-α activation protects brain capillary endothelial cells from oxygen-glucose deprivation-induced hyperpermeability in the blood-brain barrier. Current Neurovascular Research. 6 (3), 181-193 (2009).
- Culot, M., et al. Cerebrovascular protection as a possible mechanism for the protective effects of NXY-059 in preclinical models: An in vitro study. Brain Research. 1294, 144-152 (2009).
- Vandenhaute, E., Drolez, A., Sevin, E., Gosselet, F., Mysiorek, C., Dehouck, M. -. P. Adapting co-culture in vitro models of the blood-brain barrier for use in cancer research: Maintaining an appropriate endothelial monolayer for the assessment of transendothelial migration. Laboratory Investigation. 96 (5), 588-598 (2016).
- Cucullo, L., Hossain, M., Puvenna, V., Marchi, N., Janigro, D. The role of shear stress in Blood-Brain Barrier endothelial physiology. BMC Neuroscience. 12, 40 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved