Method Article
Un sistema di cellule a tripla coltura che modella la barriera emato-encefalica umana
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive un metodo per stabilire un modello umano di barriera emato-encefalica (BBB) in vitro . Le cellule endoteliali e i periciti sono seminati su ciascun lato di un filtro inserto (compartimento sanguigno) e gli astrociti sono seminati nel pozzetto inferiore (compartimento cerebrale). Il modello caratterizzato è stato utilizzato per esperimenti di trasporto di nanoparticelle.
Abstract
La somministrazione di farmaci al cervello rimane una sfida a causa delle proprietà altamente specifiche e restrittive della barriera emato-encefalica (BBB), che controlla e limita l'accesso al parenchima cerebrale. Tuttavia, con lo sviluppo delle nanotecnologie, sono stati sviluppati grandi pannelli di nuovi nanomateriali per migliorare la somministrazione di farmaci, evidenziando la necessità di microsistemi in vitro affidabili per prevedere la penetrazione cerebrale nell'ambito dei saggi preclinici. Ecco un metodo semplice per impostare un sistema microfisiologico per modellare la BBB utilizzando esclusivamente cellule umane. Nella sua configurazione, il modello consiste in una tripla coltura che include cellule endoteliali simili al cervello (BLEC), periciti e astrociti, i tre principali attori cellulari della BEE necessari per indurre e regolare le proprietà della BEE in modo più fisiologico senza la necessità di stringere i composti. Il modello sviluppato in un formato a piastra a 12 pozzetti, pronto dopo 6 giorni di tripla coltura, è caratterizzato da proprietà fisiche, espressioni geniche e proteiche e utilizzato per la misurazione del trasporto di nanogel polimerici. Il modello può essere utilizzato per una vasta gamma di esperimenti in condizioni sane e patologiche e rappresenta un valido strumento per valutazioni precliniche del trasporto di molecole e particelle, nonché del traffico intercellulare e intracellulare.
Introduzione
La BBB, localizzata a livello delle cellule endoteliali capillari cerebrali (ECs), controlla e regola l'accesso al parenchima cerebrale, che è cruciale per mantenere l'omeostasi cerebrale e la funzione delle cellule neurali 1,2. Tuttavia, nel caso della patologia cerebrale, la mancanza di accesso al parenchima cerebrale rappresenta un vero ostacolo allo sviluppo di strategie terapeutiche.
Le EC della BBB possiedono un complesso insieme di proprietà, tra cui proteine a giunzione stretta (TJ), che sigillano lo spazio intercellulare, associate a un sistema di pompe di eflusso, trasportatori specifici e recettori, che controllano la via transcellulare 1,2,3. Inoltre, tutte queste proprietà sono indotte e mantenute, grazie alle comunicazioni con i periciti incorporati nella membrana basale della BEE EC e gli astrociti, le cui estremità dei piedi circondano i capillari cerebrali 1,2,3. Quindi, studiare la BBB in vitro è una sfida considerando la complessità della sua architettura e le comunicazioni tra i diversi tipi di cellule che costituiscono l'unità neurovascolare (NVU)2. Inoltre, i diversi tipi di cellule sono cruciali per l'induzione e il mantenimento delle proprietà della BEE e di conseguenza influenzano la previsione dell'incrocio attraverso la BBB. Diverse strategie per la somministrazione di farmaci al cervello sono già state testate utilizzando un ampio pannello di tattiche per aggirare le proprietà limitate della BBB4. Più recentemente, con il progresso delle nanotecnologie, vengono sviluppati nuovi materiali per applicazioni come vettori di farmaci 5,6. Oltre al loro carico più elevato, alla ridotta tossicità e all'aumento della biodisponibilità dei farmaci, questi nuovi nanomateriali possono essere funzionalizzati per una strategia di cavallo di per attraversare la BEE e colpire specificamente le cellule nel parenchima 5,6. Tra i diversi tipi di nanomateriali valutati, i nanogel hanno attirato una notevole attenzione, principalmente grazie alle loro proprietà colloidali e alla capacità di adattare la struttura chimica per introdurre proprietà sensibili agli stimoli 7,8,9,10,11,12,13,14,15.
I modelli in vitro sono ora sviluppati per studi preclinici che utilizzano cellule umane per prevedere la penetrazione cerebrale dei farmaci16. Sono disponibili diverse impostazioni di questi modelli, dai monostrati di EC cerebrali ai sistemi cellulari multipli16. Considerando l'importanza delle cellule NVU nell'induzione e nel mantenimento della BEE e la risposta coordinata all'ambiente patologico, i modelli in vitro di BBB devono considerare tutti questi protagonisti per migliorare la rilevanza della previsione 2,17.
Il metodo attuale descrive la creazione di un modello in vitro di tripla coltura della BBB umana, che è completamente sviluppato con cellule umane per studiare specifici meccanismi cellulari e molecolari umani. Per essere fisiologicamente rilevante, il modello è costituito dai tre principali attori cellulari della BEE (ECs, periciti e astrociti) necessari per indurre e mantenere le proprietà della BEE, senza l'uso di composti di serraggio e mostrando un insieme di proprietà richieste per essere considerato come un modello in vitro di BBB16,18. Il modello è impostato in una configurazione che delimita il compartimento sanguigno e cerebrale, adatta per studi preclinici sul trasporto di farmaci e particelle per prevedere la penetrazione cerebrale. L'utilità del modello è illustrata misurando il trasporto di nanogel polimerici.
Protocollo
Il protocollo è stato approvato dal Ministero francese dell'istruzione superiore e della ricerca (riferimento: CODECOH DC2011-1321) e dal comitato di revisione sperimentale locale (Béthune Maternity Hospital, Beuvry, Francia). Per ottenere le cellule endoteliali (CE), è stato ottenuto il consenso scritto e informato dei genitori del donatore per raccogliere il sangue del cordone ombelicale, in conformità con la legislazione francese. I periciti sono forniti dal professor Takashi Kanda (Dipartimento di Neurologia e Neuroscienze Cliniche, Yamaguchi University Graduate School of Medicine, Ube, Giappone) che sono stati isolati secondo il riferimento19. Gli astrociti primari della corteccia cerebrale umana vengono acquistati da un fornitore commerciale (vedi Tabella dei materiali).
1. Coltura cellulare
- Coltura di cellule endoteliali
NOTA: Le cellule endoteliali (ECs) derivano da cellule staminali ematopoietiche CD34+ isolate dal sangue del cordone ombelicale umano, secondo il metodo descritto da Pedroso et al.20. Il fenotipo endoteliale delle EC è descritto in Pedroso et al.20.- Coltivare EC umane utilizzando il terreno di coltura delle cellule endoteliali integrato con il 5% di siero fetale di vitello (FCS), lo 0,5% di gentamicina e l'1% di integratore di crescita delle cellule endoteliali (ECM) (vedi Tabella dei materiali).
- Per la subcoltura di EC di subcoltura, due giorni prima della messa a punto del modello, ricoprire un piatto con 10 ml di gelatina al 2% per 15 minuti a 37 °C e quindi sostituirlo con 20 ml di ECM caldo. Scongelare un flaconcino di EC contenente 1 milione di cellule (le cellule sono state contate manualmente come descritto al punto 2.3.3 prima del congelamento delle cellule) nel piatto di coltura cellulare preverniciato.
- Dopo 3 ore a 37 °C, rinnovare il terreno e mantenere le celle fino alla presa della tricoltura in atmosfera umidificata all'interno di un incubatore a 37 °C sotto il 5% di CO 2 e il 21% di O2.
- Coltura di periciti
NOTA: I periciti sono isolati dal cervello umano secondo il protocollo pubblicato da Shimizu et al.19, la cui procedura di isolamento segue il metodo pubblicato da Kanda et al.21 con modifiche.- Coltivare i periciti utilizzando il terreno Eagle modificato di Dulbecco integrato con 4,5 g / L di glucosio (DMEM HG), 10% di FCS, 1% di penicillina / streptomicina e 1% di L-glutammina (vedi Tabella dei materiali).
- Per la subcoltura dei periciti, cinque giorni prima della messa a punto del modello, ricoprire due piatti con 8 ml/piatto di 100 μg/ml di soluzione di collagene di tipo I in acido acetico 0,02 N per 1 ora a temperatura ambiente (RT) e quindi lavare due volte con RT DMEM HG. Scongelare un flaconcino di periciti contenenti 1 milione di cellule in un tubo conico contenente 10 mL di mezzo caldo e centrifugare la sospensione per 5 minuti a 190 x g a 20 °C.
- Risospendere il pellet in 10 ml di terreno caldo e seminarlo nelle piastre di coltura cellulare pre-rivestite preriempite con 15 ml di mezzo/piatto caldo. Il terreno viene rinnovato dopo 3 giorni e le cellule vengono mantenute fino alla presa della tricoltura in un incubatore umidificato a 37 °C sotto il 5% di CO 2 e il 21% di O2.
- Coltura di astrociti
- Coltivare gli astrociti utilizzando un terreno di coltura con il 20% di FCS, l'1% di integratore per la crescita degli astrociti e l'1% di soluzione di penicillina / streptomicina (AM) (vedi Tabella dei materiali).
- Per la subcoltura degli astrociti, una settimana prima dell'impostazione del modello, rivestire un matraccio per coltura cellulare T75 con 10 mL di 2 μg/cm2 di poli-L-lisina (PLL) per 1 ora a 37 °C e lavare due volte con acqua sterile RT. Scongelare un flaconcino di astrociti contenente 1 milione di cellule in 20 ml di terreno caldo e semi nel matraccio di coltura cellulare T75 pre-rivestito.
NOTA: Le fiale di cellule ottenute commercialmente confermano la presenza di ~ 1 milione di cellule, quindi il conteggio delle cellule non è stato eseguito qui. - Mantenere le celle in un incubatore umidificato a 37 °C sotto il 5% di CO 2 e il 21% di O2. Il mezzo viene rinnovato dopo 24 h e poi ogni 2 giorni fino all'impostazione della tricoltura.
2. Impostazione del modello di tripla cultura
NOTA: l'assemblaggio dei tre tipi di celle viene eseguito lo stesso giorno. Il giorno prima dell'impostazione della tricoltura, eseguire il rivestimento di collagene di tipo I sui filtri a inserto ripristinati (vedi Tabella dei materiali) e seminare gli astrociti nei pozzetti prerivestiti in PLL di una piastra a 12 pozzetti.
- Semina di astrociti nei pozzi
- Rivestire i pozzetti con 500 μL di soluzione di 2 μg/cm 2 PLL, come descritto al punto 1.3.2.
- Lavare le cellule una volta con 10 mL di tampone fosfato caldo soluzione salina - senza calcio e magnesio 1X (1X PBS-CMF) (Tabella 1) prima di incubare per 3 minuti a 37 °C con 10 mL di soluzione calda al 20% di tripsina/EDTA (T/E) e staccare meccanicamente le cellule dal pallone. Trasferire la sospensione in un tubo conico contenente 5 mL di FCS caldo non diluito.
NOTA: Secondo il protocollo22 del fornitore, la raccolta di astrociti può essere ottimizzata posizionando il pallone nell'incubatore per 1 minuto e picchiettando il pallone per completare il distacco. Le cellule rimanenti devono essere raccolte con 5 mL di soluzione di neutralizzazione T/E e poste nel tubo conico contenente FCS. - Centrifugare la sospensione per 5 minuti a 20 °C a 190 x g.
- Risospendere il pellet cellulare in 5 ml di AM caldo. Contare le cellule diluendo 20 μL della sospensione cellulare in 80 μL di 1X PBS-CMF utilizzando una camera di conteggio manuale al microscopio (vedere Tabella dei materiali). Piastra circa 40.000 celle/cm2 in ciascun pozzetto preverniciato PLL in un volume di 1,5 ml di AM caldo.
- Semina di periciti sui filtri di inserimento invertiti
- Aggiungere 250 μL di soluzione di collagene di tipo I (100 μg/ml) sui filtri dell'inserto invertiti, posti alla periferia di un piatto coperto alto 25 mm (vedi Tabella dei materiali) usando una pinzetta sterile. Lasciare il rivestimento per 1 ora a RT in condizioni sterili.
NOTA: Il piatto utilizzato deve essere sufficientemente alto da garantire il mantenimento della sterilità quando si è all'esterno della cappa ed evitare il contatto tra le soluzioni sul filtro rovesciato e il coperchio del piatto. - Rimuovere accuratamente la soluzione di collagene di tipo I con una pipetta di vetro collegata a un sistema di aspirazione. Lavare due volte con 250 μL di RT DMEM HG e quindi rimuovere accuratamente tutta la soluzione dai filtri di inserimento. Lasciare i filtri dell'inserto rivestito a RT in condizioni sterili fino alla semina delle cellule.
NOTA: Durante la procedura di rivestimento, fare attenzione a non toccare il filtro per evitare danni alla membrana. Una volta rivestiti con collagene di tipo I, i filtri dell'inserto possono essere conservati durante la notte presso RT. - Il giorno dell'impostazione della tricoltura, lavare i periciti due volte con 10 ml di 1X PBS-CMF caldo e incubare le cellule con 2 ml di tripsina calda. Monitorare l'azione della tripsina osservando le cellule al microscopio. Una volta che le cellule iniziano a staccarsi, rimuovere la tripsina e aggiungere 5 ml di ECM caldo prima della dissociazione meccanica.
- Contare le cellule diluendo 20 μL della sospensione cellulare in 80 μL di 1X PBS-CMF utilizzando una camera di conteggio manuale al microscopio e seminare 44.500 cellule/cm 2 sui filtri per inserti invertiti preverniciati in un volume di 250 μL. Conservare i filtri inserto in un incubatore umidificato a 37 °C per 3 ore sotto il 5% di CO 2 e il 21% di O 2.
- Capovolgere con attenzione i filtri degli inserti utilizzando una pinzetta sterile in una piastra a 12 pozzetti contenente 1,5 ml di ECM/pozzetto caldo. I filtri di inserimento sono ora pronti per essere rivestiti sull'altro lato.
- Aggiungere 250 μL di soluzione di collagene di tipo I (100 μg/ml) sui filtri dell'inserto invertiti, posti alla periferia di un piatto coperto alto 25 mm (vedi Tabella dei materiali) usando una pinzetta sterile. Lasciare il rivestimento per 1 ora a RT in condizioni sterili.
- Semina delle cellule endoteliali sui filtri degli inserti
- Rivestire il lato superiore dei filtri a inserto con 500 μL di idrogel a base di matrice extracellulare (1/48 v/v) (vedi Tabella dei materiali). Dopo 1 ora, in un incubatore umidificato a 37 °C sotto il 5% di CO 2 e il 21% di O2, lavare una volta con 500 μL di RT DMEM HG.
- Lavare una volta con 10 ml di 1X PBS-CMF caldo e incubare le cellule con 2 ml di tripsina calda. Una volta che le cellule iniziano a staccarsi, rimuovere la tripsina e aggiungere 5 ml di ECM caldo prima della dissociazione meccanica.
- Contare le cellule diluendo 20 μL della sospensione cellulare in 80 μL di 1X PBS-CMF utilizzando una camera di conteggio manuale al microscopio e seminare le EC ad una densità di 71.500 cellule/cm2 sui filtri a inserto preverniciato in un volume di 500 μL di ECM caldo.
- Sostituire AM con 1,5 ml di ECM/pozzetto caldo e quindi trasferire i filtri di inserimento seminati (EC + periciti) sui pozzetti contenenti gli astrociti.
- Collocare i sistemi di celle di tricoltura in un incubatore umidificato a 37 °C sotto il 5% di CO 2 e il 21% di O2.
- Mantenimento della coltura a tripla cellula per l'induzione delle proprietà della BEE
NOTA: Per l'induzione delle proprietà BBB nelle CE, sono necessari 6 giorni di tripla coltura.- Rinnovare il mezzo a giorni alterni fino al giorno 6, togliendo con cura il mezzo dallo scomparto superiore e inferiore utilizzando una pipetta di vetro collegata con un sistema di aspirazione.
- Sostituire rapidamente con ECM caldo in un volume di 500 μL nel compartimento superiore e 1,5 ml nel compartimento inferiore e rimettere le celle in un incubatore umidificato a 37 °C sotto il 5% di CO 2 e il 21% di O2.
3. Validazione del fenotipo della BBB
NOTA: Dopo 6 giorni di tripla coltura, il tempo necessario per indurre il fenotipo BBB nelle CE, il modello umano di BBB è pronto per gli esperimenti. L'integrità fisica delle cellule endoteliali simili al cervello (BLEC) viene visualizzata dalla colorazione in immunofluorescenza delle proteine TJ valutate utilizzando il saggio di permeabilità ai marcatori di integrità della BBB. La validazione del fenotipo della BEE include anche l'analisi dell'espressione genica/proteica e la funzionalità delle pompe di efflusso secondo la procedura descritta in Deligne et al.,23. I periciti e gli astrociti sono visualizzati dai rispettivi marcatori di colorazione secondo la procedura descritta in Deligne et al. 202023.
- Colorazione con immunofluorescenza
- Fissare i filtri di inserimento e gli astrociti in metanolo/acetone ghiacciato (50/50 v/v) per 1 minuto e lavare due volte con RT 1X PBS-CMF.
- Separare accuratamente il filtro dall'inserto tagliando la membrana usando un bisturi. Eseguire immunocitochimica sulla membrana e sui pozzetti di fondo secondo Deligne et al.23.
NOTA: Per la fase di blocco, utilizzare 250 μL di buffer di blocco SEA BLOCK (vedere la tabella dei materiali) per 30 minuti su RT.
- Saggio di integrità della BBB
- Valutare l'integrità fisica dei BREC mediante un test di permeabilità utilizzando marcatori di integrità BBB con diversi pesi molecolari, come la fluoresceina di sodio (NaF) e il destrano 20 kDa (FD20) (vedi Tabella dei materiali).
NOTA: L'esperimento può essere eseguito secondo la procedura descritta in Deligne et al.23.
- Valutare l'integrità fisica dei BREC mediante un test di permeabilità utilizzando marcatori di integrità BBB con diversi pesi molecolari, come la fluoresceina di sodio (NaF) e il destrano 20 kDa (FD20) (vedi Tabella dei materiali).
- Funzionalità della pompa di efflusso
- Valutare la funzionalità della glicoproteina P (P-gp) e della proteina di resistenza al cancro al seno (BCRP) misurando l'accumulo intracellulare di Rhodamine 123 (R123) con e senza Elacridar, un inibitore della P-gp e del BCRP (vedere Tabella dei materiali).
NOTA: L'esperimento può essere eseguito secondo la procedura descritta in Deligne et al.23.
- Valutare la funzionalità della glicoproteina P (P-gp) e della proteina di resistenza al cancro al seno (BCRP) misurando l'accumulo intracellulare di Rhodamine 123 (R123) con e senza Elacridar, un inibitore della P-gp e del BCRP (vedere Tabella dei materiali).
- Espressioni geniche e proteiche
- Eseguire la raccolta di campioni di geni e proteine su ghiaccio dopo un rapido lavaggio con Ringer HEPES (RH) a freddo (Tabella 1) delle cellule. Prima della raccolta del campione EC, raschiare via i periciti dai filtri a inserto invertito20.
4. Trasporto di nanogel
NOTA: Per stimare il passaggio di nanogel polimerici (NG) dal compartimento luminale a quello abluminale del modello BLEC di tricoltura, sono stati aggiunti 0,1 mg/ml di soluzione NG al giorno 6 sul compartimento luminale per 24 ore. I NG studiati sono stati marcati fluorescentmente idrogel a base di N-isopropilacrilammide (NIPAM) con una dimensione media di 8-10 nm (vedi Tabella dei materiali).
- Pesare la polvere di nanogel e solubilizzarla in ECM ad una concentrazione di 1 mg/ml. Sonicare la soluzione per 10 minuti e filtrare utilizzando un filtro PTFE da 0,2 μm.
NOTA: Preparare una nuova soluzione NG il giorno dell'esperimento. - Cambiare il mezzo nel compartimento luminale e aggiungere 50 μL di soluzione di NGs nel compartimento superiore per una concentrazione finale di 0,1 mg/ml.
NOTA: Eseguire una diluizione di 1:10 dalla soluzione originale. - Dopo 24 ore di incubazione, raccogliere le aliquote dai compartimenti luminale (20 μL) e abluminale (200 μL) e posizionarle in una piastra nera da 96 pozzetti.
- Quantificare la fluorescenza utilizzando un lettore multiplo fluorescente (vedi Tabella dei materiali) con una piastra nera a 96 pozzetti utilizzando l'impostazione delle lunghezze d'onda di eccitazione/emissione a 477/540 nm. Calcolare la percentuale di attraversamento riferita alla soluzione di lavoro iniziale aggiunta al tempo = 0 h (t0)6,15.
NOTA: Per preparare la piastra a 96 pozzetti per la misurazione della fluorescenza, aggiungere 200 μL di soluzione dal compartimento abluminale e 20 μL di soluzione dal compartimento luminale e la preparazione t0 (aggiungere 180 μL di ECM per ottenere un volume finale di 200 μL). Includi anche una curva di calibrazione e uno spazio vuoto sulla piastra di lettura. Parametri strumentali: Metodo di rilevamento - Fluorescenza, Posizione ottica - Top, Tipo di lettura - Endpoint, Lunghezza d'onda di eccitazione - 477 nm, Lunghezza d'onda di emissione - 540 nm, Sensibilità - 100, Agitazione - Doppio orbitale per 5 s.
Risultati
Impostazione del modello BBB della tripla cultura umana
Il protocollo richiesto per l'impostazione del modello umano di BBB in vitro è descritto in Figura 1 e comprende passaggi successivi il cui ordine deve essere rigorosamente rispettato. In primo luogo, i tre tipi di cellule vengono coltivati singolarmente in piastre di coltura cellulare (Figura 1A) prima di essere assemblati in un sistema di filtri a inserto. L'impostazione della tripla coltura inizia con la semina del primo tipo di cellula, gli astrociti, nel pozzetto inferiore pre-rivestito. Il giorno seguente, i periciti e le EC vengono seminati rispettivamente sulle superfici abluminali e luminali pre-rivestite del filtro inserto. Il filtro dell'inserto viene quindi trasferito sugli astrociti. Il modello viene mantenuto in coltura per 6 giorni, il tempo necessario per indurre le proprietà BBB in EC, con un rinnovo del terreno a giorni alterni secondo il modello di co-coltura brevettato24. Le EC vengono quindi rinominate come BLEC (Figura 1B).
Caratterizzazione del modello umano di BBB
Il modello di coltura a tripla cellula è stato caratterizzato per la presenza di un insieme di proprietà specifiche della BBB. Prima di tutto, i dati immunocitochimici hanno confermato l'espressione di marcatori convenzionali come il recettore del fattore di crescita derivato dalle piastrine β (PDGFR-β)25,26 e la desmina per i periciti e la proteina acida fibrillare gliale (GFAP)26 per gli astrociti (Figura 2A). Quindi, dopo i 6 giorni di coltura con i periciti e gli astrociti, il monostrato di BLEC, visualizzato con la colorazione di giunzione aderente di VE-Cadherin, mostra una localizzazione continua delle proteine TJ, Claudin-5 e ZO-1, ai bordi cellulari (Figura 2A). La configurazione dei TJ è correlata con bassi coefficienti di permeabilità paracellulare misurati utilizzando marcatori di integrità BBB a basso peso molecolare, cioè NaF (376 Da)16,27 e ad alto peso molecolare, cioè FD20 (20 kDa)27, come mostrato in Figura 2B. I valori misurati sono comparabili con i modelli in vitro BBB convalidati utilizzando la fonte esatta di EC23,24,28. Complessivamente, questi risultati evidenziano la bassa permeabilità paracellulare del monostrato BLEC a tripla coltura, che è caratteristico della BBB in vivo. Inoltre, l'accumulo intracellulare di R123 nei BLEC ha mostrato un aumento significativo della presenza dell'inibitore della pompa di efflusso Elacridar 23,24 rispetto alla condizione di controllo con la sua assenza (Figura 2C). Ciò indica la presenza di molecole attive della pompa di eflusso, vale a dire P-gp e BCRP, nei BLEC.
Per caratterizzare ulteriormente i BLEC, sono stati studiati l'espressione genica e il livello proteico delle caratteristiche chiave della BBB (Figura 3). I dati ottenuti con il modello di tripla coltura sono stati confrontati con il modello di co-coltura validato e brevettato costituito da EC e periciti24 utilizzati come modello di controllo. Gli astrociti rappresentano il terzo tipo di cellula aggiunto nel modello di co-coltura iniziale nel modello di tripla coltura. Quindi, l'analisi dell'espressione genica (Figura 3A) dei BLEC a tripla coltura, confrontata con i BLEC di co-coltura, ha mostrato il mantenimento dell'espressione di caratteristiche chiave della BBB come le proteine TJ (claudina-5 e zonula occludens-1) e le pompe di efflusso (P-gp e BCRP), e la sovraregolazione della maggior parte dei trasportatori BBB studiati (trasportatore del glucosio 1) e dei recettori (recettore della transferrina). I dati di quantificazione delle proteine (Figura 3B) sono risultati essere in linea con i risultati trascrizionali. Nel complesso, questi dati supportano l'induzione positiva delle proprietà della BBB nello strato BLEC a tripla coltura simile al modello di co-coltura convalidato. Complessivamente, il modello di tripla coltura mostra le proprietà fisiche e metaboliche richieste per un sistema microfisiologico in vitro per modellare la BBB.
Applicabilità alle strategie di somministrazione di farmaci - misurazione del trasporto di nanogel
Per valutare la possibilità di utilizzare il modello di tripla coltura per studiare nuove strategie di consegna del cervello, è stato valutato il trasporto di NG neutri basati su NIPAM marcati con fluorescenza 6,15. Al tempo 0, i NG sono stati collocati nel compartimento luminale ad una concentrazione di 0,1 mg/ml (Figura 4A). Dopo 24 ore di incubazione, il 5,82% dei NG è stato trovato nel compartimento abluminale (Figura 4B), dimostrando la loro capacità di attraversare i BLEC.
I risultati dimostrano l'idoneità del modello a misurare la permeabilità di composti piccoli e grandi, come descritto con i marcatori di integrità, e valutare il trasporto di nanomateriali come i GN polimerici.
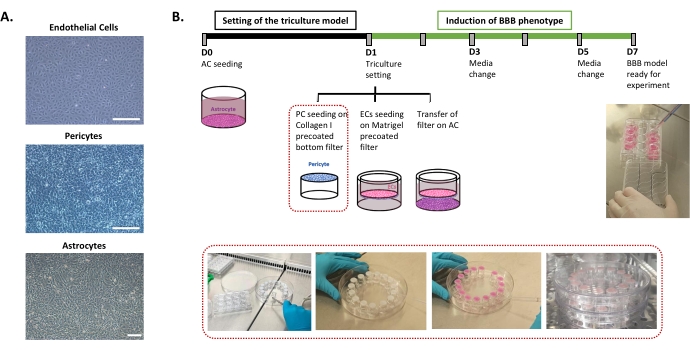
Figura 1: Rappresentazione dei passaggi critici per l'impostazione del modello in vitro di tripla coltura della BEE umana. (A) Immagini a contrasto di fase delle tre componenti cellulari del modello BEE: cellule endoteliali (EC), periciti (PC) e astrociti (AC). Barra di scala = 250 μm. (B) Timeline schematica e illustrativa per l'impostazione del modello in vitro di BBB umana a tripla coltura. La casella evidenziata rappresenta la procedura di rivestimento per il filtro dell'inserto invertito. Fare clic qui per visualizzare una versione ingrandita di questa figura.
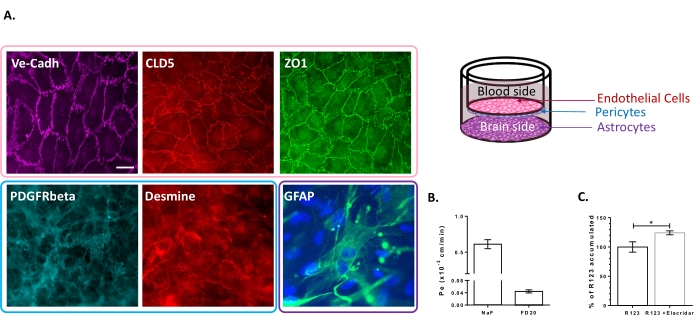
Figura 2: Valutazione delle proprietà del modello BBB a tripla coltura. (A) Immagini immunocoloranti rappresentative dei marcatori distintivi per i BLEC (Claudin-5: CLD5, Zona Occludens-1: ZO1 e VE-Cadherin: Ve-Cadh), periciti (Platelet-Derived Growth Factor Receptor-β: PDGFR-β e desmina) e astrociti (Glial Fibrillary Acidic Protein: GFAP). Barra di scala = 10 μm. (B) Permeabilità paracellulare dei BREC ai marcatori fluorescenti di integrità della BBB, fluoresceina di sodio (NaF, 376 Da, Pe: 0,61 ± 0,062) e FITC-destrano (FD20, 20 kDa, Pe: 0,04 ± 0,005). N = 3; n = 9. La funzionalità media ± SEM. (C) La funzionalità di P-gp e BCRP nelle EC è stata valutata quantificando R123 intracellulare con (124,2% ± 3,39%) e senza (100% ± 8,79%) Elacridar. N = 4; n = 12. Media ± SEM. p = 0,017 utilizzando un test t spaiato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
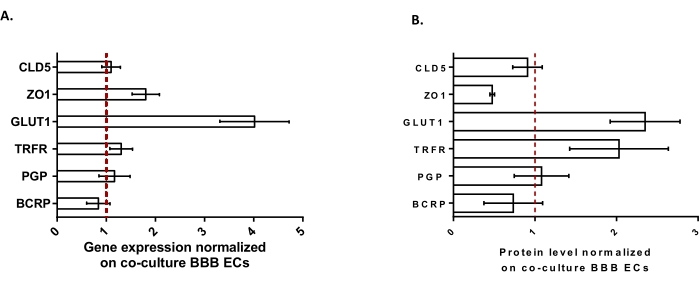
Figura 3: Valutazione dell'espressione genica BLEC e del livello proteico di marcatori distintivi nel modello di tripla coltura rispetto al modello BBB di co-coltura. (A) Espressione genica di proteine a giunzione stretta (Claudin-5: CLD5 e Zona Occludens-1: ZO1), trasportatori (Glucose Transporter-1: GLUT1, P-glycoprotein: PGP e Breast Cancer Resistance Protein: BCRP) e grandi recettori molecolari (Transferrin Receptor: TRFR), normalizzati dall'espressione di RPLP0. N = 3; n = 9. (B) Livello proteico di proteine a giunzione stretta (CLD5 e ZO1), trasportatori (GLUT1, PGP e BCRP) e recettori di grandi molecole (TRFR), normalizzati dall'espressione di β-actina. N = 3; n = 9. Media ± SEM. Per (A) e (B), i valori>1 corrispondono a livelli più elevati di espressione genica o proteica nel modello di tripla coltura. La linea rossa corrisponde ad un valore di 1 dove il livello di espressione (geni o proteine) dei due modelli è equivalente. Fare clic qui per visualizzare una versione ingrandita di questa figura.
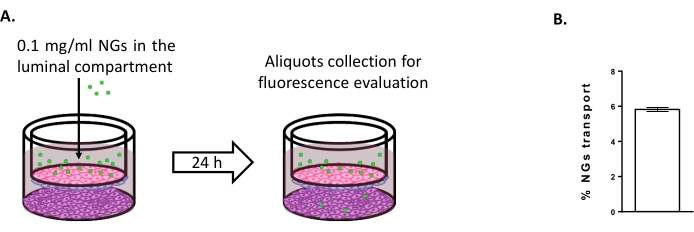
Figura 4: Misurazione del trasporto di nanogel nel modello di tripla coltura. (A) Rappresentazione schematica del saggio di trasporto del nanogel. (B) Percentuale di trasporto di nanogel dopo 24 ore di incubazione nel modello di tripla coltura (5,82% ± 0,09%). N = 2; n = 6. Media ± SEM. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Nome del buffer | Composizione | Nota | ||||
| Peso molecolare | ||||||
| Tampone fosfato soluzione salina, senza calcio e magnesio | PBS-CMF | NaCl | 8 g/L | 58.4 | Aggiungere tutto il composto in acqua sterile e attendere la completa solubilizzazione. Il pH della soluzione ottenuta deve essere compreso tra 7,3 e 7,4. Filtrare la soluzione con una membrana da 0,22 μm e conservare la soluzione sterile a 4 °C. | |
| Kcl | 0,2 g/L | 74.55 | ||||
| KH2PO4 | 0,2 g/L | 136.09 | ||||
| NaHPO4-12 H2O | 2,87 g/L | 358.14 | ||||
| Acqua | ||||||
| Ringer HEPES | RH | NaCl | 8,8 g/L | 58.4 | Aggiungere tutto il composto in acqua sterile e attendere la completa solublizzazione. Regolare il pH a 7,4 (pH della soluzione iniziale intorno a 6,8). Filtrare la soluzione con una membrana da 0,22 μm e conservare la soluzione sterile a 4 °C. | |
| Kcl | 0,387 g/L | 74.55 | ||||
| CaCl2 | 0,244 g/L | 110.99 | ||||
| MgCl 2 6H2 O | 0,0406 g/L | 203.3 | ||||
| NaHCO3 | 0,504 g/L | 84.1 | ||||
| HEPES | 1,19 g/L | 238.3 | ||||
| Glucosio | 0,504 g/L | 180.16 | ||||
| Acqua | ||||||
Tabella 1: Composizione dei diversi buffer utilizzati nel protocollo.
Discussione
Il trattamento delle malattie cerebrali rimane una sfida considerando la difficoltà dei farmaci di superare la BBB per raggiungere i loro obiettivi cellulari e molecolari nel parenchima cerebrale.
Lo sviluppo di farmaci per le malattie cerebrali mostra attualmente un basso tasso di successo poiché la maggior parte dei farmaci che mostrano risultati promettenti nei modelli preclinici non hanno mostrato alcun beneficio quando utilizzati in clinica. Seguendo la "regola delle 3R", che mira a ridurre il numero di animali utilizzati per la sperimentazione, vengono sviluppati modelli in vitro della BBB per studiare le patologie cerebrali e prevedere la penetrazione cerebrale dei farmaci29. I modelli in vitro di BBB sono stati sviluppati principalmente utilizzando cellule animali e sono diventati più sofisticati per migliorare la rilevanza dei risultati ottenuti16. Uno dei progressi significativi nell'uso delle cellule umane, che porta innegabili nuove intuizioni e maggiore specificità, a livello cellulare e molecolare, per studiare i meccanismi delle malattie umane16. Tuttavia, lo sviluppo di modelli pertinenti richiede di considerare il miglioramento delle impostazioni del modello in vitro della BBB e le conoscenze che ne derivano, grazie ai modelli animali. Quindi, è necessario considerare la complessità dell'architettura della BEE e l'importanza delle comunicazioni cellula-cellula per studiare la BBB in condizioni fisiologiche e patologiche30.
Il protocollo qui presentato descrive un metodo per impostare un modello umano completo di BBB in vitro comprendente i tre principali tipi di cellule della BEE, senza limitazioni di accesso al tessuto cerebrale. Come sistema a cellule multiple, l'induzione e il mantenimento delle proprietà della BEE, senza l'uso artificiale di composti di serraggio, ma invece indotti dalle comunicazioni cellula-cellula, sono più fisiologicamente rilevanti e in linea con l'induzione in vivo delle proprietà della BEE31. Pertanto, il rispetto della cronologia del protocollo è di primaria importanza per il successo del protocollo. Inoltre, i tempi di incubazione durante l'impostazione della tripla coltura e una volta assemblati i tre tipi di cellule rappresentano i principali passaggi critici del protocollo.
Le proprietà BBB nelle EC sono indotte dalla co-coltura con periciti, come descritto per il modello di co-coltura24. Quindi, la coltura di periciti sul retro del filtro inserto è il punto più critico e richiede di seguire rigorosamente il protocollo a rischio di non avere abbastanza periciti per l'induzione delle proprietà della BEE. Prima di tutto, durante la procedura di rivestimento e anche la semina cellulare, bisogna fare attenzione a non avere il coperchio della capsula di Petri a contatto con il rivestimento e anche il mezzo una volta che le cellule sono seminate per garantire un buon rivestimento del filtro e non perdere cellule (passaggi 2.2.1 e 2.2.4). Inoltre, una volta seminati i periciti, è essenziale attendere il tempo indicato per l'attacco dei periciti (punto 2.2.4) prima di invertire il filtro di inserimento per il rivestimento e la semina delle EC sull'altro lato (punti 2.2.5 e 2.3). Una volta seminato, sono necessari sei giorni per indurre le proprietà della BEE attraverso le comunicazioni cellula-cellula (fase 2.4).
Il modello è convalidato in termini di permeabilità limitata (associata all'impostazione delle giunzioni strette) poiché le EC del modello di tripla coltura mostrano valori di permeabilità ai marcatori di integrità della BEE simili al modello di co-coltura convalidato e misurati anche in modelli animali o umani convalidati 16,27,32. Inoltre, la validazione di un modello in vitro di BBB richiede, oltre alla limitata permeabilità, la reattività ad altri tipi cellulari della NVU e l'espressione di recettori e trasportatori funzionali16. Inoltre, il modello è riproducibile e produce più filtri e pozzetti per eseguire numerose analisi (espressione genica e proteica, colorazione fluorescente, test di tossicità) su ciascun tipo di cellula separatamente senza richiedere un metodo di selezione cellulare.
Il modello è stato sviluppato utilizzando un filtro di dimensioni dei pori da 0,4 μm per avere un tipo di cella su ciascun lato del filtro inserto. Il sistema di filtraggio a inserto ha permesso lo studio delle comunicazioni cellula-cellula in condizioni fisiologiche trasferendole su astrociti ben contenenti. La presenza di astrociti nel sistema rappresenta un valore aggiunto rispetto alla co-coltura iniziale in vitro modello24. Infatti, considerando l'importanza degli astrociti nella fisiologia della BEE, questo terzo tipo di cellula consente un'ulteriore comprensione delle comunicazioni cellula-cellula all'interno della BBB. Inoltre, il sistema di coltura a tripla cellula può essere studiato anche in condizioni patologiche come l'ictus, in cui gli astrociti svolgono un ruolo essenziale33,34,35. Inoltre, il design di BLEC / periciti su entrambi i lati del filtro inserto può essere facilmente posizionato su altri tipi di cellule per imitare condizioni patologiche come il cancro al cervello23.
La dimensione dei pori del filtro dell'inserto può portare limitazioni con alcuni esperimenti, come la trasmigrazione cellulare attraverso la BBB. Tuttavia, lo sviluppo del modello con una dimensione dei pori più grande richiede l'adattamento del protocollo per garantire la formazione di un monostrato fisiologico di EC e non di strati multipli, che non è fisiologicamente rilevante per imitare la BBB36.
L'applicabilità del modello è stata dimostrata utilizzando l'esperimento di trasporto NGs che mostra la possibilità di fare esperimenti di trasporto utilizzando un sistema multicellulare. Tuttavia, si dovrebbe essere consapevoli delle difficoltà nell'avere un composto o una molecola di controllo per l'esperimento di trasporto, condividendo proprietà comparabili con i NG poiché ogni nanostruttura presenta un insieme unico di proprietà (peso molecolare, carica, forma, proprietà fisiche, formazione di corona proteiche).
Una limitazione del modello è l'assenza di sforzo di taglio, che ha dimostrato di influenzare la differenziazione delle EC e l'espressione delle proteine TJ37. Tuttavia, lo sviluppo di un sistema fluidico che imita il capillare cerebrale è impegnativo considerando la complessità dell'aggiunta di una parte fluidica, che richiede un dispositivo specifico, in un sistema a più cellule. Inoltre, il particolare dispositivo di solito non è disponibile in commercio e non consente molte repliche, rendendo così i sistemi fluidici meno adatti per l'uso ad alta produttività.
In sintesi, questo triplo sistema di coltura costituito da cellule umane riproduce in vitro l'architettura della BBB. Consente la generazione di molti inserti che possono essere utilizzati per uno screening approfondito dei composti.
Divulgazioni
Gli autori dichiarano di non avere alcun conflitto di interessi.
Riconoscimenti
Questo lavoro è concesso dal programma di ricerca e innovazione Horizon 2020 dell'Unione Europea nell'ambito dell'accordo di sovvenzione n. 764958, nell'ambito del progetto NANOSTEM, una rete di formazione innovativa Marie Skłodowska-Curie (ITN) (Fellowship Eleonora Rizzi). Questo studio è finanziato dal «Conseil régional du Nord-Pas-de-Calais» (Fellowship to Clémence Deligne), dalla "Société Française de lutte contre les Cancers et les leucémies de l'Enfant et de l'adolescent" (SFCE), dall'Association "l'étoile de Martin" e dall'Association "Cassandra contre la leucémie".
Materiali
| Name | Company | Catalog Number | Comments |
| Cell Culture | |||
| Astocyte Medium (AM) | ScienCell | 1801 | |
| Astrocyte Growth Supplement | ScienCell | 1852 | Astrocyte Growth Supplement is provided in the AM set. |
| Cell culture dish 100 mm | Corning | 430293 | 100 mm x 20 mm; dish used for the thawing of ECs and PCs before the triculture setting |
| Cell culture dish 150 mm | Corning | 430599 | The height of these dishes (25 mm) allows the seeding of PCs in the reverted insert for the setting of the triculture model. |
| Collagen I | Corning | 354236 | Rat tail |
| Dulbecco's Modified Eagle Medium | Gibco | 31600-083 | Powder |
| Endothelial Cell Growth Supplement | ScienCell | 1051 | Endothelial Cell Growth Supplement is provided in the ECM set. |
| Endothelial Cell Medium (ECM) | ScienCell | 1001 | |
| Fetal Calf Serum | Sigma | F7524 | |
| Gelatin | Sigma | G2500 | 2% gelatin from porcine skin in PBS-CMF |
| Gentamicin | BiochromA6 | A-2712 | |
| Glucose | Sigma | G6152 | Powder |
| Glutamine | Merck | 1002891000 | |
| Human Brain Cortex Astrocytes | ScienCell | 1800-SC | |
| Malassez cell counting chamber | vWR | HECH40453702 | The count was performed manually. |
| Matrigel | Corning | 354230 | Extracellular matrix-based hydrogel |
| Penicillin/Streptomycin | ScienCell | 0503 | Penicillin/Streptomycin solution is provided in the ECM and AM sets. |
| Poly-L-lysine | ScienCell | 0413 | |
| Steritop | Millipore System | SCGPT0SRE | 0.22 µm pore size |
| Transwell insert | Corning | 3401 | 0.4 µm pore polycarbonate filter |
| Trypsin/EDTA neutralization solution | ScienCell | 0113 | |
| Trypsin/EDTA solution | ScienCell | 0103 | |
| Immunocytochemistry | |||
| SEA BLOCK blocking buffer | ThermoScientific | 37527 | |
| Alexa Fluor 568 anti-Mouse secondary antibody | Thermofisher | A11031 | Dilution 1:500 |
| Alexa Fluor 568 anti-Rabbit secondary antibody | Thermofisher | A11036 | Dilution 1:500 |
| Anti-Claudin-5 primary antibody | InVitrogen | 34-1600 | Dilution 1:100 |
| Anti-Desmin primary antibody | Abcam | ab6322 | Dilution 1:200 |
| Anti-Glial Fibrillary Acidic Protein primary antibody | Dako | Z0334 | Dilution 1:500 |
| Anti-Platelet-Derived Growth Factor-β primary antibody | Abcam | ab51090 | Dilution 1:200 |
| Anti-VE-cadherin primary antibody | Abcam | ab207732 | Dilution 1:200 |
| Anti-Zona Occludens-1 primary antibody | InVitrogen | 61-7300 | Dilution 1:200 |
| Normal Goat Serum | Sigma | G6767 | |
| ProLong Diamond Antifade Mountant with DAPI | Invitrogen | P36962 | |
| Gene expression | |||
| NucleoSpin Rna/Protein Macherey Nagel Kit | Macherey-Nagel | 740,933,250 | |
| 96 multiplate well | Biorad | HSP9601 | |
| iSCRIPT | Biorad | 1708841 | |
| Sealer sheet | Biorad | MSB1001 | |
| SsoFast EvaGreen Supermix | Biorad | 172-5201 | |
| Protein expression | |||
| 2x Laemli Sample Buffer | Biorad | 161-0737 | Add 50 µL of bMercaptoetanol to 950 µL of Laemmli Buffer and store at -20°C. Dilute 1:1 with the protein sample for the assay. |
| Anti-Breast Cancer Resistance Protein primary antibody | Abcam | ab207732 | Pre-treatment 15 minutes at RT under agitation; dilution 1:1000, O.N. at 4°C |
| Anti-Claudin-5 primary antibody | Abcam | ab15106 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Glucose Transporter 1 primary antibody | Millipore | 07-1401 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Mouse secondary antibody | Dako | P0447 | Dilution 1:5000 in TBS-Tween |
| Anti-P-glycoprotein primary antibody | Genetex | GTX23364 | Pre-treatment 15 minutes at RT under agitation; dilution 1:400, 3 hours at RT |
| Anti-Rabbit secondary antibody | Dako | P0448 | Dilution 1:8000 in TBS-Tween |
| Anti-Transferrin Receptor primary antibody | Abcam | ab84036 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Zona occludens-1 primary antibody | Abcam | ab216880 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Criterion TGX Gel | Biorad | 5678083 | |
| ECL Prime Solution | Amersham | RPN2236 | Revelation solution to keep in the dark |
| Phospatase inhibitor cocktail 2 | Sigma | P5726 | |
| Phospatase inhibitor cocktail 3 | Sigma | P0044 | |
| Protease Inhibitor | Sigma | P8340 | |
| Protein Standards | Biorad | 161-0373 | Molecular weight markers |
| RIPA 10x | Millipore | 20-188 | |
| TBS 10x | Biorad | 1706435 | |
| TRIS-Glycine | Biorad | 1610771 | |
| Tween | Biorad | 1706531 | |
| BBB integrity assay | |||
| Sodium Fluorescein | Ampresco | 0681 | λex= 490 nm; λem= 525 nm |
| Elacridar | Sigma | SML0486 | GF120918 |
| FITC-Dextran 20 kDa | Sigma | FD-20S | λex= 490 nm; λem= 525 nm |
| Rhodamine 123 | Sigma | R8004 | λex= 501 nm; λem= 538 nm |
| SynergyTM H1 | BioTek Instruments | Fluorescent multiplate reader | |
| Nanogel Transport | |||
| Syringe | Terumo | SS+01T1 | 1 mL syringe |
| Filter | FisherScientific | 15161499 | 0.2 µm PTFE membrane filter, 15 mm diameter |
| N-Isopropylacrylamide (NIPAM)-based hydrogels | The nanogels (NGs) used in the study are provided by our collaborator in Queen Mary University London, Department of Chemistry. The NGs are covalently tagged with a fluorescent molecule (λex= 477 nm; λem= 540 nm). NGs are freeze dried and shipped as powder, in this state they are stable at room temperature for long period of time. |
Riferimenti
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37, 13-25 (2010).
- Profaci, C. P., Munji, R. N., Pulido, R. S., Daneman, R. The blood-brain barrier in health and disease: Important unanswered questions. The Journal of Experimental Medicine. 217 (4), 20190062 (2020).
- Abbott, N. J. Blood-brain barrier structure and function and the challenges for CNS drug delivery. Journal of Inherited Metabolic Disease. 36 (3), 437-449 (2013).
- Kreuter, J. Drug delivery to the central nervous system by polymeric nanoparticles: What do we know. Advanced Drug Delivery Reviews. 71, 2-14 (2014).
- Zhang, W., Mehta, A., Tong, Z., Esser, L. . L.Advanced science. 8 (10), 2003937 (2021).
- Vashist, A., et al. Nanogels as potential drug nanocarriers for CNS drug delivery. Drug Discovery Today. 23 (7), 1436-1443 (2018).
- Lombardo, S. M., Schneider, M., Türeli, A. E., Günday Türeli, N. Key for crossing the BBB with nanoparticles: The rational design. Beilstein Journal of Nanotechnology. 11, 866-883 (2020).
- Bernardo-Castro, S., et al. Therapeutic nanoparticles for the different phases of ischemic stroke. Life. 11 (6), 482 (2021).
- Salinas, Y., Castilla, A. M., Resmini, M. An L-proline based thermoresponsive and pH-switchable nanogel as a drug delivery vehicle. Polymer Chemistry. 9 (17), 2271-2280 (2018).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353 (2019).
- Preman, N. K., Jain, S., Johnson, R. P. ”Smart” polymer nanogels as pharmaceutical carriers: A versatile platform for programmed delivery and diagnostics. ACS Omega. 6 (8), 5075-5090 (2021).
- Cuggino, J. C., Blanco, E. R. O., Gugliotta, L. M., Alvarez Igarzabal, C. I., Calderón, M. Crossing biological barriers with nanogels to improve drug delivery performance. Journal of Controlled Release Official Journal of the Controlled Release Society. 307, 221-246 (2019).
- Basso, J., et al. Hydrogel-based drug delivery nanosystems for the treatment of brain tumors. Gels. 4 (3), 62 (2018).
- Harilal, S., et al. Revisiting the blood-brain barrier: A hard nut to crack in the transportation of drug molecules. Brain Research Bulletin. 160, 121-140 (2020).
- Papadimitriou, S. A., Robin, M. P., Ceric, D., O'Reilly, R. K., Marino, S., Resmini, M. Fluorescent polymeric nanovehicles for neural stem cell modulation. Nanoscale. 8 (39), 17340-17349 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Cecchelli, R., et al. Modelling of the blood-brain barrier in drug discovery and development. Nature Reviews Drug Discovery. 6 (8), 650-661 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. An overview of in vitro techniques for blood-brain barrier studies. Methods in Molecular Medicine. 89, 307-324 (2003).
- Shimizu, F., et al. Peripheral nerve pericytes modify the blood-nerve barrier function and tight junctional molecules through the secretion of various soluble factors. Journal of Cellular Physiology. 226 (1), 255-266 (2011).
- Pedroso, D. C., et al. Improved survival, vascular differentiation and wound healing potential of stem cells co-cultured with endothelial cells. PLoS One. 6 (1), 16114 (2011).
- Kanda, T., Iwasaki, T., Yamawaki, M., Ikeda, K. Isolation and culture of bovine endothelial cells of endoneurial origin. Journal of Neuroscience Research. 49 (6), 769-777 (1997).
- Data sheet on human astrocytes culture. Technical resources from ScienCell Available from: https://www.sciencellonline.com/human-astrocytes.html#product_tabs_technicalresources (2021)
- Deligne, C., et al. Development of a human in vitro blood-brain tumor barrier model of diffuse intrinsic pontine glioma to better understand the chemoresistance. Fluids and Barriers of the CNS. 17 (1), 37 (2020).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), 99733 (2014).
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-Brain Barrier: From physiology to disease and back. Physiological Reviews. 99 (1), 21-78 (2019).
- Daneman, R., Prat, A. The Blood-Brain Barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), 020412 (2015).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability studies on in vitro blood-brain barrier models: Physiology, pathology, and pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Heymans, M., Figueiredo, R., Dehouck, L., Francisco, D., Sano, Y., Shimizu, F., Kanda, T., Bruggmann, R., Engelhardt, B., Winter, P., Gosselet, F., Maxime, C. Contribution of brain pericytes in blood-brain barrier formation and maintenance: A transcriptomic study of co-cultured human endothelial cells derived from hematopoietic stem cells. Fluids Barriers CNS. 17, 48 (2020).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Neuhaus, W. In Vitro Models of the Blood-Brain Barrier. Handbook of Experimental Pharmacology. 265, 75-110 (2021).
- Hoheisel, D., Nitz, T., Franke, H., Wegener, J., Hakvoort, A., Tilling, T., Galla, H. J. Hydrocortisone reinforces the blood-brain properties in a serum free cell culture system. Biochemical and Biophysical Research Communications. 247 (2), 312-315 (1998).
- Drolez, A., et al. Selection of a relevant in vitro blood-brain barrier model to investigate pro-metastatic features of human breast cancer cell lines. PloS One. 11 (3), 0151155 (2016).
- Neuhaus, W., Gaiser, F., Mahringer, A., Franz, J., Riethmüller, C., Förster, C. The pivotal role of astrocytes in an in vitro stroke model of the blood-brain barrier. Frontiers in Cellular Neuroscience. 8, 352 (2014).
- Mysiorek, C., et al. Peroxisome proliferator-activated receptor-α activation protects brain capillary endothelial cells from oxygen-glucose deprivation-induced hyperpermeability in the blood-brain barrier. Current Neurovascular Research. 6 (3), 181-193 (2009).
- Culot, M., et al. Cerebrovascular protection as a possible mechanism for the protective effects of NXY-059 in preclinical models: An in vitro study. Brain Research. 1294, 144-152 (2009).
- Vandenhaute, E., Drolez, A., Sevin, E., Gosselet, F., Mysiorek, C., Dehouck, M. -. P. Adapting co-culture in vitro models of the blood-brain barrier for use in cancer research: Maintaining an appropriate endothelial monolayer for the assessment of transendothelial migration. Laboratory Investigation. 96 (5), 588-598 (2016).
- Cucullo, L., Hossain, M., Puvenna, V., Marchi, N., Janigro, D. The role of shear stress in Blood-Brain Barrier endothelial physiology. BMC Neuroscience. 12, 40 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon