Method Article
Un système cellulaire à triple culture modélisant la barrière hémato-encéphalique humaine
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit une méthode pour établir un modèle in vitro de barrière hémato-encéphalique humaine (BHE). Les cellules endothéliales et les péricytes sont ensemencés de chaque côté d’un filtre à insert (compartiment sanguin), et les astrocytes sont ensemencés dans le puits inférieur (compartiment cérébral). Le modèle caractérisé a été utilisé pour des expériences de transport de nanoparticules.
Résumé
L’administration de médicaments au cerveau reste un défi en raison des propriétés hautement spécifiques et restrictives de la barrière hémato-encéphalique (BHE), qui contrôle et restreint l’accès au parenchyme cérébral. Cependant, avec le développement des nanotechnologies, de grands panels de nouveaux nanomatériaux ont été développés pour améliorer l’administration de médicaments, soulignant la nécessité de microsystèmes in vitro fiables pour prédire la pénétration cérébrale dans le cadre des essais précliniques. Voici une méthode simple pour mettre en place un système microphysiologique pour modéliser la BHE en utilisant uniquement des cellules humaines. Dans sa configuration, le modèle consiste en une triple culture comprenant des cellules endothéliales de type cérébral (BLEC), des péricytes et des astrocytes, les trois principaux acteurs cellulaires de la BHE nécessaires pour induire et réguler les propriétés de la BHE d’une manière plus physiologique sans avoir besoin de composés tenseurs. Le modèle développé dans un format de plaque de 12 puits, prêt après 6 jours de triple culture, est caractérisé par ses propriétés physiques, ses expressions de gènes et de protéines et est utilisé pour la mesure du transport de nanogel polymère. Le modèle peut être utilisé pour une vaste gamme d’expériences dans des conditions saines et pathologiques et représente un outil précieux pour les évaluations précliniques du transport des molécules et des particules, ainsi que du trafic intercellulaire et intracellulaire.
Introduction
La BHE, localisée au niveau des cellules endothéliales capillaires (CE) cérébrales, contrôle et régule l’accès au parenchyme cérébral, crucial pour le maintien de l’homéostasie cérébrale et de la fonction des cellules neurales 1,2. Cependant, dans le cas de la pathologie cérébrale, le manque d’accès au parenchyme cérébral représente un véritable frein au développement de stratégies thérapeutiques.
Les EC BBB possèdent un ensemble complexe de propriétés, y compris des protéines de jonction serrée (TJ), qui scellent l’espace intercellulaire, associées à un système de pompes à efflux, de transporteurs spécifiques et de récepteurs, qui contrôlent la voie transcellulaire 1,2,3. De plus, toutes ces propriétés sont induites et maintenues, grâce aux communications avec les péricytes intégrés dans la membrane basale BBB EC et les astrocytes, dont les extrémités des pieds entourent les capillaires cérébraux 1,2,3. Par conséquent, l’étude de la BHE in vitro est un défi compte tenu de la complexité de son architecture et des communications entre les différents types de cellules constituant l’unité neurovasculaire (NVU)2. De plus, les différents types de cellules sont cruciaux pour l’induction et le maintien des propriétés de la BHE et ont par conséquent un impact sur la prédiction du passage à travers la BHE. Différentes stratégies d’administration de médicaments au cerveau ont déjà été testées à l’aide d’un large panel de tactiques pour contourner les propriétés restreintes de la BHE4. Plus récemment, avec les progrès des nanotechnologies, de nouveaux matériaux sont en cours de développement pour des applications en tant que transporteurs de médicaments 5,6. En plus de leur charge plus élevée, de leur toxicité réduite et de leur biodisponibilité accrue des médicaments, ces nouveaux nanomatériaux peuvent être fonctionnalisés pour une stratégie de cheval de Troie visant à traverser la BHE et à cibler spécifiquement les cellules du parenchyme 5,6. Parmi les différents types de nanomatériaux évalués, les nanogels ont attiré une attention considérable, principalement en raison de leurs propriétés colloïdales et de leur capacité à adapter la structure chimique pour introduire des propriétés sensibles aux stimuli 7,8,9,10,11,12,13,14,15.
Des modèles in vitro sont maintenant développés pour des études précliniques utilisant des cellules humaines pour prédire la pénétration cérébrale des médicaments16. Différents paramètres de ces modèles sont disponibles, des monocouches d’EC cérébraux aux systèmes cellulaires multiples16. Compte tenu de l’importance des cellules NVU dans l’induction et le maintien de la BHE et de la réponse coordonnée à l’environnement pathologique, les modèles in vitro de la BHE doivent tenir compte de tous ces protagonistes pour améliorer la pertinence de la prédiction 2,17.
La méthode actuelle décrit la mise en place d’un modèle de triple culture in vitro de la BHE humaine, qui est entièrement développé avec des cellules humaines pour étudier des mécanismes cellulaires et moléculaires humains spécifiques. Pour être physiologiquement pertinent, le modèle consiste en trois principaux acteurs cellulaires de la BHE (CE, péricytes et astrocytes) nécessaires pour induire et maintenir les propriétés de la BHE, sans utiliser de composés tenseurs et présentant un ensemble de propriétés requises pour être considéré comme un modèle de BHE in vitro 16,18. Le modèle est mis en place dans une configuration délimitant le compartiment sanguin et cérébral, adaptée aux études précliniques du transport de médicaments et de particules pour prédire la pénétration cérébrale. L’utilité du modèle est illustrée par la mesure du transport des nanogels polymères.
Protocole
Le protocole a été approuvé par le ministère Français de l’Enseignement supérieur et de la Recherche (référence : CODECOH DC2011-1321) et par la commission locale d’investigation (maternité de Béthune, Beuvry, France). Pour l’obtention des cellules endothéliales (CE), le consentement écrit et éclairé des parents du donneur a été obtenu pour prélever du sang de cordon ombilical, conformément à la législation Français. Les péricytes sont fournis par le professeur Takashi Kanda (Département de neurologie et de neurosciences cliniques, École supérieure de médecine de l’Université Yamaguchi, Ube, Japon) qui ont été isolés conformément à la référence19. Les astrocytes primaires du cortex cérébral humain sont achetés auprès d’un fournisseur commercial (voir Tableau des matériaux).
1. Culture cellulaire
- Culture de cellules endothéliales
REMARQUE : Les cellules endothéliales (CE) sont dérivées de cellules souches hématopoïétiques CD34+ isolées du sang de cordon ombilical humain, selon la méthode décrite par Pedroso et coll.20. Le phénotype endothélial des CE est décrit dans Pedroso et coll.20.- Cultiver des CE humaines en utilisant un milieu cellulaire endothélial complété par 5 % de sérum de veau fœtal (FCS), 0,5 % de gentamicine et 1 % de supplément de croissance des cellules endothéliales (ECM) (voir le tableau des matières).
- Pour les CE de sous-culture, deux jours avant la mise en place du modèle, enrober une boîte de 10 ml de gélatine à 2 % pendant 15 minutes à 37 °C, puis la remplacer par 20 ml de MCE chaude. Décongeler un flacon de CEs contenant 1 million de cellules (les cellules ont été comptées manuellement comme décrit à l’étape 2.3.3 avant la congélation des cellules) dans la boîte de culture cellulaire préenrobée.
- Après 3 h à 37 °C, renouveler le milieu et maintenir les cellules jusqu’à la prise de la triculture dans une atmosphère humidifiée à l’intérieur d’un incubateur à 37 °C sous 5 % de CO2 et 21 %O2.
- Culture de péricytes
NOTE: Les péricytes sont isolés du cerveau humain selon le protocole publié par Shimizu et al.19, dont la procédure d’isolement suit la méthode publiée par Kanda et al.21 avec des modifications.- Cultiver les péricytes en utilisant le milieu Eagle modifié de Dulbecco supplémenté avec 4,5 g/L de glucose (DMEM HG), 10 % de FCS, 1 % de pénicilline/streptomycine et 1 % de L-glutamine (voir le tableau des matières).
- Pour la sous-culture péricytaire, cinq jours avant la mise en place du modèle, enduire deux boîtes de 8 mL/plat de 100 μg/mL de solution de collagène de type I dans de l’acide acétique 0,02 N pendant 1 h à température ambiante (RT), puis laver deux fois avec RT DMEM HG. Décongeler un flacon de péricytes contenant 1 million de cellules dans un tube conique contenant 10 mL de milieu chaud et centrifuger la suspension pendant 5 min à 190 x g à 20 °C.
- Remettez en suspension la pastille dans 10 mL de milieu chaud et ensemencez dans les boîtes de culture cellulaire pré-enrobées préremplies de 15 ml de milieu chaud/plat. Le milieu est renouvelé après 3 jours, et les cellules sont maintenues jusqu’à la prise de la triculture dans un incubateur humidifié à 37 °C sous 5% CO2 et 21%O2.
- Culture d’astrocytes
- Cultiver les astrocytes en utilisant un milieu astrocytaire supplémenté avec 20% de FCS, 1% de supplément de croissance astrocytaire et 1% de solution de pénicilline / streptomycine (AM) (voir le tableau des matériaux).
- Pour la sous-culture des astrocytes, une semaine avant la pose du modèle, enduire une fiole de culture cellulaire T75 de 10 mL de 2 μg/cm2 de poly-L-lysine (PLL) pendant 1 h à 37 °C et laver deux fois à l’eau stérile RT. Décongeler un flacon d’astrocytes contenant 1 million de cellules dans 20 mL de milieu chaud et semer dans le flacon de culture cellulaire T75 préenrobé.
REMARQUE: Les flacons cellulaires obtenus commercialement confirment la présence de ~ 1 million de cellules, de sorte que le comptage des cellules n’a pas été effectué ici. - Maintenir les cellules dans un incubateur humidifié à 37 °C sous 5% CO 2 et 21% O2. Le milieu est renouvelé après 24 h puis tous les 2 jours jusqu’à la mise en place de la triculture.
2. Définition d’un modèle de triple culture
Remarque : L’assemblage des trois types de cellules est effectué le même jour. La veille de la mise en place de la triculture, effectuer le revêtement de collagène de type I sur les filtres à insert inversés (voir Tableau des matériaux) et ensemencer les astrocytes dans les puits pré-revêtus de PLL d’une plaque de 12 puits.
- Ensemencement des astrocytes dans les puits
- Enduire les puits de 500 μL desolution de PLL 2 μg/cm2 comme décrit à l’étape 1.3.2.
- Laver les cellules une fois avec 10 mL de solution saline tampon phosphate chaude - sans calcium et magnésium 1X (1X PBS-CMF) (tableau 1) avant d’incuber pendant 3 minutes à 37 °C avec 10 mL de solution chaude de trypsine/EDTA (T/E) chaude à 20 % et détacher mécaniquement les cellules de la fiole. Transférer la suspension dans un tube conique contenant 5 mL de FCS chaud non dilué.
NOTE: Selon le protocole22 du fournisseur, la collecte des astrocytes peut être optimisée en plaçant le ballon dans l’incubateur pendant 1 min et en tapotant le ballon pour aider à compléter le détachement. Les cellules restantes doivent être collectées avec 5 mL de solution de neutralisation T/E et placées dans le tube conique contenant du FCS. - Centrifuger la suspension pendant 5 min à 20 °C à 190 x g.
- Remettez en suspension la pastille cellulaire dans 5 mL de AM chaud. Compter les cellules en diluant 20 μL de la suspension cellulaire dans 80 μL de 1X PBS-CMF à l’aide d’une chambre de comptage manuelle au microscope (voir le tableau des matériaux). Plaquer environ 40 000 cellules/cm2 dans chaque puits pré-revêtu de PLL dans un volume de 1,5 mL de MA chaude.
- Ensemencement des péricytes sur les filtres à insert inversés
- Ajouter 250 μL de solution de collagène de type I (100 μg/mL) sur les filtres à insert inversés, placés à la périphérie d’un plat couvert de 25 mm de hauteur (voir le tableau des matières) à l’aide d’une pince à épiler stérile. Laisser le revêtement pendant 1 h à TA dans des conditions stériles.
REMARQUE: Le plat usagé doit être suffisamment haut pour assurer le maintien de la stérilité à l’extérieur de la hotte et éviter tout contact entre les solutions sur le filtre retourné et le couvercle de la capsule. - Retirez soigneusement la solution de collagène de type I à l’aide d’une pipette en verre reliée à un système d’aspiration. Laver deux fois avec 250 μL de RT DMEM HG, puis retirer délicatement toute la solution des filtres à insert. Laisser les filtres enduits à insert à TA dans des conditions stériles jusqu’à l’ensemencement des cellules.
REMARQUE: Pendant la procédure de revêtement, veillez à ne pas toucher le filtre pour éviter d’endommager la membrane. Une fois recouverts de collagène de type I, les filtres d’insertion peuvent être stockés pendant la nuit chez RT. - Le jour de la triculture, laver les péricytes deux fois avec 10 mL de 1X PBS-CMF chaud et incuber les cellules avec 2 mL de trypsine chaude. Surveiller l’action de la trypsine en observant les cellules au microscope. Une fois que les cellules commencent à se détacher, retirer la trypsine et ajouter 5 mL d’ECM chaud avant la dissociation mécanique.
- Compter les cellules en diluant 20 μL de la suspension cellulaire dans 80 μL de 1X PBS-CMF à l’aide d’une chambre de comptage manuelle au microscope, et ensemencer 44 500 cellules/cm2 sur les filtres à insert inversés pré-revêtus dans un volume de 250 μL. Conserver les filtres à insert dans un incubateur humidifié à 37 °C pendant 3 h sous 5 % de CO2 et 21 %d’O2.
- Retournez délicatement les filtres d’insertion à l’aide d’une pince à épiler stérile dans une plaque de 12 puits contenant 1,5 ml d’ECM/puits chaud. Les filtres d’insertion sont maintenant prêts à être revêtus de l’autre côté.
- Ajouter 250 μL de solution de collagène de type I (100 μg/mL) sur les filtres à insert inversés, placés à la périphérie d’un plat couvert de 25 mm de hauteur (voir le tableau des matières) à l’aide d’une pince à épiler stérile. Laisser le revêtement pendant 1 h à TA dans des conditions stériles.
- Ensemencement des cellules endothéliales sur les filtres à insert
- Enduisez la face supérieure des filtres d’insertion de 500 μL d’hydrogel à base de matrice extracellulaire (1/48 v/v) (voir le tableau des matériaux). Après 1 h, dans un incubateur humidifié à 37 °C sous 5% CO 2 et 21% O2, laver une fois avec 500 μL de RT DMEM HG.
- Laver une fois avec 10 mL de 1x PBS-CMF chaud et incuber les cellules avec 2 mL de trypsine tiède. Une fois que les cellules commencent à se détacher, retirer la trypsine et ajouter 5 mL d’ECM chaud avant la dissociation mécanique.
- Compter les cellules en diluant 20 μL de la suspension cellulaire dans 80 μL de 1X PBS-CMF à l’aide d’une chambre de comptage manuelle au microscope et ensemencer les EC à une densité de 71 500 cellules/cm2 sur les filtres à insert pré-revêtus dans un volume de 500 μL d’ECM chaud.
- Remplacer AM par 1,5 mL d’ECM/puits chaud, puis transférer les filtres à insert ensemencés (EC + péricytes) sur les puits contenant les astrocytes.
- Placer les systèmes cellulaires de triculture dans un incubateur humidifié à 37 °C sous 5 % de CO2 et 21 % d’O2.
- Maintien de la culture triple cellulaire pour l’induction des propriétés de la BHE
NOTE: Pour l’induction des propriétés de la BHE dans les CE, 6 jours de triple culture sont nécessaires.- Renouveler le milieu tous les deux jours jusqu’au jour 6, en enlevant soigneusement le milieu des compartiments supérieur et inférieur à l’aide d’une pipette en verre reliée à un système d’aspiration.
- Remplacer rapidement par de l’ECM chaud dans un volume de 500 μL dans le compartiment supérieur et 1,5 mL dans le compartiment inférieur, et remettre les cellules dans un incubateur humidifié à 37 °C sous 5% CO 2 et 21% O2.
3. Validation du phénotype de la BHE
NOTE: Après 6 jours de triple culture, le temps nécessaire pour induire le phénotype BBB dans les CE, le modèle BBB humain est prêt pour les expériences. L’intégrité physique des cellules endothéliales de type cérébral (BLEC) est visualisée par coloration par immunofluorescence des protéines TJ évaluées à l’aide d’un test de perméabilité aux marqueurs d’intégrité de la BHE. La validation du phénotype de la BHE comprend également l’analyse de l’expression des gènes et des protéines et la fonctionnalité des pompes d’efflux selon la procédure décrite dans Deligne et coll.,23. Les péricytes et les astrocytes sont visualisés par des marqueurs de coloration respectifs selon la procédure décrite dans Deligne et al. 202023.
- Coloration par immunofluorescence
- Fixez les filtres à insert et les astrocytes dans du méthanol/acétone glacé (50/50 v/v) pendant 1 min et lavez deux fois avec RT 1X PBS-CMF.
- Séparez soigneusement le filtre de l’insert en coupant la membrane à l’aide d’un scalpel. Effectuer une immunocytochimie sur la membrane et les puits de fond selon Deligne et al.23.
REMARQUE: Pour l’étape de blocage, utilisez 250 μL de tampon de blocage SEA BLOCK (voir le tableau des matériaux) pendant 30 minutes à TA.
- Essai d’intégrité de la BHE
- Évaluer l’intégrité physique des BLEC par un essai de perméabilité à l’aide de marqueurs d’intégrité BBB de différents poids moléculaires, comme la fluorescéine de sodium (NaF) et le dextran 20 kDa (FD20) (voir le tableau des matériaux).
NOTE: L’expérience peut être réalisée selon la procédure décrite dans Deligne et al.23.
- Évaluer l’intégrité physique des BLEC par un essai de perméabilité à l’aide de marqueurs d’intégrité BBB de différents poids moléculaires, comme la fluorescéine de sodium (NaF) et le dextran 20 kDa (FD20) (voir le tableau des matériaux).
- Fonctionnalité de la pompe à efflux
- Évaluer la fonctionnalité de la P-glycoprotéine (P-gp) et de la protéine de résistance au cancer du sein (BCRP) en mesurant l’accumulation intracellulaire de Rhodamine 123 (R123) avec et sans Elacridar, un inhibiteur de P-gp et BCRP (voir le tableau des matières).
NOTE: L’expérience peut être réalisée selon la procédure décrite dans Deligne et al.23.
- Évaluer la fonctionnalité de la P-glycoprotéine (P-gp) et de la protéine de résistance au cancer du sein (BCRP) en mesurant l’accumulation intracellulaire de Rhodamine 123 (R123) avec et sans Elacridar, un inhibiteur de P-gp et BCRP (voir le tableau des matières).
- Expressions des gènes et des protéines
- Effectuer le prélèvement d’échantillons de gènes et de protéines sur de la glace après un lavage rapide avec du Ringer HEPES (HR) froid (Tableau 1) des cellules. Avant le prélèvement de l’échantillon CE, gratter les péricytes des filtres à insert inversés20.
4. Transport de nanogel
REMARQUE : Pour estimer le passage des nanogels polymères (NG) du compartiment luminal au compartiment abluminal du modèle BLEC en triculture, 0,1 mg/mL de solution de GN a été ajouté au jour 6 sur le compartiment luminal pendant 24 h. Les NG étudiés étaient des hydrogels à base de N-isopropylacrylamide (NIPAM) marqués par fluorescence d’une taille moyenne de 8 à 10 nm (voir le tableau des matériaux).
- Peser la poudre de nanogel et la solubiliser dans une ECM à une concentration de 1 mg/mL. Sonicer la solution pendant 10 min et filtrer à l’aide d’un filtre PTFE de 0,2 μm.
NOTE: Préparer une solution de NG fraîche le jour de l’expérience. - Changez le milieu dans le compartiment luminal et ajoutez 50 μL de solution de GN dans le compartiment supérieur pour une concentration finale de 0,1 mg/mL.
NOTE: Effectuer une dilution de 1:10 à partir de la solution d’origine. - Après 24 h d’incubation, prélever les aliquotes des compartiments luminal (20 μL) et abluminal (200 μL) et les placer dans une plaque noire de 96 puits.
- Quantifier la fluorescence à l’aide d’un lecteur fluorescent multiplaque (voir le tableau des matériaux) avec une plaque noire à 96 puits en réglant les longueurs d’onde d’excitation/émission à 477/540 nm. Calculer le pourcentage de croisement par rapport à la solution de travail initiale ajoutée au temps = 0 h (t0)6,15.
REMARQUE : Pour préparer la plaque à 96 puits pour la mesure de fluorescence, ajouter 200 μL de solution du compartiment abluminal et 20 μL de solution du compartiment luminal et préparation t0 (ajouter 180 μL d’ECM pour atteindre un volume final de 200 μL). Inclure également une courbe d’étalonnage et un blanc sur la plaque de lecture. Paramètres instrumentaux: Méthode de détection - Fluorescence, Position optique - Haut, Type de lecture - Extrémité, Longueur d’onde d’excitation - 477 nm, Longueur d’onde d’émission - 540 nm, Sensibilité - 100, Secouer - Double orbitale pendant 5 s.
Résultats
Mise en place du modèle de la triple culture humaine BBB
Le protocole requis pour la mise en place du modèle in vitro humain de BHE est décrit à la figure 1 et comprend des étapes successives dont l’ordre doit être strictement respecté. Tout d’abord, les trois types de cellules sont cultivés individuellement dans des boîtes de culture cellulaire (Figure 1A) avant d’être assemblés dans un système de filtre à insert. Le cadre de triple culture commence par l’ensemencement du premier type de cellule, les astrocytes, dans le puits de fond pré-enrobé. Le lendemain, les péricytes et les EC sont ensemencés sur les surfaces abluminales et luminales pré-revêtues du filtre à insert, respectivement. Le filtre d’insertion est ensuite transféré sur les astrocytes. Le modèle est maintenu en culture pendant 6 jours, le temps nécessaire pour induire les propriétés de la BHE dans les CE, avec un renouvellement de milieu tous les deux jours selon le modèle de co-culture breveté24. Les CE sont ensuite rebaptisées BLEC (figure 1B).
Caractérisation du modèle de BHE humaine
Le modèle de culture triple cellulaire a été caractérisé pour la présence d’un ensemble de propriétés spécifiques à la BHE. Tout d’abord, les données d’immunocytochimie ont confirmé l’expression de marqueurs conventionnels tels que le récepteur β du facteur de croissance dérivé des plaquettes (PDGFR-β)25,26 et la desmine pour les péricytes et la protéine acide fibrillaire gliale (GFAP)26 pour les astrocytes (Figure 2A). Ainsi, après les 6 jours de culture avec les péricytes et les astrocytes, la monocouche de BLECs, visualisée avec la coloration de la jonction adhérente de VE-Cadhérine, présente une localisation continue des protéines TJ, Claudin-5 et ZO-1, aux frontières cellulaires (Figure 2A). La mise en place des TJ est corrélée avec de faibles coefficients de perméabilité paracellulaire mesurés à l’aide de marqueurs d’intégrité BBB de faible poids moléculaire, c’est-à-dire NaF (376 Da)16,27 et de poids moléculaire élevé, c’est-à-dire FD20 (20 kDa)27, comme le montre la figure 2B. Les valeurs mesurées sont comparables à celles de modèles in vitro validés de BHE utilisant la source exacte des CEs23,24,28. Dans l’ensemble, ces résultats mettent en évidence la faible perméabilité paracellulaire de la monocouche BLEC à triple culture, caractéristique de la BHE in vivo. De plus, l’accumulation intracellulaire de R123 dans les BLEC a montré une augmentation significative de la présence de l’inhibiteur de la pompe à efflux Elacridar 23,24 par rapport à la condition de contrôle avec son absence (Figure 2C). Cela indique la présence de molécules actives de pompe à efflux, à savoir P-gp et BCRP, dans les BLEC.
Pour caractériser davantage les BLEC, l’expression génique et le niveau protéique des principales caractéristiques de la BHE ont été étudiés (Figure 3). Les données obtenues avec le modèle de triple culture ont été comparées au modèle de co-culture validé et breveté composé de CE et de péricytes24 utilisé comme modèle de contrôle. Les astrocytes représentent le troisième type de cellule ajouté dans le modèle de co-culture initial dans le modèle de triple culture. Par conséquent, l’analyse de l’expression génique (Figure 3A) des BLEC à triple culture, par rapport aux BLEC de co-culture, a montré le maintien de l’expression de caractéristiques clés de la BHE telles que les protéines TJ (claudin-5 et zonula occludens-1) et les pompes d’efflux (P-gp et BCRP), et la régulation positive des transporteurs de BHE (transporteur de glucose 1) et des récepteurs (récepteur de la transferrine) les plus étudiés. Les données de quantification des protéines (figure 3B) se sont avérées conformes aux résultats transcriptionnels. Dans l’ensemble, ces données soutiennent l’induction positive des propriétés de la BHE dans la couche BLEC à triple culture similaire au modèle de co-culture validé. Dans l’ensemble, le modèle de triple culture affiche les propriétés physiques et métaboliques requises pour qu’un système microphysiologique in vitro modélise la BHE.
Applicabilité aux stratégies d’administration de médicaments - mesure du transport des nanogels
Pour évaluer la possibilité d’utiliser le modèle de triple culture pour étudier de nouvelles stratégies d’administration cérébrale, le transport de NG neutres à base de NIPAM marqués par fluorescence a été évalué 6,15. Au temps 0, les GN ont été placés dans le compartiment luminal à une concentration de 0,1 mg/mL (figure 4A). Après 24 h d’incubation, 5,82 % des NG ont été retrouvés dans le compartiment abluminal (Figure 4B), prouvant leur capacité à traverser les BLEC.
Les résultats démontrent la pertinence du modèle pour mesurer la perméabilité de composés de petite et de grande taille, comme décrit avec les marqueurs d’intégrité, et évaluer le transport de nanomatériaux tels que les NG polymères.
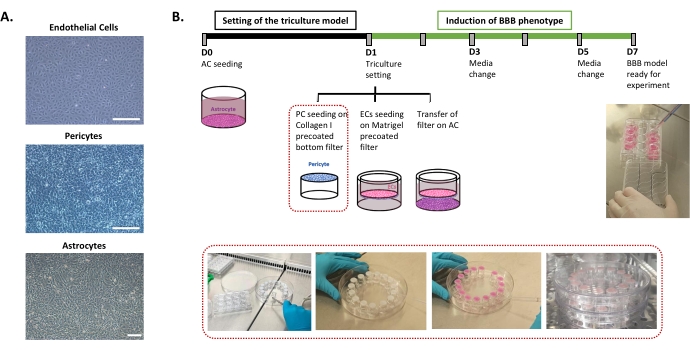
Figure 1 : Représentation des étapes critiques pour la mise en place du modèle in vitro de triple culture de la BHE humaine. (A) Images à contraste de phase des trois composants cellulaires du modèle BBB : cellules endothéliales (EC), péricytes (PC) et astrocytes (AC). Barre d’échelle = 250 μm. (B) Chronologie schématique et illustrative pour la mise en place du modèle in vitro humain de BHE à triple culture. La zone en surbrillance représente la procédure de revêtement du filtre à insert inversé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
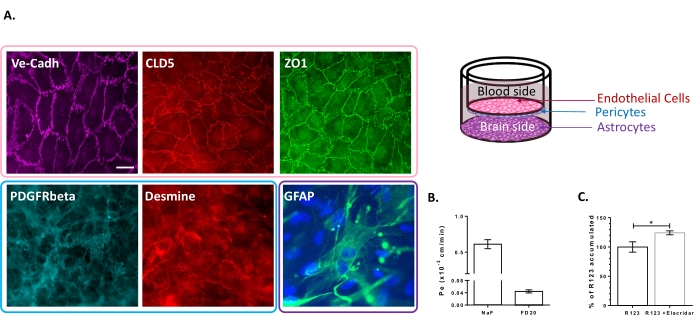
Figure 2 : Évaluation des propriétés du modèle BBB à triple culture. (A) Images représentatives d’immunomarquage des marqueurs distinctifs des BLEC (Claudin-5: CLD5, Zona Occludens-1: ZO1 et VE-Cadhérine: Ve-Cadh), des péricytes (Platelet-Derived Growth Factor Receptor-β: PDGFR-β et desmin) et des astrocytes (Glial Fibrillary Acidic Protein: GFAP). Barre d’échelle = 10 μm. (B) Perméabilité paracellulaire des BLEC aux marqueurs d’intégrité de la BHE fluorescente, à la fluorescéine de sodium (NaF, 376 Da, Pe: 0,61 ± 0,062) et au FITC-Dextran (FD20, 20 kDa, Pe: 0,04 ± 0,005). N = 3; n = 9. La fonctionnalité moyenne ± SEM. (C) P-gp et BCRP dans les CE a été évaluée en quantifiant la R123 intracellulaire avec (124,2% ± 3,39%) et sans (100% ± 8,79%) Elacridar. N = 4; n = 12. Moyenne ± SEM. p = 0,017 en utilisant un test t non apparié. Veuillez cliquer ici pour voir une version agrandie de cette figure.
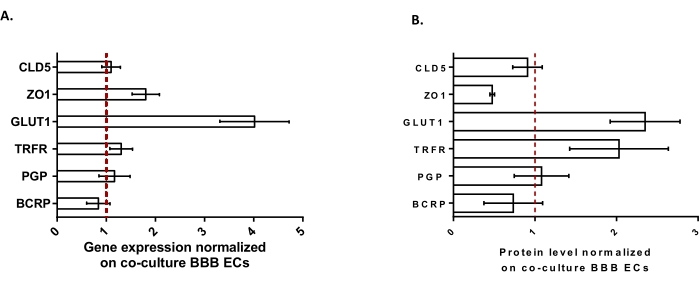
Figure 3 : Évaluation de l’expression génique BLEC et du niveau protéique de marqueurs distinctifs dans le modèle de triple culture par rapport au modèle de co-culture BBB. (A) Expression génique de protéines à jonction serrée (Claudin-5: CLD5 et Zona Occludens-1: ZO1), de transporteurs (Glucose Transporter-1: GLUT1, P-glycoprotéine: PGP et Breast Cancer Resistance Protein: BCRP) et de grandes molécules récepteurs (Transferrin Receptor: TRFR), normalisées par l’expression de RPLP0. N = 3; n = 9. (B) Niveau protéique des protéines à jonction serrée (CLD5 et ZO1), des transporteurs (GLUT1, PGP et BCRP) et des récepteurs à grandes molécules (TRFR), normalisé par l’expression de la β-actine. N = 3; n = 9. Moyenne ± SEM. Pour (A) et (B), les valeurs >1 correspondent à des niveaux plus élevés d’expression génique ou de protéines dans le modèle de triple culture. La ligne rouge correspond à une valeur de 1 où le niveau d’expression (gènes ou protéines) des deux modèles est équivalent. Veuillez cliquer ici pour voir une version agrandie de cette figure.
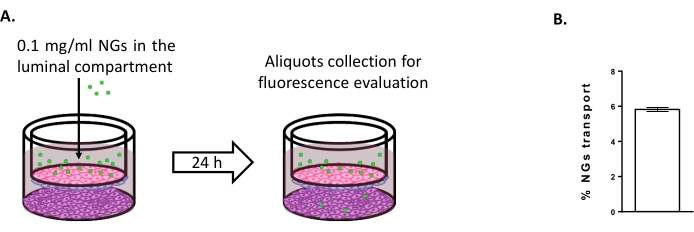
Figure 4 : Mesure du transport des nanogels dans le modèle de triple culture. (A) Représentation schématique de l’essai de transport du nanogel. (B) Pourcentage de transport de nanogel après 24 h d’incubation dans le modèle de triple culture (5,82% ± 0,09%). N = 2; n = 6. Moyenne ± SEM. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Nom de la mémoire tampon | Composition | Note | ||||
| Masse moléculaire | ||||||
| Tampon phosphate salin, sans calcium magnésium | PBS-FMC | NaCl | 8 g/L | 58.4 | Ajouter tout le composé à l’eau stérile et attendre la solubilisation complète. Le pH de la solution obtenue doit être compris entre 7,3 et 7,4. Filtrer la solution à l’aide d’une membrane de 0,22 μm et conserver la solution stérile à 4 °C. | |
| Kcl | 0,2 g/L | 74.55 | ||||
| KH2PO4 | 0,2 g/L | 136.09 | ||||
| NaHPO4-12 H2O | 2,87 g/L | 358.14 | ||||
| Eau | ||||||
| Sonneur HEPES | L’humidité relative | NaCl | 8,8 g/L | 58.4 | Ajouter tout le composé à de l’eau stérile et attendre la solublisation complète. Ajuster le pH à 7,4 (pH de la solution de départ autour de 6,8). Filtrer la solution à l’aide d’une membrane de 0,22 μm et conserver la solution stérile à 4 °C. | |
| Kcl | 0,387 g/L | 74.55 | ||||
| CaCl2 | 0,244 g/L | 110.99 | ||||
| MgCl 2 6H2 O | 0,0406 g/L | 203.3 | ||||
| NaHCO3 | 0,504 g/L | 84.1 | ||||
| HEPES | 1,19 g/L | 238.3 | ||||
| Glucose | 0,504 g/L | 180.16 | ||||
| Eau | ||||||
Tableau 1 : Composition des différents tampons utilisés dans le protocole.
Discussion
Le traitement des maladies du cerveau reste un défi compte tenu de la difficulté des médicaments à franchir la BHE pour atteindre leurs cibles cellulaires et moléculaires dans le parenchyme cérébral.
Le développement de médicaments pour les maladies du cerveau présente actuellement un faible taux de réussite, car la plupart des médicaments présentant des résultats prometteurs dans les modèles précliniques n’ont montré aucun avantage lorsqu’ils sont utilisés en clinique. Suivant la « règle des 3R », qui vise à réduire le nombre d’animaux utilisés pour l’expérimentation, des modèles in vitro de la BHE sont développés pour étudier les pathologies cérébrales et prédire la pénétration cérébrale des médicaments29. Des modèles in vitro de BHE ont principalement été développés à partir de cellules animales et sont devenus plus sophistiqués pour améliorer la pertinence des résultats obtenus16. Une des avancées significatives dans l’utilisation des cellules humaines, qui apporte indéniablement de nouvelles connaissances et plus de spécificité, aux niveaux cellulaire et moléculaire, pour étudier les mécanismes de la maladie humaine16. Cependant, le développement de modèles pertinents nécessite de considérer l’amélioration des paramètres de modèles in vitro de la BHE et les connaissances qui en découlent, grâce aux modèles animaux. Par conséquent, il doit tenir compte de la complexité de l’architecture de la BHE et de l’importance des communications cellule-cellule pour étudier la BHE dans des conditions physiologiques et pathologiques30.
Le protocole présenté ici décrit une méthode pour mettre en place un modèle humain complet de BHE in vitro comprenant les trois principaux types cellulaires de la BHE, sans limitation d’accès au tissu cérébral. En tant que système à cellules multiples, l’induction et le maintien des propriétés de la BHE, sans l’utilisation artificielle de composés de serrage, mais plutôt induits par les communications cellule-cellule sont plus pertinents physiologiquement et conformes à l’induction in vivo des propriétés de la BHE31. Par conséquent, le respect de la chronologie du protocole est d’une importance primordiale pour le succès du protocole. De plus, les temps d’incubation lors de la mise en culture triple et une fois les trois types de cellules assemblés représentent les principales étapes critiques du protocole.
Les propriétés de la BHE dans les CE sont induites par la co-culture avec des péricytes, comme décrit pour le modèle de co-culture24. Par conséquent, la culture des péricytes au verso du filtre d’insertion est le point le plus critique et nécessite de suivre strictement le protocole au risque de ne pas avoir assez de péricytes pour l’induction des propriétés de la BHE. Tout d’abord, lors de la procédure d’enrobage et de l’ensemencement cellulaire, il faut veiller à ne pas mettre le couvercle de la boîte de Petri en contact avec le revêtement et aussi le milieu une fois les cellules ensemencées pour assurer un bon revêtement du filtre et ne pas perdre de cellules (étapes 2.2.1 et 2.2.4). De plus, une fois les péricytes ensemencés, il est indispensable d’attendre le temps indiqué pour la fixation des péricytes (étape 2.2.4) avant de retourner le filtre d’insertion pour l’enrobage et l’ensemencement des EC de l’autre côté (étapes 2.2.5 et 2.3). Une fois ensemencé, six jours sont nécessaires pour induire les propriétés de la BHE par le biais de communications cellule-cellule (étape 2.4).
Le modèle est validé en termes de perméabilité restreinte (associée à la mise en place des jonctions serrées) puisque les CE du modèle de triple culture affichent des valeurs de perméabilité à des marqueurs d’intégrité BBB similaires au modèle de co-culture validé et également mesurées dans des modèles animaux ou humains validés 16,27,32. De plus, la validation d’un modèle de BHE in vitro nécessite, outre la perméabilité restreinte, la réactivité à d’autres types cellulaires de la NVU et l’expression de récepteurs et de transporteurs fonctionnels16. De plus, le modèle est reproductible et produit plusieurs filtres à insert et puits pour effectuer de nombreuses analyses (expression génique et protéique, coloration fluorescente, tests de toxicité) sur chaque type de cellule séparément sans nécessiter de méthode de tri cellulaire.
Le modèle a été développé à l’aide d’un filtre de taille de pores de 0,4 μm pour avoir un type de cellule de chaque côté du filtre à insertion. Le système de filtre à insertion a permis d’étudier les communications cellule-cellule dans des conditions physiologiques en les transférant sur des astrocytes bien contenants. La présence d’astrocytes dans le système représente une valeur plus par rapport à la co-culture initiale in vitro modèle24. En effet, compte tenu de l’importance des astrocytes dans la physiologie de la BHE, ce troisième type de cellule permet de mieux comprendre les communications cellule-cellule au sein de la BHE. De plus, le système de culture triple cellulaire peut également être étudié dans des conditions pathologiques telles que les accidents vasculaires cérébraux, dans lesquels les astrocytes jouent un rôle essentiel33,34,35. En outre, la conception des BLEC / péricytes des deux côtés du filtre d’insertion peut facilement être placée sur d’autres types de cellules pour imiter des conditions pathologiques telles que le cancer du cerveau23.
La taille des pores du filtre d’insertion peut entraîner des limitations avec certaines expériences, telles que la transmigration cellulaire à travers la BHE. Cependant, le développement du modèle avec une taille de pores plus grande nécessite l’adaptation du protocole pour assurer la formation d’une monocouche physiologique d’EC et non de couches multiples, ce qui n’est pas physiologiquement pertinent pour imiter la BBB36.
L’applicabilité du modèle a été démontrée à l’aide d’expériences de transport NG montrant la possibilité de faire une expérience de transport en utilisant un système multicellulaire. Néanmoins, il faut être conscient des difficultés d’avoir un composé ou une molécule de contrôle pour l’expérience de transport, partageant des propriétés comparables avec les NG puisque chaque nanostructure présente un ensemble unique de propriétés (poids moléculaire, charge, forme, propriétés physiques, formation de corona protéique).
L’une des limites du modèle est l’absence de contrainte de cisaillement, dont il a été démontré qu’elle influençait la différenciation des EC et l’expression des protéines TJ37. Cependant, le développement d’un système fluidique imitant le capillaire cérébral est difficile compte tenu de la complexité de l’ajout d’une partie fluidique, nécessitant un dispositif spécifique, dans un système à plusieurs cellules. De plus, le dispositif particulier n’est généralement pas disponible dans le commerce et ne permet pas de nombreuses réplications, ce qui rend les systèmes fluidiques moins adaptés à une utilisation à haut débit.
En résumé, ce système de triple culture constitué de cellules humaines reproduit in vitro l’architecture de la BHE. Il permet la génération de nombreux inserts qui peuvent être utilisés pour un criblage approfondi des composés.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas de conflit d’intérêts.
Remerciements
Ce travail est accordé par le programme de recherche et d’innovation Horizon 2020 de l’Union européenne dans le cadre de la convention de subvention n ° 764958, dans le cadre du projet NANOSTEM, un réseau de formation innovante Marie Skłodowska-Curie (ITN) (Fellowship Eleonora Rizzi). Cette étude est accordée par le Conseil régional du Nord-Pas-de-Calais (Bourse à Clémence Deligne), la Société Française de lutte contre les Cancers et les leucémies de l’Enfant et de l’adolescent (SFCE), l’Association « l’étoile de Martin » et l’Association « Cassandra contre la leucémie ».
matériels
| Name | Company | Catalog Number | Comments |
| Cell Culture | |||
| Astocyte Medium (AM) | ScienCell | 1801 | |
| Astrocyte Growth Supplement | ScienCell | 1852 | Astrocyte Growth Supplement is provided in the AM set. |
| Cell culture dish 100 mm | Corning | 430293 | 100 mm x 20 mm; dish used for the thawing of ECs and PCs before the triculture setting |
| Cell culture dish 150 mm | Corning | 430599 | The height of these dishes (25 mm) allows the seeding of PCs in the reverted insert for the setting of the triculture model. |
| Collagen I | Corning | 354236 | Rat tail |
| Dulbecco's Modified Eagle Medium | Gibco | 31600-083 | Powder |
| Endothelial Cell Growth Supplement | ScienCell | 1051 | Endothelial Cell Growth Supplement is provided in the ECM set. |
| Endothelial Cell Medium (ECM) | ScienCell | 1001 | |
| Fetal Calf Serum | Sigma | F7524 | |
| Gelatin | Sigma | G2500 | 2% gelatin from porcine skin in PBS-CMF |
| Gentamicin | BiochromA6 | A-2712 | |
| Glucose | Sigma | G6152 | Powder |
| Glutamine | Merck | 1002891000 | |
| Human Brain Cortex Astrocytes | ScienCell | 1800-SC | |
| Malassez cell counting chamber | vWR | HECH40453702 | The count was performed manually. |
| Matrigel | Corning | 354230 | Extracellular matrix-based hydrogel |
| Penicillin/Streptomycin | ScienCell | 0503 | Penicillin/Streptomycin solution is provided in the ECM and AM sets. |
| Poly-L-lysine | ScienCell | 0413 | |
| Steritop | Millipore System | SCGPT0SRE | 0.22 µm pore size |
| Transwell insert | Corning | 3401 | 0.4 µm pore polycarbonate filter |
| Trypsin/EDTA neutralization solution | ScienCell | 0113 | |
| Trypsin/EDTA solution | ScienCell | 0103 | |
| Immunocytochemistry | |||
| SEA BLOCK blocking buffer | ThermoScientific | 37527 | |
| Alexa Fluor 568 anti-Mouse secondary antibody | Thermofisher | A11031 | Dilution 1:500 |
| Alexa Fluor 568 anti-Rabbit secondary antibody | Thermofisher | A11036 | Dilution 1:500 |
| Anti-Claudin-5 primary antibody | InVitrogen | 34-1600 | Dilution 1:100 |
| Anti-Desmin primary antibody | Abcam | ab6322 | Dilution 1:200 |
| Anti-Glial Fibrillary Acidic Protein primary antibody | Dako | Z0334 | Dilution 1:500 |
| Anti-Platelet-Derived Growth Factor-β primary antibody | Abcam | ab51090 | Dilution 1:200 |
| Anti-VE-cadherin primary antibody | Abcam | ab207732 | Dilution 1:200 |
| Anti-Zona Occludens-1 primary antibody | InVitrogen | 61-7300 | Dilution 1:200 |
| Normal Goat Serum | Sigma | G6767 | |
| ProLong Diamond Antifade Mountant with DAPI | Invitrogen | P36962 | |
| Gene expression | |||
| NucleoSpin Rna/Protein Macherey Nagel Kit | Macherey-Nagel | 740,933,250 | |
| 96 multiplate well | Biorad | HSP9601 | |
| iSCRIPT | Biorad | 1708841 | |
| Sealer sheet | Biorad | MSB1001 | |
| SsoFast EvaGreen Supermix | Biorad | 172-5201 | |
| Protein expression | |||
| 2x Laemli Sample Buffer | Biorad | 161-0737 | Add 50 µL of bMercaptoetanol to 950 µL of Laemmli Buffer and store at -20°C. Dilute 1:1 with the protein sample for the assay. |
| Anti-Breast Cancer Resistance Protein primary antibody | Abcam | ab207732 | Pre-treatment 15 minutes at RT under agitation; dilution 1:1000, O.N. at 4°C |
| Anti-Claudin-5 primary antibody | Abcam | ab15106 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Glucose Transporter 1 primary antibody | Millipore | 07-1401 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Mouse secondary antibody | Dako | P0447 | Dilution 1:5000 in TBS-Tween |
| Anti-P-glycoprotein primary antibody | Genetex | GTX23364 | Pre-treatment 15 minutes at RT under agitation; dilution 1:400, 3 hours at RT |
| Anti-Rabbit secondary antibody | Dako | P0448 | Dilution 1:8000 in TBS-Tween |
| Anti-Transferrin Receptor primary antibody | Abcam | ab84036 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Anti-Zona occludens-1 primary antibody | Abcam | ab216880 | Pre-treatment 5 minutes at 95°C; dilution 1:1000, O.N. at 4°C |
| Criterion TGX Gel | Biorad | 5678083 | |
| ECL Prime Solution | Amersham | RPN2236 | Revelation solution to keep in the dark |
| Phospatase inhibitor cocktail 2 | Sigma | P5726 | |
| Phospatase inhibitor cocktail 3 | Sigma | P0044 | |
| Protease Inhibitor | Sigma | P8340 | |
| Protein Standards | Biorad | 161-0373 | Molecular weight markers |
| RIPA 10x | Millipore | 20-188 | |
| TBS 10x | Biorad | 1706435 | |
| TRIS-Glycine | Biorad | 1610771 | |
| Tween | Biorad | 1706531 | |
| BBB integrity assay | |||
| Sodium Fluorescein | Ampresco | 0681 | λex= 490 nm; λem= 525 nm |
| Elacridar | Sigma | SML0486 | GF120918 |
| FITC-Dextran 20 kDa | Sigma | FD-20S | λex= 490 nm; λem= 525 nm |
| Rhodamine 123 | Sigma | R8004 | λex= 501 nm; λem= 538 nm |
| SynergyTM H1 | BioTek Instruments | Fluorescent multiplate reader | |
| Nanogel Transport | |||
| Syringe | Terumo | SS+01T1 | 1 mL syringe |
| Filter | FisherScientific | 15161499 | 0.2 µm PTFE membrane filter, 15 mm diameter |
| N-Isopropylacrylamide (NIPAM)-based hydrogels | The nanogels (NGs) used in the study are provided by our collaborator in Queen Mary University London, Department of Chemistry. The NGs are covalently tagged with a fluorescent molecule (λex= 477 nm; λem= 540 nm). NGs are freeze dried and shipped as powder, in this state they are stable at room temperature for long period of time. |
Références
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37, 13-25 (2010).
- Profaci, C. P., Munji, R. N., Pulido, R. S., Daneman, R. The blood-brain barrier in health and disease: Important unanswered questions. The Journal of Experimental Medicine. 217 (4), 20190062 (2020).
- Abbott, N. J. Blood-brain barrier structure and function and the challenges for CNS drug delivery. Journal of Inherited Metabolic Disease. 36 (3), 437-449 (2013).
- Kreuter, J. Drug delivery to the central nervous system by polymeric nanoparticles: What do we know. Advanced Drug Delivery Reviews. 71, 2-14 (2014).
- Zhang, W., Mehta, A., Tong, Z., Esser, L. . L.Advanced science. 8 (10), 2003937 (2021).
- Vashist, A., et al. Nanogels as potential drug nanocarriers for CNS drug delivery. Drug Discovery Today. 23 (7), 1436-1443 (2018).
- Lombardo, S. M., Schneider, M., Türeli, A. E., Günday Türeli, N. Key for crossing the BBB with nanoparticles: The rational design. Beilstein Journal of Nanotechnology. 11, 866-883 (2020).
- Bernardo-Castro, S., et al. Therapeutic nanoparticles for the different phases of ischemic stroke. Life. 11 (6), 482 (2021).
- Salinas, Y., Castilla, A. M., Resmini, M. An L-proline based thermoresponsive and pH-switchable nanogel as a drug delivery vehicle. Polymer Chemistry. 9 (17), 2271-2280 (2018).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353 (2019).
- Preman, N. K., Jain, S., Johnson, R. P. ”Smart” polymer nanogels as pharmaceutical carriers: A versatile platform for programmed delivery and diagnostics. ACS Omega. 6 (8), 5075-5090 (2021).
- Cuggino, J. C., Blanco, E. R. O., Gugliotta, L. M., Alvarez Igarzabal, C. I., Calderón, M. Crossing biological barriers with nanogels to improve drug delivery performance. Journal of Controlled Release Official Journal of the Controlled Release Society. 307, 221-246 (2019).
- Basso, J., et al. Hydrogel-based drug delivery nanosystems for the treatment of brain tumors. Gels. 4 (3), 62 (2018).
- Harilal, S., et al. Revisiting the blood-brain barrier: A hard nut to crack in the transportation of drug molecules. Brain Research Bulletin. 160, 121-140 (2020).
- Papadimitriou, S. A., Robin, M. P., Ceric, D., O'Reilly, R. K., Marino, S., Resmini, M. Fluorescent polymeric nanovehicles for neural stem cell modulation. Nanoscale. 8 (39), 17340-17349 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Cecchelli, R., et al. Modelling of the blood-brain barrier in drug discovery and development. Nature Reviews Drug Discovery. 6 (8), 650-661 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. An overview of in vitro techniques for blood-brain barrier studies. Methods in Molecular Medicine. 89, 307-324 (2003).
- Shimizu, F., et al. Peripheral nerve pericytes modify the blood-nerve barrier function and tight junctional molecules through the secretion of various soluble factors. Journal of Cellular Physiology. 226 (1), 255-266 (2011).
- Pedroso, D. C., et al. Improved survival, vascular differentiation and wound healing potential of stem cells co-cultured with endothelial cells. PLoS One. 6 (1), 16114 (2011).
- Kanda, T., Iwasaki, T., Yamawaki, M., Ikeda, K. Isolation and culture of bovine endothelial cells of endoneurial origin. Journal of Neuroscience Research. 49 (6), 769-777 (1997).
- Data sheet on human astrocytes culture. Technical resources from ScienCell Available from: https://www.sciencellonline.com/human-astrocytes.html#product_tabs_technicalresources (2021)
- Deligne, C., et al. Development of a human in vitro blood-brain tumor barrier model of diffuse intrinsic pontine glioma to better understand the chemoresistance. Fluids and Barriers of the CNS. 17 (1), 37 (2020).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), 99733 (2014).
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-Brain Barrier: From physiology to disease and back. Physiological Reviews. 99 (1), 21-78 (2019).
- Daneman, R., Prat, A. The Blood-Brain Barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), 020412 (2015).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability studies on in vitro blood-brain barrier models: Physiology, pathology, and pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Heymans, M., Figueiredo, R., Dehouck, L., Francisco, D., Sano, Y., Shimizu, F., Kanda, T., Bruggmann, R., Engelhardt, B., Winter, P., Gosselet, F., Maxime, C. Contribution of brain pericytes in blood-brain barrier formation and maintenance: A transcriptomic study of co-cultured human endothelial cells derived from hematopoietic stem cells. Fluids Barriers CNS. 17, 48 (2020).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Neuhaus, W. In Vitro Models of the Blood-Brain Barrier. Handbook of Experimental Pharmacology. 265, 75-110 (2021).
- Hoheisel, D., Nitz, T., Franke, H., Wegener, J., Hakvoort, A., Tilling, T., Galla, H. J. Hydrocortisone reinforces the blood-brain properties in a serum free cell culture system. Biochemical and Biophysical Research Communications. 247 (2), 312-315 (1998).
- Drolez, A., et al. Selection of a relevant in vitro blood-brain barrier model to investigate pro-metastatic features of human breast cancer cell lines. PloS One. 11 (3), 0151155 (2016).
- Neuhaus, W., Gaiser, F., Mahringer, A., Franz, J., Riethmüller, C., Förster, C. The pivotal role of astrocytes in an in vitro stroke model of the blood-brain barrier. Frontiers in Cellular Neuroscience. 8, 352 (2014).
- Mysiorek, C., et al. Peroxisome proliferator-activated receptor-α activation protects brain capillary endothelial cells from oxygen-glucose deprivation-induced hyperpermeability in the blood-brain barrier. Current Neurovascular Research. 6 (3), 181-193 (2009).
- Culot, M., et al. Cerebrovascular protection as a possible mechanism for the protective effects of NXY-059 in preclinical models: An in vitro study. Brain Research. 1294, 144-152 (2009).
- Vandenhaute, E., Drolez, A., Sevin, E., Gosselet, F., Mysiorek, C., Dehouck, M. -. P. Adapting co-culture in vitro models of the blood-brain barrier for use in cancer research: Maintaining an appropriate endothelial monolayer for the assessment of transendothelial migration. Laboratory Investigation. 96 (5), 588-598 (2016).
- Cucullo, L., Hossain, M., Puvenna, V., Marchi, N., Janigro, D. The role of shear stress in Blood-Brain Barrier endothelial physiology. BMC Neuroscience. 12, 40 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon