A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
DetectSyn: طريقة فلورسنت سريعة وغير متحيزة للكشف عن التغيرات في كثافة المشبك
In This Article
Summary
DetectSyn هو اختبار فلورسنت سريع وغير متحيز يقيس التغيرات في عدد المشبك النسبي (المشاركة قبل وبعد المشبكي) عبر العلاجات أو الحالات المرضية. تستخدم هذه التقنية تقنية ربط القرب التي يمكن استخدامها في كل من الخلايا العصبية المستزرعة والأنسجة الثابتة.
Abstract
نقاط الاشتباك العصبي هي موقع التواصل بين الخلايا العصبية. ترتبط قوة الدائرة العصبية بالكثافة المشبكية ، وانهيار نقاط الاشتباك العصبي هو سمة من سمات الحالات المرضية مثل الاضطراب الاكتئابي الرئيسي (MDD) ومرض الزهايمر. تشمل التقنيات التقليدية للتحقيق في أعداد المشبك التعبير الجيني لعلامات الفلورسنت (على سبيل المثال ، بروتين الفلورسنت الأخضر (GFP)) ، والأصباغ التي تملأ الخلايا العصبية (على سبيل المثال ، صبغة الكربوسيانين ، DiI) ، والكشف عن الفلورسنت المناعي لعلامات العمود الفقري (على سبيل المثال ، كثافة ما بعد المشبكي 95 (PSD95)). أحد التحذيرات الرئيسية لهذه التقنيات الوكيلة هو أنها تحدد فقط التغييرات ما بعد المشبكية. ومع ذلك ، فإن المشبك هو اتصال بين محطة ما قبل المشبكي والعمود الفقري ما بعد المشبكي. يتطلب المعيار الذهبي لقياس تكوين / إزالة المشبك الداخلي إجراء مجهر إلكتروني مستهلك للوقت أو تقنيات التصوير المقطعي المصفوفي. وتتطلب هذه التقنيات تدريبا متخصصا ومعدات مكلفة. علاوة على ذلك ، يمكن تقييم عدد محدود فقط من الخلايا العصبية واستخدامها لتمثيل التغييرات في منطقة الدماغ بأكملها. DetectSyn هي تقنية فلورسنت سريعة تحدد التغييرات في تكوين المشبك العصبي أو القضاء عليه بسبب حالة مرضية أو نشاط دوائي. يستخدم DetectSyn مقايسة ربط القرب السريع للكشف عن البروتينات المتجاورة قبل وبعد المشبكي والمجهر الفلوري القياسي ، وهي تقنية متاحة بسهولة لمعظم المختبرات. يسمح الكشف الفلوري عن الثقب الناتج بتحليل سريع وغير متحيز للتجارب. يوفر DetectSyn نتائج أكثر تمثيلا من المجهر الإلكتروني لأنه يمكن تحليل مساحات أكبر من عدد محدود من الخلايا العصبية الفلورية. علاوة على ذلك ، يعمل DetectSyn على الخلايا العصبية المستزرعة في المختبر وشرائح الأنسجة الثابتة. أخيرا ، يتم توفير طريقة لتحليل البيانات التي تم جمعها من هذه التقنية. بشكل عام ، يقدم DetectSyn إجراء للكشف عن التغيرات النسبية في كثافة المشبك عبر العلاجات أو الحالات المرضية وهو أكثر سهولة من التقنيات التقليدية.
Introduction
نقاط الاشتباك العصبي هي الوحدة الأساسية للتواصل بين الخلايا العصبية1. العديد من نقاط الاشتباك العصبي بين الخلايا العصبية داخل نفس المناطق تؤدي إلى دوائر تتوسط السلوك2. تتكون المشابك العصبية من طرف ما قبل المشبكي من خلية عصبية واحدة تطلق ناقلات عصبية أو ببتيدات نيوروببتيدات تنقل المعلومات إلى مستقبلات ما بعد المشبكي لخلية عصبية أخرى. يحدد جمع الإشارات قبل المشبكي ما إذا كانت الخلايا العصبية ما بعد المشبكي ستطلق إمكانات عمل وتنشر الرسالة إلى الخلايا العصبية الأخرى.
ينشأ علم الأمراض المشبكي ، وهو انهيار نقاط الاشتباك العصبي ، في الأمراض والاضطرابات التي تتميز بانخفاض الحجم العصبي ، مثل مرض الزهايمر والاضطراب الاكتئابي الرئيسي ، مما يؤدي إلى دوائر لم تعد تؤدي على النحو الأمثل3،4،5. من المحتمل أن تكون استعادة كثافة المشبك الداخلي وراء فعالية العلاجات المحتملة لهذه الاضطرابات. على سبيل المثال ، ثبت مؤخرا أن زيادة نقاط الاشتباك العصبي تكمن وراء الفعالية السلوكية لمضادات الاكتئاب السريعة6. لفحص علاجات التشابك العصبي المحتملة بسرعة، يحتاج الباحثون إلى تقنيات تحدد بسرعة التغييرات في أرقام المشبك العصبي.
المنهجيات الحالية إما مستهلكة للوقت ومكلفة (المجهر الإلكتروني ، التصوير المقطعي المصفوفي) ، أو أنها تدرس فقط التغيرات ما بعد المشبكي دون دمج المشاركة قبل المشبكي (تحليلات العمود الفقري ، التألق المناعي / التوطين المشترك). تساعد الأصباغ مثل DiI أو البروتينات الفلورية مثل GFP على تصور الخلايا العصبية وتوصيف العمود الفقري بعد المشبكي. ومع ذلك ، يستخدم تحليل العمود الفقري النسب التي يحددها الباحث لتحديد المورفولوجيا ، والتي يمكن أن تقلل من قابلية التكاثر7. علاوة على ذلك ، لا يزال يتم الكشف عن كيفية ارتباط فئات العمود الفقري المختلفة بالمشابك الوظيفية8. يمكن أن يكون تكوين العمود الفقري عابرا وقد يعكس اللدونة ما بعد المشبكي ، ولكن يمكن القضاء على هذه العمود الفقري قبل الاستقرار في مشبك عصبي مع خلية عصبية ما قبل المشبكي9.
يوفر التوطين المشترك وكيلا أفضل للمشابك العصبية من تحليل العمود الفقري لأنه يمكن للمرء أن يصبغ المناعة للبروتينات قبل المشبكي وما بعد المشبكي. ومع ذلك ، قد تنتج البروتينات المشبكية قيم توطين مشتركة منخفضة لأن البروتينات متجاورة وقد لا تتداخل باستمرار. وبالتالي ، نظرا لأن البروتينات ليست متراكبة بالكامل ، فقد لا تقيس تقنيات التوطين المشترك بدقة التغييرات في تكوين المشبك العصبي بسبب هذه المعلومات المفقودة. أخيرا ، على الرغم من أن كل من المجهر الإلكتروني (EM) والتصوير المقطعي المصفوفي يوفران صورا عالية الدقة للمشابك العصبية ، إلا أنهما يستهلكان وقتا طويلا. يتطلب EM أيضا معدات متخصصة ، ويقتصر الباحثون على كميات صغيرة من الأنسجة لأي تجربة معينة. في حين أن التصوير المقطعي بالصفيف يوفر بأناقة القدرة على فحص العديد من البروتينات على أقسام رقيقة للغاية ويمكن دمجها مع EM10 ، فقد تكون هذه التقنية كثيفة العمالة للغاية وتتجاوز نطاق التجارب التي تحتاج إلى المسح السريع بحثا عن التغييرات في تكوين المشبك.
DetectSyn هو تطبيق محدد لفحص ربط القرب Duolink. يسمح فحص PLA بالكشف العام عن التفاعلات بين البروتين والبروتين. يقوم DetectSyn بسد المقاييس الوكيلة لما بعد المشبكي عن طريق تضخيم إشارة الفلورسنت المنبعثة من البروتينات الموسومة قبل وبعد المشبكي في غضون 40 نانومتر من بعضها البعض. إذا كانت البروتينات المشبكية في حدود 40 نانومتر ، كما هو الحال داخل شق متشابك ، فإن الأجسام المضادة الثانوية ، التي تحتوي على مجسات الحمض النووي ، سوف تهجن إلى حمض نووي دائري. يعبر هذا الحمض النووي الدائري الهجين عن مسبار فلورسنت ، يتم تضخيمه واكتشافه باستخدام تقنيات الفحص المجهري الفلوري القياسية (انظر الشكل 1). والأهم من ذلك، على عكس التصوير المقطعي الكهرومغناطيسي والتصوير المقطعي المصفوفي، أن هذه التقنية لا تتطلب معدات متخصصة وتستغرق نفس الوقت تقريبا مثل الكيمياء النسيجية المناعية القياسية. وبالتالي ، فإن إمكانية الوصول إلى هذه التقنية تمكن الباحثين خارج المؤسسات كثيفة البحث من المشاركة في أبحاث علم الأمراض العصبي. علاوة على ذلك ، يمكن لهذه التقنية فحص التغيرات في كثافة المشبكية في مناطق دماغية متعددة ضمن تجربة واحدة ، مما يوفر تمثيلا أكثر شمولية للتغيرات المشبكية بسبب المرض أو العلاج.
Protocol
تم عزل الخلايا والأنسجة عن الحيوانات وفقا لدليل المعاهد الوطنية للصحة لرعاية واستخدام المختبر والمعتمد من قبل لجنة ويك فورست المؤسسية لرعاية واستخدام الحيوانات
ملاحظة: يستخدم هذا البروتوكول على العينات التي تمت معالجتها بالفعل وتثبيتها وفقا لنماذج ومتطلبات تجريبية محددة. لأغراض العرض التوضيحي ، يتم استخدام تكوين المشبك العصبي بسبب العلاج السريع المضاد للاكتئاب لتسليط الضوء على تقنية الكشف عن المشبك6. سيتم استخدام الخلايا العصبية المستزرعة سابقا على أغطية ، ومعالجتها ، وتثبيتها في 4٪ paraformaldehyde (PFA) ، وتخزينها في 1x محلول ملحي مخزن بالفوسفات (PBS) لتسليط الضوء على الإجراءات في المختبر. سيتم استخدام أنسجة الحصين المقطعة سابقا (بسماكة 25 ميكرومتر) من الفئران المعالجة ، والتي تم دمجها عبر القلب باستخدام PBS البارد المثلج و 4٪ PFA ، ثم تخزينها في cryoprotectant لتسليط الضوء على إجراءات الشريحة. يرجى الاطلاع على11,12 لمزيد من المعلومات حول كيفية زراعة الخلايا العصبية أو القوارض عبر القلب. انظر الشكل 1 للحصول على تمثيل بياني لهذا الإجراء.
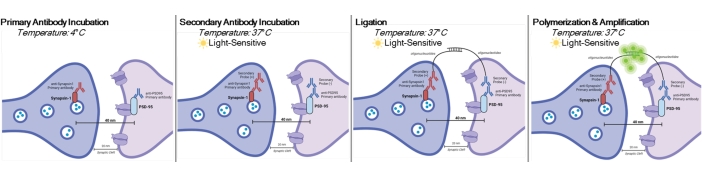
الشكل 1: التمثيل الرسومي لفحص DetectSyn. بعد اختراق أغشية الخلايا ، ترتبط الأجسام المضادة الأولية ل Synapsin1 و PSD95 بهذه البروتينات المتشابكة. ثم ترتبط الثانويات التي تحمل علامات oligonucleotide بالأجسام المضادة الأولية. إذا كان Synapsin1 و PSD95 في حدود 40 نانومتر ، كما هو الحال في المشبك ، فإن oligonucleotides تتفاعل ، ويتم تضخيم علامة الفلورسنت. يمكن بعد ذلك تصوير هذه الإشارة الفلورية عبر الفحص المجهري القياسي وتحليلها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. شطف العينات
- شطف العينات مع 500 ميكرولتر من 1x PBS + 0.75٪ الجلايسين لمدة 5 دقائق 3 مرات مع إثارة لطيفة على شاكر مداري لإزالة PFA المتبقية أو cryoprotectant.
2. كتلة واختراق العينات
- تحضير محلول الحجب والتخلل (10٪ مصل الحمير العادي ، 0.25٪ Tween 20) في 1x PBS. إعداد ما يكفي للاستخدام في الحضانة المحظورة والأولية والثانوية.
- إلى العينات (على سبيل المثال ، أغطية أو شرائح عائمة بحرية) في 24 لوحة بئر ، أضف 500 ميكرولتر من محلول الحجب والتغلغل. تأكد من أن كل بئر يحتوي على عينة مختلفة ويتم تصنيفه بشكل مناسب لمنع تبديل العينات.
- احتضان العينات في درجة حرارة الغرفة (RT) لمدة 60 دقيقة للخلايا المستزرعة أو 2 ساعة للأنسجة المقطعة. استخدم شاكر مداري للإثارة اللطيفة.
3. احتضان العينات في الأجسام المضادة الأولية
- تحضير الأجسام المضادة الأولية في المخزن المؤقت للحجب:
- تحضير كثافة ما بعد المشبكي 95 (PSD95 ؛ 1: 500 ، أرنب متعدد النسيلة) ، Synapsin1 (1: 500 ، أحادي النسيلة الفأر) ، MAP2 (1: 400 ، الدجاج متعدد النسيلة)
- قم بإعداد أليكوت عنصر تحكم سلبي يحذف أحد الأزواج المتشابكة (على سبيل المثال، بدون PSD95)
- قم بإزالة محلول الحجب بعناية باستخدام ماصة باستور البلاستيكية. حاول إزالة أكبر قدر ممكن دون إزعاج الخلايا أو تمزيق الأنسجة.
- للخلايا المستزرعة:
- خط طبق بتري بلاستيكي كبير مع بارافيلم. نقل بعناية أغطية إلى parafilm باستخدام ملقط.
- أضف بعناية 60 ميكرولتر من محلول الأجسام المضادة الأساسي إلى الجزء العلوي من الأغطية. تأكد من عدم انسكاب محلول الأجسام المضادة الأساسي على جانب الغطاء.
- لتوفير الرطوبة ومنع العينات من الجفاف خلال فترة الحضانة ، أضف الماء فائق النقاء إلى طبق بتري أصغر ورتب بعناية طبق بتري الصغير حول الأغطية.
- قم بتغطية طبق بتري الكبير واحتضن الخلايا المستزرعة لمدة 1 ساعة في RT.
- لشرائح الأنسجة:
- أضف بعناية 250 ميكرولتر من محلول الأجسام المضادة الأساسي إلى شرائح عائمة بحرية في صفيحة بئر 24.
- قم بتغطية اللوحة واحتضن الأنسجة بين عشية وضحاها عند 4 درجات مئوية مع إثارة لطيفة على شاكر مداري.
4. غسل العينات، ثم احتضان في الأجسام المضادة الثانوية
- تحضير الأجسام المضادة الثانوية في المخزن المؤقت للحظر:
- تحضير الحمار المضادة للفأر (1: 5) ، الحمار المضادة للأرانب (1: 5) ، الحمار المضادة للدجاج (1: 400).
- في هذه الخطوة ، يمكن الحصول على ضوابط تقنية إضافية عن طريق إعداد aliquot ثانوي يحذف إما الثانوية المضادة للفأر أو المضادة للأرانب.
- للخلايا المستزرعة:
- باستخدام الملقط ، اضغط بعناية على المحلول الأساسي من الأغطية على منشفة ورقية
- باستخدام الملقط ، انقل الأغطية بعناية إلى لوحة البئر الأصلية المكونة من 24 قطعة مملوءة ب 500 ميكرولتر من 1x PBS.
- لشرائح الأنسجة:
- قم بإزالة محلول الأجسام المضادة الأساسي بعناية باستخدام ماصة باستور البلاستيكية. حاول إزالة أكبر قدر ممكن دون تمزيق الأنسجة.
- إضافة 500 ميكرولتر من 1x PBS
- اغسل العينات لمدة 10 دقائق 3 مرات في 1x PBS مع إثارة لطيفة على شاكر مداري. خلال هذا الوقت ، أحضر جميع مخازن الغسيل إلى RT.
- خلال هذا الوقت ، قم بتغيير البارافيلم في طبق بتري الكبير
- للخلايا المستزرعة:
- باستخدام الملقط ، انقل الأغطية بعناية إلى طبق بتري الكبير المظلوم
- أضف بعناية 40 ميكرولتر من محلول الأجسام المضادة الثانوي إلى الجزء العلوي من الأغطية. تأكد من عدم انسكاب محلول الأجسام المضادة الثانوي على جانب الغطاء.
- إذا لزم الأمر ، أضف المزيد من الماء فائق النقاء إلى طبق بتري أصغر ورتب بعناية طبق بتري الصغير حول الأغطية.
- يغطى طبق بتري الكبير
- لشرائح الأنسجة:
- أضف بعناية 250 ميكرولتر من محلول الأجسام المضادة الثانوي إلى شرائح عائمة بحرية في صفيحة 24 بئر.
- قم بتغطية اللوحة
ملاحظة: من هنا فصاعدا ، قم بحماية العينات من الضوء عن طريق لف قمم الألواح بورق القصدير.
- احتضان العينات عند 37 درجة مئوية لمدة 1 ساعة
5. الربط
- امزج مخزون الربط بنسبة 1:5 في ماء جزيئي.
- كما هو الحال في القسم 4 ، انقل الأغطية بعناية وقم بإزالة المزيج الثانوي من الأنسجة المقطعة.
- اغسل العينات في 500 ميكرولتر من المخزن المؤقت للغسيل A
- بالنسبة للخلايا المستزرعة ، اغسل 2 مرات لمدة 5 دقائق. بالنسبة للمناديل المقطعة إلى شرائح ، اغسلها 2 مرات لمدة 10 دقائق. استخدم الإثارة اللطيفة على شاكر مداري لكليهما.
- خلال هذا الوقت ، قم بتغيير البارافيلم في طبق بتري الكبير
- مع الحفاظ على الليغاز على كتلة باردة ، قم بتخفيف الليغاز 1:40 في مخزون الربط من الخطوة 5.1. قم بإجراء هذا التخفيف مباشرة قبل إضافة الليغاز إلى العينات.
- كما هو الحال في القسم 4 ، قم بإزالة أكبر قدر ممكن من مخزن الغسيل A من العينات قبل إضافة الليغاز.
- بالنسبة للخلايا المستزرعة: انقل الأغطية مرة أخرى إلى طبق بتري المظلومة. أضف 40 ميكرولتر من مزيج الربط إلى الأغطية ، ورتب أطباق بتري صغيرة مملوءة بالماء حول الأغطية ، وقم بتغطية طبق بتري الكبير.
- بالنسبة للأنسجة المقطعة: أضف 250 ميكرولتر من مزيج الربط من الخطوة 5.4 إلى كل بئر وقم بتغطية اللوحة.
- احتضان العينات لمدة 30 دقيقة عند 37 درجة مئوية.
6. التضخيم
- امزج مخزون التضخيم بنسبة 1:5 في ماء جزيئي.
- كما هو الحال في القسم 4 ، انقل الأغطية بعناية وقم بإزالة مزيج الربط من الأنسجة المقطعة.
- غسل العينات في 500 ميكرولتر من المخزن المؤقت للغسيل A
- بالنسبة للخلايا المستزرعة ، اغسلها مرتين لمدة 2 دقيقة. بالنسبة للمناديل المقطعة إلى شرائح ، اغسلها 2 مرات لمدة 10 دقائق. استخدم الإثارة اللطيفة على شاكر مداري لكليهما.
- خلال هذا الوقت ، قم بتغيير البارافيلم في طبق بتري الكبير
- قم بإجراء هذا التخفيف مباشرة قبل إضافة البوليميراز إلى العينات. مع الحفاظ على البوليميراز على كتلة باردة ، قم بتخفيف البوليميراز
- بالنسبة للخلايا المستزرعة ، قم بتخفيف البوليميراز 1:80 في مخزون التضخيم من الخطوة 6.1.
- بالنسبة للأنسجة المقطعة، قم بتخفيف البوليميراز بنسبة 1:40 في مخزون التضخيم من الخطوة 6.1.
- كما هو الحال في الخطوة 4 ، قم بإزالة أكبر قدر ممكن من مخزن الغسيل A من العينات قبل إضافة البوليميراز.
- للخلايا المستزرعة: انقل الأغطية مرة أخرى إلى طبق بتري المظلي. أضف 40 ميكرولتر من مزيج التضخيم من الخطوة 6.4.1 إلى الأغطية ، ورتب أطباق بتري صغيرة مملوءة بالماء حول الأغطية ، وقم بتغطية طبق بتري الكبير. احتضان العينات لمدة 100 دقيقة عند 37 درجة مئوية.
- بالنسبة للأنسجة المقطعة: أضف 250 ميكرولتر من مزيج التضخيم من الخطوة 6.4.2 إلى كل بئر وقم بتغطية اللوحة. احتضان العينات لمدة 2 ساعة عند 37 درجة مئوية.
ملاحظة: خلال هذا الوقت، قم بإعداد الشرائح وتسميتها.
7. تصاعد
- كما هو الحال في الخطوة 4 ، انقل الأغطية بعناية وأزل مزيج التضخيم من الأنسجة المقطعة.
- اغسل العينات في 500 ميكرولتر من المخزن المؤقت للغسيل B 2 مرات لمدة 10 دقائق مع إثارة لطيفة على شاكر مداري.
- اغسل العينات في 500 ميكرولتر من 1٪ غسل المخزن المؤقت B لمدة 1 دقيقة مع إثارة لطيفة على شاكر مداري.
- للخلايا المستزرعة:
- إسقاط 3 ميكرولتر من وسائط التركيب على شريحة
- اضغط على المخزن المؤقت الزائد للغسيل من الغطاء ثم ضع الغطاء (مع توجيه الخلايا لأسفل) في وسائط التركيب. أغلق الجانبين بكمية صغيرة من طلاء الأظافر الشفاف لإغلاق الغطاء في مكانه.
- لشرائح الأنسجة:
- انقل شريحة الأنسجة بعناية إلى الشريحة المعدة ورتبها ، بحيث تكون الشريحة مسطحة. قم بإسقاط ما بين 5-10 ميكرولتر من وسائط التركيب (يعتمد المبلغ على حجم الشريحة) على شريحة الأنسجة
- ضع بعناية غطاء زجاجي فوق شريحة الأنسجة وأغلقه بكمية صغيرة من طلاء الأظافر الشفاف على طول الحافة لإغلاق الغطاء في مكانه.
- انتظر 15 دقيقة على الأقل قبل التحليل تحت المجهر ، أو خزن في -20 درجة مئوية.
8. الحصول على صور رقمية باستخدام المجهر البؤري
- قم بتحسين إعدادات الاكتساب (على سبيل المثال، طاقة الليزر، الكسب، الإزاحة) عبر عينات من جميع العلاجات. تأكد من أن التحسين يتضمن تقليل ضوضاء الخلفية وتعزيز الإشارة دون الإفراط في تشبع شدة إشارات الفلورسنت. بمجرد تحديد الإعدادات ، قم بتطبيق نفس إعدادات الاكتساب عبر جميع الصور التي تم الحصول عليها.
ملاحظة: يمكن استخدام تفاصيل الاقتناء التالية مع مجهر نيكون A1 متحد البؤرة وبرنامج NIS AR Elements من نيكون. - اضبط الشريحة مع العينة على المسرح وابحث عن المستوى البؤري للعينة باستخدام DAPI من خلال النظارة.
- قم بإيقاف تشغيل منفذ العين بالنقر فوق منفذ العين واختر زر تكوين بصري لضبط الإعدادات.
- اضبط الكسب والإزاحة وطاقة الليزر لكل قناة فلورسنت لتقليل ضوضاء الخلفية وتعزيز إشارة الفلورسنت. تأكد من أن إشارة الفلورسنت لا تصبح مفرطة التشبع كما هو مذكور في الخطوات 8.5-8.6.
- راقب التشبع الزائد باستخدام لون زائف لإشارة الفلورسنت. في أسفل الصورة المباشرة، انقر بزر الماوس الأيمن فوق علامة التبويب المسماة بقناة الفلورسنت المستخدمة حاليا.
- بعد ذلك ، اختر تلوين القناة واختر لونا زائفا مثل Rainbow Dark لتصور شدة التألق في لون زائف يشبه الخريطة الحرارية. في Rainbow Dark ، تشير الألوان الأكثر برودة إلى كثافة فلورسنت أقل ، وتشير الألوان الأكثر سخونة إلى كثافة فلورسنت أكثر.
- بمجرد تحسين جميع قنوات الفلورسنت ، انقر بزر الماوس الأيمن فوق زر التكوين البصري الذي تم اختياره مسبقا واختر تعيين إعداد الكاميرا الحالي لهذا الزر .
- تحقق من أن الإعدادات المختارة كافية لعينة عشوائية من كل مجموعة علاج. إذا كانت الإعدادات المختارة تشبع أي من هذه العينات، كرر الخطوة 8.4 لإزالة التشبع الزائد.
- بالنسبة للخلايا العصبية المستزرعة، اتبع الخطوات 8.10-8.16.
- باستخدام منفذ العين ، ابحث عن خلية عصبية ذات تشعبات لها الحد الأدنى من التداخل مع التشعبات الأخرى.
- قم بإيقاف تشغيل منفذ العين واستخدم قناة DAPI لتصور جسم الخلية للخلية العصبية المختارة. انقر نقرا مزدوجا فوق مركز السوما لتوسيط الخلية العصبية في منتصف مجال الرؤية.
- باستخدام قناة MAP2، ابحث عن أفضل مستوى تركيز لإشارة MAP2 من خلال المسح الضوئي المباشر.
- ضمن علامة التبويب اكتساب ND ، انقر فوق حفظ في ملف واختر ملفا لحفظ الصورة فيه ضمن استعراض. ثم أدخل اسم الملف.
- ضمن علامة التبويب Z ، حدد خيار الوضع المتماثل المعرف بواسطة النطاق . اضبط التركيز البؤري على أفضل مستوى MAP2 وانقر على الزر نسبي لتعيين هذا المستوى البؤري في منتصف المكدس z.
- اضبط النطاق على 5 ميكرومتر بخطوات 1 ميكرومتر، وتأكد من التحقق من إغلاق الغالق النشط أثناء حركة Z. ضمن علامة التبويب الطول الموجي ، حدد اسم الزر البصري باستخدام إعدادات الاكتساب التي تم تكوينها مسبقا ضمن Optical Conf. ثم انقر فوق تشغيل الآن.
- كرر الخطوات 8.1.10-8.1.15 لحوالي 10 خلايا عصبية لكل غطاء/علاج.
- بالنسبة للأنسجة المقطعة، اتبع الخطوات من 8.18 إلى 8.22.
- باستخدام منفذ العين ، ابحث عن المنطقة محل الاهتمام. على سبيل المثال، حدد موقع CA1 من الحصين.
- قم بإيقاف تشغيل منفذ العين واستخدم قناة MAP2 للعثور على أفضل مستوى تركيز لإشارة MAP2 من خلال المسح الضوئي المباشر.
- ضمن القائمة اكتساب ، اختر مسح صورة كبيرة ضوئيا. بعد ذلك، حدد اسم الزر البصري باستخدام إعدادات الاكتساب التي تم تكوينها مسبقا ضمن لوحة الالتقاط من اللوحة التي تفتح . تأكد أيضا من تحديد الهدف الصحيح في هذه اللوحة.
- ضمن لوحة المنطقة والنظارة، استخدم مفاتيح الأسهم لتعيين حدود المنطقة محل الاهتمام. بعد ذلك ، انقر فوق حفظ صورة كبيرة في ملف وإنشاء اسم ملف مسار حفظ للصورة.
- ضمن لوحة الإعداد ، تأكد من تحديد الالتقاط متعدد القنوات ، ثم اختر اسم الزر البصري مع إعدادات الاكتساب التي تم تكوينها مسبقا ضمن Optical Conf.
ملاحظة: من الممكن وجود مكدس z لصورة كبيرة ولكنه سيزيد من وقت الفحص.
9. التحليل
- على غرار إعدادات الاقتناء، استخدم عينات من جميع العلاجات لتحسين إعدادات العتبة. تأكد من أن تحسين العتبة يركز على تقليل ضوضاء الخلفية وتعزيز الإشارة دون الإفراط في تشبع شدة إشارات الفلورسنت. بمجرد تحديد هذه الإعدادات، قم بتطبيق نفس إعدادات العتبة عبر جميع الصور المستخدمة للتحليل كما هو موضح في الخطوات من 9.2 إلى 9.3.
- في ImageJ، يوجد خيار العتبة ضمن القائمة صورة > ضبط عتبة >. اختر خيار الخلفية الداكنة إذا كانت الصورة تحتوي على خلفية داكنة.
- بعد ذلك، اضبط الحدين العلوي والسفلي للعتبة لكل إعدادات عتبة محسنة تم تحديدها مسبقا، ثم انقر على تطبيق.
- بالنسبة للخلايا المستزرعة ، استخدم قناة MAP2 وأداة منطقة الاهتمام الحرة (ROI) لرسم عائد استثمار لكل خلية عصبية ، بما في ذلك التشعبات و soma. بالنسبة للأنسجة المقطعة، ارسم عائد استثمار حر اليد داخل صورة الشريحة التي تغلف منطقة الاهتمام (على سبيل المثال، الطبقة الشعاعية ل CA1 داخل الحصين).
- الحصول على مساحة عائد الاستثمار. في ImageJ، قم بقياس المساحة أسفل القائمة تحليل > قياس.
- اكتشف عدد الثقوب داخل كل عائد استثمار باستخدام أداة الكشف التلقائي مثل تحليل الجسيمات في ImageJ باتباع الخطوات 9.7-9.9.
- ابحث عن خيار تحليل الجسيمات ضمن القائمة تحليل > تحليل الجسيمات. أولا ، حدد قطر حجم الثقب ، عادة 0.1-3 ميكرومتر مربع.
- بعد ذلك، اختر خيار أقنعة التراكب من القائمة المنسدلة إظهار وحدد خيار عرض النتائج. ثم انقر فوق موافق.
- إذا لم يتم الكشف عن البونكتا باستخدام نطاق القطر المختار، فاضبط النطاق حتى يتم الكشف عن جميع الثقوب باستخدام هذا التحليل. تأكد من استخدام نفس إعدادات تحليل الجسيمات لجميع الصور.
- اقسم عدد النقاط على منطقة الاهتمام الفردية باتباع الخطوات 9.11-9.13.
- انسخ النتائج والصقها لكل صورة من النافذة المنبثقة النتائج من ImageJ في جدول بيانات.
- أولا ، حدد الملف والعينة التي تم الحصول على البيانات منها. ثم اقسم مساحة عائد الاستثمار على عدد النقاط.
- ثم قم بمسح البيانات من النافذة المنبثقة النتائج، وكرر الخطوات 9.2-9.12.
- تطبيع النتائج للتحكم في العينات: متوسط النتائج (عدد مناطق الثقب/عائد الاستثمار) لعينات التحكم. ثم ، قسم النتائج التي تم الحصول عليها من جميع العينات على متوسط عنصر التحكم للحصول على النتائج الطبيعية. يجب أن يكون المتوسط الجديد لعينات التحكم مساويا ل 1.
النتائج
يتم تقديم البيانات المعدلة من Heaney et al.6 لإثبات تجربة يتوقع فيها زيادة تكوين المشبك العصبي (يرجى الاطلاع على6 لمزيد من المعلومات ومناقشة أكثر تعمقا للآلية). في السابق ، ثبت أن مضادات الاكتئاب السريعة تتطلب تنشيط مستقبلات التمثيل الغذائي المثبطة ، GABAB (النوع الفرعي ل...
Discussion
DetectSyn هو فحص سريع يستخدم مقايسة ربط القرب للكشف عن البروتينات داخل 40 نانومتر من بعضها البعض ، مما يسمح بالكشف عن تكوين المشبك. تعمل هذه التقنية على تحسين اختبارات الفلورسنت الحالية ، والتي تعمل فقط كقياسات بديلة لتشكيل المشبك العصبي. يكتشف DetectSyn التغيرات القابلة للقياس الكمي في البروتينات...
Disclosures
ويفيد المؤلفان بعدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد الوطنية للصحة NINDS R01 NS105005 (KRG) و NS105005-03S1 (KRG) ، وزارة الدفاع USAMRMC W81XWH-14-1-0061 (KRG) ، NIAAA R01AA016852 ، NIAAA T32AA007565 (CFH) ، ومنحة من FRAXA Research (CFH) وجمعية الزهايمر ، AARG-NTF-21-852843 (KRG) ، AARF-19-614794-RAPID (KRG).
Materials
| Name | Company | Catalog Number | Comments |
| 10x PBS | Fisher Scientific | BP39920 | PBS made in house works, as well. |
| 24 well plates | Fisher Scientific | FB012929 | For tissue slices, pre-sterilized plates may be unnecessary. |
| 50 mL conical tubes | Fisher Scientific | 14-432-22 | |
| Aluminium foil | Fisher Scientific | 15-078-290 | |
| Chicken anti-MAP2 antibody | Abcam | ab5392 | |
| Clear nail polish | Fisher Scientific | NC1849418 | Other clear nail polish works, as well. |
| Cold block | Fisher Scientific | 13131012 | |
| Computer workstation | HP | ||
| Confocal or fluorescent microscope | Nikon | A1R HD25 | |
| Donkey anti-chicken FITC | Fisher Scientific | SA1-72000 | |
| Duolink donkey anti-Mouse PLUS | Sigma | DUO92001 | |
| Duolink donkey anti-Rabbit MINUS | Sigma | DUO92005 | |
| Duolink In Situ Detection Reagents Far Red | Sigma | DUO92013 | Contains ligation stock, amplification stock, ligase, and polymerase. |
| Duolink In Situ Mounting Medium with DAPI | Sigma | DUO82040 | |
| Duolink In Situ Wash Buffers, Fluorescence | Sigma | DUO82049 | Contains Wash Buffer A and Wash Buffer B; dilute Wash Buffer B to 1% in diH20 for 1% Wash Buffer B. |
| Fine-tipped paintbrush | Fisher Scientific | NC9691026 | Sable hair, size 00 or 000, can also find at craft stores |
| Fisherbrand Cover Glasses: Rectangles | Fisher Scientific | 12545MP | Cover glass is unnecessary for cultured neurons already on glass coverslips. |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 1255015 | For cultured neurons already on glass coverslips, Superfrost slides may be unnecessary. |
| Freezer, -20°C | VWR | 76449-108 | |
| Glass coverslips | Fisher Scientific | 125480 | |
| Glycine | Fisher Scientific | BP381-1 | |
| Image processing software | e.g. NIS Elements, ImageJ | ||
| Incubator | Fisher Scientific | 15-015-2633 | |
| Large petri dish, 100mm | Fisher Scientific | FB0875712 | |
| Molecular grade water | Fisher Scientific | BP24701 | |
| Mouse anti-Synapsin1 antibody | Synaptic Systems | 106-011 | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| Orbital shaker | Fisher Scientific | 02-106-1013 | |
| Parafilm | Fisher Scientific | 13-374-10 | |
| Pipette tips | Fisher Scientific | 02-707-025 | |
| Pipettes | Fisher Scientific | 14-388-100 | Working volumes range from 3 µL to 500 µL |
| Plastic pasteur pipette | Fisher Scientific | 02-708-006 | |
| Precision tweezers/foreceps | Fisher Scientific | 12-000-122 | |
| Rabbit anti-PSD95 antibody | Abcam | ab18258 | Other antibody pairs may work, as well, with optimization. |
| Refrigerator | VWR | 76470-402 | |
| Small petri dish, 60 mm | Fisher Scientific | FB0875713A | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tween 20 | Fisher Scientific | BP337-100 |
References
- Südhof, T. C. Towards an understanding of synapse formation. Neuron. 100 (2), 276-293 (2018).
- Bliss, T. V., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361 (6407), 31-39 (1993).
- Heaney, C. F., Raab-Graham, K. F. Dysregulated protein synthesis in major depressive disorder. The Oxford Handbook of Neuronal Protein Synthesis. , 510-532 (2018).
- Masliah, E., Crews, L., Hansen, L. Synaptic remodeling during aging and in Alzheimer's disease. Journal of Alzheimer's Disease. 9, 91-99 (2006).
- van Spronsen, M., Hoogenraad, C. C. Synapse pathology in psychiatric and neurologic disease. Current Neurology and Neuroscience Reports. 10 (3), 207-214 (2010).
- Heaney, C. F., Namjoshi, S. V., Uneri, A., Bach, E. C., Weiner, J. L., Raab-Graham, K. F. Role of FMRP in rapid antidepressant effects and synapse regulation. Molecular Psychiatry. 26 (6), 2350-2362 (2021).
- Pchitskaya, E., Bezprozvanny, I. Dendritic spines shape analysis-Classification or clusterization? Perspective. Frontiers in Synaptic Neuroscience. 12, 31 (2020).
- Alvarez, V. A., Sabatini, B. L. Anatomical and physiological plasticity of dendritic spines. Annual Review of Neuroscience. 30 (1), 79-97 (2007).
- Berry, K. P., Nedivi, E. Spine Dynamics: Are they all the same. Neuron. 96 (1), 43-55 (2017).
- Micheva, K. D., Smith, S. J. Array tomography: A new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55 (1), 25-36 (2007).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments: JoVE. (65), e3564 (2012).
- Workman, E. R., Niere, F., Raab-Graham, K. F. mTORC1-dependent protein synthesis underlying rapid antidepressant effect requires GABABR signaling. Neuropharmacology. 73, 192-203 (2013).
- Li, N., et al. mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists. Science. 329 (5994), 959-964 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved