Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
DetectSyn: Sinaps Yoğunluğundaki Değişiklikleri Tespit Etmek için Hızlı, Tarafsız Bir Floresan Yöntemi
Bu Makalede
Özet
DetectSyn, tedaviler veya hastalık durumları arasında göreceli sinaps (sinaptik öncesi ve sonrası) sayısındaki değişiklikleri ölçen tarafsız, hızlı bir floresan testidir. Bu teknik, hem kültürlü nöronlarda hem de sabit dokuda kullanılabilen bir yakınlık ligasyonu tekniği kullanır.
Özet
Sinapslar, nöronlar arasındaki iletişim yeridir. Nöronal devre gücü sinaptik yoğunluk ile ilişkilidir ve sinapsların parçalanması majör depresif bozukluk (MDB) ve Alzheimer hastalığı gibi hastalık durumlarının karakteristiğidir. Sinaps sayılarını araştırmak için kullanılan geleneksel teknikler arasında floresan belirteçlerin genetik ekspresyonu (örneğin, yeşil floresan proteini (GFP)), bir nöronu dolduran boyalar (örneğin, karbosiyanin boyası, DiI) ve omurga belirteçlerinin immünofloresan tespiti (örneğin, postsinaptik yoğunluk 95 (PSD95)) bulunur. Bu proxy tekniklerine yönelik önemli bir uyarı, yalnızca postsinaptik değişiklikleri tanımlamalarıdır. Yine de, bir sinaps, presinaptik bir terminal ile postsinaptik bir omurga arasındaki bir bağlantıdır. Sinaps oluşumunu/eliminasyonunu ölçmek için altın standart, zaman alan elektron mikroskobu veya dizi tomografisi teknikleri gerektirir. Bu teknikler özel eğitim ve pahalı ekipman gerektirir. Ayrıca, sadece sınırlı sayıda nöron değerlendirilebilir ve tüm beyin bölgesindeki değişiklikleri temsil etmek için kullanılır. DetectSyn, bir hastalık durumu veya ilaç aktivitesi nedeniyle sinaps oluşumundaki veya eliminasyonundaki değişiklikleri tanımlayan hızlı bir floresan tekniğidir. DetectSyn, yan yana yerleştirilmiş ön ve postsinaptik proteinleri ve çoğu laboratuvar için kolayca bulunabilen bir teknik olan standart floresan mikroskopiyi tespit etmek için hızlı bir yakınlık ligasyon testi kullanır. Ortaya çıkan punttanın floresan tespiti, deneylerin hızlı ve tarafsız bir şekilde analiz edilmesini sağlar. DetectSyn, elektron mikroskobundan daha temsili sonuçlar sağlar, çünkü sınırlı sayıda floresan nörondan daha büyük alanlar analiz edilebilir. Dahası, DetectSyn in vitro kültürlü nöronlar ve sabit doku dilimleri için çalışır. Son olarak, bu teknikten toplanan verileri analiz etmek için bir yöntem sağlanmıştır. Genel olarak, DetectSyn, tedaviler veya hastalık durumları arasında sinaps yoğunluğundaki göreceli değişiklikleri tespit etmek için bir prosedür sunar ve geleneksel tekniklerden daha erişilebilirdir.
Giriş
Sinapslar, nöronlar arasındaki iletişimin temel birimidir1. Aynı bölgelerdeki nöronlar arasındaki birçok sinaps, davranışa aracılık eden devrelere yol açar2. Sinapslar, başka bir nöronun postsinaptik reseptörlerine bilgi aktaran nörotransmiterleri veya nöropeptitleri serbest bırakan bir nörondan presinaptik bir terminalden oluşur. Presinaptik sinyallerin toplamı, postsinaptik nöronun bir aksiyon potansiyelini ateşleyip ateşlemeyeceğini ve mesajı diğer nöronlara yayıp yaymayacağını belirler.
Sinapsların parçalanması olan sinaptopatoloji, Alzheimer hastalığı ve majör depresif bozukluk gibi azalmış nöral hacimle işaretlenmiş hastalıklarda ve bozukluklarda ortaya çıkar ve artık en iyi şekilde performans göstermeyen devrelerle sonuçlanır 3,4,5. Sinaps yoğunluğunun geri kazanılması muhtemelen bu bozukluklar için potansiyel tedavilerin etkinliğinin altında yatmaktadır. Örneğin, yakın zamanda artan sinapsların hızlı antidepresanların davranışsal etkinliğinin altında yattığı gösterilmiştir6. Olası sinaptopatoloji tedavilerini hızlı bir şekilde taramak için araştırmacılar, sinaps sayılarındaki değişiklikleri hızlı bir şekilde tanımlayan tekniklere ihtiyaç duyarlar.
Mevcut metodolojiler ya zaman alıcı ve pahalıdır (elektron mikroskobu, dizi tomografisi) ya da presinaptik angajmanı (omurga analizleri, immünofloresan / kolokalizasyon) dahil etmeden sadece postsinaptik değişiklikleri incelerler. DiI gibi boyalar veya GFP gibi floresan proteinler nöronları görselleştirmeye ve postsinaptik dikenleri karakterize etmeye yardımcı olur. Bununla birlikte, omurga analizi, tekrarlanabilirliği azaltabilen morfolojiyi belirlemek için araştırmacı tanımlı oranları kullanır7. Ayrıca, farklı omurga sınıflarının fonksiyonel sinapslarla nasıl ilişkili olduğu hala ortaya çıkarılmaktadır8. Omurga oluşumu geçici olabilir ve postsinaptik plastisiteyi yansıtabilir, ancak bu dikenler presinaptik nöron9 ile bir sinapsa stabilize edilmeden önce elimine edilebilir.
Kolokalizasyon, sinapslar için omurga analizinden daha iyi bir proxy sağlar, çünkü presinaptik ve postsinaptik proteinler için immünoboyayabilir. Bununla birlikte, sinaptik proteinler düşük kolokalizasyon değerleri verebilir, çünkü proteinler yan yana getirilir ve tutarlı bir şekilde örtüşmeyebilir. Bu nedenle, proteinler tamamen üst üste binmediğinden, kolokalizasyon teknikleri, bu eksik bilgi nedeniyle sinaps oluşumundaki değişiklikleri doğru bir şekilde ölçemeyebilir. Son olarak, hem elektron mikroskobu (EM) hem de dizi tomografisi sinapsların yüksek çözünürlüklü görüntülerini sağlasa da, zaman alıcıdır. EM ayrıca özel ekipman gerektirir ve araştırmacılar herhangi bir deney için küçük hacimli dokularla sınırlıdır. Dizi tomografisi, ultra ince kesitlerde birçok proteini zarif bir şekilde tarama yeteneği sağlar ve EM10 ile birleştirilebilirken, bu teknik çok emek yoğun olabilir ve sinaps oluşumundaki değişiklikleri hızlı bir şekilde taraması gereken deneylerin kapsamı dışında olabilir.
DetectSyn, Duolink Proximity Ligation Assay'ın özel bir uygulamasıdır. PLA testi, protein-protein etkileşimlerinin genel tespitine izin verir. DetectSyn, birbirlerinden 40 nm uzaktaki etiketli ön ve son sinaptik proteinler tarafından yayılan bir floresan sinyalini yükselterek proxy postsinaptik ölçümleri köprülemektedir. Eğer sinaptik proteinler sinaptik bir yarık içinde olduğu gibi 40 nm içindeyse, DNA probları içeren ikincil antikorlar dairesel DNA'ya melezleşir. Bu hibridize dairesel DNA, daha sonra standart floresan mikroskopi teknikleriyle güçlendirilen ve tespit edilen bir floresan probu ifade eder (bkz. Şekil 1). En önemlisi, EM ve dizi tomografisinden farklı olarak, bu teknik özel ekipman gerektirmez ve standart immünohistokimya ile aynı miktarda zaman alır. Bu tekniğin erişilebilirliği, araştırma yoğun kurumların dışındaki araştırmacıların sinaptopatoloji araştırmalarına katılmalarını sağlar. Ayrıca, bu teknik, tek bir deneyde birden fazla beyin bölgesindeki sinaptik yoğunluktaki değişiklikleri inceleyebilir ve hastalık veya tedaviye bağlı sinaptik değişikliklerin daha bütünsel bir temsilini sunar.
Protokol
Hücrelerin ve dokuların hayvanlardan izole edilmesi, Ulusal Sağlık Enstitüleri'nin Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun olarak yapıldı ve Wake Forest Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylandı.
NOT: Bu protokol, belirli deneysel paradigmalar ve gereksinimler uyarınca önceden işlenmiş ve sabitlenmiş örnekler üzerinde kullanılır. Gösterim amacıyla, hızlı antidepresan tedavisine bağlı sinaps oluşumu, bu sinaps tespit tekniğini vurgulamak için kullanılır6. Daha önce kapaklarda kültürlenmiş, tedavi edilmiş,% 4 paraformaldehit (PFA) içinde sabitlenmiş ve 1x fosfat tamponlu salin (PBS) içinde depolanan nöronlar, in vitro prosedürleri vurgulamak için kullanılacaktır. Tedavi edilen farelerden daha önce dilimlenmiş hipokampal doku (25 μm kalınlığında), buz gibi soğuk PBS ve% 4 PFA ile transkardiyal olarak perfüze edilmiş ve daha sonra dilimleme prosedürlerini vurgulamak için kriyoprotektanda saklanacaktır. Nöronların nasılkültürleneceği veya kemirgenlerin transkardiyal olarak nasıl perfüze edileceği hakkında daha fazla bilgi için lütfen 11,12'ye bakınız. Bu yordamın grafik gösterimi için Şekil 1'e bakın.
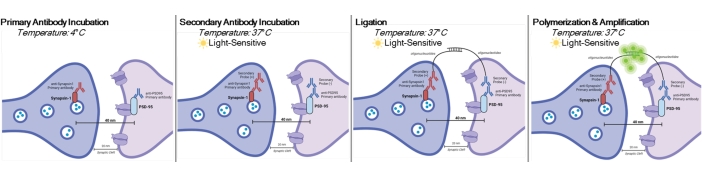
Şekil 1: DetectSyn testinin grafiksel gösterimi. Hücre zarlarını geçirgenleştirdikten sonra, Synapsin1 ve PSD95 için birincil antikorlar bu sinaptik proteinlere bağlanır. Oligonükleotid etiketleri olan sekonderler daha sonra birincil antikorlara bağlanır. Synapsin1 ve PSD95, bir sinapsta olduğu gibi 40 nm içindeyse, oligonükleotidler etkileşime girer ve bir floresan etiketi yükseltilir. Bu floresan sinyal daha sonra standart mikroskopi ile görüntülenebilir ve analiz edilebilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
1. Numuneleri durulayın
- Artık PFA veya kriyoprotektanı çıkarmak için numuneleri 500 μL 1x PBS +% 0.75 glisin ile 5 dakika 3 dakika boyunca orbital çalkalayıcı üzerinde nazik ajitasyonla durulayın.
2. Numuneleri bloke edin ve geçirgenleştirin
- 1x PBS'de blokaj ve geçirgenlik çözeltisi (% 10 normal eşek serumu,% 0.25 Ara 20) hazırlayın. Blokaj, birincil ve ikincil inkübasyonlar için kullanılacak kadar hazırlayın.
- 24 kuyucuk plakasındaki numunelere (örneğin, kapak kaymaları veya serbest yüzen dilimler) 500 μL blokaj ve geçirgenlik çözeltisi ekleyin. Her kuyunun farklı bir numune içerdiğinden ve numunelerin değiştirilmesini önlemek için uygun şekilde etiketlendiğinden emin olun.
- Numuneleri oda sıcaklığında (RT) kültürlenmiş hücreler için 60 dakika veya dilimlenmiş doku için 2 saat inkübe edin. Nazik ajitasyon için yörüngesel bir çalkalayıcı kullanın.
3. Örnekleri primer antikorlarda inkübe edin
- Bloke edici tamponda birincil antikorlar hazırlayın:
- Postsinaptik yoğunluk 95 (PSD95; 1:500, tavşan poliklonal), Synapsin1 (1:500, fare monoklonal), MAP2 (1:400, tavuk poliklonal) hazırlayın
- Sinaptik çiftlerden birini atlayan negatif bir kontrol aliquot hazırlayın (örneğin, PSD95 olmadan)
- Blokaj solüsyonunu plastik bir Pasteur pipetle dikkatlice çıkarın. Hücreleri rahatsız etmeden veya dokuyu yırtmadan mümkün olduğunca çıkarmaya çalışın.
- Kültürlü hücreler için:
- Parafilm ile büyük bir plastik petri kabı hizalayın. Forseps kullanarak kapakları parafilme dikkatlice aktarın.
- Kapak kapaklarının üstüne 60 μL birincil antikor çözeltisini dikkatlice ekleyin. Birincil antikor solüsyonunu kapak kapağının yan tarafına dökmediğinizden emin olun.
- Nem sağlamak ve numunelerin kuluçka döneminde kurumasını önlemek için, daha küçük bir Petri kabına ultra saf su ekleyin ve küçük Petri kabını kapak kapaklarının etrafına dikkatlice yerleştirin.
- Büyük Petri kabını örtün ve kültürlenmiş hücreleri RT'de 1 saat boyunca inkübe edin.
- Dilimlenmiş doku için:
- 24 kuyucuklu bir plakadaki serbest yüzen dilimlere 250 μL birincil antikor çözeltisini dikkatlice ekleyin.
- Plakayı örtün ve dokuyu bir orbital çalkalayıcı üzerinde nazik bir ajitasyonla 4 ° C'de gece boyunca inkübe edin.
4. Numuneleri yıkayın, ardından ikincil antikorlarda inkübe edin
- Bloke edici tamponda ikincil antikorlar hazırlayın:
- Eşek anti-fare (1:5), eşek anti-tavşan (1:5), eşek anti-tavuk (1:400) hazırlayın.
- Bu adımda, anti-fare veya anti-tavşan ikincilini atlayan ikincil bir aliquot hazırlanarak ek teknik kontroller elde edilebilir.
- Kültürlü hücreler için:
- Forseps kullanarak, birincil çözeltiyi kapaklardan bir kağıt havluya dikkatlice dokunun
- Forseps kullanarak, kapak kapaklarını dikkatlice 500 μL 1x PBS ile doldurulmuş orijinal 24 kuyucuklu plakalarına geri aktarın.
- Dilimlenmiş doku için:
- Birincil antikor solüsyonunu plastik bir Pasteur pipetle dikkatlice çıkarın. Dokuyu yırtmadan mümkün olduğunca çıkarmaya çalışın.
- 500 μL 1x PBS ekleyin
- Numuneleri, yörüngesel bir çalkalayıcıda nazik bir ajitasyonla 1x PBS'de 10 dakika 3 kez yıkayın. Bu süre zarfında, tüm yıkama tamponlarını RT'ye getirin.
- Bu süre zarfında, büyük Petri kabındaki parafilmi değiştirin
- Kültürlü hücreler için:
- Forseps kullanarak, kapakları dikkatlice parafilme alınmış büyük Petri kabına geri aktarın.
- Sekonder antikor çözeltisinin 40 μL'sini kapak kapaklarının üstüne dikkatlice ekleyin. İkincil antikor solüsyonunu kapak kaymasının yan tarafına dökmediğinizden emin olun.
- Gerekirse, daha küçük bir petri kabına daha fazla ultra saf su ekleyin ve küçük petri kabını kapakların etrafına dikkatlice yerleştirin.
- Büyük Petri kabını örtün
- Dilimlenmiş doku için:
- Sekonder antikor çözeltisinin 250 μL'sini, 24 kuyucuklu bir plakadaki serbest yüzen dilimlere dikkatlice ekleyin.
- Plakayı örtün
NOT: Bundan sonra, plakaların üst kısımlarını folyo ile sararak numuneleri ışıktan koruyun.
- Numuneleri 1 saat boyunca 37 °C'de inkübe edin
5. Ligasyon
- Ligasyon stoğunu moleküler sınıf suda 1:5 oranında karıştırın.
- Bölüm 4'te olduğu gibi, kapak kapaklarını dikkatlice aktarın ve ikincil karışımı dilimlenmiş dokudan çıkarın.
- Numuneleri 500 μL yıkama tamponu A içinde yıkayın
- Kültürlenmiş hücreler için, 5 dakika boyunca 2 kez yıkayın. Dilimlenmiş doku için, 10 dakika boyunca 2 kez yıkayın. Her ikisi için de yörüngesel çalkalayıcıda nazik bir ajitasyon kullanın.
- Bu süre zarfında, büyük Petri kabındaki parafilmi değiştirin
- Ligazı soğuk bir blokta tutarken, ligasyon stoğundaki ligazı 1:40 oranında 5.1. adımdan itibaren seyreltin. Ligazı numunelere eklemeden hemen önce bu seyreltmeyi gerçekleştirin.
- Bölüm 4'te olduğu gibi, ligaz eklemeden önce numunelerden mümkün olduğunca fazla yıkama tamponu A'yı çıkarın.
- Kültürlü hücreler için: Transfer kapakları parafilme alınmış Petri kabına geri döner. Örtü fişlerine 40 μL ligasyon karışımı ekleyin, kapakların etrafına küçük su dolu Petri tabakları yerleştirin ve büyük Petri kabını örtün.
- Dilimlenmiş doku için: Adım 5.4'ten itibaren her bir oyuğa 250 μL ligasyon karışımı ekleyin ve plakayı örtün.
- Numuneleri 37 °C'de 30 dakika boyunca inkübe edin.
6. Amplifikasyon
- Amplifikasyon stoğunu moleküler sınıf suda 1:5 karıştırın.
- Bölüm 4'te olduğu gibi, kapak fişlerini dikkatlice aktarın ve ligasyon karışımını dilimlenmiş dokudan çıkarın.
- Numuneleri 500 μL yıkama tamponu A'da yıkayın
- Kültürlenmiş hücreler için, 2 dakika boyunca 2 kez yıkayın. Dilimlenmiş doku için, 10 dakika boyunca 2 kez yıkayın. Her ikisi için de yörüngesel çalkalayıcıda nazik bir ajitasyon kullanın.
- Bu süre zarfında, büyük Petri kabındaki parafilmi değiştirin
- Polimerazı numunelere eklemeden hemen önce bu seyreltmeyi gerçekleştirin. Polimerazı soğuk bir blok üzerinde tutarken, polimerazı seyreltin
- Kültürlenmiş hücreler için, polimeraz 1:80'i amplifikasyon stoğunda adım 6.1'den itibaren seyreltin.
- Dilimlenmiş doku için, polimeraz 1:40'ı amplifikasyon stoğunda adım 6.1'den itibaren seyreltin.
- Adım 4'te olduğu gibi, polimerazı eklemeden önce numunelerden mümkün olduğunca fazla yıkama tamponu A'yı çıkarın.
- Kültürlü hücreler için: Kapakları parafilme alınmış Petri kabına geri aktarın. Adım 6.4.1'den itibaren amplifikasyon karışımının 40 μL'sini kapak kapaklarına ekleyin, kapakların etrafına küçük su dolu Petri tabakları yerleştirin ve büyük Petri kabını örtün. Numuneleri 37 °C'de 100 dakika boyunca inkübe edin.
- Dilimlenmiş doku için: Adım 6.4.2'den amplifikasyon karışımının 250 μL'sini her bir oyuğa ekleyin ve plakayı örtün. Numuneleri 37 °C'de 2 saat boyunca inkübe edin.
NOT: Bu süre zarfında slaytları hazırlayın ve etiketleyin.
7. Montaj
- Adım 4'te olduğu gibi, kapak kapaklarını dikkatlice aktarın ve amplifikasyon karışımını dilimlenmiş dokudan çıkarın.
- Numuneleri 500 μL yıkama tamponu B'de 10 dakika boyunca 2 kez orbital çalkalayıcı üzerinde nazik bir çalkalama ile yıkayın.
- Numuneleri 500 μL'lik %1 yıkama tamponu B'de yörüngesel çalkalayıcı üzerinde nazik bir çalkalama ile 1 dakika boyunca yıkayın.
- Kültürlü hücreler için:
- Bir slaydın üzerine 3 μL montaj ortamı bırakın
- Kapak kapağındaki fazla yıkama tamponuna dokunun ve ardından kapak kapağını (hücreler aşağı bakacak şekilde) montaj ortamına yerleştirin. Kapak kaymasını yerinde kapatmak için kenarları az miktarda şeffaf oje ile kapatın.
- Dilimlenmiş doku için:
- Bir doku dilimini hazırlanan slayda dikkatlice aktarın ve düzenleyin, böylece dilim düz durur. 5-10 μL montaj ortamını (miktar dilimin boyutuna bağlı olacaktır) doku dilimine bırakın
- Doku diliminin üzerine dikkatlice bir cam örtü parçası yerleştirin ve kapak kaymasını yerinde kapatmak için kenar boyunca az miktarda şeffaf oje ile kapatın.
- Mikroskop altında analiz etmeden önce en az 15 dakika bekleyin veya -20 ° C'de saklayın.
8. Konfokal mikroskopla dijital görüntüler elde edin
- Tüm tedavilerden numuneler arasında alım ayarlarını (ör. lazer gücü, kazanç, ofset) optimize edin. Optimizasyonun, arka plan gürültüsünü azaltmayı ve floresan sinyallerinin yoğunluğunu aşırı doyurmadan sinyali geliştirmeyi içerdiğinden emin olun. Ayarlar belirlendikten sonra, elde edilen tüm görüntülere aynı alma ayarlarını uygulayın.
NOT: Aşağıdaki edinme ayrıntıları Nikon A1 konfokal mikroskop ve Nikon NIS AR Elements yazılımı ile kullanılabilir. - Slaytı sahne alanında örnekle ayarlayın ve göz merceğinden DAPI kullanarak numunenin odak düzlemini bulun.
- Göz bağlantı noktasına tıklayarak göz bağlantı noktasını kapatın ve ayarları yapmak için bir optik yapılandırma düğmesi seçin.
- Arka plan gürültüsünü azaltmak ve floresan sinyalini geliştirmek için her floresan kanalın kazancı, ofseti ve lazer gücünü ayarlayın. Floresan sinyalinin 8.5-8.6 numaralı adımlarda belirtildiği gibi aşırı doygun hale gelmediğinden emin olun.
- Floresan sinyali için sahte renk kullanarak aşırı doygunluğu izleyin. Canlı görüntünün alt kısmında, kullanılmakta olan floresan kanalıyla etiketlenmiş sekmeyi sağ tıklatın.
- Ardından, Kanal Renklendirme'yi seçin ve floresan yoğunluğunu ısı haritası benzeri bir sahte renkte görselleştirmek için Gökkuşağı Koyu gibi bir sahte renk seçin. Rainbow Dark'ta daha soğuk renkler daha az floresan yoğunluğunu, daha sıcak renkler ise daha fazla floresan yoğunluğunu gösterir.
- Tüm floresan kanallar optimize edildikten sonra, daha önce seçilen optik yapılandırma düğmesine sağ tıklayın ve bu düğme için Geçerli Kamera Ayarını Ata'yı seçin.
- Seçilen ayarların her tedavi grubundan rastgele bir örnek için yeterli olduğunu doğrulayın. Seçilen ayarlar bu örneklerden herhangi birini aşırı doyuruyorsa, aşırı doygunluğu ortadan kaldırmak için adım 8.4'ü tekrarlayın.
- Kültürlü nöronlar için 8.10-8.16 arasındaki adımları izleyin.
- Göz portunu kullanarak, diğer dendritlerle minimum örtüşmeye sahip dendritli bir nöron arayın.
- Göz portunu kapatın ve seçilen nöronun hücre gövdesini görselleştirmek için DAPI kanalını kullanın. Nöronu görüş alanının ortasında ortalamak için soma'nın merkezine çift tıklayın.
- MAP2 kanalını kullanarak, canlı tarama ile MAP2 sinyali için en iyi odak düzlemini bulun.
- ND Edinme sekmesi altında, Dosyaya Kaydet'e tıklayın ve görüntüyü Gözat altında kaydetmek için bir dosya seçin. Ardından, dosya adını girin.
- Z sekmesi altında, Aralık Tarafından Tanımlanan Simetrik Mod seçeneğini belirleyin. Odağı en iyi MAP2 düzlemine ayarlayın ve bu odak düzlemini z-yığınının ortası olarak ayarlamak için Göreli düğmesine tıklayın.
- 1 μm adımlarla aralığı 5 μm'ye ayarlayın ve Z Hareketi Sırasında Aktif Deklanşörü Kapat'ı işaretlediğinizden emin olun. Dalga Boyu sekmesi altında, Optik Conf altında önceden yapılandırılmış alma ayarlarıyla optik düğmenin adını seçin. Ardından, Şimdi Çalıştır'a tıklayın.
- Coverslip/tedavi başına yaklaşık 10 nöron için 8.1.10-8.1.15 adımlarını tekrarlayın.
- Dilimlenmiş doku için 8.18-8.22 arasındaki adımları izleyin.
- Göz alıcı noktayı kullanarak ilgilendiğiniz bölgeyi arayın. Örneğin, hipokampusun CA1'ini bulun.
- Göz portunu kapatın ve canlı tarama ile MAP2 sinyali için en iyi odak düzlemini bulmak üzere MAP2 kanalını kullanın.
- Al menüsü altında, Büyük Resmi Tara'yı seçin. Ardından, açılan panelden Yakalama panelinin altındaki önceden yapılandırılmış alma ayarlarıyla optik düğmenin adını seçin. Ayrıca, bu panelde doğru hedefi seçtiğinizden emin olun.
- Alan panelinin ve göz merceğinin altında, ilgilenilen bölgenin sınırlarını ayarlamak için ok tuşlarını kullanın. Ardından, Büyük Resmi Dosyaya Kaydet'e tıklayın ve görüntü için bir kaydetme yolu dosya adı oluşturun.
- Kurulum panelinin altında, Çok Kanallı Yakalama'nın işaretli olduğundan emin olun ve ardından Optik Conf altında önceden yapılandırılmış alma ayarlarıyla optik düğmenin adını seçin.
NOT: Büyük bir görüntü için bir z-yığını mümkündür, ancak tarama süresini uzatır.
9. Analiz
- Edinme ayarlarına benzer şekilde, eşik ayarlarını optimize etmek için tüm tedavilerden örnekler kullanın. Eşik optimizasyonunun, floresan sinyallerin yoğunluğunu aşırı doyurmadan arka plan gürültüsünü azaltmaya ve sinyali geliştirmeye odaklandığından emin olun. Bu ayarlar belirlendikten sonra, 9.2-9.3 adımlarında açıklandığı gibi analiz için kullanılan tüm görüntülere aynı eşik ayarlarını uygulayın.
- ImageJ'de eşik seçeneği Image > Adjust > Threshold menüsünün altında bulunur. Görüntünün koyu arka planı varsa Koyu Arka Plan seçeneğini belirleyin.
- Ardından, daha önce belirlenen optimize edilmiş eşik ayarlarına göre eşiğin üst ve alt sınırlarını ayarlayın ve ardından Uygula'ya tıklayın.
- Kültürlü hücreler için, dendritler ve soma dahil olmak üzere her nöron için bir ROI çizmek üzere MAP2 kanalını ve bir serbest el ilgi alanı (ROI) aracını kullanın. Dilimlenmiş doku için, dilim görüntüsünde ilgi alanını kapsülleyen serbest bir yatırım getirisi çizin (örneğin, hipokampus içindeki CA1'in stratum radyatumu).
- Yatırım getirisinin alanını elde edin. ImageJ'de, Analiz Et > Ölçü menüsünün altındaki alanı ölçün.
- 9.7-9.9 adımlarını izleyerek ImageJ'de Partikül Analizi gibi otomatik bir algılama aracı kullanarak her yatırım getirisindeki puncta sayısını tespit edin.
- Parçacıkları Analiz Et > Analiz et menüsünün altındaki Partikül Analizi seçeneğini bulun. İlk olarak, puncta boyut çapını, tipik olarak 0.1-3 μm2'yi tanımlayın.
- Ardından, Kaplama Maskeleri seçeneği Göster açılır menüden ve Sonuçları Görüntüle seçeneği. Ardından, Tamam'a tıklayın.
- Seçilen çap aralığıyla puncta algılanmazsa, bu analizle tüm puncta algılanana kadar aralığı ayarlayın. Tüm görüntüler için aynı Parçacık Analizi ayarlarını kullandığınızdan emin olun.
- 9.11-9.13 adımlarını izleyerek puncta sayısını tek bir ilgi bölgesinin alanına bölün.
- ImageJ'deki Sonuçlar açılır penceresinden her resmin sonuçlarını kopyalayıp bir e-tabloya yapıştırın.
- İlk olarak, verilerin hangi dosyadan ve örnekten elde edildiğini belirleyin. Ardından, ROI alanını punkta sayısına bölün.
- Ardından, Sonuçlar açılır penceresindeki verileri temizleyin ve 9.2-9.12 arasındaki adımları yineleyin.
- Numuneleri kontrol etmek için sonuçları normalleştirin: Kontrol numuneleri için sonuçların ortalamasının (puncta/ROI alanı sayısı). Ardından, normalleştirilmiş sonuçları elde etmek için tüm numunelerin elde edilen sonuçlarını kontrolün ortalamasına bölün. Kontrol numunelerinin yeni ortalaması 1'e eşit olmalıdır.
Sonuçlar
Heaney ve ark.6'dan değiştirilen veriler, artan sinaps oluşumunun beklendiği bir deneyi göstermek için sunulmuştur (daha fazla bilgi ve mekanizma hakkında daha derinlemesine bir tartışma için lütfen 6'ya bakınız). Daha önce, hızlı antidepresanların etkili olması için inhibitör metabotropik reseptör GABAB'ın (gama-aminobütirik asit alt tipi B) aktivasyonunu gerektirdiği gösterilmiştir13. Ayrıca, önceki veriler hızlı anti...
Tartışmalar
DetectSyn, birbirlerinden 40 nm uzaklıktaki proteinleri tespit etmek için bir yakınlık ligasyonu testi kullanan ve sinaps oluşumunun tespit edilmesini sağlayan hızlı bir tahlildir. Bu teknik, sinaps oluşumu için sadece vekil ölçümler olarak hizmet veren mevcut floresan tahlillerini geliştirir. DetectSyn, birbirlerinin 40 nm içinde, yani sinaptik yarık içinde lokalize olan sinaptik proteinlerdeki ölçülebilir değişiklikleri tespit eder. Ayrıca, DetectSyn daha uygun maliyetlidir ve sinapsları ölçme...
Açıklamalar
Yazarlar çıkar çatışması olmadığını bildirmektedir.
Teşekkürler
Bu çalışma, Ulusal Sağlık Enstitüleri NINDS R01 NS105005 (KBY) ve NS105005-03S1 (KBY), Savunma Bakanlığı USAMRMC W81XWH-14-1-0061 (KBY), NIAAA R01AA016852, NIAAA T32AA007565 (CFH) ve FRAXA Research (CFH) ve Alzheimer Derneği, AARG-NTF-21-852843 (KBY), AARF-19-614794-RAPID (KBY) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10x PBS | Fisher Scientific | BP39920 | PBS made in house works, as well. |
| 24 well plates | Fisher Scientific | FB012929 | For tissue slices, pre-sterilized plates may be unnecessary. |
| 50 mL conical tubes | Fisher Scientific | 14-432-22 | |
| Aluminium foil | Fisher Scientific | 15-078-290 | |
| Chicken anti-MAP2 antibody | Abcam | ab5392 | |
| Clear nail polish | Fisher Scientific | NC1849418 | Other clear nail polish works, as well. |
| Cold block | Fisher Scientific | 13131012 | |
| Computer workstation | HP | ||
| Confocal or fluorescent microscope | Nikon | A1R HD25 | |
| Donkey anti-chicken FITC | Fisher Scientific | SA1-72000 | |
| Duolink donkey anti-Mouse PLUS | Sigma | DUO92001 | |
| Duolink donkey anti-Rabbit MINUS | Sigma | DUO92005 | |
| Duolink In Situ Detection Reagents Far Red | Sigma | DUO92013 | Contains ligation stock, amplification stock, ligase, and polymerase. |
| Duolink In Situ Mounting Medium with DAPI | Sigma | DUO82040 | |
| Duolink In Situ Wash Buffers, Fluorescence | Sigma | DUO82049 | Contains Wash Buffer A and Wash Buffer B; dilute Wash Buffer B to 1% in diH20 for 1% Wash Buffer B. |
| Fine-tipped paintbrush | Fisher Scientific | NC9691026 | Sable hair, size 00 or 000, can also find at craft stores |
| Fisherbrand Cover Glasses: Rectangles | Fisher Scientific | 12545MP | Cover glass is unnecessary for cultured neurons already on glass coverslips. |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 1255015 | For cultured neurons already on glass coverslips, Superfrost slides may be unnecessary. |
| Freezer, -20°C | VWR | 76449-108 | |
| Glass coverslips | Fisher Scientific | 125480 | |
| Glycine | Fisher Scientific | BP381-1 | |
| Image processing software | e.g. NIS Elements, ImageJ | ||
| Incubator | Fisher Scientific | 15-015-2633 | |
| Large petri dish, 100mm | Fisher Scientific | FB0875712 | |
| Molecular grade water | Fisher Scientific | BP24701 | |
| Mouse anti-Synapsin1 antibody | Synaptic Systems | 106-011 | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| Orbital shaker | Fisher Scientific | 02-106-1013 | |
| Parafilm | Fisher Scientific | 13-374-10 | |
| Pipette tips | Fisher Scientific | 02-707-025 | |
| Pipettes | Fisher Scientific | 14-388-100 | Working volumes range from 3 µL to 500 µL |
| Plastic pasteur pipette | Fisher Scientific | 02-708-006 | |
| Precision tweezers/foreceps | Fisher Scientific | 12-000-122 | |
| Rabbit anti-PSD95 antibody | Abcam | ab18258 | Other antibody pairs may work, as well, with optimization. |
| Refrigerator | VWR | 76470-402 | |
| Small petri dish, 60 mm | Fisher Scientific | FB0875713A | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tween 20 | Fisher Scientific | BP337-100 |
Referanslar
- Südhof, T. C. Towards an understanding of synapse formation. Neuron. 100 (2), 276-293 (2018).
- Bliss, T. V., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361 (6407), 31-39 (1993).
- Heaney, C. F., Raab-Graham, K. F. Dysregulated protein synthesis in major depressive disorder. The Oxford Handbook of Neuronal Protein Synthesis. , 510-532 (2018).
- Masliah, E., Crews, L., Hansen, L. Synaptic remodeling during aging and in Alzheimer's disease. Journal of Alzheimer's Disease. 9, 91-99 (2006).
- van Spronsen, M., Hoogenraad, C. C. Synapse pathology in psychiatric and neurologic disease. Current Neurology and Neuroscience Reports. 10 (3), 207-214 (2010).
- Heaney, C. F., Namjoshi, S. V., Uneri, A., Bach, E. C., Weiner, J. L., Raab-Graham, K. F. Role of FMRP in rapid antidepressant effects and synapse regulation. Molecular Psychiatry. 26 (6), 2350-2362 (2021).
- Pchitskaya, E., Bezprozvanny, I. Dendritic spines shape analysis-Classification or clusterization? Perspective. Frontiers in Synaptic Neuroscience. 12, 31 (2020).
- Alvarez, V. A., Sabatini, B. L. Anatomical and physiological plasticity of dendritic spines. Annual Review of Neuroscience. 30 (1), 79-97 (2007).
- Berry, K. P., Nedivi, E. Spine Dynamics: Are they all the same. Neuron. 96 (1), 43-55 (2017).
- Micheva, K. D., Smith, S. J. Array tomography: A new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55 (1), 25-36 (2007).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments: JoVE. (65), e3564 (2012).
- Workman, E. R., Niere, F., Raab-Graham, K. F. mTORC1-dependent protein synthesis underlying rapid antidepressant effect requires GABABR signaling. Neuropharmacology. 73, 192-203 (2013).
- Li, N., et al. mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists. Science. 329 (5994), 959-964 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır