A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نموذج فأر BALB/c الوليدي لالتهاب الأمعاء والقولون الناخر
* These authors contributed equally
In This Article
Erratum Notice
Summary
التهاب الأمعاء والقولون الناخر (NEC) هو أشد أمراض الجهاز الهضمي (GI) التي تحدث غالبا عند الأطفال الخدج ، وخاصة الرضع منخفضي الوزن عند الولادة ، مع ارتفاع معدل الوفيات وعدم وضوح الإمراض. قد يكون سبب NEC مرتبطا بتشوهات الجهاز المناعي الالتهابي. نموذج حيواني NEC هو أداة لا غنى عنها لأبحاث المناعة لمرض NEC. عادة ما تستخدم النماذج الحيوانية NEC الفئران الوليدة C57BL / 6J. نادرا ما تستخدم الفئران الوليدة BALB / c. وقد أظهرت الدراسات ذات الصلة أنه عندما تصاب الفئران بالعدوى ، يكون تمايز الخلايا Th2 سائدا في الفئران BALB / c مقارنة بالفئران C57BL / 6J. وقد أشارت الدراسات إلى أن حدوث وتطور NEC يرتبط بزيادة في الخلايا المساعدة التائية من النوع 2 (Th2) ويرافقه عموما عدوى. لذلك ، استخدمت هذه الدراسة الفئران BALB / c حديثي الولادة للحث على نموذج NEC مع خصائص سريرية مماثلة وتغيرات مرضية معوية مثل تلك التي لوحظت في الأطفال الذين يعانون من NEC. هناك ما يبرر إجراء مزيد من الدراسة لتحديد ما إذا كان يمكن استخدام هذا النموذج الحيواني لدراسة استجابات خلايا Th2 في NEC.
Abstract
التهاب الأمعاء والقولون الناخر (NEC) هو أشد أمراض الجهاز الهضمي (GI) التي تحدث غالبا عند الأطفال الخدج ، وخاصة الرضع منخفضي الوزن عند الولادة ، مع ارتفاع معدل الوفيات وعدم وضوح الإمراض. قد يكون سبب NEC مرتبطا بتشوهات الجهاز المناعي الالتهابي. نموذج حيواني NEC هو أداة لا غنى عنها لأبحاث المناعة لمرض NEC. عادة ما تستخدم النماذج الحيوانية NEC الفئران الوليدة C57BL / 6J. نادرا ما تستخدم الفئران الوليدة BALB / c. وقد أظهرت الدراسات ذات الصلة أنه عندما تصاب الفئران بالعدوى ، يكون تمايز الخلايا Th2 سائدا في الفئران BALB / c مقارنة بالفئران C57BL / 6J. وقد أشارت الدراسات إلى أن حدوث وتطور NEC يرتبط بزيادة في الخلايا المساعدة التائية من النوع 2 (Th2) ويرافقه عموما عدوى. لذلك ، استخدمت هذه الدراسة الفئران BALB / c حديثي الولادة للحث على نموذج NEC مع خصائص سريرية مماثلة وتغيرات مرضية معوية مثل تلك التي لوحظت في الأطفال الذين يعانون من NEC. هناك ما يبرر إجراء مزيد من الدراسة لتحديد ما إذا كان يمكن استخدام هذا النموذج الحيواني لدراسة استجابات خلايا Th2 في NEC.
Introduction
يحدث التهاب الأمعاء والقولون الناخر (NEC)، وهو أشد أمراض الجهاز الهضمي (GI)، لدى معظم الأطفال الخدج (>90٪)، وخاصة أولئك الذين يعانون من انخفاض الوزن عند الولادة (VLBW)1. في الرضع VLBW ، يتراوح معدل الإصابة بالمرض من 10٪ إلى 12٪ ، وتتراوح وفيات الأطفال الذين تم تشخيصهم ب NEC بين 20٪ و 30٪ 2,3. قد يكون سبب NEC مرتبطا بإصابات الغشاء المخاطي ، وغزو البكتيريا المسببة للأمراض ، والتغذية المعوية ، والتي يمكن أن تؤدي إلى استجابات التهابية وتحريض الإصابات المعوية في المضيفين الحساسين 3. التسبب في NEC غير واضح. تظهر الأبحاث ذات الصلة أن الاستجابة المناعية للرضيع المصاب غير طبيعية، وأن القابلية الجينية والتوتر الوعائي الدقيق والتغيرات البكتيرية المعوية قد تلعب أدوارا مهمة في المرض3.
النموذج الحيواني NEC هو أداة لا غنى عنها للبحث في التسبب في NEC. الأنواع الحيوانية المستخدمة في نماذج NEC هي الخنازير والجرذان والفئران. ومع ذلك ، نظرا لفترة الحمل الطويلة ، ودورات النمو ، وارتفاع التكاليف ، في السنوات الأخيرة ، لم تكن الخنازير الخيار الأول لنماذج NEC وتم استبدالها بالجرذان أو الفئران 4. نظرا لوجود اختلافات في الخلفية المناعية لسلالات الفئران المختلفة5 ، تحتاج الدراسات المختلفة إلى استخدام سلالات مختلفة من الفئران لإنشاء نماذج حيوانية من NEC. الفئران BALB / c لديها ميزة مهمة. عندما تكون مصابة أو تتعامل مع ضرر خارجي ، يكون استقطاب خلايا TH2 أثناء العدوى في الفئران أقوى بكثير من ذلك الموجود في سلالات أخرى من الفئران6,7,8. تلعب الخلايا التائية المساعدة دورا حاسما في حدوث وتطور NEC ، وخاصة تطور خلايا TH2 3,9,10,11. لذلك ، استخدمت هذه الدراسة الفئران BALB / c لإنشاء نموذج NEC ، والذي قد يكون مفيدا لأبحاث مرض NEC على الخلايا التائية.
Protocol
تمت الموافقة على هذا البحث من قبل لجنة الأخلاقيات الطبية في مركز قوانغتشو الطبي للنساء والأطفال (رقم 174A01) ولجنة أخلاقيات الحيوان التابعة لمركز جوانزو فوريفرجين للعلوم البيولوجية للحيوانات (IACUC-G160100). تم تربية جميع الحيوانات في نفس الغرفة في بيئة محددة خالية من مسببات الأمراض (SPF) ، وتم إجراء التجارب في بيئة تقليدية. كانت الفئران المستخدمة للتكاثر تبلغ من العمر 7-8 أسابيع. تم فصل الفئران لتحفيز NEC (n = 72) عن السد في اليوم 4 ، وتم الاحتفاظ بالسدود (n = 14) في القفص الأصلي ورعاية مجموعة الفئران الضابطة (Cont.) (n = 24).
1. إعداد الكواشف والأجهزة
- تحضير بديل الحليب للفئران BALB / c في النسبة المقابلة (مسحوق حليب الأطفال الخدج: مسحوق حليب الماعز = 2: 1).
ملاحظة: يبين الجدول 1 التركيبات الغذائية النهائية للحليب الصناعي12. - محلول LPS (2.5 مجم / مل)
- يذوب ما مجموعه 10 ملغ من مسحوق LPS في 4 مل من الماء المقطر المزدوج المعقم ، ويخلط جيدا ، ويخزن في الثلاجة عند -20 درجة مئوية بعد الاقتباس.
ملاحظة: يتم تخزين محلول LPS في الظلام عند 2-8 درجة مئوية للاستخدام الفوري أو عند -20 درجة مئوية للتخزين على المدى الطويل.
- يذوب ما مجموعه 10 ملغ من مسحوق LPS في 4 مل من الماء المقطر المزدوج المعقم ، ويخلط جيدا ، ويخزن في الثلاجة عند -20 درجة مئوية بعد الاقتباس.
2. الحث على التهاب الأمعاء والقولون الناخر في الفئران BALB / c حديثي الولادة
- إطعام الفئران حديثي الولادة.
- احتفظ بالفئران حديثي الولادة في نفس القفص مع السد ، الذي يرضعه السد في الأيام 0-4.
- في ليلة اليوم 4 (عندما تزن الفئران حديثي الولادة 2.5-3 جم) ، افصل الفئران حديثي الولادة في مجموعة NEC عن السد لحث NEC ، واحتفظ بها في حاضنة ، وأطعمها بالصيغة. ومع ذلك ، يسمح لمجموعة Cont. بالبقاء مع السد وتغذيته.
ملاحظة: يجب تربية الفئران حديثي الولادة التي يتم فصلها عن السد في حاضنة بسبب ضعف تنظيم درجة حرارة الجسم.
- قم بتحضير أنبوب gavage عن طريق نقعه في 75٪ من حاويات الكحول لمدة 1-2 دقيقة واغسلها مرتين في ماء نظيف ومقطر مزدوج.
ملاحظة: لتجنب التلوث المتبادل بين الفئران ، يجب إجراء العملية المذكورة أعلاه بعد إطعام كل ماوس. - حث نموذج NEC.
- خذ الفئران حديثي الولادة من السد في اليوم 4 وصومها لليلة واحدة.
- قم بتجفيف الفئران باستخدام LPS (20-30 ميكرولتر في المرة الواحدة) وأطعمها بالصيغة في اليوم 5 (40-50 ميكرولتر في المرة الواحدة).
- من اليوم 5 فصاعدا ، تخضع الفئران لدورة نقص الأكسجة وإعادة الأكسجين والصدمة الباردة مرتين في اليوم لمدة 5 أيام. ضع الفئران في جهاز نقص الأكسجة بنسبة 5٪ O2 لمدة 90 ثانية وأعد أكسجتها لمدة 3 دقائق ؛ كرر هذه العملية خمس مرات. بعد ذلك ، ضع الفئران في بيئة 4 درجات مئوية لمدة 15 دقيقة ثم انقلها إلى حاضنة. انظر الشكل 1 ألف ، باء لعملية الحث.
ملاحظة: تم إجراء دورة من التحفيز البارد لنقص الأكسجة وإعادة الأكسجين مرة واحدة في الصباح ومرة واحدة في فترة ما بعد الظهر. تم تحضير خليط من 5٪ O2 مع 95٪ N2 في الحاوية ، وتم قياس التركيز باستخدام كاشف الأكسجين.
- راقب عن كثب جميع الفئران ، ووزنها كل يوم ، وسجل بقاء الفئران خلال فترة الحث ، وسجل خصائص البراز (مع أو بدون براز لزج / براز دموي).
ملاحظة: يستمر نموذج NEC المعمول به لمدة 5 أيام. - في اليوم 10 أو قبل ذلك ، عندما تظهر الفئران أعراض NEC (العلوص ، الهيماتوتشيزيا ، الإسهال)13 ، قم بالقتل الرحيم للفئران عن طريق استنشاق التخدير باستخدام الأيزوفلوران ، ثم جمع الأنسجة المعوية على الفور. لا تجمع الأنسجة من الفئران التي ماتت تلقائيا.
ملاحظة: في هذه الدراسة ، تم تكييف نقطة النهاية ل euthenasia الفأر عندما أظهر الفأر الدم وزرقة الجسم كله.
3. غافاج الماوس
- إصلاح رأس الماوس ، وعقد أنبوب المعدة في اليد اليمنى. أدخل أنبوب المعدة من الزاوية اليسرى من فم الماوس.
ملاحظة: تم تثبيت الرأس بالسبابة على رأس الماوس والضغط عليه برفق للخلف والأسفل لمنع الماوس من الانحناء للأمام أثناء العملية والتأثير على إدخال أنبوب المعدة. - حرك الأنبوب ببطء إلى وسط الفم. بعد إدخال الأنبوب حوالي 2-3 سم ، ادفع 40-50 ميكرولتر من الصيغة أو 20-30 ميكرولتر من LPS إلى الجهاز الهضمي. انظر الشكل 2 ألف ، ب للحصول على gavage.
ملاحظة: في ظل الظروف العادية ، يتم إدخال أنبوب المعدة في الجهاز الهضمي بسلاسة. إذا كان لدى الفأر منعكس قوي على القيء ، فقد تم إدخال أنبوب المعدة في القصبة الهوائية عن طريق الخطأ. يجب سحب أنبوب المعدة بلطف والسماح للفأر بالراحة لفترة من الوقت قبل محاولة الاستئصال مرة أخرى. بالإضافة إلى ذلك ، يتم استخدام إجراء gavage للحث على نموذج NEC قبل القتل الرحيم للفئران.
4. جمع عينات الأنسجة المعوية الطازجة لتلطيخ الهيماتوكسيلين والإيوسين (H & E)
- اغمر الأنسجة الدوارة الطازجة من الماوس في الفورمالين بنسبة 10٪ لمدة 24 ساعة.
- قم بتضمين الأنسجة في البارافين وقطعها إلى أقسام 4 ميكرومتر.
- قم بإزالة البارافينات من الأقسام الموجودة في الزيلين وقم بإعادة ترطيبها على التوالي في الإيثانول المطلق ، والإيثانول بنسبة 95٪ ، والإيثانول بنسبة 80٪ ، والإيثانول بنسبة 70٪ ، والماء المقطر ، مع النقع لمدة 5 دقائق في كل خطوة. قم بتلطيخ الأقسام بمحلول الهيماتوكسيلين لمدة 5 دقائق وتمييزها في 1٪ من حمض الهيدروكلوريك في 75٪ كحول لمدة 5 ثوان. أخيرا ، قم بتلطيخها بمحلول الإيوسين لمدة 1 دقيقة.
ملاحظة: بعد تلطيخ بمحلول الهيماتوكسيلين ، يجب تمييزه بحمض الهيدروكلوريك بنسبة 1٪ في الإيثانول لإزالة محلول الهيماتوكسيلين المرتبط بشكل مفرط وصبغة الهيماتوكسيلين السيتوبلازمية. تركيز 1 ٪ من حمض الهيدروكلوريك مناسب للأنسجة المعوية. - فحص الأنسجة المرضية للأنسجة المعوية عند تكبير 40x.
النتائج
تم تحفيز نموذج BALB / c mouse NEC عن طريق تغذية الصيغة ، وتغذية LPS ، ونقص الأكسجة ، والتحفيز البارد. خلال فترة الحث ، لوحظت الفئران لأمراض الأمعاء ، وخصائص البراز ، وتغيرات وزن الجسم ، والبقاء على قيد الحياة يوميا. صور تمثيلية للأمعاء الدقيقة أثناء تحريض NEC ؛ تمثل الأرقام في الصورة درجة علم الأمراض ?...
Discussion
NEC هو حالة الطوارئ الأكثر شيوعا في الجهاز الهضمي لحديثي الولادة ، مع ارتفاع معدل الإصابة والوفيات ، وخاصة عند الأطفال الخدج1،2،3. ومع ذلك ، فإن التسبب في المرض لا يزال غير واضح. ويعتقد حاليا أن تلف الغشاء المخاطي ، وغزو مسببات الأمراض ، والت...
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
يشكر المؤلفون بنك الموارد البيولوجية السريرية في مركز قوانغتشو الطبي للنساء والأطفال على توفير العينة السريرية ومركز جوانزو فوريفرجين للعلوم البيولوجية للحيوانات على توفير الفئران. تم دعم هذا البحث من قبل منحة المؤسسة الوطنية للعلوم الطبيعية في الصين 81770510 (R.Z).
Materials
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Sinopharm Chemical Reagent Co., LTD. | 100092683 | |
| Goat Milk powder | Petag | 71795558417 | |
| HE dye solution | Sinopharm Chemical Reagent Co., LTD. | G1003 | |
| Isoflurane | RWD, Shenzhen Reward Life Technology Co., LTD. | R510 | |
| LPS | Sigma-Adrich | L2880 | |
| Medical oxygen | various | various | |
| Microscope | NIKON | NIKON imaging system (DS-Ri2) | |
| Neutral resin | Sinopharm Chemical Reagent Co., LTD. | 10004160 | |
| Paraffin | various | various | |
| Premature baby milk powder | Abbott | 57430 | |
| Xylene | Sinopharm Chemical Reagent Co., LTD. | 10023418 | |
| 1% Hydrochloric acid | various | various | |
| 10% Formalin | LEAGENE | DF0110 |
References
- Horbar, J. D., et al. Mortality and neonatal morbidity among infants 501 to 1500 grams from 2000 to 2009. Pediatrics. 129 (6), 1019-1026 (2012).
- Stoll, B. J., et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics. 126 (3), 443-456 (2010).
- Neu, J., Walker, W. A. Necrotizing enterocolitis. New England Journal of Medicine. 364 (3), 255-264 (2011).
- Sangild, P. T., et al. Invited Review: The preterm pig as a model in pediatric gastroenterology. Journal of Animal Science. 91 (10), 4713-4729 (2013).
- Cancro, M. P., Sigal, N. H., Klinman, N. R. Differential expression of an equivalent clonotype among BALB/c and C57BL/6 mice. Journal of Experimental Medicine. 147 (1), 1-12 (1978).
- Kuroda, E., Yamashita, U. Mechanisms of enhanced macrophage-mediated prostaglandin E2 production and its suppressive role in Th1 activation in Th2-dominant BALB/c mice. Journal of Immunology. 170 (2), 757-764 (2003).
- Fornefett, J., et al. Comparative analysis of clinics, pathologies and immune responses in BALB/c and C57BL/6 mice infected with Streptobacillus moniliformis. Microbes and Infection. 20 (2), 101-110 (2018).
- Rosas, L. E., et al. Genetic background influences immune responses and disease outcome of cutaneous L. mexicana infection in mice. International Immunology. 17 (10), 1347-1357 (2005).
- Sproat, T., Payne, R. P., Embleton, N. D., Berrington, J., Hambleton, S. T cells in preterm infants and the influence of milk diet. Frontiers in Immunology. 11, 1035 (2020).
- Nanthakumar, N., et al. The mechanism of excessive intestinal inflammation in necrotizing enterocolitis: an immature innate immune response. PLoS One. 6 (3), 17776 (2011).
- Afrazi, A., et al. New insights into the pathogenesis and treatment of necrotizing enterocolitis: Toll-like receptors and beyond. Pediatric Research. 69 (3), 183-188 (2011).
- Auestad, N., Korsak, R. A., Bergstrom, J. D., Edmond, J. Milk-substitutes comparable to rat's milk; their preparation, composition and impact on development and metabolism in the artificially reared rat. British Journal of Nutrition. 61 (3), 495-518 (1989).
- Liu, Y., et al. Lactoferrin-induced myeloid-derived suppressor cell therapy attenuates pathologic inflammatory conditions in newborn mice. Journal of Clinical Investigation. 129 (10), 4261-4275 (2019).
- MohanKumar, K., et al. A murine neonatal model of necrotizing enterocolitis caused by anemia and red blood cell transfusions. Nature Communications. 10 (1), 3494 (2019).
- He, Y. M., et al. Transitory presence of myeloid-derived suppressor cells in neonates is critical for control of inflammation. Nature Medicine. 24 (2), 224-231 (2018).
- Cho, S. X., et al. Characterization of the pathoimmunology of necrotizing enterocolitis reveals novel therapeutic opportunities. Nature Communications. 11 (1), 5794 (2020).
- Halpern, M. D., et al. Decreased development of necrotizing enterocolitis in IL-18-deficient mice. American Journal of Physiology. Gastrointestinal and Liver Physiology. 294 (1), 20-26 (2007).
- Wu, N., et al. MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche. Nature. 592 (7855), 606-610 (2021).
- Nino, D. F., Sodhi, C. P., Hackam, D. J. Necrotizing enterocolitis: new insights into pathogenesis and mechanisms. Nature Reviews. Gastroenterology & Hepatology. 13 (10), 590-600 (2016).
- Chuang, S. L., et al. Cow's milk protein-specific T-helper type I/II cytokine responses in infants with necrotizing enterocolitis. Pediatric Allergy & Immunology. 20 (1), 45-52 (2009).
Erratum
Formal Correction: Erratum: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis
Posted by JoVE Editors on 3/07/2022. Citeable Link.
An erratum was issued for: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis. The Representative Results section was updated.
Figure 1 was updated from:

Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
to:
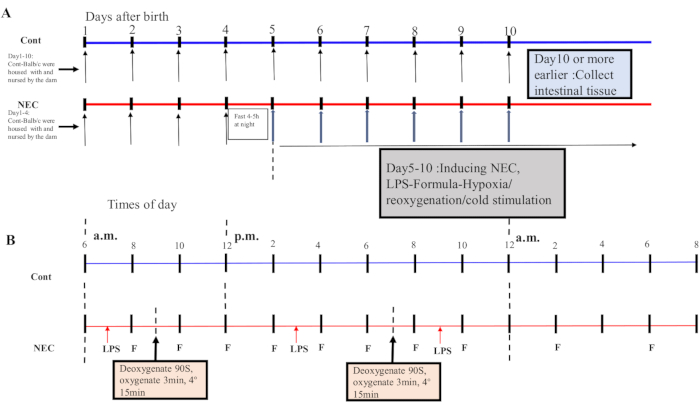
Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved