È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un modello murino BALB/c neonatale di enterocolite necrotizzante
* Questi autori hanno contribuito in egual misura
In questo articolo
Erratum Notice
Riepilogo
L'enterocolite necrotizzante (NEC) è la malattia gastrointestinale (GI) più grave che si verifica spesso nei neonati prematuri, in particolare nei neonati con peso alla nascita molto basso, con alta mortalità e patogenesi poco chiara. La causa del NEC può essere correlata ad anomalie del sistema immunitario infiammatorio. Un modello animale NEC è uno strumento indispensabile per la ricerca immunitaria sulla malattia NEC. I modelli animali NEC di solito usano topi neonatali C57BL / 6J; I topi neonatali BALB/c sono usati raramente. Studi correlati hanno dimostrato che quando i topi sono infetti, la differenziazione delle cellule Th2 è predominante nei topi BALB / c rispetto ai topi C57BL / 6J. Gli studi hanno suggerito che la presenza e lo sviluppo di NEC sono associati ad un aumento delle cellule T helper di tipo 2 (Th2) e sono generalmente accompagnati da infezione. Pertanto, questo studio ha utilizzato topi BALB/c neonatali per indurre un modello NEC con caratteristiche cliniche e cambiamenti patologici intestinali simili a quelli osservati nei bambini con NEC. Ulteriori studi sono necessari per determinare se questo modello animale potrebbe essere utilizzato per studiare le risposte delle cellule Th2 in NEC.
Abstract
L'enterocolite necrotizzante (NEC) è la malattia gastrointestinale (GI) più grave che si verifica spesso nei neonati prematuri, in particolare nei neonati con peso alla nascita molto basso, con alta mortalità e patogenesi poco chiara. La causa del NEC può essere correlata ad anomalie del sistema immunitario infiammatorio. Un modello animale NEC è uno strumento indispensabile per la ricerca immunitaria sulla malattia NEC. I modelli animali NEC di solito usano topi neonatali C57BL / 6J; I topi neonatali BALB/c sono usati raramente. Studi correlati hanno dimostrato che quando i topi sono infetti, la differenziazione delle cellule Th2 è predominante nei topi BALB / c rispetto ai topi C57BL / 6J. Gli studi hanno suggerito che la presenza e lo sviluppo di NEC sono associati ad un aumento delle cellule T helper di tipo 2 (Th2) e sono generalmente accompagnati da infezione. Pertanto, questo studio ha utilizzato topi BALB/c neonatali per indurre un modello NEC con caratteristiche cliniche e cambiamenti patologici intestinali simili a quelli osservati nei bambini con NEC. Ulteriori studi sono necessari per determinare se questo modello animale potrebbe essere utilizzato per studiare le risposte delle cellule Th2 in NEC.
Introduzione
L'enterocolite necrotizzante (NEC), la più grave malattia gastrointestinale (GI), si verifica nella maggior parte dei neonati prematuri (>90%), in particolare quelli con peso alla nascita molto basso (VLBW)1. Nei neonati VLBW, l'incidenza della malattia varia dal 10% al 12% e la mortalità dei bambini con diagnosi di NEC è compresa tra il 20% e il 30%2,3. La causa del NEC può essere correlata a lesioni della mucosa, invasione da parte di batteri patogeni e alimentazione intestinale, che può portare a risposte infiammatorie e all'induzione di lesioni intestinali in ospiti sensibili3. La patogenesi del NEC non è chiara. Ricerche pertinenti mostrano che la risposta immunitaria del bambino affetto è anormale e la suscettibilità genetica, la tensione microvascolare e i cambiamenti batterici intestinali possono svolgere un ruolo importante nella malattia3.
Il modello animale NEC è uno strumento indispensabile per la ricerca sulla patogenesi del NEC. Le specie animali utilizzate per i modelli NEC sono maiali, ratti e topi. Tuttavia, a causa del lungo periodo di gestazione, dei cicli di crescita e dei costi elevati, negli ultimi anni i suini non sono stati la prima scelta per i modelli NEC e sono stati sostituiti con ratti o topi4. Poiché ci sono differenze nel background immunitario di diversi ceppi di topo5, diversi studi devono utilizzare diversi ceppi di topi per stabilire modelli animali NEC. I topi BALB/c hanno una caratteristica importante; quando sono infettati o affrontano danni esterni, la polarizzazione delle cellule TH2 durante l'infezione nei topi è significativamente più forte di quella in altri ceppi di topi6,7,8. Le cellule T helper svolgono un ruolo cruciale nella comparsa e nella progressione di NEC, in particolare lo sviluppo di cellule TH23,9,10,11. Pertanto, questo studio ha utilizzato topi BALB / c per stabilire il modello NEC, che potrebbe essere utile per la ricerca sulla malattia NEC sulle cellule T.
Protocollo
Questa ricerca è stata approvata dal Comitato etico medico del Guangzhou Women and Children's Medical Center (n. 174A01) e dal Comitato etico animale del Guangzhou Forevergen Biosciences Laboratory Animal Center (IACUC-G160100). Tutti gli animali sono stati allevati nella stessa stanza in un ambiente specifico privo di agenti patogeni (SPF) e gli esperimenti sono stati condotti in un ambiente convenzionale. I topi utilizzati per l'allevamento avevano 7-8 settimane; i topi per indurre NEC (n = 72) sono stati separati dalla diga il giorno 4, e le dighe (n = 14) sono state tenute nella gabbia originale e allattate i topi del gruppo di controllo (Cont.) (n = 24).
1. Preparazione di reagenti e dispositivi
- Preparare il sostituto del latte per i topi BALB/c nel rapporto corrispondente (latte prematuro in polvere per bambini: latte di capra in polvere = 2:1).
NOTA: Le composizioni nutrizionali finali del latte artificiale12 sono riportate nella Tabella 1. - Soluzione di LPS (2,5 mg/mL)
- Sciogliere un totale di 10 mg di polvere di LPS in 4 ml di acqua distillata sterilizzata, mescolare bene e conservare in frigorifero a -20 °C dopo l'aliquotazione.
NOTA: la soluzione LPS viene conservata al buio a 2-8 °C per l'uso immediato o a -20 °C per la conservazione a lungo termine.
- Sciogliere un totale di 10 mg di polvere di LPS in 4 ml di acqua distillata sterilizzata, mescolare bene e conservare in frigorifero a -20 °C dopo l'aliquotazione.
2. Indurre enterocolite necrotizzante nei topi neonatali BALB/c
- Dai da mangiare ai topi neonatali.
- Tenere i topi neonatali nella stessa gabbia con la diga, allattata dalla diga nei giorni 0-4.
- La notte del giorno 4 (quando i topi neonatali pesano 2,5-3 g), separare i topi neonatali nel gruppo NEC dalla diga per indurre NEC, tenerli in un'incubatrice per animali e nutrirli con la formula. Tuttavia, il gruppo Cont. è autorizzato a rimanere e ad essere alimentato dalla diga.
NOTA: I topi neonatali che sono separati dalla diga devono essere allevati in un'incubatrice a causa della loro debole regolazione della temperatura corporea.
- Preparare il tubo di gavage immergendolo in contenitori di alcol al 75% per 1-2 minuti e lavarli due volte in acqua pulita e a doppia distillazione.
NOTA: Per evitare la contaminazione incrociata tra i topi, il processo di cui sopra deve essere eseguito dopo aver alimentato ciascun topo. - Indurre il modello NEC.
- Prendi i topi neonatali dalla diga il giorno 4 e digiunali per una notte.
- Gavage i topi con LPS (20-30 μL alla volta) e nutrirli con la formula il giorno 5 (40-50 μL alla volta).
- Dal giorno 5 in poi, sottoporre i topi a un ciclo ipossia-reossigenazione-freddo-shock due volte al giorno per 5 giorni. Posizionare i topi in un dispositivo di ipossia al 5% di O2 per 90 s e riossigenarli per 3 minuti; ripetere questo processo cinque volte. Quindi, posizionare i topi in un ambiente a 4 ° C per 15 minuti e quindi trasferirli in un'incubatrice. Vedere la Figura 1A,B per il processo di induzione.
NOTA: Un ciclo di ipossia-reossigenazione-stimolazione del freddo è stato eseguito una volta al mattino e una volta nel pomeriggio. Una miscela di 5% O2 con 95% N2 è stata preparata nel contenitore e la concentrazione è stata misurata con un rilevatore di ossigeno.
- Osservare da vicino tutti i topi, pesarli ogni giorno, registrare la sopravvivenza dei topi durante il periodo di induzione e registrare le caratteristiche delle feci (con o senza feci appiccicose / feci sanguinolente).
NOTA: il modello NEC stabilito dura 5 giorni. - Il giorno 10 o prima, quando i topi mostrano sintomi NEC (ileo, ematochezia, diarrea)13, eutanasizzare i topi mediante anestesia per inalazione con isoflurano, quindi raccogliere immediatamente il tessuto intestinale. Non raccogliere tessuti dai topi che sono morti spontaneamente.
NOTA: In questo studio, il punto finale dell'eutenasia del topo è stato adattato quando il topo ha mostrato ematochezia e cianosi di tutto il corpo.
3. Gavage il mouse
- Fissare la testa del topo, tenendo il tubo gastrico nella mano destra. Inserire il tubo gastrico dall'angolo sinistro della bocca del mouse.
NOTA: La testa è stata fissata con l'indice sulla testa del mouse e premuta delicatamente all'indietro e verso il basso per evitare che il mouse si pieghi in avanti durante l'operazione e influenzi l'inserimento del tubo gastrico. - Spostare lentamente il tubo al centro della bocca. Dopo aver inserito il tubo di circa 2-3 cm, spingere 40-50 μL di formula o 20-30 μL di LPS nel tratto digestivo. Vedere la Figura 2A,B per il gavage.
NOTA: In circostanze normali, il tubo gastrico viene inserito nel tratto digestivo senza intoppi. Se il topo ha un forte riflesso di vomito, il tubo gastrico è stato inserito nella trachea per errore. Il tubo gastrico deve essere estratto delicatamente e il topo deve essere lasciato riposare per un po 'prima di tentare di nuovo il gavage. Inoltre, la procedura gavage viene utilizzata per indurre il modello di NEC prima dell'eutanasia dei topi.
4. Raccogliere campioni di tessuto intestinale fresco per la colorazione di ematossilina ed eosina (H & E)
- Immergere il tessuto ileo fresco del topo in formalina al 10% per 24 ore.
- Incorporare i tessuti nella paraffina e tagliarli in sezioni da 4 μm.
- Deparaffinizzare le sezioni in xilene e reidratarle successivamente in etanolo assoluto, etanolo al 95%, etanolo all'80%, etanolo al 70% e acqua distillata, immergendole per 5 minuti in ogni passaggio. Colorare le sezioni con soluzione di ematossilina per 5 minuti e differenziarle in acido cloridrico all'1% in alcool al 75% per 5 s. Infine, macchiarli con una soluzione di eosina per 1 minuto.
NOTA: Dopo la colorazione con soluzione di ematossilina, deve essere differenziato con acido cloridrico all'1% in etanolo per rimuovere la soluzione di ematossilina eccessivamente legata e il colorante citoplasmatico di ematossilina. La concentrazione dell'1% di acido cloridrico è adatta per il tessuto intestinale. - Esaminare l'istopatologia del tessuto intestinale con ingrandimento 40x.
Risultati
Il modello NEC murino BALB/c è stato indotto dall'alimentazione con formula, dall'alimentazione con LPS, dall'ipossia e dalla stimolazione a freddo. Durante il periodo di induzione, i topi sono stati osservati per patologia intestinale, caratteristiche delle feci, cambiamenti di peso corporeo e sopravvivenza giornaliera. Immagini rappresentative dell'intestino tenue durante l'induzione del NEC; i numeri nella foto rappresentano il punteggio di patologia intestinale da 0 (epitelio normale) a 4 (il più grave) (
Discussione
Il NEC è l'emergenza del sistema gastrointestinale più comune per i neonati, con un'alta incidenza e mortalità, specialmente nei neonati prematuri1,2,3. Tuttavia, la sua patogenesi non è ancora chiara. Attualmente si ritiene che il danno alla mucosa, l'invasione di agenti patogeni e l'alimentazione enterale siano fattori ad alto rischio per NEC3. Ad oggi, gli animali utilizzati per il modello NEC sono...
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Gli autori ringraziano la Clinical Biological Resource Bank del Guangzhou Women and Children's Medical Center per aver fornito il campione clinico e il Guangzhou Forevergen Biosciences Laboratory Animal Center per la fornitura di topi. Questa ricerca è stata sostenuta dalla National Natural Science Foundation of China grant 81770510 (R.Z.).
Materiali
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Sinopharm Chemical Reagent Co., LTD. | 100092683 | |
| Goat Milk powder | Petag | 71795558417 | |
| HE dye solution | Sinopharm Chemical Reagent Co., LTD. | G1003 | |
| Isoflurane | RWD, Shenzhen Reward Life Technology Co., LTD. | R510 | |
| LPS | Sigma-Adrich | L2880 | |
| Medical oxygen | various | various | |
| Microscope | NIKON | NIKON imaging system (DS-Ri2) | |
| Neutral resin | Sinopharm Chemical Reagent Co., LTD. | 10004160 | |
| Paraffin | various | various | |
| Premature baby milk powder | Abbott | 57430 | |
| Xylene | Sinopharm Chemical Reagent Co., LTD. | 10023418 | |
| 1% Hydrochloric acid | various | various | |
| 10% Formalin | LEAGENE | DF0110 |
Riferimenti
- Horbar, J. D., et al. Mortality and neonatal morbidity among infants 501 to 1500 grams from 2000 to 2009. Pediatrics. 129 (6), 1019-1026 (2012).
- Stoll, B. J., et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics. 126 (3), 443-456 (2010).
- Neu, J., Walker, W. A. Necrotizing enterocolitis. New England Journal of Medicine. 364 (3), 255-264 (2011).
- Sangild, P. T., et al. Invited Review: The preterm pig as a model in pediatric gastroenterology. Journal of Animal Science. 91 (10), 4713-4729 (2013).
- Cancro, M. P., Sigal, N. H., Klinman, N. R. Differential expression of an equivalent clonotype among BALB/c and C57BL/6 mice. Journal of Experimental Medicine. 147 (1), 1-12 (1978).
- Kuroda, E., Yamashita, U. Mechanisms of enhanced macrophage-mediated prostaglandin E2 production and its suppressive role in Th1 activation in Th2-dominant BALB/c mice. Journal of Immunology. 170 (2), 757-764 (2003).
- Fornefett, J., et al. Comparative analysis of clinics, pathologies and immune responses in BALB/c and C57BL/6 mice infected with Streptobacillus moniliformis. Microbes and Infection. 20 (2), 101-110 (2018).
- Rosas, L. E., et al. Genetic background influences immune responses and disease outcome of cutaneous L. mexicana infection in mice. International Immunology. 17 (10), 1347-1357 (2005).
- Sproat, T., Payne, R. P., Embleton, N. D., Berrington, J., Hambleton, S. T cells in preterm infants and the influence of milk diet. Frontiers in Immunology. 11, 1035 (2020).
- Nanthakumar, N., et al. The mechanism of excessive intestinal inflammation in necrotizing enterocolitis: an immature innate immune response. PLoS One. 6 (3), 17776 (2011).
- Afrazi, A., et al. New insights into the pathogenesis and treatment of necrotizing enterocolitis: Toll-like receptors and beyond. Pediatric Research. 69 (3), 183-188 (2011).
- Auestad, N., Korsak, R. A., Bergstrom, J. D., Edmond, J. Milk-substitutes comparable to rat's milk; their preparation, composition and impact on development and metabolism in the artificially reared rat. British Journal of Nutrition. 61 (3), 495-518 (1989).
- Liu, Y., et al. Lactoferrin-induced myeloid-derived suppressor cell therapy attenuates pathologic inflammatory conditions in newborn mice. Journal of Clinical Investigation. 129 (10), 4261-4275 (2019).
- MohanKumar, K., et al. A murine neonatal model of necrotizing enterocolitis caused by anemia and red blood cell transfusions. Nature Communications. 10 (1), 3494 (2019).
- He, Y. M., et al. Transitory presence of myeloid-derived suppressor cells in neonates is critical for control of inflammation. Nature Medicine. 24 (2), 224-231 (2018).
- Cho, S. X., et al. Characterization of the pathoimmunology of necrotizing enterocolitis reveals novel therapeutic opportunities. Nature Communications. 11 (1), 5794 (2020).
- Halpern, M. D., et al. Decreased development of necrotizing enterocolitis in IL-18-deficient mice. American Journal of Physiology. Gastrointestinal and Liver Physiology. 294 (1), 20-26 (2007).
- Wu, N., et al. MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche. Nature. 592 (7855), 606-610 (2021).
- Nino, D. F., Sodhi, C. P., Hackam, D. J. Necrotizing enterocolitis: new insights into pathogenesis and mechanisms. Nature Reviews. Gastroenterology & Hepatology. 13 (10), 590-600 (2016).
- Chuang, S. L., et al. Cow's milk protein-specific T-helper type I/II cytokine responses in infants with necrotizing enterocolitis. Pediatric Allergy & Immunology. 20 (1), 45-52 (2009).
Erratum
Formal Correction: Erratum: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis
Posted by JoVE Editors on 3/07/2022. Citeable Link.
An erratum was issued for: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis. The Representative Results section was updated.
Figure 1 was updated from:

Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
to:
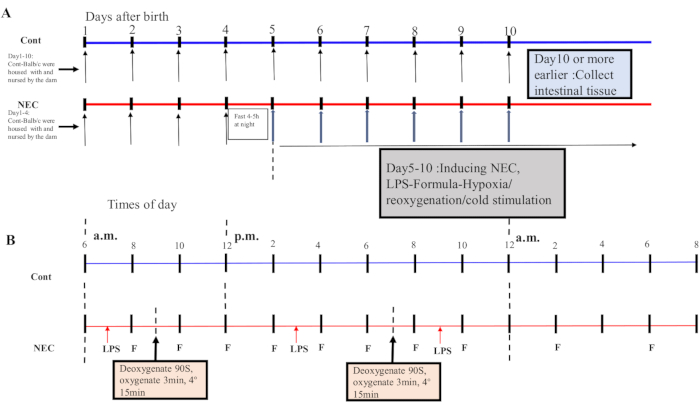
Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon