Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un modèle murin BALB/c néonatal d’entérocolite nécrosante
* Ces auteurs ont contribué à parts égales
Dans cet article
Erratum Notice
Résumé
L’entérocolite nécrosante (CEN) est la maladie gastro-intestinale (GI) la plus grave qui survient souvent chez les prématurés, en particulier les nourrissons de très faible poids à la naissance, avec une mortalité élevée et une pathogenèse incertaine. La cause de la CEN peut être liée à des anomalies inflammatoires du système de régulation immunitaire. Un modèle animal NEC est un outil indispensable pour la recherche sur le système immunitaire contre les maladies NEC. Les modèles animaux NEC utilisent généralement des souris néonatales C57BL/6J; Les souris néonatales BALB/c sont rarement utilisées. Des études connexes ont montré que lorsque des souris sont infectées, la différenciation cellulaire Th2 est prédominante chez les souris BALB / c par rapport aux souris C57BL / 6J. Des études ont suggéré que l’apparition et le développement de NEC sont associés à une augmentation des cellules T auxiliaires de type 2 (Th2) et sont généralement accompagnés d’une infection. Par conséquent, cette étude a utilisé des souris BALB/c néonatales pour induire un modèle NEC présentant des caractéristiques cliniques et des changements pathologiques intestinaux similaires à ceux observés chez les enfants atteints de NEC. Une étude plus approfondie est justifiée pour déterminer si ce modèle animal pourrait être utilisé pour étudier les réponses des cellules Th2 dans la NEC.
Résumé
L’entérocolite nécrosante (CEN) est la maladie gastro-intestinale (GI) la plus grave qui survient souvent chez les prématurés, en particulier les nourrissons de très faible poids à la naissance, avec une mortalité élevée et une pathogenèse incertaine. La cause de la CEN peut être liée à des anomalies inflammatoires du système de régulation immunitaire. Un modèle animal NEC est un outil indispensable pour la recherche sur le système immunitaire contre les maladies NEC. Les modèles animaux NEC utilisent généralement des souris néonatales C57BL/6J; Les souris néonatales BALB/c sont rarement utilisées. Des études connexes ont montré que lorsque des souris sont infectées, la différenciation cellulaire Th2 est prédominante chez les souris BALB / c par rapport aux souris C57BL / 6J. Des études ont suggéré que l’apparition et le développement de NEC sont associés à une augmentation des cellules T auxiliaires de type 2 (Th2) et sont généralement accompagnés d’une infection. Par conséquent, cette étude a utilisé des souris BALB/c néonatales pour induire un modèle NEC présentant des caractéristiques cliniques et des changements pathologiques intestinaux similaires à ceux observés chez les enfants atteints de NEC. Une étude plus approfondie est justifiée pour déterminer si ce modèle animal pourrait être utilisé pour étudier les réponses des cellules Th2 dans la NEC.
Introduction
L’entérocolite nécrosante (CEN), la maladie gastro-intestinale (GI) la plus grave, survient chez la plupart des prématurés (>90 %), en particulier ceux qui ont un très faible poids à la naissance (VLBW)1. Chez les nourrissons atteints de VLBW, l’incidence de la maladie varie de 10% à 12%, et la mortalité des enfants diagnostiqués avec NEC est comprise entre 20% et 30%2,3. La cause de la NEC peut être liée à des lésions muqueuses, à l’invasion par des bactéries pathogènes et à l’alimentation intestinale, ce qui peut entraîner des réponses inflammatoires et l’induction de lésions intestinales chez les hôtes sensibles3. La pathogenèse de NEC n’est pas claire. Des recherches pertinentes montrent que la réponse immunitaire du nourrisson affecté est anormale et que la susceptibilité génétique, la tension microvasculaire et les changements bactériens intestinaux peuvent jouer un rôle important dans la maladie3.
Le modèle animal NEC est un outil indispensable pour la recherche sur la pathogenèse du NEC. Les espèces animales utilisées pour les modèles NEC sont les porcs, les rats et les souris. Cependant, en raison de la longue période de gestation, des cycles de croissance et des coûts élevés, ces dernières années, les porcs n’ont pas été le premier choix pour les modèles NEC et ont été remplacés par des rats ou des souris4. Comme il existe des différences dans le contexte immunitaire de différentes souches de souris5, différentes études doivent utiliser différentes souches de souris pour établir des modèles animaux NEC. Les souris BALB/ c ont une caractéristique importante; lorsqu’elles sont infectées ou font face à des dommages externes, la polarisation des cellules TH2 pendant l’infection chez la souris est significativement plus forte que celle des autres souches de souris6,7,8. Les lymphocytes T auxiliaires jouent un rôle crucial dans l’apparition et la progression de la NEC, en particulier le développement des cellules TH23,9,10,11. Par conséquent, cette étude a utilisé des souris BALB / c pour établir le modèle NEC, ce qui pourrait être utile pour la recherche sur la maladie NEC sur les cellules T.
Protocole
Cette recherche a été approuvée par le Comité d’éthique médicale du Guangzhou Women and Children’s Medical Center (NO. 174A01) et le Comité d’éthique animale du Guangzhou Forevergen Biosciences Laboratory Animal Center (IACUC-G160100). Tous les animaux ont été élevés dans la même pièce dans un environnement spécifique exempt d’agents pathogènes (FPS), et des expériences ont été menées dans un environnement conventionnel. Les souris utilisées pour la reproduction étaient âgées de 7 à 8 semaines; les souris pour induire le NEC (n = 72) ont été séparées du barrage le jour 4, et les mères (n = 14) ont été gardées dans la cage d’origine et ont nourri les souris du groupe témoin (Suite) (n = 24).
1. Préparation des réactifs et des dispositifs
- Préparer le substitut de lait pour les souris BALB/c dans le rapport correspondant (lait en poudre pour bébé prématuré: lait de chèvre en poudre = 2:1).
REMARQUE : Les compositions nutritionnelles finales du lait maternisé12 sont présentées dans le tableau 1. - Solution de LPS (2,5 mg/mL)
- Dissoudre un total de 10 mg de poudre de LPS dans 4 mL d’eau stérilisée à double distillation, bien mélanger et conserver au réfrigérateur à -20 °C après aliquote.
REMARQUE: La solution LPS est stockée dans l’obscurité à 2-8 ° C pour une utilisation immédiate ou à -20 ° C pour un stockage à long terme.
- Dissoudre un total de 10 mg de poudre de LPS dans 4 mL d’eau stérilisée à double distillation, bien mélanger et conserver au réfrigérateur à -20 °C après aliquote.
2. Induire une entérocolite nécrosante chez les souris BALB/c néonatales
- Nourrissez les souris néonatales.
- Gardez les souris néonatales dans la même cage que la mère, nourries par la mère les jours 0 à 4.
- La nuit du jour 4 (lorsque les souris néonatales pèsent 2,5 à 3 g), séparez les souris néonatales du groupe NEC de la mère pour induire la NEC, gardez-les dans un incubateur d’animaux et nourrissez-les avec du lait maternisé. Cependant, le groupe Cont. est autorisé à rester avec le barrage et à être nourri par celui-ci.
REMARQUE: Les souris néonatales séparées de la mère doivent être élevées dans un incubateur en raison de leur faible régulation de la température corporelle.
- Préparez le tube de gavage en le faisant tremper dans des récipients d’alcool à 75% pendant 1 à 2 minutes et lavez-les deux fois dans de l’eau propre et double distillée.
REMARQUE: Pour éviter la contamination croisée entre les souris, le processus ci-dessus doit être effectué après avoir nourri chaque souris. - Induire le modèle NEC.
- Prenez les souris néonatales du barrage le jour 4 et jeûnez-les pendant une nuit.
- Gavage les souris avec du LPS (20-30 μL à la fois) et les nourrir avec du lait maternisé le jour 5 (40-50 μL à la fois).
- À partir du jour 5, soumettez les souris à un cycle hypoxie-réoxygénation-froid-choc deux fois par jour pendant 5 jours. Placez les souris dans un dispositif d’hypoxie à 5% O2 pendant 90 s et réoxygénez-les pendant 3 min; répétez ce processus cinq fois. Ensuite, placez les souris dans un environnement à 4 °C pendant 15 minutes, puis transférez-les dans un incubateur. Voir figure 1A,B pour le processus d’induction.
REMARQUE: Un cycle d’hypoxie-réoxygénation-stimulation par le froid a été effectué une fois le matin et une fois l’après-midi. Un mélange de 5 % d’O2 et de 95 % de N2 a été préparé dans le récipient et la concentration a été mesurée à l’aide d’un détecteur d’oxygène.
- Observez attentivement toutes les souris, pesez-les tous les jours, enregistrez la survie des souris pendant la période d’induction et enregistrez les caractéristiques des selles (avec ou sans selles collantes / selles sanglantes).
REMARQUE: Le modèle NEC établi dure 5 jours. - Le jour 10 ou plus tôt, lorsque les souris présentent des symptômes de NEC (iléus, hématochézie, diarrhée)13, euthanasier les souris par anesthésie par inhalation avec de l’isoflurane, puis prélever immédiatement le tissu intestinal. Ne prélevez pas de tissus sur les souris mortes spontanément.
REMARQUE: Dans cette étude, le point final de l’euthénasie de la souris a été adapté lorsque la souris a présenté une hématochézie et une cyanose de tout le corps.
3. Gavage la souris
- Fixez la tête de la souris en tenant la sonde gastrique dans la main droite. Insérez la sonde gastrique dans le coin gauche de la bouche de la souris.
REMARQUE: La tête a été fixée avec l’index sur la tête de la souris et doucement pressée vers l’arrière et vers le bas pour empêcher la souris de se pencher vers l’avant pendant l’opération et d’affecter l’insertion de la sonde gastrique. - Déplacez lentement le tube vers le centre de la bouche. Après avoir inséré le tube d’environ 2-3 cm, poussez 40-50 μL de formule ou 20-30 μL de LPS dans le tube digestif. Voir figure 2A,B pour le gavage.
REMARQUE: Dans des circonstances normales, la sonde gastrique est insérée dans le tube digestif en douceur. Si la souris a un fort réflexe de vomissement, la sonde gastrique a été insérée dans la trachée par erreur. La sonde gastrique doit être retirée doucement et la souris doit être laissée reposer pendant un certain temps avant de réessayer de la gavage. De plus, la procédure de gavage est utilisée pour induire le modèle de NEC avant l’euthanasie des souris.
4. Prélever des échantillons de tissu intestinal frais pour la coloration à l’hématoxyline et à l’éosine (H & E)
- Immerger le tissu frais de l’iléon de la souris dans 10% de formol pendant 24 h.
- Incorporer les tissus dans de la paraffine et les découper en sections de 4 μm.
- Déparaffinez les sections dans le xylène et réhydratez-les successivement en éthanol absolu, 95% d’éthanol, 80% d’éthanol, 70% d’éthanol et eau distillée, en trempant pendant 5 min à chaque étape. Colorez les sections avec une solution d’hématoxyline pendant 5 min et différenciez-les en acide chlorhydrique à 1% dans de l’alcool à 75% pendant 5 s. Enfin, colorez-les avec une solution d’éosine pendant 1 min.
REMARQUE: Après coloration avec une solution d’hématoxyline, il doit être différencié avec de l’acide chlorhydrique à 1% dans l’éthanol pour éliminer la solution d’hématoxyline excessivement liée et le colorant hématoxyline cytoplasmique. La concentration d’acide chlorhydrique à 1% convient au tissu intestinal. - Examiner l’histopathologie du tissu intestinal à un grossissement de 40x.
Résultats
Le modèle BALB/c de souris NEC a été induit par l’alimentation au lait maternisé, l’alimentation LPS, l’hypoxie et la stimulation par le froid. Au cours de la période d’induction, les souris ont été observées pour la pathologie intestinale, les caractéristiques des selles, les changements de poids corporel et la survie quotidienne. Images représentatives de l’intestin grêle pendant l’induction de la NEC; les chiffres de l’image représentent le score de pathologie intestinale de 0 (épithélium n...
Discussion
La NEC est l’urgence du système gastro-intestinal la plus courante chez les nouveau-nés, avec une incidence et une mortalité élevées, en particulier chez les prématurés1,2,3. Cependant, sa pathogenèse n’est pas encore claire. On croit actuellement que les lésions muqueuses, l’invasion d’agents pathogènes et l’alimentation entérale sont des facteurs de risque élevés pour NEC3. À ce ...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Les auteurs remercient la Banque de ressources biologiques cliniques du Centre médical pour femmes et enfants de Guangzhou pour avoir fourni l’échantillon clinique et le Centre des animaux de laboratoire des biosciences de Guangzhou Forevergen pour avoir fourni des souris. Cette recherche a été soutenue par la Fondation nationale des sciences naturelles de Chine 81770510 (R.Z.).
matériels
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Sinopharm Chemical Reagent Co., LTD. | 100092683 | |
| Goat Milk powder | Petag | 71795558417 | |
| HE dye solution | Sinopharm Chemical Reagent Co., LTD. | G1003 | |
| Isoflurane | RWD, Shenzhen Reward Life Technology Co., LTD. | R510 | |
| LPS | Sigma-Adrich | L2880 | |
| Medical oxygen | various | various | |
| Microscope | NIKON | NIKON imaging system (DS-Ri2) | |
| Neutral resin | Sinopharm Chemical Reagent Co., LTD. | 10004160 | |
| Paraffin | various | various | |
| Premature baby milk powder | Abbott | 57430 | |
| Xylene | Sinopharm Chemical Reagent Co., LTD. | 10023418 | |
| 1% Hydrochloric acid | various | various | |
| 10% Formalin | LEAGENE | DF0110 |
Références
- Horbar, J. D., et al. Mortality and neonatal morbidity among infants 501 to 1500 grams from 2000 to 2009. Pediatrics. 129 (6), 1019-1026 (2012).
- Stoll, B. J., et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics. 126 (3), 443-456 (2010).
- Neu, J., Walker, W. A. Necrotizing enterocolitis. New England Journal of Medicine. 364 (3), 255-264 (2011).
- Sangild, P. T., et al. Invited Review: The preterm pig as a model in pediatric gastroenterology. Journal of Animal Science. 91 (10), 4713-4729 (2013).
- Cancro, M. P., Sigal, N. H., Klinman, N. R. Differential expression of an equivalent clonotype among BALB/c and C57BL/6 mice. Journal of Experimental Medicine. 147 (1), 1-12 (1978).
- Kuroda, E., Yamashita, U. Mechanisms of enhanced macrophage-mediated prostaglandin E2 production and its suppressive role in Th1 activation in Th2-dominant BALB/c mice. Journal of Immunology. 170 (2), 757-764 (2003).
- Fornefett, J., et al. Comparative analysis of clinics, pathologies and immune responses in BALB/c and C57BL/6 mice infected with Streptobacillus moniliformis. Microbes and Infection. 20 (2), 101-110 (2018).
- Rosas, L. E., et al. Genetic background influences immune responses and disease outcome of cutaneous L. mexicana infection in mice. International Immunology. 17 (10), 1347-1357 (2005).
- Sproat, T., Payne, R. P., Embleton, N. D., Berrington, J., Hambleton, S. T cells in preterm infants and the influence of milk diet. Frontiers in Immunology. 11, 1035 (2020).
- Nanthakumar, N., et al. The mechanism of excessive intestinal inflammation in necrotizing enterocolitis: an immature innate immune response. PLoS One. 6 (3), 17776 (2011).
- Afrazi, A., et al. New insights into the pathogenesis and treatment of necrotizing enterocolitis: Toll-like receptors and beyond. Pediatric Research. 69 (3), 183-188 (2011).
- Auestad, N., Korsak, R. A., Bergstrom, J. D., Edmond, J. Milk-substitutes comparable to rat's milk; their preparation, composition and impact on development and metabolism in the artificially reared rat. British Journal of Nutrition. 61 (3), 495-518 (1989).
- Liu, Y., et al. Lactoferrin-induced myeloid-derived suppressor cell therapy attenuates pathologic inflammatory conditions in newborn mice. Journal of Clinical Investigation. 129 (10), 4261-4275 (2019).
- MohanKumar, K., et al. A murine neonatal model of necrotizing enterocolitis caused by anemia and red blood cell transfusions. Nature Communications. 10 (1), 3494 (2019).
- He, Y. M., et al. Transitory presence of myeloid-derived suppressor cells in neonates is critical for control of inflammation. Nature Medicine. 24 (2), 224-231 (2018).
- Cho, S. X., et al. Characterization of the pathoimmunology of necrotizing enterocolitis reveals novel therapeutic opportunities. Nature Communications. 11 (1), 5794 (2020).
- Halpern, M. D., et al. Decreased development of necrotizing enterocolitis in IL-18-deficient mice. American Journal of Physiology. Gastrointestinal and Liver Physiology. 294 (1), 20-26 (2007).
- Wu, N., et al. MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche. Nature. 592 (7855), 606-610 (2021).
- Nino, D. F., Sodhi, C. P., Hackam, D. J. Necrotizing enterocolitis: new insights into pathogenesis and mechanisms. Nature Reviews. Gastroenterology & Hepatology. 13 (10), 590-600 (2016).
- Chuang, S. L., et al. Cow's milk protein-specific T-helper type I/II cytokine responses in infants with necrotizing enterocolitis. Pediatric Allergy & Immunology. 20 (1), 45-52 (2009).
Erratum
Formal Correction: Erratum: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis
Posted by JoVE Editors on 3/07/2022. Citeable Link.
An erratum was issued for: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis. The Representative Results section was updated.
Figure 1 was updated from:

Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
to:
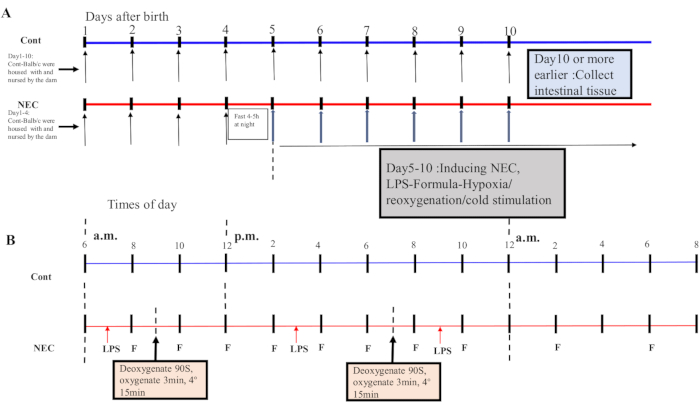
Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon