このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
壊死性腸炎の新生児BALB/cマウスモデル
* これらの著者は同等に貢献しました
Erratum Notice
要約
壊死性腸炎(NEC)は、未熟児、特に超低出生体重児にしばしば発生する最も重篤な胃腸(GI)疾患であり、死亡率が高く、病因が不明である。NECの原因は、炎症性免疫調節系の異常に関係している可能性があります。NECの動物モデルは、NECの疾患免疫研究に欠かせないツールです。NECの動物モデルは通常、C57BL/6J新生児マウスを使用します。BALB/c新生児マウスはめったに使用されません。関連する研究は、マウスが感染すると、C57BL/6Jマウスと比較して、THB細胞分化がBALB/cマウスにおいて優勢であることを示した。研究によると、NECの発生と発達はTヘルパー2型(Th2)細胞の増加と関連しており、一般に感染を伴うことが示唆されています。そこで本研究では、新生児BALB/cマウスを用いて、NEC小児と同様の臨床特性と腸管病理学的変化を有するNECモデルを誘導した。この動物モデルがNECにおけるTh2細胞応答を研究するために使用できるかどうかを判断するために、さらなる研究が保証されている。
要約
壊死性腸炎(NEC)は、未熟児、特に超低出生体重児にしばしば発生する最も重篤な胃腸(GI)疾患であり、死亡率が高く、病因が不明である。NECの原因は、炎症性免疫調節系の異常に関係している可能性があります。NECの動物モデルは、NECの疾患免疫研究に欠かせないツールです。NECの動物モデルは通常、C57BL/6J新生児マウスを使用します。BALB/c新生児マウスはめったに使用されません。関連する研究は、マウスが感染すると、C57BL/6Jマウスと比較して、THB細胞分化がBALB/cマウスにおいて優勢であることを示した。研究によると、NECの発生と発達はTヘルパー2型(Th2)細胞の増加と関連しており、一般に感染を伴うことが示唆されています。そこで本研究では、新生児BALB/cマウスを用いて、NEC小児と同様の臨床特性と腸管病理学的変化を有するNECモデルを誘導した。この動物モデルがNECにおけるTh2細胞応答を研究するために使用できるかどうかを判断するために、さらなる研究が保証されている。
概要
最も重篤な胃腸(GI)疾患である壊死性腸炎(NEC)は、ほとんどの未熟児(>90%)、特に超低出生体重(VLBW)1に発生します。VLBW乳児では、この疾患の発生率は10%から12%の範囲であり、NECと診断された小児の死亡率は20%〜30%である2,3。NECの原因は、粘膜損傷、病原性細菌による侵入、および腸の摂食に関連している可能性があり、炎症反応および感受性宿主における腸管損傷の誘発につながる可能性がある3。NECの病因は不明である。関連する研究は、罹患した乳児の免疫応答が異常であり、遺伝的感受性、微小血管緊張、および腸内細菌の変化がこの疾患において重要な役割を果たす可能性があることを示している3。
NECの動物モデルは、NECの病態研究に欠かせないツールです。NECモデルに使用される動物種は、ブタ、ラット、マウスです。しかし、妊娠期間が長く、成長サイクルが長く、コストが高いため、近年、ブタはNECモデルの最初の選択肢ではなく、ラットやマウスに置き換えられています4。異なるマウス系統の免疫バックグラウンドに違いがあるため5、NECの動物モデルを確立するために、異なる研究が異なる系統のマウスを使用する必要がある。BALB/cマウスは重要な特徴を有する。それらが感染しているか、または外部損傷に対処するとき、マウスにおける感染中のTH2細胞の分極は、マウスの他の系統におけるそれよりも有意に強い6,7,8。Tヘルパー細胞は、NECの発生および進行、特にTH2細胞の発生において重要な役割を果たしている3,9,10,11。そこで、本研究ではBALB/cマウスを用いてNECモデルを確立し、T細胞に関するNEC疾患研究に役立てられる可能性がある。
Access restricted. Please log in or start a trial to view this content.
プロトコル
本研究は、広州女性小児医療センター医療倫理委員会(NO.174A01)および広州フォーエバーゲンバイオサイエンス実験動物センター(IACUC-G160100)動物倫理委員会によって承認されました。すべての動物を特定の病原体フリー(SPF)環境で同じ部屋で飼育し、実験は従来の環境で行った。飼育に使用したマウスは7〜8週齢であった。NEC誘導用マウス(n=72)を4日目にダムから分離し、ダム(n=14)を元のケージに保持し、対照(続き)群マウス(n=24)を飼育した。
1. 試薬および装置の調製
- BALB/cマウスの代用乳を対応する比率で調製する(未熟児粉乳:ヤギ粉乳=2:1)。
注:フォーミュラミルク12 の最終栄養組成物を 表1に示す。 - LPS 溶液 (2.5 ミリグラム/mL)
- LPS粉末10mgを4mLの滅菌二重蒸留水に溶解し、よく混ぜ合わせ、分注後-20°Cの冷蔵庫で保存する。
注:LPS溶液は、即時使用のために2〜8°Cで暗所で、または長期保存のために-20°Cで保存される。
- LPS粉末10mgを4mLの滅菌二重蒸留水に溶解し、よく混ぜ合わせ、分注後-20°Cの冷蔵庫で保存する。
2. 新生児BALB/cマウスに壊死性腸炎を誘導する
- 新生児マウスに餌をやる。
- 新生児マウスをダムと同じケージに入れ、0-4日目にダムで飼育する。
- 4日目の夜(新生児マウスの体重が2.5~3gの場合)に、NEC群の新生児マウスをダムから分離してNECを誘導し、動物用インキュベーターに保管し、フォーミュラを投与します。しかし、Cont.グループはダムにとどまり、ダムによって供給されることが許されています。
注:ダムから分離された新生児マウスは、体温調節が弱いため、インキュベーターで飼育する必要があります。
- 経管を75%アルコール容器に1〜2分間浸して準備し、清潔な二重蒸留水で2回洗浄します。
注:マウス間の交差汚染を避けるために、上記のプロセスは、各マウスに給餌した後に実行する必要があります。 - NECモデルを誘導する。
- 4日目にダムから新生児マウスを連れて行き、一晩断食してください。
- マウスにLPS(一度に20〜30μL)を経食し、5日目にフォーミュラ(一度に40〜50μL)を給餌する。
- 5日目以降、マウスを1日2回、5日間、低酸素-再酸素化-コールドショックサイクルに供する。マウスを5%O2の低酸素装置に90秒間置き、3分間再酸素化する。このプロセスを 5 回繰り返します。次に、マウスを4°Cの環境に15分間置き、次いでインキュベーターに移す。誘導プロセスについては、図1A,Bを参照してください。
注:低酸素再酸素化 - 低温刺激のサイクルは、午前中に1回、午後に1回実施された。容器内に5%O2と95%N2の混合物を調製し、酸素検出器で濃度を測定した。
- すべてのマウスを注意深く観察し、毎日体重を量り、誘導期間中のマウスの生存を記録し、便の特徴(粘着性便/血便の有無にかかわらず)を記録する。
注:確立されたNECモデルは5日間持続します。 - 10日目以前にNEC症状(イレウス、血腫、下痢)13を示した場合は、イソフルランによる吸入麻酔により安楽死させ、直ちに腸組織を採取します。自発的に死亡したマウスから組織を採取しないでください。
注:本研究では、マウスが全身の血腫血およびチアノーゼを示したときに、マウス安楽死の終点を適応させた。
3.マウスを経絶する
- 右手に胃管を持ち、マウスヘッドを固定します。マウスの口の左隅から胃管を挿入します。
メモ:頭部は人差し指でマウスの頭部に固定し、操作中にマウスが前方に曲がったり、胃管の挿入に影響を与えたりしないように、前後に軽く押しました。 - チューブをゆっくりと口の中心に動かします。チューブを約2〜3cm挿入した後、40〜50μLの式または20〜30μLのLPSを消化管に押し込む。経管栄養については図2A,Bを参照されたい。
注:通常の状況下では、胃管は消化管にスムーズに挿入されます。マウスが強い嘔吐反射を有する場合、胃管は誤って気管に挿入されている。胃管を静かに引き抜く必要があり、マウスは再度経管栄養を試みる前にしばらく休ませてください。さらに、経管栄養手順は、マウスの安楽死の前にNECのモデルを誘導するために使用される。
4. ヘマトキシリンおよびエオジン(H&E)染色のための新鮮な腸組織標本を収集する
- マウスからの新鮮な回腸組織を10%ホルマリンに24時間浸漬する。
- 組織をパラフィンに埋め込み、4μmの切片にスライスする。
- 切片をキシレンで脱パラフィンし、無水エタノール、95%エタノール、80%エタノール、70%エタノール、および蒸留水に順次再水和し、各工程で5分間浸漬する。切片をヘマトキシリン溶液で5分間染色し、1%塩酸中75%アルコール中で5秒間区別する。最後に、それらをエオジン溶液で1分間染色する。
注:ヘマトキシリン溶液で染色した後、エタノール中の1%塩酸で分化させて、過剰に結合したヘマトキシリン溶液および細胞質ヘマトキシリン色素を除去する必要がある。1%塩酸の濃度は腸組織に適している。 - 腸組織の組織病理学を40倍の倍率で調べる。
Access restricted. Please log in or start a trial to view this content.
結果
BALB/cマウスNECモデルは、フォーミュラ給餌、LPS給餌、低酸素、および低温刺激によって誘導された。誘導期間中、マウスは腸の病理、便の特徴、体重変化、および毎日の生存について観察された。NEC誘導中の小腸の代表的な画像;写真中の数字は、0(正常な上皮)から4(最も重症)までの腸病理スコアを表す(図3A)。腸管病理スコアは、Cont.群よりもNEC群で有意に高かった(
Access restricted. Please log in or start a trial to view this content.
ディスカッション
NECは、新生児にとって最も一般的な胃腸系緊急事態であり、特に未熟児において、高い発生率と死亡率を示しています1,2,3。しかし、その病因はまだ不明である。現在、粘膜損傷、病原体侵入、経腸栄養がNEC3の高危険因子であると考えられています。現在までに、NECモデルに使用されている動物は、主に...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、開示する利益相反はありません。
謝辞
著者らは、臨床サンプルを提供してくれた広州女性小児医療センターの臨床生物資源バンクと、マウスを提供してくれた広州フォーエバージェンバイオサイエンス実験動物センターに感謝している。この研究は、中国国家自然科学財団の助成金81770510(R.Z.)の支援を受けました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Sinopharm Chemical Reagent Co., LTD. | 100092683 | |
| Goat Milk powder | Petag | 71795558417 | |
| HE dye solution | Sinopharm Chemical Reagent Co., LTD. | G1003 | |
| Isoflurane | RWD, Shenzhen Reward Life Technology Co., LTD. | R510 | |
| LPS | Sigma-Adrich | L2880 | |
| Medical oxygen | various | various | |
| Microscope | NIKON | NIKON imaging system (DS-Ri2) | |
| Neutral resin | Sinopharm Chemical Reagent Co., LTD. | 10004160 | |
| Paraffin | various | various | |
| Premature baby milk powder | Abbott | 57430 | |
| Xylene | Sinopharm Chemical Reagent Co., LTD. | 10023418 | |
| 1% Hydrochloric acid | various | various | |
| 10% Formalin | LEAGENE | DF0110 |
参考文献
- Horbar, J. D., et al. Mortality and neonatal morbidity among infants 501 to 1500 grams from 2000 to 2009. Pediatrics. 129 (6), 1019-1026 (2012).
- Stoll, B. J., et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics. 126 (3), 443-456 (2010).
- Neu, J., Walker, W. A. Necrotizing enterocolitis. New England Journal of Medicine. 364 (3), 255-264 (2011).
- Sangild, P. T., et al. Invited Review: The preterm pig as a model in pediatric gastroenterology. Journal of Animal Science. 91 (10), 4713-4729 (2013).
- Cancro, M. P., Sigal, N. H., Klinman, N. R. Differential expression of an equivalent clonotype among BALB/c and C57BL/6 mice. Journal of Experimental Medicine. 147 (1), 1-12 (1978).
- Kuroda, E., Yamashita, U. Mechanisms of enhanced macrophage-mediated prostaglandin E2 production and its suppressive role in Th1 activation in Th2-dominant BALB/c mice. Journal of Immunology. 170 (2), 757-764 (2003).
- Fornefett, J., et al. Comparative analysis of clinics, pathologies and immune responses in BALB/c and C57BL/6 mice infected with Streptobacillus moniliformis. Microbes and Infection. 20 (2), 101-110 (2018).
- Rosas, L. E., et al. Genetic background influences immune responses and disease outcome of cutaneous L. mexicana infection in mice. International Immunology. 17 (10), 1347-1357 (2005).
- Sproat, T., Payne, R. P., Embleton, N. D., Berrington, J., Hambleton, S. T cells in preterm infants and the influence of milk diet. Frontiers in Immunology. 11, 1035(2020).
- Nanthakumar, N., et al. The mechanism of excessive intestinal inflammation in necrotizing enterocolitis: an immature innate immune response. PLoS One. 6 (3), 17776(2011).
- Afrazi, A., et al. New insights into the pathogenesis and treatment of necrotizing enterocolitis: Toll-like receptors and beyond. Pediatric Research. 69 (3), 183-188 (2011).
- Auestad, N., Korsak, R. A., Bergstrom, J. D., Edmond, J. Milk-substitutes comparable to rat's milk; their preparation, composition and impact on development and metabolism in the artificially reared rat. British Journal of Nutrition. 61 (3), 495-518 (1989).
- Liu, Y., et al. Lactoferrin-induced myeloid-derived suppressor cell therapy attenuates pathologic inflammatory conditions in newborn mice. Journal of Clinical Investigation. 129 (10), 4261-4275 (2019).
- MohanKumar, K., et al. A murine neonatal model of necrotizing enterocolitis caused by anemia and red blood cell transfusions. Nature Communications. 10 (1), 3494(2019).
- He, Y. M., et al. Transitory presence of myeloid-derived suppressor cells in neonates is critical for control of inflammation. Nature Medicine. 24 (2), 224-231 (2018).
- Cho, S. X., et al. Characterization of the pathoimmunology of necrotizing enterocolitis reveals novel therapeutic opportunities. Nature Communications. 11 (1), 5794(2020).
- Halpern, M. D., et al. Decreased development of necrotizing enterocolitis in IL-18-deficient mice. American Journal of Physiology. Gastrointestinal and Liver Physiology. 294 (1), 20-26 (2007).
- Wu, N., et al. MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche. Nature. 592 (7855), 606-610 (2021).
- Nino, D. F., Sodhi, C. P., Hackam, D. J. Necrotizing enterocolitis: new insights into pathogenesis and mechanisms. Nature Reviews. Gastroenterology & Hepatology. 13 (10), 590-600 (2016).
- Chuang, S. L., et al. Cow's milk protein-specific T-helper type I/II cytokine responses in infants with necrotizing enterocolitis. Pediatric Allergy & Immunology. 20 (1), 45-52 (2009).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis
Posted by JoVE Editors on 3/07/2022. Citeable Link.
An erratum was issued for: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis. The Representative Results section was updated.
Figure 1 was updated from:

Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
to:
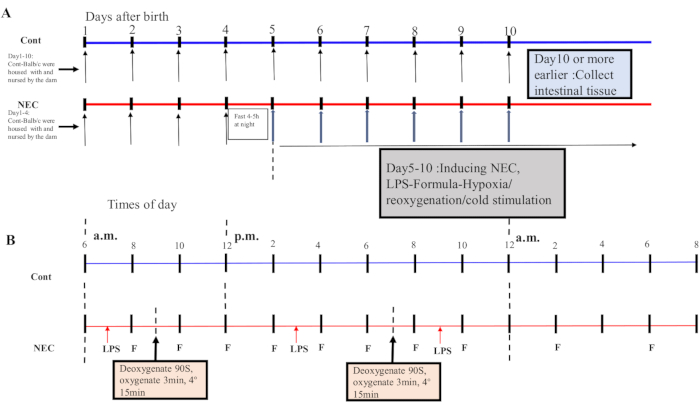
Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved