É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um modelo de rato BALB/c neonatal de Enterocolite Necrotizante
* Estes autores contribuíram igualmente
Neste Artigo
Erratum Notice
Resumo
A enterocolite necrosante (NEC) é a doença gastrointestinal (GI) mais grave que ocorre frequentemente em bebês prematuros, especialmente bebês com baixo peso ao nascer, com alta mortalidade e patogênese pouco clara. A causa da NEC pode estar relacionada a anormalidades inflamatórias do sistema de regulação imunológica. Um modelo animal NEC é uma ferramenta indispensável para a pesquisa imunológica da doença NEC. Modelos animais NEC geralmente usam camundongos neonatais C57BL/6J; Os camundongos neonatais BALB/c raramente são usados. Estudos relacionados mostraram que quando os camundongos são infectados, a diferenciação celular Th2 é predominante em camundongos BALB/c em comparação com camundongos C57BL/6J. Estudos sugerem que a ocorrência e o desenvolvimento da NEC estão associados a um aumento nas células auxiliares T tipo 2 (Th2) e são geralmente acompanhados de infecção. Portanto, este estudo utilizou camundongos BALB/c neonatais para induzir um modelo NEC com características clínicas semelhantes e alterações patológicas intestinais observadas em crianças com NEC. Um estudo mais aprofundado é necessário para determinar se esse modelo animal poderia ser usado para estudar respostas de células Th2 na NEC.
Resumo
A enterocolite necrosante (NEC) é a doença gastrointestinal (GI) mais grave que ocorre frequentemente em bebês prematuros, especialmente bebês com baixo peso ao nascer, com alta mortalidade e patogênese pouco clara. A causa da NEC pode estar relacionada a anormalidades inflamatórias do sistema de regulação imunológica. Um modelo animal NEC é uma ferramenta indispensável para a pesquisa imunológica da doença NEC. Modelos animais NEC geralmente usam camundongos neonatais C57BL/6J; Os camundongos neonatais BALB/c raramente são usados. Estudos relacionados mostraram que quando os camundongos são infectados, a diferenciação celular Th2 é predominante em camundongos BALB/c em comparação com camundongos C57BL/6J. Estudos sugerem que a ocorrência e o desenvolvimento da NEC estão associados a um aumento nas células auxiliares T tipo 2 (Th2) e são geralmente acompanhados de infecção. Portanto, este estudo utilizou camundongos BALB/c neonatais para induzir um modelo NEC com características clínicas semelhantes e alterações patológicas intestinais observadas em crianças com NEC. Um estudo mais aprofundado é necessário para determinar se esse modelo animal poderia ser usado para estudar respostas de células Th2 na NEC.
Introdução
A enterocolite necrosante (NEC), a doença gastrointestinal mais grave (GI), ocorre na maioria dos bebês prematuros (>90%), especialmente aqueles com baixo peso ao nascer (VLBW)1. Em bebês VLBW, a incidência da doença varia de 10% a 12%, e a mortalidade de crianças diagnosticadas com NEC é entre 20% e 30%2,3. A causa da NEC pode estar relacionada a lesões mucosas, invasão por bactérias patogênicas e alimentação intestinal, o que pode levar a respostas inflamatórias e à indução de lesões intestinais em hospedeiros suscetíveis3. A patogênese da NEC não está clara. Pesquisas relevantes mostram que a resposta imune do bebê afetado é anormal, e a suscetibilidade genética, tensão microvascular e alterações bacterianas intestinais podem desempenhar papéis importantes na doença3.
O modelo animal nec é uma ferramenta indispensável para a pesquisa sobre a patogênese da NEC. As espécies animais utilizadas para modelos NEC são porcos, ratos e camundongos. No entanto, devido ao longo período de gestação, ciclos de crescimento e altos custos, nos últimos anos, os suínos não têm sido a primeira escolha para os modelos nec e foram substituídos por ratos ou ratos4. Como há diferenças no fundo imunológico de diferentes cepas de camundongos5, diferentes estudos precisam usar diferentes cepas de camundongos para estabelecer modelos animais NEC. Os ratos BALB/c têm uma característica importante; quando estão infectados ou lidam com danos externos, a polarização das células TH2 durante a infecção em camundongos é significativamente mais forte do que em outras cepas de camundongos6,7,8. As células auxiliares T desempenham um papel crucial na ocorrência e progressão da NEC, especialmente no desenvolvimento de células TH23,9,10,11. Portanto, este estudo utilizou camundongos BALB/c para estabelecer o modelo NEC, o que pode ser útil para a pesquisa da doença nec em células T.
Protocolo
Esta pesquisa foi aprovada pelo Comitê de Ética Médica do Centro Médico da Mulher e da Criança de Guangzhou (Nº 174A01) e pelo Comitê de Ética Animal do Centro animal do Laboratório de Biociências de Guangzhou Forevergen (IACUC-G160100). Todos os animais foram criados na mesma sala em um ambiente específico livre de patógenos (SPF), e experimentos foram realizados em ambiente convencional. Os camundongos utilizados para reprodução tinham de 7 a 8 semanas; os camundongos para induzir NEC (n = 72) foram separados da barragem no dia 4, e as barragens(n=14) foram mantidas na gaiola original e amamentaram os ratos do grupo controle (Cont.) (n=24).
1. Preparação de reagentes e dispositivos
- Prepare o substituto do leite para os camundongos BALB/c na proporção correspondente (leite em pó prematuro: leite em pó de cabra = 2:1).
NOTA: As composições nutricionais finais do leite de fórmula12 são mostradas na Tabela 1. - Solução LPS (2,5 mg/mL)
- Dissolva um total de 10 mg de pó LPS em 4 mL de água esterilizada dupla destilada, misture bem e armazene em uma geladeira a -20 °C após a aliquotação.
NOTA: A solução LPS é armazenada no escuro a 2-8 °C para uso imediato ou a -20 °C para armazenamento a longo prazo.
- Dissolva um total de 10 mg de pó LPS em 4 mL de água esterilizada dupla destilada, misture bem e armazene em uma geladeira a -20 °C após a aliquotação.
2. Induzir enterocolite necrosante em camundongos BALB/c neonatais
- Alimente os ratos neonatais.
- Mantenha os camundongos neonatais na mesma gaiola com a represa, amamentados pela represa nos dias 0-4.
- Na noite do dia 4 (quando os camundongos neonatais pesam 2,5-3 g), separe os camundongos neonatais do grupo NEC da barragem para induzir nec, mantê-los em uma incubadora animal e alimentá-los com fórmula. No entanto, o grupo Cont. está autorizado a ficar e ser alimentado pela represa.
NOTA: Os camundongos neonatais separados da barragem devem ser criados em uma incubadora devido à sua fraca regulação da temperatura corporal.
- Prepare o tubo de gavage, encharcando-o em recipientes de álcool de 75% por 1-2 min e lave-os duas vezes em água limpa e dupla destilada.
NOTA: Para evitar a contaminação cruzada entre os camundongos, o processo acima deve ser realizado após a alimentação de cada rato. - Induzir o modelo NEC.
- Pegue os ratos neonatais da represa no dia 4 e acelere-os por uma noite.
- Gavage os ratos com LPS (20-30 μL de cada vez) e alimente-os com fórmula no dia 5 (40-50 μL de cada vez).
- A partir do dia 5, submia os camundongos a um ciclo de choque frio-de hipoxia-reoxigenação duas vezes por dia durante 5 dias. Coloque os camundongos em um dispositivo de hipóxia a 5% de O2 para 90 s e reoxigená-los por 3 min; repetir este processo cinco vezes. Em seguida, coloque os ratos em um ambiente de 4 °C por 15 minutos e depois transfira-os para uma incubadora. Consulte a Figura 1A,B para o processo de indução.
NOTA: Um ciclo de estimulação hipóxia-reoxigenação-fria foi realizado uma vez pela manhã e uma vez à tarde. Uma mistura de 5% de O2 com 95% N2 foi preparada no recipiente, e a concentração foi medida com detector de oxigênio.
- Observe minuciosamente todos os camundongos, pese-os todos os dias, registe os camundongos durante o período de indução e registe as características das fezes (com ou sem fezes pegajosas/fezes ensanguentadas).
NOTA: O modelo NEC estabelecido dura 5 dias. - No dia 10 ou mais cedo, quando os camundongos apresentam sintomas nec (íleo, hematochezia, diarreia)13, eutanize os camundongos por anestesia de inalação com isoflurano, depois colete imediatamente o tecido intestinal. Não recolha tecidos dos camundongos que morreram espontaneamente.
NOTA: Neste estudo, o ponto final da euenasia do rato foi adaptado quando o mouse exibiu hematochezia e cianose de todo o corpo.
3. Gavage o mouse
- Conserte a cabeça do rato, segurando a sonda gástrica na mão direita. Insira a sonda gástrica do canto esquerdo da boca do mouse.
NOTA: A cabeça foi fixada com o dedo indicador na cabeça do mouse e gentilmente pressionada para trás e para baixo para evitar que o rato se dobrasse para frente durante a operação e afetasse a inserção da sonda gástrica. - Mova lentamente o tubo para o centro da boca. Depois de inserir o tubo aproximadamente 2-3 cm, empurre 40-50 μL de fórmula ou 20-30 μL de LPS no trato digestivo. Veja a Figura 2A,B para o gavage.
NOTA: Em circunstâncias normais, a sonda gástrica é inserida suavemente no trato digestivo. Se o camundongo tem um forte reflexo de vômito, a sonda gástrica foi inserida na traqueia por engano. A sonda gástrica deve ser retirada suavemente e o rato pode descansar por um tempo antes de tentar gavage novamente. Além disso, o procedimento de gavage é usado para induzir o modelo de NEC antes da eutanásia de camundongos.
4. Coletar amostras de tecido intestinal fresco para coloração de hematoxilina e eosina (H&E)
- Mergulhe o tecido íleo fresco do mouse em 10% de formalina por 24 h.
- Incorpore os tecidos em parafina e corte-os em seções de 4 μm.
- Desparafinar as seções em xileno e reidratá-las sucessivamente em etanol absoluto, 95% etanol, 80% etanol, 70% etanol e água destilada, de molho por 5 minutos em cada etapa. Manche as seções com solução de hematoxilina por 5 min e diferencie-as em 1% de ácido clorídrico em 75% de álcool para 5 s. Finalmente, manche-os com solução de eosina por 1 min.
NOTA: Após a coloração com solução de hematoxilina, deve ser diferenciado com ácido clorídrico de 1% no etanol para remover solução de hematoxilina excessivamente ligada e corante de hematoxíquia citoplasmica. A concentração de 1% de ácido clorídrico é adequada para tecido intestinal. - Examine a histopatologia do tecido intestinal a 40x de ampliação.
Resultados
O modelo NEC do rato BALB/c foi induzido pela alimentação de fórmulas, alimentação de LPS, hipóxia e estimulação fria. Durante o período de indução, os camundongos foram observados para patologia intestinal, características das fezes, alterações de peso corporal e sobrevida diária. Imagens representativas do intestino delgado durante a indução da NEC; os números no quadro representam o escore da patologia intestinal de 0 (epitélio normal) a 4 (o mais grave) (Figura 3A). O ...
Discussão
A NEC é a emergência do sistema gastrointestinal mais comum para recém-nascidos, com alta incidência e mortalidade, especialmente em bebês prematuros1,2,3. No entanto, sua patogênese ainda não está clara. Acredita-se atualmente que danos mucosos, invasão de patógenos e alimentação enteral são fatores de alto risco para o NEC3. Até o momento, os animais utilizados para o modelo NEC são princ...
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Os autores agradecem ao Banco de Recursos Biológicos Clínicos do Centro Médico de Mulheres e Crianças de Guangzhou por fornecer a amostra clínica e o Guangzhou Forevergen Biosciences Laboratory Animal Center por fornecer camundongos. Esta pesquisa foi apoiada pela Fundação Nacional de Ciência Natural da China 81770510 (R.Z.).
Materiais
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Sinopharm Chemical Reagent Co., LTD. | 100092683 | |
| Goat Milk powder | Petag | 71795558417 | |
| HE dye solution | Sinopharm Chemical Reagent Co., LTD. | G1003 | |
| Isoflurane | RWD, Shenzhen Reward Life Technology Co., LTD. | R510 | |
| LPS | Sigma-Adrich | L2880 | |
| Medical oxygen | various | various | |
| Microscope | NIKON | NIKON imaging system (DS-Ri2) | |
| Neutral resin | Sinopharm Chemical Reagent Co., LTD. | 10004160 | |
| Paraffin | various | various | |
| Premature baby milk powder | Abbott | 57430 | |
| Xylene | Sinopharm Chemical Reagent Co., LTD. | 10023418 | |
| 1% Hydrochloric acid | various | various | |
| 10% Formalin | LEAGENE | DF0110 |
Referências
- Horbar, J. D., et al. Mortality and neonatal morbidity among infants 501 to 1500 grams from 2000 to 2009. Pediatrics. 129 (6), 1019-1026 (2012).
- Stoll, B. J., et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics. 126 (3), 443-456 (2010).
- Neu, J., Walker, W. A. Necrotizing enterocolitis. New England Journal of Medicine. 364 (3), 255-264 (2011).
- Sangild, P. T., et al. Invited Review: The preterm pig as a model in pediatric gastroenterology. Journal of Animal Science. 91 (10), 4713-4729 (2013).
- Cancro, M. P., Sigal, N. H., Klinman, N. R. Differential expression of an equivalent clonotype among BALB/c and C57BL/6 mice. Journal of Experimental Medicine. 147 (1), 1-12 (1978).
- Kuroda, E., Yamashita, U. Mechanisms of enhanced macrophage-mediated prostaglandin E2 production and its suppressive role in Th1 activation in Th2-dominant BALB/c mice. Journal of Immunology. 170 (2), 757-764 (2003).
- Fornefett, J., et al. Comparative analysis of clinics, pathologies and immune responses in BALB/c and C57BL/6 mice infected with Streptobacillus moniliformis. Microbes and Infection. 20 (2), 101-110 (2018).
- Rosas, L. E., et al. Genetic background influences immune responses and disease outcome of cutaneous L. mexicana infection in mice. International Immunology. 17 (10), 1347-1357 (2005).
- Sproat, T., Payne, R. P., Embleton, N. D., Berrington, J., Hambleton, S. T cells in preterm infants and the influence of milk diet. Frontiers in Immunology. 11, 1035 (2020).
- Nanthakumar, N., et al. The mechanism of excessive intestinal inflammation in necrotizing enterocolitis: an immature innate immune response. PLoS One. 6 (3), 17776 (2011).
- Afrazi, A., et al. New insights into the pathogenesis and treatment of necrotizing enterocolitis: Toll-like receptors and beyond. Pediatric Research. 69 (3), 183-188 (2011).
- Auestad, N., Korsak, R. A., Bergstrom, J. D., Edmond, J. Milk-substitutes comparable to rat's milk; their preparation, composition and impact on development and metabolism in the artificially reared rat. British Journal of Nutrition. 61 (3), 495-518 (1989).
- Liu, Y., et al. Lactoferrin-induced myeloid-derived suppressor cell therapy attenuates pathologic inflammatory conditions in newborn mice. Journal of Clinical Investigation. 129 (10), 4261-4275 (2019).
- MohanKumar, K., et al. A murine neonatal model of necrotizing enterocolitis caused by anemia and red blood cell transfusions. Nature Communications. 10 (1), 3494 (2019).
- He, Y. M., et al. Transitory presence of myeloid-derived suppressor cells in neonates is critical for control of inflammation. Nature Medicine. 24 (2), 224-231 (2018).
- Cho, S. X., et al. Characterization of the pathoimmunology of necrotizing enterocolitis reveals novel therapeutic opportunities. Nature Communications. 11 (1), 5794 (2020).
- Halpern, M. D., et al. Decreased development of necrotizing enterocolitis in IL-18-deficient mice. American Journal of Physiology. Gastrointestinal and Liver Physiology. 294 (1), 20-26 (2007).
- Wu, N., et al. MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche. Nature. 592 (7855), 606-610 (2021).
- Nino, D. F., Sodhi, C. P., Hackam, D. J. Necrotizing enterocolitis: new insights into pathogenesis and mechanisms. Nature Reviews. Gastroenterology & Hepatology. 13 (10), 590-600 (2016).
- Chuang, S. L., et al. Cow's milk protein-specific T-helper type I/II cytokine responses in infants with necrotizing enterocolitis. Pediatric Allergy & Immunology. 20 (1), 45-52 (2009).
Erratum
Formal Correction: Erratum: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis
Posted by JoVE Editors on 3/07/2022. Citeable Link.
An erratum was issued for: A Neonatal BALB/c Mouse Model of Necrotizing Enterocolitis. The Representative Results section was updated.
Figure 1 was updated from:

Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
to:
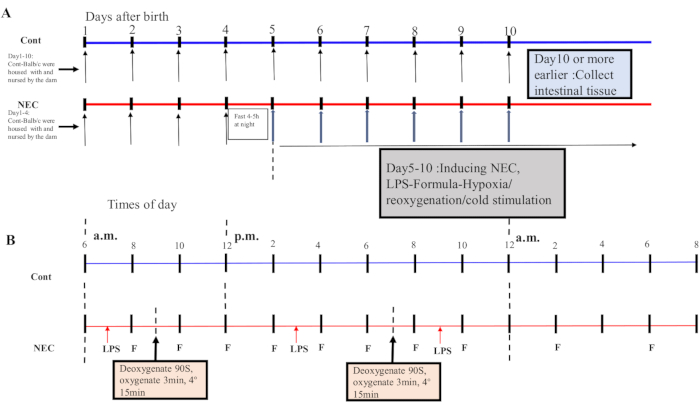
Figure 1: Induction of the BALB/c NEC model process. (A) The mice in the NEC group were separated from the dam at birth until they were 4 days old (on Day 4) and fasted that night. The NEC model was induced from Day 5 onwards after birth and lasted for 5 days. Intestinal tissue specimens were collected on Day 10 or earlier. The mice in the Cont. group were housed with and nursed by the dam. (B) The sequence of operations for each day after inducing the NEC model. Abbreviations: Cont. = control; NEC = necrotizing enterocolitis; LPS = lipopolysaccharide. Please click here to view a larger version of this figure.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados