A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التخمير الذي يتم التحكم فيه بالضوء لإنتاج المواد الكيميائية والبروتين الميكروبي
* These authors contributed equally
In This Article
Summary
يوفر التحكم البصري الجيني في التمثيل الغذائي الميكروبي تحكما ديناميكيا مرنا في عمليات التخمير. يوضح البروتوكول هنا كيفية إعداد التخمير المنظم بالضوء الأزرق لإنتاج المواد الكيميائية والبروتين على نطاقات حجمية مختلفة.
Abstract
توفر مصانع الخلايا الميكروبية بديلا مستداما لإنتاج المواد الكيميائية والبروتينات المؤتلفة من المواد الأولية المتجددة. ومع ذلك ، فإن إثقال كاهل الكائنات الحية الدقيقة بالتعديلات الجينية يمكن أن يقلل من لياقة المضيف وإنتاجيته. يمكن التغلب على هذه المشكلة باستخدام التحكم الديناميكي: التعبير المستحث عن الإنزيمات والمسارات ، عادة باستخدام إضافات كيميائية أو مغذية ، لتحقيق التوازن بين النمو الخلوي والإنتاج. يقدم علم البصريات الوراثي طريقة غير غازية وقابلة للتعديل للغاية وقابلة للعكس لتنظيم التعبير الجيني ديناميكيا. هنا ، نصف كيفية إعداد التخمير الذي يتم التحكم فيه بالضوء للإشريكية القولونية الهندسية و Saccharomyces cerevisiae لإنتاج المواد الكيميائية أو البروتينات المؤتلفة. نناقش كيفية تطبيق الضوء في أوقات وجرعات مختارة لفصل النمو الميكروبي والإنتاج لتحسين التحكم في التخمير والإنتاجية ، بالإضافة إلى اعتبارات التحسين الرئيسية للحصول على أفضل النتائج. بالإضافة إلى ذلك ، نصف كيفية تنفيذ عناصر التحكم في الضوء لتجارب المفاعلات الحيوية على نطاق المختبر. تسهل هذه البروتوكولات اعتماد الضوابط البصرية الجينية في الكائنات الحية الدقيقة الهندسية لتحسين أداء التخمير.
Introduction
يقدم علم البصريات الوراثي، وهو التحكم في العمليات البيولوجية باستخدام البروتينات المستجيبة للضوء، استراتيجية جديدة للتحكم ديناميكيا في التخمير الميكروبي لإنتاج المواد الكيميائية والبروتين1،2. غالبا ما يضعف عبء المسارات الأيضية الهندسية وسمية بعض المواد الوسيطة والمنتجات نمو الخلايا3. ويمكن أن تؤدي هذه الضغوط إلى ضعف تراكم الكتلة الأحيائية وانخفاض الإنتاجية3. ويمكن التصدي لهذا التحدي عن طريق تقسيم عمليات التخمير مؤقتا إلى مرحلة نمو وإنتاج، تكرس موارد التمثيل الغذائي لتراكم الكتلة الحيوية أو توليف المنتجات على التوالي4. لقد أظهرنا مؤخرا أن الانتقال من النمو إلى الإنتاج في هذا التخمير ثنائي المراحل يمكن أن يحدث مع التغيرات في ظروف الإضاءة5،6،7. توفر القابلية العالية للضبط والانعكاس والتعامد لمدخلات الضوء8 مزايا فريدة للتخمير الذي يتم التحكم فيه بالضوء والذي يصعب أو يستحيل تكراره مع المحفزات الكيميائية المستخدمة في التحكم الديناميكي في التخمير التقليدي ثنائي الطور4،9،10،11.
تم استخدام بروتين EL222 المستجيب للضوء الأزرق المشتق من Erythrobacter litoralis لتطوير العديد من الدوائر البصرية الجينية للهندسة الأيضية في Saccharomyces cerevisiae5,7,12,13. يحتوي EL222 على مجال مستشعر جهد الضوء والأكسجين (LOV) الذي يخضع لتحول توافقي عند تنشيط الضوء الأزرق (465 نانومتر) ، مما يسمح له بالارتباط بتسلسل الحمض النووي المتشابه (C120)13. يؤدي دمج EL222 مع مجال تنشيط VP16 الفيروسي (VP16-EL222) إلى عامل نسخ مستجيب للضوء الأزرق يمكنه تنشيط التعبير الجيني بشكل عكسي في S. cerevisiae7 والكائنات الحية الأخرى14 من المروج الاصطناعي PC120. تم تطوير العديد من الدوائر القائمة على EL222 واستخدامها للإنتاج الكيميائي في S. cerevisiae ، مثل نظام OptoEXP الأساسي المنشط بالضوء 7 ، حيث يتم التعبير عن الجين محل الاهتمام مباشرة من PC120 (الشكل 1A). ومع ذلك ، فإن المخاوف من اختراق الضوء في كثافات الخلايا العالية التي تصادف عادة في مرحلة إنتاج التخمير حفزتنا على تطوير دوائر مقلوبة يتم تحفيزها في الظلام ، مثل دوائر OptoINVRT و OptoQ-INVRT (الشكل 1B) 5،7،13. تسخر هذه الأنظمة الجالاكتوز (GAL) أو حمض الكينيك (Q) من S. cerevisiae و N. crassa ، على التوالي ، وتتحكم في مثبطاتها المقابلة (GAL80 و QS) باستخدام VP16-EL222 ، لقمع التعبير الجيني في الضوء وحثه بقوة في الظلام. يؤدي الجمع بين دوائر OptoEXP و OptoINVRT إلى التحكم ثنائي الاتجاه في التعبير الجيني ، مما يتيح التخمير ثنائي الطور الذي يتم فيه تحفيز مرحلة النمو بالضوء الأزرق ، ومرحلة الإنتاج مع الظلام (الشكل 2A)5,7.
إن استخدام الضوء بدلا من الظلام للحث على التعبير الجيني خلال مرحلة الإنتاج من شأنه أن يوسع بشكل كبير قدرات الضوابط البصرية الجينية ولكنه سيتطلب أيضا التغلب على قيود اختراق الضوء لكثافات الخلايا العالية التي تصادف عادة في مرحلة التخمير هذه. وتحقيقا لهذه الغاية، قمنا بتطوير دوائر، تعرف باسم OptoAMP و OptoQ-AMP، تعمل على تضخيم الاستجابة النسخية لتحفيز الضوء الأزرق. تستخدم هذه الدوائر طفرات من النوع البري أو شديد الحساسية من VP16-EL222 للتحكم في إنتاج منشطات النسخ Gal4p أو QF2 من تنظيمات GAL أو Q ، على التوالي ، مما يحقق حساسية معززة وتعبيرا جينيا أقوى مع الضوء12,13 (الشكل 1C). يمكن لدوائر OptoAMP تحقيق تحريض ضوئي كامل ومتجانس في مفاعلات حيوية سعة 5 لتر بكثافة بصرية (تقاس عند 600 نانومتر; OD600) قيم لا تقل عن 40 مع ~ 0.35٪ فقط من الإضاءة (5٪ جرعة ضوئية على ~ 7٪ فقط من السطح السائب). وهذا يدل على درجة أعلى من الحساسية مقارنة ب OptoEXP، الذي يتطلب إضاءة بنسبة 100٪ تقريبا12. إن القدرة على تحفيز التعبير الجيني بفعالية مع الضوء عند كثافة الخلايا العالية تفتح فرصا جديدة للتحكم الديناميكي في عمليات التخمير. ويشمل ذلك عمليات التخمير التشغيلية في أكثر من مرحلتين زمنيتين، مثل التخمير ثلاثي المراحل، حيث يتم إنشاء مراحل النمو والحث والإنتاج بجداول إضاءة فريدة لتحسين الإنتاج الكيميائي (الشكل 2B)12.

الشكل 1: الدوائر البصرية الجينية للتحكم الديناميكي في S. cerevisiae. تعتمد دوائر OptoEXP و OptoINVRT و OptoAMP على نظام VP16-EL222 الحساس للضوء. (أ) في دائرة OptoEXP ، يؤدي التعرض للضوء الأزرق إلى تغيير توافقي و dimerization من VP16-EL222 ، مما يكشف عن مجال ربط الحمض النووي ويسمح بالنسخ من PC120. وقد عدل هذا الرقم من تشاو وآخرين.7. (B) تسخر دوائر OptoINVRT تنظيمات GAL (المعروضة) أو Q للحث على التعبير في الظلام. في الدوائر القائمة على GAL، يتم التعبير عن VP16-EL222 وGAL4 بشكل تأسيسي، في حين يتم التعبير عن محركات الأقراص PC120 عن مثبط GAL80 (في الدوائر القائمة على Q، يتم استبدال GAL4 وGAL80 ب QF2 و QS، على التوالي، ويتم استخدام مروج اصطناعي يحتوي على QUAS بدلا من مروج GAL). في الضوء ، يمنع Gal80p تنشيط الجين محل الاهتمام من PGAL1. في الظلام ، لا يتم التعبير عن GAL80 ويتحلل بسرعة عن طريق دمجه في مجال degron التأسيسي (المجال البني الصغير) ، والذي يسمح بتنشيط PGAL1 بواسطة Gal4p. وقد عدل هذا الرقم من Zhao et al.5. (C) تستخدم دوائر OptoAMP أيضا VP16-EL222 للتحكم في تنظيمات GAL (المعروضة) أو Q. في هذه الدوائر ، يتم التعبير عن مثبط GAL80 (أو QS) بشكل أساسي ودمجه في degron حساس للصور (مجال أزرق صغير) يضمن القمع المحكم في الظلام. PC120 وتعبير التحكم المتحور VP16-EL222 شديد الحساسية ل GAL4 (أو QF2) مع الضوء ، والذي ينشط بقوة PGAL1 (أو مروج يحتوي على QUAS) في الضوء. يمكن للدوائر المشتقة من GAL استخدام أشكال هندسية من PGAL1 ، مثل PGAL1-M أو PGAL1-S ، والتي زادت من النشاط ، بالإضافة إلى المروجين من النوع البري الذي يتحكم فيه تنظيم GAL (PGAL1 ، PGAL10 ، PGAL2 ، PGAL7). تم تعديل الرقم من Zhao et al.12. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التخمير ثنائي وثلاثي الطور عبر الزمن. (أ) تتكون عمليات التخمير ثنائية الطور التي تعمل بدوائر مقلوبة من مرحلة نمو مدفوعة بالضوء ومرحلة إنتاج مظلمة. في مرحلة النمو ، تتراكم الكتلة الحيوية مع بقاء مسار الإنتاج مكبوتا. عند الوصول إلى OD600 المطلوب ، يتم نقل الخلايا إلى الظلام لضبط التمثيل الغذائي قبل إعادة تعليقها في وسائط جديدة لمرحلة الإنتاج. (ب) في عملية من ثلاث مراحل ، يتم تحديد مراحل النمو والحضانة والإنتاج من خلال جداول ضوئية فريدة من نوعها ، والتي قد تتكون من فترة نمو مظلمة ، وحضانة نبضية ، ومرحلة إنتاج مضاءة بالكامل. الشكل الذي تم إنشاؤه باستخدام Biorender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
كما تم تطوير الدوائر البصرية الجينية للتحكم الديناميكي في إنتاج المواد الكيميائية والبروتين في الإشريكية القولونية. تتحكم دوائر OptoLAC في مثبط LacI البكتيري باستخدام دائرة pDawn المستجيبة للضوء ، والتي تستند إلى نظام YF1 / FixJ المكون من مكونين 6 (الشكل 3). على غرار OptoINVRT5 ، تم تصميم دوائر OptoLAC لقمع التعبير الجيني في الضوء وتحفيزه في الظلام. يمكن أن تتطابق مستويات التعبير باستخدام دوائر OptoLAC مع تلك التي تحققت باستخدام تحريض الأيزوبروبيل القياسي β-d-1-thiogalactopyranoside (IPTG) ، وبالتالي الحفاظ على قوة الحث الكيميائي مع توفير إمكانية محسنة للضبط والانعكاس 6. لذلك ، تتيح دوائر OptoLAC التحكم الفعال في البصريات الجينية للهندسة الأيضية في الإشريكية القولونية.
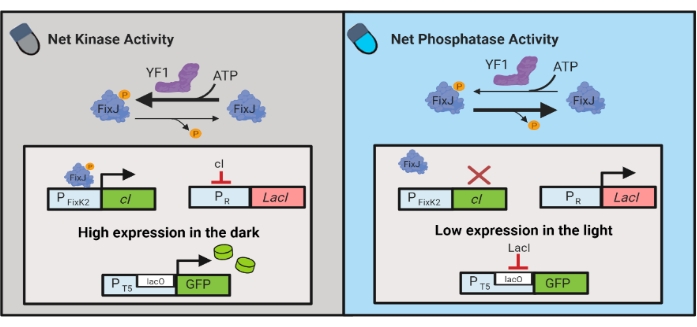
الشكل 3: دوائر OptoLAC للتحكم الديناميكي في الإشريكية القولونية. تقوم دوائر OptoLAC بتكييف نظام pDawn و lac operon لتحقيق التنشيط في الظلام والقمع في الضوء. في الظلام ، يفسفرات YF1 FixJ ، والتي تقوم بعد ذلك بتنشيط مروج PFixK2 للتعبير عن مثبط cI. يمنع مثبط cI التعبير عن مثبط lacI من مروج PR ، مما يسمح بنسخ الجين محل الاهتمام من مروج يحتوي على lacO. على العكس من ذلك ، يقلل الضوء الأزرق من نشاط كيناز صافي YF1 ، مما يعكس فسفرة FixJ وبالتالي تعبير cI ، مما يقلل من التعبير عن lacI ويمنع التعبير من المروج المحتوي على lacO. وقد عدل هذا الرقم من لالواني وآخرين.6. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
نصف هنا البروتوكولات الأساسية للتخمير الذي يتم التحكم فيه بالضوء ل S. cerevisiae و E. coli لإنتاج المواد الكيميائية أو البروتين. بالنسبة لكل من الخميرة والبكتيريا ، نركز أولا على التخمير مع مرحلة نمو مدفوعة بالضوء ومرحلة إنتاج ناجمة عن الظلام ممكنة بواسطة دوائر OptoINVRT و OptoLAC. بعد ذلك ، نصف بروتوكولا للتخمير ثلاثي المراحل (النمو ، الحث ، الإنتاج) الذي يتم التحكم فيه بالضوء والذي يتم تمكينه بواسطة دوائر OptoAMP. علاوة على ذلك ، نصف كيفية توسيع نطاق التخمير الذي يتم التحكم فيه بصريا من الصفائح الدقيقة إلى المفاعلات الحيوية على نطاق المختبر. من خلال هذا البروتوكول ، نهدف إلى توفير دليل كامل وقابل للتكرار بسهولة لإجراء عمليات التخمير التي يتم التحكم فيها بالضوء لإنتاج المواد الكيميائية أو البروتين.
Protocol
1. الإنتاج الكيميائي الذي يتم التحكم فيه بالضوء باستخدام دائرة S. cerevisiae OptoINVRT7
- بناء الإجهاد
- احصل على سلالة مع الأوكسوتروفي الخاص به3 ، لأن هذه العلامة ضرورية لمعظم بلازميدات OptoINVRT الموجودة5. إذا كنت تسعى إلى التنظيم البصري الوراثي لجين أصلي في S. cerevisiae ، فقم ببناء سلالة يتم فيها حذف أي نسخة داخلية المنشأ من الجين.
- قم بإضفاء الطابع الخطي على البلازميد الذي يحتوي على دائرة OptoINVRT7 ، مثل EZ-L4395 ، ودمجه في موضع his3 للسلالة المساعدة باستخدام طرق تحويل أسيتات الليثيوم القياسية 15. إذا كنت تستخدم بلازميد EZ-L439 ، الذي يحتوي على مكونات لقمع PGAL1 في الضوء وتنشيطه في الظلام ، فقم بالخطية في موقع تقييد PmeI.
- بعد التحول ، قم بالطرد المركزي للخلايا عند 150 × g لمدة 1 دقيقة وأعد تعليقها بلطف في 200 ميكرولتر من الوسط الاصطناعي الكامل الطازج (SC-His).
- قم بصب حجم الخلية بالكامل على ألواح SC-His agar واحتضنها عند 30 درجة مئوية لمدة 2-3 أيام حتى تظهر المستعمرات.
- قم بإعداد الخلايا المختصة من هذه السلالة باستخدام بروتوكولات تحويل خلات الليثيوم القياسية ، وتحويلها باستخدام بلازميد يحتوي على الجين (الجينات) المراد التحكم فيه بصريا في اتجاه مجرى النهر إما من مروج PGAL1-M أو PGAL1-S 5.
ملاحظة: استخدام البلازميد الذي يتكامل في مواقع δ (YARCdelta5) ويختار مع Zeocin يسمح بتكامل مستقر متعدد النسخ7،16،17،18. - بعد التحول، قم بالطرد المركزي للثقافة عند 150 × g لمدة 1 دقيقة وأعد تعليقها بلطف في 200 ميكرولتر من وسط تسرب SC الطازج.
ملاحظة: مروج PGAL1-M هو نسخة اصطناعية من مروج PGAL1 مع حذف مواقع قمع Mig1p ، في حين أن PGAL1-S هو نسخة هندسية من PGAL1-M ، والتي تحتوي على مواقع إضافية لربط منشط Gal4p. يمكن استخدام مروج PGAL1 العادي للتحكم في التعبير ؛ ومع ذلك ، فإن قوة التعبير ستكون أقل من هؤلاء المروجين المهندسين. - قم بلوحة حجم الخلية بالكامل على صفيحة أجار مستخلص الخميرة الببتون (YPD) إذا تم دمجها في مواقع δ ، أو لوحة تسرب SC إذا تحولت باستخدام بلازميد يحتوي على علامة اختيار. احتضان في 30 درجة مئوية لمدة 16 ساعة تحت الضوء الأزرق المستمر للحفاظ على الجين الذي تسيطر عليه بصريا قمع.
ملاحظة: بالنسبة لبعض السلالات، قد تنمو المستعمرات بشكل أسرع عند احتضانها في نبضات الضوء الأزرق (على سبيل المثال، 1 ثانية على / 79 ثانية إيقاف، 5 ثانية على / 75 ثانية إيقاف، 10 ثانية على / 70 ثانية إيقاف، إلخ) بدلا من الإضاءة الثابتة، والتي يجب تحديدها تجريبيا لكل سلالة، إذا لزم الأمر. - استخدم أي مصدر ضوء 465 نانومتر وضع لوحة LED ~ 40 سم فوق اللوحة بحيث تكون شدة الضوء ~ 80-110 ميكرومول / م 2 / ث. قياس الشدة باستخدام مقياس كمومي (انظر جدول المواد).
- في حالة الاندماج في مواقع δ ، قم بإنشاء نسخة طبق الأصل من اللوحة على لوحات YPD تحتوي على مجموعة من تركيزات Zeocin بين 400 ميكروغرام / مل و 1200 ميكروغرام / مل لاختيار مجموعة متنوعة من أرقام نسخ التكامل 5,7,12,16,17,18. احتضان الألواح المقلدة عند 30 درجة مئوية تحت ضوء أزرق ثابت أو نابض لمدة 2-3 أيام حتى تظهر المستعمرات.
- فحص أولي لأفضل المستعمرات
- اختر ثماني مستعمرات من كل صفيحة واستخدمها لتلقيح 1 مل من SC-Medium المكمل بالجلوكوز بنسبة 2٪ في الآبار الفردية لصفيحة 24 بئرا. تنمو في لوحات 24 بئرا تحت الخلايا بين عشية وضحاها (16-20 ساعة) عند 30 درجة مئوية مع اهتزاز 200 دورة في الدقيقة (قطر مداري 19 مم) تحت إضاءة الضوء الأزرق الثابتة.
- في صباح اليوم التالي ، قم بتخفيف كل ثقافة في 1 مل من SC-He الطازج مع 2٪ من الجلوكوز إلى قيم OD600 التي تتراوح بين 0.01-0.3 وتنمو في لوحات 24 بئرا تحت ضوء ثابت أو نبضي عند 30 درجة مئوية مع اهتزاز 200 دورة في الدقيقة حتى تصل إلى كثافات الخلايا بين 2 و 9 قيم OD600 (الشكل 4A). يعتمد مقدار الوقت اللازم لمرحلة النمو هذه على السلالة.
- احتضن الألواح في الظلام لمدة 4 ساعات عند 30 درجة مئوية مع اهتزاز 200 دورة في الدقيقة عن طريق إيقاف تشغيل لوحة الإضاءة ولف الألواح بورق الألومنيوم.
ملاحظة: تسمح هذه الخطوة للخلايا بالانتقال الأيضي إلى مرحلة الإنتاج قبل إعادة التعليق في وسائط الإنتاج. - لبدء مرحلة الإنتاج ، قم بالطرد المركزي للمزارع في لوحة 24 بئرا عند 234 × g لمدة 5 دقائق وأعد تعليق الخلايا في 1 مل من وسط تسرب SC الطازج مع 2٪ من الجلوكوز. قم بإغلاق الألواح لمنع تبخر المنتج المطلوب باستخدام شريط مانع للتسرب من الألواح الدقيقة المعقمة.
- قم بتخمير الألواح المختومة في الظلام لمدة 48 ساعة عند 30 درجة مئوية مع الاهتزاز عند 200 دورة في الدقيقة. تأكد من أن الألواح ملفوفة بورق الألومنيوم لمنع أي تعرض للضوء.
ملاحظة: تغليف الألواح في رقائق معدنية لا يحد من توافر الأكسجين أو الغاز في عمليات التخمير. ومع ذلك ، فإن شريط الختم المعقم يحد من نقل الغاز. يمكن وضع ثقوب صغيرة في الشريط لإدخال الأكسجين ، إذا لزم الأمر.
- الحصاد والتحليل
- لحصاد التخمير ، قم بالطرد المركزي للألواح لمدة 5 دقائق عند 234 × g ونقل 800 ميكرولتر من supernatant إلى أنابيب طرد مركزي دقيق 1.5 مل.
- اعتمادا على المادة الكيميائية المثيرة للاهتمام ، قم بالتحليل باستخدام الكروماتوغرافيا السائلة عالية الأداء (HPLC) ، أو كروماتوغرافيا الغاز - قياس الطيف الكتلي (GC-MS) ، أو طريقة تحليلية أخرى باستخدام تقنية تحضير العينة الأنسب للأداة المستخدمة.
2. إنتاج البروتين الذي يتم التحكم فيه بالضوء باستخدام نظام E. coli OptoLAC
- بناء الإجهاد
- شارك في تحويل BL21 DE3 ΔlacI ΔlacI-DE3 مع بلازميد يحتوي على دائرة OptoLAC1B أو OptoLAC2B 6 وبلازميد يعبر عن البروتين المؤتلف الذي يثير اهتمام مروج PT719.
- بعد التحويل ، استرجع الخلايا لمدة 1 ساعة في 1 مل من المرق الأمثل الفائق مع قمع الهدم (SOC ؛ 2٪ tryptone ، 0.5٪ مستخلص الخميرة ، 10 mM NaCl ، 2.5 mM KCl ، 10 mM MgCl2 ، 10 mM MgSO4 ، 20 mM glucose) عند 37 درجة مئوية مع الدوران أو الاهتزاز.
ملاحظة: يجب أن يكون البلازميد الذي يحتوي على البروتين محل الاهتمام متوافقا مع بلازميد OptoLAC (أي علامة مقاومة مختلفة وأصل التكرار) ويجب ألا يحتوي على نسخة من lacI. - الطرد المركزي للخلايا في 4845 × غرام لمدة 3 دقائق وتركيز الكريات في 200 ميكرولتر من وسائط مرق الليزوجيني (LB). قم بصب الخلايا المركزة بأكملها على صفيحة LB agar بالمضادات الحيوية المناسبة وتنمو عند 37 درجة مئوية بين عشية وضحاها تحت الضوء الأزرق المستمر للحفاظ على التعبير عن البروتين مكبوتا.
- الفحص الأولي للتحقق من التعبير
- خذ ثلاث مستعمرات مفردة واستخدمها لتلقيح 1 مل من وسائط LB بالمضادات الحيوية المناسبة في الآبار الفردية لصفيحة من 24 بئرا. تنمو بين عشية وضحاها (16-20 ساعة) عند 37 درجة مئوية مع اهتزاز 200 دورة في الدقيقة تحت إضاءة الضوء الأزرق المستمرة (الشكل 4A).
- في اليوم التالي ، استخدم 1.5 ميكرولتر من الثقافة لقياس OD600 في مقياس الطيف الضوئي مع قياس الحجم الصغير. قم بتخفيف الثقافات إلى 1 مل من LB الطازج في لوحات 24 بئرا إلى قيم OD600 التي تتراوح بين 0.01-0.1.
- تنمو الثقافات عند 37 درجة مئوية مع اهتزاز 200 دورة في الدقيقة تحت الضوء الأزرق لمدة 2-3 ساعات. بدءا من الساعة الثانية ، خذ قياسات OD600 كل 15 دقيقة للتأكد من أن الثقافات لا تفرط في نطاق OD600 من 0.1-1.5.
- بمجرد أن تكون الثقافات في OD600 المطلوب ، قم بإيقاف تشغيل لوحة الإضاءة ولف اللوحة بورق الألومنيوم لبدء مرحلة الإنتاج. احتفظ باللوحة في الظلام لمدة 8 ساعات (37 درجة مئوية) أو 20 ساعة (30 درجة مئوية) أو 48 ساعة (18 درجة مئوية) مع اهتزاز 200 دورة في الدقيقة.
- قم بقياس وتسجيل قيمة OD600 النهائية لكل ثقافة.
- الحصاد والتحليل
- انقل 800 ميكرولتر من كل مزرعة إلى أنبوب طرد مركزي صغير سعة 1.5 مل وأجهزة طرد مركزي لمدة 5 دقائق عند 17000 × جم.
- أعد تعليق حبيبة الخلية في 200 ميكرولتر من المخزن المؤقت لإعادة التعليق (Tris 50 mM ، الرقم الهيدروجيني 8.0 ، NaCl 300 mM).
ملاحظة: يمكن تعديل تركيز كلوريد الصوديوم بناء على البروتين المؤتلف الذي يتم تحليله. - أضف 50 ميكرولتر من 6x كبريتات دوديسيل الصوديوم (SDS) المخزن المؤقت للعينة (Tris 375 mM ، الرقم الهيدروجيني 6.8 ، SDS 9٪ ، الجلسرين 50٪ ، بروموفينول الأزرق 0.03٪ ، DTT 9٪). احتضان في 100 درجة مئوية لمدة 10 دقائق مع الاهتزاز عند 700 دورة في الدقيقة في خلاط حراري.
- تحميل ~ 3-20 ميكرولتر من الثقافة في هلام SDS-PAGE 12٪. باستخدام قياس OD600 النهائي كدليل ، قم بتحميل نفس الكمية تقريبا من البروتين لكل عينة (أي ما يعادل 10 ميكرولتر من العينة المقابلة لقيمة OD600 النهائية من 1). استخدم مصدر طاقة لتشغيل الرحلان الكهربائي عند 100 فولت حتى يتم حل الجل بالكامل.
- قم بتلطيخ الجل بمحلول G-250 الأزرق اللامع Coomassie عن طريق التسخين لمدة 30-40 ثانية في فرن الميكروويف ، ثم احتضانه على دوار المنصة لمدة 15 دقيقة على الأقل.
- اشطفيه بالماء منزوع الأيونات مرتين وأزيلي البقع عن البقعة على دوار المنصة لمدة 30 دقيقة على الأقل (أو طوال الليل)، مع إضافة منديلين للتنظيف مربوطين في عقدة للمساعدة في امتصاص البقعة. غلي الجل في كمية كافية من الماء في فرن الميكروويف لمدة 15 دقيقة لتسريع عملية إزالة الصبغ.
3. التخمير ثلاثي المراحل باستخدام نظام S. cerevisiae OptoAMP
- بناء الإجهاد
- احصل على سلالة ذات علامة auxotrophic الخاصة به 3 ، لأن هذه العلامة ضرورية لاستخدام بلازميدات OptoAMP الحالية5. إذا كنت تسعى إلى التنظيم البصري الوراثي لجين أصلي في S. cerevisiae ، فقم ببناء سلالة يتم فيها حذف النسخة الداخلية من هذا الجين.
- قم بخطنة بلازميد يحتوي على دائرة OptoAMP4 ، مثل EZ-L58012 ، ودمجها في موضع his3 للسلالة المساعدة التغذية باستخدام طرق تحويل أسيتات الليثيوم القياسية15. في حالة استخدام EZ-L580 ، قم بخطي البلازميد في موقع تقييد PmeI.
- بعد التحول ، قم بالطرد المركزي للخلايا عند 150 × g لمدة 1 دقيقة وأعد تعليقها بلطف في 200 ميكرولتر من وسط SC-His الطازج.
- قم بلوحة حجم الخلية بالكامل على وسائط انتقائية (SC-His-agar) واحتضنها عند 30 درجة مئوية لمدة 2-3 أيام حتى تظهر المستعمرات.
- قم بإعداد الخلايا المختصة من هذه السلالة وتحويلها باستخدام بلازميد يحتوي على الجين (الجينات) المراد التحكم فيه بصريا في اتجاه مجرى النهر من مروج PGAL1-S12.
ملاحظة: استخدام البلازميد الذي يتكامل في مواقع δ ويختار مع Zeocin يسمح بتكامل واختيار مستقر متعدد النسخ. - بعد التحويل ، قم بالطرد المركزي للثقافة عند 150 × g لمدة 1 دقيقة وأعد التعليق بلطف في 200 ميكرولتر من وسط تسرب SC الطازج.
ملاحظة: مروج PGAL1-S هو نسخة اصطناعية من مروج PGAL1 حيث يتم حذف مواقع قمع Mig1p وإضافة مواقع ربط منشط Gal4p إضافية. يمكن استخدام مروج PGAL1 العادي ؛ ومع ذلك ، فإن قوة التعبير ستكون أقل من هذا المروج الهندسي. - قم بلوحة حجم الخلية بالكامل على لوحة أجار YPD أو SC-dropout واحتضان عند 30 درجة مئوية لمدة 16 ساعة في الظلام (ملفوفة في رقائق الألومنيوم). الحضانة في الظلام تبقي الجين الذي يتم التحكم فيه بصريا مكبوتا ، مما يسمح للخلايا بتوجيه مواردها الأيضية نحو نمو الخلايا بدلا من الإنتاج الكيميائي.
- في حالة الاندماج في مواقع δ ، قم بنسخ لوحة طبق الأصل على لوحات YPD تحتوي على مجموعة من تركيزات Zeocin لاختيار مجموعة متنوعة من أرقام نسخ التكامل. احتضن الألواح عند 30 درجة مئوية في الظلام (ملفوفة بورق الألومنيوم) لمدة 2-3 أيام حتى تظهر المستعمرات.
- فحص أولي لأفضل المستعمرات
- اختر ثماني مستعمرات من كل صفيحة واستخدمها لتلقيح 1 مل من SC-His Medium مع 2٪ من الجلوكوز في آبار فردية من صفيحة 24 بئرا. تنمو الخلايا بين عشية وضحاها (16-20 ساعة) في الظلام عند 30 درجة مئوية مع اهتزاز 200 دورة في الدقيقة.
- في صباح اليوم التالي ، قم بتخفيف كل ثقافة في 1 مل من SC-Medium الطازج مع 2٪ من الجلوكوز إلى 0.1 OD600 وتنمو في الظلام عند 30 درجة مئوية مع اهتزاز 200 دورة في الدقيقة حتى تصل إلى OD600 من 3. لف الألواح بورق الألومنيوم لمنع التعرض للضوء. يعتمد مقدار الوقت اللازم لمرحلة النمو هذه على السلالة.
- لبدء مرحلة الحث ، احتضن الألواح تحت الضوء النبضي (على سبيل المثال ، 5 ثانية على / 95 ثانية قبالة) لمدة 12 ساعة عند 30 درجة مئوية مع اهتزاز 200 دورة في الدقيقة. استخدم أي مصدر ضوء 465 نانومتر وضع لوحة LED فوق اللوحة بحيث تكون شدة الضوء ~ 80-110 ميكرومول / م 2 / ثانية للحصول على أفضل النتائج (الشكل 4A).
ملاحظة: تختلف مدة نبضة الضوء المثلى لهذه الحضانة بناء على المادة الكيميائية التي يتم إنتاجها. يوصى بفحص مجموعة من جداول الإضاءة من 0.1٪ (على سبيل المثال ، 1 ثانية على 999 ثانية قبالة) إلى 100٪ (إضاءة كاملة). - لبدء مرحلة الإنتاج ، قم بالطرد المركزي للثقافات عند 234 × g لمدة 5 دقائق وأعد تعليقها في SC-His الطازج مع 2٪ من الجلوكوز. قم بإغلاق الألواح لمنع تبخر المنتج المطلوب باستخدام شريط مانع للتسرب من الألواح الدقيقة المعقمة.
- قم بتخمير الألواح المختومة في الضوء لمدة 48 ساعة عند 30 درجة مئوية مع الاهتزاز عند 200 دورة في الدقيقة. قم بتحسين جدول الإضاءة خلال هذه الخطوة حيث تستفيد بعض المواد الكيميائية من مرحلة الإنتاج النبضي بدلا من الضوء الكامل.
- الحصاد والتحليل
- حصاد التخمير عن طريق الطرد المركزي للألواح لمدة 5 دقائق عند 234 × g ونقل 800 ميكرولتر من supernatant إلى أنابيب الطرد المركزي الدقيقة 1.5 مل.
- اعتمادا على المادة الكيميائية ذات الأهمية ، قم بالتحليل باستخدام HPLC أو GC-MS أو طريقة تحليلية أخرى باستخدام تقنية تحضير العينة الأنسب للأداة المستخدمة.
4. إنتاج المواد الكيميائية (الميفالونات) من الإشريكية القولونية في مفاعل حيوي يتم التحكم فيه بالضوء
- التلقيح الأولي وإعداد المفاعل الحيوي
- تلقيح مستعمرة من سلالة E. coli المصممة بإنتاج كيميائي يتم التحكم فيه بالضوء إلى 5 مل من أملاح M9 الدنيا (3.37 mM Na2HPO4 ، 2.2 mM KH2PO4 ، 0.855 mM NaCl ، 0.935 mM NH4Cl) تستكمل بأحماض كاسامينو 0.2٪ w / v ، 5٪ w / v glucose ، وخليط المعادن النزرة20 (0.0084 جم / لتر EDTA ، 0.0025 جم / لتر CoCl2 ، 0.015 جم / لتر MnCl2 ، 0.0015 جم / لتر CuCl2 ، 0.003 جم / لتر H3BO3 ، 0.0025 جم / لتر Na2MoO4 ، 0.008 جم / لتر ZnCl2 ، 0.06 جم / لتر Fe (III) سيترات ، 0.0045 جم / لتر ثيامين ، 1.3 جم / لتر MgSO4) في أنبوب مخروطي 50 مل.
- قم بتنمية الثقافة بين عشية وضحاها عند 30 درجة مئوية مع اهتزاز 200 دورة في الدقيقة تحت إضاءة الضوء الأزرق.
- قم بإعداد لوحة رأس وعاء المفاعل الحيوي ، مع التأكد من تثبيت المنافذ التالية: أدخل للمسبار الحراري ؛ مسبار الأكسجين المذاب (DO) ؛ سبارجر الغاز - اتصل بمصدر الهواء من خلال مرشح 0.2 ميكرومتر ؛ المكره مكثف الغاز - اتصل بمرشح 0.2 ميكرومتر ؛ خط التبريد (x2) ؛ خطوط التغذية (x2) - واحدة لإضافة الوسائط ، واحدة للتحكم في درجة الحموضة ؛ خط أخذ العينات - تأكد من وصوله إلى قاع السفينة ؛ ميناء فارغ مسبار الأس الهيدروجيني - معايرة المسبار بمعايير الرقم الهيدروجيني = 4 والرقم الهيدروجيني = 7 قبل التثبيت ، إما الأوتوكلاف مع بقية الوعاء أو التعقيم بالإيثانول بنسبة 95٪ وإدخاله بشكل معقم قبل الإعداد.
- املأ الوعاء ب 1 لتر من الماء المصفى ، وقم بتوصيل لوحة الرأس وشدها ، مع التأكد من أن الحلقة O تناسب وتغلق بشكل مريح.
- قم بتغطية أي فتحات في المفاعل برقائق الألومنيوم.
- قم بإعداد ثلاثة شرائط من الأنابيب: واحدة لإزالة الماء ، وواحدة لإدخال العلف ، وواحدة للتحكم في درجة الحموضة. قم بتغطية النهايات بورق الألومنيوم ولف جميع الأنابيب برقائق الألومنيوم.
ملاحظة: NH4OH ، الذي يستخدم لتعديل درجة الحموضة ، لا يتدفق بسلاسة في أنابيب السيليكون ، مما قد يؤدي إلى معدلات تدفق غير دقيقة والإفراط في قاعدة الثقافة. لتجنب هذه المشكلة، استخدم أنابيب المضخة المتوافقة بيولوجيا (BPT) لتغذية NH4OH. - قم بتعقيم المفاعل الحيوي والأنابيب ، باستخدام دورة سائلة مدتها 30 دقيقة.
- إزالة المواد من الأوتوكلاف. بمجرد أن تبرد بما يكفي للتعامل معها ، قم بتوصيل المكره ، ومجسات الأس الهيدروجيني و DO ، ومصدر الهواء ، ومدخل ومخرج المكثف ، ومدخل ومخرج التبريد بمحطة التحكم.
- أدخل المسبار الحراري وقم بتغطية الوعاء بسترة تدفئة. قم بتثبيت السترة باتجاه الجزء العلوي من الوعاء لتجنب حجب الثقافة عن التعرض للضوء.
- قم بتوصيل أحد الأنابيب المعقمة بخط أخذ العينات وقم بتأمينه من خلال مضخة أخذ العينات. ضع الطرف الآخر بحيث يتدفق إلى حاوية فارغة يمكنها استيعاب 1 لتر على الأقل.
- قم بتوصيل أنبوب معقم آخر بأحد خطوط التغذية وقم بتأمينه من خلال إحدى مضخات التغذية. قم بتوصيل الطرف الآخر من الأنبوب بزجاجة من وسائط M9. تغذية وسائل الإعلام في المفاعل.
- قم بتوصيل أنبوب معقم آخر بأحد خطوط التغذية وقم بتأمينه من خلال إحدى مضخات التغذية. قم بتوصيل الطرف الآخر من الأنبوب بالزجاجة التي تحتوي على 28٪ -30٪ NH4OH.
تنبيه: NH4OH هو التآكل. اعمل في غطاء الدخان أثناء النقل إلى زجاجة تغذية وتأكد من وضع زجاجة التغذية في احتواء ثانوي. - ضع ثلاث لوحات ضوئية في تشكيل مثلث على بعد 20 سم تقريبا من المفاعل ، مع التحقق من أن شدة الضوء على سطح الوعاء تصل إلى ~ 80-110 ميكرومول / م 2 / ثانية من كل جانب (الشكل 4B).
- في اليوم التالي ، قم بتشغيل نظام المفاعل الحيوي والمبرد. اضبط نقطة ضبط درجة حرارة المفاعل على 37 درجة مئوية ، ونقطة ضبط الرقم الهيدروجيني على 7.0 ، والإثارة على 200 دورة في الدقيقة. يجب تشغيل سترة التدفئة.
- قم بمعايرة مسبار DO عن طريق الانتظار أولا حتى تصبح درجة الحرارة وقياسات DO ثابتة (ستكون هذه هي نقطة الضبط بنسبة 100٪). بعد ذلك ، افصل المسبار عن النظام (ستكون هذه هي نقطة الضبط 0٪). كرر ذلك حتى يستقر قياس DO عند 100٪ عند توصيل المسبار، ثم اضبط نقطة ضبط DO على 20٪.
- إنتاج المواد الكيميائية التي يتم التحكم فيها بالضوء
- قم بتلقيح المفاعل الحيوي إلى OD600 الأولي من 0.001-0.1. قم بتشغيل لوحات الإضاءة لبدء النمو.
- بعد 3 ساعات ، ابدأ في أخذ عينات من خط أخذ العينات لأخذ قياسات OD600 لتجنب زيادة كثافة الخلايا المثلى للحث (ρs). بمجرد الوصول إلى ρs الأمثل (القيمة المثلى لإنتاج الميفالونات هي 0.17) ، قم بإيقاف تشغيل الألواح الضوئية ، وتغطية المفاعل برقائق الألومنيوم ، ولف الإعداد بقطعة قماش سوداء لبدء مرحلة الإنتاج المظلمة.
- أضف 50 ميكرولتر من الرغوة المضادة ، 8 ساعات بعد التحول إلى الظلام. قم بفك المنفذ الفارغ وماصة الرغوة المضادة مباشرة في المفاعل.
- استخدم منفذ أخذ العينات لأخذ عينات بشكل دوري لتحليل HPLC أو GC.
- التفكيك والتحليل
- بعد الانتهاء من التجربة ، قم بإيقاف تشغيل النظام. قم بفك مجسات DO و pH بعناية واغسلها بالماء والصابون. قم بفك لوحة الرأس واغسلها بالماء والصابون باستخدام فرشاة.
- انقل الثقافة إلى حاوية فارغة وأضف المبيض إلى تركيز نهائي بنسبة 10٪ v / v. ضعيه في غطاء دخان وتخلص منه بعد 30 دقيقة.
- اغسل وعاء المفاعل بالماء والصابون باستخدام فرشاة.
- إعداد العينات للتحليل بناء على المنتج محل الاهتمام. لإنتاج الميفالونات ، امزج 560 ميكرولتر من الثقافة مع 140 ميكرولتر من 0.5 M HCl ودوامة بسرعة عالية لمدة 1 دقيقة. هذا يحول الميفالونات إلى (±)-مفالونولاكتون.
تحذير: حمض الهيدروكلوريك هو خطر على الصحة. تعامل مع معدات الوقاية الشخصية المناسبة وتأكد من تغطية أنابيب العينات بشكل صحيح قبل الدوامة. - جهاز طرد مركزي عند 17000 × جم لمدة 45 دقيقة عند 4 درجات مئوية. نقل 250 ميكرولتر من supernatant إلى قارورة HPLC.
- بالنسبة للميفاليونات ، قم بتحليل العينات باستخدام عمود التبادل الأيوني للأحماض العضوية. تحديد كمية الإنتاج باستخدام كاشف معامل الانكسار (RID) ، ومقارنة مناطق الذروة بمعيار (±) - مفالونولاكتون.
النتائج
تم تنفيذ التنظيم البصري الوراثي لعملية التمثيل الغذائي الميكروبي بنجاح لإنتاج مجموعة متنوعة من المنتجات ، بما في ذلك الوقود الحيوي والمواد الكيميائية السائبة والبروتينات والمنتجات الطبيعية5،6،7،12،13.
Discussion
لطالما تم تطبيق التحكم الديناميكي لتحسين إنتاجية الهندسة الأيضية وإنتاج البروتين المؤتلف4. عادة ما يتم تنفيذ التحولات في التعبير الأنزيمي باستخدام محفزات كيميائية مثل IPTG21 و galactose22 و tetracycline23 ، ولكن تم أيضا بوساطة استخدام ظروف العملية مثل درجة الحرار...
Disclosures
تقدم المؤلفون بطلب للحصول على العديد من براءات الاختراع للدوائر والأساليب البصرية الجينية الموضحة في هذه المقالة.
Acknowledgements
تم دعم هذا البحث من قبل وزارة الطاقة الأمريكية ، ومكتب العلوم ، ومكتب البحوث البيولوجية والبيئية رقم الجائزة DE-SC0019363 ، وجائزة NSF CAREER CBET-1751840 ، وصناديق بيو الخيرية ، وجائزة كاميل دريفوس للمعلمين والباحثين.
Materials
| Name | Company | Catalog Number | Comments |
| Light-controlled chemical production using S. cerevisiae | |||
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Agar powder | Thermo Fisher Scientific | 303991049 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| EZ-L439 OptoINVRT7 Plasmid | N/A | N/A | See Reference 1 |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| PmeI | New England Biolabs | R0560L | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| Replica-plating device | Thomas Scientific | F37848-0000 | |
| Replica-plating pads | Sunrise Science Products | 3005-012 | |
| SC-His powder | Sunrise Science Products | 1303-030 | |
| SC Complete powder | Sunrise Science Products | 1459-100 | |
| Sterile sealing film | Excel Scientific | STR-SEAL-PLT | |
| YPD agar plates | VWR | 100217-054 | |
| Zeocin | Thermo Fisher Scientific | R25005 | |
| Light-controlled protein production using E. coli | |||
| 6X SDS Sample Buffer | Cepham Life Sciences | 10502 | |
| 12% Acrylamide protein gels | Thermo Fisher Scientific | NP0341BOX | |
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| Coomassie Brilliant Blue G-250 | Thermo Fisher Scientific | 20279 | |
| Electrophoresis cell | Bio-Rad | 1658004 | |
| Electrophoresis power supply | Bio-Rad | 1645050 | |
| LB broth (Miller) | Fisher Scientific | BP97235 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NaCl | Thomas Scientific | SX0425-1 | |
| OptoLAC plasmids | N/A | N/A | See Reference 2 |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SOC medium | Thermo Fisher Scientific | 15544034 | |
| Thermomixer | Eppendorf | 5382000015 | |
| Tris base | Fisher Scientific | BP1521 | |
| Three-phase fermentation using S. cerevisiae | |||
| Same materials as "Light-controlled chemical production using S. cerevisiae" protocol plus the following: | |||
| EZ-L580 OptoAMP4 Plasmid | N/A | N/A | See Reference 10 |
| Chemical production in a light-controlled bioreactor | |||
| Aluminum foil | Reynolds | B004NG90YO | |
| Antifoam | Sigma-Aldrich | A8311 | |
| Bioreactor with control station | Eppendorf | B120110001 | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Bleach | VWR Scientific | 89501-620 (CS) | |
| Blue LED panel | HQRP | 884667106091218 | |
| BPT tubing | Fisher Scientific | 14-170-15 | |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Hydrochloric acid (HCl) | Fisher Scientific | 7647-01-0 | |
| M9 Minimal Salts | Thermo Fisher Scientific | A1374401 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NH4OH Solution | Sigma-Aldrich | I0503-1VL | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SC Complete powder | Sunrise Science Products | 1459-100 |
References
- Figueroa, D., Rojas, V., Romero, A., Larrondo, L. F., Salinas, F. The rise and shine of yeast optogenetics. Yeast. 38 (2), 131-146 (2021).
- Pouzet, S., et al. The promise of optogenetics for bioproduction: Dynamic control strategies and scale-up instruments. Bioengineering. 7 (4), 151 (2020).
- Venayak, N., Anesiadis, N., Cluett, W. R., Mahadevan, R. Engineering metabolism through dynamic control. Current Opinion in Biotechnology. 34, 142-152 (2015).
- Lalwani, M. A., Zhao, E. M., Avalos, J. L. Current and future modalities of dynamic control in metabolic engineering. Current Opinion in Biotechnology. 52, 56-65 (2018).
- Zhao, E. M., et al. Design and characterization of rapid optogenetic circuits for dynamic control in yeast metabolic engineering. ACS Synthetic Biology. 9 (12), 3254-3266 (2020).
- Lalwani, M. A., et al. Optogenetic control of the lac operon for bacterial chemical and protein production. Nature Chemical Biology. 17 (1), 71-79 (2021).
- Zhao, E. M., et al. Optogenetic regulation of engineered cellular metabolism for microbial chemical production. Nature. 555 (7698), 683-687 (2018).
- Baumschlager, A., Khammash, M. Synthetic biological approaches for optogenetics and tools for transcriptional light-control in bacteria. Advanced Biology. 5 (5), 2000256 (2021).
- Dvorak, P., et al. Exacerbation of substrate toxicity by IPTG in Escherichia coli BL21(DE3) carrying a synthetic metabolic pathway. Microbial Cell Factories. 14, 201 (2015).
- Hartline, C. J., Schmitz, A. C., Han, Y., Zhang, F. Dynamic control in metabolic engineering: Theories, tools, and applications. Metabolic Engineering. 63, 126-140 (2021).
- Ni, C., Dinh, C. V., Prather, K. L. J. Dynamic control of metabolism. Annual Review of Chemical and Biomolecular Engineering. 12, 519-560 (2021).
- Zhao, E. M., et al. Optogenetic amplification circuits for light-induced metabolic control. ACS Synthetic Biology. 10 (5), 1143-1154 (2021).
- Lalwani, M. A., Zhao, E. M., Wegner, S. A., Avalos, J. L. The Neurospora crassa Inducible Q System Enables Simultaneous Optogenetic Amplification and Inversion in Saccharomyces cerevisiae for Bidirectional Control of Gene Expression. ACS Synthetic Biology. 10 (8), 2060-2075 (2021).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Marx, H., Mecklenbräuker, A., Gasser, B., Sauer, M., Mattanovich, D. Directed gene copy number amplification in Pichia pastoris by vector integration into the ribosomal DNA locus. FEMS Yeast Research. 9 (8), 1260-1270 (2009).
- Nordén, K., et al. Increasing gene dosage greatly enhances recombinant expression of aquaporins in Pichia pastoris. BMC Biotechnology. 11, 47 (2011).
- Zhao, E. M., et al. Light-based control of metabolic flux through assembly of synthetic organelles. Nature Chemical Biology. 15 (6), 589-597 (2019).
- Dowee, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- Zhou, K., Edgar, S., Stephanopoulos, G. Engineering microbes to synthesize plant isoprenoids. Methods in Enzymology. 575, 225-245 (2016).
- Arfman, N., Worrell, V., Ingram, L. O. Use of the tac promoter and lacI(q) for the controlled expression of Zymomonas mobilis fermentative genes in Escherichia coli and Zymomonas mobilis. Journal of Bacteriology. 174 (22), 7370-7378 (1992).
- Steen, E. J., et al. Metabolic engineering of Saccharomyces cerevisiae for the production of n-butanol. Microbial Cell Factories. 7 (1), 1-8 (2008).
- Tan, S. Z., Manchester, S., Prather, K. L. J. Controlling central carbon metabolism for improved pathway yields in Saccharomyces cerevisiae. ACS Synthetic Biology. 5 (2), 116-124 (2015).
- Jayaraman, P., et al. Blue light-mediated transcriptional activation and repression of gene expression in bacteria. Nucleic Acids Research. 44 (14), 6994 (2016).
- Fernandez-Rodriguez, J., Moser, F., Song, M., Voigt, C. A. Engineering RGB color vision into Escherichia coli. Nature Chemical Biology. 13 (7), 706-708 (2017).
- Ding, Q., et al. Light-powered Escherichia coli cell division for chemical production. Nature Communications. 11 (1), 1-14 (2020).
- Senoo, S., Tandar, S. T., Kitamura, S., Toya, Y., Shimizu, H. Light-inducible flux control of triosephosphate isomerase on glycolysis in Escherichia coli. Biotechnology and Bioengineering. 116 (12), 3292-3300 (2019).
- Ramakrishnan, P., Tabor, J. J. Repurposing synechocystis PCC6803 UirS-UirR as a UV-violet/green photoreversible transcriptional regulatory tool in E. Coli. ACS Synthetic Biology. 5 (7), 733-740 (2016).
- Tabor, J. J., Levskaya, A., Voigt, C. A. Multichromatic control of gene expression in escherichia coli. Journal of Molecular Biology. 405 (2), 315-324 (2011).
- Stewart, C. J., McClean, M. N. Design and implementation of an automated illuminating, culturing, and sampling system for microbial optogenetic applications. Journal of Visualized Experiments:JoVE. (120), e54894 (2017).
- Grødem, E. O. S., Sweeney, K., McClean, M. N. Automated calibration of optoPlate LEDs to reduce light dose variation in optogenetic experiments. BioTechniques. 69 (4), 313-316 (2020).
- Gerhardt, K. P., et al. An open-hardware platform for optogenetics and photobiology. Scientific Reports. 6, (2016).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Steel, H., Habgood, R., Kelly, C., Papachristodoulou, A. In situ characterisation and manipulation of biological systems with Chi.Bio. PLoS Biology. 18 (7), (2020).
- Carrasco-López, C., García-Echauri, S. A., Kichuk, T., Avalos, J. L. Optogenetics and biosensors set the stage for metabolic cybergenetics. Current Opinion in Biotechnology. 65, 296-309 (2020).
- Milias-Argeitis, A., Rullan, M., Aoki, S. K., Buchmann, P., Khammash, M. Automated optogenetic feedback control for precise and robust regulation of gene expression and cell growth. Nature Communications. 7 (1), 1-11 (2016).
- Melendez, J., et al. Real-time optogenetic control of intracellular protein concentration in microbial cell cultures. Integrative Biology: Quantitative Biosciences From Nano to Macro. 6 (3), 366-372 (2014).
- Milias-Argeitis, A., et al. In silico feedback for in vivo regulation of a gene expression circuit. Nature Biotechnology. 29 (12), 1114-1116 (2011).
- Castillo-Hair, S. M., Baerman, E. A., Fujita, M., Igoshin, O. A., Tabor, J. J. Optogenetic control of Bacillus subtilis gene expression. Nature Communications. 10 (1), 1-11 (2019).
- Xia, A., et al. Optogenetic modification of pseudomonas aeruginosa enables controllable twitching motility and host infection. ACS Synthetic Biology. 10 (3), 531-541 (2021).
- Pu, L., Yang, S., Xia, A., Jin, F. Optogenetics manipulation enables prevention of biofilm formation of engineered pseudomonas aeruginosa on surfaces. ACS Synthetic Biology. 7 (1), 200-208 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved