需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于微生物化学和蛋白质生产的光控发酵
摘要
微生物代谢的光遗传学控制为发酵过程提供了灵活的动态控制。这里的实验方案展示了如何建立蓝光调节的发酵,用于不同体积尺度的化学和蛋白质生产。
摘要
微生物细胞工厂为从可再生原料生产化学品和重组蛋白提供了一种可持续的替代方案。然而,通过基因修饰使微生物负担过重会降低宿主的适应性和生产力。这个问题可以通过使用动态控制来克服:酶和途径的诱导表达,通常使用基于化学或营养的添加剂,以平衡细胞生长和生产。光遗传学提供了一种非侵入性,高度可调和可逆的动态调节基因表达的方法。在这里,我们描述了如何建立工程 大肠杆菌 和 酿酒酵母 的光控发酵,以生产化学物质或重组蛋白。我们讨论了如何在选定的时间和剂量下应用光,以分离微生物生长和生产,以改善发酵控制和生产率,以及获得最佳结果的关键优化考虑因素。此外,我们还描述了如何为实验室规模的生物反应器实验实施光控制。这些方案有助于在工程微生物中采用光遗传学控制,以提高发酵性能。
引言
光遗传学是利用光响应蛋白控制生物过程的一种新策略,为动态控制微生物发酵以进行化学和蛋白质生产提供了一种新策略1,2。工程代谢途径的负担以及某些中间体和产品的毒性通常会损害细胞生长3。这种压力会导致生物质积累不良并降低生产力3。这一挑战可以通过将发酵暂时划分为生长和生产阶段来解决,这些阶段将代谢资源分别用于生物质积累或产品合成4。我们最近表明,在这种两相发酵中,从生长到生产的过渡可以通过照明条件的变化来诱导5,6,7。光输入的高可调性、可逆性和正交性8 为光控发酵提供了独特的优势,而这些发酵剂很难或不可能用用于传统两相发酵动态控制的化学诱导剂复制4,9,10,11。
来自乳酸红杆菌的蓝光响应性EL222蛋白已被用于开发几种光遗传学电路,用于酿酒酵母的代谢工程5,7,12,13。EL222包含一个光氧电压传感器(LOV)结构域,该结构域在蓝光激活(465nm)时经历构象位移,使其能够与其同源DNA序列(C120)13结合。将EL222融合到病毒VP16激活结构域(VP16-EL222)可产生蓝光响应转录因子,该转录因子可逆地激活酿酒酵母7和其他生物体14中合成启动子PC120中的基因表达。基于EL222的几个电路已经开发并用于酿酒酵母的化学生产,例如基本的光激活OptoEXP系统7,其中目的基因直接从PC120表达(图1A)。然而,在发酵生产阶段通常遇到的高细胞密度下的光穿透问题促使我们开发在黑暗中诱导的倒置电路,例如OptoINVRT和OptoQ-INVRT电路(图1B)5,7,13。这些系统分别利用酿酒酵母和克拉沙猪笼草的半乳糖(GAL)或奎宁(Q)调节剂,用VP16-EL222控制其相应的抑制因子(GAL80和QS),以抑制光照下的基因表达,并在黑暗中强烈诱导。结合OptoEXP和OptoINVRT电路,可以双向控制基因表达,实现两相发酵,其中生长阶段由蓝光诱导,生产阶段与黑暗(图2A)5,7。
在生产阶段使用光而不是黑暗来诱导基因表达将大大扩展光遗传学控制的能力,但也需要克服在这个发酵阶段通常遇到的高细胞密度的光穿透限制。为此,我们开发了称为OptoAMP和OptoQ-AMP的电路,可以放大对蓝光刺激的转录响应。这些电路分别使用VP16-EL222的野生型或超敏突变体来控制GAL或Q调节子的转录激活剂Gal4p或QF2的产生,从而在光照下实现增强的灵敏度和更强的基因表达12,13(图1C)。OptoAMP电路可以在光密度(在600nm下测量;OD600)值至少为40,仅约0.35%的照度(仅在约7%的体积表面上为5%的光剂量)。与OptoEXP相比,这显示出更高的灵敏度,OptoEXP需要接近100%的照明12。在高细胞密度下用光有效诱导基因表达的能力为发酵的动态控制开辟了新的机会。这包括在两个以上的时间阶段进行发酵,例如三相发酵,其中生长,诱导和生产阶段以独特的轻计划建立,以优化化学生产(图2B)12。

图1:用于动态控制酿酒酵母的光遗传学电路。 OptoEXP、OptoINVRT 和 OptoAMP 电路基于光敏 VP16-EL222 系统。(A)在OptoEXP电路中,暴露于蓝光会导致VP16-EL222的构象变化和二聚化,从而暴露DNA结合结构域并允许从PC120转录。该图由Zhao等人修改为7。(B) OptoINVRT电路利用GAL(如图所示)或Q调节子在黑暗中诱导表达。在基于GAL的电路中,VP16-EL222和GAL4是本构表达的,而PC120驱动GAL80抑制器的表达(在基于Q的电路中,GAL4和GAL80分别被QF2和QS取代,并且使用合成的含QUAS的启动子代替GAL启动子)。在光照下,Gal80p阻止了PGAL1目的基因的激活。在黑暗中,GAL80不被表达,并通过将其融合到一个本构的degron结构域(小的棕色结构域)而迅速降解,这允许Gal4p激活PGAL1。该图由Zhao等人修改为5。(C) 光电放大器电路还使用 VP16-EL222 来控制 GAL(如图所示)或 Q 重稳态。在这些电路中,GAL80抑制器(或QS)被组成表达并融合到光敏的degron(小蓝色域),确保在黑暗中进行严格的抑制。PC120和超敏的VP16-EL222突变体控制表达的GAL4(或QF2)与光,其强烈激活光中的PGAL1(或含QUAS的启动子)。GAL衍生的电路可以使用工程形式的PGAL1,例如PGAL1-M或PGAL1-S,它们具有增加的活性,以及由GAL调节子(PGAL1,PGAL10,PGAL2,PGAL7)控制的野生型启动子。该图由 Zhao 等人修改而来。请点击此处查看此图的放大版本。

图 2:随时间推移的两相和三相发酵。 (A) 采用倒置回路操作的两相发酵包括光驱动的生长阶段和黑暗的生产阶段。在生长阶段,随着生产途径的抑制,生物质会积累。在达到所需的OD 600时,细胞被转移到黑暗中以代谢调整,然后重悬于新鲜培养基中以进行生产阶段。(B)在三阶段过程中,生长,孵化和生产阶段由独特的光照时间表定义,其中可能包括黑暗的生长期,脉冲孵育和完全照明的生产阶段。使用Biorender创建的图。 请点击此处查看此图的放大版本。
还开发了光遗传学电路,用于动态控制大肠杆菌中的化学和蛋白质产生。OptoLAC 电路使用基于 YF1/FixJ 双组分系统6 的光响应 pDawn 电路控制细菌 LacI 抑制器(图 3)。与OptoINVRT5类似,OptoLAC电路旨在抑制光中的基因表达并在黑暗中诱导基因表达。使用 OptoLAC 电路的表达水平可以达到或超过标准异丙基β-d-1-硫代乳糖焦氰胺苷 (IPTG) 诱导达到的水平,从而保持化学诱导的强度,同时提供增强的可调性和可逆性6。因此,OptoLAC电路能够为大肠杆菌的代谢工程提供有效的光遗传学控制。
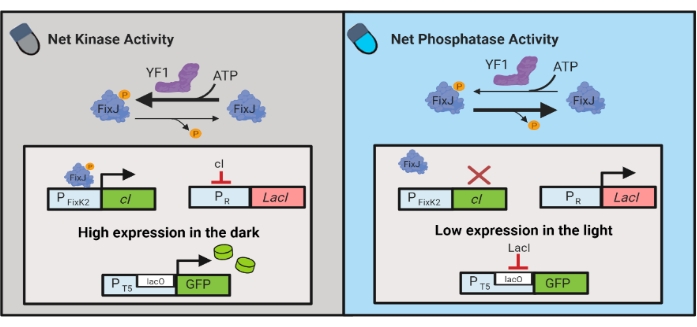
图 3:用于动态控制 大肠杆菌的 OptoLAC 电路。 OptoLAC电路调整pDawn系统和lac操纵子,以实现黑暗中的激活和光照下的抑制。在黑暗中,YF1磷酸化FixJ,然后激活PFixK2 启动子以表达 cI 抑制剂。 cI 抑制因子阻止来自PR启动子的 lacI 抑制因子的表达,PR 启动子允许从含 lacO的启动子转录目的基因。相反,蓝光降低YF1网激酶活性,逆转FixJ磷酸化,从而逆转 cI 表达,从而抑制 lacI 的表达并阻止含 lacO的启动子的表达。该图已从Lalwani等人6修改而来。 请点击此处查看此图的放大版本。
我们在这里描述了 酿酒酵母 和 大肠 杆菌用于化学或蛋白质生产的光控发酵的基本方案。对于酵母和细菌,我们首先关注由 OptoINVRT 和 OptoLAC 电路实现的光驱动生长阶段和黑暗诱导生产阶段的发酵。随后,我们描述了一种由OptoAMP电路实现的三相(生长,诱导,生产)光控发酵的协议。此外,我们还描述了如何将光遗传学控制的发酵从微孔板扩大到实验室规模的生物反应器。通过该协议,我们的目标是为化学或蛋白质生产进行光控发酵提供完整且易于重复的指南。
研究方案
1. 使用 酿酒酵母 光电光IVT7电路进行光控化学生产
- 应变结构
- 获得具有 他的3 auxotrophy的菌株,因为该标记对于大多数现有的OptoINVRT质粒是必需的5。如果寻求 酿酒酵母原生基因的光遗传学调控,请构建一个菌株,其中删除该基因的任何内源性拷贝。
- 对含有 OptoINVRT7 电路(如 EZ-L4395)的质粒进行线性化处理,并使用标准醋酸锂转化方法将其整合到生长营养菌株的 his3 位点15。如果使用EZ-L439质粒,其中包含在光线下抑制PGAL1并在黑暗中激活它的组分,则在PmeI限制位点线性化。
- 转化后,将细胞以150× g 离心1分钟,并轻轻重悬于200μL新鲜组氨酸 - 丢弃合成完全培养基(SC-His)培养基中。
- 将整个细胞体积平板接种到SC-His琼脂平板上,并在30°C下孵育2-3天,直到出现菌落。
- 使用标准醋酸锂转化方案从该菌株中制备感受态细胞,并用含有PGAL1-M或PGAL1-S启动子下游要光遗传学控制的基因的质粒进行转化5。
注:使用在δ位点(YARCdelta5)上整合并与Zeocin一起选择的质粒可实现稳定的多重本整合7,16,17,18。 - 转化后,以150× g 离心培养物1分钟,并轻轻重悬于200μL新鲜SC液滴培养基中。
注意:PGAL1-M启动子是PGAL1 启动子的合成版本,删除了Mig1p抑制位点,而PGAL1-S 是PGAL1-M的工程版本,具有额外的Gal4p激活剂结合位点。正则PGAL1 启动子可用于控制表达;但是,表达强度将低于这些工程启动子。 - 如果整合到δ位点,则将整个细胞体积接种在酵母提取物蛋白胨葡萄糖(YPD)琼脂平板上,或者如果与含有选择标记物的质粒转化,则将SC-dropout平板。在恒定的蓝光下在30°C下孵育16小时,以保持光遗传学控制的基因被抑制。
注意:对于某些菌株,当在蓝光脉冲中孵育时(例如,1 s on/79 s 关闭,5 s on/75 s 关闭,10 s on/70 s 关闭等)而不是在恒定照明下,如果需要,必须通过实验确定每个菌株的菌落,从而生长得更快。 - 使用任何465nm光源,并将LED面板放置在板上方〜40厘米处,使光强度约为80-110μmol/ m2 / s。使用量子计测量强度(见 材料表)。
- 如果整合到δ位点,则在YPD板上创建板的复制品,其中包含400μg/ mL至1,200μg/ mL之间的玉米蛋白浓度范围,以选择各种整合拷贝数5,7,12,16,17,18。将复制板在恒定或脉冲蓝光下在30°C下孵育2-3天,直到菌落出现。
- 初步筛选最佳菌落
- 从每个板中选择八个菌落,并用它们在24孔板的单个孔中接种1mL补充有2%葡萄糖的SC-His培养基。在30°C下在细胞下的24孔板中生长过夜(16-20小时),在恒定的蓝光照射下以200rpm(19mm轨道直径)振荡。
- 第二天早上,将每个培养物稀释在1mL新鲜SC-His培养基中,其2%葡萄糖至OD 600 值范围为0.01-0.3,并在30°C的恒定或脉冲光下在24孔板中生长,振荡200rpm,直到它们达到2至9 OD600 值之间的细胞密度(图4A)。该生长阶段所需的时间将取决于菌株。
- 在30°C下将板在黑暗中孵育4小时,通过关闭灯板并用铝箔包裹板来振荡200rpm。
注意:该步骤允许细胞代谢过渡到生产阶段,然后再在生产培养基中重悬。 - 为了开始生产阶段,将培养物在24孔板中以234× g 离心5分钟,并将细胞重悬于1mL具有2%葡萄糖的新鲜SC液滴培养基中。通过使用无菌微孔板密封胶带密封板以防止所需产品的蒸发。
- 在30°C下在黑暗中发酵密封板48小时,并以200rpm振荡。确保板材用铝箔包裹,以防止暴露在光线下。
注意:用铝箔包裹板不会限制发酵过程中的氧气或气体可用性;但是,无菌密封胶带确实限制了气体转移。如有必要,可以在胶带上戳小孔以引入氧气。
- 收获和分析
- 为了收获发酵,将板在234× g 下离心5分钟,并将800μL上清液转移到1.5mL微量离心管中。
- 根据感兴趣的化学品,使用高效液相色谱(HPLC),气相色谱 - 质谱法(GC-MS)或使用最适合所用仪器的样品制备技术的其他分析方法进行分析。
2. 使用大肠杆菌OptoLAC系统进行光控蛋白质生产
- 应变结构
- 将电功能性 BL21 DE3 ΔlacI ΔlacI-DE3 与含有 OptoLAC1B 或 OptoLAC2B 电路6 的质粒以及表达 PT7 启动子中目标重组蛋白的质粒共转化19。
- 转化后,在37°C下用分解代谢物抑制(SOC;2%色蛋白酮,0.5%酵母提取物,10mM NaCl,2.5mM KCl,10mM MgCl2,10mM MgSO4,20mM葡萄糖)在1mL超优肉汤中回收细胞1小时,旋转或摇动。
注意:含有目的蛋白的质粒必须与OptoLAC质粒(即不同的抗性标记和复制来源)相容,并且不得包含 lacI的拷贝。 - 将细胞以4845× g 离心3分钟,并将沉淀浓缩在200μL溶菌汤(LB)培养基中。将整个浓缩细胞接种到具有适当抗生素的LB琼脂平板上,并在恒定的蓝光下在37°C下生长过夜,以保持抑制蛋白质表达。
- 初始筛查以验证表达
- 取三个单菌落,并用它们在24孔板的单个孔中接种1mL含有适当抗生素的LB培养基。在37°C下生长过夜(16-20小时),在恒定的蓝光照射下振荡200rpm(图4A)。
- 第二天,使用1.5μL培养物在具有微量测量的分光光度计中测量OD 600 。将培养物稀释至24孔板中的1 mL新鲜LB至OD 600 值,范围为0.01-0.1。
- 在37°C下以200rpm在蓝光下振荡2-3小时培养物。从第二个小时开始,每15分钟进行OD 600 测量,以确保培养物不会过度生长OD 600 范围0.1-1.5。
- 一旦培养物达到所需的OD 600,关闭灯板并用铝箔包裹板以启动生产阶段。将板保持在黑暗中8小时(37°C),20小时(30°C)或48小时(18°C),振荡200 rpm。
- 测量并记录每个区域性的最终 OD600 值。
- 收获和分析
- 将800μL每种培养物转移到1.5mL微量离心管中,并在17,000× g下离心5分钟。
- 将细胞沉淀重悬于200μL重悬缓冲液(Tris 50mM,pH 8.0,NaCl 300mM)中。
注意:NaCl的浓度可以根据所分析的重组蛋白进行调整。 - 加入50μL6x十二烷基硫酸钠(SDS)样品缓冲液(Tris 375mM,pH 6.8,SDS 9%,甘油50%,溴酚蓝0.03%,DTT 9%)。在100°C下孵育10分钟,在热混合器中以700rpm振荡。
- 在12%SDS-PAGE凝胶中上样〜3-20μL培养物。使用最终的OD600 测量作为指导,为每个样品上样大约相同量的蛋白质(相当于10μL样品对应于最终OD 600 值1)。使用电源在100 V下进行电泳,直到凝胶完全分辨。
- 用考马斯亮蓝色G-250溶液染色凝胶,方法是在微波炉中加热30-40秒,然后在平台旋转器上孵育至少15分钟。
- 用去离子水冲洗两次,并在平台旋转器上脱色至少30分钟(或过夜),加入两块打结的清洁湿巾以帮助吸收污渍。将凝胶在微波炉中在足够量的水中煮沸15分钟,以加快脱色过程。
3. 使用酿酒酵母光电AMP系统进行三相发酵
- 应变结构
- 获得具有 his3 辅助营养标记物的菌株,因为该标记对于使用现有的 OptoAMP 质粒是必需的5。如果寻求 酿酒酵母原生基因的光遗传学调控,请构建一个菌株,其中该基因的内源性拷贝被删除。
- 对含有 OptoAMP4 电路的质粒(如 EZ-L58012)进行线性化处理,并使用标准醋酸锂转化方法将其整合到生长营养菌株的 his3 位点中15。如果使用EZ-L580,在PmeI限制位点线性化质粒。
- 转化后,将细胞以150× g 离心1分钟,并轻轻重悬于200μL新鲜SC-His培养基中。
- 将整个细胞体积接种在选择性培养基(SC-His-琼脂)上,并在30°C下孵育2-3天,直到出现菌落。
- 从该菌株中制备感受态细胞,并用含有PGAL1-S 启动子下游要光遗传学控制的基因的质粒转化它们12。
注意:使用在δ位点整合并与Zeocin一起选择的质粒可实现稳定的多重本整合和选择。 - 转化后,以150× g 离心培养物1分钟,并轻轻重悬于200μL新鲜SC液滴培养基中。
注意:PGAL1-S 启动子是PGAL1启动子的合成版本,其中Mig1p抑制位点被删除并添加额外的Gal4p激活剂结合位点。可以使用常规的PGAL1 启动子;但是,表达强度将低于此工程启动子。 - 将整个细胞体积接种在YPD或SC液态琼脂板上,并在黑暗中在30°C下孵育16小时(用铝箔包裹)。在黑暗中孵育可以抑制光遗传学控制的基因,这使得细胞能够将其代谢资源引导到细胞生长而不是化学生产上。
- 如果整合到δ位点,则将复制板复制到含有一系列Zeocin浓度的YPD板上,以选择各种整合拷贝数。将板在30°C的黑暗中孵育(用铝箔包裹)2-3天,直到出现菌落。
- 初步筛选最佳菌落
- 从每个板中选择8个菌落,并用它们在24孔板的单个孔中接种1mL含有2%葡萄糖的SC-His培养基。在30°C的黑暗中用200rpm振荡将细胞培养过夜(16-20小时)。
- 第二天早上,将每种培养物稀释在1mL新鲜SC-His培养基中,加入2%葡萄糖至0.1 OD 600 ,并在30°C的黑暗中生长,200rpm振荡,直到它们达到OD600 的3。用铝箔包裹板材,以防止暴露在光线下。该生长阶段所需的时间将取决于菌株。
- 要开始感应阶段,请在脉冲光(例如,5 s on / 95 s off)下在30°C下以200rpm振荡12小时孵育板。使用任何465nm光源,并在板上方放置一个LED面板,使光强度约为80-110μmol/ m2 / s,以获得最佳效果(图4A)。
注意:该孵育的最佳光脉冲持续时间将根据产生的化学物质而有所不同。建议筛选一系列照明计划,范围从 0.1%(例如,1 秒对 999 秒关闭)到 100%(全光)。 - 为了开始生产阶段,将培养物以234× g 离心5分钟,然后重悬于含有2%葡萄糖的新鲜SC-His培养基中。使用无菌微孔板密封胶带密封板以防止所需产品的蒸发。
- 在30°C下在光照下发酵密封板48小时,并以200rpm振荡。在此步骤中优化照明计划,因为某些化学品受益于脉冲生产阶段而不是全光。
- 收获和分析
- 通过将板在234× g 下离心5分钟并将800μL上清液转移到1.5mL微量离心管中来收获发酵物。
- 根据感兴趣的化学品,使用HPLC,GC-MS或其他分析方法进行分析,使用最适合所用仪器的样品制备技术进行分析。
4. 在光控生物反应器中从大肠杆菌生产化学(甲羟戊酸盐)
- 初始接种和生物反应器设置
- 将采用光控化学生产的大肠杆菌菌株菌落接种到5 mL M9极低盐(3.37 mM Na2HPO4,2.2 mM KH2PO4,0.855 mM NaCl,0.935 mM NH4Cl)中,并补充0.2%w / v卡萨米氨基酸,5%w / v葡萄糖和微量金属混合物20(0.0084 g / L EDTA, 在 50 mL 锥形管中,0.0025 克/升 CoCl2、0.015 克/升氯化铜 2、0.0015 克/升铜Cl2、0.003 克/升 H3BO3、0.0025 克/升 Na2MoO4、0.008 克/升锌Cl2、0.06 克/升铁(III)柠檬酸盐、0.0045 克/升硫胺素、1.3 克/升 MgSO4)。
- 在30°C下以200rpm在蓝光照射下振荡培养过夜。
- 设置生物反应器容器头板,确保安装以下端口:用于热探头的插入;溶解氧(DO)探头;气体分布器 - 通过0.2μm过滤器连接到空气源;叶轮;气体冷凝器 - 连接到0.2μm过滤器;冷却管路 (x2);进料管路 (x2) - 一个用于添加培养基,一个用于 pH 控制;采样线 - 确保它到达容器的底部;空端口;pH电极 - 在安装前用pH = 4和pH = 7的标准品校准探头,用容器的其余部分高压灭菌或用95%乙醇灭菌并在设置前无菌插入。
- 用1升过滤水填充容器,并连接头板并拧紧,确保O形圈紧贴并密封。
- 用铝箔覆盖反应器中的任何开口。
- 准备三条管:一条用于除去水,一条用于插入进料,一条用于pH控制。用铝箔盖住两端,并将所有管子包裹在铝箔中。
注意:用于pH调节的NH4OH在硅胶管中流动不顺畅,这可能导致流速不准确和培养物过碱化。为避免此问题,请使用生物相容性泵管 (BPT) 进行 NH4OH 进料。 - 高压灭菌生物反应器和管道,使用30分钟的液体循环。
- 从高压灭菌器中取出材料。一旦冷却到足以处理,请将叶轮、pH 和 DO 探头、空气源、冷凝器入口和出口以及冷却入口和出口连接到控制站。
- 插入热探头并用加热护套盖住容器。将护套固定在容器顶部,以避免在光照下阻挡培养物。
- 将其中一个无菌管连接到采样管路,并通过采样泵固定。将另一端放置,使其流入可以容纳至少1升的空容器中。
- 将另一根无菌管连接到其中一条进料管路,并通过其中一个进料泵固定。将管的另一端连接到一瓶M9介质。将介质送入反应器。
- 将另一根无菌管连接到其中一条进料管路,并通过其中一个进料泵固定。将管的另一端连接到含有28%-30%NH4OH的瓶子。
注意:NH4OH具有腐蚀性。在转移到进料瓶时在通风橱中工作,并确保将进料瓶置于二级密封中。 - 将三个光板放置在距离反应器约20厘米的三角形地层中,检查容器表面的光强度是否从每侧达到〜80-110μmol/ m2 / s(图4B)。
- 第二天,打开生物反应器系统和冷却器。将反应器温度设定值设置为37°C,pH设定值设置为7.0,搅拌至200 rpm。应打开加热夹克。
- 校准溶氧探头,首先等待温度和溶氧测量值恒定(这将是100%设定值)。然后,断开探头与系统的连接(这将是 0% 设定值)。重复上述步骤,直到连接探头时DO测量稳定在100%,然后将DO设定值设置为20%。
- 光控化工生产
- 将生物反应器接种至初始OD 600 为0.001-0.1。打开灯板以启动生长。
- 3小时后,开始从采样线中取样进行OD600 测量,以避免过度生长诱导的最佳细胞密度(ρs)。一旦达到最佳ρs (甲基戊酸盐生产的最佳值为0.17),关闭灯板,用铝箔覆盖反应器,并用黑布包裹装置以启动黑暗生产阶段。
- 加入50μL消泡剂,切换到黑暗后8小时。拧下空口,将消泡剂直接移入反应器中。
- 使用采样口定期采集样品以进行 HPLC 或 GC 分析。
- 反汇编和分析
- 实验结束后,关闭系统。小心地拧下DO和pH电极,并用肥皂和水清洗。拧下头板,用肥皂和水刷洗。
- 将培养物转移到空容器中,并加入漂白剂至10%v / v的终浓度。放入通风橱中,30分钟后处理。
- 用刷子用肥皂和水清洗反应釜。
- 根据感兴趣的产品准备样品进行分析。对于甲羟戊酸盐的产生,将560μL培养物与140μL0.5M HCl混合,高速涡旋1分钟。这将甲羟戊酸转化为(±)-甲羟戊酸内酯。
注意:HCl 对健康有害。使用适当的PPE处理,并确保在涡旋前正确封盖样品管。 - 在4°C下以17,000× g 离心45分钟。 将250μL上清液转移到HPLC小瓶中。
- 对于甲羟戊酸盐,使用有机酸离子交换柱分析样品。使用折射率检测器(RID)量化产量,将峰面积与(±)甲羟戊内酯的标准进行比较。
结果
微生物代谢的光遗传学调节已成功实施,以生产多种产品,包括生物燃料,散装化学品,蛋白质和天然产物5,6,7,12,13。这些过程中的大多数都是为了在光照下进行细胞生长而设计的(当低细胞密度对光穿透的挑战最小时),以及一旦细胞生长,黑暗就会诱导生产。使用?...
讨论
长期以来,动态控制一直被应用于提高代谢工程和重组蛋白生产的产量4。酶表达的转变通常使用化学诱导剂(如IPTG21,半乳糖22和四环素23)来实现,但也使用温度和pH等工艺条件介导。基因表达的光遗传学控制消除了改变发酵参数或培养基组成的需要,使其成为传统诱导策略的易于应用的替代方案。打开或关闭灯光的容易程...
披露声明
作者为本文所述的光遗传学电路和方法申请了多项专利。
致谢
这项研究得到了美国能源部,科学办公室,生物和环境研究办公室奖编号DE-SC0019363,NSF CAREER奖CBET-1751840,皮尤慈善信托基金和Camille Dreyfus教师学者奖的支持。
材料
| Name | Company | Catalog Number | Comments |
| Light-controlled chemical production using S. cerevisiae | |||
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Agar powder | Thermo Fisher Scientific | 303991049 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| EZ-L439 OptoINVRT7 Plasmid | N/A | N/A | See Reference 1 |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| PmeI | New England Biolabs | R0560L | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| Replica-plating device | Thomas Scientific | F37848-0000 | |
| Replica-plating pads | Sunrise Science Products | 3005-012 | |
| SC-His powder | Sunrise Science Products | 1303-030 | |
| SC Complete powder | Sunrise Science Products | 1459-100 | |
| Sterile sealing film | Excel Scientific | STR-SEAL-PLT | |
| YPD agar plates | VWR | 100217-054 | |
| Zeocin | Thermo Fisher Scientific | R25005 | |
| Light-controlled protein production using E. coli | |||
| 6X SDS Sample Buffer | Cepham Life Sciences | 10502 | |
| 12% Acrylamide protein gels | Thermo Fisher Scientific | NP0341BOX | |
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| Coomassie Brilliant Blue G-250 | Thermo Fisher Scientific | 20279 | |
| Electrophoresis cell | Bio-Rad | 1658004 | |
| Electrophoresis power supply | Bio-Rad | 1645050 | |
| LB broth (Miller) | Fisher Scientific | BP97235 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NaCl | Thomas Scientific | SX0425-1 | |
| OptoLAC plasmids | N/A | N/A | See Reference 2 |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SOC medium | Thermo Fisher Scientific | 15544034 | |
| Thermomixer | Eppendorf | 5382000015 | |
| Tris base | Fisher Scientific | BP1521 | |
| Three-phase fermentation using S. cerevisiae | |||
| Same materials as "Light-controlled chemical production using S. cerevisiae" protocol plus the following: | |||
| EZ-L580 OptoAMP4 Plasmid | N/A | N/A | See Reference 10 |
| Chemical production in a light-controlled bioreactor | |||
| Aluminum foil | Reynolds | B004NG90YO | |
| Antifoam | Sigma-Aldrich | A8311 | |
| Bioreactor with control station | Eppendorf | B120110001 | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Bleach | VWR Scientific | 89501-620 (CS) | |
| Blue LED panel | HQRP | 884667106091218 | |
| BPT tubing | Fisher Scientific | 14-170-15 | |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Hydrochloric acid (HCl) | Fisher Scientific | 7647-01-0 | |
| M9 Minimal Salts | Thermo Fisher Scientific | A1374401 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NH4OH Solution | Sigma-Aldrich | I0503-1VL | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SC Complete powder | Sunrise Science Products | 1459-100 |
参考文献
- Figueroa, D., Rojas, V., Romero, A., Larrondo, L. F., Salinas, F. The rise and shine of yeast optogenetics. Yeast. 38 (2), 131-146 (2021).
- Pouzet, S., et al. The promise of optogenetics for bioproduction: Dynamic control strategies and scale-up instruments. Bioengineering. 7 (4), 151 (2020).
- Venayak, N., Anesiadis, N., Cluett, W. R., Mahadevan, R. Engineering metabolism through dynamic control. Current Opinion in Biotechnology. 34, 142-152 (2015).
- Lalwani, M. A., Zhao, E. M., Avalos, J. L. Current and future modalities of dynamic control in metabolic engineering. Current Opinion in Biotechnology. 52, 56-65 (2018).
- Zhao, E. M., et al. Design and characterization of rapid optogenetic circuits for dynamic control in yeast metabolic engineering. ACS Synthetic Biology. 9 (12), 3254-3266 (2020).
- Lalwani, M. A., et al. Optogenetic control of the lac operon for bacterial chemical and protein production. Nature Chemical Biology. 17 (1), 71-79 (2021).
- Zhao, E. M., et al. Optogenetic regulation of engineered cellular metabolism for microbial chemical production. Nature. 555 (7698), 683-687 (2018).
- Baumschlager, A., Khammash, M. Synthetic biological approaches for optogenetics and tools for transcriptional light-control in bacteria. Advanced Biology. 5 (5), 2000256 (2021).
- Dvorak, P., et al. Exacerbation of substrate toxicity by IPTG in Escherichia coli BL21(DE3) carrying a synthetic metabolic pathway. Microbial Cell Factories. 14, 201 (2015).
- Hartline, C. J., Schmitz, A. C., Han, Y., Zhang, F. Dynamic control in metabolic engineering: Theories, tools, and applications. Metabolic Engineering. 63, 126-140 (2021).
- Ni, C., Dinh, C. V., Prather, K. L. J. Dynamic control of metabolism. Annual Review of Chemical and Biomolecular Engineering. 12, 519-560 (2021).
- Zhao, E. M., et al. Optogenetic amplification circuits for light-induced metabolic control. ACS Synthetic Biology. 10 (5), 1143-1154 (2021).
- Lalwani, M. A., Zhao, E. M., Wegner, S. A., Avalos, J. L. The Neurospora crassa Inducible Q System Enables Simultaneous Optogenetic Amplification and Inversion in Saccharomyces cerevisiae for Bidirectional Control of Gene Expression. ACS Synthetic Biology. 10 (8), 2060-2075 (2021).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Marx, H., Mecklenbräuker, A., Gasser, B., Sauer, M., Mattanovich, D. Directed gene copy number amplification in Pichia pastoris by vector integration into the ribosomal DNA locus. FEMS Yeast Research. 9 (8), 1260-1270 (2009).
- Nordén, K., et al. Increasing gene dosage greatly enhances recombinant expression of aquaporins in Pichia pastoris. BMC Biotechnology. 11, 47 (2011).
- Zhao, E. M., et al. Light-based control of metabolic flux through assembly of synthetic organelles. Nature Chemical Biology. 15 (6), 589-597 (2019).
- Dowee, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- Zhou, K., Edgar, S., Stephanopoulos, G. Engineering microbes to synthesize plant isoprenoids. Methods in Enzymology. 575, 225-245 (2016).
- Arfman, N., Worrell, V., Ingram, L. O. Use of the tac promoter and lacI(q) for the controlled expression of Zymomonas mobilis fermentative genes in Escherichia coli and Zymomonas mobilis. Journal of Bacteriology. 174 (22), 7370-7378 (1992).
- Steen, E. J., et al. Metabolic engineering of Saccharomyces cerevisiae for the production of n-butanol. Microbial Cell Factories. 7 (1), 1-8 (2008).
- Tan, S. Z., Manchester, S., Prather, K. L. J. Controlling central carbon metabolism for improved pathway yields in Saccharomyces cerevisiae. ACS Synthetic Biology. 5 (2), 116-124 (2015).
- Jayaraman, P., et al. Blue light-mediated transcriptional activation and repression of gene expression in bacteria. Nucleic Acids Research. 44 (14), 6994 (2016).
- Fernandez-Rodriguez, J., Moser, F., Song, M., Voigt, C. A. Engineering RGB color vision into Escherichia coli. Nature Chemical Biology. 13 (7), 706-708 (2017).
- Ding, Q., et al. Light-powered Escherichia coli cell division for chemical production. Nature Communications. 11 (1), 1-14 (2020).
- Senoo, S., Tandar, S. T., Kitamura, S., Toya, Y., Shimizu, H. Light-inducible flux control of triosephosphate isomerase on glycolysis in Escherichia coli. Biotechnology and Bioengineering. 116 (12), 3292-3300 (2019).
- Ramakrishnan, P., Tabor, J. J. Repurposing synechocystis PCC6803 UirS-UirR as a UV-violet/green photoreversible transcriptional regulatory tool in E. Coli. ACS Synthetic Biology. 5 (7), 733-740 (2016).
- Tabor, J. J., Levskaya, A., Voigt, C. A. Multichromatic control of gene expression in escherichia coli. Journal of Molecular Biology. 405 (2), 315-324 (2011).
- Stewart, C. J., McClean, M. N. Design and implementation of an automated illuminating, culturing, and sampling system for microbial optogenetic applications. Journal of Visualized Experiments:JoVE. (120), e54894 (2017).
- Grødem, E. O. S., Sweeney, K., McClean, M. N. Automated calibration of optoPlate LEDs to reduce light dose variation in optogenetic experiments. BioTechniques. 69 (4), 313-316 (2020).
- Gerhardt, K. P., et al. An open-hardware platform for optogenetics and photobiology. Scientific Reports. 6, (2016).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Steel, H., Habgood, R., Kelly, C., Papachristodoulou, A. In situ characterisation and manipulation of biological systems with Chi.Bio. PLoS Biology. 18 (7), (2020).
- Carrasco-López, C., García-Echauri, S. A., Kichuk, T., Avalos, J. L. Optogenetics and biosensors set the stage for metabolic cybergenetics. Current Opinion in Biotechnology. 65, 296-309 (2020).
- Milias-Argeitis, A., Rullan, M., Aoki, S. K., Buchmann, P., Khammash, M. Automated optogenetic feedback control for precise and robust regulation of gene expression and cell growth. Nature Communications. 7 (1), 1-11 (2016).
- Melendez, J., et al. Real-time optogenetic control of intracellular protein concentration in microbial cell cultures. Integrative Biology: Quantitative Biosciences From Nano to Macro. 6 (3), 366-372 (2014).
- Milias-Argeitis, A., et al. In silico feedback for in vivo regulation of a gene expression circuit. Nature Biotechnology. 29 (12), 1114-1116 (2011).
- Castillo-Hair, S. M., Baerman, E. A., Fujita, M., Igoshin, O. A., Tabor, J. J. Optogenetic control of Bacillus subtilis gene expression. Nature Communications. 10 (1), 1-11 (2019).
- Xia, A., et al. Optogenetic modification of pseudomonas aeruginosa enables controllable twitching motility and host infection. ACS Synthetic Biology. 10 (3), 531-541 (2021).
- Pu, L., Yang, S., Xia, A., Jin, F. Optogenetics manipulation enables prevention of biofilm formation of engineered pseudomonas aeruginosa on surfaces. ACS Synthetic Biology. 7 (1), 200-208 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。