Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Fermentaciones controladas por la luz para la producción química microbiana y de proteínas
* Estos autores han contribuido por igual
En este artículo
Resumen
El control optogenético del metabolismo microbiano ofrece un control dinámico flexible sobre los procesos de fermentación. El protocolo aquí muestra cómo configurar fermentaciones reguladas por luz azul para la producción química y de proteínas a diferentes escalas volumétricas.
Resumen
Las fábricas de células microbianas ofrecen una alternativa sostenible para producir productos químicos y proteínas recombinantes a partir de materias primas renovables. Sin embargo, sobrecargar un microorganismo con modificaciones genéticas puede reducir la aptitud y la productividad del huésped. Este problema se puede superar mediante el uso de control dinámico: expresión inducible de enzimas y vías, típicamente utilizando aditivos químicos o a base de nutrientes, para equilibrar el crecimiento y la producción celular. Optogenetics ofrece un método no invasivo, altamente ajustable y reversible para regular dinámicamente la expresión génica. Aquí, describimos cómo configurar fermentaciones controladas por la luz de Escherichia coli y Saccharomyces cerevisiae modificadas para la producción de productos químicos o proteínas recombinantes. Discutimos cómo aplicar luz en momentos y dosis seleccionados para desacoplar el crecimiento microbiano y la producción para mejorar el control de la fermentación y la productividad, así como las consideraciones clave de optimización para obtener los mejores resultados. Además, describimos cómo implementar controles de luz para experimentos de biorreactores a escala de laboratorio. Estos protocolos facilitan la adopción de controles optogenéticos en microorganismos diseñados para mejorar el rendimiento de la fermentación.
Introducción
La optogenética, el control de procesos biológicos con proteínas sensibles a la luz, ofrece una nueva estrategia para controlar dinámicamente las fermentaciones microbianas para la producción química y proteica1,2. La carga de las vías metabólicas modificadas y la toxicidad de algunos productos intermedios y productos a menudo perjudican el crecimiento celular3. Tales tensiones pueden conducir a una acumulación deficiente de biomasa y a una reducción de la productividad3. Este desafío puede abordarse dividiendo temporalmente las fermentaciones en una fase de crecimiento y producción, que dedican recursos metabólicos a la acumulación de biomasa o a la síntesis de productos, respectivamente4. Recientemente demostramos que la transición del crecimiento a la producción en esta fermentación bifásica puede ser inducida con cambios en las condiciones de iluminación5,6,7. La alta capacidad de ajuste, reversibilidad y ortogonalidad de las entradas de luz8 ofrece ventajas únicas a las fermentaciones controladas por la luz que son difíciles o imposibles de replicar con inductores químicos utilizados en el control dinámico de fermentaciones bifásicas convencionales4,9,10,11.
La proteína EL222 sensible a la luz azul derivada de Erythrobacter litoralis se ha utilizado para desarrollar varios circuitos optogenéticos para la ingeniería metabólica en Saccharomyces cerevisiae5,7,12,13. EL222 contiene un dominio sensor de voltaje de luz-oxígeno (LOV) que sufre un cambio conformacional tras la activación de la luz azul (465 nm), lo que le permite unirse a su secuencia de ADN cognado (C120)13. La fusión de EL222 al dominio de activación viral VP16 (VP16-EL222) da como resultado un factor de transcripción sensible a la luz azul que puede activar reversiblemente la expresión génica en S. cerevisiae7 y otros organismos14 a partir del promotor sintético PC120. Varios circuitos basados en EL222 han sido desarrollados y utilizados para la producción química en S. cerevisiae, como el sistema básico OptoEXP activado por luz7, en el que el gen de interés se expresa directamente desde PC120 (Figura 1A). Sin embargo, las preocupaciones de penetración de la luz en las altas densidades celulares típicamente encontradas en la fase de producción de las fermentaciones nos motivaron a desarrollar circuitos invertidos que se inducen en la oscuridad, como los circuitos OptoINVRT y OptoQ-INVRT (Figura 1B)5,7,13. Estos sistemas aprovechan los reguleones de galactosa (GAL) o ácido quínico (Q) de S. cerevisiae y N. crassa, respectivamente, controlando sus correspondientes represores (GAL80 y QS) con VP16-EL222, para reprimir la expresión génica a la luz e inducirla fuertemente en la oscuridad. La combinación de los circuitos OptoEXP y OptoINVRT da como resultado un control bidireccional de la expresión génica, permitiendo fermentaciones bifásicas en las que la fase de crecimiento se induce con luz azul y la fase de producción con oscuridad (Figura 2A)5,7.
El uso de la luz en lugar de la oscuridad para inducir la expresión génica durante la fase de producción ampliaría en gran medida las capacidades de los controles optogenéticos, pero también requeriría superar las limitaciones de penetración de la luz de las altas densidades celulares que se encuentran típicamente en esta fase de fermentación. Para ello, hemos desarrollado circuitos, conocidos como OptoAMP y OptoQ-AMP, que amplifican la respuesta transcripcional a la estimulación de la luz azul. Estos circuitos utilizan mutantes de tipo salvaje o hipersensibles de VP16-EL222 para controlar la producción de los activadores transcripcionales Gal4p o QF2 de los reguleones GAL o Q, respectivamente, logrando una mayor sensibilidad y una expresión génica más fuerte con luz12,13 (Figura 1C). Los circuitos OptoAMP pueden lograr una inducción de luz completa y homogénea en biorreactores de 5 L a una densidad óptica (medida a 600 nm; OD600) valores de al menos 40 con solo ~ 0.35% de iluminación (dosis de luz del 5% en solo ~ 7% de la superficie a granel). Esto demuestra un mayor grado de sensibilidad en comparación con OptoEXP, que requiere cerca del 100% de iluminación12. La capacidad de inducir eficazmente la expresión génica con luz a altas densidades celulares abre nuevas oportunidades para el control dinámico de las fermentaciones. Esto incluye fermentaciones operativas en más de dos fases temporales, como las fermentaciones trifásicas, en las que se establecen fases de crecimiento, inducción y producción con programas de luz únicos para optimizar la producción química (Figura 2B)12.

Figura 1: Circuitos optogenéticos para el control dinámico de S. cerevisiae. Los circuitos OptoEXP, OptoINVRT y OptoAMP se basan en el sistema VP16-EL222 sensible a la luz. (A) En el circuito OptoEXP, la exposición a la luz azul causa un cambio conformacional y dimerización de VP16-EL222, que expone un dominio de unión al ADN y permite la transcripción desde PC120. La cifra ha sido modificada a partir de Zhao et al.7. (B) Los circuitos OptoINVRT aprovechan los regulones GAL (mostrados) o Q para inducir la expresión en la oscuridad. En los circuitos basados en GAL, VP16-EL222 y GAL4 se expresan constitutivamente, mientras que PC120 impulsa la expresión del represor GAL80 (en los circuitos basados en Q, GAL4 y GAL80 se reemplazan por QF2 y QS, respectivamente, y se utiliza un promotor sintético que contiene QUAS en lugar de un promotor GAL). A la luz, Gal80p previene la activación del gen de interés de PGAL1. En la oscuridad, GAL80 no se expresa y se degrada rápidamente fusionándolo a un dominio degron constitutivo (pequeño dominio marrón), que permite la activación de PGAL1 por Gal4p. La cifra ha sido modificada a partir de Zhao et al.5. (C) Los circuitos OptoAMP también utilizan VP16-EL222 para controlar los reguleones GAL (mostrados) o Q. En estos circuitos, el represor GAL80 (o QS) se expresa constitutivamente y se fusiona con un degron fotosensible (pequeño dominio azul) que garantiza una represión estricta en la oscuridad. PC120 y una expresión de control mutante hipersensible VP16-EL222 de GAL4 (o QF2) con luz, que activa fuertemente PGAL1 (o un promotor que contiene QUAS) en la luz. Los circuitos derivados de GAL pueden utilizar formas de ingeniería de PGAL1, como PGAL1-M o PGAL1-S, que tienen una mayor actividad, así como promotores de tipo salvaje controlados por el regulón GAL (PGAL1, PGAL10, PGAL2, PGAL7). La figura ha sido modificada de Zhao et al.12. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Fermentaciones bifásicas y trifásicas a través del tiempo. (A) Las fermentaciones bifásicas operadas con circuitos invertidos consisten en una fase de crecimiento impulsada por la luz y una fase de producción oscura. En la fase de crecimiento, la biomasa se acumula a medida que la vía de producción permanece reprimida. Al alcanzar el OD600 deseado, las células se desplazan a la oscuridad para ajustarse metabólicamente antes de ser resuspendidas en medios frescos para la fase de producción. (B) En un proceso de tres fases, las fases de crecimiento, incubación y producción están definidas por programas de luz únicos, que pueden consistir en un período de crecimiento oscuro, incubación pulsada y fase de producción completamente iluminada. Figura creada con Biorender. Haga clic aquí para ver una versión más grande de esta figura.
También se han desarrollado circuitos optogenéticos para el control dinámico de la producción química y proteica en E. coli. Los circuitos OptoLAC controlan el represor bacteriano LacI utilizando el circuito pDawn sensible a la luz, que se basa en el sistema de dos componentes YF1/FixJ6 (Figura 3). Al igual que OptoINVRT5, los circuitos OptoLAC están diseñados para reprimir la expresión génica en la luz e inducirla en la oscuridad. Los niveles de expresión que utilizan circuitos OptoLAC pueden igualar o superar los alcanzados con la inducción estándar de isopropilo β-d-1-tiogalactopiranósido (IPTG), manteniendo así la fuerza de la inducción química al tiempo que ofrece una mayor capacidad de ajuste y reversibilidad6. Por lo tanto, los circuitos OptoLAC permiten un control optogenético efectivo para la ingeniería metabólica en E. coli.
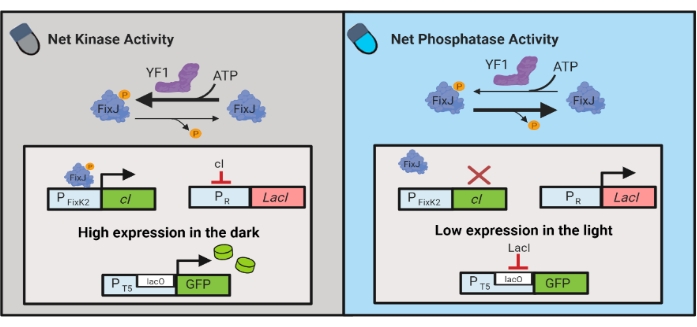
Figura 3: Circuitos OptoLAC para el control dinámico de E. coli. Los circuitos OptoLAC adaptan el sistema pDawn y el operón lac para lograr la activación en la oscuridad y la represión en la luz. En la oscuridad, YF1 fosforila FixJ, que luego activa el promotor PFixK2 para expresar el represor cI . El represor cI impide la expresión del represor lacI del promotor PR , lo que permite la transcripción del gen de interés a partir de un promotor que contiene lacO. Por el contrario, la luz azul reduce la actividad de la quinasa neta YF1, revirtiendo la fosforilación de FixJ y, por lo tanto, la expresión de cI , lo que desreprime la expresión de lacI e impide la expresión del promotor que contiene lacO. La figura ha sido modificada a partir de Lalwani et al.6. Haga clic aquí para ver una versión más grande de esta figura.
Describimos aquí los protocolos básicos para fermentaciones controladas por la luz de S. cerevisiae y E. coli para la producción química o proteica. Tanto para levaduras como para bacterias, primero nos centramos en fermentaciones con una fase de crecimiento impulsada por la luz y una fase de producción inducida por la oscuridad habilitada por los circuitos OptoINVRT y OptoLAC. Posteriormente, describimos un protocolo para una fermentación trifásica (crecimiento, inducción, producción) controlada por la luz habilitada por los circuitos OptoAMP. Además, describimos cómo escalar fermentaciones controladas optogenéticamente desde microplacas hasta biorreactores a escala de laboratorio. Con este protocolo, nuestro objetivo es proporcionar una guía completa y fácilmente reproducible para la realización de fermentaciones controladas por la luz para la producción química o proteica.
Protocolo
1. Producción química controlada por la luz utilizando el circuito S. cerevisiae OptoINVRT7
- Construcción de tensión
- Obtener una distensión con his3 auxotrofia, ya que este marcador es necesario para la mayoría de los plásmidos OptoINVRT existentes5. Si busca la regulación optogenética de un gen que es nativo de S. cerevisiae, construya una cepa en la que se elimine cualquier copia endógena del gen.
- Linealizar el plásmido que contiene el circuito OptoINVRT7, como EZ-L4395, e integrarlo en el his3-locus de la cepa auxotrófica utilizando métodos estándar de transformación de acetato de litio15. Si utiliza el plásmido EZ-L439, que contiene los componentes para reprimir PGAL1 en la luz y activarlo en la oscuridad, linealice en el sitio de restricción de PmeI.
- Después de la transformación, centrífugue las células a 150 x g durante 1 min y resuspenda suavemente en 200 μL de medio completo sintético de gota de histidina fresca (SC-His).
- Coloque todo el volumen celular en placas de agar SC-His e incube a 30 °C durante 2-3 días hasta que aparezcan las colonias.
- Preparar células competentes a partir de esta cepa utilizando protocolos estándar de transformación de acetato de litio, y transformarlas con un plásmido que contenga el gen o genes a controlar optogenéticamente aguas abajo del promotor PGAL1-M o PGAL1-S5.
NOTA: El uso de un plásmido que se integra en δ(YARCdelta5) y selecciona con Zeocin permite una integración multicopia estable7,16,17,18. - Después de la transformación, centrifugar el cultivo a 150 x g durante 1 min y resuspender suavemente en 200 μL de medio fresco de abandono de SC.
NOTA: El promotor PGAL1-M es una versión sintética del promotor PGAL1 con los sitios de represión Mig1p eliminados, mientras que PGAL1-S es una versión diseñada de PGAL1-M, que tiene sitios de enlace de activador Gal4p adicionales. El promotor PGAL1 regular se puede utilizar para controlar la expresión; sin embargo, la fuerza de expresión será menor que la de estos promotores diseñados. - Placa todo el volumen celular en una placa de agar de peptona dextrosa (YPD) de extracto de levadura si se integra en sitios δ, o una placa de abandono de SC si se transforma con un plásmido que contiene un marcador de selección. Incubar a 30 °C durante 16 h bajo luz azul constante para mantener el gen controlado optogenéticamente reprimido.
NOTA: Para algunas cepas, las colonias pueden crecer más rápido cuando se incuban en pulsos de luz azul (por ejemplo, 1 s encendido / 79 s apagado, 5 s encendido / 75 s apagado, 10 s encendido / 70 s apagado, etc.) en lugar de en iluminación constante, que debe determinarse experimentalmente para cada cepa, si es necesario. - Use cualquier fuente de luz de 465 nm y coloque un panel LED ~ 40 cm por encima de la placa de modo que la intensidad de la luz sea de ~ 80-110 μmol / m2 / s. Mida la intensidad usando un medidor cuántico (ver Tabla de Materiales).
- Si se integra en sitios δ, cree una réplica de la placa en placas YPD que contengan un rango de concentraciones de zeocina entre 400 μg / ml y 1,200 μg / ml para seleccionar una variedad de números de copia de integración5,7,12,16,17,18. Incubar las placas réplica a 30 °C bajo luz azul constante o pulsada durante 2-3 días hasta que aparezcan las colonias.
- Cribado preliminar de las mejores colonias
- Seleccione ocho colonias de cada placa y utilícelas para inocular 1 ml de sc-his medio suplementado con 2% de glucosa en pocillos individuales de una placa de 24 pocillos. Crecer en placas de 24 pocillos debajo de las celdas durante la noche (16-20 h) a 30 °C con 200 rpm (diámetro orbital de 19 mm) temblando bajo una iluminación constante de luz azul.
- A la mañana siguiente, diluya cada cultivo en 1 ml de un medio SC-His fresco con 2% de glucosa a valores de OD600 que van desde 0.01-0.3 y crezca en placas de 24 pocillos bajo luz constante o pulsada a 30 ° C con agitación de 200 rpm hasta que alcancen densidades celulares entre 2 y 9 valores de OD600 (Figura 4A). La cantidad de tiempo necesario para esta fase de crecimiento dependerá de la tensión.
- Incubar las placas en la oscuridad durante 4 h a 30 °C con agitación a 200 rpm apagando el panel de luz y envolviendo las placas en papel de aluminio.
NOTA: Este paso permite a las células hacer la transición metabólica a la fase de producción antes de la resuspensión en el medio de producción. - Para iniciar la fase de producción, centrífugos los cultivos en la placa de 24 pocillos a 234 x g durante 5 min y resuspenda las células en 1 mL de medio fresco SC-dropout con 2% de glucosa. Selle las placas para evitar la evaporación del producto deseado mediante el uso de cinta de sellado de microplacas estériles.
- Fermentar las placas selladas en la oscuridad durante 48 h a 30 °C con agitación a 200 rpm. Asegúrese de que las placas estén envueltas en papel de aluminio para evitar cualquier exposición a la luz.
NOTA: Envolver las placas en papel de aluminio no limita la disponibilidad de oxígeno o gas en las fermentaciones; sin embargo, la cinta de sellado estéril limita la transferencia de gas. Se pueden hacer pequeños agujeros en la cinta para introducir oxígeno, si es necesario.
- Cosecha y análisis
- Para cosechar las fermentaciones, centrífuga las placas durante 5 min a 234 x g y transfiera 800 μL del sobrenadante a tubos de microcentrífuga de 1,5 mL.
- Dependiendo de la sustancia química de interés, analice mediante cromatografía líquida de alto rendimiento (HPLC), cromatografía de gases-espectrometría de masas (GC-MS) u otro método analítico utilizando la técnica de preparación de muestras más adecuada para el instrumento utilizado.
2. Producción de proteínas controladas por la luz utilizando el sistema OptoLAC de E. coli
- Construcción de tensión
- Co-transformación electrocompetente BL21 DE3 ΔlacI ΔlacI-DE3 con un plásmido que contiene el circuito OptoLAC1B u OptoLAC2B6 y un plásmido que expresa la proteína recombinante de interés del promotor PT719.
- Después de la transformación, recuperar las células durante 1 h en 1 mL de caldo súper óptimo con represión catabolita (SOC; 2% triptona, 0.5% extracto de levadura, 10 mM NaCl, 2.5 mM KCl, 10 mM MgCl2, 10 mM MgSO4, 20 mM glucosa) a 37 °C con rotación o agitación.
NOTA: El plásmido que contiene la proteína de interés debe ser compatible con el plásmido OptoLAC (es decir, diferente marcador de resistencia y origen de replicación) y no debe contener una copia de lacI. - Centrifugar las células a 4845 x g durante 3 min y concentrar el pellet en 200 μL de caldo de lisogenia (LB). Coloque todas las células concentradas en una placa de agar LB con antibióticos apropiados y crezca a 37 ° C durante la noche bajo luz azul constante para mantener la expresión de proteínas reprimida.
- Examen inicial para verificar la expresión
- Tome tres colonias individuales y úselas para inocular 1 ml de LB media con antibióticos apropiados en pocillos individuales de una placa de 24 pocillos. Crecer durante la noche (16-20 h) a 37 °C con agitación de 200 rpm bajo iluminación constante de luz azul (Figura 4A).
- Al día siguiente, use 1.5 μL de cultivo para medir OD600 en un espectrofotómetro con una medición de microvolumen. Diluya los cultivos en 1 ml de LB fresco en placas de 24 pocillos a valores de OD600 que van desde 0.01-0.1.
- Cultive los cultivos a 37 °C con 200 rpm agitando bajo luz azul durante 2-3 h. A partir de la segunda hora, realice mediciones de OD600 cada 15 minutos para asegurarse de que los cultivos no sobrecojan el rango de OD600 de 0.1-1.5.
- Una vez que los cultivos estén en el OD600 deseado, apague el panel de luz y envuelva la placa en papel de aluminio para iniciar la fase de producción. Mantenga la placa en la oscuridad durante 8 h (37 °C), 20 h (30 °C) o 48 h (18 °C), con agitación de 200 rpm.
- Mida y registre el valor final de OD600 de cada cultivo.
- Cosecha y análisis
- Transfiera 800 μL de cada cultivo a un tubo de microcentrífuga de 1,5 ml y centrífuga durante 5 min a 17.000 x g.
- Resuspendir el pellet celular en 200 μL de tampón de resuspensión (Tris 50 mM, pH 8.0, NaCl 300 mM).
NOTA: La concentración de NaCl se puede ajustar en función de la proteína recombinante que se está analizando. - Agregue 50 μL de tampón de muestra de dodecil sulfato de sodio (SDS) 6x (Tris 375 mM, pH 6.8, SDS 9%, glicerol 50%, azul de bromofenol 0.03%, TDT 9%). Incubar a 100 °C durante 10 min con agitación a 700 rpm en un termomezclador.
- Cargue ~ 3-20 μL del cultivo en un gel SDS-PAGE al 12%. Utilizando la medición final de OD600 como guía, cargue aproximadamente la misma cantidad de proteína para cada muestra (equivalente a 10 μL de la muestra correspondiente a un valor final de OD600 de 1). Utilice una fuente de alimentación para ejecutar la electroforesis a 100 V hasta que el gel se resuelva por completo.
- Manche el gel con la solución Coomassie brilliant blue G-250 calentando durante 30-40 s en un horno de microondas y luego incubando en un rotador de plataforma durante al menos 15 min.
- Enjuague con agua desionizada dos veces y mantenga en un rotador de plataforma durante al menos 30 minutos (o durante la noche), agregando dos toallitas de limpieza atadas en un nudo para ayudar a absorber la mancha. Hervir el gel en cantidad suficiente de agua en el horno de microondas durante 15 minutos para acelerar el proceso de detención.
3. Fermentación trifásica utilizando el sistema S. cerevisiae OptoAMP
- Construcción de tensión
- Obtener una cepa con un marcador auxotrófico his3 , ya que este marcador es necesario para utilizar los plásmidos OptoAMP existentes5. Si se busca la regulación optogenética de un gen que es nativo de S. cerevisiae, construir una cepa en la que se elimine la copia endógena de este gen.
- Linealizar un plásmido que contiene el circuito OptoAMP4, como EZ-L58012, e integrarlo en el locus his3 de la cepa auxotrófica utilizando métodos estándar de transformación de acetato de litio15. Si usa EZ-L580, linealice el plásmido en el sitio de restricción de PmeI.
- Después de la transformación, centrífugue las células a 150 x g durante 1 min y resuspenda suavemente en 200 μL de medio SC-His fresco.
- Placa todo el volumen celular en medios selectivos (SC-His-agar) e incuba a 30 °C durante 2-3 días hasta que aparezcan las colonias.
- Preparar células competentes a partir de esta cepa y transformarlas con un plásmido que contenga el gen o genes a controlar optogenéticamente aguas abajo del promotor PGAL1-S12.
NOTA: El uso de un plásmido que se integra en δ sitios y selecciona con Zeocin permite una integración y selección multicopia estables. - Después de la transformación, centrífuga el cultivo a 150 x g durante 1 min y resuspender suavemente en 200 μL de medio fresco de abandono de SC.
NOTA: El promotor PGAL1-S es una versión sintética del promotor PGAL1 en la que se eliminan los sitios de represión Mig1p y se agregan sitios de enlace al activador Gal4p adicionales. Se puede utilizar el promotor PGAL1 regular; sin embargo, la fuerza de expresión será menor que este promotor diseñado. - Coloque todo el volumen celular en una placa de agar YPD o SC-dropout e incube a 30 ° C durante 16 h en la oscuridad (envuelta en papel de aluminio). La incubación en la oscuridad mantiene reprimido el gen controlado optogenéticamente, lo que permite a las células dirigir sus recursos metabólicos hacia el crecimiento celular en lugar de la producción química.
- Si se integra en δ sitios, replique la placa en placas YPD que contengan un rango de concentraciones de zeocina para seleccionar una variedad de números de copia de integración. Incubar las placas a 30 °C en la oscuridad (envueltas en papel de aluminio) durante 2-3 días hasta que aparezcan colonias.
- Cribado preliminar de las mejores colonias
- Seleccione ocho colonias de cada placa y utilícelas para inocular 1 ml de SC-His medio con 2% de glucosa en pocillos individuales de una placa de 24 pocillos. Cultive las células durante la noche (16-20 h) en la oscuridad a 30 °C con agitación de 200 rpm.
- A la mañana siguiente, diluir cada cultivo en 1 mL de sc-his medio fresco con 2% de glucosa a 0.1 OD600 y crecer en la oscuridad a 30 °C con agitación de 200 rpm hasta que alcancen un OD600 de 3. Envuelva las placas en papel de aluminio para evitar la exposición a la luz. La cantidad de tiempo necesario para esta fase de crecimiento dependerá de la tensión.
- Para iniciar la fase de inducción, incubar las placas bajo luz pulsada (por ejemplo, 5 s encendido/95 s apagado) durante 12 h a 30 °C con agitación de 200 rpm. Utilice cualquier fuente de luz de 465 nm y coloque un panel LED sobre la placa de modo que la intensidad de la luz sea de ~ 80-110 μmol / m2 / s para obtener resultados óptimos (Figura 4A).
NOTA: La duración óptima del pulso de luz para esta incubación variará según el producto químico que se produzca. Se recomienda filtrar una gama de horarios de luz desde 0.1% (por ejemplo, 1 s en 999 s apagado) hasta 100% (luz completa). - Para iniciar la fase de producción, centrifugar los cultivos a 234 x g durante 5 min y resuspendir en medio FRESCO SC-His con 2% de glucosa. Selle las placas para evitar la evaporación del producto deseado utilizando cinta de sellado de microplacas estéril.
- Fermentar las placas selladas a la luz durante 48 h a 30 °C con agitación a 200 rpm. Optimice el programa de luz durante este paso, ya que algunos productos químicos se benefician de una fase de producción pulsada en lugar de luz completa.
- Cosecha y análisis
- Cosecha las fermentaciones centrifugando las placas durante 5 min a 234 x g y transfiriendo 800 μL del sobrenadante a tubos de microcentrífuga de 1,5 mL.
- Dependiendo del producto químico de interés, analice utilizando HPLC, GC-MS u otro método analítico utilizando la técnica de preparación de muestras más adecuada para el instrumento utilizado.
4. Producción química (mevalonato) a partir de E. coli en un biorreactor controlado por la luz
- Inoculación inicial y configuración del biorreactor
- Inocular una colonia de una cepa de E. coli diseñada con producción química controlada por la luz en 5 mL de sales mínimas M9 (3.37 mM Na2HPO4, 2.2 mM KH2PO4, 0.855 mM NaCl, 0.935 mM NH4Cl) suplementadas con 0.2% p/v casaminoácidos, 5% p/v glucosa y mezcla de metales traza20 (0.0084 g/L EDTA, 0,0025 g/L CoCl2, 0,015 g/L MnCl2, 0,0015 g/L CuCl2, 0,003 g/L H3BO3, 0,0025 g/L Na2MoO4, 0,008 g/L ZnCl2, 0,06 g/L De Fe (III) citrato, 0,0045 g/L tiamina, 1,3 g/L MgSO4) en un tubo cónico de 50 mL.
- Cultive el cultivo durante la noche a 30 ° C con 200 rpm agitando bajo iluminación de luz azul.
- Configure la placa de cabeza del recipiente del biorreactor, asegurándose de que estén instalados los siguientes puertos: inserto para sonda térmica; sonda de oxígeno disuelto (DO); sparger de gas: conéctese a la fuente de aire a través de un filtro de 0,2 μm; impulsor; condensador de gas: conéctese a un filtro de 0,2 μm; línea de enfriamiento (x2); líneas de alimentación (x2) - una para la adición de medios, otra para el control del pH; línea de muestreo: asegúrese de que llegue al fondo del buque; puerto vacío; Sonda de pH: calibre la sonda con estándares de pH = 4 y pH = 7 antes de la instalación, ya sea en autoclave con el resto del recipiente o esterilice con etanol al 95% e inserte asépticamente antes de la configuración.
- Llene el recipiente con 1 L de agua filtrada, y coloque la placa de la cabeza y apriete, asegurándose de que la junta tórica se ajuste y selle perfectamente.
- Cubra cualquier abertura en el reactor con papel de aluminio.
- Prepare tres tiras de tubos: una para eliminar el agua, otra para insertar el alimento y otra para el control del pH. Cubra los extremos con papel de aluminio y envuelva todos los tubos en papel de aluminio.
NOTA: El NH4OH, que se utiliza para el ajuste del pH, no fluye suavemente en los tubos de silicona, lo que puede conducir a tasas de flujo inexactas y a una baseificación excesiva del cultivo. Para evitar este problema, utilice tubos de bomba biocompatibles (BPT) para la alimentación NH4OH. - Autoclave el biorreactor y el tubo, utilizando un ciclo de líquido de 30 minutos.
- Retire los materiales del autoclave. Una vez que esté lo suficientemente frío como para manejar, conecte el impulsor, las sondas de pH y OD, la fuente de aire, la entrada y salida del condensador, y la entrada y salida de enfriamiento a la estación de control.
- Inserte la sonda térmica y cubra el recipiente con una camisa calefactora. Asegure la chaqueta hacia la parte superior del recipiente para evitar bloquear el cultivo de la exposición a la luz.
- Conecte uno de los tubos estériles a la línea de muestreo y asegúrelo a través de la bomba de muestreo. Coloque el otro extremo de tal manera que fluya en un recipiente vacío que pueda contener al menos 1 L. Escurra el agua dentro del recipiente.
- Conecte otro tubo estéril a una de las líneas de alimentación y asegúrelo a través de una de las bombas de alimentación. Conecte el otro extremo del tubo a una botella de soporte M9. Alimentar los medios en el reactor.
- Conecte otro tubo estéril a una de las líneas de alimentación y asegúrelo a través de una de las bombas de alimentación. Conecte el otro extremo del tubo a la botella que contiene 28% -30% de NH4OH.
PRECAUCIÓN: El NH4OH es corrosivo. Trabaje en una campana extractora de humos mientras se transfiere a una botella de alimentación y asegúrese de que la botella de alimentación se coloque en contención secundaria. - Coloque tres paneles de luz en una formación triangular a ~ 20 cm de distancia del reactor, verificando que las intensidades de luz en la superficie del recipiente alcancen ~ 80-110 μmol / m2 / s desde cada lado (Figura 4B).
- Al día siguiente, encienda el sistema de biorreactor y el enfriador. Ajuste el punto de ajuste de la temperatura del reactor a 37 °C, el punto de ajuste del pH a 7.0 y la agitación a 200 rpm. La camisa calefactora debe encenderse.
- Calibre la sonda DO esperando primero hasta que las mediciones de temperatura y DO se vuelvan constantes (este será el punto de ajuste del 100%). Luego, desconecte la sonda del sistema (este será el punto de ajuste del 0%). Repita el procedimiento hasta que la medición de OD se estabilice al 100 % cuando la sonda esté conectada y, a continuación, establezca el punto de ajuste de OD en un 20 %.
- Producción química controlada por la luz
- Inocular el biorreactor a un OD600 inicial de 0.001-0.1. Encienda los paneles de luz para iniciar el crecimiento.
- Después de 3 h, comience a tomar muestras de la línea de muestreo para tomar mediciones de OD600 para evitar el crecimiento excesivo de la densidad celular óptima de inducción (ρs). Una vez que se alcanza el ρs óptimo (el valor óptimo para la producción de mevalonato es 0.17), apague los paneles de luz, cubra el reactor con papel de aluminio y envuelva la configuración en tela negra para iniciar la fase de producción oscura.
- Agregue 50 μL de antiespumante, 8 h después de cambiar a la oscuridad. Desenrosque el puerto vacío y pipetee el antiespumante directamente en el reactor.
- Utilice el puerto de muestreo para tomar muestras periódicamente para el análisis de HPLC o GC.
- Desmontaje y análisis
- Una vez concluido el experimento, apague el sistema. Desenrosque cuidadosamente las sondas de DO y pH y lávelas con agua y jabón. Desenrosque la placa de la cabeza y lávela con agua y jabón con un cepillo.
- Transfiera el cultivo a un recipiente vacío y agregue lejía a una concentración final de 10% v / v. Colocar en una campana extractora de humos y desechar después de 30 min.
- Lave el recipiente del reactor con agua y jabón con un cepillo.
- Preparar las muestras para su análisis en función del producto de interés. Para la producción de mevalonato, mezclar 560 μL de cultivo con 140 μL de 0,5 M HCl y vórtice a alta velocidad durante 1 min. Esto convierte el mevalonato en (±)-mevalonolactona.
PRECAUCIÓN: El HCl es un peligro para la salud. Manipule con el EPP adecuado y asegúrese de que los tubos de muestra estén correctamente tapados antes del vórtice. - Centrifugar a 17.000 x g durante 45 min a 4 °C. Transfiera 250 μL del sobrenadante a un vial de HPLC.
- Para el mevalonato, analice las muestras utilizando una columna de intercambio iónico de ácidos orgánicos. Cuantificar la producción utilizando un detector de índice de refracción (RID), comparando las áreas pico con un estándar de (±)-mevalonolactona.
Resultados
La regulación optogenética del metabolismo microbiano se ha implementado con éxito para producir una variedad de productos, incluidos biocombustibles, productos químicos a granel, proteínas y productos naturales5,6,7,12,13. La mayoría de estos procesos están diseñados para que el crecimiento celular ocurra en la luz (cuando la baja densidad celular pla...
Discusión
El control dinámico se ha aplicado durante mucho tiempo para mejorar los rendimientos de la ingeniería metabólica y la producción de proteínas recombinantes4. Los cambios en la expresión enzimática se implementan más típicamente utilizando inductores químicos como IPTG21, galactosa22 y tetraciclina23, pero también se han mediado utilizando condiciones de proceso como la temperatura y el pH. El control optogenético ...
Divulgaciones
Los autores han solicitado varias patentes para los circuitos y métodos optogenéticos descritos en este artículo.
Agradecimientos
Esta investigación fue apoyada por el Departamento de Energía de los Estados Unidos, la Oficina de Ciencias, el Premio de la Oficina de Investigación Biológica y Ambiental Número DE-SC0019363, el Premio NSF CAREER CBET-1751840, The Pew Charitable Trusts y el Premio Camille Dreyfus Teacher-Scholar.
Materiales
| Name | Company | Catalog Number | Comments |
| Light-controlled chemical production using S. cerevisiae | |||
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Agar powder | Thermo Fisher Scientific | 303991049 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| EZ-L439 OptoINVRT7 Plasmid | N/A | N/A | See Reference 1 |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| PmeI | New England Biolabs | R0560L | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| Replica-plating device | Thomas Scientific | F37848-0000 | |
| Replica-plating pads | Sunrise Science Products | 3005-012 | |
| SC-His powder | Sunrise Science Products | 1303-030 | |
| SC Complete powder | Sunrise Science Products | 1459-100 | |
| Sterile sealing film | Excel Scientific | STR-SEAL-PLT | |
| YPD agar plates | VWR | 100217-054 | |
| Zeocin | Thermo Fisher Scientific | R25005 | |
| Light-controlled protein production using E. coli | |||
| 6X SDS Sample Buffer | Cepham Life Sciences | 10502 | |
| 12% Acrylamide protein gels | Thermo Fisher Scientific | NP0341BOX | |
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| Coomassie Brilliant Blue G-250 | Thermo Fisher Scientific | 20279 | |
| Electrophoresis cell | Bio-Rad | 1658004 | |
| Electrophoresis power supply | Bio-Rad | 1645050 | |
| LB broth (Miller) | Fisher Scientific | BP97235 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NaCl | Thomas Scientific | SX0425-1 | |
| OptoLAC plasmids | N/A | N/A | See Reference 2 |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SOC medium | Thermo Fisher Scientific | 15544034 | |
| Thermomixer | Eppendorf | 5382000015 | |
| Tris base | Fisher Scientific | BP1521 | |
| Three-phase fermentation using S. cerevisiae | |||
| Same materials as "Light-controlled chemical production using S. cerevisiae" protocol plus the following: | |||
| EZ-L580 OptoAMP4 Plasmid | N/A | N/A | See Reference 10 |
| Chemical production in a light-controlled bioreactor | |||
| Aluminum foil | Reynolds | B004NG90YO | |
| Antifoam | Sigma-Aldrich | A8311 | |
| Bioreactor with control station | Eppendorf | B120110001 | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Bleach | VWR Scientific | 89501-620 (CS) | |
| Blue LED panel | HQRP | 884667106091218 | |
| BPT tubing | Fisher Scientific | 14-170-15 | |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Hydrochloric acid (HCl) | Fisher Scientific | 7647-01-0 | |
| M9 Minimal Salts | Thermo Fisher Scientific | A1374401 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NH4OH Solution | Sigma-Aldrich | I0503-1VL | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SC Complete powder | Sunrise Science Products | 1459-100 |
Referencias
- Figueroa, D., Rojas, V., Romero, A., Larrondo, L. F., Salinas, F. The rise and shine of yeast optogenetics. Yeast. 38 (2), 131-146 (2021).
- Pouzet, S., et al. The promise of optogenetics for bioproduction: Dynamic control strategies and scale-up instruments. Bioengineering. 7 (4), 151 (2020).
- Venayak, N., Anesiadis, N., Cluett, W. R., Mahadevan, R. Engineering metabolism through dynamic control. Current Opinion in Biotechnology. 34, 142-152 (2015).
- Lalwani, M. A., Zhao, E. M., Avalos, J. L. Current and future modalities of dynamic control in metabolic engineering. Current Opinion in Biotechnology. 52, 56-65 (2018).
- Zhao, E. M., et al. Design and characterization of rapid optogenetic circuits for dynamic control in yeast metabolic engineering. ACS Synthetic Biology. 9 (12), 3254-3266 (2020).
- Lalwani, M. A., et al. Optogenetic control of the lac operon for bacterial chemical and protein production. Nature Chemical Biology. 17 (1), 71-79 (2021).
- Zhao, E. M., et al. Optogenetic regulation of engineered cellular metabolism for microbial chemical production. Nature. 555 (7698), 683-687 (2018).
- Baumschlager, A., Khammash, M. Synthetic biological approaches for optogenetics and tools for transcriptional light-control in bacteria. Advanced Biology. 5 (5), 2000256 (2021).
- Dvorak, P., et al. Exacerbation of substrate toxicity by IPTG in Escherichia coli BL21(DE3) carrying a synthetic metabolic pathway. Microbial Cell Factories. 14, 201 (2015).
- Hartline, C. J., Schmitz, A. C., Han, Y., Zhang, F. Dynamic control in metabolic engineering: Theories, tools, and applications. Metabolic Engineering. 63, 126-140 (2021).
- Ni, C., Dinh, C. V., Prather, K. L. J. Dynamic control of metabolism. Annual Review of Chemical and Biomolecular Engineering. 12, 519-560 (2021).
- Zhao, E. M., et al. Optogenetic amplification circuits for light-induced metabolic control. ACS Synthetic Biology. 10 (5), 1143-1154 (2021).
- Lalwani, M. A., Zhao, E. M., Wegner, S. A., Avalos, J. L. The Neurospora crassa Inducible Q System Enables Simultaneous Optogenetic Amplification and Inversion in Saccharomyces cerevisiae for Bidirectional Control of Gene Expression. ACS Synthetic Biology. 10 (8), 2060-2075 (2021).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Marx, H., Mecklenbräuker, A., Gasser, B., Sauer, M., Mattanovich, D. Directed gene copy number amplification in Pichia pastoris by vector integration into the ribosomal DNA locus. FEMS Yeast Research. 9 (8), 1260-1270 (2009).
- Nordén, K., et al. Increasing gene dosage greatly enhances recombinant expression of aquaporins in Pichia pastoris. BMC Biotechnology. 11, 47 (2011).
- Zhao, E. M., et al. Light-based control of metabolic flux through assembly of synthetic organelles. Nature Chemical Biology. 15 (6), 589-597 (2019).
- Dowee, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- Zhou, K., Edgar, S., Stephanopoulos, G. Engineering microbes to synthesize plant isoprenoids. Methods in Enzymology. 575, 225-245 (2016).
- Arfman, N., Worrell, V., Ingram, L. O. Use of the tac promoter and lacI(q) for the controlled expression of Zymomonas mobilis fermentative genes in Escherichia coli and Zymomonas mobilis. Journal of Bacteriology. 174 (22), 7370-7378 (1992).
- Steen, E. J., et al. Metabolic engineering of Saccharomyces cerevisiae for the production of n-butanol. Microbial Cell Factories. 7 (1), 1-8 (2008).
- Tan, S. Z., Manchester, S., Prather, K. L. J. Controlling central carbon metabolism for improved pathway yields in Saccharomyces cerevisiae. ACS Synthetic Biology. 5 (2), 116-124 (2015).
- Jayaraman, P., et al. Blue light-mediated transcriptional activation and repression of gene expression in bacteria. Nucleic Acids Research. 44 (14), 6994 (2016).
- Fernandez-Rodriguez, J., Moser, F., Song, M., Voigt, C. A. Engineering RGB color vision into Escherichia coli. Nature Chemical Biology. 13 (7), 706-708 (2017).
- Ding, Q., et al. Light-powered Escherichia coli cell division for chemical production. Nature Communications. 11 (1), 1-14 (2020).
- Senoo, S., Tandar, S. T., Kitamura, S., Toya, Y., Shimizu, H. Light-inducible flux control of triosephosphate isomerase on glycolysis in Escherichia coli. Biotechnology and Bioengineering. 116 (12), 3292-3300 (2019).
- Ramakrishnan, P., Tabor, J. J. Repurposing synechocystis PCC6803 UirS-UirR as a UV-violet/green photoreversible transcriptional regulatory tool in E. Coli. ACS Synthetic Biology. 5 (7), 733-740 (2016).
- Tabor, J. J., Levskaya, A., Voigt, C. A. Multichromatic control of gene expression in escherichia coli. Journal of Molecular Biology. 405 (2), 315-324 (2011).
- Stewart, C. J., McClean, M. N. Design and implementation of an automated illuminating, culturing, and sampling system for microbial optogenetic applications. Journal of Visualized Experiments:JoVE. (120), e54894 (2017).
- Grødem, E. O. S., Sweeney, K., McClean, M. N. Automated calibration of optoPlate LEDs to reduce light dose variation in optogenetic experiments. BioTechniques. 69 (4), 313-316 (2020).
- Gerhardt, K. P., et al. An open-hardware platform for optogenetics and photobiology. Scientific Reports. 6, (2016).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Steel, H., Habgood, R., Kelly, C., Papachristodoulou, A. In situ characterisation and manipulation of biological systems with Chi.Bio. PLoS Biology. 18 (7), (2020).
- Carrasco-López, C., García-Echauri, S. A., Kichuk, T., Avalos, J. L. Optogenetics and biosensors set the stage for metabolic cybergenetics. Current Opinion in Biotechnology. 65, 296-309 (2020).
- Milias-Argeitis, A., Rullan, M., Aoki, S. K., Buchmann, P., Khammash, M. Automated optogenetic feedback control for precise and robust regulation of gene expression and cell growth. Nature Communications. 7 (1), 1-11 (2016).
- Melendez, J., et al. Real-time optogenetic control of intracellular protein concentration in microbial cell cultures. Integrative Biology: Quantitative Biosciences From Nano to Macro. 6 (3), 366-372 (2014).
- Milias-Argeitis, A., et al. In silico feedback for in vivo regulation of a gene expression circuit. Nature Biotechnology. 29 (12), 1114-1116 (2011).
- Castillo-Hair, S. M., Baerman, E. A., Fujita, M., Igoshin, O. A., Tabor, J. J. Optogenetic control of Bacillus subtilis gene expression. Nature Communications. 10 (1), 1-11 (2019).
- Xia, A., et al. Optogenetic modification of pseudomonas aeruginosa enables controllable twitching motility and host infection. ACS Synthetic Biology. 10 (3), 531-541 (2021).
- Pu, L., Yang, S., Xia, A., Jin, F. Optogenetics manipulation enables prevention of biofilm formation of engineered pseudomonas aeruginosa on surfaces. ACS Synthetic Biology. 7 (1), 200-208 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados