É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Fermentações controladas por luz para produção de produtos químicos e proteicos microbianos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O controle optogenético do metabolismo microbiano oferece controle dinâmico flexível sobre os processos de fermentação. O protocolo aqui mostra como configurar fermentações reguladas por luz azul para produção química e proteica em diferentes escalas volumosas.
Resumo
As fábricas de células microbianas oferecem uma alternativa sustentável para a produção de produtos químicos e proteínas recombinantes a partir de matérias-primas renováveis. No entanto, sobrecarregar um microrganismo com modificações genéticas pode reduzir o condicionamento físico e a produtividade do hospedeiro. Esse problema pode ser superado usando o controle dinâmico: expressão indutível de enzimas e caminhos, tipicamente usando aditivos à base de químicos ou nutrientes, para equilibrar o crescimento e a produção celular. A optogenética oferece um método não invasivo, altamente tável e reversível de regular dinamicamente a expressão genética. Aqui, descrevemos como configurar fermentações controladas por luz de Escherichia coli e Saccharomyces cerevisiae para a produção de produtos químicos ou proteínas recombinantes. Discutimos como aplicar luz em horários selecionados e dosagens para desacoplar o crescimento e a produção microbiana para melhor controle de fermentação e produtividade, bem como as principais considerações de otimização para melhores resultados. Além disso, descrevemos como implementar controles de luz para experimentos bioreatores em escala de laboratório. Esses protocolos facilitam a adoção de controles optogenéticos em microrganismos projetados para melhor desempenho de fermentação.
Introdução
A optogenética, o controle de processos biológicos com proteínas leves responsivas, oferece uma nova estratégia para controlar dinamicamente as fermentações microbianas para a produção química e proteica1,2. A carga de vias metabólicas projetadas e a toxicidade de alguns intermediários e produtos muitas vezes prejudicam o crescimento celular3. Tais tensões podem levar à má acumulação de biomassa e à redução da produtividade3. Esse desafio pode ser enfrentado dividindo temporalmente as fermentações em uma fase de crescimento e produção, que dedicam recursos metabólicos ao acúmulo de biomassa ou à síntese do produto, respectivamente4. Recentemente, mostramos que a transição do crescimento para a produção nesta fermentação em duas fases pode ser induzida com mudanças nas condições de iluminação5,6,7. A alta sintonia, reversibilidade e ortogonalidade dos insumos leves8 oferecem vantagens únicas às fermentações controladas pela luz que são difíceis ou impossíveis de replicar com indutores químicos usados no controle dinâmico das fermentações convencionais em duas fases4,9,10,11.
A proteína EL222 responsiva de luz azul derivada de Erythrobacter litoralis tem sido usada para desenvolver vários circuitos optogenéticos para engenharia metabólica em Saccharomyces cerevisiae5,7,12,13. El222 contém um domínio sensor de tensão de oxigênio leve (LOV) que sofre uma mudança conformacional sobre a ativação da luz azul (465 nm), que permite que ele se ligue à sua sequência de DNA cognato (C120)13. Fundir EL222 ao domínio de ativação do VP16 viral (VP16-EL222) resulta em um fator de transcrição responsiva de luz azul que pode ativar reversivelmente a expressão genética em S. cerevisiae7 e outros organismos14 do promotor sintético PC120. Vários circuitos baseados no EL222 foram desenvolvidos e utilizados para a produção química em S. cerevisiae, como o sistema OptoEXP ativado pela luz básica7, no qual o gene de interesse é diretamente expresso a partir de PC120 (Figura 1A). No entanto, preocupações com a penetração da luz nas altas densidades celulares tipicamente encontradas na fase de produção de fermentações nos motivaram a desenvolver circuitos invertidos que são induzidos no escuro, como os circuitos OptoINVRT e OptoQ-INVRT (Figura 1B)5,7,13. Estes sistemas aproveitam os regulons galactose (GAL) ou quinic acid (Q) de S. cerevisiae e N. crassa, respectivamente, controlando seus repressores correspondentes (GAL80 e QS) com VP16-EL222, para reprimir a expressão genética na luz e induzi-la fortemente no escuro. A combinação de circuitos OptoEXP e OptoINVRT resulta em controle bidirecional da expressão genética, permitindo fermentações em duas fases nas quais a fase de crescimento é induzida com luz azul, e a fase de produção com escuridão (Figura 2A)5,7.
Usar a luz em vez de escuridão para induzir a expressão genética durante a fase de produção expandiria muito as capacidades de controles optogenéticos, mas também exigiria superar as limitações de penetração de luz das altas densidades celulares tipicamente encontradas nesta fase de fermentação. Para isso, desenvolvemos circuitos, conhecidos como OptoAMP e OptoQ-AMP, que amplificam a resposta transcricional à estimulação da luz azul. Esses circuitos usam mutantes do tipo selvagem ou hipersensíveis do VP16-EL222 para controlar a produção dos ativadores transcricionais Gal4p ou QF2 dos regulons GAL ou Q, respectivamente, alcançando maior sensibilidade e expressão genética mais forte com luz12,13 (Figura 1C). Os circuitos optoAMP podem alcançar indução de luz completa e homogênea em bioreatores de 5 L a uma densidade óptica (medida a 600 nm; OD600) valores de pelo menos 40 com apenas ~0,35% de iluminação (5% de dose leve em apenas ~7% da superfície a granel). Isso demonstra um maior grau de sensibilidade em comparação com o OptoEXP, que requer cerca de 100% de iluminação12. A capacidade de induzir efetivamente a expressão genética com luz em altas densidades celulares abre novas oportunidades para o controle dinâmico das fermentações. Isso inclui fermentações operacionais em mais de duas fases temporais, como fermentações trifásicas, nas quais as fases de crescimento, indução e produção são estabelecidas com cronogramas de luz únicos para otimizar a produção química (Figura 2B)12.

Figura 1: Circuitos optogenéticos para controle dinâmico de S. cerevisiae. Os circuitos OptoEXP, OptoINVRT e OptoAMP são baseados no sistema VP16-EL222 sensível à luz. (A) No circuito OptoEXP, a exposição à luz azul causa uma alteração conformacional e a dimerização do VP16-EL222, que expõe um domínio de vinculação de DNA e permite a transcrição do PC120. O número foi modificado de Zhao et al.7. (B) Os circuitos OptoINVRT aproveitam os regulons GAL (mostrado) ou Q para induzir a expressão no escuro. Nos circuitos baseados em GAL, VP16-EL222 e GAL4 são expressos constitutivamente, enquanto a expressão de drives PC120 do repressor GAL80 (em circuitos baseados em Q, GAL4 e GAL80 são substituídas por QF2 e QS, respectivamente, e um promotor sintético contendo QUAS é usado em vez de um promotor gal). À luz, Gal80p impede a ativação do gene de interesse do PGAL1. No escuro, GAL80 não é expresso e rapidamente degradado, fundindo-o a um domínio degron constitutivo (pequeno domínio marrom), que permite a ativação de PGAL1 por Gal4p. O número foi modificado de Zhao et al.5. (C) Os circuitos OptoAMP também usam VP16-EL222 para controlar os regulons GAL (mostrado) ou Q. Nestes circuitos, o repressor GAL80 (ou QS) é expresso e fundido constitutivamente e fundido a um degron sensível a fotos (pequeno domínio azul) garantindo uma repressão apertada no escuro. PC120 e uma expressão de controle mutante hipersensível VP16-EL222 de GAL4 (ou QF2) com luz, que ativa fortemente O PGAL1 (ou um promotor contendo QUAS) na luz. Os circuitos derivados de GAL podem usar formas projetadas de PGAL1, como PGAL1-M ou PGAL1-S, que aumentaram a atividade, bem como promotores do tipo selvagem controlados pelo regulon GAL (PGAL1, PGAL10, PGAL2, PGAL7). A figura foi modificada de Zhao et al.12. Clique aqui para ver uma versão maior desta figura.

Figura 2: Fermentações de duas e três fases através do tempo. (A) Fermentações em duas fases operadas com circuitos invertidos consistem em uma fase de crescimento orientada pela luz e uma fase de produção escura. Na fase de crescimento, a biomassa se acumula à medida que a via de produção permanece reprimida. Ao atingir o OD600 desejado, as células são deslocadas para o escuro para ajustar metabolicamente antes de serem resuspendidas em novas mídias para a fase de produção. (B) Em um processo trifásica, as fases de crescimento, incubação e produção são definidas por cronogramas de luz únicos, que podem consistir em um período de crescimento escuro, incubação pulsada e fase de produção totalmente iluminada. Figura criada com Biorender. Clique aqui para ver uma versão maior desta figura.
Circuitos optogenéticos também foram desenvolvidos para controle dinâmico da produção química e proteica em E. coli. Os circuitos optoLAC controlam o repressor LacI bacteriano usando o circuito pDawn responsivo à luz, que é baseado no sistema de dois componentes YF1/FixJ6 (Figura 3). Semelhante ao OptoINVRT5, os circuitos OptoLAC são projetados para reprimir a expressão genética na luz e induzi-la no escuro. Os níveis de expressão usando circuitos OptoLAC podem corresponder ou exceder aqueles alcançados com indução isopropílico padrão β-d-1-thiogalactopyranoside (IPTG), mantendo assim a força da indução química ao mesmo tempo que oferece maior sintonia e reversibilidade6. Portanto, os circuitos OptoLAC permitem um controle optogenético eficaz para a engenharia metabólica em E. coli.
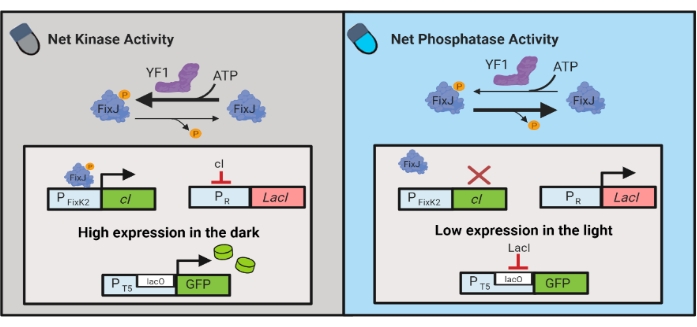
Figura 3: Circuitos OptoLAC para controle dinâmico de E. coli. Os circuitos OptoLAC adaptam o sistema pDawn e operon de lac para alcançar ativação no escuro e repressão à luz. No escuro, o YF1 fosforila fixJ, que então ativa o promotor PFixK2 para expressar o repressor cI . O repressor de IC impede a expressão do repressor lacI do promotor de PR , que permite a transcrição do gene de interesse de um promotor contendo lacO. Por outro lado, a luz azul reduz a atividade de quinase líquida YF1, invertendo a fosforilação fixJ e, portanto, a expressão cI , que deprime a expressão do lacI e impede a expressão do promotor contendo lacO. O número foi modificado de Lalwani et al.6. Clique aqui para ver uma versão maior desta figura.
Descrevemos aqui os protocolos básicos para fermentações controladas pela luz de S. cerevisiae e E. coli para produção química ou proteica. Para a levedura e as bactérias, primeiro focamos em fermentações com uma fase de crescimento impulsionada pela luz e uma fase de produção induzida pela escuridão habilitada pelos circuitos OptoINVRT e OptoLAC. Posteriormente, descrevemos um protocolo para uma fermentação trifásica (crescimento, indução, produção) controlada por luz habilitada pelos circuitos OptoAMP. Além disso, descrevemos como escalar fermentações optogeneticamente controladas de microplacos a bioreatores em escala de laboratório. Com este protocolo, pretendemos fornecer um guia completo e facilmente reprodutível para a realização de fermentações controladas por luz para produção química ou proteica.
Protocolo
1. Produção química controlada por luz utilizando o circuito S. cerevisiae OptoINVRT7
- Construção de cepa
- Obtenha uma cepa com sua3 auxotrofia, pois este marcador é necessário para a maioria dos plasmídeos OptoINVRT existentes5. Se buscar a regulação optogenética de um gene nativo de S. cerevisiae, construa uma cepa na qual qualquer cópia endógena do gene seja excluída.
- Linearize o plasmídeo contendo o circuito OptoINVRT7, como o EZ-L4395, e integre-o no his3-locus da cepa auxotrófica usando métodos padrão de transformação de lítio-acetato15. Se usar o plasmídeo EZ-L439, que contém os componentes para reprimir O PGAL1 na luz e ativá-lo no escuro, linearize-o no local de restrição do PmeI.
- Após a transformação, centrifugar as células a 150 x g por 1 min e suavemente resuspend em 200 μL de meio completo sintético de histidina fresco (SC-His).
- Emplaque todo o volume celular em placas de ágar SC-Seu e incubar a 30 °C por 2-3 dias até que as colônias apareçam.
- Prepare células competentes dessa cepa usando protocolos padrão de transformação de acetato de lítio e transforme-as com um plasmídeo contendo os genes para serem controlados optogeneticamente a jusante do promotor PGAL1-M ou PGAL1-S5.
NOTA: O uso de um plasmídeo que se integra em δ-locais (YARCdelta5) e seleciona com Zeocin permite integração multicópia estável7,16,17,18. - Após a transformação, centrifugar a cultura a 150 x g por 1 min e suavemente resuspend em 200 μL de meio sc-dropout fresco.
NOTA: O promotor PGAL1-M é uma versão sintética do promotor PGAL1 com os sites de repressão Mig1p excluídos, enquanto o PGAL1-S é uma versão projetada do PGAL1-M, que tem sites extras de ligação do ativador Gal4p. O promotor PGAL1 regular pode ser usado para controlar a expressão; no entanto, a força de expressão será menor do que esses promotores projetados. - Plaque o volume inteiro da célula em uma placa de ágar extrato de levedura peptone dextrose (YPD) se integrando-se em δ-locais, ou uma placa de evasão sc se transformar com um plasmídeo contendo um marcador de seleção. Incubar a 30 °C por 16 h sob luz azul constante para manter o gene otogeneticamente controlado reprimido.
NOTA: Para algumas cepas, as colônias podem crescer mais rapidamente quando incubadas em pulsos de luz azul (por exemplo, 1 s on/79 s off, 5 s on/75 s off, 10 s on/70 s off, etc.) em vez de em iluminação constante, que deve ser determinada experimentalmente para cada cepa, se necessário. - Use qualquer fonte de luz de 465 nm e coloque um painel LED ~40 cm acima da placa de tal forma que a intensidade da luz seja ~80-110 μmol/m2/s. Meça a intensidade usando um medidor quântico (ver Tabela de Materiais).
- Se integrar em δ-sites, crie uma réplica da placa em placas YPD contendo uma gama de concentrações de Zeocina entre 400 μg/mL e 1.200 μg/mL para selecionar para uma variedade de números de cópia de integração5,7,12,16,17,18. Incubar as placas de réplica a 30 °C sob luz azul constante ou pulsada por 2-3 dias até que as colônias apareçam.
- Triagem preliminar para as melhores colônias
- Selecione oito colônias de cada placa e use-as para vacinar 1 mL de SC-Seu meio complementado com 2% de glicose em poços individuais de uma placa de 24 poços. Cresça em placas de 24 poços sob as células durante a noite (16-20 h) a 30 °C com 200 rpm (diâmetro orbital de 19 mm) tremendo sob iluminação constante de luz azul.
- Na manhã seguinte, diluir cada cultura em 1 mL de um sc-seu médio fresco com 2% de glicose a OD600 valores variando de 0,01-0,3 e crescer em placas de 24 poços sob luz constante ou pulsada a 30 °C com 200 rpm tremendo até atingirem densidades celulares entre 2 e 9 valores OD600 (Figura 4A). A quantidade de tempo necessária para esta fase de crescimento dependerá da tensão.
- Incubar as placas no escuro por 4h a 30 °C com 200 rpm tremendo desligando o painel de luz e enrolando as placas em papel alumínio.
NOTA: Esta etapa permite que as células transitem metabolicamente para a fase de produção antes da ressuspensão na mídia de produção. - Para iniciar a fase de produção, centrifugar as culturas na placa de 24 poços a 234 x g por 5 min e resuspend células em 1 mL de sc-dropout médio fresco com 2% de glicose. Sele as placas para evitar a evaporação do produto desejado usando fita de vedação microplatéria estéril.
- Fermente as placas seladas no escuro por 48h a 30 °C com agitação a 200 rpm. Certifique-se de que as placas estão enroladas em papel alumínio para evitar qualquer exposição à luz.
NOTA: Embrulhar as placas em papel alumínio não limita a disponibilidade de oxigênio ou gás nas fermentações; no entanto, a fita de vedação estéril limita a transferência de gás. Pequenos orifícios podem ser cutucados na fita para introduzir oxigênio, se necessário.
- Colheita e análise
- Para colher as fermentações, centrifufique as placas por 5 min a 234 x g e transfira 800 μL do supernatante em tubos de microcentrifuuge de 1,5 mL.
- Dependendo do produto químico de interesse, analise usando cromatografia líquida de alto desempenho (HPLC), espectrometria de cromatografia-massa gasosa (GC-MS), ou outro método analítico utilizando a técnica de preparação da amostra mais adequada para o instrumento utilizado.
2. Produção de proteína controlada por luz utilizando o sistema E. coli OptoLAC
- Construção de cepa
- Co-transforme eletrocompetente BL21 DE3 ΔlacI ΔlacI-DE3 com um plasmídeo contendo o circuito OptoLAC1B ou OptoLAC2B6 e um plasmídeo que expressa a proteína recombinante de interesse do promotor PT719.
- Após a transformação, recupere as células por 1 h em 1 mL de caldo super ótimo com repressão catabólito (SOC; 2% tripla, extrato de levedura de 0,5%, 10 mM NaCl, 2,5 mM KCl, 10 mM MgCl2, 10 mM MgSO4, 20 mM de glicose) a 37 °C com rotação ou agitação.
NOTA: O plasmídeo contendo a proteína de interesse deve ser compatível com o plasmídeo OptoLAC (ou seja, marcador de resistência diferente e origem da replicação) e não deve conter uma cópia de lacI. - Centrifugar as células a 4845 x g por 3 min e concentrar a pelota em 200 μL de caldo de lysogenia (LB). Coloque as células concentradas em uma placa de ágar LB com antibióticos apropriados e cresça a 37 °C durante a noite sob luz azul constante para manter a expressão proteica reprimida.
- Triagem inicial para verificar a expressão
- Pegue três colônias simples e use-as para vacinar 1 mL de mídia LB com antibióticos apropriados em poços individuais de uma placa de 24 poços. Cresça durante a noite (16-20 h) a 37 °C com 200 rpm tremendo sob iluminação constante de luz azul (Figura 4A).
- No dia seguinte, use 1,5 μL de cultura para medir OD600 em um espectrofotômetro com uma medição de microvolume. Culturas diluídas em 1 mL de LB fresco em placas de 24 poços a valores OD600 que variam de 0,01-0,1.
- Cresça as culturas a 37 °C com 200 rpm tremendo sob luz azul por 2-3 h. A partir da segunda hora, faça medições de OD600 a cada 15 minutos para garantir que as culturas não superem a faixa OD600 de 0,1-1,5.
- Uma vez que as culturas estejam no OD600 desejado, desligue o painel de luz e enrole a placa em papel alumínio para iniciar a fase de produção. Mantenha a placa no escuro por 8h (37 °C), 20 h (30 °C) ou 48 h (18 °C), com 200 rpm tremendo.
- Medir e registrar o valor final de OD600 de cada cultura.
- Colheita e análise
- Transfira 800 μL de cada cultura para um tubo de microcentrifuuge de 1,5 mL e centrífuga por 5 min a 17.000 x g.
- Resuspense a pelota de célula em 200 μL de tampão de ressuspensão (Tris 50 mM, pH 8.0, NaCl 300 mM).
NOTA: A concentração de NaCl pode ser ajustada com base na proteína recombinante que está sendo analisada. - Adicione 50 μL de 6x sulfato de sódio (SDS) tampão de amostra (Tris 375 mM, pH 6.8, SDS 9%, glicerol 50%, azul bromofenol 0,03%, DTT 9%). Incubar a 100 °C por 10 min com agitação a 700 rpm em um termomixer.
- Carregue ~3-20 μL da cultura em um gel SDS-PAGE de 12%. Utilizando a medição final de OD600 como guia, carregue aproximadamente a mesma quantidade de proteína para cada amostra (equivalente a 10 μL da amostra correspondente a um valor final de OD600 de 1). Use uma fonte de alimentação para executar a eletroforese a 100 V até que o gel esteja totalmente resolvido.
- Colora o gel com solução G-250 azul brilhante Coomassie aquecendo para 30-40 s em um forno de micro-ondas, e depois incubando em um rotador de plataforma por pelo menos 15 minutos.
- Enxágüe com água deionizada duas vezes e desestir em um rotador de plataforma por pelo menos 30 minutos (ou durante a noite), adicionando dois lenços de limpeza amarrados em um nó para ajudar a absorver a mancha. Ferva o gel em quantidade suficiente de água no forno micro-ondas por 15 minutos para acelerar o processo de desinsindúnte.
3. Fermentação trifásica utilizando o sistema S. cerevisiae OptoAMP
- Construção de cepa
- Obtenha uma cepa com um marcador auxotrófico his3 , pois este marcador é necessário para usar os plasmídeos OptoAMP existentes5. Se buscar a regulação optogenética de um gene nativo de S. cerevisiae, construa uma cepa na qual a cópia endógena deste gene seja excluída.
- Linearize um plasmídeo contendo o circuito OptoAMP4, como o EZ-L58012, e integre-o no lócus his3 da cepa auxotrófica usando métodos padrão de transformação de lítio-acetato15. Se usar OZ-L580, linearize o plasmídeo no local de restrição do PmeI.
- Após a transformação, centrifugar as células a 150 x g por 1 min e suavemente resuspend em 200 μL de SC-Seu médio fresco.
- Emplaque todo o volume celular em mídia seletiva (SC-His-ágar) e incubar a 30 °C por 2-3 dias até que as colônias apareçam.
- Prepare células competentes dessa cepa e transforme-as com um plasmídeo contendo os genes para serem controlados optogeneticamente a jusante do promotor PGAL1-S12.
NOTA: O uso de um plasmídeo que se integra em δ locais e seleciona com Zeocin permite integração e seleção de multicópias estáveis. - Depois de transformar, centrifugar a cultura a 150 x g por 1 min e suavemente resuspend em 200 μL de médio sc-dropout fresco.
NOTA: O promotor PGAL1-S é uma versão sintética do promotor PGAL1 no qual os sites de repressão Mig1p são excluídos e sites extras de vinculação do ativador Gal4p são adicionados. O promotor PGAL1 regular pode ser usado; no entanto, a força de expressão será menor do que este promotor projetado. - Emplaque todo o volume celular em uma placa de ágar YPD ou SC-dropout e incubar a 30 °C por 16 h no escuro (envolto em papel alumínio). A incubação no escuro mantém o gene otogeneticamente controlado reprimido, o que permite que as células direcionem seus recursos metabólicos para o crescimento celular em vez de produção química.
- Se integrar em δ-sites, a réplica de placas YPD contendo uma série de concentrações de Zeocin para selecionar para uma variedade de números de cópia de integração. Incubar as placas a 30 °C no escuro (embrulhado em papel alumínio) por 2-3 dias até que as colônias apareçam.
- Triagem preliminar para as melhores colônias
- Selecione oito colônias de cada placa e use-as para vacinar 1 mL de SC-Seu meio com 2% de glicose em poços individuais de uma placa de 24 poços. Cresça as células durante a noite (16-20 h) no escuro a 30 °C com 200 rpm tremendo.
- Na manhã seguinte, diluir cada cultura em 1 mL de SC-Seu médio fresco com 2% de glicose a 0,1 OD600 e crescer no escuro a 30 °C com 200 rpm tremendo até atingir um OD600 de 3. Enrole as placas em papel alumínio para evitar a exposição à luz. A quantidade de tempo necessária para esta fase de crescimento dependerá da tensão.
- Para iniciar a fase de indução, incubar as placas sob luz pulsada (por exemplo, 5 s on/95 s off) por 12 h a 30 °C com 200 rpm tremendo. Use qualquer fonte de luz de 465 nm e coloque um painel led acima da placa de tal forma que a intensidade da luz seja ~80-110 μmol/m2/s para obter resultados ótimos (Figura 4A).
NOTA: A duração ideal do pulso de luz para esta incubação variará de acordo com o produto químico produzido. Recomenda-se a triagem de uma série de horários de luz de 0,1% (por exemplo, 1 s em 999 s off) a 100% (luz completa). - Para iniciar a fase de produção, centrifugar as culturas a 234 x g por 5 min e resuspend em SC-Seu médio fresco com 2% de glicose. Sele as placas para evitar a evaporação do produto desejado usando fita de vedação microplata estéril.
- Fermente as placas seladas em luz por 48h a 30 °C com agitação a 200 rpm. Otimize o cronograma de luz durante esta etapa, pois alguns produtos químicos se beneficiam de uma fase de produção pulsada em vez de luz total.
- Colheita e análise
- Colher as fermentações por centrifugação das placas por 5 min a 234 x g e transferir 800 μL do supernante em tubos de microcentrifuuge de 1,5 mL.
- Dependendo do produto químico de interesse, analise usando HPLC, GC-MS ou outro método analítico utilizando a técnica de preparação da amostra mais adequada para o instrumento utilizado.
4. Produção química (mevalonato) de E. coli em um bioreator controlado pela luz
- Inoculação inicial e configuração do bioreator
- Inocula uma colônia de uma cepa E. coli projetada com produção química controlada pela luz em 5 mL de sais mínimos M9 (3,37 mM Na2HPO4, 2,2 mM KH2PO4, 0,855 mM NaCl, 0,935 mM NH4Cl) suplementados com 0,2% w/v casaminoácidos, 5% w/v de glicose e mistura de metais trace20 (0,0084 g/L EDTA, 0,0025 g/L CoCl2, 0,015 g/L MnCl2, 0,0015 g/L CuCl2, 0,003 g/L H3BO3, 0,0025 g/L Na2MoO4, 0,008 g/L ZnCl2, 0,06 g/L Fe (III) citrato, 0,0045 g/L thiamine, 1,3 g/L MgSO4) em um tubo conlical de 50 m.
- Cresça a cultura durante a noite a 30 °C com 200 rpm tremendo sob iluminação de luz azul.
- Configure a placa principal do vaso bioreator, certificando-se de que as seguintes portas estejam instaladas: inserir para sonda térmica; sonda de oxigênio dissolvido (DO); sparger de gás - conectar-se à fonte de ar através de um filtro de 0,2 μm; impulsor; condensador de gás - conecte-se a um filtro de 0,2 μm; linha de resfriamento (x2); linhas de alimentação (x2) - uma para adição de mídia, outra para controle de pH; linha de amostragem - garantir que atinja a parte inferior do vaso; porto vazio; pH sonda - calibrar a sonda com padrões de pH = 4 e pH = 7 antes da instalação, seja autoclave com o resto do vaso ou esterilizar com 95% de etanol e asepticamente inserir antes da configuração.
- Encha o recipiente com 1 L de água filtrada, e conecte a placa da cabeça e aperte, certificando-se de que o anel O se encaixa e sela.
- Cubra qualquer abertura no reator com papel alumínio.
- Prepare três tiras de tubulação: uma para a remoção da água, uma para inserção da ração e outra para controle de pH. Cubra as extremidades com papel alumínio e enrole toda a tubulação em papel alumínio.
NOTA: O NH4OH, que é usado para ajuste de pH, não flui suavemente em tubos de silicone, o que pode levar a taxas de fluxo imprecisas e sobre-basificação da cultura. Para evitar esse problema, use tubos de bomba biocompatíveis (BPT) para a alimentação NH4OH. - Autoclave o bioreator e tubo, usando um ciclo líquido de 30 minutos.
- Remova os materiais da autoclave. Uma vez frio o suficiente para manusear, conecte as sondas impeller, pH e DO, fonte de ar, entrada e saída do condensador, e entrada e saída de resfriamento à estação de controle.
- Insira a sonda térmica e cubra a nave com uma jaqueta de aquecimento. Fixar a jaqueta em direção ao topo do vaso para evitar bloquear a cultura da exposição à luz.
- Conecte um dos tubos estéreis à linha de amostragem e fixe através da bomba de amostragem. Coloque a outra extremidade de tal forma que ela flua em um recipiente vazio que pode conter pelo menos 1 L. Drene a água dentro do vaso.
- Conecte outro tubo estéril a uma das linhas de alimentação e proteja através de uma das bombas de alimentação. Conecte a outra extremidade do tubo a uma garrafa de mídia M9. Alimente a mídia para o reator.
- Conecte outro tubo estéril a uma das linhas de alimentação e proteja através de uma das bombas de alimentação. Conecte a outra extremidade do tubo à garrafa contendo 28%-30% NH4OH.
ATENÇÃO: NH4OH é corrosivo. Trabalhe em um capô de fumaça enquanto se transfere para uma garrafa de ração e certifique-se de que a garrafa de alimentação seja colocada em contenção secundária. - Coloque três painéis de luz em uma formação triangular ~20 cm de distância do reator, verificando se as intensidades de luz na superfície do vaso atingem ~80-110 μmol/m2/s de cada lado (Figura 4B).
- No dia seguinte, ligue o sistema bioreator e o refrigerador. Defina o ponto de temperatura do reator para 37 °C, o ponto de 7,0 do pH e a agitação a 200 rpm. A jaqueta de aquecimento deve ligar.
- Calibrar a sonda DO pela primeira vez esperando até que a temperatura e as medições DO se tornem constantes (este será o ponto de setpoint 100%). Em seguida, desconecte a sonda do sistema (este será o setpoint de 0%). Repita até que a medição DO se estabilize em 100% quando a sonda estiver conectada e, em seguida, defina o setpoint DO para 20%.
- Produção química controlada por luz
- Inocular o bioreator a um OD600 inicial de 0,001-0.1. Ligue os painéis de luz para iniciar o crescimento.
- Após 3h, comece a colher amostras da linha amostral para tomar medições de OD600 para evitar o excesso de crescimento da densidade celular ideal de indução (ρs). Uma vez alcançado o ρs ideal (o valor ideal para a produção de mevalonato é 0,17), desligue os painéis de luz, cubra o reator em papel alumínio e enrole a configuração em pano preto para iniciar a fase de produção escura.
- Adicione 50 μL de antifoam, 8h depois de mudar para escuridão. Desaparafusar a porta vazia e pipeta o antifoam diretamente no reator.
- Use a porta de amostragem para coletar periodicamente amostras para análise hplc ou gc.
- Desmontagem e análise
- Depois que o experimento for concluído, desligue o sistema. Desaparafusar cuidadosamente as sondas DO e pH e lavá-las com água e sabão. Desaparafusar a placa da cabeça e lavá-la com água e sabão usando um pincel.
- Transfira a cultura para um recipiente vazio e adicione alvejante a uma concentração final de 10% v/v. Coloque em um capô de fumaça e descarte depois de 30 minutos.
- Lave o vaso do reator com água e sabão usando uma escova.
- Prepare as amostras para análise com base no produto de interesse. Para produção de mevalonato, misture 560 μL de cultura com 140 μL de 0,5 M HCl e vórtice em alta velocidade por 1 min. Isso converte mevalonato em (±)-mevalonolactona.
ATENÇÃO: HCl é um risco para a saúde. Manuseie com EPI adequado e certifique-se de que os tubos de amostra estejam devidamente tampados antes do vórtice. - Centrifugar a 17.000 x g por 45 min a 4 °C. Transfira 250 μL do supernatante para um frasco HPLC.
- Para o mevalonato, analise amostras usando uma coluna de troca de íons ácidos orgânicos. Quantifique a produção usando um detector de índice refrativo (RID), comparando áreas de pico a um padrão de (±)-mevalonolactona.
Resultados
A regulação optogenética do metabolismo microbiano foi implementada com sucesso para produzir uma variedade de produtos, incluindo biocombustíveis, produtos químicos a granel, proteínas e produtos naturais5,6,7,12,13. A maioria desses processos são projetados para que o crescimento celular ocorra à luz (quando a baixa densidade celular apresenta desafi...
Discussão
O controle dinâmico tem sido aplicado há muito tempo para melhorar os rendimentos da engenharia metabólica e da produção de proteínas recombinantes4. Mudanças na expressão enzimática são mais tipicamente implementadas usando indutores químicos como IPTG21, galactose22 e tetraciclina23, mas também foram mediadas usando condições de processo como temperatura e pH. O controle optogenético da expressão genética el...
Divulgações
Os autores solicitaram várias patentes para os circuitos e métodos optogenéticos descritos neste artigo.
Agradecimentos
Esta pesquisa foi apoiada pelo Departamento de Energia dos EUA, Escritório de Ciência, Office of Biological and Environmental Research Award Número DE-SC0019363, o NSF CAREER Award CBET-1751840, The Pew Charitable Trusts e o Camille Dreyfus Teacher-Scholar Award.
Materiais
| Name | Company | Catalog Number | Comments |
| Light-controlled chemical production using S. cerevisiae | |||
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Agar powder | Thermo Fisher Scientific | 303991049 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| EZ-L439 OptoINVRT7 Plasmid | N/A | N/A | See Reference 1 |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| PmeI | New England Biolabs | R0560L | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| Replica-plating device | Thomas Scientific | F37848-0000 | |
| Replica-plating pads | Sunrise Science Products | 3005-012 | |
| SC-His powder | Sunrise Science Products | 1303-030 | |
| SC Complete powder | Sunrise Science Products | 1459-100 | |
| Sterile sealing film | Excel Scientific | STR-SEAL-PLT | |
| YPD agar plates | VWR | 100217-054 | |
| Zeocin | Thermo Fisher Scientific | R25005 | |
| Light-controlled protein production using E. coli | |||
| 6X SDS Sample Buffer | Cepham Life Sciences | 10502 | |
| 12% Acrylamide protein gels | Thermo Fisher Scientific | NP0341BOX | |
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| Coomassie Brilliant Blue G-250 | Thermo Fisher Scientific | 20279 | |
| Electrophoresis cell | Bio-Rad | 1658004 | |
| Electrophoresis power supply | Bio-Rad | 1645050 | |
| LB broth (Miller) | Fisher Scientific | BP97235 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NaCl | Thomas Scientific | SX0425-1 | |
| OptoLAC plasmids | N/A | N/A | See Reference 2 |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SOC medium | Thermo Fisher Scientific | 15544034 | |
| Thermomixer | Eppendorf | 5382000015 | |
| Tris base | Fisher Scientific | BP1521 | |
| Three-phase fermentation using S. cerevisiae | |||
| Same materials as "Light-controlled chemical production using S. cerevisiae" protocol plus the following: | |||
| EZ-L580 OptoAMP4 Plasmid | N/A | N/A | See Reference 10 |
| Chemical production in a light-controlled bioreactor | |||
| Aluminum foil | Reynolds | B004NG90YO | |
| Antifoam | Sigma-Aldrich | A8311 | |
| Bioreactor with control station | Eppendorf | B120110001 | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Bleach | VWR Scientific | 89501-620 (CS) | |
| Blue LED panel | HQRP | 884667106091218 | |
| BPT tubing | Fisher Scientific | 14-170-15 | |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Hydrochloric acid (HCl) | Fisher Scientific | 7647-01-0 | |
| M9 Minimal Salts | Thermo Fisher Scientific | A1374401 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NH4OH Solution | Sigma-Aldrich | I0503-1VL | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SC Complete powder | Sunrise Science Products | 1459-100 |
Referências
- Figueroa, D., Rojas, V., Romero, A., Larrondo, L. F., Salinas, F. The rise and shine of yeast optogenetics. Yeast. 38 (2), 131-146 (2021).
- Pouzet, S., et al. The promise of optogenetics for bioproduction: Dynamic control strategies and scale-up instruments. Bioengineering. 7 (4), 151 (2020).
- Venayak, N., Anesiadis, N., Cluett, W. R., Mahadevan, R. Engineering metabolism through dynamic control. Current Opinion in Biotechnology. 34, 142-152 (2015).
- Lalwani, M. A., Zhao, E. M., Avalos, J. L. Current and future modalities of dynamic control in metabolic engineering. Current Opinion in Biotechnology. 52, 56-65 (2018).
- Zhao, E. M., et al. Design and characterization of rapid optogenetic circuits for dynamic control in yeast metabolic engineering. ACS Synthetic Biology. 9 (12), 3254-3266 (2020).
- Lalwani, M. A., et al. Optogenetic control of the lac operon for bacterial chemical and protein production. Nature Chemical Biology. 17 (1), 71-79 (2021).
- Zhao, E. M., et al. Optogenetic regulation of engineered cellular metabolism for microbial chemical production. Nature. 555 (7698), 683-687 (2018).
- Baumschlager, A., Khammash, M. Synthetic biological approaches for optogenetics and tools for transcriptional light-control in bacteria. Advanced Biology. 5 (5), 2000256 (2021).
- Dvorak, P., et al. Exacerbation of substrate toxicity by IPTG in Escherichia coli BL21(DE3) carrying a synthetic metabolic pathway. Microbial Cell Factories. 14, 201 (2015).
- Hartline, C. J., Schmitz, A. C., Han, Y., Zhang, F. Dynamic control in metabolic engineering: Theories, tools, and applications. Metabolic Engineering. 63, 126-140 (2021).
- Ni, C., Dinh, C. V., Prather, K. L. J. Dynamic control of metabolism. Annual Review of Chemical and Biomolecular Engineering. 12, 519-560 (2021).
- Zhao, E. M., et al. Optogenetic amplification circuits for light-induced metabolic control. ACS Synthetic Biology. 10 (5), 1143-1154 (2021).
- Lalwani, M. A., Zhao, E. M., Wegner, S. A., Avalos, J. L. The Neurospora crassa Inducible Q System Enables Simultaneous Optogenetic Amplification and Inversion in Saccharomyces cerevisiae for Bidirectional Control of Gene Expression. ACS Synthetic Biology. 10 (8), 2060-2075 (2021).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Marx, H., Mecklenbräuker, A., Gasser, B., Sauer, M., Mattanovich, D. Directed gene copy number amplification in Pichia pastoris by vector integration into the ribosomal DNA locus. FEMS Yeast Research. 9 (8), 1260-1270 (2009).
- Nordén, K., et al. Increasing gene dosage greatly enhances recombinant expression of aquaporins in Pichia pastoris. BMC Biotechnology. 11, 47 (2011).
- Zhao, E. M., et al. Light-based control of metabolic flux through assembly of synthetic organelles. Nature Chemical Biology. 15 (6), 589-597 (2019).
- Dowee, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- Zhou, K., Edgar, S., Stephanopoulos, G. Engineering microbes to synthesize plant isoprenoids. Methods in Enzymology. 575, 225-245 (2016).
- Arfman, N., Worrell, V., Ingram, L. O. Use of the tac promoter and lacI(q) for the controlled expression of Zymomonas mobilis fermentative genes in Escherichia coli and Zymomonas mobilis. Journal of Bacteriology. 174 (22), 7370-7378 (1992).
- Steen, E. J., et al. Metabolic engineering of Saccharomyces cerevisiae for the production of n-butanol. Microbial Cell Factories. 7 (1), 1-8 (2008).
- Tan, S. Z., Manchester, S., Prather, K. L. J. Controlling central carbon metabolism for improved pathway yields in Saccharomyces cerevisiae. ACS Synthetic Biology. 5 (2), 116-124 (2015).
- Jayaraman, P., et al. Blue light-mediated transcriptional activation and repression of gene expression in bacteria. Nucleic Acids Research. 44 (14), 6994 (2016).
- Fernandez-Rodriguez, J., Moser, F., Song, M., Voigt, C. A. Engineering RGB color vision into Escherichia coli. Nature Chemical Biology. 13 (7), 706-708 (2017).
- Ding, Q., et al. Light-powered Escherichia coli cell division for chemical production. Nature Communications. 11 (1), 1-14 (2020).
- Senoo, S., Tandar, S. T., Kitamura, S., Toya, Y., Shimizu, H. Light-inducible flux control of triosephosphate isomerase on glycolysis in Escherichia coli. Biotechnology and Bioengineering. 116 (12), 3292-3300 (2019).
- Ramakrishnan, P., Tabor, J. J. Repurposing synechocystis PCC6803 UirS-UirR as a UV-violet/green photoreversible transcriptional regulatory tool in E. Coli. ACS Synthetic Biology. 5 (7), 733-740 (2016).
- Tabor, J. J., Levskaya, A., Voigt, C. A. Multichromatic control of gene expression in escherichia coli. Journal of Molecular Biology. 405 (2), 315-324 (2011).
- Stewart, C. J., McClean, M. N. Design and implementation of an automated illuminating, culturing, and sampling system for microbial optogenetic applications. Journal of Visualized Experiments:JoVE. (120), e54894 (2017).
- Grødem, E. O. S., Sweeney, K., McClean, M. N. Automated calibration of optoPlate LEDs to reduce light dose variation in optogenetic experiments. BioTechniques. 69 (4), 313-316 (2020).
- Gerhardt, K. P., et al. An open-hardware platform for optogenetics and photobiology. Scientific Reports. 6, (2016).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Steel, H., Habgood, R., Kelly, C., Papachristodoulou, A. In situ characterisation and manipulation of biological systems with Chi.Bio. PLoS Biology. 18 (7), (2020).
- Carrasco-López, C., García-Echauri, S. A., Kichuk, T., Avalos, J. L. Optogenetics and biosensors set the stage for metabolic cybergenetics. Current Opinion in Biotechnology. 65, 296-309 (2020).
- Milias-Argeitis, A., Rullan, M., Aoki, S. K., Buchmann, P., Khammash, M. Automated optogenetic feedback control for precise and robust regulation of gene expression and cell growth. Nature Communications. 7 (1), 1-11 (2016).
- Melendez, J., et al. Real-time optogenetic control of intracellular protein concentration in microbial cell cultures. Integrative Biology: Quantitative Biosciences From Nano to Macro. 6 (3), 366-372 (2014).
- Milias-Argeitis, A., et al. In silico feedback for in vivo regulation of a gene expression circuit. Nature Biotechnology. 29 (12), 1114-1116 (2011).
- Castillo-Hair, S. M., Baerman, E. A., Fujita, M., Igoshin, O. A., Tabor, J. J. Optogenetic control of Bacillus subtilis gene expression. Nature Communications. 10 (1), 1-11 (2019).
- Xia, A., et al. Optogenetic modification of pseudomonas aeruginosa enables controllable twitching motility and host infection. ACS Synthetic Biology. 10 (3), 531-541 (2021).
- Pu, L., Yang, S., Xia, A., Jin, F. Optogenetics manipulation enables prevention of biofilm formation of engineered pseudomonas aeruginosa on surfaces. ACS Synthetic Biology. 7 (1), 200-208 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados