Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mikrobiyal Kimyasal ve Protein Üretimi için Işık Kontrollü Fermantasyonlar
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Mikrobiyal metabolizmanın optogenetik kontrolü, fermantasyon süreçleri üzerinde esnek dinamik kontrol sağlar. Buradaki protokol, farklı hacimsel ölçeklerde kimyasal ve protein üretimi için mavi ışık ayarlı fermantasyonların nasıl kurulacağını göstermektedir.
Özet
Mikrobiyal hücre fabrikaları, yenilenebilir hammaddelerden kimyasallar ve rekombinant proteinler üretmek için sürdürülebilir bir alternatif sunmaktadır. Bununla birlikte, bir mikroorganizmanın genetik modifikasyonlarla aşırı yüklenmesi, konakçı uygunluğunu ve verimliliğini azaltabilir. Bu sorun, dinamik kontrol kullanılarak aşılabilir: hücresel büyüme ve üretimi dengelemek için tipik olarak kimyasal veya besin bazlı katkı maddeleri kullanan enzimlerin ve yolakların indüklenebilir ekspresyonu. Optogenetik, gen ekspresyonunu dinamik olarak düzenlemek için invaziv olmayan, yüksek oranda ayarlanabilir ve geri dönüşümlü bir yöntem sunar. Burada, kimyasalların veya rekombinant proteinlerin üretimi için mühendislik ürünü Escherichia coli ve Saccharomyces cerevisiae'nin ışık kontrollü fermantasyonlarının nasıl kurulacağını açıklıyoruz. Gelişmiş fermantasyon kontrolü ve üretkenliği için mikrobiyal büyüme ve üretimi ayırmak için seçilen zamanlarda ve dozajlarda ışığın nasıl uygulanacağını ve en iyi sonuçlar için temel optimizasyon hususlarını tartışıyoruz. Ek olarak, laboratuvar ölçeğinde biyoreaktör deneyleri için ışık kontrollerinin nasıl uygulanacağını açıklıyoruz. Bu protokoller, gelişmiş fermantasyon performansı için mühendislik mikroorganizmalarında optogenetik kontrollerin benimsenmesini kolaylaştırır.
Giriş
Biyolojik süreçlerin ışığa duyarlı proteinlerle kontrolü olan optogenetik, kimyasal ve protein üretimi için mikrobiyal fermantasyonları dinamik olarak kontrol etmek için yeni bir strateji sunar1,2. Mühendislik metabolik yolaklarının yükü ve bazı ara ürünlerin ve ürünlerin toksisitesi genellikle hücre büyümesini bozar3. Bu tür gerilimler zayıf biyokütle birikimine ve üretkenliğin azalmasına neden olabilir3. Bu zorluk, fermantasyonların metabolik kaynakları sırasıyla biyokütle birikimine veya ürün sentezine ayıran bir büyüme ve üretim aşamasına geçici olarak bölünmesiyle ele alınabilir4. Kısa bir süre önce, bu iki fazlı fermantasyonda büyümeden üretime geçişin, aydınlatma koşullarındaki değişikliklerle tetiklenebileceğini gösterdik5,6,7. Işık girdilerinin yüksek ayarlanabilirliği, tersine çevrilebilirliği ve ortogonalitesi8, geleneksel iki fazlı fermantasyonların dinamik kontrolünde kullanılan kimyasal indükleyicilerle çoğaltılması zor veya imkansız olan ışık kontrollü fermantasyonlara benzersiz avantajlar sunar4,9,10,11.
Erythrobacter litoris'ten türetilen mavi ışığa duyarlı EL222 proteini, Saccharomyces cerevisiae5,7,12,13'te metabolik mühendislik için birkaç optogenetik devre geliştirmek için kullanılmıştır. EL222, mavi ışık aktivasyonu (465 nm) üzerine konformasyonel bir kaymaya uğrayan ve konyak DNA dizisine (C120) bağlanmasını sağlayan bir ışık-oksijen-voltaj sensörü (LOV) alanı içerir13. EL222'nin viral VP16 aktivasyon alanına (VP16-EL222) kaynaştırılması, sentetik promotör PC120'den S. cerevisiae7 ve diğer organizmalarda14 gen ekspresyonunu geri dönüşümlü olarak aktive edebilen mavi ışığa duyarlı bir transkripsiyon faktörü ile sonuçlanır. EL222'ye dayanan çeşitli devreler geliştirilmiş ve S. cerevisiae'de kimyasal üretim için kullanılmıştır, örneğin temel ışıkla aktive olan OptoEXP sistemi7 gibi, ilgilenilen genin doğrudan PC120'den ifade edildiği (Şekil 1A). Bununla birlikte, fermantasyonların üretim aşamasında tipik olarak karşılaşılan yüksek hücre yoğunluklarındaki ışık penetrasyonu endişeleri, bizi OptoINVRT ve OptoQ-INVRT devreleri gibi karanlıkta indüklenen ters devreler geliştirmeye motive etmiştir (Şekil 1B)5,7,13. Bu sistemler, sırasıyla S. cerevisiae ve N. crassa'dan galaktoz (GAL) veya kinik asit (Q) regülonlarını kullanır, karşılık gelen baskılayıcılarını (GAL80 ve QS) VP16-EL222 ile kontrol eder, ışıkta gen ekspresyonunu bastırır ve karanlıkta güçlü bir şekilde indükler. OptoEXP ve OptoINVRT devrelerinin birleştirilmesi, gen ekspresyonunun çift yönlü kontrolü ile sonuçlanır ve büyüme fazının mavi ışıkla ve üretim fazının karanlıkla indüklendiği iki fazlı fermantasyonları mümkün kılar (Şekil 2A)5,7.
Üretim aşamasında gen ekspresyonunu indüklemek için karanlık yerine ışık kullanmak, optogenetik kontrollerin yeteneklerini büyük ölçüde genişletecek, ancak aynı zamanda fermantasyonun bu aşamasında tipik olarak karşılaşılan yüksek hücre yoğunluklarının ışık penetrasyon sınırlamalarının üstesinden gelmeyi gerektirecektir. Bu amaçla, mavi ışık stimülasyonuna transkripsiyonel yanıtı yükselten OptoAMP ve OptoQ-AMP olarak bilinen devreler geliştirdik. Bu devreler, sırasıyla GAL veya Q regülasyonlarının transkripsiyonel aktivatörleri Gal4p veya QF2'nin üretimini kontrol etmek için VP16-EL222'nin vahşi tip veya aşırı duyarlı mutantlarını kullanır ve ışıkla daha fazla duyarlılık ve daha güçlü gen ekspresyonu elde eder12,13 (Şekil 1C). OptoAMP devreleri, optik yoğunlukta (600 nm'de ölçülen) 5 L biyoreaktörlerde tam ve homojen ışık indüksiyonu elde edebilir; OD600) sadece ~% 0.35 aydınlatma ile en az 40 değerleri (dökme yüzeyin sadece% ~% 7'sinde% 5 ışık dozu). Bu, %100'e yakın aydınlatma gerektiren OptoEXP'e kıyasla daha yüksek bir hassasiyet derecesi gösterir12. Yüksek hücre yoğunluklarında ışıkla gen ekspresyonunu etkili bir şekilde indükleme yeteneği, fermantasyonların dinamik kontrolü için yeni fırsatlar yaratır. Bu, kimyasal üretimi optimize etmek için benzersiz ışık programlarıyla büyüme, indüksiyon ve üretim aşamalarının oluşturulduğu üç fazlı fermantasyonlar gibi ikiden fazla zamansal fazda çalışan fermantasyonları içerir (Şekil 2B)12.

Resim 1: S. cerevisiae'nin dinamik kontrolü için optogenetik devreler. OptoEXP, OptoINVRT ve OptoAMP devreleri ışığa duyarlı VP16-EL222 sistemine dayanmaktadır. (A) OptoEXP devresinde, mavi ışığa maruz kalmak, DNA bağlayıcı bir alanı açığa çıkaran ve PC120'den transkripsiyona izin veren VP16-EL222'nin konformasyonel bir değişimine ve dimerizasyonuna neden olur. Rakam Zhao ve ark.7'den değiştirilmiştir. (B) OptoINVRT devreleri, karanlıkta ifadeyi indüklemek için GAL (gösterilen) veya Q regülonlarını kullanır. GAL tabanlı devrelerde, VP16-EL222 ve GAL4 yapısal olarak ifade edilirken, PC120, GAL80 baskılayıcısının ifadesini çalıştırır (Q tabanlı devrelerde, GAL4 ve GAL80, sırasıyla QF2 ve QS ile değiştirilir ve GAL promotörü yerine sentetik bir QUAS içeren promotör kullanılır). Işıkta, Gal80p, PGAL1'den ilgili genin aktivasyonunu önler. Karanlıkta, GAL80, PGAL1'in Gal4p tarafından aktive edilmesine izin veren kurucu bir degron alanına (küçük kahverengi alan) kaynaştırılarak eksprese edilmez ve hızla parçalanır. Rakam Zhao ve ark.5'ten değiştirilmiştir. (C) OptoAMP devreleri ayrıca GAL (gösterilmiştir) veya Q regülonlarını kontrol etmek için VP16-EL222 kullanır. Bu devrelerde, GAL80 baskılayıcı (veya QS) yapısal olarak ifade edilir ve karanlıkta sıkı bastırma sağlayan ışığa duyarlı bir degron (küçük mavi alan) ile kaynaştırılır. PC120 ve aşırı duyarlı VP16-EL222 mutant ekspresyonu, ışıkta PGAL1'i (veya QUAS içeren bir promotörü) güçlü bir şekilde aktive eden ışıkla GAL4'ün (veya QF2'nin) ekspresyonunu kontrol eder. GAL türevi devreler, artan aktiviteye sahip PGAL1-M veya PGAL1-S gibi PGAL1'in mühendislik formlarını ve GAL regulonu (PGAL1, PGAL10, PGAL2, PGAL7) tarafından kontrol edilen vahşi tip promotörleri kullanabilir. Şekil Zhao ve ark.12'den değiştirilmiştir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 2: Zaman içinde iki ve üç fazlı fermantasyonlar. (A) Ters çevrilmiş devrelerle çalıştırılan iki fazlı fermantasyonlar, ışıkla çalışan bir büyüme fazı ve karanlık bir üretim fazından oluşur. Büyüme aşamasında, üretim yolu baskılanmış kaldıkça biyokütle birikir. İstenilen OD600'e ulaştıktan sonra, hücreler üretim aşaması için taze ortamda yeniden askıya alınmadan önce metabolik olarak ayarlanmak üzere karanlığa kaydırılır. (B) Üç fazlı bir süreçte, büyüme, inkübasyon ve üretim aşamaları, karanlık bir büyüme periyodu, darbeli inkübasyon ve tamamen aydınlatılmış üretim aşamasından oluşabilecek benzersiz ışık programları ile tanımlanır. Biorender ile oluşturulan figür. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Optogenetik devreler, E. coli'de kimyasal ve protein üretiminin dinamik kontrolü için de geliştirilmiştir. OptoLAC devreleri, YF1/FixJ iki bileşenli sistem6 tabanlı ışığa duyarlı pDawn devresini kullanarak bakteriyel LacI baskılayıcıyı kontrol eder (Şekil 3). OptoINVRT5'e benzer şekilde, OptoLAC devreleri ışıktaki gen ekspresyonunu bastırmak ve karanlıkta indüklemek için tasarlanmıştır. OptoLAC devrelerini kullanan ekspresyon seviyeleri, standart izopropil β-d-1-tiyogalaktopiranosid (IPTG) indüksiyonu ile elde edilenlerle eşleşebilir veya aşabilir, böylece gelişmiş ayarlanabilirlik ve geri dönüşümlülük sunarken kimyasal indüksiyonun gücünü koruyabilir6. Bu nedenle, OptoLAC devreleri, E. coli'de metabolik mühendislik için etkili optogenetik kontrol sağlar.
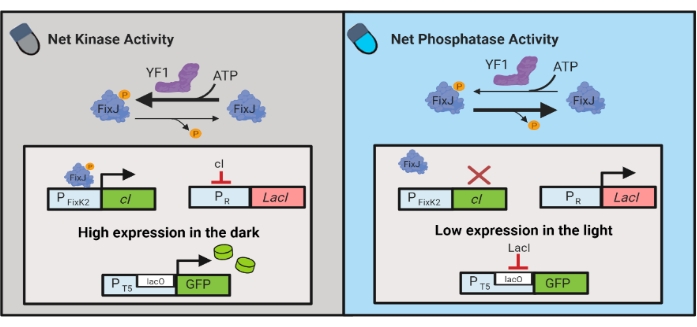
Resim 3: E. coli'nin dinamik kontrolü için OptoLAC devreleri. OptoLAC devreleri, karanlıkta aktivasyon ve ışıkta baskı sağlamak için pDawn sistemini ve lac operonu'yu uyarlar. Karanlıkta, YF1 FixJ'yi fosforile eder, bu da daha sonra cI baskılayıcısını ifade etmek için PFixK2 promotörünü aktive eder. CP baskılayıcı, lacI baskılayıcının PR promotöründen ekspresyonunu önler, bu da lacO içeren bir promotörden ilgilenilen genin transkripsiyonuna izin verir. Tersine, mavi ışık YF1 net kinaz aktivitesini azaltır, FixJ fosforilasyonunu ve dolayısıyla lacI ekspresyonunu baskılayan ve lakO içeren promotörden ekspresyonu önleyen cI ekspresyonunu tersine çevirir. Şekil Lalwani ve ark.6'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Burada, kimyasal veya protein üretimi için S. cerevisiae ve E. coli'nin ışık kontrollü fermantasyonları için temel protokolleri açıklıyoruz. Hem maya hem de bakteriler için, öncelikle OptoINVRT ve OptoLAC devreleri tarafından sağlanan ışık odaklı bir büyüme aşaması ve karanlığa bağlı bir üretim aşaması ile fermantasyonlara odaklanıyoruz. Daha sonra, OptoAMP devreleri tarafından sağlanan üç fazlı (büyüme, indüksiyon, üretim) ışık kontrollü fermantasyon için bir protokol tanımladık. Ayrıca, mikroplakalardan laboratuvar ölçeğindeki biyoreaktörlere kadar optogenetik olarak kontrol edilen fermantasyonların nasıl ölçeklendirileceğini açıklıyoruz. Bu protokolle, kimyasal veya protein üretimi için ışık kontrollü fermantasyonlar gerçekleştirmek için eksiksiz ve kolayca tekrarlanabilir bir kılavuz sağlamayı amaçlıyoruz.
Protokol
1. S. cerevisiae OptoINVRT7 devresini kullanarak ışık kontrollü kimyasal üretim
- Gerinim yapısı
- Bu belirteç mevcut çoğu OptoINVRT plazmidi için gerekli olduğundan3 auxotrophy ile bir suş elde edin5. S. cerevisiae'ye özgü bir genin optogenetik düzenlemesini arıyorsanız, genin herhangi bir endojen kopyasının silindiği bir suş oluşturun.
- EZ-L4395 gibi OptoINVRT7 devresini içeren plazmidi doğrusallaştırın ve standart lityum-asetat transformasyon yöntemlerini kullanarak oksotrofik suşun his3-lokusuna entegre edin15. PGAL1'i ışıkta bastırmak ve karanlıkta etkinleştirmek için bileşenleri içeren EZ-L439 plazmidini kullanıyorsanız, PmeI kısıtlama bölgesinde doğrusallaştırın.
- Transformasyonu takiben, hücreleri 1 dakika boyunca 150 x g'de santrifüj edin ve 200 μL taze histidin-damlama sentetik tam ortam (SC-His) ortamında yavaşça yeniden askıya alın.
- Tüm hücre hacmini SC-His agar plakalarına yerleştirin ve koloniler ortaya çıkana kadar 2-3 gün boyunca 30 ° C'de inkübe edin.
- Standart lityum asetat transformasyon protokollerini kullanarak bu suştan yetkin hücreler hazırlayın ve bunları PGAL1-M veya PGAL1-S promoter5'in aşağı yönünde optogenetik olarak kontrol edilecek genleri içeren bir plazmid ile dönüştürün.
NOT: δ bölgelerinde (YARCdelta5) bütünleşen ve Zeocin ile seçen bir plazmid kullanmak, kararlı çoklu kopya entegrasyonuna olanak tanır7,16,17,18. - Transformasyondan sonra, kültürü 1 dakika boyunca 150 x g'de santrifüj edin ve 200 μL taze SC-bırakma ortamında yavaşça yeniden askıya alın.
NOT: PGAL1-M promotörü, PGAL1 promotörünün Mig1p baskı bölgeleri silinmiş sentetik bir versiyonudur, PGAL1-S ise ekstra Gal4p aktivatör bağlama bölgelerine sahip PGAL1-M'nin tasarlanmış bir versiyonudur. Normal PGAL1 promotörü, ifadeyi kontrol etmek için kullanılabilir; ancak, ifade gücü bu mühendislik destekleyicilerinden daha düşük olacaktır. - Tüm hücre hacmini bir maya ekstraktı pepton dekstroz (YPD) agar plakası üzerine δ bölgelere entegre edilirse veya bir seçim işaretleyicisi içeren bir plazmid ile dönüşüyorsa bir SC-bırakma plakası üzerine plakalayın. Optogenetik olarak kontrol edilen geni bastırmak için sabit mavi ışık altında 16 saat boyunca 30 ° C'de inkübe edin.
NOT: Bazı suşlar için, koloniler, gerekirse her bir gerinim için deneysel olarak belirlenmesi gereken sabit aydınlatmadan ziyade, mavi ışık darbelerinde (örneğin, 1 s açık / 79 s kapalı, 5 s açık / 75 s kapalı, 10 s açık / 70 s kapalı, vb.) inkübe edildiğinde daha hızlı büyüyebilir. - Herhangi bir 465 nm ışık kaynağı kullanın ve plakanın ~ 40 cm yukarısına, ışık yoğunluğu ~ 80-110 μmol / m2 / s olacak şekilde bir LED panel yerleştirin. Bir kuantum ölçer kullanarak yoğunluğu ölçün (bkz.
- δ alanlarına entegre ediliyorsa, çeşitli entegrasyon kopya numaralarını seçmek için 400 μg / mL ile 1.200 μg / mL arasında bir dizi Zeosin konsantrasyonu içeren YPD plakaları üzerine plakanın bir kopyasını oluşturun5,7,12,16,17,18. Kopya plakaları, koloniler görünene kadar 2-3 gün boyunca sabit veya darbeli mavi ışık altında 30 ° C'de inkübe edin.
- En iyi koloniler için ön tarama
- Her plakadan sekiz koloni seçin ve bunları 24 kuyucuklu bir plakanın bireysel kuyucuklarında% 2 glikoz ile desteklenmiş 1 mL SC-His ortamını aşılamak için kullanın. Sabit mavi ışık aydınlatması altında sallanan 200 rpm (19 mm yörünge çapı) ile 30 ° C'de gece boyunca (16-20 saat) hücrelerin altındaki 24 kuyucuklu plakalarda büyüyün.
- Ertesi sabah, her bir kültürü taze bir SC-His ortamının 1 mL'sinde 0.01-0.3 arasında değişen OD600 değerlerine kadar% 2 glikoz ile seyreltin ve 2 ila 9 OD600 değerleri arasındaki hücre yoğunluklarına ulaşana kadar 200 rpm sallanarak 30 ° C'de sabit veya darbeli ışık altında 24 kuyucuklu plakalarda büyüyün (Şekil 4A). Bu büyüme aşaması için gereken süre, gerilmeye bağlı olacaktır.
- Işık panelini kapatıp plakaları alüminyum folyoya sararak plakaları 30 ° C'de 4 saat boyunca karanlıkta 200 rpm sallayarak inkübe edin.
NOT: Bu adım, hücrelerin üretim ortamında yeniden süspansiyondan önce metabolik olarak üretim aşamasına geçmesini sağlar. - Üretim aşamasına başlamak için, 24 kuyucuklu plakadaki kültürleri 5 dakika boyunca 234 x g'de santrifüj edin ve hücreleri% 2 glikoz ile 1 mL taze SC-dropout ortamında yeniden askıya alın. İstenilen ürünün buharlaşmasını önlemek için steril mikroplaka sızdırmazlık bandı kullanarak plakaları kapatın.
- Sızdırmaz plakaları karanlıkta 30 ° C'de 48 saat boyunca 200 rpm'de çalkalayarak fermente edin. Işığa maruz kalmayı önlemek için plakaların alüminyum folyoya sarıldığından emin olun.
NOT: Plakaların folyoya sarılması, fermantasyonlarda oksijen veya gaz mevcudiyetini sınırlamaz; Bununla birlikte, steril sızdırmazlık bandı gaz transferini sınırlar. Gerekirse, oksijen vermek için bantta küçük delikler açılabilir.
- Hasat ve analiz
- Fermantasyonları hasat etmek için, plakaları 234 x g'de 5 dakika boyunca santrifüj yapın ve süpernatantın 800 μL'sini 1.5 mL mikrosantrifüj tüplerine aktarın.
- İlgilenilen kimyasala bağlı olarak, yüksek performanslı sıvı kromatografisi (HPLC), gaz kromatografisi-kütle spektrometresi (GC-MS) veya kullanılan cihaz için en uygun numune hazırlama tekniğini kullanan başka bir analitik yöntem kullanarak analiz yapın.
2. E. coli OptoLAC sistemi kullanılarak ışık kontrollü protein üretimi
- Gerinim yapısı
- Elektroremejman BL21 DE3 ΔlacI ΔlacI-DE3'ü, OptoLAC1B veya OptoLAC2B devresini6 içeren bir plazmid ve PT7 promotöründen19 ilgi duyulan rekombinant proteini ifade eden bir plazmid ile birlikte dönüştürün.
- Dönüştürdükten sonra, hücreleri 1 mL'lik süper optimal et suyunda 1 saat boyunca katabolit bastırma (SOC; % 2 tripton,% 0.5 maya ekstresi, 10 mM NaCl, 2.5 mM KCl, 10 mM MgCl2, 10 mM MgSO4, 20 mM glikoz) ile 37 ° C'de rotasyon veya sallama ile geri kazanın.
NOT: İlgilenilen proteini içeren plazmid, OptoLAC plazmidi (yani, farklı direnç belirteci ve replikasyon kökeni) ile uyumlu olmalı ve lacI'nin bir kopyasını içermemelidir. - Hücreleri 3 dakika boyunca 4845 x g'de santrifüj edin ve peleti 200 μL lizojen et suyu (LB) ortamında yoğunlaştırın. Tüm konsantre hücreleri uygun antibiyotiklerle bir LB agar plağına yerleştirin ve protein ekspresyonunu bastırmak için sabit mavi ışık altında gece boyunca 37 ° C'de büyür.
- İfadeyi doğrulamak için ilk tarama
- Üç tek koloni alın ve bunları 24 delikli bir plakanın bireysel kuyucuklarında uygun antibiyotiklerle 1 mL LB ortamını aşılamak için kullanın. Sabit mavi ışık aydınlatması altında sallanan 200 rpm ile 37 ° C'de gece boyunca (16-20 saat) büyütün (Şekil 4A).
- Ertesi gün, OD600'ü mikro hacim ölçümüne sahip bir spektrofotometrede ölçmek için 1,5 μL kültür kullanın. Kültürleri 24 delikli plakalarda 1 mL taze LB halinde 0,01-0,1 arasında değişen OD600 değerlerine kadar seyreltin.
- Kültürleri 37 ° C'de 2-3 saat boyunca mavi ışık altında sallanan 200 rpm ile büyütün. İkinci saatten başlayarak, kültürlerin OD600 aralığının 0,1-1,5 aralığını aşmamasını sağlamak için her 15 dakikada bir OD600 ölçümleri alın.
- Kültürler istenen OD600'e ulaştığında, ışık panelini kapatın ve üretim aşamasını başlatmak için plakayı alüminyum folyoya sarın. Plakayı karanlıkta 8 saat (37 °C), 20 saat (30 °C) veya 48 saat (18 °C) boyunca 200 rpm sallayarak saklayın.
- Her kültürün son OD600 değerini ölçün ve kaydedin.
- Hasat ve analiz
- Her kültürün 800 μL'sini 1,5 mL'lik bir mikrosantrifüj tüpüne aktarın ve 17.000 x g'de 5 dakika boyunca santrifüj yapın.
- Hücre peletini 200 μL resüspansiyon tamponunda (Tris 50 mM, pH 8.0, NaCl 300 mM) yeniden askıya alın.
NOT: NaCl konsantrasyonu, analiz edilen rekombinant proteine göre ayarlanabilir. - 50 μL 6x sodyum dodesil sülfat (SDS) numune tamponu ekleyin (Tris 375 mM, pH 6.8, SDS% 9, gliserol % 50, bromofenol mavisi% 0.03, DTT% 9). Bir termomikserde 700 rpm'de sallayarak 10 dakika boyunca 100 ° C'de inkübe edin.
- Kültürün ~3-20 μL'sini %12'lik bir SDS-PAGE jeline yükleyin. Son OD600 ölçümünü kılavuz olarak kullanarak, her numune için yaklaşık olarak aynı miktarda protein yükleyin (1'in son OD600 değerine karşılık gelen numunenin 10 μL'sine eşdeğer). Jel tamamen çözülene kadar elektroforezi 100 V'ta çalıştırmak için bir güç kaynağı kullanın.
- Jeli Coomassie parlak mavi G-250 çözeltisi ile bir mikrodalga fırında 30-40 s ısıtarak ve daha sonra bir platform rotatöründe en az 15 dakika inkübe ederek sabitleyin.
- Deiyonize suyla iki kez durulayın ve lekeyi emmeye yardımcı olmak için bir düğüme bağlı iki temizleme mendili ekleyerek bir platform rotatöründe en az 30 dakika (veya gece boyunca) destain yapın. Leke giderme işlemini hızlandırmak için jeli mikrodalga fırında 15 dakika boyunca yeterli miktarda suda kaynatın.
3. S. cerevisiae OptoAMP sistemini kullanarak üç fazlı fermantasyon
- Gerinim yapısı
- Mevcut OptoAMP plazmidlerini kullanmak için bu belirteç gerekli olduğundan, his3 öxotrofik belirteci ile bir suş elde edin5. S. cerevisiae'ye özgü bir genin optogenetik düzenlemesini arıyorsanız, bu genin endojen kopyasının silindiği bir suş oluşturun.
- EZ-L58012 gibi OptoAMP4 devresini içeren bir plazmidi doğrusallaştırın ve standart lityum-asetat transformasyon yöntemlerini kullanarak oksotrofik suşun his3 lokusuna entegre edin15. EZ-L580 kullanıyorsanız, PmeI kısıtlama bölgesinde plazmidi doğrusallaştırın.
- Transformasyonu takiben, hücreleri 1 dakika boyunca 150 x g'de santrifüj edin ve 200 μL taze SC-His ortamında yavaşça askıya alın.
- Tüm hücre hacmini seçici ortam (SC-His-agar) üzerine yerleştirin ve koloniler ortaya çıkana kadar 2-3 gün boyunca 30 ° C'de inkübe edin.
- Bu suştan yetkin hücreler hazırlayın ve bunları PGAL1-S promotörünün optogenetik olarak aşağı yönünde kontrol edilecek genleri içeren bir plazmid ile dönüştürün12.
NOT: δ bölgelerinde bütünleşen ve Zeocin ile seçen bir plazmid kullanmak, kararlı çoklu kopya entegrasyonu ve seçimi sağlar. - Dönüştürdükten sonra, kültürü 1 dakika boyunca 150 x g'de santrifüj edin ve 200 μL taze SC-bırakma ortamında yavaşça askıya alın.
NOT: PGAL1-S promotörü, PGAL1 promotörünün Mig1p baskı sitelerinin silindiği ve ekstra Gal4p aktivatör bağlama sitelerinin eklendiği sentetik bir sürümüdür. Normal PGAL1 promotörü kullanılabilir; ancak, ifade gücü bu mühendislik destekçisinden daha düşük olacaktır. - Tüm hücre hacmini bir YPD veya SC-dropout agar plakasına yerleştirin ve karanlıkta 16 saat boyunca 30 ° C'de inkübe edin (alüminyum folyoya sarılı). Karanlıkta kuluçkaya yatmak, optogenetik olarak kontrol edilen geni bastırır, bu da hücrelerin metabolik kaynaklarını kimyasal üretimden ziyade hücre büyümesine yönlendirmelerini sağlar.
- δ entegre ediliyorsa, çeşitli entegrasyon kopya numaralarını seçmek için bir dizi Zeocin konsantrasyonu içeren YPD plakalarına kopya plaka yerleştirin. Plakaları karanlıkta 30 ° C'de (alüminyum folyoya sarılı) koloniler görünene kadar 2-3 gün boyunca inkübe edin.
- En iyi koloniler için ön tarama
- Her plakadan sekiz koloni seçin ve bunları 24 kuyucuklu bir plakanın bireysel kuyucuklarında% 2 glikoz ile 1 mL SC-His ortamını aşılamak için kullanın. Hücreleri karanlıkta gece boyunca (16-20 saat) 30 ° C'de 200 rpm sallayarak büyütün.
- Ertesi sabah, her kültürü 1 mL taze SC-His ortamında% 2 glikoz ile 0.1 OD600'e kadar seyreltin ve 30 ° C'de karanlıkta büyür ve 200 rpm sallanarak 3'lük bir OD600'e ulaşana kadar sallanır. Işığa maruz kalmayı önlemek için plakaları alüminyum folyoya sarın. Bu büyüme aşaması için gereken süre, gerilmeye bağlı olacaktır.
- İndüksiyon fazını başlatmak için, plakaları darbeli ışık altında (örneğin, 5 s açık / 95 s kapalı) 30 ° C'de 12 saat boyunca 200 rpm sallama ile inkübe edin. Herhangi bir 465 nm ışık kaynağı kullanın ve optimum sonuçlar için ışık yoğunluğu ~ 80-110 μmol / m2 / s olacak şekilde plakanın üzerine bir LED panel yerleştirin (Şekil 4A).
NOT: Bu inkübasyon için optimum ışık darbesi süresi, üretilen kimyasala bağlı olarak değişecektir. %0,1 (örneğin, 999 sn'de 1 sn) ile %100 (tam ışık) arasında değişen ışık programlarının taranması önerilir. - Üretim aşamasına başlamak için, kültürleri 5 dakika boyunca 234 x g'de santrifüj edin ve% 2 glikoz ile taze SC-His ortamında yeniden askıya alın. İstenilen ürünün buharlaşmasını önlemek için steril mikroplaka sızdırmazlık bandı kullanarak plakaları kapatın.
- Sızdırmaz plakaları 30 ° C'de 48 saat boyunca ışıkta fermente edin ve 200 rpm'de çalkalayın. Bu adımda ışık programını optimize edin, çünkü bazı kimyasallar tam ışık yerine darbeli bir üretim aşamasından yararlanır.
- Hasat ve analiz
- Plakaları 234 x g'de 5 dakika boyunca santrifüj yaparak ve süpernatantın 800 μL'sini 1.5 mL mikrosantrifüj tüplerine aktararak fermantasyonları toplayın.
- İlgilenilen kimyasala bağlı olarak, kullanılan cihaz için en uygun numune hazırlama tekniğini kullanarak HPLC, GC-MS veya başka bir analitik yöntem kullanarak analiz edin.
4. Işık kontrollü bir biyoreaktörde E. coli'den kimyasal (mevalonat) üretimi
- İlk aşılama ve biyoreaktör kurulumu
- Işık kontrollü kimyasal üretimle tasarlanmış bir E. coli suşu kolonisini, 5 mL M9 minimum tuza (3,37 mM Na2HPO4, 2,2 mM KH2PO4, 0,855 mM NaCl, 0,935 mM NH4Cl) aşılayın ve %0,2 w/v kasamino asitler, %5 w/v glikoz ve eser metal karışımı20 (0,0084 g/L EDTA, 0,0025 g/L CoCl2, 0,015 g/L MnCl2, 0,0015 g/L CuCl2, 0,003 g/L H3BO3, 0,0025 g/L Na2MoO4, 0,008 g/L ZnCl2, 0,06 g/L Fe (III) sitrat, 0,0045 g/L tiamin, 1,3 g/L MgSO4) 50 mL konik tüp içinde.
- Mavi ışık aydınlatması altında sallanan 200 rpm ile kültürü gece boyunca 30 ° C'de büyütün.
- Aşağıdaki portların takıldığından emin olarak biyoreaktör kabı kafa plakasını ayarlayın: termal prob için takın; çözünmüş oksijen (DO) probu; gaz ayırıcı - 0,2 μm'lik bir filtreyle hava kaynağına bağlayın; çark; gaz kondenseri - 0,2 μm'lik bir filtreye bağlayın; soğutma hattı (x2); besleme hatları (x2) - biri ortam ilavesi için, biri pH kontrolü için; örnekleme hattı - geminin dibine ulaştığından emin olun; boş bağlantı noktası; pH probu - probu kurulumdan önce pH = 4 ve pH = 7 standartlarıyla kalibre edin, kabın geri kalanıyla otoklav yapın veya% 95 etanol ile sterilize edin ve kurulumdan önce aseptik olarak yerleştirin.
- Kabı 1 L filtrelenmiş suyla doldurun ve kafa plakasını takın ve O-ringin sıkıca oturduğundan ve sızdırmazlık sağladığından emin olarak sıkın.
- Reaktörün içindeki açıklıkları alüminyum folyo ile örtün.
- Üç boru şeridi hazırlayın: biri suyu çıkarmak için, biri beslemeyi yerleştirmek için ve biri pH kontrolü için. Uçları alüminyum folyo ile örtün ve tüm boruları alüminyum folyoya sarın.
NOT: pH ayarı için kullanılan NH4OH, silikon borularda düzgün bir şekilde akmaz, bu da yanlış akış hızlarına ve kültürün aşırı bazlanmasına neden olabilir. Bu sorunu önlemek için, NH4OH beslemesi için biyouyumlu pompa borusu (BPT) kullanın. - 30 dakikalık bir sıvı döngüsü kullanarak biyoreaktörü ve boruyu otoklav edin.
- Malzemeleri otoklavdan çıkarın. Başa çıkmak için yeterince soğuduktan sonra, pervane, pH ve DO problarını, hava kaynağını, kondenser giriş ve çıkışını ve soğutma giriş ve çıkışını kontrol istasyonuna bağlayın.
- Termal probu takın ve kabı bir ısıtma ceketi ile örtün. Kültürün ışığa maruz kalmasını önlemek için ceketi kabın üst kısmına doğru sabitleyin.
- Steril tüplerden birini numune alma hattına bağlayın ve numune alma pompasından sabitleyin. Diğer ucu, en az 1 L tutabilen boş bir kaba akacak şekilde yerleştirin.
- Başka bir steril tüpü besleme hatlarından birine bağlayın ve besleme pompalarından birine sabitleyin. Tüpün diğer ucunu bir şişe M9 ortamına bağlayın. Medyayı reaktöre besleyin.
- Başka bir steril tüpü besleme hatlarından birine bağlayın ve besleme pompalarından birine sabitleyin. Tüpün diğer ucunu% 28 -% 30 NH4OH içeren şişeye bağlayın.
DİKKAT: NH4OH aşındırıcıdır. Bir yem şişesine aktarırken bir davlumbazda çalışın ve yem şişesinin ikincil muhafazaya yerleştirildiğinden emin olun. - Reaktörden ~20 cm uzakta üçgen bir formasyona üç ışık paneli yerleştirin ve kabın yüzeyindeki ışık yoğunluklarının her iki taraftan ~80-110 μmol / m2 / s'ye ulaştığını kontrol edin (Şekil 4B).
- Ertesi gün, biyoreaktör sistemini ve soğutucuyu açın. Reaktör sıcaklığı ayar noktasını 37 °C'ye, pH ayar noktasını 7,0'a ve ajitasyonu 200 rpm'ye ayarlayın. Isıtma ceketi açılmalıdır.
- Önce sıcaklık ve DO ölçümleri sabit hale gelene kadar bekleyerek DO probunu kalibre edin (bu% 100 ayar noktası olacaktır). Ardından, probu sistemden ayırın (bu% 0 ayar noktası olacaktır). Prob bağlandığında DO ölçümü %100'de stabilize olana kadar tekrarlayın ve ardından DO ayar noktasını %20 olarak ayarlayın.
- Işık kontrollü kimyasal üretim
- Biyoreaktörü 0.001-0.1'lik bir ilk OD600'e aşılayın. Büyümeyi başlatmak için ışık panellerini açın.
- 3 saat sonra, optimal indüksiyon hücre yoğunluğunun (ρs) aşırı büyümesini önlemek için OD600 ölçümleri almak için örnekleme hattından numune almaya başlayın. Optimum ρs'ye ulaşıldığında (mevalonat üretimi için en uygun değer 0.17'dir), ışık panellerini kapatın, reaktörü alüminyum folyo ile örtün ve karanlık üretim aşamasını başlatmak için kurulumu siyah beze sarın.
- Karanlığa geçtikten 8 saat sonra 50 μL köpük önleyici ekleyin. Boş portu sökün ve köpük önleyiciyi doğrudan reaktöre pipetleyin.
- HPLC veya GC analizi için periyodik olarak numune almak üzere örnekleme bağlantı noktasını kullanın.
- Sökme ve analiz
- Deney tamamlandıktan sonra sistemi kapatın. DO ve pH problarını dikkatlice sökün ve sabun ve suyla yıkayın. Kafa plakasını sökün ve bir fırça kullanarak sabun ve suyla yıkayın.
- Kültürü boş bir kaba aktarın ve% 10 v / v'lik son konsantrasyona çamaşır suyu ekleyin. Bir duman davlumbazına yerleştirin ve 30 dakika sonra atın.
- Reaktör kabını bir fırça kullanarak sabun ve suyla yıkayın.
- İlgilenilen ürüne göre analiz için numuneleri hazırlayın. Mevalonat üretimi için, 560 μL kültürü 140 μL 0,5 M HCl ile karıştırın ve 1 dakika boyunca yüksek hızda vorteksi karıştırın. Bu, mevalonatı (±)-mevalonolaktona dönüştürür.
DİKKAT: HCl bir sağlık tehlikesidir. Uygun KKD ile tutun ve vorteksten önce numune tüplerinin düzgün bir şekilde kapatıldığından emin olun. - 4 °C'de 45 dakika boyunca 17.000 x g'de santrifüj. Süpernatantın 250 μL'sini bir HPLC şişesine aktarın.
- Mevalonat için, organik asitler iyon değişim sütunu kullanarak numuneleri analiz edin. Bir kırılma indisi dedektörü (RID) kullanarak üretimi ölçün, pik alanları (±)-mevalonolakton standardıyla karşılaştırın.
Sonuçlar
Mikrobiyal metabolizmanın optogenetik düzenlemesi, biyoyakıtlar, dökme kimyasallar, proteinler ve doğal ürünler dahil olmak üzere çeşitli ürünler üretmek için başarıyla uygulanmıştır5,6,7,12,13. Bu işlemlerin çoğu, hücre büyümesinin ışıkta gerçekleşmesi (düşük hücre yoğunluğu ışık penetrasyonu ile minimum zorluklar yaratt...
Tartışmalar
Dinamik kontrol, metabolik mühendislik ve rekombinant protein üretimi için verimi artırmak amacıyla uzun zamandır uygulanmaktadır4. Enzimatik ekspresyondaki kaymalar en tipik olarak IPTG21, galaktoz22 ve tetrasiklin23 gibi kimyasal indükleyiciler kullanılarak uygulanır, ancak sıcaklık ve pH gibi proses koşulları kullanılarak da aracılık edilir. Gen ekspresyonunun optogenetik kontrolü, fermantasyon parametrele...
Açıklamalar
Yazarlar, bu makalede açıklanan optogenetik devreler ve yöntemler için çeşitli patent başvurularında bulunmuşlardır.
Teşekkürler
Bu araştırma ABD Enerji Bakanlığı, Bilim Ofisi, DE-SC0019363 Biyolojik ve Çevresel Araştırma Ofisi Ödül Numarası, NSF KARİYER Ödülü CBET-1751840, Pew Charitable Trusts ve Camille Dreyfus Öğretmen-Akademisyen Ödülü tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Light-controlled chemical production using S. cerevisiae | |||
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Agar powder | Thermo Fisher Scientific | 303991049 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| EZ-L439 OptoINVRT7 Plasmid | N/A | N/A | See Reference 1 |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| PmeI | New England Biolabs | R0560L | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| Replica-plating device | Thomas Scientific | F37848-0000 | |
| Replica-plating pads | Sunrise Science Products | 3005-012 | |
| SC-His powder | Sunrise Science Products | 1303-030 | |
| SC Complete powder | Sunrise Science Products | 1459-100 | |
| Sterile sealing film | Excel Scientific | STR-SEAL-PLT | |
| YPD agar plates | VWR | 100217-054 | |
| Zeocin | Thermo Fisher Scientific | R25005 | |
| Light-controlled protein production using E. coli | |||
| 6X SDS Sample Buffer | Cepham Life Sciences | 10502 | |
| 12% Acrylamide protein gels | Thermo Fisher Scientific | NP0341BOX | |
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| Coomassie Brilliant Blue G-250 | Thermo Fisher Scientific | 20279 | |
| Electrophoresis cell | Bio-Rad | 1658004 | |
| Electrophoresis power supply | Bio-Rad | 1645050 | |
| LB broth (Miller) | Fisher Scientific | BP97235 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NaCl | Thomas Scientific | SX0425-1 | |
| OptoLAC plasmids | N/A | N/A | See Reference 2 |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SOC medium | Thermo Fisher Scientific | 15544034 | |
| Thermomixer | Eppendorf | 5382000015 | |
| Tris base | Fisher Scientific | BP1521 | |
| Three-phase fermentation using S. cerevisiae | |||
| Same materials as "Light-controlled chemical production using S. cerevisiae" protocol plus the following: | |||
| EZ-L580 OptoAMP4 Plasmid | N/A | N/A | See Reference 10 |
| Chemical production in a light-controlled bioreactor | |||
| Aluminum foil | Reynolds | B004NG90YO | |
| Antifoam | Sigma-Aldrich | A8311 | |
| Bioreactor with control station | Eppendorf | B120110001 | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Bleach | VWR Scientific | 89501-620 (CS) | |
| Blue LED panel | HQRP | 884667106091218 | |
| BPT tubing | Fisher Scientific | 14-170-15 | |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Hydrochloric acid (HCl) | Fisher Scientific | 7647-01-0 | |
| M9 Minimal Salts | Thermo Fisher Scientific | A1374401 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NH4OH Solution | Sigma-Aldrich | I0503-1VL | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SC Complete powder | Sunrise Science Products | 1459-100 |
Referanslar
- Figueroa, D., Rojas, V., Romero, A., Larrondo, L. F., Salinas, F. The rise and shine of yeast optogenetics. Yeast. 38 (2), 131-146 (2021).
- Pouzet, S., et al. The promise of optogenetics for bioproduction: Dynamic control strategies and scale-up instruments. Bioengineering. 7 (4), 151 (2020).
- Venayak, N., Anesiadis, N., Cluett, W. R., Mahadevan, R. Engineering metabolism through dynamic control. Current Opinion in Biotechnology. 34, 142-152 (2015).
- Lalwani, M. A., Zhao, E. M., Avalos, J. L. Current and future modalities of dynamic control in metabolic engineering. Current Opinion in Biotechnology. 52, 56-65 (2018).
- Zhao, E. M., et al. Design and characterization of rapid optogenetic circuits for dynamic control in yeast metabolic engineering. ACS Synthetic Biology. 9 (12), 3254-3266 (2020).
- Lalwani, M. A., et al. Optogenetic control of the lac operon for bacterial chemical and protein production. Nature Chemical Biology. 17 (1), 71-79 (2021).
- Zhao, E. M., et al. Optogenetic regulation of engineered cellular metabolism for microbial chemical production. Nature. 555 (7698), 683-687 (2018).
- Baumschlager, A., Khammash, M. Synthetic biological approaches for optogenetics and tools for transcriptional light-control in bacteria. Advanced Biology. 5 (5), 2000256 (2021).
- Dvorak, P., et al. Exacerbation of substrate toxicity by IPTG in Escherichia coli BL21(DE3) carrying a synthetic metabolic pathway. Microbial Cell Factories. 14, 201 (2015).
- Hartline, C. J., Schmitz, A. C., Han, Y., Zhang, F. Dynamic control in metabolic engineering: Theories, tools, and applications. Metabolic Engineering. 63, 126-140 (2021).
- Ni, C., Dinh, C. V., Prather, K. L. J. Dynamic control of metabolism. Annual Review of Chemical and Biomolecular Engineering. 12, 519-560 (2021).
- Zhao, E. M., et al. Optogenetic amplification circuits for light-induced metabolic control. ACS Synthetic Biology. 10 (5), 1143-1154 (2021).
- Lalwani, M. A., Zhao, E. M., Wegner, S. A., Avalos, J. L. The Neurospora crassa Inducible Q System Enables Simultaneous Optogenetic Amplification and Inversion in Saccharomyces cerevisiae for Bidirectional Control of Gene Expression. ACS Synthetic Biology. 10 (8), 2060-2075 (2021).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Marx, H., Mecklenbräuker, A., Gasser, B., Sauer, M., Mattanovich, D. Directed gene copy number amplification in Pichia pastoris by vector integration into the ribosomal DNA locus. FEMS Yeast Research. 9 (8), 1260-1270 (2009).
- Nordén, K., et al. Increasing gene dosage greatly enhances recombinant expression of aquaporins in Pichia pastoris. BMC Biotechnology. 11, 47 (2011).
- Zhao, E. M., et al. Light-based control of metabolic flux through assembly of synthetic organelles. Nature Chemical Biology. 15 (6), 589-597 (2019).
- Dowee, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- Zhou, K., Edgar, S., Stephanopoulos, G. Engineering microbes to synthesize plant isoprenoids. Methods in Enzymology. 575, 225-245 (2016).
- Arfman, N., Worrell, V., Ingram, L. O. Use of the tac promoter and lacI(q) for the controlled expression of Zymomonas mobilis fermentative genes in Escherichia coli and Zymomonas mobilis. Journal of Bacteriology. 174 (22), 7370-7378 (1992).
- Steen, E. J., et al. Metabolic engineering of Saccharomyces cerevisiae for the production of n-butanol. Microbial Cell Factories. 7 (1), 1-8 (2008).
- Tan, S. Z., Manchester, S., Prather, K. L. J. Controlling central carbon metabolism for improved pathway yields in Saccharomyces cerevisiae. ACS Synthetic Biology. 5 (2), 116-124 (2015).
- Jayaraman, P., et al. Blue light-mediated transcriptional activation and repression of gene expression in bacteria. Nucleic Acids Research. 44 (14), 6994 (2016).
- Fernandez-Rodriguez, J., Moser, F., Song, M., Voigt, C. A. Engineering RGB color vision into Escherichia coli. Nature Chemical Biology. 13 (7), 706-708 (2017).
- Ding, Q., et al. Light-powered Escherichia coli cell division for chemical production. Nature Communications. 11 (1), 1-14 (2020).
- Senoo, S., Tandar, S. T., Kitamura, S., Toya, Y., Shimizu, H. Light-inducible flux control of triosephosphate isomerase on glycolysis in Escherichia coli. Biotechnology and Bioengineering. 116 (12), 3292-3300 (2019).
- Ramakrishnan, P., Tabor, J. J. Repurposing synechocystis PCC6803 UirS-UirR as a UV-violet/green photoreversible transcriptional regulatory tool in E. Coli. ACS Synthetic Biology. 5 (7), 733-740 (2016).
- Tabor, J. J., Levskaya, A., Voigt, C. A. Multichromatic control of gene expression in escherichia coli. Journal of Molecular Biology. 405 (2), 315-324 (2011).
- Stewart, C. J., McClean, M. N. Design and implementation of an automated illuminating, culturing, and sampling system for microbial optogenetic applications. Journal of Visualized Experiments:JoVE. (120), e54894 (2017).
- Grødem, E. O. S., Sweeney, K., McClean, M. N. Automated calibration of optoPlate LEDs to reduce light dose variation in optogenetic experiments. BioTechniques. 69 (4), 313-316 (2020).
- Gerhardt, K. P., et al. An open-hardware platform for optogenetics and photobiology. Scientific Reports. 6, (2016).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Steel, H., Habgood, R., Kelly, C., Papachristodoulou, A. In situ characterisation and manipulation of biological systems with Chi.Bio. PLoS Biology. 18 (7), (2020).
- Carrasco-López, C., García-Echauri, S. A., Kichuk, T., Avalos, J. L. Optogenetics and biosensors set the stage for metabolic cybergenetics. Current Opinion in Biotechnology. 65, 296-309 (2020).
- Milias-Argeitis, A., Rullan, M., Aoki, S. K., Buchmann, P., Khammash, M. Automated optogenetic feedback control for precise and robust regulation of gene expression and cell growth. Nature Communications. 7 (1), 1-11 (2016).
- Melendez, J., et al. Real-time optogenetic control of intracellular protein concentration in microbial cell cultures. Integrative Biology: Quantitative Biosciences From Nano to Macro. 6 (3), 366-372 (2014).
- Milias-Argeitis, A., et al. In silico feedback for in vivo regulation of a gene expression circuit. Nature Biotechnology. 29 (12), 1114-1116 (2011).
- Castillo-Hair, S. M., Baerman, E. A., Fujita, M., Igoshin, O. A., Tabor, J. J. Optogenetic control of Bacillus subtilis gene expression. Nature Communications. 10 (1), 1-11 (2019).
- Xia, A., et al. Optogenetic modification of pseudomonas aeruginosa enables controllable twitching motility and host infection. ACS Synthetic Biology. 10 (3), 531-541 (2021).
- Pu, L., Yang, S., Xia, A., Jin, F. Optogenetics manipulation enables prevention of biofilm formation of engineered pseudomonas aeruginosa on surfaces. ACS Synthetic Biology. 7 (1), 200-208 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır