Method Article
تحليل نموذج فأر مرض باركنسون الناجم عن ناقلات الفيروسات المرتبطة بالأدينو التي تشفر α-سينوكلين البشري
In This Article
Summary
يحلل هذا العمل جرعة الناقل ووقت التعرض اللازم للحث على التهاب الأعصاب والتنكس العصبي والإعاقة الحركية في هذا النموذج قبل السريري لمرض باركنسون. يتم تسليم هذه النواقل التي تشفر α-سينوكلين البشري إلى المادة السوداء لتلخيص أمراض سينوكلين المرتبطة بمرض باركنسون.
Abstract
مرض باركنسون هو اضطراب تنكسي عصبي ينطوي على موت الخلايا العصبية الدوبامينية في المسار الزنجي ، وبالتالي ، الفقدان التدريجي للسيطرة على الحركات الطوعية. يتم تشغيل هذه العملية العصبية التنكسية عن طريق ترسب مجاميع البروتين في الدماغ ، والتي تتكون أساسا من α-سينوكلين. أشارت العديد من الدراسات إلى أن الالتهاب العصبي مطلوب لتطوير التنكس العصبي المرتبط بمرض باركنسون. والجدير بالذكر أن العملية الالتهابية العصبية تنطوي على تنشيط الخلايا الدبقية الدقيقة وكذلك تسلل الخلايا التائية الطرفية إلى المادة السوداء (SN). يحلل هذا العمل نموذج الفأر لمرض باركنسون الذي يلخص تنشيط الخلايا الدبقية الصغيرة ، وتسلل الخلايا التائية إلى SN ، والتنكس العصبي للخلايا العصبية الدوبامينية النيجيرية ، والإعاقة الحركية. يتم تحفيز نموذج الفأر هذا لمرض باركنسون من خلال التسليم المجسمة للناقلات الفيروسية المرتبطة بالغدية التي تشفر α-سينوكلين (AAV-hαSyn) من النوع البري البشري في SN. وتم تأكيد التوصيل الصحيح للنواقل الفيروسية إلى SN باستخدام نواقل المكافحة التي تشفر البروتين الفلوري الأخضر (GFP). بعد ذلك ، كيف أثرت جرعة AAV-hαSyn التي تم إعطاؤها في SN على مدى تعبير hαSyn ، وفقدان الخلايا العصبية الدوبامينية النيجيرية ، والضعف الحركي. علاوة على ذلك ، تم تحديد ديناميكيات تعبير hαSyn ، والتنشيط الدبقي الصغير ، وتسلل الخلايا التائية طوال الفترة الزمنية لتطور المرض. وبالتالي ، توفر هذه الدراسة نقاطا زمنية حرجة قد تكون مفيدة لاستهداف أمراض سينوكلين والالتهاب العصبي في هذا النموذج قبل السريري لمرض باركنسون.
Introduction
بعد مرض الزهايمر ، يعد مرض باركنسون ثاني أكثر الأمراض العصبية التنكسية انتشارا في جميع أنحاء العالم. الخلايا العصبية الأولية المتأثرة بمرض باركنسون هي تلك الموجودة في المسار nigrostriatal ، والتي تنتج الدوبامين وتتحكم في الحركة الطوعية. ونتيجة لذلك ، فإن أكثر الأعراض المميزة المرتبطة بهذا الاضطراب هي الإعاقة الحركية. يتضمن هذا المرض أيضا ترسب مجاميع البروتين في الدماغ ، والتي تتكون أساسا من α-سينوكلين (αSyn)1 ، وهو بروتين خلوي مرتبط بأطراف ما قبل المشبكي. وقد أظهرت الأدلة أن توليد الشوائب المسببة للأمراض من αSyn يتم تشغيله عن طريق سوء الطي أو عن طريق بعض التعديلات بعد الترجمة لهذا البروتين2.
والجدير بالذكر أنه تم تأسيس علاقة وثيقة بين علم الأمراض αSyn وفقدان الخلايا العصبية الدوبامينية للمسار nigrostriatal في مرض باركنسون البشري والنماذج الحيوانية 3,4. يمثل فهم كيفية توليد مجاميع αSyn وكيف تحفز موت الخلايا العصبية تحديا كبيرا في هذا المجال. أظهرت مجموعة متزايدة من الدراسات أنه من خلال زيادة الإجهاد التأكسدي ، يعد خلل الميتوكوندريا أحد الأسباب الرئيسية لتوليد مجاميع αSyn2. في الواقع ، العديد من الجينات المرتبطة بخطر مرض باركنسون تشفر البروتينات المشاركة في وظيفة الميتوكوندريا ، والمورفولوجيا ، والديناميكيات 5,6. بالإضافة إلى ذلك ، يشكل الخلل الوظيفي في الليزوزومات ، والذي يؤدي إلى تراكم الميتوكوندريا المختلة وظيفيا و αSyn غير المطوي بشكل خاطئ حدثا رئيسيا آخر يعزز توليد مجاميع αSyn7.
وقد أشارت الأدلة الناشئة إلى أنه بمجرد ترسب مجاميع αSyn في الدماغ ، فإن هذه البروتينات المسببة للأمراض تحفز المستقبلات الشبيهة بالرسوم (TLRs) على الخلايا الدبقية الصغيرة ، وبالتالي تؤدي إلى تنشيط الخلايا الدبقية الدقيقة وبيئة التهابية أولية في المادة السوداء (SN) 8,9. علاوة على ذلك ، تشير الأدلة إلى أن مجاميع αSyn يتم التقاطها وتقديمها بواسطة الخلايا التي تقدم المستضدات إلى الخلايا التائية ، مما يؤدي إلى استجابة مناعية تكيفية خاصة ب αSyn10,11. هذه الخلايا التائية الخاصة ب αSyn تتسلل لاحقا إلى الدماغ ويتم إعادة تحريكها بواسطة الخلايا الدبقية الصغيرة المنشطة ، وبالتالي تعزيز إفراز العوامل السمية العصبية التي تثير الموت العصبي 9,10. ومن المثير للاهتمام ، أن العديد من خطوط الأدلة قد اقترحت أن مجاميع αSyn يتم توليدها أولا في الجهاز العصبي المعوي ثم يتم نقلها عبر العصب المبهم إلى جذع الدماغ12.
تم استخدام العديد من النماذج الحيوانية لمرض باركنسون لسنوات عديدة ، بما في ذلك تلك الناجمة عن إعطاء المواد السامة للأعصاب (أي 6-هيدروكسي دوبامين ، باراكوات ، روتينون ، 1-ميثيل-4-فينيل-1،2،3،6-رباعي هيدروبيريدين) وتلك التي تنطوي على حالات وراثية (أي α-سينوكلين المتحور ، كيناز متكرر غني بالليوسين المتحور 2)13 . على الرغم من أن النماذج التي تنطوي على تنكس عصبي ناجم عن السموم العصبية تكرر بعض جوانب مرض باركنسون ، إلا أن أيا منها لا يلخص جميع الجوانب الأساسية للمرض أو ليست تقدمية13. من ناحية أخرى ، على الرغم من أن نماذج الفئران الجينية التي تنطوي على التعبير عن نسخ متحولة من كيناز 2 المتكرر الغني بالليوسين ، أو الإصدارات المتحولة من α-سينوكلين ، أو الإفراط في التعبير عن α-سينوكلين البشري من النوع البري تؤدي إلى ضعف حركي ، وفي بعض الحالات ، أيضا تطور اعتلال سينوكلينولين ، فإنها لا تتكاثر تنكسا عصبيا بارزا للخلايا العصبية الدوبامينية النيجيرية ، وهو جانب أساسي من مرض باركنسون13 ، 14. تمكن نوع ثالث من النماذج الحيوانية للتنكس العصبي من تلبية معظم الجوانب الأساسية لمرض باركنسون ، وهو التسليم المجسمة للناقلات الفيروسية المرتبطة بالغدية (AAVs) التي تشفر α-سينوكلين البشري (AAV-hαSyn) 14,15. الأهم من ذلك ، تسمح AAVs بنقل الخلايا العصبية بفعالية عالية وعلى المدى الطويل في دماغ الثدييات البالغ. علاوة على ذلك ، فقد ثبت أن التسليم المجسمة ل AAV-hαSyn في SN يعيد إنتاج العديد من الجوانب الأساسية للمرض ، بما في ذلك علم أمراض αSyn ، والتنشيط الدبقي الصغير ، والتنكس العصبي ، والإعاقة الحركية16،17،18،19،20. تقدم هذه الدراسة تحليلا لكيفية تأثير جرعة الناقل الفيروسي والوقت الذي يلي توصيل الناقل الفيروسي على مدى تعبير hαSyn ، والتنكس العصبي ، والالتهاب العصبي في المسار nigrostriatal ، وكذلك درجة الضعف الحركي في نموذج الماوس للتوصيل المجسمة أحادية الجانب ل hαSyn في SN.
Protocol
أجريت جميع الدراسات في إطار الطبعة 8th من دليل رعاية واستخدام الحيوانات المختبرية. تمت الموافقة على البروتوكولات التجريبية من قبل IACUC في Fundación Ciencia & Vida (مؤسسة العلوم من أجل الحياة) ، بما في ذلك تلك التي تنطوي على التخدير والألم والضيق والقتل الرحيم (رقم التصريح P-035/2022).
1. الجراحة المجسمة
- التحضير للجراحة (حوالي 1 ساعة)
- للحفاظ على بيئة معقمة ، ارتد ملابس جراحية مناسبة أثناء الجراحة بأكملها ، بما في ذلك أغطية الأحذية والقناع الجراحي والحاجز الصحي والقفازات والغطاء الجراحي.
- رش 70٪ من الإيثانول على الماوس وجميع المواد الجراحية للحفاظ على بيئة معقمة.
- للحث على التسكين ، حقن الفأر مع كاربروفين 5 ملغ / كغ تحت الجلد (s.c) كل 12 ساعة21 بدءا من 1 ساعة قبل الجراحة وتستمر حتى 3 أيام بعد الجراحة.
- لتخدير الماوس ، ضع الحيوان في غرفة حثية. افتح تدفق الأيزوفلوران بمعدل 0.5٪ ثم قم بزيادته ببطء حتى يصل إلى 5٪ على مدار 5 دقائق تقريبا حتى يفقد الماوس منعكس التصحيح22.
- إزالة الحيوان من غرفة الحث. انقل الحيوان على الفور إلى دائرة غير قابلة لإعادة التنفس باستخدام مخروط أنف بحجم مناسب. الحفاظ على تخدير الفأر مع الايزوفلوران 1٪ طوال فترة الجراحة.
- تأكد من تخدير الماوس بالكامل عن طريق قرص ذيله ومخالبه. عندما لا يتفاعل الماوس مع قرص الذيل والكفوف ، فهذا يعني أن الماوس مخدر تماما.
- حلق رأس الماوس باستخدام المقص. نظف جلد الفأر باستخدام قطعة قطن مع الكلورهيكسيدين 2٪ وإزالة كل الشعر.
- إصلاح رأس الماوس في الإطار المجسم.
- ضع واقيا للقرنية في كلتا عيني الفأر باستخدام قطعة قطن. لمنع تحريض الإجهاد في القوارض الأخرى ، تجنب وجود أي فأر آخر في غرفة الجراحة23.
- الجراحة (حوالي 30 دقيقة)
- نظف رأس الفأر بثلاث جولات من الكلورهيكسيدين بنسبة 2٪ متبوعا بنسبة 70٪ من الإيثانول. كشف الجمجمة باستخدام المواد الجراحية وجعل ثقب رفيع مع حفر في الإحداثيات التالية: الأمامي الخلفي −2.8 ملم، والمتوسط الجانبي 1.4 ملم فيما يتعلق بالخط الإنسي.
- ضع إبرة حقنة 10 ميكرولتر في الحفرة وحرك الإبرة داخل الدماغ ببطء حتى تصل إلى -7.2 مم ظهرية بطنية فيما يتعلق بالجافية24.
- اترك الإبرة في الموضع النهائي لمدة دقيقتين للسماح للأنسجة بالاستقرار قليلا ، ثم حقن 1 ميكرولتر من AAV5-CBA-hαSyn (AAV-hαSyn) أو AAV5-CBA-eGFP (AAV-GFP) أو السيارة (PBS عند درجة الحموضة 7.4 ؛ جراحة صورية) في المادة السوداء اليمنى بمعدل 0.2 ميكرولتر / 30 ثانية.
- اترك الإبرة في نفس الموضع لمدة 5 دقائق بعد تسليم النواقل الفيروسية ثم اسحبها ببطء.
- ما بعد الجراحة (حوالي 5 دقائق)
- أغلق الجرح باستخدام خياطة معقمة مضفرة بالحرير غير قابلة للامتصاص.
- ضع الماوس في القفص المنزلي الذي تم تسخينه مسبقا عن طريق وضعه فوق مرتبة كهربائية ساخنة (25 درجة مئوية).
ملاحظة: يجب الحفاظ على الماوس بمفرده في قفص المنزل حتى يتمكن من المشي دون صعوبة ويلتئم الجرح.
2. تحديد أداء المحرك باستخدام اختبار الشعاع
- التدريب (حوالي 15 دقيقة لكل ماوس)
- بعد اثني عشر أسبوعا من الجراحة المجسمة ، قم بتقييم الأداء الحركي باستخدام نسخة مبسطة من اختبار الشعاع الموصوف قبل25. لهذا الغرض ، استخدم شعاعا أفقيا بطول 25 سم وعرض 3 سم. يجب تغطية سطح الشعاع بشبكة معدنية بمربعات 1 سم ومرتفعة 1 سم فوق الشعاع.
- التقط مقطع فيديو للفأر الذي يعبر شعاع سطح الشبكة من طرف إلى الطرف الآخر من الشعاع ، حيث يوجد القفص المنزلي. تدريب الماوس لمدة 2 أيام قبل تحديد أداء المحرك.
- في اليوم الأول ، قم بتدريب الماوس على المشي عبر الشعاع خمس مرات بدون الشبكة.
- في اليوم الثاني ، قم بتدريب الماوس على المشي عبر الشعاع في وجود الشبكة خمس مرات.
- الاختبار (حوالي 5 دقائق لكل ماوس)
- في اليوم الثالث ، قم بتقييم الأداء الحركي. للقيام بذلك ، حدد عدد الأخطاء التي تقوم بها الكفوف اليسرى أو الكفوف اليمنى بشكل منفصل من خلال مشاهدة مقاطع الفيديو في وضع الحركة البطيئة.
ملاحظة: يتم تعريف الخطأ على أنه عندما لا يخطو مخلب بشكل صحيح على الشبكة ، وبالتالي يصبح مرئيا على جانب الشبكة أو بين الشبكة وسطح الشعاع.
- في اليوم الثالث ، قم بتقييم الأداء الحركي. للقيام بذلك ، حدد عدد الأخطاء التي تقوم بها الكفوف اليسرى أو الكفوف اليمنى بشكل منفصل من خلال مشاهدة مقاطع الفيديو في وضع الحركة البطيئة.
3. معالجة الأنسجة
- التروية عبر القلب (حوالي 15 دقيقة لكل ماوس)
- لتخدير الفأر ، حقن خليط من الكيتامين (80 مجم / كجم) و xylazine (10 mg / kg) داخل الصفاق (i.p) باستخدام حقنة 1 مل وإبرة 27 G26.
- بمجرد تخدير الماوس بالكامل (تم تأكيده كما هو الحال في الخطوة 1.1.6.) ، افتح الصدر بمواد جراحية وكشف القلب.
- ثم أدخل إبرة 21 جم (اجعل الطرف مسطحا باستخدام مثقاب) في البطين الأيسر للقلب.
- عن طريق اقتران الإبرة بأنبوب ، قم بإدخال 50 مل من PBS (الرقم الهيدروجيني 7.4) بمعدل 9.5 مل / دقيقة باستخدام مضخة تمعجية.
- إصلاح الدماغ وحمايته بالتبريد (حوالي 10 دقائق لكل دماغ)
- قم بإزالة الدماغ باستخدام المقص والملقط ، ثم قم بإصلاحه عن طريق الغمر في 5 مل من 4٪ paraformaldehyde في PBS (الرقم الهيدروجيني 7.4) عند 4 درجات مئوية لمدة 24 ساعة.
- بعد ذلك ، ضع الدماغ الثابت في 15 مل من 30٪ من السكروز عند 4 درجات مئوية لمدة 48 ساعة.
- ثم ، ضع الدماغ في 4 مل من محلول الحماية من البرد (20٪ جلسرين و 2٪ DMSO في PBS) واحفظ الدماغ عند -80 درجة مئوية أو استخدمه على الفور في الخطوة التالية.
- الحصول على شرائح الدماغ (حوالي 20 دقيقة لكل دماغ).
ملاحظة: تأكد من وضع الدماغ في كريوستات في وضع مناسب لإجراء تخفيضات إكليلية.- للحصول على شرائح SN ، قم بقطع الدماغ إلى أقسام بسماكة 40 ميكرومتر تبدأ من -2.92 مم وتنتهي عند -3.64 مم24.
- حصاد كل شريحة في بئر (تحتوي على 1 مل من محلول الحماية بالتبريد) من صفيحة من 24 بئرا باتباع ترتيب أمامي خلفي كما هو موضح من قبل25،27،28.
- لإجراء تحليلات كيميائية نسيجية مناعية (القسم 4.) وتحليلات التألق المناعي (القسم 5.) في SN ، اختر ستة أقسام SN إكليلية مأخوذة على فترات منتظمة (120 ميكرومتر) تغطي كامل المدى الوردي الذيلي للنواة (720 ميكرومتر في المجموع) ، كما هو موضح من قبل25،27،28.
- للحصول على شرائح مخططة ، قم بقطع الدماغ إلى أقسام بسماكة 40 ميكرومتر تبدأ من +1.34 مم وتنتهي عند -0.26 مم24.
- احصد كل شريحة في أنبوب تبريد سعة 2 مل (يحتوي على 1 مل من محلول الحماية بالتبريد) باتباع ترتيب أمامي خلفي.
- لإجراء تحاليل كيميائية نسيجية مناعية (القسم 4.) وتحليلات التألق المناعي (القسم 5.) في المخطط ، اختر خمسة أقسام مخططة إكليلية مأخوذة على فترات منتظمة (320 ميكرومتر) تغطي كامل المدى الوردي الذيلي للنواة (1600 ميكرومتر في المجموع).
4. التحليل الكيميائي النسيجي المناعي لتحديد كمية الخلايا العصبية الدوبامين و microgliosis (حوالي 2 أيام)
- للتحليل الكيميائي النسيجي المناعي للشرائح المخططة أو النيجيرية ، ضع مجموعة من خمس شرائح (مخطط) أو ست شرائح (SN) من نفس الدماغ في بئر واحد من صفيحة من 24 بئرا.
- اغسل الأقسام 3x ب 1 مل من PBS ثم احتضنها ب 0.5 مل من 0.03٪ H 2 O2في الميثانول في درجة حرارة الغرفة ومع الإثارة لمدة 30 دقيقة لتعطيل نشاط البيروكسيديز الداخلي.
- اغسل الأقسام 3x ب 1 مل من PBS واحتضنها ب 0.5 مل من محلول الحجب (مصل الماعز 4٪ ، و 0.05٪ Triton X-100 ، و 4٪ BSA في PBS) في درجة حرارة الغرفة ومع الإثارة لمدة 40 دقيقة.
- بعد ذلك ، احتضان مع 0.5 مل من محلول الحجب الذي يحتوي على الجسم المضاد الأساسي (الأرنب المضاد للتيروزين هيدروكسيلاز [TH] pAb المخفف 1: 1000 [انظر الجدول 1] ؛ أو الأرنب المضاد Iba1 الأجسام المضادة المخففة 1: 1000) في درجة حرارة الغرفة ومع الإثارة بين عشية وضحاها.
- اغسل الأقسام 3x ب 1 مل من PBS واحتضنها ب 0.5 مل من محلول الحجب الذي يحتوي على الماعز البيوتينيل المضاد للأرانب pAb (1:500 ، انظر الجدول 1) في درجة حرارة الغرفة ومع الإثارة لمدة 2 ساعة.
- ثم ، اغسل الأقسام 3x ب 1 مل من PBS واحتضنها ب 0.5 مل من avidin المترافق مع البيروكسيديز (1: 5000 ، انظر الجدول 1) في محلول الحجب في درجة حرارة الغرفة ومع الإثارة لمدة 90 دقيقة.
- اغسل الأقسام 3x ب 1 مل من PBS واحتضنها ب 0.5 مل من محلول الركيزة (0.05٪ diaminobenzidine في 0.03٪ H 2 O2/ Trizma-HCl buffer عند الرقم الهيدروجيني 7.6). ارتد قفازات ومعطفا مختبريا لهذه الخطوة ، لأن ديامينوبينزيدين هو مادة مسرطنة محتملة.
- عندما يكون التلطيخ المحدد واضحا (عادة 30 ثانية ل TH و 5 دقائق ل Iba1) ، أخرج محلول الركيزة واغسل الأقسام 3x مع 1 مل من PBS في درجة حرارة الغرفة ومع الإثارة. قم دائما بإجراء التلطيخ المناعي لشرائح جميع الأدمغة المدرجة في نفس التجربة في وقت واحد.
ملاحظة: التلطيخ المحدد ل TH واضح عندما يظهر تلطيخ TH المناعي في منطقة SN ، والذي يعرض شكلا مميزا في الدماغ. يتم تحديد العلامة المحددة ل Iba1 عندما يظهر تلطيخ المناعة Iba1 على شرائح الدماغ الضابطة ذات الأشكال الدبقية الدقيقة النموذجية ، والتي يتم تأكيدها عند مراقبة المجهر. وبهذه الطريقة ، يتم تحديد الوقت الدقيق لعرض الركيزة لتحليل المدينة العالمية للخدمات الإنسانية لكل تجربة واحدة. - قم بتركيب أقسام الدماغ على شرائح زجاجية باستخدام محلول من الجيلاتين بنسبة 0.2٪ في 0.05 M Tris (الرقم الهيدروجيني 7.6). ضع كل مجموعة من خمس شرائح (مخطط) أو ست شرائح (SN) تم الحصول عليها من نفس الدماغ بترتيب روستروكلوي على نفس الشريحة الزجاجية.
- حدد عدد الخلايا العصبية TH+ في SN.
- لتحديد كمية الخلايا العصبية TH+ في SN ، احصل على صور للشرائح الست عند تكبير 20x باستخدام مجهر المجال الساطع ، كما هو موضح قبل25،27،28. استخدم ضبط اللون التالي: درجة حرارة اللون 3200 كلفن ، أحمر سماوي 40٪ ، أخضر أرجواني 39٪ ، أصفر أزرق 54٪ ، جاما 0.5 ، تباين 37 ، سطوع 13 ، تشبع 5.
- باستخدام برنامج Image J ، حدد محيط SN pars compacta في نصف الكرة الذي تم تحليله. تجنب اختيار الخلايا العصبية TH+ من منطقة tegmental البطنية (VTA).
- بعد ذلك ، اطلب من البرنامج حساب المساحة المحددة (عادة 0.04-0.07 مم2 / نصف الكرة الأرضية ، اعتمادا على الوضع الوردي). ثم، باستخدام أداة النقاط المتعددة، ضع علامة على كل خلية عصبية TH+ بنقطة.
- باستخدام أداة النقاط ، اطلب من البرنامج حساب إجمالي عدد النقاط. مع عدد النقاط الكلية (الخلايا العصبية TH+) ومساحة SNpc ، احسب كثافة الخلايا العصبية TH+ / mm2.
- كرر نفس العملية الحسابية في نصفي الكرة الأرضية على شرائح SN الست ثم احسب متوسط الخلايا العصبية TH+ / mm2 على الجانبين الجانبي والمعاكس.
- تحديد عدد الخلايا الدبقية الصغيرة المنشطة في المخطط
- لتحديد كمية الخلايا الدبقية الصغيرة المنشطة في المخطط ، احصل على صورتين في كل نصف كرة لجميع الشرائح المخططة الخمس عند تكبير 20x باستخدام مجهر المجال الساطع ونفس الإعدادات المشار إليها في الخطوة 4.10.1. باستخدام برنامج Image J ، في كل صورة واحدة (تعرض مساحة 660 ميكرومتر × 877 ميكرومتر) ، ضع علامة بنقطة على كل خلية واحدة تعبر عن كثافة Iba1 العالية وشكل الأميبويد باستخدام أداة النقاط المتعددة. باستخدام أداة النقاط ، اطلب من البرنامج حساب إجمالي عدد النقاط.
- مع عدد النقاط الإجمالية ومساحة الصورة ، احسب كثافة الخلايا الدبقية الصغيرة المنشطة (الخلاياالعالية Iba1 / mm2) كما تم إجراؤها قبل29.
| المستضد المستهدف | مقترنة ب | النسيلة | المضيف specie | تفاعل النوع* | التخفيف** |
| التيروزين هيدروكسيلاز | غير متوفر | متعدد النسيلة | أرنب | الماوس، الجرذ، الإنسان | 1/200 - 1/1000 |
| إيبا1 | غير متوفر | وحيد النسيلة | أرنب | الماوس، الجرذ، الإنسان | 1/1000 |
| ألفا سينوكلين | غير متوفر | وحيد النسيلة | أرنب | بشري | 1/150 |
| CD4 | غير متوفر | وحيد النسيلة | جرذ | فأر | 1/250 |
| IgG (H + L) | البيوتينيل | متعدد النسيلة | ماعز | أرنب | 1/500 |
| IgG (H + L) | أليكسا فلور 546 | متعدد النسيلة | ماعز | أرنب | 1/500 |
| IgG (H + L) | أليكسا فلور 647 | متعدد النسيلة | ماعز | أرنب | 1/500 |
| IgG (H + L) | أليكسا فلور 546 | متعدد النسيلة | ماعز | جرذ | 1/500 |
الجدول 1: تخفيفات الأجسام المضادة. غير متوفر وغير قابل للتطبيق. * ، يتم تحديده فقط إذا كانت هناك تفاعلات مع الفأر والجرذان والإنسان ، بغض النظر عن التفاعل مع الأنواع الأخرى. **، يتم تحديد نطاق تخفيف واحد أو تخفيف.
5. تحليل التألق المناعي لتقييم تسلل الخلايا التائية في المسار nigrostriatal (حوالي 2 أيام)
- لتحليل التألق المناعي ل hαSyn أو TH / GFP على شرائح مخططة أو نيجيرية ، ضع مجموعة من خمس شرائح (مخطط) أو ست شرائح (SN) من نفس الدماغ في بئر واحد من صفيحة 24 بئرا.
- اغسل الأقسام 3x ب 1 مل من PBS ثم احتضنها بمحلول حجب 0.5 مل (0.3٪ Triton X-100 و 0.05٪ tween20 و 5٪ BSA في PBS) في درجة حرارة الغرفة ومع الإثارة لمدة 40 دقيقة.
- بعد ذلك ، احتضان مع 0.5 مل من محلول الحجب الذي يحتوي على الجسم المضاد الأساسي (الأرنب المضاد TH pAb المخفف 1:500 ؛ أو الجسم المضاد الأرنب المضاد hαSyn المخفف 1:150 ، انظر الجدول 1) في درجة حرارة الغرفة ومع الإثارة بين عشية وضحاها.
- اغسل الأقسام 3x ب 1 مل من PBS واحتضنها ب 0.5 مل من محلول الحجب الذي يحتوي على الجسم المضاد الثانوي المضاد للأرانب المقترن ب AlexaFluor546 (1:500 ، انظر الجدول 1) و 4′,6-diamidino-2-phenylindole (DAPI ؛ 1:1000) في درجة حرارة الغرفة ومع الإثارة لمدة 2 ساعة. ثم اغسل الأقسام 3x ب 1 مل من PBS.
- قم بتركيب أقسام الدماغ على شرائح زجاجية كما هو موضح أعلاه (الخطوة 4.9). تم الحصول على الصور باستخدام مجهر فلوري مقلوب مقترن بوحدة إمداد بالطاقة.
- لتحليل التألق المناعي ل TH / CD4 / GFP (Foxp3) على شرائح نيغرال ، ضع مجموعة من ست شرائح (SN) من نفس الدماغ في بئر واحد من صفيحة 24 بئرا. اغسل الأقسام 3x ب 1 مل من PBS ثم احتضنها ب 0.5 مل من محلول الحجب (0.5٪ Triton X-100 ، 0.5٪ جيلاتين جلد السمك في PBS) في درجة حرارة الغرفة ومع الإثارة لمدة 2 ساعة.
- احتضان مع 0.5 مل من محلول حجب يحتوي على الأجسام المضادة الأولية الأرانب المضادة TH pAb (1:200 ، انظر الجدول 1) والفئران المضادة CD4 ( 1:250) في 4 درجة مئوية ومع الإثارة بين عشية وضحاها.
- اغسل الأقسام 3x ب 1 مل من PBS واحتضنها ب 0.5 مل من محلول الحجب الذي يحتوي على مضاد للأرانب مقترنا ب AlexaFluor 647 (1:500 ، انظر الجدول 1) ومضاد الفئران المقترن ب AlexaFluor 546 ( 1:500) في درجة حرارة الغرفة ومع الإثارة لمدة 2 ساعة. ثم اغسل الأقسام 3x ب 1 مل من PBS.
- ضع كل مجموعة من ست شرائح (SN) تم الحصول عليها من نفس الدماغ بترتيب روستروكلوي على نفس الشريحة الزجاجية وقم بتركيبها باستخدام Fluoromount G. احصل على صور باستخدام مجهر Leica DMi8. استخدم إعدادات المجهر البؤري المشار إليها في الجدول 2 للحصول على صور من تحليل التألق المناعي.
| اسم شانيل | مكعب | الانبعاثات الموجية | اسم جدول البحث | وقت التعرض | كسب | الدقة XY | الدقة Z |
| قناة 1 | Y5 | 700nm | رمادي | 1,011.727 مللي ثانية | قدرة بئر عالية | 2.237 أم | 24.444 أم |
| قناة 2 | جي إف بي | 525nm | أخضر | 326.851 مللي ثانية | قدرة بئر عالية | 2.237 أم | 24.444 أم |
| قناة 3 | TXR | 630nm | أحمر | 406.344 مللي ثانية | قدرة بئر عالية | 2.237 أم | 24.444 أم |
| قناة 4 | دابي | 460nm | أزرق | 91.501 مللي ثانية | قدرة بئر عالية | 2.237 أم | 24.444 أم |
الجدول 2: إعدادات المجهر البؤري المستخدمة للحصول على صور من تحليل التألق المناعي.
6. التحليل الإحصائي
- لمقارنة البيانات التي تم الحصول عليها من الجانبين الجانبي والمتقابل ، استخدم اختبار t للطالب ثنائي الذيل المقترن.
- لمقارنة البيانات التي تم الحصول عليها من الفئران التي تتلقى AAV-hαSyn ومن الفئران التي تتلقى AAV-GFP أو الجراحة الصورية ، استخدم اختبار t للطالب ثنائي الذيل غير المقترن. ضع في اعتبارك الفروق المعنوية عند < قيم P 0.05.
النتائج
التحقق من صحة التسليم الصحيح لناقلات AAV في الخلايا العصبية الدوبامين في المسار nigrostriatal
لدراسة عمليات الالتهاب العصبي والتنكس العصبي والإعاقة الحركية التي يعززها علم أمراض سينوكلين ، تم استخدام نموذج فأر لمرض باركنسون الناجم عن التسليم المجسمة من جانب واحد لترميز AAV hαSyn في SN 16,17,30,31 (انظر التصميم التجريبي في الشكل التكميلي 1 ). للتحقق من صحة التسليم الصحيح لناقلات AAV في الخلايا العصبية الدوبامينية في المسار nigrostriatal ، تم حقن ترميز AAV GFP (AAV-GFP) في SN ، وبعد 12 أسبوعا ، تم تحليل التألق GFP وتفاعل التيروزين هيدروكسيلاز (TH) المناعي في SN و striatum بواسطة التألق المناعي. لوحظ التألق المرتبط ب GFP حصريا على الجانب الجانبي ، وكان هناك توطين مشترك كبير مع التفاعل المناعي TH في كل من SN والمخطط ، مما يشير إلى التسليم الصحيح لناقلات AAV في الخلايا العصبية الدوبامينية للمسار nigrostriatal (الشكل 1).
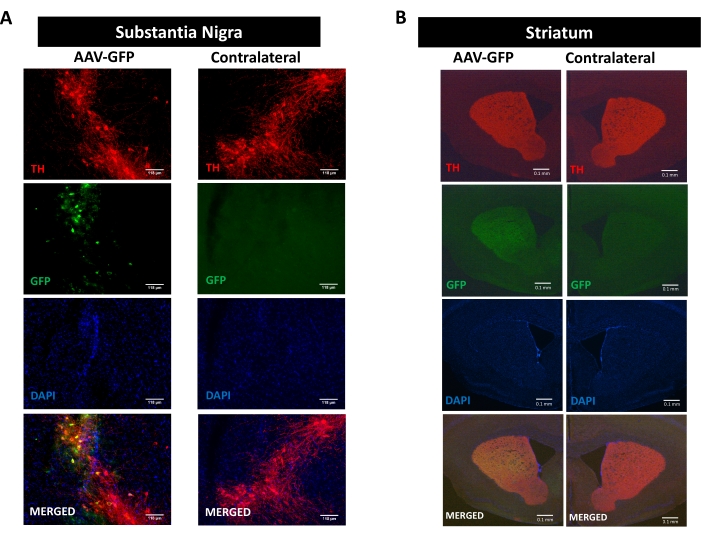
الشكل 1: تحليل تسليم AAV-GFP في المسار nigrostriatal. تلقت الفئران AAV-GFP (1 × 10 10 vg / mouse) وبعد 12 أسبوعا تم التضحية بها ، وتم تضحية TH بالمناعة في (A) SN (قضبان المقياس هي 118 ميكرومتر) و (B) المخطط (قضبان المقياس هي100 ميكرومتر). تم تحليل التألق المرتبط ب TH- و GFP بواسطة المجهر epifluorescence. كانت النوى ملطخة ب DAPI. يتم عرض صور تمثيلية لتلطيخ مدمج أو مفرد ل TH (أحمر) و GFP (أخضر) و DAPI (أزرق). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
إعداد جرعة من الناقل الفيروسي الذي يتم إعطاؤه للحث على التنكس العصبي والإعاقة الحركية في نموذج الفأر لمرض باركنسون الناجم عن AAV-hαSyn
لاختبار جرعة AAV-hαSyn المطلوبة للحث على الإفراط الكبير في التعبير عن hαSyn الذي يعزز التنكس العصبي للخلايا العصبية الدوبامينية النيجيرية ، تم حقن جرعات مختلفة (1 × 108 جينومات فيروسية [vg] / فأر ، 1 × 109 vg / فأر ، أو 1 × 10 10 vg / mouse) من AAV-hαSyn ، وبعد12 أسبوعا ، تم تقييم التفاعل المناعي hαSyn ومدى التفاعل المناعي TH في المسار nigrostriatal. على الرغم من أن التفاعل المناعي hαSyn كان واضحا مع جميع الجرعات التي تم اختبارها في SN (الشكل 2) ، إلا أن الفئران التي تلقت 1 × 1010 vg / mouse فقط قدمت تفاعلا مناعيا واضحا ل hαSyn في المخطط (الشكل 3). علاوة على ذلك ، أظهرت الفئران التي تتلقى 1 × 1010 vg / mouse من AAV-hαSyn خسارة كبيرة في الخلايا العصبية الدوبامينية في SN (الشكل 4A ، B). على الرغم من أن الفئران التي تتلقى 1 × 10 10 vg / mouse من AAV-GFP أظهرت درجة منخفضة (~20٪) من فقدان الخلايا العصبية (الشكل 4A ، B) ، فإن الفئران التي تتلقى نفس الجرعة من AAV-hαSyn قدمت درجة أعلى بكثير من التنكس العصبي للخلايا العصبية الدوبامينية النيجيرية (الشكل 4C). وبناء على ذلك ، تم إجراء المزيد من التجارب باستخدام 1 ×10 10 vg / mouse من AAV-hαSyn. بالإضافة إلى ذلك ، تم تحديد مدى الضعف الحركي في الفئران التي تتلقى جرعات مختلفة من AAV-hαSyn باستخدام اختبار الشعاع (الشكل 5A) ، كما هو موضح قبل25. تم الكشف عن انخفاض كبير في الأداء الحركي حصريا مع 1 ×10 10 vg / mouse من AAV-hαSyn في اختبار الشعاع عند مقارنة عدد الأخطاء التي ارتكبتها المنصات اليمنى واليسرى (الشكل 5B) وعند مقارنة العدد الإجمالي لأخطاء الفئران التي تتلقى AAV-hαSyn مقارنة بالفئران التي تتلقى ناقل التحكم AAV-GFP (الشكل 5C). وبناء على ذلك ، تم إجراء المزيد من التجارب باستخدام 1 ×10 10 vg / mouse من AAV-hαSyn.
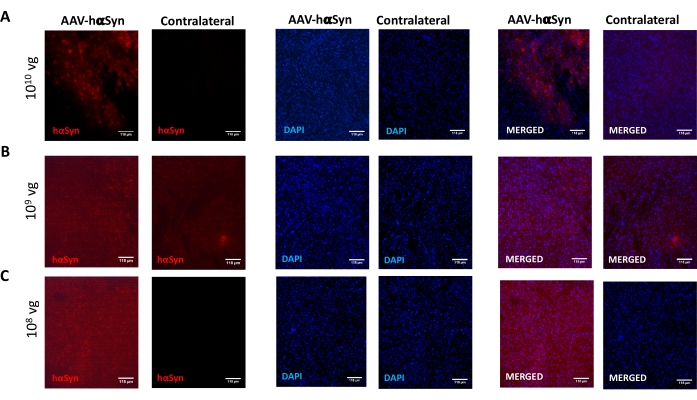
الشكل 2: تحليل تعبير α-سينوكلين البشري في SN للفئران المعالجة بجرعات مختلفة من AAV-hαSyn. تلقت الفئران AAV-hαSyn في (A) 1 × 10 10 vg / mouse ، (B) 1 × 109 vg / mouse ، أو (C) 1 × 108 vg / mouse وبعد12 أسبوعا تم التضحية بها ، وتم تحليل تعبير hαSyn بواسطة التألق المناعي في SN باستخدام المجهر epifluorescence. كانت النوى ملطخة ب DAPI. يتم عرض صور تمثيلية للتلطيخ المدمج أو الفردي ل hαSyn (أحمر) أو DAPI (أزرق). أشرطة المقياس هي 118 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
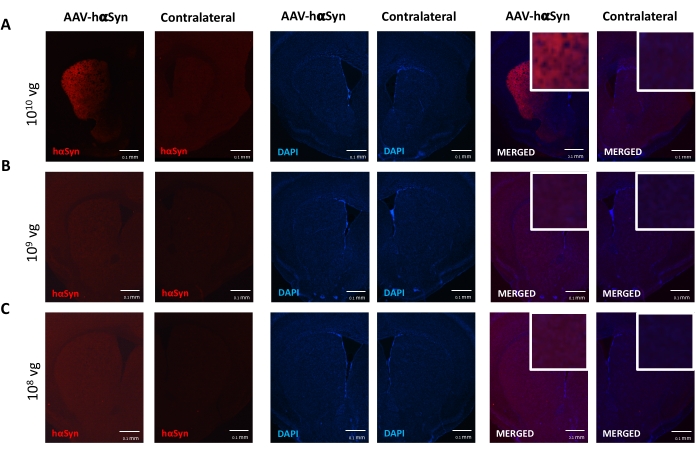
الشكل 3: تحليل تعبير الإنسان α-سينوكلين في مخطط الفئران المعالجة بجرعات مختلفة من AAV-hαSyn. تلقت الفئران AAV-hαSyn في (A) 1 × 10 10 vg / mouse ، (B) 1 × 109 vg / mouse ، أو (C) 1 × 108 vg / mouse) وبعد12 أسبوعا تم التضحية بها ، وتم تحليل تعبير hαSyn بواسطة التألق المناعي في المخطط باستخدام المجهر epifluorescence. كانت النوى ملطخة ب DAPI. يتم عرض صور تمثيلية للتلطيخ المدمج أو الفردي ل hαSyn (أحمر) أو DAPI (أزرق). أشرطة المقياس هي 100 ميكرومتر. يظهر الإدراج في الزاوية العلوية اليسرى من الصور المدمجة منطقة اهتمام بالتكبير الأعلى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
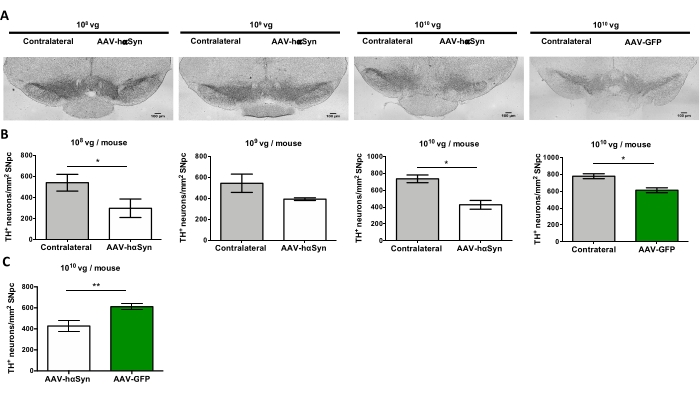
الشكل 4: فقدان الخلايا العصبية الدوبامينية في SN في الفئران المعالجة بجرعات مختلفة من AAV-hαSyn أو ناقلات التحكم. تلقت الفئران AAV-hαSyn (1 × 10 10 vg / mouse ، 1 × 109 vg / mouse ، أو 1 x 108 vg / mouse) أو AAV-GFP (1 x10 10 vg / mouse) وبعد12 أسبوعا تم التضحية بها ، وتم تحليل TH في SNpc بواسطة الكيمياء النسيجية المناعية. (أ) الصور التمثيلية. قضبان المقياس ، 100 ميكرومتر (B ، C) تم تحديد كثافة الخلايا العصبية كميا على أنها عدد الخلايا العصبية TH + / mm2. تمثل البيانات متوسط ± SEM. n = 3-8 فئران لكل مجموعة. (ب) أجريت مقارنة بين الجانبين الجانبي والجانبين المتقابلين باستخدام اختبار t للطالب المقترن ثنائي الذيل. (ج) أجريت مقارنة بين الجوانب الجانبية من الفئران التي تتلقى 1 ×10 10 vg/mouse من AAV-hαSyn أو AAV-GFP. (ب، ج) في حين تشير الأشرطة البيضاء إلى التحديد الكمي للخلايا العصبية TH+ على الجانب الجانبي من الفئران التي تتلقى AAV-hαSyn ، تشير الأشرطة الخضراء إلى تحديد كمية الخلايا العصبية TH+ على الجانب الجانبي من الفئران التي تتلقى AAV-GFP. تشير الأشرطة الرمادية إلى تحديد كمية الخلايا العصبية TH+ على الجانب المقابل للمجموعة المقابلة. تم إجراء المقارنات بواسطة اختبار t للطالب غير المقترن ذو ذيلين. * ص < 0.05 ؛ **ص < 0.01. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
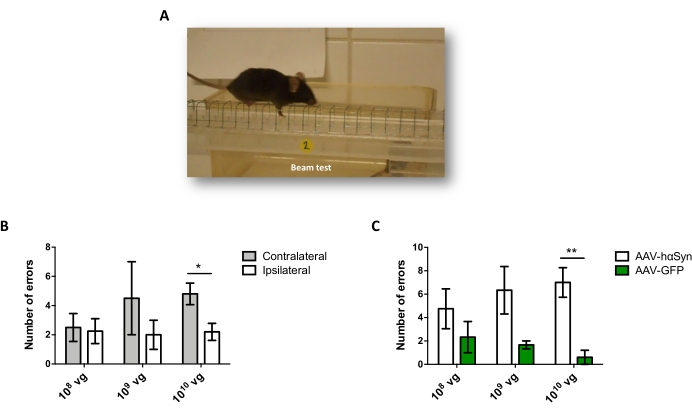
الشكل 5: تحليل الأداء الحركي في الفئران المعالجة بجرعات مختلفة من AAV-hαSyn. تلقت الفئران جرعات مختلفة (1 × 10 10 vg / mouse ، 1 × 109 vg / mouse ، أو 1 × 108 vg / mouse) من AAV-hαSyn أو AAV-GFP ، وبعد12 أسبوعا ، تم تقييم أداء المحرك من خلال اختبار الحزمة. (أ) صورة لفأر يمشي على الشعاع. (ب) تم تحديد عدد الأخطاء التي ارتكبتها الأطراف اليسرى (المعاكسة) مقابل الأطراف اليمنى (ipsilateral) كميا في مجموعات الفئران التي تتلقى AAV-hαSyn. (ج) تمت مقارنة العدد الإجمالي للأخطاء بين المجموعات التجريبية المختلفة التي تتلقى نفس الجرعة من AAV-hαSyn أو AAV-GFP. تمثل البيانات متوسط ± SEM. n = 3-5 فئران لكل مجموعة. تم إجراء المقارنات بواسطة (B) اختبار t للطالب ذي ذيلين أو بواسطة (C) اختبار t للطالب غير المقترن ثنائي الذيل. * ص < 0.05 ؛ **ص < 0.01. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
إعداد حركية نموذج مرض باركنسون الناجم عن AAV-αSyn
بعد تحديد جرعة AAV-hαSyn المناسبة المستخدمة للحث على مستوى كبير من التنكس العصبي والضعف الحركي ، أجريت تجارب لتحديد بداية الإفراط في التعبير hαSyn. لهذا الغرض ، عولجت الفئران ب 1 × 1010 vg / mouse من AAV-hαSyn أو جراحة صورية. تم تحليل مدى تعبير hαSyn في SN مرة واحدة في الأسبوع خلال الأسابيع 2-5 بعد الجراحة المجسمة (انظر التصميم التجريبي في الشكل التكميلي 2). تظهر النتائج أنه على الرغم من اكتشاف تعبير hαSyn بمستويات منخفضة في وقت مبكر من أسابيع 2 بعد الجراحة ، ظهرت مجموعات hαSyn في الأسبوع 5 بعد الجراحة المجسمة (الشكل 6).

الشكل 6: تحليل المسار الزمني للتعبير عن α-سينوكلين البشري في SN للفئران المعالجة ب AAV-hαSyn. تلقت الفئران AAV-hαSyn (1 ×10 10 vg / mouse) أو مجرد جراحة مجسمة زائفة ، وتم تحليل تعبير hαSyn في SN (A) 2 أسابيع ، (B) 3 أسابيع ، (C) 4 أسابيع ، أو (D) بعد 5 أسابيع عن طريق التألق المناعي باستخدام المجهر epifluorescence. كانت النوى ملطخة ب DAPI. يتم عرض صور تمثيلية للتلطيخ المدمج أو الفردي ل hαSyn (أحمر) أو DAPI (أزرق). قضبان المقياس ، 100 ميكرومتر. يظهر الإدراج في الزاوية العلوية اليسرى من الصور المدمجة منطقة اهتمام بالتكبير الأعلى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
بعد ذلك ، أجريت تجارب لتحديد النقاط الزمنية المناسبة لتحليل التهاب الأعصاب وتسلل الخلايا التائية في الجهاز العصبي المركزي (CNS) بعد التسليم المجسمة ل AAV-hαSyn. لتحديد ذروة تنشيط الخلايا الدبقية الدقيقة بعد علاج الفئران باستخدام AAV-hαSyn ، تم تقييم مدى الخلايا التي تعبر عن مستويات عالية من Iba1 في المخطط مرة واحدة في الأسبوع خلال الأسابيع 2-15 بعد الجراحة المجسمة. تظهر النتائج زيادة كبيرة في التنشيط الدبقي الصغير للجانب الجانبي مقارنة بالجانب المقابل للفئران بعد 15 أسبوعا من علاج AAV-hαSyn (الشكل 7). كما تم تقييم عدد خلايا Treg (CD4 + Foxp3 +) التي تسللت إلى SNpc في نقاط زمنية مختلفة بعد التسليم النمطي ل AAV-hαSyn بواسطة التألق المناعي بعد ملاحظة المجهر البؤري. تظهر النتائج أن ذروة تسلل Treg إلى SNpc كانت في 11 أسبوعا بعد الجراحة ، في حين أن مدى تسلل Treg إلى هذه المنطقة من الدماغ كان أقل في الأسبوع 8 أو الأسبوع 13 بعد الجراحة (الشكل 8). لم يتم الكشف عن أي خلايا CD4+ T تتسلل إلى المخطط (البيانات غير معروضة). إجمالا ، تشير هذه النتائج إلى أنه باستخدام 1 × 10 10 vg / mouse من AAV-hαSyn ، فإن أنسب نقطة زمنية لتحليل التهاب الأعصاب هي الأسبوع 15 بعد الجراحة المجسمة ، في حين يبدو أن النقطة الزمنية المناسبة لتحليل تسلل الخلايا التائية إلى الجهاز العصبي المركزي هي الأسبوع11 بعد علاج AAV-hαSyn.
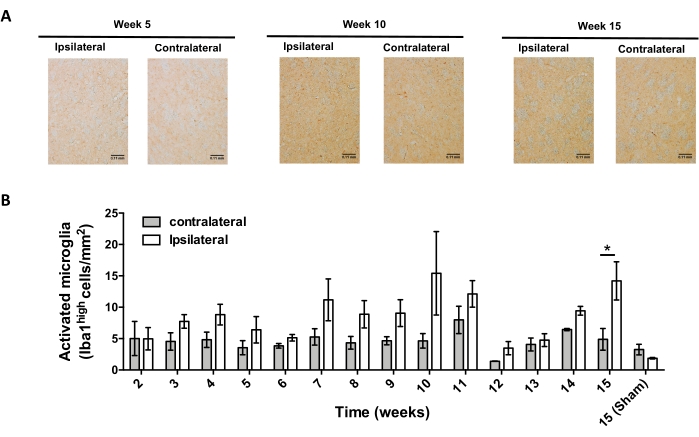
الشكل 7: تحليل المسار الزمني للتنشيط الدبقي الصغير في الفئران الملقحة ب AAV-hαSyn. تلقت الفئران AAV-hαSyn (1 ×10 10 vg / mouse) ، وتم تقييم تنشيط الخلايا الدبقية الدقيقة عن طريق التحليل الكيميائي المناعي ل Iba1 في المخطط في نقاط زمنية مختلفة بعد الجراحة. (أ) يتم عرض صور نظرة عامة تمثيلية للتحليل الكيميائي المناعي ل Iba1 من الفئران التي ضحى بها بعد 5 أسابيع أو 10 أسابيع أو 15 أسبوعا من التلقيح باستخدام AAV-hαSyn. قضبان المقياس ، 110 ميكرومتر (B) تم تحديد كثافة الخلايا الدبقية الصغيرة المنشطة كميا كعدد الخلايا التي تعبر عن مستويات عالية من Iba1 وشكل الأميبويد لكل منطقة. تمثل البيانات متوسط ± SEM. n = 3 فئران لكل مجموعة. تم استخدام اختبار t للطالب ثنائي الذيل لتحديد الفروق الإحصائية بين Iba1 الجانبي والمقابل في كل مجموعة. * ص < 0.05. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
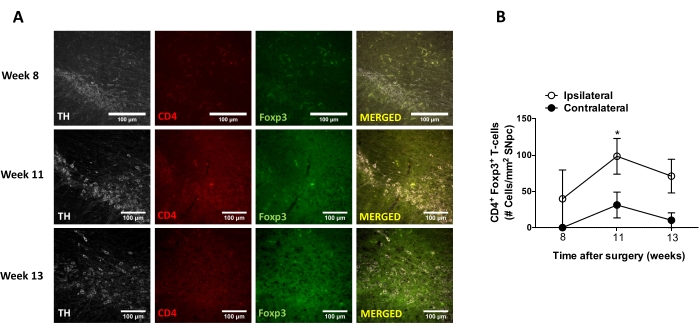
الشكل 8: تحليل المسار الزمني لتسلل الخلايا التائية CD4+ إلى SN للفئران الملقحة ب AAV-hαSyn. تلقت الفئران مراسل Foxp3gfp AAV-hαSyn (1 × 1010 vg / الماوس). تم تحليل وجود خلايا T CD4 + التي تعبر عن Foxp3 ووجود الخلايا العصبية TH+ في نقاط زمنية مختلفة (الأسبوع 8 والأسبوع 11 والأسبوع 13 بعد الجراحة) في SN بواسطة التألق المناعي. (أ) يتم عرض صور تمثيلية للتلطيخ المناعي الفردي أو الدمج. أشرطة المقياس ، 100 ميكرومتر (B) تم تحديد عدد خلايا CD4 + Foxp3 + T لكل منطقة في SN. تمثل البيانات متوسط ± SEM من 3 فئران لكل مجموعة. * p<0.05 ، الخلايا التائية CD4 + Foxp3+ ذات الذيل المزدوج بواسطة اختبار t للطالب ثنائي الذيل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: تصميم تجريبي لتقييم تأثير الجرعات المختلفة من ناقلات AAV على أمراض سينوكلين ، والتنكس العصبي ، والإعاقة الحركية. تم تخدير الفئران الذكور من النوع البري C57BL/6 وتلقت تلقيحا مجسما بجرعات مختلفة (1 × 10 10 vg / mouse ، أو 1 × 109 vg / mouse ، أو 1 ×10 8 vg / mouse) من AAV ترميز α-synuclein البشري (AAV-hαSyn) أو eGFP (AAV-GFP) تحت سيطرة مروج CBA في المادة السوداء اليمنى (SN). بعد 12 أسبوعا ، تم تقييم التعبير عن GFP و hαSyn في SN و striatum (Str) بواسطة التألق المناعي (IF) ، وتم قياس الخلايا الإيجابية لهيدروكسيلاز التيروزين (TH+) بواسطة الكيمياء النسيجية المناعية (IHC) في SN ، وتم تقييم الأداء الحركي بواسطة اختبار الحزمة. يشار إلى عدد الفئران في كل مجموعة تجريبية بين قوسين. * يشير إلى المجموعات التي مات فيها فأر واحد قبل التحليلات. يشير كل تحليل بين قوسين إلى رقم الشكل من متن الورقة حيث يتم عرض النتائج المقابلة. يرجى النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: التصميم التجريبي لتحديد حركية تسلل الخلايا التائية والالتهاب العصبي وتعبير hαSyn. تم تخدير الفئران مراسل Foxp3gfp وتلقت التلقيح التجسيمي ل AAV (1 ×10 10 vg / mouse) ترميز α-synuclein البشري (AAV-hαSyn) تحت سيطرة مروج CBA في المادة السوداء اليمنى (SN) أو الجراحة الصورية (PBS). تم التضحية بالفئران في نقاط زمنية مختلفة ، وتم تقييم التعبير عن hαSyn في SN والمخطط بواسطة التألق المناعي (IF) ، GFP (Foxp3) ، CD4 ، وتم قياس الخلايا الإيجابية لهيدروكسيلاز التيروزين (TH +) بواسطة IF في SN ، وتم تحليل تعبير Iba1 بواسطة الكيمياء المناعية (IHC) في المخطط (Str). يشار إلى عدد الفئران في كل مجموعة تجريبية. يشار إلى نطاق النقاط الزمنية المدرجة في كل تحليل. يشير كل تحليل بين قوسين إلى رقم الشكل من متن الورقة حيث يتم عرض النتائج المقابلة. يرجى النقر هنا لتنزيل هذا الملف.
Discussion
قد يساعد نموذج الفأر للتنكس العصبي الذي تم تحليله هنا في دراسة العديد من الجوانب الحرجة المشاركة في الفيزيولوجيا المرضية لمرض باركنسون ، بما في ذلك الآليات المشاركة في علم أمراض αSyn والتنشيط الدبقي الصغير ، ومشاركة الجهاز المناعي المحيطي في تنظيم الالتهاب العصبي ، وآليات التنكس العصبي. من بين الآليات المشاركة في علم أمراض αSyn هي تلك الآليات دون الخلوية المرتبطة بخلل الميتوكوندريا أو الليزوسومات أو البروتيسومال في وجود حمل مفرط من αSyn في الخلايا العصبية الدوبامين في SN2. من المهم مراعاة أنه بالإضافة إلى تعبير hαSyn الناجم عن النقل بوساطة AAV ، يساهم الماوس الداخلي αSyn أيضا في حمل التعبير الكلي αSyn. الفئران المعدلة وراثيا التي تبالغ في التعبير عن الفئران αSyn تطور أمراض سينوكلين مماثلة ، وعلم الأمراض العصبية ، وضعف حركي لتلك النماذج الفئران على أساس الإفراط في التعبير عن hαSyn32. فيما يتعلق بالتنشيط الدبقي الصغير ، يمكن استخدام نموذج الفأر الحالي لدراسة كيف يمكن للاعبين الجزيئيين والخلويين المختلفين مثل السيتوكينات والناقلات العصبية والخلايا النجمية والخلايا العصبية والحاجز الدموي الدماغي والخلايا التائية تنظيم اكتساب الأنماط الظاهرية الوظيفية المؤيدة للالتهابات أو المضادة للالتهابات 8,10,11 . يشكل هذا النموذج أيضا أداة مهمة لدراسة دور الجهاز المناعي المحيطي ، بما في ذلك ليس فقط الخلايا التائية ولكن أيضا البلاعم والخلايا الوحيدة والعدلات ، على عمليات الالتهاب العصبي والتنكس العصبي للخلايا العصبية النيجيرية11،33،34. وأخيرا ، يمثل نموذج الفأر هذا أيضا نظاما قيما لدراسة الآليات الخلوية والجزيئية للتنكس العصبي في الجسم الحي ، بما في ذلك تلك التي تسببها العمليات الخلوية الداخلية ، مثل الإجهاد التأكسدي ، وعجز الطاقة ، والعضيات التالفة 2 ، أو تلك التي يمارسها اللاعبون الخارجيون ، مثل العوامل السمية العصبية التي تنتجها الخلايا الدبقية الدقيقة ، والخلايا النجمية ، والخلايا التائية السامة للخلايا8 ، 28,29,35.
أحد قيود نموذج الفأر هذا هو دراسة كيف أن التجميع المرضي ل αSyn في مواقع خارج الدماغ قد يشكل المراحل الأولية في تطور مرض باركنسون36. في هذا الصدد ، هناك أدلة متزايدة تشير إلى أنه قبل التنكس العصبي للخلايا العصبية النيجيرية والضعف الحركي ، يبدأ علم أمراض αSyn في الغشاء المخاطي للأمعاء والظهارة الشمية36 ، وربما استجابة الخلايا التائية الخاصة ب αSyn وكذلك12. بعد ذلك ، ستنتقل مجاميع αSyn عبر العصب المبهم إلى جذع الدماغ ، مما يؤدي إلى التهاب الأعصاب والتنكس العصبي للخلايا العصبية الدوبامينية12. على الرغم من أن نموذج AAV-hαSyn يلخص معظم جوانب مرض باركنسون ، إلا أنه لا توجد مشاركة واضحة للتجميع المرضي ل αSyn في مواقع خارج الدماغ في هذا النموذج. قد يكون النموذج البديل الذي يتضمن علم أمراض hαSyn مناسبا لدراسة هذه الجوانب من مرض باركنسون هو الفئران المعدلة وراثيا التي تبالغ في التعبير عن hαSyn تحت سيطرة مروج Thy1 ، نموذج Thy1-SNCA 37 ، حيث يعتمد تطور المرض على ميكروبات الأمعاء وينطوي على ضعف واضح في الجهاز الهضمي38.
على الرغم من أنه مفيد لدراسة العمليات المتنوعة المرتبطة بالفيزيولوجيا المرضية لمرض باركنسون ، إلا أن نموذج الفأر الحالي ينطوي على خطوات حاسمة يجب فحصها بدقة ، بما في ذلك التسليم الصحيح للناقلات الفيروسية في الإحداثيات المكانية المقابلة ، والتعبير الانتقائي عن hαSyn في الخلايا العصبية (التي تعتمد على النمط المصلي AAV وبناء المتجه) ، وجرعة AAV المناسبة وتوقيتها قبل تحليل النمط الظاهري لمرض باركنسون. من الضروري تحليل التوصيل السليم للناقلات الفيروسية في SN ، لأن استخدام الإحداثيات المكانية الصحيحة ل SN قد لا يكون كافيا عندما لا تكون الإبرة مستقيمة تماما ، والتي تكون في بعض الأحيان غير محسوسة للعين البشرية. علاوة على ذلك ، يعتمد انتشار ناقلات AAV على النمط المصلي AAV39. ولهذه الأسباب، من الضروري إجراء ضوابط دورية للجودة للتحقق من التسليم والانتشار الصحيحين لناقلات AAV-GFP المحقونة بعد ملاحظة GFP في شرائح الدماغ التي تحتوي على منطقة SN.
فيما يتعلق بالتعبير الانتقائي ل hαSyn في الخلايا العصبية ، من حيث المبدأ ، يمكن هندسة التعبير عن hαSyn ليتم التحكم فيه من قبل مروج انتقائي للخلايا العصبية أو ، بشكل أكثر دقة ، انتقائي للخلايا العصبية الدوبامينية ، مثل استخدام مروج TH في ناقلات AAV للحث على التعبير الانتقائي للجينات في الخلايا العصبية الدوبامينية40 . ومع ذلك ، فإن هذه الاستراتيجية لا تعمل عندما يكون ما يتم البحث عنه هو التعبير المفرط عن جين الاهتمام. لهذا السبب ، في النموذج الحالي ، من الضروري استخدام مروج قوي (مروج يحفز تعبيرا عاليا عن الجين النهائي) والأنماط المصلية AAV مع الاستوائية العصبية. في هذه الدراسة ، تم استخدام مروج CBA كمروج قوي للحث على الإفراط في التعبير عن hαSyn ، وتم استخدام النمط المصلي AAV5 للناقل الفيروسي. تم استخدام هذا النمط المصلي من قبل لنقل الخلايا العصبية للفئران والفئران41,42. هنا ، أظهرت النتائج أنه بعد 12 أسبوعا من تسليم AAV5-GFP في SN من الفئران ، كان التألق الأخضر موجودا بشكل انتقائي على الجانب الجانبي لكل من SN والمخطط (الشكل 1) ، مما يشير إلى النقل الفعال للخلايا العصبية في المسار nigrostriatal.
جانب آخر حاسم من نموذج الفأر هذا لمرض باركنسون هو النقطة الزمنية المطلوبة لتحليل عملية معينة بعد الجراحة. في هذا الصدد ، يظهر هذا العمل دراسة حركية للعمليات المختلفة التي ينطوي عليها علم الأمراض. نظرا لأن النقاط الزمنية الرئيسية تتغير مع جرعة الجينوم الفيروسي المعطاة لكل فأر ، فإن النمط المصلي ل AAV المستخدم ، أو حتى مع دفعة AAV المستخدمة ، تم إجراء تحليل استجابة الجرعة لكمية AAV-αSyn المطلوبة للحث على فقدان كبير في الخلايا العصبية TH+ والإعاقة الحركية لأول مرة. وقد أظهرت الدراسات السابقة ضعفا حركيا كبيرا وفقدان الخلايا العصبية TH+ في المسار nigrostriatal بعد 12 أسبوعا من حقن AAV-αSyn في الفئران بجرعات تتراوح بين 6 × 108-3 × 10 10 الجينوم الفيروسي لكل فأر 16,17,30,31. وفقا لذلك ، تراوحت جرعة AAV-hαSyn المستخدمة للحث على تعبير hαSyn في المسار nigrostriatal ، وفقدان الخلايا العصبية TH + ، والضعف الحركي في الفئران من 1 × 108-1 × 1010 الجينوم الفيروسي لكل فأر. علاوة على ذلك ، للسيطرة على أن فقدان الخلايا العصبية TH + والضعف الحركي قد تم إجراؤه بسبب الإفراط في التعبير عن hαSyn في SN وليس عن طريق عدوى AAV للخلايا العصبية في SN ، تم تضمين مجموعات التحكم التي تم فيها تسليم ترميز AAV لجين مراسل (AAV-eGFP) من جانب واحد في SN من الفئران وتم تحديد التنكس العصبي والإعاقة الحركية. أظهرت النتائج أنه بعد 12 أسبوعا من الجراحة المجسمة ، كان 1 ×10 10 جينومات فيروسية لكل فأر جرعة مناسبة من AAV5-hαSyn ، حيث أظهرت الفئران التي تتلقى هذا الحمل الفيروسي hαSyn كبيرا في المسار nigrostriatal (الشكل 2 والشكل 3) ، وفقدان الخلايا العصبية TH+ (الشكل 4) ، وضعف الحركة (الشكل 5). وعلى النقيض من ذلك، لم تكن الجرعات المنخفضة من AAV5-hαSyn (1 × 108 جينومات فيروسية لكل فأر و 1 × 109 جينومات فيروسية لكل ماوس) قوية بما يكفي للوصول إلى تغييرات كبيرة في جميع هذه المعلمات معا (الأشكال 2-4). تجدر الإشارة إلى أن إعطاء AAV-GFP عند 1 × 10 10 جينوم فيروسي لكل فأر أدى إلى انخفاض (~20٪) ، ولكن درجة كبيرة من فقدان الخلايا العصبية TH+ من الخلايا العصبية الدوبامينية النيجيرية (الشكل 4A ، B). تتفق هذه النتيجة مع الملاحظات السابقة باستخدام هذا النموذج41 وربما تكون نتيجة لانخفاض مستوى الالتهاب العصبي الناجم عن إعطاء ناقلات AAV في SN. ومع ذلك ، كان مدى فقدان الخلايا العصبية TH+ أعلى بكثير في الفئران التي تتلقى AAV5-hαSyn مقارنة بتلك التي تتلقى نفس الجرعة من AAV-GFP (الشكل 4C). تجدر الإشارة إلى أن حركية تعبير hαSyn لا تعتمد فقط على كفاءة النقل ولكن أيضا على مدى انتشار AAV39. نظرا لأن انتشار AAV يعتمد على النمط المصلي AAV ، فقد تختلف النقاط الزمنية الرئيسية الدقيقة في هذا النموذج الحيواني عند استخدام نمط مصلي AAV آخر مختلف عن AAV5.
بعد ذلك ، تم إجراء تحليل حركي باستخدام 1 × 1010 جينوم فيروسي لكل فأر لتحديد النقاط الزمنية الرئيسية في نموذج الماوس هذا. نظرا لأن الأدلة الحالية أظهرت بعض الأعراض المبكرة التي تظهر قبل الإعاقة الحركية ، والتي من شأنها أن تسمح بالتشخيص المبكر لمرض باركنسون43,44 ، سعت هذه التجارب إلى العثور على النقطة الزمنية التي كان فيها تعبير hαSyn واضحا بالفعل ولكن في غياب ضعف حركي. تظهر النتائج أن بداية تعبير hαSyn في SN كانت في 5 أسابيع بعد التسليم المجسمة ل AAV-hαSyn (الشكل 6). تشكل هذه النقطة الزمنية نقطة زمنية مثيرة للاهتمام لبدء إدارة العلاجات المصممة خصيصا لوقف العمليات العصبية الالتهابية والتنكسية العصبية. كانت النقاط الزمنية الرئيسية الأخرى المحددة هنا هي أوقات الذروة لحدثين حاسمين مرتبطين بعملية الالتهاب العصبي: الوقت الذي تصل فيه الخلايا الدبقية الصغيرة إلى أقصى درجة من التنشيط ووقت أقصى تسرب للخلايا التائية إلى SN. أظهرت النتائج منحنى مع اتجاه يصل إلى موجتين من التنشيط الدبقي الصغير الأقصى ، الأولى في 10 أسابيع بعد الجراحة والثانية في 15 أسبوعا بعد الجراحة (الشكل 7). أظهر التحليل الحركي لتسلل الخلايا التائية وقت الذروة لتسلل Treg إلى SN في 11 أسبوعا بعد الجراحة المجسمة (الشكل 8). والمثير للدهشة أنه لم يتم الكشف عن أي خلايا T مستجيبة (CD4 + Foxp3-) تتسلل إلى SN خلال الإطار الزمني الذي تم تحليله (الأسابيع 8-13 بعد الجراحة). إجمالا، تشير هذه النتائج إلى إطار زمني مناسب للبدء في إدارة العلاجات الموجهة نحو وقف عملية التهاب الأعصاب وتخفيف تسلل الخلايا التائية إلى SN باستخدام هذا النموذج قبل السريري، والذي يتراوح بين الأسبوع 5 بعد الجراحة (بداية الإفراط في التعبير عن hαsyn) والأسبوع 10 بعد الجراحة (الموجة الأولى من التهاب الأعصاب وتسلل الخلايا التائية) (الشكل 9).
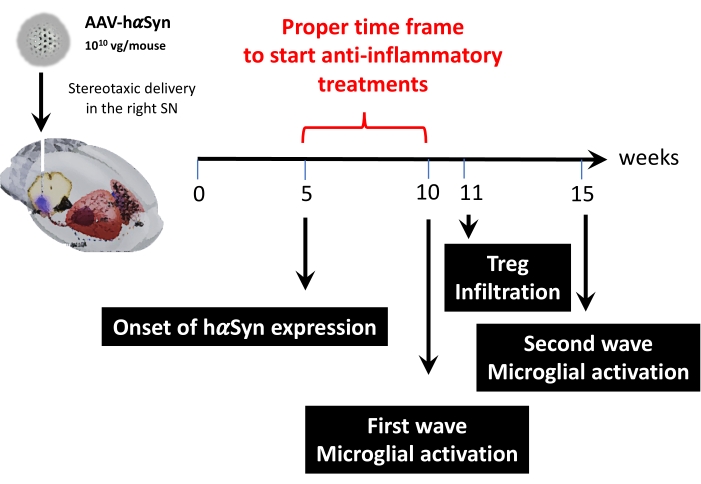
الشكل 9: ملخص للنقاط الزمنية الرئيسية التي تم العثور عليها لهذا النموذج الحيواني. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Disclosures
يعلن المؤلفون أن البحث قد أجري في غياب أي مصالح مالية أو غير مالية متنافسة.
Acknowledgements
نشكر الدكتور سيباستيان فالينزويلا والدكتورة ميكايلا ريكا على مساعدتهما البيطرية القيمة في منشأتنا الحيوانية. تم دعم هذا العمل من قبل "Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID" Centro Ciencia & Vida ، FB210008 (إلى Fundación Ciencia & Vida) ، ومركز Geroscience لصحة الدماغ والتمثيل الغذائي ، FONDAP-15150012. تم تمويل هذا العمل أيضا من خلال المنح FONDECYT-1210013 (إلى R.P) و FONDECYT-1150766 (إلى F.C.) من "الوكالة الوطنية للبحوث والتنمية في تشيلي (ANID)" و MJFF-10332.01 (إلى R.P) و MJFF-17303 (إلى F.C.) من مؤسسة مايكل جي فوكس لأبحاث باركنسون.
Materials
| Name | Company | Catalog Number | Comments |
| ANIMALS AND ANIMAL FOOD | |||
| Foxp3-GFP C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 023800 | |
| Laboratory Rodent Diet | LabDiet | Rodent Diet 5001 | Standard Rodent diet |
| Wild-type C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 000664 | |
| VIRAL VECTORS | |||
| AAV5-CBA-αSyn | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 10E13 vg/mL |
| AAV5-CBA-eGFP | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 9.5 x 10E12 vg/mL |
| ANESTHETICS AND ANALGESICS | |||
| Isoflurane | Baxter | 218082 | 1% for stereotaxic surgery |
| Ketamine | Drag Pharma | CHE30 | 70 mg/Kg for stereotaxic surgery |
| Sevoflurane | Baxter | VE2L9117 | For before transcardial perfusion |
| Tramadol | Drag Pharma | DPH134 | 30 mg/Kg every 24 h |
| Xylazine | Centrovet | EHL40 | 9 mg/kg for stereotaxic surgery |
| EQUIPMENT | |||
| Beam test | Home made | N/A | horizontal beam 25 cm length and 3 cm width. The beam surface was covered by a metallic grid (1 cm2). |
| Cryostate | Leica | CM1520 | |
| Digital camera | Nikon | S2800 Coolpix | For recording the beam test performance |
| Microscope | Olympus | BX51 | Used for IHC analysis (section 4.4) |
| Microscope | Olympus | IX71 | Used for IF analysis (section 5.3) |
| Microscope | Leica | DMI8 | Used for IF analysis (section 5.7) |
| New Standard Stereotaxic, mouse | Stoelting, Wood Dale, IL, USA | 51500 | stereotaxic frame for surgery |
| Peristaltic Pump | Masterflex | C-flex L/S16 | |
| Power supply unit | Olympus | U-RFL-T | Used for IF analysis (section 5.3) |
| Surgical suture | Sylkam®, B Braun | C0760171 | |
| Syringe 100 U | BD | 324918 | For anesthesia before transcardial perfusion, 29G needle |
| Syringe RN 5uL SYR W/O NEEDLE | Hamilton | HA-7641-01 | For viral vector innoculation |
| BUFFERS AND REAGENTS | |||
| Aviden, Peroxidase Conjugate | Merck, Darmstadt, Germany | 189728 | |
| Bovine Serum Albumin | Merck, Darmstadt, Germany | 9048-46-8 | |
| Cryotrotection buffer | Home made | N/A | 20% glycerine and 2% DMSO in PBS |
| DAPI | Abcam | ab228549 | |
| Diaminobenzidine | Merck, Darmstadt, Germany | D8001 | |
| Fluoromount -G T | Electron Microscopy Science | 17984-25 | |
| Gelatin | Merck, Darmstadt, Germany | 104078 | |
| Normal goat serum | Jackson ImmunoResearch Laboratory | 5000121 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 104005 | |
| PBS | Home made | N/A | 0.125 M, pH 7.4 |
| Peroxidase inactivating buffer | Home made | N/A | 0.03% H2O2 in methanol |
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| Trizma Hydrochloride | Merck, Darmstadt, Germany | 1185-53-1 | |
| Tween 20 | Sigma-Aldrich | 822184 | |
| ANTIBODIES | |||
| Biotin-SP (long spacer) AffiniPure Goat Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch Laboratory | 111065003 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11010 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 647 | ThermoFisher Scientific | A21244 | |
| Goat anti-Rat IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11081 | |
| Rabbit monoclonal anti-alpha-Synuclein | Abcam | ab138501 | |
| Rabbit monoclonal anti-Iba-1 | Abcam | EPR16588 | |
| Rabbit polyclonal anti-Tyrosine Hydroxylase | Millipore | AB152 | |
| Rat monoclonal anti-CD4 | Biolegend | 100402 | |
| SOFTWARES | |||
| GraphPad | Prism | 6.0 | Fos stats analysis |
| ImageJ | National Institute of Health | N/A | For image analysis |
| LAS X | Leica | N/A | For image capture with Leica microscope |
| ProgRes Capture Pro | Jenoptik | N/A | For image capture with Olympus microscope |
| VLC media player | VideoLAN Organization | N/A | For analysis of behavioural tests |
References
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiology of Aging. 24 (2), 197-211 (2003).
- Lim, K. L., Zhang, C. W. Molecular events underlying Parkinson's disease - An interwoven tapestry. Frontiers in Neurology. 4, 33(2013).
- Abdelmotilib, H., et al. α-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Mori, F., et al. Relationship among alpha-synuclein accumulation, dopamine synthesis, and neurodegeneration in Parkinson disease substantia nigra. The Journal of Neuropathology & Experimental Neurology. 65 (8), 808-815 (2006).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson's disease. Biochimica et Biophysica Acta. 1802 (1), 29-44 (2010).
- Vazquez-Velez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44, 87-108 (2021).
- Dehay, B., et al. Lysosomal impairment in Parkinson's disease. Movement Disorders. 28 (6), 725-732 (2013).
- Gonzalez, H., Elgueta, D., Montoya, A., Pacheco, R. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases. Journal of Neuroimmunology. 274 (1-2), 1-13 (2014).
- Pacheco, R. T-cell based immunotherapies for Parkinson's disease. Exploration of Neuroprotective Therapy. 1 (2), 72-85 (2021).
- Gonzalez, H., Contreras, F., Pacheco, R. Regulation of the neurodegenerative process associated to Parkinson's disease by CD4+ T-cells. Journal of Neuroimmune Pharmacology. 10 (4), 561-575 (2015).
- Gonzalez, H., Pacheco, R. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases. Journal of Neuroinflammation. 11 (1), 201(2014).
- Campos-Acuna, J., Elgueta, D., Pacheco, R. T-cell-driven inflammation as a mediator of the gut-brain axis involved in Parkinson's disease. Frontiers in Immunology. 10, 239(2019).
- Blesa, J., Phani, S., Jackson-Lewis, V., Przedborski, S. Classic and new animal models of Parkinson's disease. Journal of Biomedicine and Biotechnology. 2012, 845618(2012).
- Ulusoy, A., Decressac, M., Kirik, D., Bjorklund, A. Viral vector-mediated overexpression of alpha-synuclein as a progressive model of Parkinson's disease. Progress in Brain Research. 184, 89-111 (2010).
- Gomez-Benito, M., et al. Modeling Parkinson's disease with the alpha-synuclein protein. Frontiers in Pharmacology. 11, 356(2020).
- Song, L. K., et al. Targeted overexpression of alpha-synuclein by rAAV2/1 vectors induces progressive nigrostriatal degeneration and increases vulnerability to MPTP in mouse. PLoS One. 10 (6), 0131281(2015).
- Theodore, S., Cao, S., McLean, P. J., Standaert, D. G. Targeted overexpression of human alpha-synuclein triggers microglial activation and an adaptive immune response in a mouse model of Parkinson disease. Journal of Neuropathology and Experimental Neurology. 67 (12), 1149-1158 (2008).
- Sanchez-Guajardo, V., Annibali, A., Jensen, P. H., Romero-Ramos, M. alpha-Synuclein vaccination prevents the accumulation of parkinson disease-like pathologic inclusions in striatum in association with regulatory T cell recruitment in a rat model. Journal of Neuropathology and Experimental Neurology. 72 (7), 624-645 (2013).
- Sanchez-Guajardo, V., Febbraro, F., Kirik, D., Romero-Ramos, M. Microglia acquire distinct activation profiles depending on the degree of alpha-synuclein neuropathology in a rAAV based model of Parkinson's disease. PLoS One. 5 (1), 8784(2010).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular Neurodegeneration. 8, 44(2013).
- Cho, C., et al. Evaluating analgesic efficacy and administration route following craniotomy in mice using the grimace scale. Scientific Reports. 9 (1), 359(2019).
- Flecknell, P. Laboratory Animal Anaesthesia. 3rd Ed. , ElsevierAcademic Press. Cambridge, MA. (2009).
- Bind, R. H., Minney, S. M., Rosenfeld, S., Hallock, R. M. The role of pheromonal responses in rodent behavior: Future directions for the development of laboratory protocols. Journal of the American Association for Laboratory Animal Science. 52 (2), 124-129 (2013).
- Paxinos, G., Franklin, K. B. J. The Mouse Brain in Stereotaxic Coordinates. , Academic Press. Cambridge, MA. (2001).
- Elgueta, D., et al. Dopamine receptor D3 expression is altered in CD4+ T-cells from Parkinson's disease patients and its pharmacologic inhibition attenuates the motor impairment in a mouse model. Frontiers in Immunology. 10, 981(2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Fernandez-Suarez, D., et al. The monoacylglycerol lipase inhibitor JZL184 is neuroprotective and alters glial cell phenotype in the chronic MPTP mouse model. Neurobiology of Aging. 35 (11), 2603-2616 (2014).
- Elgueta, D., et al. Pharmacologic antagonism of dopamine receptor D3 attenuates neurodegeneration and motor impairment in a mouse model of Parkinson's disease. Neuropharmacology. 113, 110-123 (2017).
- Montoya, A., et al. Dopamine receptor D3 signalling in astrocytes promotes neuroinflammation. Journal of Neuroinflammation. 16 (1), 258(2019).
- Williams, G. P., et al. Targeting of the class II transactivator attenuates inflammation and neurodegeneration in an alpha-synuclein model of Parkinson's disease. Journal of Neuroinflammation. 15 (1), 244(2018).
- Benskey, M. J., et al. Silencing alpha synuclein in mature nigral neurons results in rapid neuroinflammation and subsequent toxicity. Frontiers in Molecular Neuroscience. 11, 36(2018).
- Rieker, C., et al. Neuropathology in mice expressing mouse alpha-synuclein. PLoS One. 6 (9), 24834(2011).
- Harms, A. S., et al. alpha-Synuclein fibrils recruit peripheral immune cells in the rat brain prior to neurodegeneration. Acta Neuropathologica Communications. 5 (1), 85(2017).
- Williams, G. P., et al. CD4 T cells mediate brain inflammation and neurodegeneration in a mouse model of Parkinson disease. Brain. 144 (7), 2047-2059 (2021).
- Matheoud, D., et al. Intestinal infection triggers Parkinson's disease-like symptoms in Pink1(-/-) mice. Nature. 571 (7766), 565-569 (2019).
- Jan, A., Goncalves, N. P., Vaegter, C. B., Jensen, P. H., Ferreira, N. The prion-like spreading of alpha-synuclein in Parkinson's disease: Update on models and hypotheses. International Journal of Molecular Sciences. 22 (15), 8338(2021).
- Chesselet, M. F., et al. A progressive mouse model of Parkinson's disease: The Thy1-aSyn ("Line 61") mice. Neurotherapeutics. 9 (2), 297-314 (2012).
- Sampson, T. R., et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease. Cell. 167 (6), 1469-1480 (2016).
- Ciron, C., et al. Human alpha-iduronidase gene transfer mediated by adeno-associated virus types 1, 2, and 5 in the brain of nonhuman primates: Vector diffusion and biodistribution. Human Gene Therapy. 20 (4), 350-360 (2009).
- Ben-Shaanan, T. L., et al. Activation of the reward system boosts innate and adaptive immunity. Nature Medicine. 22 (8), 940-944 (2016).
- Albert, K., Voutilainen, M. H., Domanskyi, A., Airavaara, M. AAV vector-mediated gene delivery to substantia nigra dopamine neurons: Implications for gene therapy and disease models. Genes. 8 (2), 63(2017).
- Bordia, T., Perez, X. A., Heiss, J., Zhang, D., Quik, M. Optogenetic activation of striatal cholinergic interneurons regulates L-dopa-induced dyskinesias. Neurobiology of Disease. 91, 47-58 (2016).
- Kim, A., et al. Upgraded methodology for the development of early diagnosis of Parkinson's disease based on searching blood markers in patients and experimental models. Molecular Neurobiology. 56 (5), 3437-3450 (2018).
- Lei, H., et al. Parkinson's disease diagnosis via joint learning from multiple modalities and relations. IEEE Journal of Biomedical and Health Informatics. 23 (4), 1437-1449 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved