Method Article
인간 α-시누클레인을 코딩하는 아데노 관련 바이러스 벡터에 의해 유도된 파킨슨병 마우스 모델 분석
요약
이 연구는 파킨슨 병의 전임상 모델에서 신경 염증, 신경 변성 및 운동 장애를 유도하는 데 필요한 벡터 용량과 노출 시간을 분석합니다. 인간 α시누클레인을 코딩하는 이들 벡터는 파킨슨병과 관련된 시누클레인 병리를 재분석하기 위해 흑질로 전달된다.
초록
파킨슨 병은 nigrostriatal 경로의 도파민 성 뉴런의 죽음과 결과적으로 자발적인 운동의 통제의 점진적 손실을 포함하는 신경 퇴행성 장애입니다. 이 신경 퇴행성 과정은 주로 α-synuclein으로 구성되는 뇌에 단백질 응집체의 침착에 의해 유발됩니다. 여러 연구에 따르면 파킨슨 병과 관련된 신경 변성을 일으키기 위해서는 신경 염증이 필요하다는 사실이 밝혀졌습니다. 특히, 신경염증 과정은 미세아교세포 활성화뿐만 아니라 말초 T 세포의 흑질(SN) 내로의 침윤을 수반한다. 이 연구는 미세아교세포 활성화, SN으로의 T-세포 침윤, 니그랄 도파민성 뉴런의 신경변성 및 운동 장애를 되풀이하는 파킨슨병의 마우스 모델을 분석한다. 파킨슨병의 이러한 마우스 모델은 인간 야생형 α시누클레인(AAV-hαSyn)을 코딩하는 아데노-관련 바이러스 벡터의 입체택시 전달에 의해 SN 내로 유도된다. SN 내로의 바이러스 벡터의 정확한 전달은 녹색 형광 단백질 (GFP)을 코딩하는 대조군 벡터를 사용하여 확인하였다. 그 후, SN에 투여된 AAV-hαSyn의 투여량이 hαSyn 발현의 정도, 니그랄 도파민성 뉴런의 손실, 및 운동 장애에 어떻게 영향을 미치는지 평가하였다. 더욱이, hαSyn 발현, 미세아교세포 활성화 및 T-세포 침윤의 역학은 질병 발달의 시간 과정에 걸쳐 결정되었다. 따라서, 본 연구는 파킨슨병의 전임상 모델에서 시누클레인 병리학 및 신경염증을 표적화하는데 유용할 수 있는 중요한 시점을 제공한다.
서문
알츠하이머 병 후, 파킨슨 병은 전 세계적으로 두 번째로 널리 퍼진 신경 퇴행성 질환입니다. 파킨슨 병에 영향을받는 주요 뉴런은 도파민을 생성하고 자발적인 움직임을 조절하는 nigrostriatal 경로의 뉴런입니다. 결과적으로,이 장애와 관련된 가장 특징적인 증상은 운동 장애입니다. 이 병리학은 또한 시냅스 전 말단과 관련된 세포질 단백질 인 α-synuclein (αSyn)1로 주로 구성된 뇌에 단백질 응집체의 침착을 포함합니다. 증거는 αSyn의 병원성 내포물의 생성이 미스폴딩 또는 이 단백질2의 일부 번역 후 변형에 의해 촉발된다는 것을 보여주었다.
특히, αSyn 병리학과 인간 파킨슨 병 및 동물 모델 3,4에서 nigrostriatal 경로의 도파민성 뉴런의 손실 사이에 밀접한 관계가 확립되었습니다. αSyn 응집체가 어떻게 생성되는지, 그리고 이들이 어떻게 뉴런 사멸을 유도하는지 이해하는 것은 이 분야에서 중요한 도전과제입니다. 점점 더 많은 연구 그룹이 산화 스트레스를 증가시킴으로써 미토콘드리아 기능 장애가 αSyn 응집체2의 생성에 대한 주요 원인 중 하나임을 보여주었습니다. 실제로, 파킨슨병 위험과 관련된 몇몇 유전자는 미토콘드리아 기능, 형태학 및 역학에 관여하는 단백질을 코딩한다 5,6. 또한, 리소좀 기능장애는 기능장애성 미토콘드리아의 축적을 초래하고 αSyn을 미스폴딩하여 αSyn 응집체7의 생성을 촉진하는 또 다른 주요 사건을 구성한다.
새로운 증거에 따르면, 일단 αSyn 응집체가 뇌에 침착되면, 이러한 병원성 단백질은 미세아교세포의 톨-유사 수용체(TLR)를 자극하여 미세아교세포 활성화 및 흑질(SN)8,9의 초기 염증 환경을 촉발시킨다. 더욱이, 증거는 αSyn 응집체가 포획되어 항원 제시 세포에 의해 T 세포에 제시되어 αSyn10,11에 특이적인 적응 면역 반응을 유도한다는 것을 나타낸다. 이러한 αSyn 특이적 T 세포는 후속적으로 뇌에 침투하여 활성화된 미세아교세포에 의해 재자극되어 신경세포 사멸을 유발하는 신경독성 인자의 분비를 촉진한다(9,10). 흥미롭게도, αSyn 응집체가 장내 신경계에서 먼저 생성된 다음, 미주 신경을 통해 뇌 줄기(12)로 운반된다는 몇 가지 증거들이 제시되었다.
파킨슨병의 몇몇 동물 모델은 신경독성 물질(즉, 6-하이드록시도파민, 파라콰트, 로테논, 1-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘)의 투여에 의해 유도된 것들과 유전적 상태(즉, 돌연변이 α-시누클레인, 돌연변이 류신-풍부 반복 키나아제 2)13의 투여에 의해 유도된 것들을 포함하여 수년 동안 사용되어 왔다. . 파킨슨 병의 일부 측면을 복제하는 신경 독소 유도 신경 퇴행과 관련된 모델에도 불구하고, 그들 중 누구도 질병의 모든 필수 측면을 재검토하거나 진행적이지 않습니다13. 한편, 류신이 풍부한 반복 키나아제 2의 돌연변이 버전의 발현, α-시누클레인의 돌연변이 버전, 또는 인간 야생형 α-시누클레인의 과발현을 포함하는 유전자 마우스 모델이 운동 장애를 초래하고, 어떤 경우에는 시누클레노병증의 발달을 초래하지만, 이들은 파킨슨병의 필수적인 측면인 니그랄 도파민성 뉴런의 두드러진 신경변성을 재현하지 못한다(13), 14. 신경 퇴행의 세 번째 종류의 동물 모델은 파킨슨 병의 필수적인 측면의 대부분을 충족 시켰으며, 인간 α 시누클레인 (AAV-hαSyn)을 코딩하는 아데노 관련 바이러스 벡터 (AAVs)의 입체 택시 전달 14,15. 중요하게도, AAVs는 포유류의 성인 뇌에서 높은 효능과 장기적으로 뉴런의 형질도입을 허용한다. 더욱이, SN에서 AAV-hαSyn의 입체택시 전달은 αSyn 병리학, 미세아교세포 활성화, 신경변성 및 운동 장애 16,17,18,19,20을 포함하는 질병의 많은 필수적인 측면을 재현하는 것으로 나타났다. 이 연구는 바이러스 벡터의 용량과 바이러스 벡터 전달 후 시간이 nigrostriatal 경로에서 hαSyn 발현, 신경 변성 및 신경 염증의 정도뿐만 아니라 SN에서 hαSyn의 일방적 인 입체 택시 전달의 마우스 모델에서의 운동 장애 정도에 어떻게 영향을 미치는지에 대한 분석을 제시합니다.
프로토콜
모든 연구는 실험실 동물의 관리 및 사용을위한 가이드 제 8 판에 따라 수행되었습니다. 실험 프로토콜은 마취, 통증, 고통 및 안락사와 관련된 것을 포함하여 Fundación Ciencia & Vida (Science for Life Foundation)의 IACUC에 의해 승인되었습니다 (허가 번호 P-035/2022).
1. 입체 수술
- 수술 준비 (약 1 시간)
- 무균 환경을 유지하려면 신발 커버, 수술 마스크, 위생 장벽, 장갑 및 수술 캡을 포함하여 전체 수술 중에 적절한 수술복을 착용하십시오.
- 무균 환경을 유지하기 위해 마우스와 모든 수술 재료에 70 % 에탄올을 분무하십시오.
- 진통을 유도하려면 수술 전 1 시간마다 12 시간 21시간마다 카프로펜 5 mg / kg을 피하 주사하고 수술 후 3 일까지 계속하십시오.
- 마우스를 마취하려면 동물을 유도 챔버에 넣으십시오. 이소플루란 유동을 0.5%의 속도로 연 다음, 마우스가 우뢰 반사(22)를 잃을 때까지 대략 5분에 걸쳐 천천히 최대 5%까지 증가시킨다.
- 유도 챔버에서 동물을 제거한다. 즉시 동물을 적절한 크기의 코 콘이있는 비 호흡 회로로 옮깁니다. 수술 전 시간 동안 이소플루란 1%로 마우스 마취를 유지하십시오.
- 마우스가 꼬리와 발을 꼬집어 완전히 마취되었는지 확인하십시오. 마우스가 꼬리와 발을 꼬집는 것에 반응하지 않으면 마우스가 완전히 마취되었음을 의미합니다.
- 가위를 사용하여 마우스의 머리를 면도하십시오. 클로르헥시딘 2 %의 면봉을 사용하여 마우스의 피부를 닦고 모든 머리카락을 제거하십시오.
- 마우스의 머리를 고정 관념 프레임에 고정시킵니다.
- 면봉을 사용하여 양쪽 마우스 눈에 각막 보호제를 놓습니다. 다른 설치류에서 스트레스 유도를 방지하려면, 수술실(23)에서 임의의 다른 마우스의 존재를 피한다.
- 수술(약 30분)
- 2 % 클로르헥시딘 (chlorhexidine)의 세 라운드와 70 % 에탄올로 마우스의 머리를 닦으십시오. 수술 용 재료를 사용하여 두개골을 노출시키고 전후 -2.8mm, 내측선에 대해 평측 1.4mm의 드릴로 얇은 구멍을 뚫습니다.
- 10 μL 주사기의 바늘을 구멍에 넣고 경막24에 대하여 -7.2 mm 등쪽 복부에 도착할 때까지 바늘을 천천히 뇌 안쪽으로 옮깁니다.
- 조직이 약간 침전될 수 있도록 바늘을 2분 동안 최종 위치에 두고 AAV5-CBA-hαSyn(AAV-hαSyn), AAV5-CBA-eGFP(AAV-GFP) 또는 비히클(pH 7.4에서 PBS; 가짜 수술)을 0.2 μL/30 s의 속도로 우측 흑질에 주입한다.
- 바이러스 벡터의 전달 후 5 분 동안 바늘을 같은 위치에 둔 다음 천천히 철회하십시오.
- 수술 후 (약 5 분)
- 멸균 실크 꼰 비 흡수성 봉합사를 사용하여 상처를 닫습니다.
- 마우스를 전기 가열된 매트리스(25°C) 위에 놓음으로써 예열된 홈 케이지에 넣는다.
참고 : 마우스는 어려움없이 걸을 수 있고 상처가 치유 될 때까지 홈 케이지에서 혼자 유지해야합니다.
2. 빔 테스트를 이용한 모터 성능 결정
- 교육(마우스당 약 15분)
- 입체택시 수술 후 12주째,25 이전에 설명된 빔 테스트의 단순화된 버전을 사용하여 모터 성능을 평가한다. 이를 위해 길이 25cm, 너비 3cm의 수평 빔을 사용하십시오. 빔 표면은 정사각형이 1cm이고 빔 위로 1cm 높이의 금속 격자로 덮여 있어야합니다.
- 홈 케이지가 있는 빔의 한쪽 끝에서 반대쪽 끝으로 격자 표면 빔을 횡단하는 마우스의 비디오를 촬영합니다. 모터 성능을 결정하기 전에 2 일 동안 마우스를 훈련시킵니다.
- 첫날에는 그리드없이 빔을 다섯 번 통과하도록 마우스를 훈련시킵니다.
- 둘째 날에는 그리드가있는 상태에서 빔을 다섯 번 걷도록 마우스를 훈련시킵니다.
- 테스트 (마우스 당 약 5 분)
- 셋째 날에 모터 성능을 평가하십시오. 이렇게하려면 슬로우 모션 모드에서 비디오를 시청하여 왼쪽 발 또는 오른쪽 발에 의해 수행 된 오류 수를 별도로 정량화하십시오.
참고: 오류는 발이 그리드를 올바르게 밟지 않아 그리드의 측면 또는 그리드와 빔 표면 사이에 표시되는 경우로 정의됩니다.
- 셋째 날에 모터 성능을 평가하십시오. 이렇게하려면 슬로우 모션 모드에서 비디오를 시청하여 왼쪽 발 또는 오른쪽 발에 의해 수행 된 오류 수를 별도로 정량화하십시오.
3. 조직 처리
- 심질 관류(마우스당 약 15분)
- 마우스를 마취하려면 케타민 (80 mg / kg)과 크실라진 (10 mg / kg)의 혼합물을 1 mL 주사기와 27 G 바늘26을 사용하여 복강 내 (즉) 주사하십시오.
- 마우스가 완전히 마취되면 (단계 1.1.6에서와 같이 확인), 수술 재료로 흉부를 열고 심장을 노출시킵니다.
- 그런 다음 21G 바늘 (드릴을 사용하여 팁을 평평하게 만들기)을 심장의 좌심실에 삽입하십시오.
- 바늘을 파이프에 결합시켜, 연동 펌프를 사용하여 PBS 50 mL (pH 7.4)를 9.5 mL/min의 속도로 퍼퓨즈한다.
- 뇌 고정 및 냉동 보호 (뇌 당 약 10 분)
- 가위와 핀셋을 이용하여 뇌를 제거한 다음, 4°C에서 24시간 동안 PBS(pH 7.4) 중의 4% 파라포름알데히드 5 mL에 침지하여 고정시킨다.
- 그 후, 고정된 뇌를 15 mL의 30% 수크로오스에 넣고 4°C에서 48시간 동안 복용하였다.
- 그런 다음 뇌를 4 mL의 냉동 보호 용액 (PBS 중 20 % 글리세린 및 2 % DMSO)에 넣고 -80 °C에서 뇌를 저장하거나 다음 단계에서 즉시 사용하십시오.
- 뇌 조각 얻기 (뇌 당 약 20 분).
참고 : 뇌가 코로나 절단을 할 수있는 적절한 위치에있는 냉동 장치에 배치되었는지 확인하십시오.- SN 슬라이스를 얻으려면 뇌를 -2.92mm에서 시작하여 -3.64mm 24mm에서 마무리하는 40μm 두께의 절편으로 절단합니다.
- 각 슬라이스를 24-웰 플레이트의 웰(1 mL의 냉동 보호 용액 함유)에서 수확하고,25,27,28 이전에 기술된 바와 같이 전후 순서에 따른다.
- SN에서 면역조직화학(섹션 4.) 및 면역형광 분석(섹션 5.)을 수행하려면, 25,27,28 이전에 설명된 바와 같이 핵의 전체 로스트로코달 정도(총 720μm)를 커버하는 균일한 간격(120μm)으로 취해진 6개의 코로나 SN 절편을 선택하십시오.
- 줄무늬 조각을 얻으려면 뇌를 +1.34mm에서 시작하여 -0.26mm 24에서 마무리하는 40μm 두께의 절편으로 자릅니다.
- 전후 순서에 따라 각 조각을 2 mL 냉동 튜브 (1 mL의 냉동 보호 용액 포함)에서 수확하십시오.
- 선조체에서 면역조직화학(섹션 4.) 및 면역형광 분석(섹션 5.)을 수행하려면 핵의 전체 로스트로카우달 정도(총 1600μm)를 커버하는 균일한 간격(320μm)으로 촬영된 5개의 코로나 삼중항 절편을 선택합니다.
4. 도파민성 뉴런과 미세아교세포를 정량화하기 위한 면역조직화학 분석 (약 2일)
- 줄무늬 또는 니그랄 슬라이스의 면역조직화학적 분석을 위해, 동일한 뇌에서 다섯 개(선조체) 또는 여섯 개(SN) 슬라이스 세트를 24웰 플레이트의 한 웰에 배치한다.
- 절편 3x를 1 mL의 PBS로 세척한 다음, 실온에서 메탄올 중 0.03%H2O2의 0.5 mL와 함께 인큐베이션하고, 30분 동안 교반하면서 내인성 퍼옥시다제 활성을 불활성화시킨다.
- 절편을 1 mL의 PBS로 3x 세척하고, 실온에서 0.5 mL의 블로킹 용액 (PBS 중 4% 염소 혈청, 0.05% 트리톤 X-100, 및 4% BSA)과 함께 인큐베이션하고 40분 동안 교반시킨다.
- 그 후, 1차 항체(토끼 항-티로신 하이드록실라제 [TH] pAb를 1:1000으로 희석한 [ 표 1 참조]; 또는 토끼 항-Iba1 항체 1:1000으로 희석)를 함유하는 블로킹 용액 0.5 mL와 함께 실온에서 밤새 교반하면서 인큐베이션한다.
- 절편 3x를 PBS 1 mL로 세척하고, 실온에서 비오티닐화 염소 항토끼 pAb (1:500, 표 1 참조)를 함유하는 블로킹 용액 0.5 mL와 함께 인큐베이션하고 2 h 동안 교반시킨다.
- 이어서, 절편 3x를 PBS 1 mL로 세척하고, 0.5 mL의 퍼옥시다제-공액 아비딘 (1:5000, 표 1 참조)과 함께 실온에서 블로킹 용액으로 인큐베이션하고, 90분 동안 교반시켰다.
- 절편 3x를 1 mL의 PBS로 세척하고, 0.5 mL의 기질 용액 (pH 7.6에서 0.03%H2O2/Trizma-HCl 완충액 중의 0.05% 디아미노벤지딘)과 함께 인큐베이션한다. 디아미노벤지딘이 잠재적 발암 물질이기 때문에이 단계를 위해 장갑과 실험실 코트를 착용하십시오.
- 특이적 염색이 명백할 때(전형적으로 TH의 경우 30초, Iba1의 경우 5분), 기질 용액을 꺼내고 실온에서 PBS 1 mL로 절편을 3x 세척하고 교반시킨다. 항상 동일한 실험에 포함 된 모든 뇌 조각의 면역 염색을 동시에 수행하십시오.
참고 : TH의 특정 염색은 TH 면역 염색이 뇌에서 특징적인 모양을 나타내는 SN의 영역에 나타날 때 분명합니다. Iba1의 특정 마크는 Iba1 면역 염색이 현미경 관찰시 확인되는 전형적인 미세 아교 모양의 대조군 뇌 조각에 나타날 때 결정됩니다. 이러한 방식으로, IHC 분석을 위한 기질 박람회의 정확한 시간은 모든 단일 실험에 대해 결정된다. - 뇌 절편을 0.05 M 트리스 (pH 7.6) 중의 0.2% 젤라틴 용액을 사용하여 유리 슬라이드에 장착한다. 동일한 뇌에서 얻은 다섯 개(선조체) 또는 여섯 개(SN) 조각의 각 세트를 동일한 유리 슬라이드 위에 로스트로카우달 순서로 놓습니다.
- SN에서 TH+ 뉴런의 수를 정량화한다.
- SN에서 TH + 뉴런을 정량화하려면 25,27,28 이전에 설명한 바와 같이 밝은 필드 현미경을 사용하여20x 배율로 여섯 조각의 사진을 획득하십시오. 색온도 3200K, 시안-적색 40%, 마젠타-그린 39%, 옐로우-블루 54%, 감마 0.5, 콘트라스트 37, 밝기 13, 채도 5 등의 색상 조정을 사용합니다.
- Image J 소프트웨어를 사용하여 분석된 반구에서 SN pars compacta의 둘레를 선택합니다. 복부 tegmental 영역 (VTA)에서 TH + 뉴런의 선택을 피하십시오.
- 그런 다음 소프트웨어에 선택한 영역 (일반적으로 rostrocaudal 위치에 따라 0.04-0.07 mm2 / 반구)을 계산하도록 요청하십시오. 그런 다음 다중 점 도구를 사용하여 모든 TH + 뉴런에 점으로 태그를 지정합니다.
- 점 도구를 사용하여 소프트웨어에 총 점 수를 계산하도록 요청하십시오. 총 점 수 (TH + 뉴런)와 SNpc의 면적을 사용하여 TH + 뉴런 / mm 2의 밀도를 계산하십시오.
- 여섯 개의 SN 슬라이스에서 양쪽 반구에서 동일한 계산을 반복 한 다음 동측 및 대측 측면에서 TH + 뉴런 / mm2 의 평균을 계산하십시오.
- 선조체에서 활성화 된 미세 아교세포의 수를 정량화하십시오.
- 선조체에서 활성화된 미세아교세포를 정량화하려면 밝은 필드 현미경과 4.10.1 단계에 표시된 것과 동일한 설정을 사용하여 20x 배율로 다섯 개의 줄무늬 조각 모두에 대해 각 반구에서 두 장의 사진을 획득하십시오. Image J 소프트웨어를 사용하여 모든 단일 사진 (660 μm x 877 μm의 면적 표시)에서 멀티 포인트 도구를 사용하여 높은 Iba1 강도와 아메보이드 모양을 발현하는 모든 단일 세포에 점을 태그하십시오. 점 도구를 사용하여 소프트웨어에 총 점 수를 계산하도록 요청하십시오.
- 총 점의 수와 사진의 면적을 사용하여29 이전에 수행 된 활성화 된 미세 아교 세포 (Iba1높은 세포 / mm2)의 밀도를 계산하십시오.
| 표적 항원 | 에 결합됨 | 클론성 | 호스트 사양 | 특정 반응성* | 희석** |
| 티로신 하이드록실라제 | 해당 없음 | 다클론 | 토끼 | 마우스, 쥐, 인간 | 1/200 - 1/1000 |
| 이바1 | 해당 없음 | 단일 클론 | 토끼 | 마우스, 쥐, 인간 | 1/1000 |
| 알파-시누클레인 | 해당 없음 | 단일 클론 | 토끼 | 사람의 | 1/150 |
| CD4 | 해당 없음 | 단일 클론 | 쥐 | 마우스 | 1/250 |
| IgG (H+L) | 비오티닐화 | 다클론 | 염소 | 토끼 | 1/500 |
| IgG (H+L) | 알렉사플루오르 546 | 다클론 | 염소 | 토끼 | 1/500 |
| IgG (H+L) | 알렉사플루오르 647 | 다클론 | 염소 | 토끼 | 1/500 |
| IgG (H+L) | 알렉사플루오르 546 | 다클론 | 염소 | 쥐 | 1/500 |
표 1: 항체 희석액. N/A, 해당되지 않습니다. *, 다른 종과의 반응성에 관계없이 마우스, 쥐 및 인간과의 반응성이있는 경우에만 명시됩니다. **, 단일 희석 또는 희석 범위가 지정됩니다.
5. nigrostriatal 경로에서 T 세포 침윤을 평가하기위한 면역 형광 분석 (약 2 일)
- 줄무늬 또는 니그랄 슬라이스에서 hαSyn 또는 TH/GFP의 면역형광 분석을 위해, 24웰 플레이트의 한 웰에 동일한 뇌에서 다섯 개(선조체) 또는 여섯 개(SN) 슬라이스 세트를 함께 넣는다.
- 절편을 1 mL의 PBS로 3x 세척한 다음, 실온에서 0.5 mL의 블로킹 용액 (PBS 중 0.3% 트리톤 X-100, 0.05% tween20, 및 5% BSA)과 함께 인큐베이션하고 40분 동안 교반시켰다.
- 그 후, 실온에서 1차 항체(토끼 항-TH pAb 1:500로 희석된 토끼 항-TH pAb; 또는 토끼 항-hαSyn 항체를 1:150으로 희석, 표 1 참조)를 함유하는 블로킹 용액 0.5 mL와 함께 인큐베이션하고 밤새 교반시킨다.
- 절편 3x를 PBS 1 mL로 세척하고, AlexaFluor546 결합 항토끼 2차 항체(1:500, 표 1 참조) 및 4',6-디아미디노-2-페닐인돌(DAPI; 1:1000)을 함유하는 블로킹 용액 0.5 mL와 함께 실온에서 2시간 동안 교반하면서 인큐베이션한다. 이어서, 절편을 1 mL의 PBS로 3x 세척한다.
- 위에서 설명한 대로 유리 슬라이드에 뇌 섹션을 장착합니다(단계 4.9.). 이미지는 전원 공급 장치에 결합된 반전된 형광 현미경으로 획득되었다.
- 니그랄 슬라이스에서 TH/CD4/GFP(Foxp3)의 면역형광 분석을 위해, 동일한 뇌에서 여섯 개의 (SN) 슬라이스 세트를 24웰 플레이트의 한 웰에 놓으십시오. 절편을 1 mL의 PBS로 3x로 세척한 다음, 실온에서 0.5 mL의 블로킹 용액 (PBS 중 0.5% 트리톤 X-100, 0.5% 어쉬 스킨 젤라틴)과 함께 인큐베이션하고 2 h 동안 교반시킨다.
- 1차 항체인 토끼 항-TH pAb (1:200, 표 1 참조) 및 래트 항-CD4 ( 1:250)를 함유하는 0.5 mL의 블로킹 용액과 함께 4°C에서 인큐베이션하고 밤새 교반시킨다.
- 절편 3x를 PBS 1 mL로 세척하고, AlexaFluor 647 (1:500, 표 1 참조) 및 AlexaFluor 546에 결합된 항토끼 (1:500) 및 항-래트를 함유하는 블로킹 용액 0.5 mL와 함께 실온에서 2시간 동안 교반하면서 인큐베이션한다. 이어서, 절편을 1 mL의 PBS로 3x 세척한다.
- 동일한 뇌에서 얻은 6 개의 (SN) 슬라이스 세트를 동일한 유리 슬라이드에 로스트로 카우달 순서로 놓고 Fluoromount G. 라이카 DMi8 현미경을 사용하여 이미지를 획득하여 장착하십시오. 표 2 에 표시된 공초점 현미경 설정을 사용하여 면역형광 분석으로부터 이미지를 획득한다.
| 샤넬 이름 | 입방체 | 방출 웨이브 렝 | 조회 테이블 이름 | 노출 시간 | 이득 | 해상도 XY | 해상도 Z |
| 채널 1 | Y5 | 700nm | 회색 | 1,011.727 밀리세컨드 | 높은 우물 수용량 | 2.237 um | 24.444 um |
| 채널 2 | GFP | 525nm | 녹색 | 326.851 밀리세컨드 | 높은 우물 수용량 | 2.237 um | 24.444 um |
| 채널 3 | 증권 시세 표시기 | 630nm | 빨강 | 406.344 밀리세컨드 | 높은 우물 수용량 | 2.237 um | 24.444 um |
| 채널 4 | 다피 | 460nm | 파랑 | 91.501 밀리세컨드 | 높은 우물 수용량 | 2.237 um | 24.444 um |
표 2: 면역형광 분석으로부터 이미지의 획득에 사용되는 공초점 현미경 설정.
6. 통계 분석
- 동측 측과 대측 측면에서 얻은 데이터를 비교하려면 쌍을 이룬 두 꼬리 스튜던트 t-검정을 사용하십시오.
- AAV-hαSyn을 받은 마우스와 AAV-GFP 또는 가짜 수술을 받은 마우스에서 얻은 데이터를 비교하려면 짝을 이루지 않은 두 꼬리 스튜던트 t-테스트를 사용하십시오. P 값이 0.05가 < 때 유의한 차이를 고려하십시오.
결과
nigrostriatal 경로의 도파민성 뉴런에서 AAV 벡터의 정확한 전달을 검증하는 것
시누클레인 병리에 의해 촉진되는 신경염증, 신경변성 및 운동 장애의 과정을 연구하기 위해, SN16,17,30,31에서 hαSyn을 코딩하는 AAV의 일방적인 입체택시 전달에 의해 유도되는 파킨슨병의 마우스 모델을 사용하였다(보충 도 1의 실험 설계 참조). ). nigrostriatal 경로의 도파민성 뉴런에서 AAV 벡터의 정확한 전달을 검증하기 위해, GFP (AAV-GFP)를 코딩하는 AAV를 SN에 주입하고, 12주 후, GFP 형광 및 티로신 하이드록실라제 (TH) 면역반응성을 면역형광에 의해 SN 및 선조체에서 분석하였다. GFP 관련 형광은 동측 측에서만 독점적으로 관찰되었고, SN 및 선조체 둘 다에서 TH 면역반응성과 유의한 공국재화가 있었으며, 이는 니그로스트리아 경로의 도파민성 뉴런에서 AAV 벡터의 정확한 전달을 나타낸다(도 1).
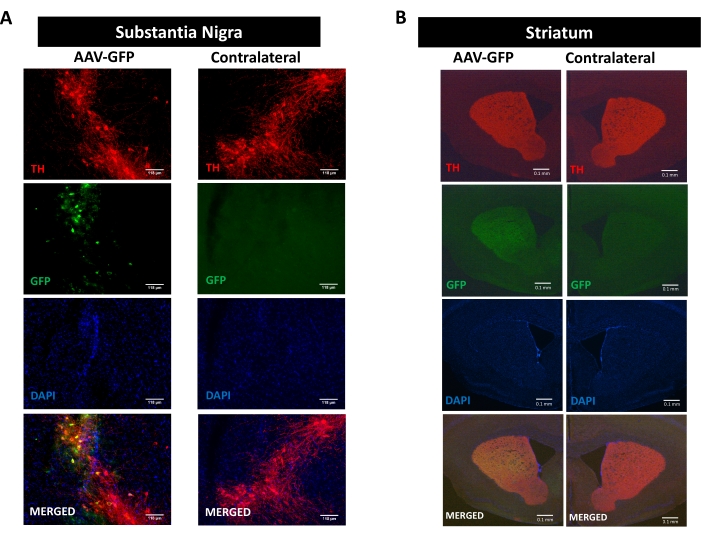
도 1: nigrostriatal 경로에서 AAV-GFP의 전달의 분석. 마우스는 AAV-GFP (1 x 1010 vg/mouse)를 받았고 12 주 후에 희생되었고, TH는 (A) SN (스케일 바는 118 μm) 및 (B) 선조체 (스케일 바는 100 μm이다)에서 면역염색되었다. TH- 및 GFP-관련 형광을 에피형광 현미경으로 분석하였다. 핵을 DAPI로 염색하였다. TH (적색), GFP (녹색) 및 DAPI (파란색)의 병합 또는 단일 염색의 대표적인 이미지가 도시되어 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
AAV-hαSyn에 의해 유도된 파킨슨병의 마우스 모델에서 신경변성 및 운동 장애를 유도하기 위해 투여된 바이러스 벡터의 투여량을 설정한다.
nigral dopaminergic 뉴런의 신경 변성을 촉진하는 hαSyn의 유의한 과발현을 유도하는 데 필요한 AAV-hαSyn의 용량을 시험하기 위해, AAV-hαSyn의 상이한 투여량 (1 x 10 9 vg/마우스 또는 1 x10 10 vg/mouse)을 주입하고, 12주 후, hαSyn 면역반응성 및 TH 면역반응성의 정도를 nigrostriatal 경로에서 평가하였다. SN에서 테스트된 모든 용량에서 hαSyn 면역반응성이 뚜렷했지만(그림 2), 1 x 1010 vg/마우스를 투여받은 마우스만이 선조체에서 명백한 hαSyn 면역반응성을 나타냈다(도 3). 더욱이, AAV-hαSyn의 1 x 1010 vg/마우스를 투여받은 마우스는 SN에서 도파민성 뉴런의 상당한 손실을 나타냈다(도 4A,B). AAV-GFP의 1 x10 10 vg/마우스를 투여받은 마우스는 낮은 정도(~20%)의 신경 손실을 나타냈지만(도 4A,B), 동일한 용량의 AAV-hαSyn을 투여받은 마우스는 니그랄 도파민성 뉴런의 신경변성 정도가 상당히 높았다(도 4C). 따라서, AAV-hαSyn의 1 x10 10 vg/마우스를 사용하여 추가 실험을 수행하였다. 또한, 운동 장애의 정도는 앞서도 25에 기재된 바와 같이 빔 검정(도 5A)을 사용하여 AAV-hαSyn의 상이한 투여량을 수용하는 마우스에서 결정되었다. 빔 테스트에서 AAV-hαSyn의 1 x 1010 vg/mouse에서 모터 성능의 현저한 감소가 독점적으로 검출되었는데, 이는 오른쪽 및 왼쪽 패드에 의해 만들어진 오류 수를 비교할 때(그림 5B) AAV-hαSyn을 수신한 마우스와 대조 벡터 AAV-GFP를 받은 마우스와 비교했을 때(그림 5C). 따라서, AAV-hαSyn의 1 x10 10 vg/마우스를 사용하여 추가 실험을 수행하였다.
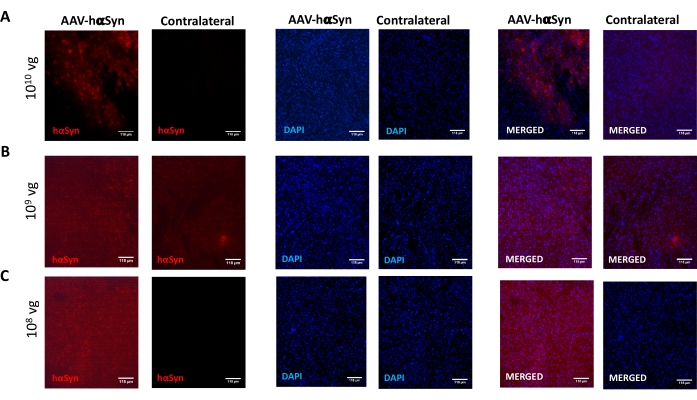
도 2: 상이한 용량의 AAV-hαSyn으로 처리된 마우스의 SN에서의 인간 α-시누클레인 발현의 분석. 마우스는 (A) 1 x 10 10 vg/마우스, (B) 1 x 109 vg/마우스 또는 (C) 1 x 108 vg/마우스에서 AAV-hαSyn을 받았고 12주 후에 희생되었고, hαSyn 발현은 후피형광 현미경을 사용하여 SN에서 면역형광으로 분석되었다. 핵을 DAPI로 염색하였다. hαSyn (적색) 또는 DAPI (파란색)의 병합 또는 단일 염색의 대표적인 이미지가 도시되어 있다. 스케일 바는 118μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
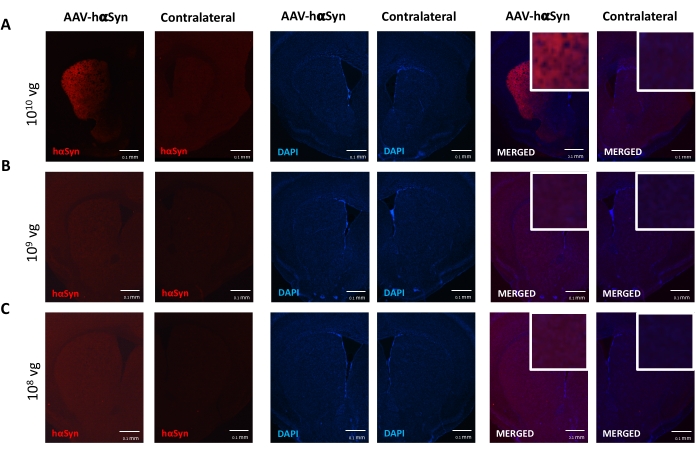
도 3: AAV-hαSyn의 상이한 투여량으로 처리된 마우스의 선조체에서의 인간 α-시누클레인 발현의 분석. 마우스는 (A) 1 x 10 10 vg/mouse, (B) 1 x 109 vg/mouse, 또는 (C) 1 x 108 vg/mouse)에서 AAV-hαSyn을 받았고, 12주 후에 희생되었고, hαSyn 발현은 후피형광 현미경을 사용하여 선조체에서 면역형광으로 분석되었다. 핵을 DAPI로 염색하였다. hαSyn (적색) 또는 DAPI (파란색)의 병합 또는 단일 염색의 대표적인 이미지가 도시되어 있다. 스케일 바는 100 μm이다. 병합된 이미지의 오른쪽 위 모서리에 있는 삽입은 더 높은 배율에서 관심 영역을 보여 줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
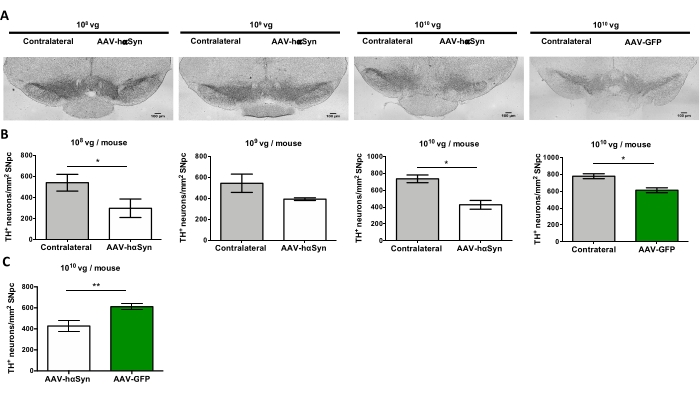
도 4: AAV-hαSyn 또는 대조군 벡터의 상이한 투여량으로 처리된 마우스에서 SN의 도파민성 뉴런의 손실. 마우스는 AAV-hαSyn (1 x 10 vg/mouse, 1 x 109 vg/mouse, 또는 1 x 108 vg/mouse) 또는 AAV-GFP (1 x 10 10vg/mouse)를 받았고12주 후에 희생되었고, TH는 면역조직화학에 의해 SNpc에서 분석되었다. (A) 대표 이미지. 스케일 바, 100 μm. (B,C) 뉴런의 밀도는 TH+ 뉴런/mm2의 수로서 정량화되었다. 데이터는 평균 ± SEM을 나타낸다. n=그룹당 3-8마리의 마우스. (B) 동측성과 대측면의 비교는 두 꼬리 쌍을 이룬 스튜던트 t-검정을 사용하여 수행되었다. (c) AAV-hαSyn 또는 AAV-GFP의 1 x10 vg/마우스를 수용한 마우스로부터의 동측성 측면의 비교가 수행되었다. (B,C) 흰색 막대는 AAV-hαSyn을 투여받은 마우스의 동측 측에서 TH+ 뉴런의 정량화를 나타내는 반면, 녹색 막대는 AAV-GFP를 받는 마우스의 동측 측에서 TH+ 뉴런의 정량화를 나타낸다. 회색 막대는 해당 그룹의 대측에서 TH + 뉴런의 정량화를 나타냅니다. 비교는 두 꼬리 짝을 이루지 않은 스튜던트 t-테스트에 의해 수행되었다. *p < 0.05; **p < 0.01. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
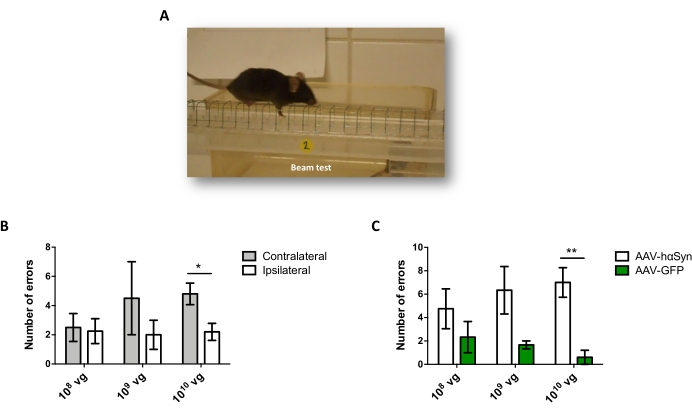
도 5: AAV-hαSyn의 상이한 투여량으로 처리된 마우스에서의 운동 성능의 분석. 마우스는 AAV-hαSyn 또는 AAV-GFP의 다른 용량 (1 x 10 10 vg / 마우스, 1 x 109 vg / 마우스 또는 1 x 108 vg / 마우스)을 받았으며 12 주 후 빔 테스트로 모터 성능을 평가했습니다. (A) 빔 위를 걷는 마우스의 이미지. (b) 왼쪽 팔다리 (대측성) 대 오른쪽 팔다리 (ipsilateral)에 의해 수행 된 오류의 수는 AAV-hαSyn을받는 마우스 그룹에서 정량화되었다. (c) AAV-hαSyn 또는 AAV-GFP의 동일한 투여량을 투여받은 상이한 실험군 간에 총 오차 수를 비교하였다. 데이터는 그룹당 평균 ± SEM. n=3-5마리의 마우스를 나타낸다. 비교는 (B) 쌍을 이룬 두 꼬리 스튜던트 t-테스트 또는 (C) 짝을 이루지 않은 두 꼬리 스튜던트 t-테스트에 의해 수행되었다. *p < 0.05; **p < 0.01. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
AAV-αSyn에 의해 유도된 파킨슨병 모델의 동역학 설정
상당한 수준의 신경변성 및 운동 장애를 유도하기 위해 사용된 적절한 AAV-hαSyn 용량을 결정한 후, hαSyn 과발현의 발병을 정의하기 위한 실험을 수행하였다. 이를 위해, 마우스를 AAV-hαSyn 또는 가짜 수술의 1 x 1010 vg/마우스로 처리하였다. hαSyn 발현의 정도는 입체택시 수술 후 2-5주 동안 일주일에 한 번 SN에서 분석되었다( 보충도 2의 실험 설계 참조). 결과는 hαSyn 발현이 수술 후 2 주 이내에 낮은 수준에서 검출 되었음에도 불구하고 hαSyn 클러스터가 입체 택시 수술 후 5 주에 나타났다는 것을 보여줍니다 (그림 6).

도 6: AAV-hαSyn을 처리한 마우스의 SN에서 인간 α시누클레인 발현의 시간 경과를 분석한다. 마우스는 AAV-hαSyn (1 x10 10 vg/mouse) 또는 가짜 입체택시 수술을 받았고, SN에서 hαSyn의 발현을 (A) 2주, (B) 3주, (C) 4주 또는 (D) 5주 후 후피형광 현미경을 이용한 면역형광으로 분석하였다. 핵을 DAPI로 염색하였다. hαSyn (적색) 또는 DAPI (파란색)의 병합 또는 단일 염색의 대표적인 이미지가 도시되어 있다. 스케일 바, 100 μm. 병합된 이미지의 오른쪽 위 모서리에 있는 삽입은 더 높은 배율에서 관심 영역을 보여 줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그 후, AAV-hαSyn의 입체택시 전달 후 중추신경계(CNS)에서의 신경염증 및 T-세포 침윤을 분석하기에 적합한 시점을 결정하기 위한 실험을 수행하였다. AAV-hαSyn으로 마우스를 처리한 후 미세아교세포 활성화의 피크를 확인하기 위해, 선조체에서 높은 수준의 Iba1을 발현하는 세포의 정도를 입체택시 수술 후 2-15주 동안 일주일에 한 번 평가하였다. 결과는 AAV-hαSyn 처리 후 15주 후 마우스의 대측성 측면과 비교하여 동측방의 미세아교세포 활성화의 현저한 증가를 보여준다(도 7). SNpc 내로 침윤된 Treg (CD4+ Foxp3+) 세포의 수는 또한 면역형광 관찰에 이어 공초점 현미경 관찰에 의해 AAV-hαSyn의 입체택시 전달 후 상이한 시점에서 평가되었다. 결과는 SNpc 내로의 Treg 침윤의 피크가 수술 후 11 주에 있었던 반면, Treg가 뇌의이 영역에 침투하는 정도는 수술 후 8 주 또는 13 주에 더 낮았다는 것을 보여줍니다 (그림 8). 선조체에 침윤하는 CD4+ T 세포는 검출되지 않았다(데이터는 나타내지 않음). 전체적으로, 이러한 결과는 AAV-hαSyn의 1 x 10 10 vg / 마우스를 사용하여 신경 염증을 분석하는 데 가장 적합한 시점은 입체 택시 수술 후 15 주이며, CNS로의 T 세포 침윤을 분석하기위한 적절한 시점은 AAV-hαSyn 치료 후11 주째 인 것으로 보입니다.
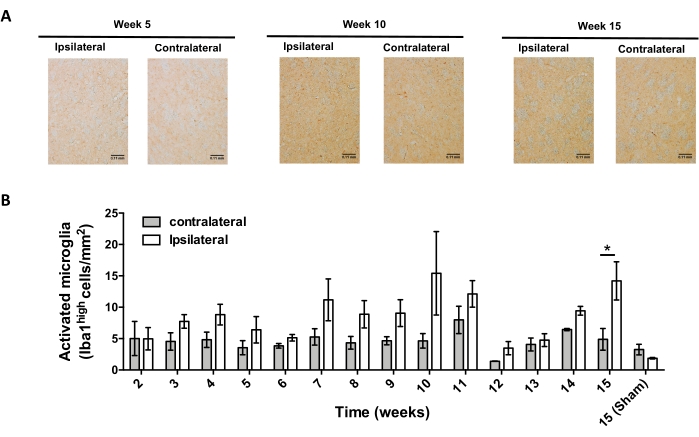
도 7: AAV-hαSyn을 접종한 마우스에서 미세아교세포 활성화의 시간 경과를 분석함. 마우스는 AAV-hαSyn (1 x 1010 vg/mouse)을 받았고, 미세아교세포 활성화는 수술 후 다른 시점에서 선조체에서 Iba1의 면역조직화학적 분석에 의해 평가되었다. (a) AAV-hαSyn으로 접종한 후 5주, 10주 또는 15주 후에 희생된 마우스로부터의 Iba1의 면역조직화학적 분석의 대표적인 개요 이미지가 도시되어 있다. 스케일 바, 110 μm. (B) 활성화된 미세아교세포의 밀도는 면적당 높은 수준의 Iba1 및 아메보이드 형태를 발현하는 세포의 수로서 정량화되었다. 데이터는 그룹당 평균 ± SEM. n=3마리의 마우스를 나타낸다. 두 꼬리 쌍을 이룬 스튜던트 t-검정을 사용하여 각 그룹에서 동측성 Iba1과 대측성 Iba1 사이의 통계적 차이를 확인했습니다. *p< 0.05입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
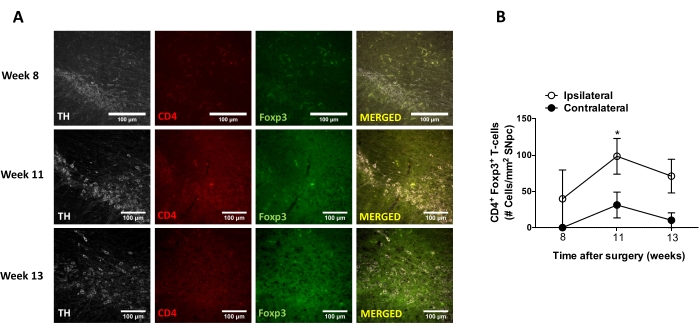
도 8: AAV-hαSyn을 접종한 마우스의 SN 내로의 CD4+ T 세포 침윤의 시간 경과의 분석. Foxp3gfp 리포터 마우스는 AAV-hαSyn (1 x 1010 vg/마우스)을 받았다. Foxp3를 발현하는 CD4+ T-세포의 존재 및 TH+ 뉴런의 존재를 면역형광에 의해 SN에서 상이한 시점 (수술 후 8주, 11주, 및 13주째)에서 분석하였다. (a) 단일 면역염색 또는 병합을 위한 대표적인 이미지가 도시되어 있다. 스케일 바, 100 μm. (B) SN 내의 면적당 CD4+ Foxp3+ T 세포의 수를 정량화하였다. 데이터는 그룹당 3마리의 마우스로부터의 평균 ± SEM을 나타낸다. *p<0.05, 동측성 대 대측성 CD4+ Foxp3+ T 세포 2꼬리 스튜던트 t-검정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1 : 시누클레인 병리학, 신경 변성 및 운동 장애에 대한 AAV 벡터의 다양한 용량의 효과를 평가하기위한 실험 설계. 야생형 수컷 C57BL/6 마우스를 마취시키고, CBA 프로모터의 제어 하에 인간 α-시누클레인(AAV-hαSyn) 또는 eGFP(AAV-GFP)를 코딩하는 AAV의 상이한 용량(1 x 10 10 vg/마우스, 1 x 109 vg/마우스 또는 1 x 108 vg/마우스)의 입체택시 접종을 받았다. 12주 후, SN 및 선조체(Str)에서의 GFP 및 hαSyn의 발현을 면역형광(IF)으로 평가하였고, 티로신 하이드록실라제 양성(TH+) 세포를 SN에서 면역조직화학(IHC)에 의해 정량하고, 빔 검정에 의해 운동 성능을 평가하였다. 각 실험군의 마우스 수는 괄호 안에 표시되어 있다. *는 분석 전에 마우스 한 마리가 사망한 그룹을 나타냅니다. 각 분석은 괄호 안에 해당 결과가 표시된 용지 본문의 그림 수를 나타냅니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: T-세포 침윤, 신경염증 및 hαSyn 발현의 동역학을 결정하기 위한 실험 설계. Foxp3gfp 리포터 마우스를 마취시키고, CBA 프로모터의 제어 하에 인간 α-시누클레인 (AAV-hαSyn)을 코딩하는 AAV (1 x 10 vg/마우스)의 입체택시 접종을 우측 흑질(SN) 또는 가짜 수술(PBS)로 받았다. 마우스를 상이한 시점에서 희생시키고, SN 및 선조체에서의 hαSyn의 발현을 면역형광 (IF), GFP (Foxp3), CD4, 및 티로신 하이드록실라제 양성 (TH+) 세포에 의해 평가하였고, SN에서의 IF에 의해 정량하고, 선조체 (Str)에서의 Iba1 발현을 면역조직화학(IHC)에 의해 분석하였다. 각 실험군의 마우스 수가 표시되어 있다. 각 분석에 포함된 시점의 범위가 표시됩니다. 각 분석은 괄호 안에 해당 결과가 표시된 용지 본문의 그림 수를 나타냅니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에서 분석 된 신경 변성의 마우스 모델은 αSyn 병리학 및 미세 아교 활성화에 관련된 메커니즘, 신경 염증의 조절에 말초 면역 체계의 관여 및 신경 변성의 메커니즘을 포함하여 파킨슨 병의 병리 생리학과 관련된 많은 중요한 측면을 연구하는 데 도움이 될 수 있습니다. αSyn 병리학에 관여하는 메카니즘 중에는SN2의 도파민성 뉴런에서 αSyn의 과도한 부하가 존재하는 미토콘드리아, 리소말, 또는 프로테아좀 기능장애와 관련된 세포내 기전이 있다. AAV 매개된 형질도입에 의해 유도된 hαSyn 발현 이외에도, 내인성 마우스 αSyn이 또한 총 αSyn 발현의 부하에 기여한다는 것을 고려하는 것이 중요하다. αSyn을 과발현하는 트랜스제닉 마우스는 hαSyn32의 과발현에 기초한 이들 마우스 모델에 유사한 시누클레인 병리학, 신경병리학 및 운동 장애를 개발한다. 미세아교세포 활성화와 관련하여, 본 마우스 모델은 사이토카인, 신경전달물질, 성상세포, 뉴런, 혈액-뇌 장벽 및 T 세포와 같은 상이한 분자 및 세포 플레이어가 전염증성 또는 항염증 기능적 표현형의 획득을 어떻게 조절할 수 있는지를 연구하는데 사용될 수 있다 8,10,11 . 이 모델은 또한 T 세포뿐만 아니라 대식세포, 단핵구 및 호중구를 포함한 말초 면역계의 역할을 니그랄 뉴런의 신경 염증 및 신경 변성 과정에 연구하는 데 중요한 도구입니다 11,33,34. 마지막으로, 이러한 마우스 모델은 또한 산화 스트레스, 에너지 결핍, 및 손상된 소기관(2)과 같은 내부 세포 과정에 의해 유도되는 것들, 또는 외부 플레이어에 의해 발휘되는 것들, 예컨대 미세아교세포, 성상세포, 및 세포독성 T 세포에 의해 생성된 신경독성 인자(8)를 포함하는 생체내에서 신경변성의 세포 및 분자 메카니즘을 연구하는데 유용한 시스템을 나타내고, 28,29,35.
이 마우스 모델의 한계는 뇌외 위치에서 αSyn의 병리학 적 응집이 파킨슨 병 발병의 초기 단계를 구성 할 수있는 방법에 대한 연구입니다36. 이와 관련하여, nigral 뉴런의 신경 변성 및 운동 장애 전에, αSyn 병리학은 장 점막 및 후각 상피(36 )에서 시작되고, 아마도 αSyn 특이적 T 세포 반응 뿐만 아니라12 일 것이라는 증거가 증가하고 있습니다. 그 후, αSyn 응집체는 미주 신경을 통해 뇌간으로 이동하여 도파민성 뉴런(12)의 신경염증 및 신경변성을 촉발시킨다. AAV-hαSyn 모델이 파킨슨 병의 대부분의 측면을 되풀이하지만,이 모델에서 대뇌 외 위치에서 αSyn의 병리학 적 응집에 대한 명백한 개입은 없습니다. 파킨슨 병의 이러한 측면을 연구하기에 적합한 hαSyn 병리학을 포함하는 대안 모델은 Thy1 프로모터, Thy1-SNCA 모델37의 제어하에 hαSyn을 과발현하는 트랜스제닉 마우스일 수 있으며, 여기서 질병 발달은 장내 미생물에 의존하고 명백한 위장 장애38을 수반한다.
파킨슨 병의 병리 생리학과 관련된 다양한 과정의 연구에 도움이되지만, 본 마우스 모델은 상응하는 공간 좌표에서 바이러스 벡터의 올바른 전달, 뉴런에서의 hαSyn의 선택적 발현 (AAV 혈청형 및 벡터 구성물에 의존함)을 포함하여 미세하게 검사되어야하는 중요한 단계를 포함합니다. 파킨슨병 표현형을 분석하기 전에 적절한 AAV 투여량 및 타이밍을 포함한다. SN에서 바이러스 벡터의 적절한 전달에 대한 분석은 바늘이 완전히 직선이 아닐 때 충분하지 않을 수 있기 때문에 SN에서 바이러스 벡터의 적절한 전달에 대한 분석이 필요하며, 때로는 인간의 눈에 인식 할 수 없습니다. 더욱이, AAV 벡터의 확산은 AAV 혈청형39에 의존한다. 이러한 이유로, SN의 영역을 포함하는 뇌 절편에서 GFP의 관찰에 이어 주입된 AAV-GFP 벡터의 정확한 전달 및 확산을 점검하는 주기적인 품질 관리를 수행할 필요가 있다.
뉴런에서의 hαSyn의 선택적 발현과 관련하여, 원칙적으로, hαSyn의 발현은 뉴런에 대해 선택적인 프로모터에 의해 조절되도록 조작될 수 있거나, 훨씬 더 정확하게는 도파민성 뉴런에 대해 선택적이며, 예를 들어 도파민성 뉴런(40)에서 유전자의 선택적 발현을 유도하기 위해 AAV 벡터에서 TH 프로모터를 사용하는 것과 같은 도파민성 뉴런에 대해 선택적일 수 있다. . 그러나이 전략은 추구되는 것이 관심있는 유전자의 과발현 일 때 작동하지 않습니다. 이러한 이유로, 본 모델에서는, 강력한 프로모터(하류 유전자의 높은 발현을 유도하는 프로모터) 및 AAV 혈청형을 뉴런 트로피즘과 함께 사용하는 것이 필수적이다. 이 연구에서, CBA 프로모터는 hαSyn의 과발현을 유도하기 위한 강력한 프로모터로서 사용되었고, AAV5 혈청형은 바이러스 벡터에 사용되었다. 이 혈청형은 마우스 및 래트 뉴런(41,42)을 형질도입하기 위해 이전에 사용되어 왔다. 여기서, 결과는, 마우스의 SN에서 AAV5-GFP의 전달 12주 후, 녹색 형광이 SN 및 선조체 둘 다의 동측성 측에 선택적으로 존재한다는 것을 입증하였고(도 1), 이는 nigrostriatal 경로의 뉴런의 효율적인 형질도입을 나타낸다.
파킨슨 병의이 마우스 모델의 또 다른 중요한 측면은 수술 후 특정 과정을 분석하는 데 필요한 시점입니다. 이와 관련하여이 연구는 병리학과 관련된 다양한 과정에 대한 운동 학적 연구를 보여줍니다. 주요 시점이 마우스당 주어진 바이러스 게놈의 용량, 사용된 AAV의 혈청형, 또는 사용된 AAV의 배치에 따라 변화하기 때문에, TH+ 뉴런 및 운동 장애의 유의한 손실을 유도하는데 필요한 AAV-αSyn의 양에 대한 용량-반응 분석이 먼저 수행되었다. 이전의 연구들은 마우스당 6 x 108-3 x 10 바이러스 게놈 16,17,30,31 범위의 용량으로 마우스에서 AAV-αSyn 주사를 12주 동안 투여한 후 심각한 운동 장애와 니그로스트리아 경로의 TH+ 뉴런의 손실을 보여주었다. 따라서 nigrostriatal 경로에서 hαSyn 발현을 유도하는 데 사용되는 AAV-hαSyn의 용량, TH + 뉴런의 손실 및 마우스의 운동 손상은 마우스 당 1 x 108-1 x 10바이러스 게놈 범위였습니다. 또한, TH+ 뉴런의 소실 및 운동 장애가 SN의 뉴런의 AAV 감염이 아닌 SN에서의 hαSyn의 과발현에 의해 유도되는 것을 조절하기 위해, 마우스의 SN에서 일방적으로 전달된 리포터 유전자(AAV-eGFP)를 암호화하는 AAV가 포함된 대조군이 포함되었고 신경변성 및 운동 장애가 결정되었다. 그 결과, 입체택시 수술 후 12주 후, 마우스당 1 x 10 바이러스 게놈이 AAV5-hαSyn의 적절한 투여량이었으며,이 바이러스 부하를 받은 마우스는 nigrostriatal pathway에서 유의한 hαSyn을 나타냈으며(도 2 및 도 3), TH+ 뉴런의 손실(도 4), 및 운동 장애(도 5). 대조적으로, AAV5-hαSyn (마우스 당 1 x 108 바이러스 게놈 및 마우스 당 1 x 109 바이러스 게놈)의 낮은 용량은 이러한 모든 매개 변수에서 중요한 변화에 도달 할만큼 충분히 강하지 않았습니다 (그림 2-4). 참고로, 마우스 당 1 x 10 바이러스 게놈에서 AAV-GFP의 투여는 니그랄 도파민성 뉴런의 TH+ 뉴런의 낮은 (~20%), 그러나 상당한 정도의 손실을 유도하였다 (도 4A, B). 이 결과는 이 모델41을 사용한 이전의 관찰과 일치하며, 아마도 SN에 AAV 벡터의 투여에 의해 유도된 낮은 수준의 신경염증의 결과일 것이다. 그럼에도 불구하고, TH+ 뉴런의 손실 정도는 AAV-GFP의 동일한 투여량을 투여받은 마우스와 비교하여 AAV5-hαSyn을 투여받은 마우스에서 유의하게 더 높았다(도 4C). 참고로, hαSyn 발현의 동역학은 형질도입의 효율뿐만 아니라 AAV 확산(39)의 정도에 의존한다. AAV 확산은 AAV 혈청형에 의존하기 때문에, 이 동물 모델의 정확한 핵심 시점은 AAV5와 상이한 다른 AAV 혈청형을 사용할 때 달라질 수 있다.
그 후, 이 마우스 모델에서 주요 시점을 결정하기 위해 마우스당 1 x10 바이러스 게놈을 사용하여 동역학 분석을 수행하였다. 현재의 증거는 파킨슨 병 43,44의 조기 진단을 허용하는 운동 장애 이전에 나타나는 몇 가지 초기 증상을 보여 주었기 때문에이 실험은 hαSyn 발현이 이미 분명하지만 운동 장애가없는 시점을 찾고자했습니다. 결과는 SN에서 hαSyn 발현의 개시가 AAV-hαSyn의 입체택시 전달 후 5주째에 있었다는 것을 보여준다(도 6). 이 시점은 신경염증 및 신경퇴행성 과정을 중단시키기 위해 맞춤화된 치료법을 투여하기 시작하는 흥미로운 시간적 시점을 구성한다. 여기서 결정된 다른 주요 시점은 신경염증 과정과 관련된 두 가지 중요한 사건에 대한 피크 시간, 즉 미세아교세포가 최대 활성화 정도에 도달하는 시간과 SN으로의 최대 T 세포 침윤 시간이었다. 결과는 최대 미세아교세포 활성화의 두 파동에 도달하는 추세를 가진 곡선을 보였으며, 첫 번째는 수술 후 10주에, 두 번째는 수술 후 15주에 도달했습니다(그림 7). T 세포 침윤의 동역학적 분석은 입체택시 수술 후 11주째에 SN 내로의 Treg 침윤의 피크 시간을 나타내었다(도 8). 놀랍게도, 분석된 기간 동안 SN에 침윤하는 이펙터 T 세포(CD4+ Foxp3-)는 검출되지 않았다(수술 후 8-13주). 전체적으로, 이러한 결과는 이 전임상 모델을 사용하여 신경염증 과정을 중단하고 SN으로의 T-세포 침윤을 감쇠시키는 데 초점을 맞춘 치료법을 투여하기 시작하는 적절한 기간을 시사하며, 이는 수술 후 5주째(hαSyn 과발현의 발병)와 수술 후 10주째(신경염증 및 T-세포 침윤의 첫 번째 파동)(그림 9) 사이입니다.
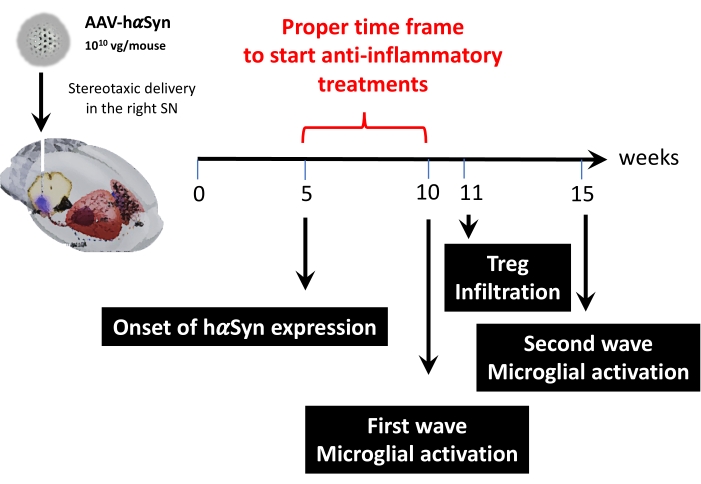
그림 9: 이 동물 모델에 대해 발견된 주요 시점 요약. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
공개
저자들은 연구가 재정적 또는 비 재정적 경쟁 이익이없는 상태에서 수행되었다고 선언합니다.
감사의 말
우리는 Sebastián Valenzuela 박사와 Micaela Ricca 박사가 동물 시설에서 귀중한 수의학 지원을 해준 것에 감사드립니다. 이 연구는 "Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID" Centro Ciencia & Vida, FB210008 (to Fundación Ciencia & Vida), Geroscience Center for Brain Health and Metabolism, FONDAP-15150012의 지원을 받았다. 이 작품은 또한 "Agencia Nacional de Investigación y Desarrollo de Chile (ANID)"및 MJFF-10332.01 (R.P.) 및 MJFF-17303 (F.C.)의 FONDECYT-1210013 (R.P.) 및 MJFF-17303 (F.C.)을 파킨슨 연구 재단의 보조금으로 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| ANIMALS AND ANIMAL FOOD | |||
| Foxp3-GFP C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 023800 | |
| Laboratory Rodent Diet | LabDiet | Rodent Diet 5001 | Standard Rodent diet |
| Wild-type C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 000664 | |
| VIRAL VECTORS | |||
| AAV5-CBA-αSyn | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 10E13 vg/mL |
| AAV5-CBA-eGFP | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 9.5 x 10E12 vg/mL |
| ANESTHETICS AND ANALGESICS | |||
| Isoflurane | Baxter | 218082 | 1% for stereotaxic surgery |
| Ketamine | Drag Pharma | CHE30 | 70 mg/Kg for stereotaxic surgery |
| Sevoflurane | Baxter | VE2L9117 | For before transcardial perfusion |
| Tramadol | Drag Pharma | DPH134 | 30 mg/Kg every 24 h |
| Xylazine | Centrovet | EHL40 | 9 mg/kg for stereotaxic surgery |
| EQUIPMENT | |||
| Beam test | Home made | N/A | horizontal beam 25 cm length and 3 cm width. The beam surface was covered by a metallic grid (1 cm2). |
| Cryostate | Leica | CM1520 | |
| Digital camera | Nikon | S2800 Coolpix | For recording the beam test performance |
| Microscope | Olympus | BX51 | Used for IHC analysis (section 4.4) |
| Microscope | Olympus | IX71 | Used for IF analysis (section 5.3) |
| Microscope | Leica | DMI8 | Used for IF analysis (section 5.7) |
| New Standard Stereotaxic, mouse | Stoelting, Wood Dale, IL, USA | 51500 | stereotaxic frame for surgery |
| Peristaltic Pump | Masterflex | C-flex L/S16 | |
| Power supply unit | Olympus | U-RFL-T | Used for IF analysis (section 5.3) |
| Surgical suture | Sylkam®, B Braun | C0760171 | |
| Syringe 100 U | BD | 324918 | For anesthesia before transcardial perfusion, 29G needle |
| Syringe RN 5uL SYR W/O NEEDLE | Hamilton | HA-7641-01 | For viral vector innoculation |
| BUFFERS AND REAGENTS | |||
| Aviden, Peroxidase Conjugate | Merck, Darmstadt, Germany | 189728 | |
| Bovine Serum Albumin | Merck, Darmstadt, Germany | 9048-46-8 | |
| Cryotrotection buffer | Home made | N/A | 20% glycerine and 2% DMSO in PBS |
| DAPI | Abcam | ab228549 | |
| Diaminobenzidine | Merck, Darmstadt, Germany | D8001 | |
| Fluoromount -G T | Electron Microscopy Science | 17984-25 | |
| Gelatin | Merck, Darmstadt, Germany | 104078 | |
| Normal goat serum | Jackson ImmunoResearch Laboratory | 5000121 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 104005 | |
| PBS | Home made | N/A | 0.125 M, pH 7.4 |
| Peroxidase inactivating buffer | Home made | N/A | 0.03% H2O2 in methanol |
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| Trizma Hydrochloride | Merck, Darmstadt, Germany | 1185-53-1 | |
| Tween 20 | Sigma-Aldrich | 822184 | |
| ANTIBODIES | |||
| Biotin-SP (long spacer) AffiniPure Goat Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch Laboratory | 111065003 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11010 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 647 | ThermoFisher Scientific | A21244 | |
| Goat anti-Rat IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11081 | |
| Rabbit monoclonal anti-alpha-Synuclein | Abcam | ab138501 | |
| Rabbit monoclonal anti-Iba-1 | Abcam | EPR16588 | |
| Rabbit polyclonal anti-Tyrosine Hydroxylase | Millipore | AB152 | |
| Rat monoclonal anti-CD4 | Biolegend | 100402 | |
| SOFTWARES | |||
| GraphPad | Prism | 6.0 | Fos stats analysis |
| ImageJ | National Institute of Health | N/A | For image analysis |
| LAS X | Leica | N/A | For image capture with Leica microscope |
| ProgRes Capture Pro | Jenoptik | N/A | For image capture with Olympus microscope |
| VLC media player | VideoLAN Organization | N/A | For analysis of behavioural tests |
참고문헌
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiology of Aging. 24 (2), 197-211 (2003).
- Lim, K. L., Zhang, C. W. Molecular events underlying Parkinson's disease - An interwoven tapestry. Frontiers in Neurology. 4, 33(2013).
- Abdelmotilib, H., et al. α-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Mori, F., et al. Relationship among alpha-synuclein accumulation, dopamine synthesis, and neurodegeneration in Parkinson disease substantia nigra. The Journal of Neuropathology & Experimental Neurology. 65 (8), 808-815 (2006).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson's disease. Biochimica et Biophysica Acta. 1802 (1), 29-44 (2010).
- Vazquez-Velez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44, 87-108 (2021).
- Dehay, B., et al. Lysosomal impairment in Parkinson's disease. Movement Disorders. 28 (6), 725-732 (2013).
- Gonzalez, H., Elgueta, D., Montoya, A., Pacheco, R. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases. Journal of Neuroimmunology. 274 (1-2), 1-13 (2014).
- Pacheco, R. T-cell based immunotherapies for Parkinson's disease. Exploration of Neuroprotective Therapy. 1 (2), 72-85 (2021).
- Gonzalez, H., Contreras, F., Pacheco, R. Regulation of the neurodegenerative process associated to Parkinson's disease by CD4+ T-cells. Journal of Neuroimmune Pharmacology. 10 (4), 561-575 (2015).
- Gonzalez, H., Pacheco, R. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases. Journal of Neuroinflammation. 11 (1), 201(2014).
- Campos-Acuna, J., Elgueta, D., Pacheco, R. T-cell-driven inflammation as a mediator of the gut-brain axis involved in Parkinson's disease. Frontiers in Immunology. 10, 239(2019).
- Blesa, J., Phani, S., Jackson-Lewis, V., Przedborski, S. Classic and new animal models of Parkinson's disease. Journal of Biomedicine and Biotechnology. 2012, 845618(2012).
- Ulusoy, A., Decressac, M., Kirik, D., Bjorklund, A. Viral vector-mediated overexpression of alpha-synuclein as a progressive model of Parkinson's disease. Progress in Brain Research. 184, 89-111 (2010).
- Gomez-Benito, M., et al. Modeling Parkinson's disease with the alpha-synuclein protein. Frontiers in Pharmacology. 11, 356(2020).
- Song, L. K., et al. Targeted overexpression of alpha-synuclein by rAAV2/1 vectors induces progressive nigrostriatal degeneration and increases vulnerability to MPTP in mouse. PLoS One. 10 (6), 0131281(2015).
- Theodore, S., Cao, S., McLean, P. J., Standaert, D. G. Targeted overexpression of human alpha-synuclein triggers microglial activation and an adaptive immune response in a mouse model of Parkinson disease. Journal of Neuropathology and Experimental Neurology. 67 (12), 1149-1158 (2008).
- Sanchez-Guajardo, V., Annibali, A., Jensen, P. H., Romero-Ramos, M. alpha-Synuclein vaccination prevents the accumulation of parkinson disease-like pathologic inclusions in striatum in association with regulatory T cell recruitment in a rat model. Journal of Neuropathology and Experimental Neurology. 72 (7), 624-645 (2013).
- Sanchez-Guajardo, V., Febbraro, F., Kirik, D., Romero-Ramos, M. Microglia acquire distinct activation profiles depending on the degree of alpha-synuclein neuropathology in a rAAV based model of Parkinson's disease. PLoS One. 5 (1), 8784(2010).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular Neurodegeneration. 8, 44(2013).
- Cho, C., et al. Evaluating analgesic efficacy and administration route following craniotomy in mice using the grimace scale. Scientific Reports. 9 (1), 359(2019).
- Flecknell, P. Laboratory Animal Anaesthesia. 3rd Ed. , ElsevierAcademic Press. Cambridge, MA. (2009).
- Bind, R. H., Minney, S. M., Rosenfeld, S., Hallock, R. M. The role of pheromonal responses in rodent behavior: Future directions for the development of laboratory protocols. Journal of the American Association for Laboratory Animal Science. 52 (2), 124-129 (2013).
- Paxinos, G., Franklin, K. B. J. The Mouse Brain in Stereotaxic Coordinates. , Academic Press. Cambridge, MA. (2001).
- Elgueta, D., et al. Dopamine receptor D3 expression is altered in CD4+ T-cells from Parkinson's disease patients and its pharmacologic inhibition attenuates the motor impairment in a mouse model. Frontiers in Immunology. 10, 981(2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Fernandez-Suarez, D., et al. The monoacylglycerol lipase inhibitor JZL184 is neuroprotective and alters glial cell phenotype in the chronic MPTP mouse model. Neurobiology of Aging. 35 (11), 2603-2616 (2014).
- Elgueta, D., et al. Pharmacologic antagonism of dopamine receptor D3 attenuates neurodegeneration and motor impairment in a mouse model of Parkinson's disease. Neuropharmacology. 113, 110-123 (2017).
- Montoya, A., et al. Dopamine receptor D3 signalling in astrocytes promotes neuroinflammation. Journal of Neuroinflammation. 16 (1), 258(2019).
- Williams, G. P., et al. Targeting of the class II transactivator attenuates inflammation and neurodegeneration in an alpha-synuclein model of Parkinson's disease. Journal of Neuroinflammation. 15 (1), 244(2018).
- Benskey, M. J., et al. Silencing alpha synuclein in mature nigral neurons results in rapid neuroinflammation and subsequent toxicity. Frontiers in Molecular Neuroscience. 11, 36(2018).
- Rieker, C., et al. Neuropathology in mice expressing mouse alpha-synuclein. PLoS One. 6 (9), 24834(2011).
- Harms, A. S., et al. alpha-Synuclein fibrils recruit peripheral immune cells in the rat brain prior to neurodegeneration. Acta Neuropathologica Communications. 5 (1), 85(2017).
- Williams, G. P., et al. CD4 T cells mediate brain inflammation and neurodegeneration in a mouse model of Parkinson disease. Brain. 144 (7), 2047-2059 (2021).
- Matheoud, D., et al. Intestinal infection triggers Parkinson's disease-like symptoms in Pink1(-/-) mice. Nature. 571 (7766), 565-569 (2019).
- Jan, A., Goncalves, N. P., Vaegter, C. B., Jensen, P. H., Ferreira, N. The prion-like spreading of alpha-synuclein in Parkinson's disease: Update on models and hypotheses. International Journal of Molecular Sciences. 22 (15), 8338(2021).
- Chesselet, M. F., et al. A progressive mouse model of Parkinson's disease: The Thy1-aSyn ("Line 61") mice. Neurotherapeutics. 9 (2), 297-314 (2012).
- Sampson, T. R., et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease. Cell. 167 (6), 1469-1480 (2016).
- Ciron, C., et al. Human alpha-iduronidase gene transfer mediated by adeno-associated virus types 1, 2, and 5 in the brain of nonhuman primates: Vector diffusion and biodistribution. Human Gene Therapy. 20 (4), 350-360 (2009).
- Ben-Shaanan, T. L., et al. Activation of the reward system boosts innate and adaptive immunity. Nature Medicine. 22 (8), 940-944 (2016).
- Albert, K., Voutilainen, M. H., Domanskyi, A., Airavaara, M. AAV vector-mediated gene delivery to substantia nigra dopamine neurons: Implications for gene therapy and disease models. Genes. 8 (2), 63(2017).
- Bordia, T., Perez, X. A., Heiss, J., Zhang, D., Quik, M. Optogenetic activation of striatal cholinergic interneurons regulates L-dopa-induced dyskinesias. Neurobiology of Disease. 91, 47-58 (2016).
- Kim, A., et al. Upgraded methodology for the development of early diagnosis of Parkinson's disease based on searching blood markers in patients and experimental models. Molecular Neurobiology. 56 (5), 3437-3450 (2018).
- Lei, H., et al. Parkinson's disease diagnosis via joint learning from multiple modalities and relations. IEEE Journal of Biomedical and Health Informatics. 23 (4), 1437-1449 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유