Method Article
İnsan α-Sinükleini Kodlayan Adeno İlişkili Viral Vektörler Tarafından İndüklenen Parkinson Hastalığı Fare Modelinin Analizi
Bu Makalede
Özet
Bu çalışma, Parkinson hastalığının bu klinik öncesi modelinde nöroinflamasyonu, nörodejenerasyonu ve motor bozukluğu indüklemek için gereken vektör dozunu ve maruz kalma süresini analiz etmektedir. İnsan α-sinükleini kodlayan bu vektörler, Parkinson hastalığı ile ilişkili sinüklein patolojisini özetlemek için substantia nigra'ya verilir.
Özet
Parkinson hastalığı, nigrostriatal yolun dopaminerjik nöronlarının ölümünü ve sonuç olarak gönüllü hareketlerin kontrolünün ilerleyici kaybını içeren nörodejeneratif bir hastalıktır. Bu nörodejeneratif süreç, esas olarak α-sinükleinden oluşan beyindeki protein agregalarının birikmesiyle tetiklenir. Birçok çalışma, Parkinson hastalığı ile ilişkili nörodejenerasyonu geliştirmek için nöroinflamasyonun gerekli olduğunu göstermiştir. Özellikle, nöroinflamatuar süreç, mikroglial aktivasyonun yanı sıra periferik T hücrelerinin substantia nigra'ya (SN) infiltrasyonunu içerir. Bu çalışma, mikroglial aktivasyonu, SN'ye T hücresi infiltrasyonunu, nigral dopaminerjik nöronların nörodejenerasyonunu ve motor bozukluğu özetleyen Parkinson hastalığının bir fare modelini analiz etmektedir. Parkinson hastalığının bu fare modeli, insan vahşi tipi α-sinükleini (AAV-hαSyn) SN'ye kodlayan adeno ilişkili viral vektörlerin stereotaksik olarak verilmesiyle indüklenir. Viral vektörlerin SN'ye doğru şekilde verilmesi, yeşil floresan proteini (GFP) kodlayan kontrol vektörleri kullanılarak doğrulandı. Daha sonra, SN'de uygulanan AAV-hαSyn dozunun hαSyn ekspresyonunun derecesini nasıl etkilediği, nigral dopaminerjik nöronların kaybı ve motor bozulma değerlendirildi. Ayrıca, hαSyn ekspresyonu, mikroglial aktivasyon ve T-hücresi infiltrasyonunun dinamikleri, hastalık gelişiminin seyri boyunca belirlendi. Bu nedenle, bu çalışma, Parkinson hastalığının bu klinik öncesi modelinde sinüklein patolojisini ve nöroinflamasyonu hedeflemek için yararlı olabilecek kritik zaman noktaları sunmaktadır.
Giriş
Alzheimer hastalığından sonra, Parkinson hastalığı dünya çapında en yaygın ikinci nörodejeneratif hastalıktır. Parkinson hastalığında etkilenen birincil nöronlar, dopamin üreten ve gönüllü hareketi kontrol eden nigrostriatal yolun nöronlarıdır. Sonuç olarak, bu bozuklukla ilişkili en karakteristik semptom motor bozukluktur. Bu patoloji aynı zamanda beyinde, esas olarak presinaptik terminallerle ilişkili sitozolik bir protein olan α-sinükleinden (αSyn)1 oluşan protein agregalarının birikmesini de içerir. Kanıtlar, αSyn'in patojenik inklüzyonları oluşumunun, yanlış katlanarak veya bu proteinin bazı post-translasyonel modifikasyonları tarafından tetiklendiğini göstermiştir2.
Özellikle, αSyn patolojisi ile insan Parkinson hastalığında ve hayvan modellerinde nigrostriatal yolun dopaminerjik nöronlarının kaybı arasında yakın bir ilişki kurulmuştur 3,4. αSyn agregalarının nasıl üretildiğini ve nöronal ölümü nasıl indüklediklerini anlamak, bu alanda önemli bir zorluğu temsil eder. Giderek artan bir grup çalışma, oksidatif stresi artırarak, mitokondriyal disfonksiyonun αSyn agregalarının2 oluşumunun önde gelen nedenlerinden biri olduğunu göstermiştir. Gerçekten de, Parkinson hastalığı riski ile ilişkili birkaç gen, mitokondriyal fonksiyon, morfoloji ve dinamiklerde rol oynayan proteinleri kodlar 5,6. Ek olarak, işlevsiz mitokondri birikimi ve yanlış katlanmış αSyn ile sonuçlanan lizozomal disfonksiyon, αSyn agregaları7'nin oluşumunu teşvik eden bir başka önemli olayı oluşturur.
Ortaya çıkan kanıtlar, αSyn agregaları beyinde biriktiğinde, bu patojenik proteinlerin mikroglia üzerindeki toll benzeri reseptörleri (TLR'ler) uyardığını, böylece substantia nigra (SN) 8,9'da mikroglial aktivasyonu ve ilk enflamatuar ortamı tetiklediğini göstermiştir. Ayrıca, kanıtlar αSyn agregalarının yakalandığını ve antijen sunan hücreler tarafından T hücrelerine sunulduğunu ve αSyn10,11'e özgü adaptif bir bağışıklık tepkisini indüklediğini göstermektedir. Bu αSyn-spesifik T hücreleri daha sonra beyne sızar ve aktif mikroglia tarafından yeniden uyarılır, böylece nöronal ölümü uyandıran nörotoksik faktörlerin salgılanmasını teşvik eder 9,10. İlginç bir şekilde, birkaç kanıt dizisi, αSyn agregalarının önce enterik sinir sisteminde üretildiğini ve daha sonra vagus sinirinden beyin sapına taşındığını ileri sürmüştür12.
Parkinson hastalığının çeşitli hayvan modelleri, nörotoksik maddelerin (yani, 6-hidroksidopamin, paraquat, rotenon, 1-metil-4-fenil-1,2,3,6-tetrahidropiridin) ve genetik koşulları içerenler (yani, mutant α-sinüklein, mutant lösin bakımından zengin tekrarlayan kinaz 2) uygulanmasıyla indüklenenler de dahil olmak üzere uzun yıllardır kullanılmaktadır. . Parkinson hastalığının bazı yönlerini kopyalayan nörotoksin kaynaklı nörodejenerasyonu içeren modellere rağmen, hiçbiri hastalığın tüm temel yönlerini özetlemez veya ilerleyici değildir13. Öte yandan, lösin bakımından zengin tekrar kinaz 2'nin mutant versiyonlarının ekspresyonunu, α-sinükleinin mutant versiyonlarını veya insan vahşi tip α-sinükleinin aşırı ekspresyonunu içeren genetik fare modelleri, motor bozulmaya ve bazı durumlarda sinükleinopatinin gelişmesine neden olsa da, Parkinson hastalığının önemli bir yönü olan nigral dopaminerjik nöronların belirgin nörodejenerasyonunu yeniden üretmezler13, 14. Üçüncü bir tür nörodejenerasyon hayvan modeli, Parkinson hastalığının temel yönlerinin çoğunu, insan α-sinükleini (AAV-hαSyn) kodlayan adeno ilişkili viral vektörlerin (AAV'ler) stereotaksik olarak verilmesini sağlamayı başarmıştır 14,15. Önemli olarak, AAV'ler, yüksek etkinliğe sahip nöronların transdüksiyonuna ve memelilerin yetişkin beyninde uzun vadede izin verir. Ayrıca, SN'deki AAV-hαSyn'in stereotaksik iletiminin, αSyn patolojisi, mikroglial aktivasyon, nörodejenerasyon ve motor bozukluk16,17,18,19,20 dahil olmak üzere hastalığın temel yönlerinin çoğunu yeniden ürettiği gösterilmiştir. Bu çalışma, viral vektör dozunun ve viral vektör dağıtımından sonraki sürenin, nigrostriatal yolaktaki hαSyn ekspresyonunun, nörodejenerasyonun ve nöroinflamasyonun derecesini ve ayrıca SN'deki hαSyn'in tek taraflı stereotaksik iletiminin fare modelinde motor bozulma derecesini nasıl etkilediğinin bir analizini sunmaktadır.
Protokol
Tüm çalışmalar Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'nun 8. baskısı altında gerçekleştirilmiştir. Deneysel protokoller, anestezi, ağrı, sıkıntı ve ötenazi içerenler de dahil olmak üzere Fundación Ciencia & Vida'daki (Yaşam için Bilim Vakfı) IACUC tarafından onaylandı (İzin numarası P-035/2022).
1. Stereotaksik cerrahi
- Ameliyata hazırlık (yaklaşık 1 saat)
- Aseptik bir ortamı korumak için, tüm ameliyat boyunca ayakkabı kapakları, cerrahi maske, sıhhi bariyer, eldiven ve cerrahi başlık dahil olmak üzere uygun cerrahi kıyafetler giyin.
- Aseptik bir ortam sağlamak için fareye ve tüm cerrahi malzemelere %70 etanol püskürtün.
- Analjezi indüklemek için, fareye ameliyattan 1 saat önce başlayıp ameliyattan 3 gün sonrasına kadar devam eden her 12 saattebir deri altından 5 mg / kg karprofen (s.c.) enjekte edin.
- Fareyi anestezik etmek için, hayvanı bir indüksiyon odasına yerleştirin. İzofluran akışını %0,5 oranında açın ve ardından fare sağ refleksini kaybedene kadar yaklaşık 5 dakika içinde yavaşça %5'e kadar artırın22.
- Hayvanı indüksiyon odasından çıkarın. Hayvanı derhal uygun büyüklükte bir burun konisi ile solunum yapmayan bir devreye aktarın. Fare anestezisini ameliyat süresi boyunca% 1 izofluran ile koruyun.
- Farenin kuyruğunu ve pençelerini sıkıştırarak tamamen uyuşturulduğunu doğrulayın. Fare kuyruğunu ve pençelerini sıkıştırmaya tepki vermediğinde, farenin tamamen uyuşturulduğu anlamına gelir.
- Makas kullanarak farenin kafasını tıraş edin. Farenin cildini% 2 klorheksidin içeren bir pamuklu çubukla temizleyin ve tüm saçları çıkarın.
- Farenin kafasını stereotaksik çerçeveye sabitleyin.
- Pamuklu çubukla her iki fare gözüne de kornea koruyucusu yerleştirin. Diğer kemirgenlerde stres indüksiyonunu önlemek için, ameliyat odasında başka bir farenin varlığından kaçının23.
- Ameliyat (yaklaşık 30 dk.)
- Farenin kafasını üç tur% 2 klorheksidin ve% 70 etanol ile temizleyin. Kafatasını cerrahi malzeme kullanarak ortaya çıkarın ve aşağıdaki koordinatlarda bir matkapla ince bir delik açın: anteroposterior -2.8 mm ve medial çizgiye göre mediolateral 1.4 mm.
- 10 μL'lik bir şırınganın iğnesini deliğe koyun ve dura24'e göre -7.2 mm dorsoventral'a ulaşana kadar iğneyi beynin içinde yavaşça hareket ettirin.
- Dokunun biraz yerleşmesine izin vermek için iğneyi 2 dakika boyunca son pozisyonda bırakın ve ardından 0.2 μL / 30 s oranında sağ substantia nigra'ya 1 μL AAV5-CBA-hαSyn (AAV-hαSyn), AAV5-CBA-eGFP (AAV-GFP) veya araç (pH 7.4'te PBS; sahte cerrahi) enjekte edin.
- Viral vektörlerin verilmesinden sonra iğneyi 5 dakika boyunca aynı pozisyonda bırakın ve ardından yavaşça çekin.
- Ameliyat sonrası (yaklaşık 5 dakika)
- Steril ipek örgülü emilemeyen bir dikiş kullanarak yarayı kapatın.
- Fareyi, elektrikli ısıtmalı bir yatağın (25 ° C) üzerine yerleştirerek önceden ısıtılmış ev kafesine koyun.
NOT: Fare, zorluk çekmeden yürüyene ve yara iyileşene kadar ev kafesinde tek başına tutulmalıdır.
2. Kiriş testi kullanılarak motor performansının belirlenmesi
- Eğitim (fare başına yaklaşık 15 dakika)
- Stereotaksik cerrahiden on iki hafta sonra,25'ten önce tarif edilen ışın testinin basitleştirilmiş bir versiyonunu kullanarak motor performansını değerlendirin. Bu amaçla, 25 cm uzunluğunda ve 3 cm genişliğinde yatay bir kiriş kullanın. Kiriş yüzeyi, 1 cm kareli metalik bir ızgara ile kaplanmalı ve kirişin 1 cm üzerinde yükseltilmelidir.
- Farenin, ızgara yüzeyi ışınını bir uçtan ev kafesinin bulunduğu kirişin karşı ucuna doğru geçtiği bir video çekin. Motor performansının belirlenmesinden önce fareyi 2 gün boyunca eğitin.
- İlk gün, fareyi ızgara olmadan ışının içinden beş kez yürümesi için eğitin.
- İkinci gün, fareyi ızgaranın varlığında ışının içinden beş kez yürümesi için eğitin.
- Test (fare başına yaklaşık 5 dakika)
- Üçüncü günde, motor performansını değerlendirin. Bunu yapmak için, videoları ağır çekim modunda izleyerek sol pençeler veya sağ pençeler tarafından gerçekleştirilen hataların sayısını ayrı ayrı ölçün.
NOT: Bir hata, bir pençenin ızgaraya doğru şekilde basmaması ve bu nedenle ızgaranın yan tarafında veya ızgara ile kiriş yüzeyi arasında görünür hale gelmesi olarak tanımlanır.
- Üçüncü günde, motor performansını değerlendirin. Bunu yapmak için, videoları ağır çekim modunda izleyerek sol pençeler veya sağ pençeler tarafından gerçekleştirilen hataların sayısını ayrı ayrı ölçün.
3. Doku işleme
- Transkardiyal perfüzyon (fare başına yaklaşık 15 dakika)
- Fareyi anestezik etmek için, 1 mL'lik bir şırınga ve 27 G iğne26 kullanarak intraperitoneal olarak (i.p.) ketamin (80 mg / kg) ve ksilazin (10 mg / kg) karışımı enjekte edin.
- Fare tamamen anestezi altına alındıktan sonra (adım 1.1.6.'daki gibi onaylanmıştır), toraksı cerrahi malzeme ile açın ve kalbi açığa çıkarın.
- Ardından, kalbin sol ventrikülüne 21 G'lik bir iğne yerleştirin (matkap kullanarak ucu düz hale getirin).
- İğneyi bir boruya bağlayarak, peristaltik bir pompa kullanarak 50 mL PBS (pH 7.4) perfüze edin.
- Beynin sabitlenmesi ve kriyoproteksiyonu (beyin başına yaklaşık 10 dakika)
- Makas ve cımbız kullanarak beyni çıkarın ve ardından 24 saat boyunca 4 ° C'de PBS'de (pH 7.4) 5 mL% 4 paraformaldehit daldırarak sabitleyin.
- Daha sonra, sabit beyni 48 saat boyunca 4 ° C'de% 30 sakkarozun 15 mL'sine koyun.
- Daha sonra, beyni 4 mL kriyoproteksiyon çözeltisine (PBS'de% 20 gliserin ve% 2 DMSO) koyun ve beyni -80 ° C'de saklayın veya bir sonraki adımda hemen kullanın.
- Beyin dilimleri elde etmek (beyin başına yaklaşık 20 dakika).
NOT: Koronal kesikler yapmak için beynin bir kriyostata uygun bir pozisyonda yerleştirildiğinden emin olun.- SN dilimleri elde etmek için, beyni -2,92 mm'den başlayıp -3,64 mm 24'te bitirerek40 μm kalınlığında bölümlere ayırın.
- Her dilimi,25,27,28'den önce tarif edildiği gibi anteroposterior bir sırayı takiben 24 kuyucuklu bir plakanın bir kuyusunda (1 mL kriyoproteksiyon çözeltisi içeren) hasat edin.
- SN'de immünohistokimyasal (bölüm 4.) ve immünofloresan analizleri (bölüm 5.) yapmak için, 25,27,28'den önce açıklandığı gibi, çekirdeğin tüm rostrokaudal derecesini (toplamda 720 μm) kapsayan tek tip aralıklarla (120 μm) alınan altı koronal SN bölümünü seçin.
- Striatal dilimler elde etmek için, beyni +1.34 mm'den başlayıp -0.26 mm 24'te bitirerek40 μm kalınlığında bölümlere ayırın.
- Her dilimi, anteroposterior bir sırayı takiben 2 mL'lik bir kriyotüp (1 mL kriyoproteksiyon çözeltisi içeren) içinde hasat edin.
- Striatumda immünohistokimyasal (bölüm 4.) ve immünofloresan analizleri (bölüm 5.) yapmak için, çekirdeğin tüm rostrokaudal derecesini (toplamda 1600 μm) kapsayan düzgün aralıklarla (320 μm) alınan beş koronal striatal bölüm seçin.
4. Dopaminerjik nöronları ve mikrogliozu ölçmek için immünohistokimyasal analiz (yaklaşık 2 gün)
- Striatal veya nigral dilimlerin immünohistokimyasal analizi için, aynı beyinden beş (striatum) veya altı (SN) dilim setini 24 delikli bir plakanın bir kuyucuğuna yerleştirin.
- Bölümleri 3x'i 1 mL PBS ile yıkayın ve daha sonra endojen peroksidaz aktivitesini inaktive etmek için oda sıcaklığında ve 30 dakika boyunca çalkalama ile metanolünde% 0.03H2O2 0.5 mL ile inkübe edin.
- Bölümleri 3x'te 1 mL PBS ile yıkayın ve 0,5 mL blokaj çözeltisi (% 4 keçi serumu,% 0,05 Triton X-100 ve% 4 BSA) ile oda sıcaklığında ve 40 dakika boyunca çalkalama ile inkübe edin.
- Daha sonra, oda sıcaklığında ve gece boyunca ajitasyonla primer antikor (tavşan anti-tirozin hidroksilaz [TH] pAb seyreltilmiş 1:1000 [bakınız Tablo 1]; veya tavşan anti-Iba1 antikoru seyreltilmiş 1:1000) içeren 0,5 mL bloke edici çözelti ile inkübe edin.
- 3x kesitlerini 1 mL PBS ile yıkayın ve biyotinile keçi anti-tavşan pAb (1:500, bakınız Tablo 1) içeren 0,5 mL bloke edici çözelti ile oda sıcaklığında ve 2 saat boyunca ajitasyonla inkübe edin.
- Daha sonra, 3x kesitleri 1 mL PBS ile yıkayın ve oda sıcaklığında bloke çözeltisinde ve 90 dakika boyunca ajitasyonla 0,5 mL peroksidaz konjuge avidin (1:5000, bakınız Tablo 1) ile inkübe edin.
- Bölümleri 3x, 1 mL PBS ile yıkayın ve 0,5 mL substrat çözeltisi (pH 7,6'da %0,03 H2 O 2/Trizma-HCl tamponunda %0,05 diaminobenzidin) ile inkübe edin. Bu adım için eldiven ve laboratuvar önlüğü giyin, çünkü diaminobenzidin potansiyel bir kanserojendir.
- Spesifik boyama belirgin olduğunda (tipik olarak TH için 30 saniye ve Iba1 için 5 dakika), substrat çözeltisini çıkarın ve 3x bölümlerini oda sıcaklığında ve ajitasyonda 1 mL PBS ile yıkayın. Her zaman aynı deneyde yer alan tüm beyin dilimlerinin immün boyamasını aynı anda gerçekleştirin.
NOT: TH'nin spesifik boyanması, beyinde karakteristik bir şekil gösteren SN bölgesinde TH immün boyaması ortaya çıktığında belirgindir. Iba1'in spesifik işareti, mikroskop gözlemi ile doğrulanan tipik mikroglial şekillere sahip kontrol beyin dilimlerinde Iba1 immün boyama göründüğünde belirlenir. Bu şekilde, IHC analizi için substrat açıklığının tam zamanı her bir deney için belirlenir. - Beyin bölümlerini 0.05 M Tris'te (pH 7.6) % 0.2'lik bir jelatin çözeltisi kullanarak cam slaytlara monte edin. Aynı beyinden elde edilen beş (striatum) veya altı (SN) dilimden oluşan her seti rostrokaudal sırayla aynı cam slayta yerleştirin.
- SN'deki TH+ nöronlarının sayısını sayın.
- SN'deki TH+ nöronlarını ölçmek için, 25,27,28'den önce açıklandığı gibi parlak alan mikroskobu kullanarak20x büyütmede altı dilimin fotoğraflarını alın. Aşağıdaki renk ayarını kullanın: renk sıcaklığı 3200 K, camgöbeği kırmızısı% 40, macenta-yeşil% 39, sarı-mavi% 54, gama 0,5, kontrast 37, parlaklık 13, doygunluk 5.
- Image J yazılımını kullanarak, analiz edilen yarımküredeki SN pars compacta'nın çevresini seçin. Ventral tegmental alandan (VTA) TH+ nöronlarının seçiminden kaçının.
- Daha sonra, yazılımdan seçilen alanı hesaplamasını isteyin (rostrokaudal konuma bağlı olarak tipik olarak 0.04-0.07 mm2 / yarımküre). Ardından, çok noktalı aracı kullanarak, her bir TH+ nöronunu bir nokta ile etiketleyin.
- Nokta aracını kullanarak, yazılımdan toplam nokta sayısını saymasını isteyin. Toplam nokta sayısı (TH+ nöronlar) ve SNpc'nin alanı ile TH+ nöronlarının /mm2'nin yoğunluğunu hesaplayın.
- Aynı hesaplamayı altı SN diliminde her iki yarımkürede de tekrarlayın ve ardından ipsilateral ve kontralateral taraflardaki TH+ nöronlarının /mm2'nin ortalamasını hesaplayın.
- Striatumdaki aktif mikroglia sayısını ölçün
- Striatumdaki aktif mikrogliayı ölçmek için, parlak alan mikroskobu ve adım 4.10.1'de belirtilen aynı ayarları kullanarak 20x büyütmede beş striatal dilimin tümü için her yarım kürede iki fotoğraf elde edin. Image J yazılımını kullanarak, her bir fotoğrafta (660 μm x 877 μm alan görüntüleyerek), çok noktalı aracı kullanarak yüksek Iba1 yoğunluğunu ve ameboid şeklini ifade eden her bir hücreyi bir nokta ile etiketleyin. Nokta aracını kullanarak, yazılımdan toplam nokta sayısını saymasını isteyin.
- Toplam nokta sayısı ve fotoğrafın alanı ile,29'dan önce gerçekleştirilen aktif mikroglia yoğunluğunu (Iba1yüksek hücreler /mm2) hesaplayın.
| Hedef antijen | Şuna bağlı | Klonalite | Ana bilgisayar özellikleri | Özel reaktivite* | Seyreltme** |
| Tirozin Hidroksilaz | Yok | Poliklonal | Tavşan | Fare, Sıçan, İnsan | 1/200 - 1/1000 |
| İba1 | Yok | Monoklonal | Tavşan | Fare, Sıçan, İnsan | 1/1000 |
| alfa-Sinüklein | Yok | Monoklonal | Tavşan | İnsan | 1/150 |
| CD4 | Yok | Monoklonal | Sıçan | Fare | 1/250 |
| IgG (H+L) | Biyotinillenmiş | Poliklonal | Keçi | Tavşan | 1/500 |
| IgG (H+L) | AlexaFluor 546 · | Poliklonal | Keçi | Tavşan | 1/500 |
| IgG (H+L) | AlexaFluor 647 · | Poliklonal | Keçi | Tavşan | 1/500 |
| IgG (H+L) | AlexaFluor 546 · | Poliklonal | Keçi | Sıçan | 1/500 |
Tablo 1: Antikor seyreltmeleri. N/A, geçerli değil. *, Diğer türlerle reaktiviteden bağımsız olarak, yalnızca fare, sıçan ve insan ile reaktivite varsa belirtilir. **, Tek bir seyreltme veya seyreltme aralığı belirtilir.
5. Nigrostriatal yolakta T hücresi infiltrasyonunu değerlendirmek için immünofloresan analizi (yaklaşık 2 gün)
- Striatal veya nigral dilimler üzerinde hαSyn veya TH/GFP'nin immünofloresan analizi için, aynı beyinden beş (striatum) veya altı (SN) dilim setini 24 delikli bir plakanın bir kuyucuğunda bir araya getirin.
- 3x kesitleri 1 mL PBS ile yıkayın ve daha sonra oda sıcaklığında ve 40 dakika boyunca çalkalama ile 0,5 mL blokaj çözeltisi (% 0,3 Triton X-100,% 0,05 ara20 ve% 5 BSA) ile inkübe edin.
- Daha sonra, birincil antikoru (tavşan anti-TH pAb seyreltilmiş 1:500; veya tavşan anti-hαSyn antikoru seyreltilmiş 1:150) içeren 0.5 mL bloke edici çözelti ile inkübe edin, oda sıcaklığında ve gece boyunca ajitasyonla.
- 3x bölümlerini 1 mL PBS ile yıkayın ve AlexaFluor546 kuplajlı anti-tavşan sekonder antikoru (1:500, bakınız Tablo 1) ve 4′,6-diamidino-2-fenilindol (DAPI; 1:1000) içeren 0,5 mL bloke çözeltisi ile oda sıcaklığında ve 2 saat boyunca ajitasyonla inkübe edin. Ardından, bölümleri 3x olarak 1 mL PBS ile yıkayın.
- Beyin bölümlerini yukarıda açıklandığı gibi cam slaytlara monte edin (adım 4.9.). Görüntüler, bir güç kaynağı ünitesine bağlanmış ters çevrilmiş bir floresan mikroskobu ile elde edildi.
- Nigral dilimler üzerinde TH/CD4/GFP(Foxp3)'ün immünofloresan analizi için, aynı beyinden altı (SN) dilim setini 24 delikli bir plakanın bir kuyucuğuna yerleştirin. 3x kesitleri 1 mL PBS ile yıkayın ve daha sonra oda sıcaklığında ve 2 saat boyunca ajitasyonla 0,5 mL bloke edici çözelti (PBS'de% 0,5 Triton X-100,% 0,5 balık derisi jelatini) ile inkübe edin.
- Birincil antikorlar tavşan anti-TH pAb (1:200, bakınız Tablo 1) ve sıçan anti-CD4 (1:250) içeren 0.5 mL bloke edici çözelti ile 4 ° C'de ve gece boyunca ajitasyonla inkübe edin.
- Bölümleri 3x'i 1 mL PBS ile yıkayın ve AlexaFluor 647'ye (1:500, bakınız Tablo 1) bağlı anti-tavşan ve AlexaFluor 546'ya ( 1:500) bağlı anti-sıçan içeren 0,5 mL bloke çözeltisi ile oda sıcaklığında ve 2 saat boyunca ajitasyonla inkübe edin. Ardından, bölümleri 3x olarak 1 mL PBS ile yıkayın.
- Aynı beyinden elde edilen altı (SN) dilim setini rostrokaudal sırayla aynı cam slayta koyun ve bunları Fluoromount G. kullanarak monte edin Leica DMi8 mikroskobu kullanarak görüntü elde edin. İmmünofloresan analizinden görüntü elde etmek için Tablo 2'de belirtilen konfokal mikroskop ayarlarını kullanın.
| Chanel Adı | Küp | Emisyon Dalga Boyu | Arama Tablosu adı | Pozlama süresi | Kazanç | Çözünürlük XY | Çözünürlük Z |
| Kanal 1 | Y5 Serisi | 700nm | Gri | 1.011,727 ms | yüksek kuyu kapasitesi | 2.237 um | 24.444 um |
| Kanal 2 | cesaret | 525nm | Yeşil | 326.851 ms | yüksek kuyu kapasitesi | 2.237 um | 24.444 um |
| Kanal 3 | cesaret | 630nm | Kırmızı | 406.344 ms | yüksek kuyu kapasitesi | 2.237 um | 24.444 um |
| Kanal 4 | Dapi Dili | 460nm | Mavi | 91.501 ms | yüksek kuyu kapasitesi | 2.237 um | 24.444 um |
Tablo 2: İmmünofloresan analizinden görüntü elde etmek için kullanılan konfokal mikroskop ayarları.
6. İstatistiksel analiz
- İpsilateral ve karşıt taraflardan elde edilen verileri karşılaştırmak için, eşleştirilmiş iki kuyruklu bir Öğrenci t-testi kullanın.
- AAV-hαSyn alan farelerden ve AAV-GFP veya sahte cerrahi alan farelerden elde edilen verileri karşılaştırmak için, eşleşmemiş iki kuyruklu bir Öğrenci t-testi kullanın. P değerleri 0,05 < olduğunda önemli farklılıklar göz önünde bulundurun.
Sonuçlar
Nigrostriatal yolun dopaminerjik nöronlarında AAV vektörlerinin doğru iletiminin doğrulanması
Sinüklein patolojisi tarafından teşvik edilen nöroinflamasyon, nörodejenerasyon ve motor bozukluk süreçlerini incelemek için, SN16,17,30,31'de AAV kodlama hαSyn'in tek taraflı stereotaksik iletimi ile indüklenen Parkinson hastalığının bir fare modeli kullanılmıştır (Ek Şekil 1'deki deneysel tasarıma bakınız). ). Nigrostriatal yolun dopaminerjik nöronlarında AAV vektörlerinin doğru iletimini doğrulamak için, SN'ye GFP (AAV-GFP) kodlayan AAV enjekte edildi ve 12 hafta sonra, GFP floresan ve tirozin hidroksilaz (TH) immünoreaktivitesi SN ve striatumda immünofloresan ile analiz edildi. GFP ile ilişkili floresan sadece ipsilateral tarafta gözlendi ve hem SN hem de striatumda TH immünoreaktivitesi ile anlamlı kolokalizasyon vardı, bu da nigrostriatal yolun dopaminerjik nöronlarında AAV vektörlerinin doğru verildiğini gösterdi (Şekil 1).
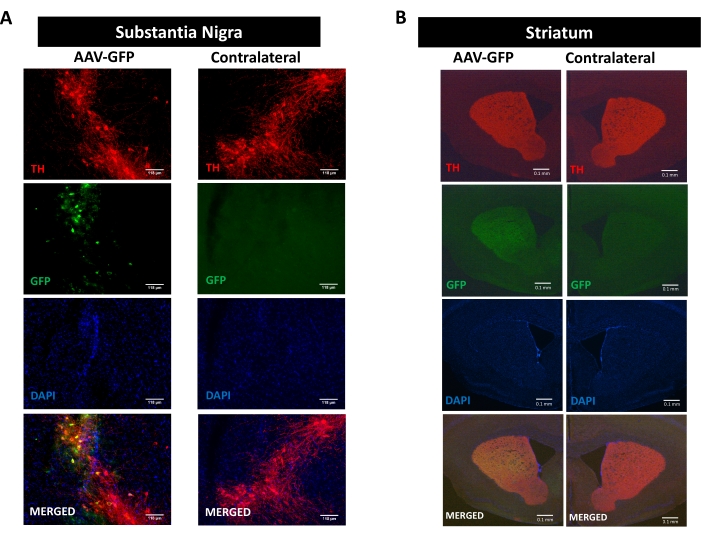
Şekil 1: AAV-GFP'nin nigrostriatal yolakta verilmesinin analizi. Farelere AAV-GFP (1 x 1010 vg / fare) verildi ve 12 hafta sonra kurban edildi ve TH, (A) SN'de (ölçek çubukları 118 μm) ve (B) striatumda (ölçek çubukları 100 μm) immünoboyadı. TH- ve GFP ile ilişkili floresan epifloresan mikroskopi ile analiz edildi. Çekirdekler DAPI ile boyandı. TH (kırmızı), GFP (yeşil) ve DAPI'nin (mavi) birleştirilmiş veya tek boyanmasının temsili görüntüleri gösterilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
AAV-hαSyn tarafından indüklenen Parkinson hastalığının fare modelinde nörodejenerasyon ve motor bozukluğu indüklemek için uygulanan viral vektör dozunun ayarlanması
Nigral dopaminerjik nöronların nörodejenerasyonunu destekleyen hαSyn'in anlamlı bir aşırı ekspresyonunu indüklemek için gereken AAV-hαSyn dozunu test etmek için, AAV-hαSyn'in farklı dozları (1 x 108 viral genom [vg] / fare, 1 x 109 vg / fare veya1 x 10 10 vg / fare) enjekte edildi ve 12 hafta sonra, nigrostriatal yolda hαSyn immünoreaktivitesi ve TH immünoreaktivitesinin derecesi değerlendirildi. SN'de test edilen tüm dozlarda hαSyn immünoreaktivitesi belirgin olmasına rağmen (Şekil 2), sadece 1 x 1010 vg / fare alan fareler striatumda belirgin hαSyn immünoreaktivitesi göstermiştir (Şekil 3). Ayrıca, AAV-hαSyn'den1 x 10 vg / fare alan fareler, SN'de önemli miktarda dopaminerjik nöron kaybı gösterdi (Şekil 4A, B). AAV-GFP'nin 1 x10 10 vg / faresini alan fareler düşük derecede (~% 20) nöronal kayıp göstermesine rağmen (Şekil 4A, B), aynı dozda AAV-hαSyn alan fareler, nigral dopaminerjik nöronların önemli ölçüde daha yüksek bir nörodejenerasyon derecesini göstermiştir (Şekil 4C). Buna göre, AAV-hαSyn'in 1 x10 10 vg / faresi kullanılarak daha ileri deneyler yapıldı. Ek olarak, motor bozukluğun derecesi,25'ten önce açıklandığı gibi, ışın testi (Şekil 5A) kullanılarak farklı dozlarda AAV-hαSyn alan farelerde belirlendi. Motor performansında önemli bir azalma, ışın testinde hem sağ hem de sol pedler tarafından yapılan hataların sayısını karşılaştırırken (Şekil 5B) ve AAV-hαSyn alan farelerin toplam hata sayısını AAV-GFP kontrol vektörünü alan farelerle karşılaştırıldığında (Şekil 5C) sadece 1 x 1010 vg / fare AAV-hαSyn ile tespit edilmiştir (Şekil 5C). Buna göre, AAV-hαSyn'in 1 x10 10 vg / faresi kullanılarak daha ileri deneyler yapıldı.
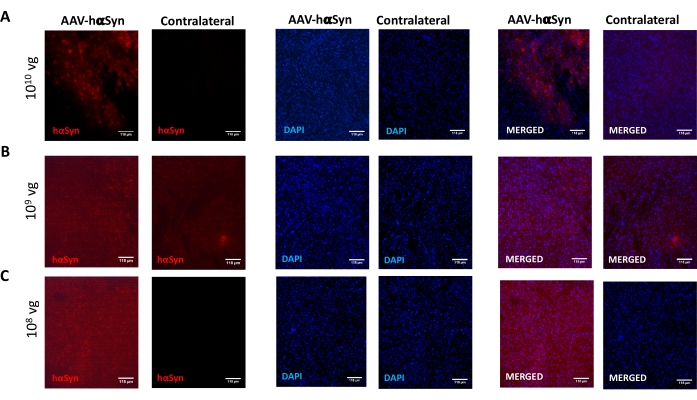
Şekil 2: Farklı dozlarda AAV-hαSyn ile tedavi edilen farelerin SN'sinde insan α-sinüklein ekspresyonunun analizi. Farelere (A) 1 x 10 10 vg / fare, (B) 1 x 109 vg / fare veya (C)1 x 10 8 vg / farede AAV-hαSyn verildi ve 12 hafta sonra feda edildi ve hαSyn ekspresyonu epifloresan mikroskobu kullanılarak SN'de immünofloresan ile analiz edildi. Çekirdekler DAPI ile boyandı. hαSyn (kırmızı) veya DAPI'nin (mavi) birleştirilmiş veya tek boyanmasının temsili görüntüleri gösterilir. Ölçek çubukları 118 μm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
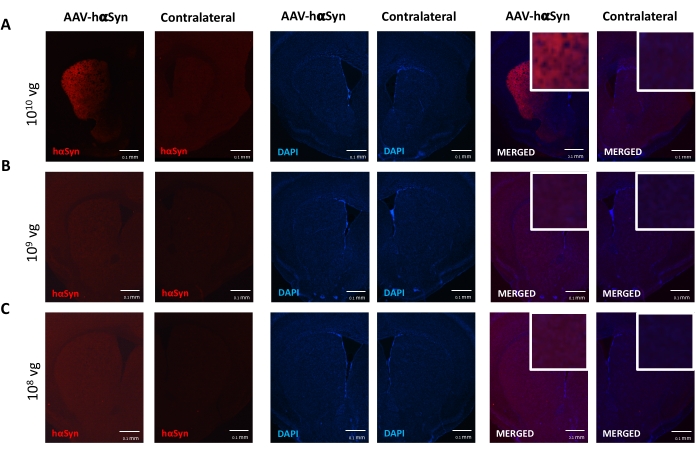
Şekil 3: Farklı dozlarda AAV-hαSyn ile tedavi edilen farelerin striatumunda insan α-sinüklein ekspresyonunun analizi. Farelere (A) 1 x 10 10 vg / fare, (B) 1 x10 9 vg / fare veya (C) 1 x 108 vg / fare) AAV-hαSyn verildi ve 12 hafta sonra kurban edildi ve hαSyn ekspresyonu epifloresan mikroskobu kullanılarak striatumdaki immünofloresan ile analiz edildi. Çekirdekler DAPI ile boyandı. hαSyn (kırmızı) veya DAPI'nin (mavi) birleştirilmiş veya tek boyanmasının temsili görüntüleri gösterilir. Ölçek çubukları 100 μm'dir. Birleştirilen görüntülerin sağ üst köşesindeki ek, daha yüksek büyütmeye ilgi duyan bir alanı gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
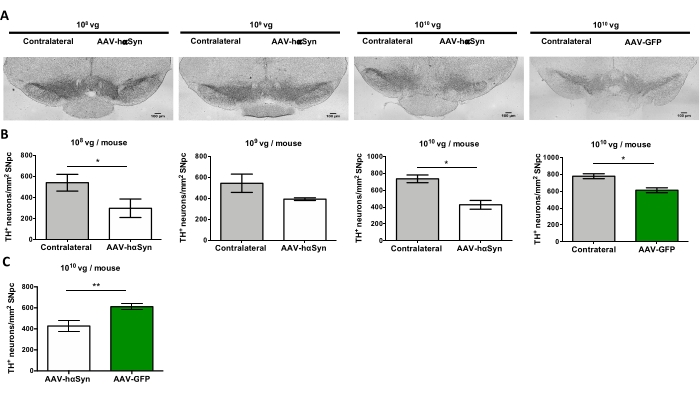
Şekil 4: Farklı dozlarda AAV-hαSyn veya kontrol vektörü ile tedavi edilen farelerde SN'nin dopaminerjik nöronlarının kaybı. Farelere AAV-hαSyn (1 x 10 10 vg/fare, 1 x 109 vg/fare veya 1 x 108 vg/fare) veya AAV-GFP (1 x 1010 vg/fare) verildi ve12 hafta sonra kurban edildi ve TH, immünohistokimya ile SNpc'de analiz edildi. (A) Temsili görüntüler. Ölçek çubukları, 100 μm. (B,C) Nöronların yoğunluğu, TH+ nöronların/mm2'nin sayısı olarak ölçüldü. Veriler ortalama ± SEM temsil eder. n = grup başına 3-8 fare. (B) İki kuyruklu eşleştirilmiş Öğrencinin t-testi kullanılarak ipsilateral ile kontralateral tarafların karşılaştırılması yapılmıştır. (C) AAV-hαSyn veya AAV-GFP 1 x10 vg/fare alan farelerden ipsilateral kenarların karşılaştırılması gerçekleştirilmiştir. (B,C) Beyaz çubuklar, AAV-hαSyn alan farelerin ipsilateral tarafındaki TH+ nöronlarının miktarını gösterirken, yeşil çubuklar, AAV-GFP alan farelerin ipsilateral tarafındaki TH+ nöronlarının miktarını gösterir. Gri çubuklar, karşılık gelen grubun karşıt tarafındaki TH+ nöronlarının miktarını gösterir. Karşılaştırmalar iki kuyruklu eşlenmemiş bir Student's t-testi ile yapıldı. *p < 0,05; **p 0,01 <. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
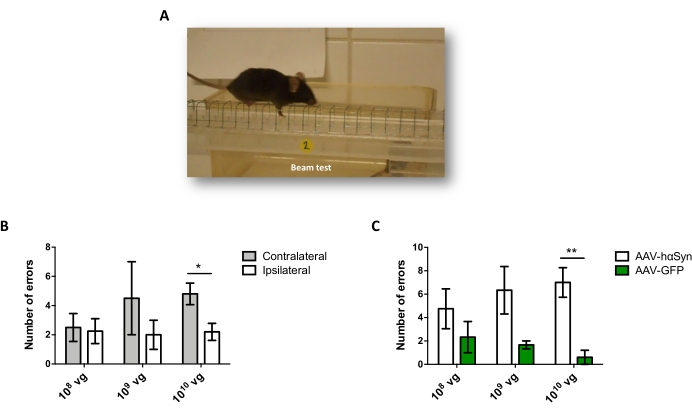
Şekil 5: Farklı dozlarda AAV-hαSyn ile tedavi edilen farelerde motor performansının analizi. Farelere AAV-hαSyn veya AAV-GFP'nin farklı dozları (1 x 10 10 10 vg / fare, 1 x 109 vg / fare veya 1 x 108 vg / fare) verildi ve 12 hafta sonra motor performansı ışın testi ile değerlendirildi. (A) Kiriş üzerinde yürüyen bir farenin görüntüsü. (B) AAV-hαSyn alan fare gruplarında sol ekstremiteler (kontralateral) ile sağ ekstremiteler (ipsilateral) arasında gerçekleştirilen hataların sayısı ölçülmüştür. (C) Toplam hata sayısı, aynı dozda AAV-hαSyn veya AAV-GFP alan farklı deney grupları arasında karşılaştırılmıştır. Veriler ortalama SEM ± temsil eder. n = grup başına 3-5 fare. Karşılaştırmalar (B) eşleştirilmiş iki kuyruklu bir Öğrencinin t-testi veya (C) eşlenmemiş iki kuyruklu bir Öğrencinin t-testi ile gerçekleştirilmiştir. *p < 0,05; **p 0,01 <. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
AAV-αSyn tarafından indüklenen Parkinson hastalığı modelinin kinetiğinin kurulması
Önemli düzeyde nörodejenerasyon ve motor bozukluğu indüklemek için kullanılan uygun AAV-hαSyn dozunu belirledikten sonra, hαSyn aşırı ekspresyonunun başlangıcını tanımlamak için deneyler yapıldı. Bu amaçla fareler 1 x 10 10vg /fare AAV-hαSyn veya sahte cerrahi ile tedavi edildi. hαSyn ekspresyonunun kapsamı, stereotaksik cerrahiden sonraki 2-5. haftalarda haftada bir kez SN'de analiz edildi ( Ek Şekil 2'deki deneysel tasarıma bakınız). Sonuçlar, hαSyn ekspresyonunun ameliyattan 2 hafta kadar erken bir sürede düşük seviyelerde tespit edilmesine rağmen, hαSyn kümelerinin stereotaksik cerrahiden sonraki 5. haftada ortaya çıktığını göstermektedir (Şekil 6).

Şekil 6: AAV-hαSyn ile tedavi edilen farelerin SN'sinde insan α-sinüklein ekspresyonunun zaman seyrinin analizi. Farelere AAV-hαSyn (1 x10 10 vg / fare) veya sadece sahte stereotaksik cerrahi verildi ve SN'deki hαSyn ekspresyonu (A) 2 hafta, (B) 3 hafta, (C) 4 hafta veya (D) 5 hafta sonra epifloresan mikroskobu kullanılarak immünofloresan ile analiz edildi. Çekirdekler DAPI ile boyandı. hαSyn (kırmızı) veya DAPI'nin (mavi) birleştirilmiş veya tek boyanmasının temsili görüntüleri gösterilir. Ölçek çubukları, 100 μm. Birleştirilen görüntülerin sağ üst köşesindeki ek, daha yüksek büyütmeye ilgi duyan bir alanı gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Daha sonra, AAV-hαSyn'in stereotaksik dağıtımından sonra merkezi sinir sisteminde (CNS) nöroinflamasyonu ve T-hücresi infiltrasyonunu analiz etmek için uygun zaman noktalarını belirlemek için deneyler yapıldı. AAV-hαSyn ile farelerin tedavisinden sonra mikroglial aktivasyonun zirvesini belirlemek için, steriatumda yüksek Iba1 seviyelerini eksprese eden hücrelerin derecesi, stereotaksik cerrahiden sonraki 2-15. haftalarda haftada bir kez değerlendirildi. Sonuçlar, AAV-hαSyn tedavisinden 15 hafta sonra farelerin kontralateral tarafına kıyasla ipsilateral tarafın mikroglial aktivasyonunda anlamlı bir artış olduğunu göstermektedir (Şekil 7). SNpc'ye sızan Treg (CD4 + Foxp3 +) hücrelerinin sayısı, immünofloresan ve konfokal mikroskopi gözlemi ile AAV-hαSyn'in stereotaksik olarak verilmesinden sonra farklı zaman noktalarında da değerlendirildi. Sonuçlar, Treg infiltrasyonunun SNpc'ye infiltrasyonunun zirvesinin ameliyattan 11 hafta sonra olduğunu, Treg'in beynin bu bölgesine sızma derecesinin ameliyattan sonraki 8. haftada veya 13. haftada daha düşük olduğunu göstermektedir (Şekil 8). Striatuma sızan CD4 + T hücresi tespit edilmedi (veriler gösterilmedi). Toplamda, bu sonuçlar, AAV-hαSyn'in 1 x 10 10 vg / faresini kullanarak, nöroinflamasyonu analiz etmek için en uygun zaman noktasının stereotaksik cerrahiden sonraki 15. hafta olduğunu, CNS'ye T hücresi infiltrasyonunu analiz etmek için uygun bir zaman noktasının AAV-hαSyn tedavisinden sonra11. hafta olduğunu göstermektedir.
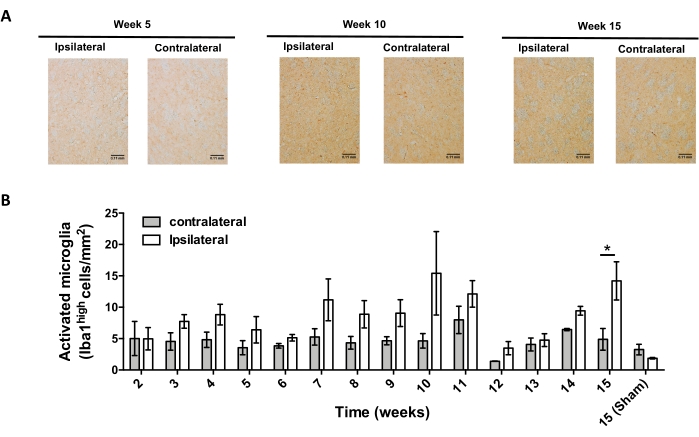
Şekil 7: AAV-hαSyn ile aşılanmış farelerde mikroglial aktivasyonun zaman seyrinin analizi. Farelere AAV-hαSyn (1 x 1010 vg/fare) verildi ve mikroglial aktivasyon, ameliyat sonrası farklı zaman noktalarında striatumdaki Iba1'in immünohistokimyasal analizi ile değerlendirildi. (A) AAV-hαSyn ile aşılamadan 5 hafta, 10 hafta veya 15 hafta sonra kurban edilen farelerden Iba1'in immünohistokimyasal analizinin temsili genel görüntüleri gösterilmiştir. Ölçek çubukları, 110 μm. (B) Aktif mikroglianın yoğunluğu, alan başına yüksek düzeyde Iba1 ve ameboid şekli eksprese eden hücre sayısı olarak ölçülmüştür. Veriler ortalama ± SEM temsil eder. n = grup başına 3 fare. Her grupta ipsilateral ve kontralateral Iba1 arasındaki istatistiksel farklılıkları belirlemek için iki kuyruklu eşleştirilmiş bir Öğrenci t-testi kullanıldı. *p 0,05 <. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
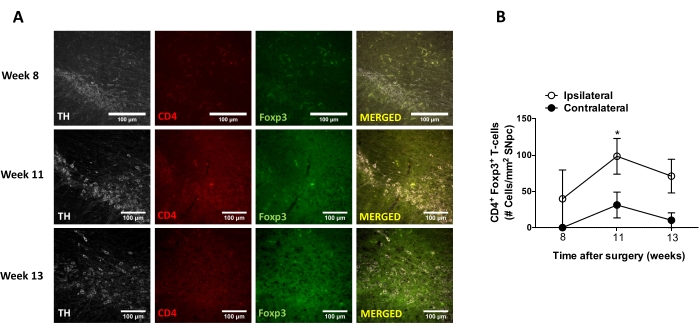
Şekil 8: AAV-hαSyn ile aşılanmış farelerin SN'sine CD4 + T hücresi infiltrasyonunun zaman seyrinin analizi. Foxp3gfp muhabir fareleri AAV-hαSyn (1 x 1010 vg / fare) aldı. Foxp3'ü eksprese eden CD4 + T hücrelerinin varlığı ve TH+ nöronlarının varlığı, immünofloresan ile SN'de farklı zaman noktalarında (8. hafta, 11. hafta ve ameliyattan sonraki 13. hafta) analiz edildi. (A) Tek immün boyama veya birleştirme için temsili görüntüler gösterilir. Ölçek çubukları, 100 μm. (B) SN'de alan başına CD4+ Foxp3+ T hücrelerinin sayısı ölçüldü. Veriler, grup başına 3 fareden ortalama ± SEM'i temsil eder. *p<0.05, iki kuyruklu Öğrenci t-testi ile ipsilateral ve kontralateral CD4+ Foxp3+ T hücreleri. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Farklı dozlarda AAV vektörlerinin sinüklein patolojisi, nörodejenerasyon ve motor bozukluk üzerindeki etkisini değerlendirmek için deneysel tasarım. Vahşi tip erkek C57BL / 6 fareler anestezi altına alındı ve CBA promotörünün kontrolü altında insan α-sinükleini (AAV-hαSyn) veya eGFP (AAV-GFP) kodlayan AAV'nin farklı dozlarında (1 x 10 10 vg / fare, 1 x 109 vg / fare veya 1 x 108 vg / fare) stereotaksik aşılama yapıldı. 12 hafta sonra, SN ve striatumda (Str) GFP ve hαSyn ekspresyonu immünofloresan (IF), tirozin hidroksilaz pozitif (TH+) hücreler SN'de immünohistokimya (IHC) ile ölçüldü ve ışın testi ile motor performans değerlendirildi. Her deney grubundaki fare sayısı parantez içinde belirtilmiştir. * Analizlerden önce bir farenin öldüğü grupları gösterir. Her analiz, parantez içinde, karşılık gelen sonuçların gösterildiği kağıdın gövdesindeki şeklin numarasını gösterir. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 2: T-hücresi infiltrasyonu, nöroinflamasyon ve hαSyn ekspresyonunun kinetiğini belirlemek için deneysel tasarım. Foxp3gfp muhabir fareleri anestezi altına alındı ve CBA promotörünün kontrolü altında insan α-sinükleini (AAV-hαSyn) kodlayan AAV'nin (1 x 10 10 vg / fare) stereotaksik aşılaması yapıldı. Fareler farklı zaman noktalarında kurban edildi ve SN ve striatumdaki hαSyn ekspresyonu immünofloresans (IF), GFP (Foxp3), CD4 ile değerlendirildi ve tirozin hidroksilaz pozitif (TH+) hücreler SN'de IF ile ölçüldü ve Iba1 ekspresyonu striatumda (Str) immünohistokimya (IHC) ile analiz edildi. Her deney grubundaki farelerin sayısı belirtilmiştir. Her analize dahil edilen zaman noktaları aralığı belirtilir. Her analiz, parantez içinde, karşılık gelen sonuçların gösterildiği kağıdın gövdesindeki şeklin numarasını gösterir. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Burada analiz edilen nörodejenerasyonun fare modeli, αSyn patolojisinde ve mikroglial aktivasyonda yer alan mekanizmalar, periferik bağışıklık sisteminin nöroinflamasyonun düzenlenmesine katılımı ve nörodejenerasyon mekanizmaları dahil olmak üzere Parkinson hastalığının patofizyolojisinde yer alan birçok kritik yönün incelenmesine yardımcı olabilir. αSyn patolojisinde yer alan mekanizmalar arasında, SN2'nin dopaminerjik nöronlarında aşırı miktarda αSyn yükü varlığında mitokondriyal, lizozomal veya proteazomal disfonksiyon ile ilişkili hücre altı mekanizmalar bulunmaktadır. AAV aracılı transdüksiyonun neden olduğu hαSyn ekspresyonuna ek olarak, endojen fare αSyn'in de toplam αSyn ekspresyonunun yüküne katkıda bulunduğunu düşünmek önemlidir. Fare αSyn'i aşırı eksprese eden transgenik fareler, hαSyn32'nin aşırı ekspresyonuna dayanan bu fare modellerine benzer sinüklein patolojisi, nöropatoloji ve motor bozukluk geliştirir. Mikroglial aktivasyon ile ilgili olarak, mevcut fare modeli, sitokinler, nörotransmiterler, astrositler, nöronlar, kan-beyin bariyeri ve T hücreleri gibi farklı moleküler ve hücresel oyuncuların pro-inflamatuar veya anti-inflamatuar fonksiyonel fenotiplerin edinimini nasıl düzenleyebileceğini incelemek için kullanılabilir 8,10,11 . Bu model aynı zamanda sadece T hücreleri değil, makrofajlar, monositler ve nötrofiller de dahil olmak üzere periferik bağışıklık sisteminin nigral nöronların nöroinflamasyon ve nörodejenerasyon süreçleri üzerindeki rolünü incelemek için önemli bir araç oluşturmaktadır 11,33,34. Son olarak, bu fare modeli aynı zamanda oksidatif stres, enerji açıkları ve hasarlı organeller 2 gibi iç hücresel süreçler tarafından indüklenenler veya mikroglial hücreler, astrositler ve sitotoksik T hücreleritarafından üretilen nörotoksik faktörler gibi dış oyuncular tarafından uygulananlar da dahil olmak üzere nörodejenerasyonun hücresel ve moleküler mekanizmalarını in vivo olarak incelemek için değerli bir sistemi temsil eder. 28,29,35.
Bu fare modelinin bir sınırlaması, αSyn'in ekstra-serebral lokalizasyonlarda patolojik agregasyonunun Parkinson hastalığının gelişiminde ilk aşamaları nasıl oluşturabileceğinin incelenmesidir36. Bu bağlamda, nigral nöronların nörodejenerasyonundan ve motor bozulmadan önce, αSyn patolojisinin bağırsak mukozasında ve koku alma epiteli36'da ve muhtemelen αSyn'e özgü T-hücresi yanıtında da başladığını gösteren kanıtlar artmaktadır12. Daha sonra, αSyn agregaları vagus sinirinden beyin sapına göç edecek ve dopaminerjik nöronların nöroinflamasyonunu ve nörodejenerasyonunu tetikleyecektir12. AAV-hαSyn modeli Parkinson hastalığının birçok yönünü özetlemesine rağmen, bu modelde ekstra-serebral lokalizasyonlarda αSyn'in patolojik agregasyonunun belirgin bir katılımı yoktur. Parkinson hastalığının bu yönlerini incelemek için uygun hαSyn patolojisini içeren alternatif bir model, hastalık gelişiminin bağırsak mikrobiyotasına bağlı olduğu ve belirgin bir gastrointestinal bozukluk içerdiği Thy1 promotörü, Thy1-SNCA model37'nin kontrolü altında hαSyn'i aşırı eksprese eden transgenik fareler olabilir38.
Parkinson hastalığının patofizyolojisi ile ilişkili çeşitli süreçlerin incelenmesi için yararlı olmasına rağmen, mevcut fare modeli, viral vektörlerin karşılık gelen uzamsal koordinatlarda doğru verilmesi, nöronlarda hαSyn'in seçici ekspresyonu (AAV serotipine ve vektör yapısına bağlı olarak) dahil olmak üzere dikkatle kontrol edilmesi gereken kritik adımları içerir. ve Parkinson fenotipini analiz etmeden önce uygun AAV dozu ve zamanlaması. SN'deki viral vektörlerin uygun şekilde verilmesinin analizi gereklidir, çünkü SN'nin doğru uzamsal koordinatlarının kullanılması, iğne tamamen düz olmadığında yeterli olmayabilir, bu da bazen insan gözüyle algılanamaz. Ayrıca, AAV vektörlerinin difüzyonu AAV serotip39'a bağlıdır. Bu nedenlerle, SN alanını içeren beyin dilimlerinde GFP'nin gözlemlenmesini takiben, enjekte edilen AAV-GFP vektörlerinin doğru iletimini ve difüzyonunu kontrol eden periyodik kalite kontrollerinin yapılması gerekmektedir.
Nöronlarda hαSyn'in seçici ekspresyonu ile ilgili olarak, prensip olarak, hαSyn ekspresyonu, nöronlar için seçici bir promotör tarafından kontrol edilmek üzere veya daha kesin olarak, dopaminerjik nöronlarda genlerin seçici ekspresyonunu indüklemek için AAV vektörlerinde TH promotörünün kullanılması gibi dopaminerjik nöronlar için seçici olarak tasarlanabilir40 . Bununla birlikte, bu strateji, aranan şey ilgi geninin aşırı ifadesi olduğunda işe yaramaz. Bu nedenle, mevcut modelde, güçlü bir promotör (aşağı akış geninin yüksek ekspresyonunu indükleyen bir promotör) ve nöronal tropizmli AAV serotiplerinin kullanılması esastır. Bu çalışmada, CBA promotörü, hαSyn'in aşırı ekspresyonunu indüklemek için güçlü bir promotör olarak kullanıldı ve viral vektör için AAV5 serotipi kullanıldı. Bu serotip daha önce fare ve sıçan nöronlarını41,42 dönüştürmek için kullanılmıştır. Burada, sonuçlar, farelerin SN'sinde AAV5-GFP'nin verilmesinden 12 hafta sonra, yeşil floresanın hem SN hem de striatumun ipsilateral tarafında seçici olarak mevcut olduğunu göstermiştir (Şekil 1), bu da nigrostriatal yolun nöronlarının verimli transdüksiyonunu göstermektedir.
Parkinson hastalığının bu fare modelinin bir diğer kritik yönü, ameliyattan sonra belirli bir süreci analiz etmek için gereken zaman noktasıdır. Bu bağlamda, bu çalışma patolojide yer alan farklı süreçlerin kinetik bir çalışmasını göstermektedir. Anahtar zaman noktaları, fare başına verilen viral genomların dozu, kullanılan AAV'nin serotipi veya hatta kullanılan AAV partisi ile değiştiğinden, ilk önce TH+ nöronlarında ve motor bozulmada önemli bir kayba neden olmak için gereken AAV-αSyn miktarının doz-yanıt analizi yapılmıştır. Önceki çalışmalar, farelerde 12 haftalık AAV-αSyn enjeksiyonlarından sonra, fare başına 6 x 10 8-3 x 10 10 10viral genom 16,17,30,31 arasında değişen dozlarda önemli motor bozulma ve nigrostriatal yolun TH+ nöronlarının kaybını göstermiştir. Buna göre, nigrostriatal yolakta hαSyn ekspresyonunu, TH+ nöronlarının kaybını ve farelerde motor bozulmayı indüklemek için kullanılan AAV-hαSyn dozu, fare başına 1 x 108-1 x 1010 viral genom arasında değişmiştir. Ayrıca, TH+ nöronlarının kaybının ve motor bozukluğun, SN nöronlarının AAV enfeksiyonu ile değil, SN'deki hαSyn'in aşırı ekspresyonuyla indüklendiğini kontrol etmek için, farelerin SN'sinde tek taraflı olarak bir muhabir gen (AAV-eGFP) için AAV kodlamasının verildiği kontrol grupları dahil edildi ve nörodejenerasyon ve motor bozukluk belirlendi. Sonuçlar, stereotaksik cerrahiden 12 hafta sonra, fare başına 1 x10 10 viral genomun uygun bir AAV5-hαSyn dozu olduğunu gösterdi, çünkü bu viral yükü alan fareler nigrostriatal yolda önemli hαSyn (Şekil 2 ve Şekil 3), TH+ nöronlarının kaybı (Şekil 4) ve motor bozukluk (Şekil 5) gösterdi. Buna karşılık, daha düşük AAV5-hαSyn dozları (fare başına 1 x 108 viral genom ve fare başına 1 x 109 viral genom), tüm bu parametrelerde birlikte önemli değişikliklere ulaşacak kadar güçlü değildi (Şekil 2-4). Not olarak, AAV-GFP'nin fare başına 1 x 10 10 viral genomda uygulanması, düşük (~%20), ancak nigral dopaminerjik nöronların TH+ nöronlarının önemli derecede kaybına neden olmuştur (Şekil 4A, B). Bu sonuç, bu model41'i kullanan önceki gözlemlerle aynı fikirdedir ve muhtemelen SN'de AAV vektörlerinin uygulanmasıyla indüklenen düşük bir nöroinflamasyon seviyesinin sonucudur. Bununla birlikte, TH+ nöronlarının kaybının derecesi, AAV5-hαSyn alan farelerde, aynı dozda AAV-GFP alanlara kıyasla anlamlı derecede daha yüksekti (Şekil 4C). Not olarak, hαSyn ekspresyonunun kinetiği sadece transdüksiyonun verimliliğine değil, aynı zamanda AAV difüzyonunun derecesine de bağlıdır39. AAV difüzyonu AAV serotipine bağlı olduğundan, bu hayvan modelindeki kesin anahtar zaman noktaları, AAV5'ten farklı başka bir AAV serotipi kullanıldığında değişebilir.
Daha sonra, bu fare modelindeki kilit zaman noktalarını belirlemek için fare başına 1 x 1010 viral genom kullanılarak kinetik bir analiz yapıldı. Mevcut kanıtlar, Parkinson hastalığınınerken teşhisine izin verecek olan motor bozukluktan önce ortaya çıkan bazı erken semptomları gösterdiğinden, bu deneyler hαSyn ekspresyonunun zaten belirgin olduğu ancak motor bozukluğun yokluğunda zaman noktasını bulmaya çalıştı. Sonuçlar, SN'deki hαSyn ekspresyonunun başlangıcının, AAV-hαSyn'in stereotaksik dağıtımından 5 hafta sonra olduğunu göstermektedir (Şekil 6). Bu zaman noktası, nöroinflamatuar ve nörodejeneratif süreçleri durdurmak için uyarlanmış tedavileri uygulamaya başlamak için ilginç bir zamansal nokta oluşturur. Burada belirlenen diğer önemli zaman noktaları, nöroinflamasyon süreciyle ilişkili iki kritik olayın en yoğun zamanlarıydı: mikroglia'nın maksimum aktivasyon derecesine ulaştığı zaman ve SN'ye maksimum T hücresi infiltrasyon zamanı. Sonuçlar, ilki ameliyattan 10 hafta sonra ve ikincisi ameliyattan 15 hafta sonra olmak üzere iki maksimum mikroglial aktivasyon dalgasına ulaşan bir eğilime sahip bir eğri gösterdi (Şekil 7). T-hücresi infiltrasyonunun kinetik analizi, stereotaksik cerrahiden 11 hafta sonra SN'ye Treg infiltrasyonunun en yüksek zamanını göstermiştir (Şekil 8). Şaşırtıcı bir şekilde, analiz edilen zaman diliminde (ameliyattan 8-13. haftalar) SN'ye sızan hiçbir efektör T hücresi (CD4 + Foxp3-) tespit edilmedi. Toplamda, bu sonuçlar, nöroinflamasyon sürecini durdurmaya ve ameliyattan sonraki 5. hafta (hαSyn aşırı ekspresyonunun başlangıcı) ile ameliyattan sonraki 10. hafta (nöroinflamasyon ve T hücresi infiltrasyonunun ilk dalgası) arasında değişen bu klinik öncesi modeli kullanarak SN'ye T hücresi infiltrasyonunu azaltmaya yönelik tedavileri uygulamaya başlamak için uygun bir zaman dilimi önermektedir (Şekil 9).
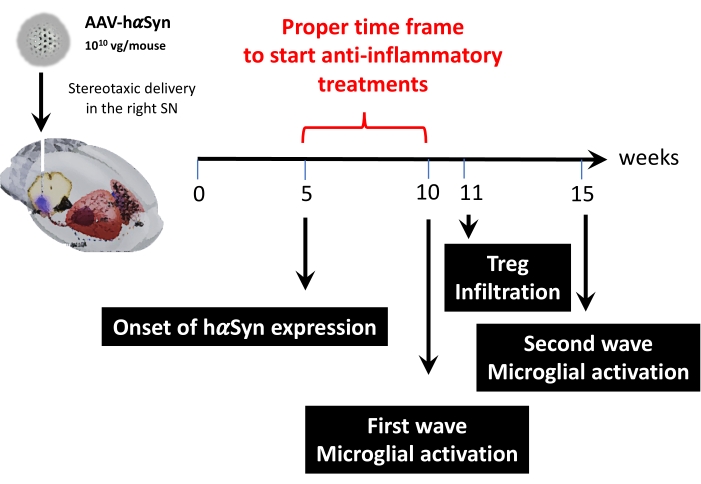
Şekil 9: Bu hayvan modeli için bulunan önemli zaman noktalarının özeti. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Açıklamalar
Yazarlar, araştırmanın herhangi bir finansal veya finansal olmayan rekabet çıkarının yokluğunda yapıldığını beyan etmektedir.
Teşekkürler
Dr. Sebastián Valenzuela ve Dr. Micaela Ricca'ya hayvan tesisimizdeki değerli veteriner yardımları için teşekkür ederiz. Bu çalışma "Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID" Centro Ciencia & Vida, FB210008 (Fundación Ciencia & Vida'ya) ve Geroscience Beyin Sağlığı ve Metabolizması Merkezi, FONDAP-15150012 tarafından desteklenmiştir. Bu çalışma aynı zamanda "Agencia Nacional de Investigación y Desarrollo de Chile (ANID)" ve Michael J Fox Parkinson Araştırmaları Vakfı'ndan MJFF-10332.01 (R.P.) ve MJFF-10332.01 (R.P.'ye) ve MJFF-17303 (F.C.'ye) hibeleri ile finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| ANIMALS AND ANIMAL FOOD | |||
| Foxp3-GFP C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 023800 | |
| Laboratory Rodent Diet | LabDiet | Rodent Diet 5001 | Standard Rodent diet |
| Wild-type C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 000664 | |
| VIRAL VECTORS | |||
| AAV5-CBA-αSyn | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 10E13 vg/mL |
| AAV5-CBA-eGFP | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 9.5 x 10E12 vg/mL |
| ANESTHETICS AND ANALGESICS | |||
| Isoflurane | Baxter | 218082 | 1% for stereotaxic surgery |
| Ketamine | Drag Pharma | CHE30 | 70 mg/Kg for stereotaxic surgery |
| Sevoflurane | Baxter | VE2L9117 | For before transcardial perfusion |
| Tramadol | Drag Pharma | DPH134 | 30 mg/Kg every 24 h |
| Xylazine | Centrovet | EHL40 | 9 mg/kg for stereotaxic surgery |
| EQUIPMENT | |||
| Beam test | Home made | N/A | horizontal beam 25 cm length and 3 cm width. The beam surface was covered by a metallic grid (1 cm2). |
| Cryostate | Leica | CM1520 | |
| Digital camera | Nikon | S2800 Coolpix | For recording the beam test performance |
| Microscope | Olympus | BX51 | Used for IHC analysis (section 4.4) |
| Microscope | Olympus | IX71 | Used for IF analysis (section 5.3) |
| Microscope | Leica | DMI8 | Used for IF analysis (section 5.7) |
| New Standard Stereotaxic, mouse | Stoelting, Wood Dale, IL, USA | 51500 | stereotaxic frame for surgery |
| Peristaltic Pump | Masterflex | C-flex L/S16 | |
| Power supply unit | Olympus | U-RFL-T | Used for IF analysis (section 5.3) |
| Surgical suture | Sylkam®, B Braun | C0760171 | |
| Syringe 100 U | BD | 324918 | For anesthesia before transcardial perfusion, 29G needle |
| Syringe RN 5uL SYR W/O NEEDLE | Hamilton | HA-7641-01 | For viral vector innoculation |
| BUFFERS AND REAGENTS | |||
| Aviden, Peroxidase Conjugate | Merck, Darmstadt, Germany | 189728 | |
| Bovine Serum Albumin | Merck, Darmstadt, Germany | 9048-46-8 | |
| Cryotrotection buffer | Home made | N/A | 20% glycerine and 2% DMSO in PBS |
| DAPI | Abcam | ab228549 | |
| Diaminobenzidine | Merck, Darmstadt, Germany | D8001 | |
| Fluoromount -G T | Electron Microscopy Science | 17984-25 | |
| Gelatin | Merck, Darmstadt, Germany | 104078 | |
| Normal goat serum | Jackson ImmunoResearch Laboratory | 5000121 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 104005 | |
| PBS | Home made | N/A | 0.125 M, pH 7.4 |
| Peroxidase inactivating buffer | Home made | N/A | 0.03% H2O2 in methanol |
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| Trizma Hydrochloride | Merck, Darmstadt, Germany | 1185-53-1 | |
| Tween 20 | Sigma-Aldrich | 822184 | |
| ANTIBODIES | |||
| Biotin-SP (long spacer) AffiniPure Goat Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch Laboratory | 111065003 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11010 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 647 | ThermoFisher Scientific | A21244 | |
| Goat anti-Rat IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11081 | |
| Rabbit monoclonal anti-alpha-Synuclein | Abcam | ab138501 | |
| Rabbit monoclonal anti-Iba-1 | Abcam | EPR16588 | |
| Rabbit polyclonal anti-Tyrosine Hydroxylase | Millipore | AB152 | |
| Rat monoclonal anti-CD4 | Biolegend | 100402 | |
| SOFTWARES | |||
| GraphPad | Prism | 6.0 | Fos stats analysis |
| ImageJ | National Institute of Health | N/A | For image analysis |
| LAS X | Leica | N/A | For image capture with Leica microscope |
| ProgRes Capture Pro | Jenoptik | N/A | For image capture with Olympus microscope |
| VLC media player | VideoLAN Organization | N/A | For analysis of behavioural tests |
Referanslar
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiology of Aging. 24 (2), 197-211 (2003).
- Lim, K. L., Zhang, C. W. Molecular events underlying Parkinson's disease - An interwoven tapestry. Frontiers in Neurology. 4, 33(2013).
- Abdelmotilib, H., et al. α-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Mori, F., et al. Relationship among alpha-synuclein accumulation, dopamine synthesis, and neurodegeneration in Parkinson disease substantia nigra. The Journal of Neuropathology & Experimental Neurology. 65 (8), 808-815 (2006).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson's disease. Biochimica et Biophysica Acta. 1802 (1), 29-44 (2010).
- Vazquez-Velez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44, 87-108 (2021).
- Dehay, B., et al. Lysosomal impairment in Parkinson's disease. Movement Disorders. 28 (6), 725-732 (2013).
- Gonzalez, H., Elgueta, D., Montoya, A., Pacheco, R. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases. Journal of Neuroimmunology. 274 (1-2), 1-13 (2014).
- Pacheco, R. T-cell based immunotherapies for Parkinson's disease. Exploration of Neuroprotective Therapy. 1 (2), 72-85 (2021).
- Gonzalez, H., Contreras, F., Pacheco, R. Regulation of the neurodegenerative process associated to Parkinson's disease by CD4+ T-cells. Journal of Neuroimmune Pharmacology. 10 (4), 561-575 (2015).
- Gonzalez, H., Pacheco, R. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases. Journal of Neuroinflammation. 11 (1), 201(2014).
- Campos-Acuna, J., Elgueta, D., Pacheco, R. T-cell-driven inflammation as a mediator of the gut-brain axis involved in Parkinson's disease. Frontiers in Immunology. 10, 239(2019).
- Blesa, J., Phani, S., Jackson-Lewis, V., Przedborski, S. Classic and new animal models of Parkinson's disease. Journal of Biomedicine and Biotechnology. 2012, 845618(2012).
- Ulusoy, A., Decressac, M., Kirik, D., Bjorklund, A. Viral vector-mediated overexpression of alpha-synuclein as a progressive model of Parkinson's disease. Progress in Brain Research. 184, 89-111 (2010).
- Gomez-Benito, M., et al. Modeling Parkinson's disease with the alpha-synuclein protein. Frontiers in Pharmacology. 11, 356(2020).
- Song, L. K., et al. Targeted overexpression of alpha-synuclein by rAAV2/1 vectors induces progressive nigrostriatal degeneration and increases vulnerability to MPTP in mouse. PLoS One. 10 (6), 0131281(2015).
- Theodore, S., Cao, S., McLean, P. J., Standaert, D. G. Targeted overexpression of human alpha-synuclein triggers microglial activation and an adaptive immune response in a mouse model of Parkinson disease. Journal of Neuropathology and Experimental Neurology. 67 (12), 1149-1158 (2008).
- Sanchez-Guajardo, V., Annibali, A., Jensen, P. H., Romero-Ramos, M. alpha-Synuclein vaccination prevents the accumulation of parkinson disease-like pathologic inclusions in striatum in association with regulatory T cell recruitment in a rat model. Journal of Neuropathology and Experimental Neurology. 72 (7), 624-645 (2013).
- Sanchez-Guajardo, V., Febbraro, F., Kirik, D., Romero-Ramos, M. Microglia acquire distinct activation profiles depending on the degree of alpha-synuclein neuropathology in a rAAV based model of Parkinson's disease. PLoS One. 5 (1), 8784(2010).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular Neurodegeneration. 8, 44(2013).
- Cho, C., et al. Evaluating analgesic efficacy and administration route following craniotomy in mice using the grimace scale. Scientific Reports. 9 (1), 359(2019).
- Flecknell, P. Laboratory Animal Anaesthesia. 3rd Ed. , ElsevierAcademic Press. Cambridge, MA. (2009).
- Bind, R. H., Minney, S. M., Rosenfeld, S., Hallock, R. M. The role of pheromonal responses in rodent behavior: Future directions for the development of laboratory protocols. Journal of the American Association for Laboratory Animal Science. 52 (2), 124-129 (2013).
- Paxinos, G., Franklin, K. B. J. The Mouse Brain in Stereotaxic Coordinates. , Academic Press. Cambridge, MA. (2001).
- Elgueta, D., et al. Dopamine receptor D3 expression is altered in CD4+ T-cells from Parkinson's disease patients and its pharmacologic inhibition attenuates the motor impairment in a mouse model. Frontiers in Immunology. 10, 981(2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Fernandez-Suarez, D., et al. The monoacylglycerol lipase inhibitor JZL184 is neuroprotective and alters glial cell phenotype in the chronic MPTP mouse model. Neurobiology of Aging. 35 (11), 2603-2616 (2014).
- Elgueta, D., et al. Pharmacologic antagonism of dopamine receptor D3 attenuates neurodegeneration and motor impairment in a mouse model of Parkinson's disease. Neuropharmacology. 113, 110-123 (2017).
- Montoya, A., et al. Dopamine receptor D3 signalling in astrocytes promotes neuroinflammation. Journal of Neuroinflammation. 16 (1), 258(2019).
- Williams, G. P., et al. Targeting of the class II transactivator attenuates inflammation and neurodegeneration in an alpha-synuclein model of Parkinson's disease. Journal of Neuroinflammation. 15 (1), 244(2018).
- Benskey, M. J., et al. Silencing alpha synuclein in mature nigral neurons results in rapid neuroinflammation and subsequent toxicity. Frontiers in Molecular Neuroscience. 11, 36(2018).
- Rieker, C., et al. Neuropathology in mice expressing mouse alpha-synuclein. PLoS One. 6 (9), 24834(2011).
- Harms, A. S., et al. alpha-Synuclein fibrils recruit peripheral immune cells in the rat brain prior to neurodegeneration. Acta Neuropathologica Communications. 5 (1), 85(2017).
- Williams, G. P., et al. CD4 T cells mediate brain inflammation and neurodegeneration in a mouse model of Parkinson disease. Brain. 144 (7), 2047-2059 (2021).
- Matheoud, D., et al. Intestinal infection triggers Parkinson's disease-like symptoms in Pink1(-/-) mice. Nature. 571 (7766), 565-569 (2019).
- Jan, A., Goncalves, N. P., Vaegter, C. B., Jensen, P. H., Ferreira, N. The prion-like spreading of alpha-synuclein in Parkinson's disease: Update on models and hypotheses. International Journal of Molecular Sciences. 22 (15), 8338(2021).
- Chesselet, M. F., et al. A progressive mouse model of Parkinson's disease: The Thy1-aSyn ("Line 61") mice. Neurotherapeutics. 9 (2), 297-314 (2012).
- Sampson, T. R., et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease. Cell. 167 (6), 1469-1480 (2016).
- Ciron, C., et al. Human alpha-iduronidase gene transfer mediated by adeno-associated virus types 1, 2, and 5 in the brain of nonhuman primates: Vector diffusion and biodistribution. Human Gene Therapy. 20 (4), 350-360 (2009).
- Ben-Shaanan, T. L., et al. Activation of the reward system boosts innate and adaptive immunity. Nature Medicine. 22 (8), 940-944 (2016).
- Albert, K., Voutilainen, M. H., Domanskyi, A., Airavaara, M. AAV vector-mediated gene delivery to substantia nigra dopamine neurons: Implications for gene therapy and disease models. Genes. 8 (2), 63(2017).
- Bordia, T., Perez, X. A., Heiss, J., Zhang, D., Quik, M. Optogenetic activation of striatal cholinergic interneurons regulates L-dopa-induced dyskinesias. Neurobiology of Disease. 91, 47-58 (2016).
- Kim, A., et al. Upgraded methodology for the development of early diagnosis of Parkinson's disease based on searching blood markers in patients and experimental models. Molecular Neurobiology. 56 (5), 3437-3450 (2018).
- Lei, H., et al. Parkinson's disease diagnosis via joint learning from multiple modalities and relations. IEEE Journal of Biomedical and Health Informatics. 23 (4), 1437-1449 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır