Method Article
Análisis del modelo de ratón de la enfermedad de Parkinson inducido por vectores virales adenoasociados que codifican la α-sinucleína humana
En este artículo
Resumen
Este trabajo analiza la dosis del vector y el tiempo de exposición necesarios para inducir neuroinflamación, neurodegeneración y deterioro motor en este modelo preclínico de la enfermedad de Parkinson. Estos vectores que codifican la α-sinucleína humana se administran en la sustancia negra para recapitular la patología de la sinucleína asociada con la enfermedad de Parkinson.
Resumen
La enfermedad de Parkinson es un trastorno neurodegenerativo que implica la muerte de las neuronas dopaminérgicas de la vía nigrostriatal y, en consecuencia, la pérdida progresiva del control de los movimientos voluntarios. Este proceso neurodegenerativo se desencadena por la deposición de agregados de proteínas en el cerebro, que están constituidos principalmente por α-sinucleína. Varios estudios han indicado que la neuroinflamación es necesaria para desarrollar la neurodegeneración asociada con la enfermedad de Parkinson. En particular, el proceso neuroinflamatorio implica la activación microglial, así como la infiltración de células T periféricas en la sustancia negra (SN). Este trabajo analiza un modelo de ratón de la enfermedad de Parkinson que recapitula la activación microglial, la infiltración de células T en el SN, la neurodegeneración de las neuronas dopaminérgicas nigral y el deterioro motor. Este modelo de ratón de la enfermedad de Parkinson es inducido por la administración estereotáxica de vectores virales adenoasociados que codifican la α-sinucleína de tipo salvaje humano (AAV-hαSyn) en el SN. La correcta entrega de vectores virales en el SN se confirmó utilizando vectores de control que codifican la proteína fluorescente verde (GFP). Posteriormente, se evaluó cómo la dosis de AAV-hαSyn administrada en el SN afectó el grado de expresión de hαSyn, la pérdida de neuronas dopaminérgicas nigral y el deterioro motor. Además, la dinámica de la expresión de hαSyn, la activación microglial y la infiltración de células T se determinaron a lo largo del curso del desarrollo de la enfermedad. Por lo tanto, este estudio proporciona puntos de tiempo críticos que pueden ser útiles para atacar la patología de la sinucleína y la neuroinflamación en este modelo preclínico de la enfermedad de Parkinson.
Introducción
Después de la enfermedad de Alzheimer, la enfermedad de Parkinson es la segunda enfermedad neurodegenerativa más prevalente en todo el mundo. Las neuronas primarias afectadas en la enfermedad de Parkinson son las de la vía nigrostriatal, que producen dopamina y controlan el movimiento voluntario. Como consecuencia, el síntoma más característico asociado a este trastorno es la discapacidad motora. Esta patología también implica la deposición de agregados de proteínas en el cerebro, que están compuestos principalmente de α-sinucleína (αSyn)1, una proteína citosólica asociada a terminales presinápticos. La evidencia ha demostrado que la generación de inclusiones patogénicas de αSyn se desencadena por un plegamiento incorrecto o por algunas modificaciones post-traduccionales de esta proteína2.
En particular, se ha establecido una estrecha relación entre la patología αSyn y la pérdida de neuronas dopaminérgicas de la vía nigrostriatal en la enfermedad de Parkinson humana y modelos animales 3,4. Comprender cómo se generan los agregados αSyn y cómo inducen la muerte neuronal representa un desafío significativo en el campo. Un grupo creciente de estudios ha demostrado que, al aumentar el estrés oxidativo, la disfunción mitocondrial es una de las principales causas de la generación de agregados αSyn2. De hecho, varios genes asociados con el riesgo de enfermedad de Parkinson codifican proteínas involucradas en la función, morfología y dinámica mitocondrial 5,6. Además, la disfunción lisosomal, que resulta en la acumulación de mitocondrias disfuncionales y αSyn mal plegadas, constituye otro evento importante que promueve la generación de agregados αSyn7.
La evidencia emergente ha indicado que, una vez que los agregados de αSyn se depositan en el cerebro, estas proteínas patógenas estimulan receptores tipo toll (TLR) en la microglía, desencadenando así la activación microglial y un ambiente inflamatorio inicial en la sustancia negra (SN)8,9. Además, la evidencia indica que los agregados de αSyn son capturados y presentados por las células presentadoras de antígenos a las células T, induciendo una respuesta inmune adaptativa específica a αSyn10,11. Estas células T específicas de αSyn se infiltran posteriormente en el cerebro y son reestimuladas por microglía activada, promoviendo así la secreción de factores neurotóxicos que evocan la muerte neuronal 9,10. Curiosamente, varias líneas de evidencia han sugerido que los agregados αSyn se generan primero en el sistema nervioso entérico y luego se transportan a través del nervio vago hasta el tronco encefálico12.
Varios modelos animales de la enfermedad de Parkinson se han utilizado durante muchos años, incluidos los inducidos por la administración de sustancias neurotóxicas (es decir, 6-hidroxidopamina, paraquat, rotenona, 1-metil-4-fenil-1,2,3,6-tetrahidropiridina) y aquellos que involucran condiciones genéticas (es decir, mutante α-sinucleína, quinasa de repetición 2 rica en leucina mutante)13 . A pesar de que los modelos que involucran neurodegeneración inducida por neurotoxinas replican algunos aspectos de la enfermedad de Parkinson, ninguno de ellos recapitula todos los aspectos esenciales de la enfermedad o no es progresivo13. Por otro lado, aunque los modelos genéticos de ratón que implican la expresión de versiones mutantes de la quinasa 2 repetida rica en leucina, las versiones mutantes de α-sinucleína o la sobreexpresión de α-sinucleína humana de tipo salvaje dan lugar a un deterioro motor y, en algunos casos, también al desarrollo de sinucleinopatía, no reproducen la neurodegeneración prominente de las neuronas dopaminérgicas nigrales, que es un aspecto esencial de la enfermedad de Parkinson13, 14. Un tercer tipo de modelo animal de neurodegeneración ha logrado satisfacer la mayoría de los aspectos esenciales de la enfermedad de Parkinson, la entrega estereotáxica de vectores virales adenoasociados (AAV) que codifican la α-sinucleína humana (AAV-hαSyn)14,15. Es importante destacar que los AAV permiten la transducción de neuronas con alta eficacia y a largo plazo en el cerebro adulto de los mamíferos. Además, se ha demostrado que la administración estereotáxica de AAV-hαSyn en el SN reproduce muchos de los aspectos esenciales de la enfermedad, incluida la patología αSyn, la activación microglial, la neurodegeneración y el deterioro motor 16,17,18,19,20. Este estudio presenta un análisis de cómo la dosis del vector viral y el tiempo después de la entrega del vector viral afectan la extensión de la expresión de hαSyn, la neurodegeneración y la neuroinflamación en la vía nigrostriatal, así como el grado de deterioro motor en el modelo de ratón de la administración estereotáxica unilateral de hαSyn en el SN.
Protocolo
Todos los estudios se realizaron en el marco de la 8ª edición de la Guía para el Cuidado y Uso de Animales de Laboratorio. Los protocolos experimentales fueron aprobados por el IACUC en la Fundación Ciencia & Vida, incluidos los que involucran anestesia, dolor, angustia y eutanasia (permiso número P-035/2022).
1. La cirugía estereotáxica
- Preparación para la cirugía (aproximadamente 1 h)
- Para mantener un ambiente aséptico, use ropa quirúrgica adecuada durante toda la cirugía, incluyendo cubiertas de zapatos, una máscara quirúrgica, una barrera sanitaria, guantes y una gorra quirúrgica.
- Rocíe etanol al 70% sobre el ratón y todo el material quirúrgico para mantener un ambiente aséptico.
- Para inducir la analgesia, inyecte al ratón carprofeno 5 mg/kg por vía subcutánea (s.c.) cada 12 h21 comenzando 1 h antes de la cirugía y continuando hasta 3 días después de la cirugía.
- Para anestesiar al ratón, coloque al animal en una cámara de inducción. Abra el flujo de isoflurano a una velocidad del 0,5% y luego aumente lentamente hasta un 5% durante aproximadamente 5 minutos hasta que el ratón haya perdido su reflejo de enderezamiento22.
- Retire al animal de la cámara de inducción. Transfiera inmediatamente al animal a un circuito sin rerespiración con un cono nasal del tamaño adecuado. Mantenga la anestesia del ratón con isoflurano al 1% durante todo el tiempo de la cirugía.
- Confirme que el ratón está completamente anestesiado pellizcando su cola y patas. Cuando el ratón no reacciona al pellizcar la cola y las patas, significa que el ratón está completamente anestesiado.
- Afeitar la cabeza del ratón con tijeras. Limpiar la piel del ratón con un hisopo de algodón con clorhexidina al 2% y eliminar todo el vello.
- Fije la cabeza del ratón en el marco estereotáxico.
- Coloque un protector corneal en ambos ojos de ratón con un hisopo de algodón. Para prevenir la inducción de estrés en otros roedores, evite la presencia de cualquier otro ratón en la sala de cirugía23.
- La cirugía (aproximadamente 30 min)
- Limpie la cabeza del ratón con tres rondas de clorhexidina al 2% seguidas de etanol al 70%. Exponer el cráneo con material quirúrgico y hacer un orificio fino con un taladro en las siguientes coordenadas: anteroposterior −2,8 mm, y mediolateral 1,4 mm con respecto a la línea medial.
- Coloque la aguja de una jeringa de 10 μL en el orificio y mueva la aguja dentro del cerebro lentamente hasta llegar a -7,2 mm dorsoventral con respecto a la duramadre24.
- Deje la aguja en la posición final durante 2 minutos para permitir que el tejido se asiente un poco, y luego inyecte 1 μL de AAV5-CBA-hαSyn (AAV-hαSyn), AAV5-CBA-eGFP (AAV-GFP) o vehículo (PBS a pH 7.4; cirugía simulada) en la sustancia negra derecha a una velocidad de 0.2 μL / 30 s.
- Deje la aguja en la misma posición durante 5 minutos después de la administración de vectores virales y luego retírela lentamente.
- Postoperatorio (aproximadamente 5 min)
- Cierre la herida con una sutura estéril trenzada de seda no absorbible.
- Coloque el ratón en la jaula casera precalentada colocándolo sobre un colchón eléctrico calentado (25 °C).
NOTA: El ratón debe mantenerse solo en la jaula doméstica hasta que pueda caminar sin dificultad y la herida haya cicatrizado.
2. Determinación del rendimiento del motor mediante la prueba del haz
- Entrenamiento (aproximadamente 15 min por ratón)
- Doce semanas después de la cirugía estereotáxica, evalúe el rendimiento motor utilizando una versión simplificada de la prueba de haz descrita antesde 25. Para este propósito, use una viga horizontal de 25 cm de largo y 3 cm de ancho. La superficie de la viga debe cubrirse con una rejilla metálica con cuadrados de 1 cm y elevada 1 cm por encima de la viga.
- Tome un video del ratón atravesando el haz de la superficie de la rejilla desde un extremo hasta el extremo opuesto del haz, donde se encuentra la jaula doméstica. Entrene el ratón durante 2 días antes de la determinación del rendimiento del motor.
- El primer día, entrena al ratón para que camine a través de la viga cinco veces sin la rejilla.
- En el segundo día, entrena al ratón para que camine a través del haz en presencia de la rejilla cinco veces.
- La prueba (aproximadamente 5 min por ratón)
- Al tercer día, evalúe el rendimiento del motor. Para hacer esto, cuantifique el número de errores realizados por las patas izquierdas o por las patas derechas por separado viendo los videos en modo de cámara lenta.
NOTA: Un error se define como cuando una pata no pisa correctamente la rejilla y, por lo tanto, se hace visible en el lado de la rejilla o entre la rejilla y la superficie del haz.
- Al tercer día, evalúe el rendimiento del motor. Para hacer esto, cuantifique el número de errores realizados por las patas izquierdas o por las patas derechas por separado viendo los videos en modo de cámara lenta.
3. Procesamiento de tejidos
- Perfusión transcárdica (aproximadamente 15 min por ratón)
- Para anestesiar al ratón, inyecte una mezcla de ketamina (80 mg/kg) y xilazina (10 mg/kg) por vía intraperitoneal (i.p.) utilizando una jeringa de 1 ml y una aguja de 27 G26.
- Una vez que el ratón esté completamente anestesiado (confirmado como en el paso 1.1.6.), abra el tórax con material quirúrgico y exponga el corazón.
- Luego, inserte una aguja de 21 G (haga que la punta sea plana con un taladro) en el ventrículo izquierdo del corazón.
- Al acoplar la aguja a una tubería, perfunda 50 ml de PBS (pH 7.4) a una velocidad de 9.5 ml / min utilizando una bomba peristáltica.
- Fijación y crioprotección del cerebro (aproximadamente 10 minutos por cerebro)
- Retire el cerebro con tijeras y pinzas, y luego fíjelo por inmersión en 5 ml de paraformaldehído al 4% en PBS (pH 7.4) a 4 ° C durante 24 h.
- Después, coloque el cerebro fijo en 15 ml de sacarosa al 30% a 4 ° C durante 48 h.
- Luego, coloque el cerebro en 4 ml de solución de crioprotección (20% de glicerina y 2% de DMSO en PBS) y guarde el cerebro a -80 ° C o úselo inmediatamente en el siguiente paso.
- Obtención de cortes cerebrales (aproximadamente 20 min por cerebro).
NOTA: Asegúrese de que el cerebro se coloque en un criostato en una posición adecuada para hacer cortes coronales.- Para obtener rodajas SN, corte el cerebro en secciones de 40 μm de espesor a partir de -2,92 mm y terminando en -3,64 mm24.
- Cosechar cada rebanada en un pocillo (que contenga 1 ml de solución de crioprotección) de una placa de 24 pocillos siguiendo un orden anteroposterior como se describió antes 25,27,28.
- Para realizar análisis inmunohistoquímicos (sección 4.) e inmunofluorescencia (sección 5.) en el SN, elija seis secciones coronales de SN tomadas a intervalos uniformes (120 μm) que cubran toda la extensión rostrocaudal del núcleo (720 μm en total), como se describió antes 25,27,28.
- Para obtener rebanadas estriatales, corte el cerebro en secciones de 40 μm de espesor a partir de +1.34 mm y terminando en -0.26 mm24.
- Cosechar cada rebanada en un criotubo de 2 ml (que contiene 1 ml de solución de crioprotección) siguiendo un orden anteroposterior.
- Para realizar análisis inmunohistoquímicos (sección 4.) e inmunofluorescencia (sección 5.) en el cuerpo estriado, elija cinco secciones estriatales coronales tomadas a intervalos uniformes (320 μm) que cubran toda la extensión rostrocaudal del núcleo (1600 μm en total).
4. Análisis inmunohistoquímico para cuantificar neuronas dopaminérgicas y microgliosis (aproximadamente 2 días)
- Para el análisis inmunohistoquímico de rebanadas estriatales o nigrales, coloque el conjunto de cinco (estriado) o seis (SN) cortes del mismo cerebro en un pocillo de una placa de 24 pocillos.
- Lavar las secciones 3x con 1 mL de PBS y luego incubar con 0.5 mL de 0.03% H2O2 en metanol a temperatura ambiente y con agitación durante 30 min para inactivar la actividad endógena de la peroxidasa.
- Lavar las secciones 3x con 1 ml de PBS e incubar con 0,5 ml de solución bloqueadora (4% de suero de cabra, 0,05% de Tritón X-100 y 4% de BSA en PBS) a temperatura ambiente y con agitación durante 40 min.
- Después, incubar con 0,5 ml de solución bloqueadora que contenga el anticuerpo primario (anti-tirosina hidroxilasa de conejo [TH] pAb diluido 1:1000 [ver Tabla 1]; o anticuerpo anti-Iba1 de conejo diluido 1:1000) a temperatura ambiente y con agitación durante la noche.
- Lavar las secciones 3x con 1 mL de PBS e incubar con 0,5 mL de solución bloqueadora que contenga pAb anti-conejo de cabra biotinilada (1:500, ver Tabla 1) a temperatura ambiente y con agitación durante 2 h.
- A continuación, lavar las secciones 3x con 1 ml de PBS e incubar con 0,5 ml de avidina conjugada con peroxidasa (1:5000, ver Tabla 1) en solución de bloqueo a temperatura ambiente y con agitación durante 90 min.
- Lavar las secciones 3x con 1 ml de PBS e incubar con 0,5 ml de solución de sustrato (diaminobenzidina al 0,05% en tampón H2O2/Trizma-HCl al pH 7,6). Use guantes y una bata de laboratorio para este paso, ya que la diaminobencidina es un carcinógeno potencial.
- Cuando la tinción específica sea evidente (típicamente 30 segundos para TH y 5 min para Iba1), saque la solución de sustrato y lave las secciones 3x con 1 ml de PBS a temperatura ambiente y con agitación. Realizar siempre la inmunotinción de lonchas de todos los cerebros incluidos en el mismo experimento de forma simultánea.
NOTA: La tinción específica de TH es evidente cuando aparece la inmunotinción de TH en el área del SN, que muestra una forma característica en el cerebro. La marca específica de Iba1 se determina cuando aparece la inmunotinción de Iba1 en cortes cerebrales de control con formas microgliales típicas, que se confirman tras la observación al microscopio. De esta manera, se determina el tiempo exacto de exposición del sustrato para el análisis de IHC para cada experimento. - Monte las secciones cerebrales en portaobjetos de vidrio utilizando una solución de gelatina al 0,2% en 0,05 M Tris (pH 7,6). Coloque cada juego de cinco (estriado) o seis (SN) rebanadas obtenidas del mismo cerebro en orden rostrocaudal en el mismo portaobjetos de vidrio.
- Cuantificar el número de neuronas TH+ en el SN.
- Para cuantificar las neuronas TH+ en el SN, adquiera fotos de las seis rebanadas con un aumento de 20x utilizando un microscopio de campo brillante, como se describió antesde 25,27,28. Utilice el siguiente ajuste de color: temperatura de color 3200 K, rojo cian-40%, verde magenta 39%, amarillo-azul 54%, gamma 0.5, contraste 37, brillo 13, saturación 5.
- Utilizando el software Image J, seleccione el perímetro del SN pars compacta en el hemisferio analizado. Evite la selección de neuronas TH+ del área tegmental ventral (VTA).
- Después, pida al software que calcule el área seleccionada (típicamente 0.04-0.07 mm2 / hemisferio, dependiendo de la posición rostrocaudal). Luego, usando la herramienta multipunto, etiquete cada neurona TH + con un punto.
- Usando la herramienta de puntos, pídale al software que cuente el número total de puntos. Con el número de puntos totales (neuronas TH+ ) y el área del SNpc, calcule la densidad de las neuronas TH+ /mm2.
- Repita el mismo cálculo en ambos hemisferios en las seis rebanadas de SN y luego calcule la media de neuronas TH + / mm2 en los lados ipsilateral y contralateral.
- Cuantificar el número de microglía activada en el cuerpo estriado
- Para cuantificar la microglía activada en el cuerpo estriado, adquiera dos fotos en cada hemisferio para las cinco rodajas estriatales con un aumento de 20x utilizando un microscopio de campo brillante y los mismos ajustes indicados en el paso 4.10.1. Usando el software Image J, en cada foto (que muestra un área de 660 μm x 877 μm), etiquete con un punto cada celda expresando alta intensidad Iba1 y forma ameboide utilizando la herramienta multipunto. Usando la herramienta de puntos, pídale al software que cuente el número total de puntos.
- Con el número de puntos totales y el área de la foto, calcule la densidad de la microglía activada (célulasaltas Iba1 / mm2) como se realizó antesde 29.
| Antígeno objetivo | Acoplado a | Clonalidad | Especie huésped | Reactividad de la especie* | Dilución** |
| Tirosina hidroxilasa | N/A | Policlonal | Conejo | Ratón, Rata, Humano | 1/200 - 1/1000 |
| Iba1 | N/A | Monoclonal | Conejo | Ratón, Rata, Humano | 1/1000 |
| alfa-sinucleína | N/A | Monoclonal | Conejo | Humano | 1/150 |
| CD4 | N/A | Monoclonal | Rata | Ratón | 1/250 |
| IgG (H+L) | Biotinilado | Policlonal | Cabra | Conejo | 1/500 |
| IgG (H+L) | AlexaFluor 546 | Policlonal | Cabra | Conejo | 1/500 |
| IgG (H+L) | AlexaFluor 647 | Policlonal | Cabra | Conejo | 1/500 |
| IgG (H+L) | AlexaFluor 546 | Policlonal | Cabra | Rata | 1/500 |
Tabla 1: Diluciones de anticuerpos. N/A, no aplicable. *, Solo se especifica si hay reactividades con ratón, rata y humano, independientemente de la reactividad con otras especies. **, Se especifica una sola dilución o un rango de dilución.
5. Análisis de inmunofluorescencia para evaluar la infiltración de células T en la vía nigrostriatal (aproximadamente 2 días)
- Para el análisis de inmunofluorescencia de hαSyn o TH/GFP en rodajas estriatales o nigrales, junte el conjunto de cinco (estriado) o seis (SN) rebanadas del mismo cerebro en un pocillo de una placa de 24 pocillos.
- Lavar las secciones 3x con 1 mL de PBS y luego incubar con 0.5 mL de solución de bloqueo (0.3% Triton X-100, 0.05% tween20 y 5% BSA en PBS) a temperatura ambiente y con agitación durante 40 min.
- Después, incubar con 0,5 ml de solución bloqueadora que contenga el anticuerpo primario (conejo anti-TH pAb diluido 1:500; o anticuerpo anti-hαSyn de conejo diluido 1:150, ver Tabla 1) a temperatura ambiente y con agitación durante la noche.
- Lavar las secciones 3x con 1 ml de PBS e incubar con 0,5 ml de solución bloqueadora que contenga anticuerpo secundario anti-conejo acoplado a AlexaFluor546 (1:500, ver Tabla 1) y 4′,6-diamidino-2-fenilindol (DAPI; 1:1000) a temperatura ambiente y con agitación durante 2 h. Luego, lave las secciones 3x con 1 ml de PBS.
- Monte las secciones cerebrales en diapositivas de vidrio como se describió anteriormente (paso 4.9.). Las imágenes se adquirieron con un microscopio de fluorescencia invertido acoplado a una unidad de fuente de alimentación.
- Para el análisis de inmunofluorescencia de TH/CD4/GFP(Foxp3) en rodajas de nigral, coloque el conjunto de seis rebanadas (SN) del mismo cerebro en un pocillo de una placa de 24 pocillos. Lavar las secciones 3x con 1 mL de PBS y luego incubar con 0.5 mL de solución bloqueadora (0.5% Triton X-100, 0.5% gelatina de piel de pescado en PBS) a temperatura ambiente y con agitación durante 2 h.
- Incubar con 0,5 ml de solución bloqueadora que contenga los anticuerpos primarios conejo anti-TH pAb (1:200, ver Tabla 1) y anti-CD4 de rata (1:250) a 4 °C y con agitación durante la noche.
- Lavar las secciones 3x con 1 mL de PBS e incubar con 0,5 mL de solución de bloqueo que contenga anti-conejo acoplado a AlexaFluor 647 (1:500, ver Tabla 1) y anti-rata acoplado a AlexaFluor 546 (1:500) a temperatura ambiente y con agitación durante 2 h. Luego, lave las secciones 3x con 1 ml de PBS.
- Coloque cada juego de seis rebanadas (SN) obtenidas del mismo cerebro en orden rostrocaudal en el mismo portaobjetos de vidrio y móntelas usando Fluoromount G. Adquiera imágenes usando un microscopio Leica DMi8. Utilice los ajustes del microscopio confocal indicados en la Tabla 2 para obtener imágenes del análisis de inmunofluorescencia.
| Nombre de Chanel | Cubo | Longitud de onda de emisión | Nombre de la tabla de búsqueda | Tiempo de exposición | Ganar | Resolución XY | Resolución Z |
| Canal 1 | Y5 | 700nm | Gris | 1.011.727 ms | alta capacidad de pozos | 2.237 um | 24.444 um |
| Canal 2 | GFP | 525 nm | Verde | 326.851 metros | alta capacidad de pozos | 2.237 um | 24.444 um |
| Canal 3 | TXR | 630nm | Rojo | 406.344 metros | alta capacidad de pozos | 2.237 um | 24.444 um |
| Canal 4 | Dapi | 460nm | Azul | 91.501 metros | alta capacidad de pozos | 2.237 um | 24.444 um |
Tabla 2: Ajustes de microscopio confocal utilizados para la adquisición de imágenes a partir del análisis de inmunofluorescencia.
6. Análisis estadístico
- Para comparar los datos obtenidos de los lados ipsilateral y contralateral, use una prueba t de Student de dos colas emparejada.
- Para comparar los datos obtenidos de ratones que recibieron AAV-hαSyn y de ratones que recibieron AAV-GFP o cirugía simulada, use una prueba t de Student de dos colas sin aparear. Considere diferencias significativas cuando los valores de P < 0,05.
Resultados
Validar la correcta entrega de vectores AAV en las neuronas dopaminérgicas de la vía nigrostriatal
Para estudiar los procesos de neuroinflamación, neurodegeneración y deterioro motor promovido por la patología de la sinucleína, se utilizó un modelo de ratón de la enfermedad de Parkinson inducida por la administración estereotáxica unilateral de AAV que codifica hαSyn en el SN 16,17,30,31 (ver el diseño experimental en figura suplementaria 1 ). Para validar la correcta entrega de vectores AAV en las neuronas dopaminérgicas de la vía nigrostriatal, se inyectó AAV que codifica GFP (AAV-GFP) en el SN, y 12 semanas después, se analizó la fluorescencia GFP y la inmunorreactividad tirosina hidroxilasa (TH) en el SN y el cuerpo estriado por inmunofluorescencia. La fluorescencia asociada a GFP se observó exclusivamente en el lado ipsilateral, y hubo una colocalización significativa con inmunorreactividad TH tanto en el SN como en el estriado, lo que indica la correcta entrega de vectores AAV en las neuronas dopaminérgicas de la vía nigrostriatal (Figura 1).
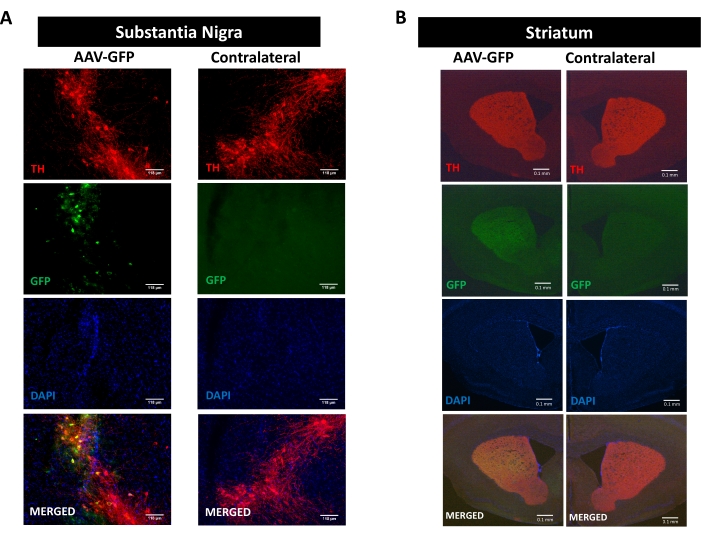
Figura 1: Análisis de la administración de AAV-GFP en la vía nigrostriatal. Los ratones recibieron AAV-GFP (1 x 1010 vg / ratón) y 12 semanas después fueron sacrificados, y TH se inmunoteñó en (A) el SN (las barras de escala son 118 μm) y (B) el cuerpo estriado (las barras de escala son 100 μm). La fluorescencia asociada a TH y GFP se analizó mediante microscopía de epifluorescencia. Los núcleos se tiñeron con DAPI. Se muestran imágenes representativas de tinción combinada o simple de TH (rojo), GFP (verde) y DAPI (azul). Haga clic aquí para ver una versión más grande de esta figura.
Establecimiento de la dosis del vector viral administrado para inducir neurodegeneración y deterioro motor en el modelo de ratón de la enfermedad de Parkinson inducida por AAV-hαSyn
Para probar la dosis de AAV-hαSyn requerida para inducir una sobreexpresión significativa de hαSyn que promueve la neurodegeneración de las neuronas dopaminérgicas nigral, se inyectaron diferentes dosis (1 x 108 genomas virales [vg]/ratón, 1 x 109 vg/ratón, o 1 x 1010 vg /ratón) de AAV-hαSyn, y 12 semanas después, se evaluó la inmunorreactividad hαSyn y el grado de inmunorreactividad TH en la vía nigrostriatal. Aunque la inmunorreactividad hαSyn fue evidente con todas las dosis probadas en el SN (Figura 2), solo los ratones que recibieron 1 x 1010 vg/ratón presentaron inmunorreactividad hαSyn evidente en el cuerpo estriado (Figura 3). Además, los ratones que recibieron 1 x10 10 vg / ratón de AAV-hαSyn mostraron una pérdida significativa de neuronas dopaminérgicas en el SN (Figura 4A, B). Aunque los ratones que recibieron 1 x10 10 vg/ratón de AAV-GFP mostraron un bajo grado (~20%) de pérdida neuronal (Figura 4A, B), los ratones que recibieron la misma dosis de AAV-hαSyn presentaron un grado significativamente mayor de neurodegeneración de neuronas dopaminérgicas nigral (Figura 4C). En consecuencia, se realizaron más experimentos utilizando 1 x 1010 vg / ratón de AAV-hαSyn. Además, se determinó el grado de deterioro motor en ratones que recibieron diferentes dosis de AAV-hαSyn mediante el uso de la prueba de haz (Figura 5A), como se describió antes25. Se detectó una reducción significativa en el rendimiento del motor exclusivamente con 1 x10 10 vg/ratón de AAV-hαSyn en la prueba de haz tanto al comparar el número de errores cometidos por las almohadillas derecha e izquierda (Figura 5B) como al comparar el número total de errores de ratones que recibieron AAV-hαSyn en comparación con ratones que recibieron el vector de control AAV-GFP (Figura 5C). En consecuencia, se realizaron más experimentos utilizando 1 x 1010 vg / ratón de AAV-hαSyn.
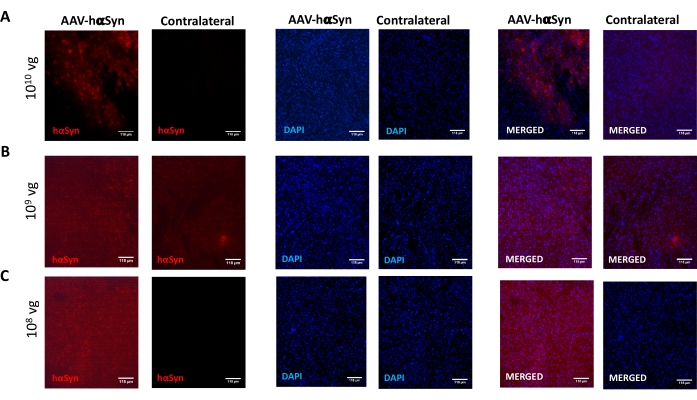
Figura 2: Análisis de la expresión de α-sinucleína humana en el SN de ratones tratados con diferentes dosis de AAV-hαSyn. Los ratones recibieron AAV-hαSyn en (A) 1 x 1010 vg/ratón, (B) 1 x 109 vg/ratón, o (C) 1 x 108 vg/ratón y 12 semanas después fueron sacrificados, y la expresión de hαSyn se analizó por inmunofluorescencia en el SN mediante microscopía de epifluorescencia. Los núcleos se tiñeron con DAPI. Se muestran imágenes representativas de tinción combinada o simple de hαSyn (rojo) o DAPI (azul). Las barras de escala son de 118 μm. Haga clic aquí para ver una versión más grande de esta figura.
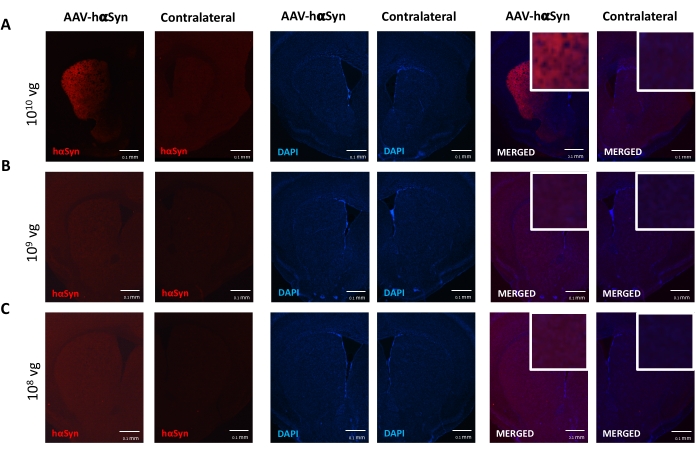
Figura 3: Análisis de la expresión de α-sinucleína humana en el cuerpo estriado de ratones tratados con diferentes dosis de AAV-hαSyn. Los ratones recibieron AAV-hαSyn en (A) 1 x 1010 vg /ratón, (B) 1 x 109 vg/ratón, o (C) 1 x 108 vg/ratón) y 12 semanas después fueron sacrificados, y la expresión de hαSyn se analizó por inmunofluorescencia en el cuerpo estriado mediante microscopía de epifluorescencia. Los núcleos se tiñeron con DAPI. Se muestran imágenes representativas de tinción combinada o simple de hαSyn (rojo) o DAPI (azul). Las barras de escala son de 100 μm. El inserto en la esquina superior derecha de las imágenes combinadas muestra un área de interés en un aumento más alto. Haga clic aquí para ver una versión más grande de esta figura.
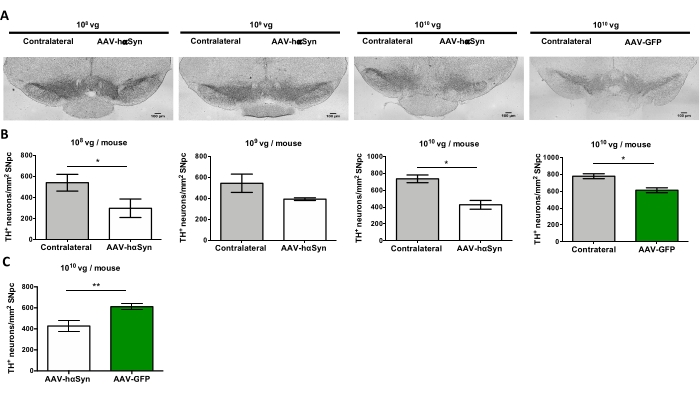
Figura 4: Pérdida de neuronas dopaminérgicas del SN en ratones tratados con diferentes dosis de AAV-hαSyn o vector control. Los ratones recibieron AAV-hαSyn (1 x10 10 vg/ratón, 1 x 109 vg/ratón, o 1 x 108 vg/ratón) o AAV-GFP (1 x 1010 vg/ratón) y 12 semanas después fueron sacrificados, y la TH fue analizada en el SNpc por inmunohistoquímica. (A) Imágenes representativas. Barras de escala, 100 μm. (B,C) La densidad de neuronas se cuantificó como el número de neuronas TH+/mm2. Los datos representan la media ± SEM. n = 3-8 ratones por grupo. (B) Se realizó una comparación de los lados ipsilateral con los contralaterales utilizando la prueba t de Student emparejada de dos colas. (C) Se realizó una comparación de los lados ipsilaterales de ratones que recibieron1 x 10 10 vg/ratón de AAV-hαSyn o AAV-GFP. (B,C) Mientras que las barras blancas indican la cuantificación de las neuronas TH+ en el lado ipsilateral de los ratones que reciben AAV-hαSyn, las barras verdes indican la cuantificación de las neuronas TH+ en el lado ipsilateral de los ratones que reciben AAV-GFP. Las barras grises indican la cuantificación de las neuronas TH+ en el lado contralateral del grupo correspondiente. Las comparaciones se realizaron mediante una prueba t de Student de dos colas sin aparear. *p < 0,05; **p < 0,01. Haga clic aquí para ver una versión más grande de esta figura.
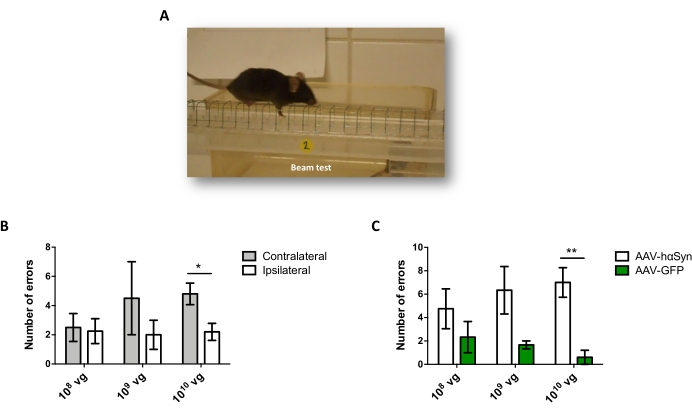
Figura 5: Análisis del rendimiento motor en ratones tratados con diferentes dosis de AAV-hαSyn. Los ratones recibieron diferentes dosis (1 x 1010 vg / ratón, 1 x 109 vg / ratón, o 1 x 108 vg / ratón) de AAV-hαSyn o AAV-GFP, y 12 semanas después, el rendimiento del motor se evaluó mediante la prueba de haz. (A) Imagen de un ratón caminando sobre la viga. (B) El número de errores cometidos por miembros izquierdos (contralaterales) versus miembros derechos (ipsilaterales) se cuantificó en los grupos de ratones que recibieron AAV-hαSyn. (C) Se comparó el número total de errores entre diferentes grupos experimentales que recibieron la misma dosis de AAV-hαSyn o AAV-GFP. Los datos representan la media ± SEM. n = 3-5 ratones por grupo. Las comparaciones fueron realizadas por (B) una prueba t de Student de dos colas emparejada o por (C) una prueba t de Student de dos colas no emparejada. *p < 0,05; **p < 0,01. Haga clic aquí para ver una versión más grande de esta figura.
Establecimiento de la cinética del modelo de enfermedad de Parkinson inducido por AAV-αSyn
Después de determinar la dosis adecuada de AAV-hαSyn utilizada para inducir un nivel significativo de neurodegeneración y deterioro motor, se realizaron experimentos para definir el inicio de la sobreexpresión de hαSyn. Para este propósito, los ratones fueron tratados con 1 x 1010 vg / ratón de AAV-hαSyn o cirugía simulada. El grado de expresión de hαSyn se analizó en el SN una vez por semana durante las semanas 2-5 después de la cirugía estereotáxica (ver el diseño experimental en la Figura Suplementaria 2). Los resultados muestran que, a pesar de que la expresión de hαSyn se detectó en niveles bajos tan pronto como 2 semanas después de la cirugía, los grupos de hαSyn aparecieron en la semana 5 después de la cirugía estereotáxica (Figura 6).

Figura 6: Análisis del curso temporal de la expresión de α-sinucleína humana en el SN de ratones tratados con AAV-hαSyn. Los ratones recibieron AAV-hαSyn (1 x 1010 vg/ratón) o simplemente la cirugía estereotáxica simulada, y la expresión de hαSyn en el SN se analizó (A) 2 semanas, (B) 3 semanas, (C) 4 semanas, o (D) 5 semanas después mediante inmunofluorescencia mediante microscopía de epifluorescencia. Los núcleos se tiñeron con DAPI. Se muestran imágenes representativas de tinción combinada o simple de hαSyn (rojo) o DAPI (azul). Barras de escala, 100 μm. El inserto en la esquina superior derecha de las imágenes combinadas muestra un área de interés en un aumento más alto. Haga clic aquí para ver una versión más grande de esta figura.
Posteriormente, se realizaron experimentos para determinar los puntos de tiempo adecuados para analizar la neuroinflamación y la infiltración de células T en el sistema nervioso central (SNC) después de la administración estereotáxica de AAV-hαSyn. Para determinar el pico de activación microglial después del tratamiento de ratones con AAV-hαSyn, se evaluó la extensión de las células que expresan altos niveles de Iba1 en el cuerpo estriado una vez por semana durante las semanas 2-15 después de la cirugía estereotáxica. Los resultados muestran un aumento significativo en la activación microglial del lado ipsilateral en comparación con el lado contralateral de ratones 15 semanas después del tratamiento con AAV-hαSyn (Figura 7). El número de células Treg (CD4+ Foxp3+) infiltradas en el SNpc también se evaluó en diferentes puntos temporales después de la administración estereotáxica de AAV-hαSyn por inmunofluorescencia seguida de la observación de microscopía confocal. Los resultados muestran que el pico de infiltración de Treg en el SNpc fue a las 11 semanas después de la cirugía, mientras que la extensión de Treg infiltrándose en esta área del cerebro fue menor en la semana 8 o la semana 13 después de la cirugía (Figura 8). No se detectaron linfocitos T CD4+ infiltrados en el cuerpo estriado (datos no mostrados). En conjunto, estos resultados indican que, utilizando 1 x 1010 vg/ratón de AAV-hαSyn, el punto de tiempo más adecuado para analizar la neuroinflamación es la semana 15 después de la cirugía estereotáxica, mientras que un punto de tiempo adecuado para analizar la infiltración de células T en el SNC parece ser la semana 11 después del tratamiento con AAV-hαSyn.
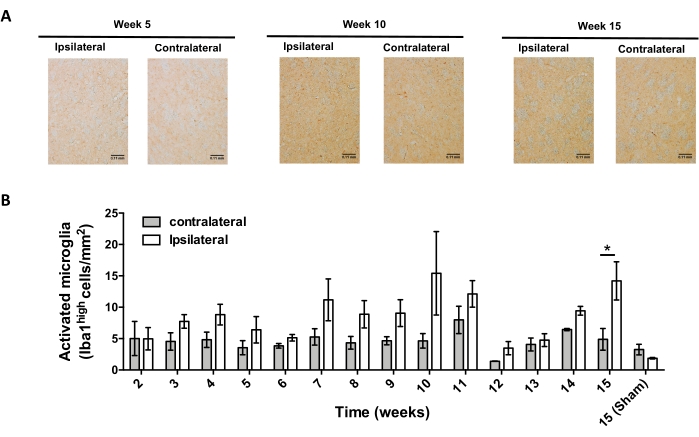
Figura 7: Análisis del curso temporal de la activación microglial en ratones inoculados con AAV-hαSyn. Los ratones recibieron AAV-hαSyn (1 x 1010 vg/ratón), y la activación microglial se evaluó mediante análisis inmunohistoquímico de Iba1 en el cuerpo estriado en diferentes puntos temporales después de la cirugía. (A) Se muestran imágenes generales representativas del análisis inmunohistoquímico de Iba1 de ratones sacrificados 5 semanas, 10 semanas o 15 semanas después de la inoculación con AAV-hαSyn. Barras de escala, 110 μm. (B) La densidad de la microglía activada se cuantificó como el número de células que expresan altos niveles de Iba1 y forma ameboide por área. Los datos representan la media ± SEM. n = 3 ratones por grupo. Se utilizó una prueba t de Student pareada de dos colas para determinar las diferencias estadísticas entre iba1 ipsilateral y contralateral en cada grupo. *p < 0,05. Haga clic aquí para ver una versión más grande de esta figura.
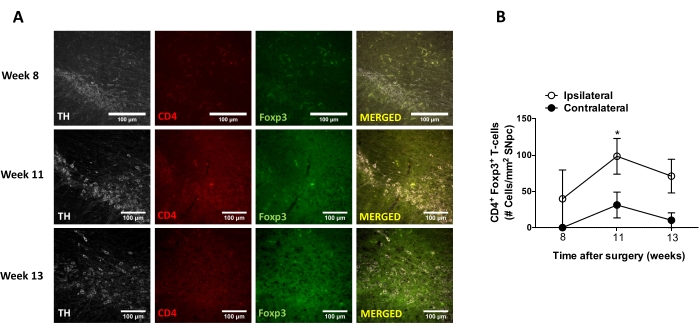
Figura 8: Análisis del curso temporal de la infiltración de linfocitos T CD4+ en el SN de ratones inoculados con AAV-hαSyn. Los ratones reporteros Foxp3gfp recibieron AAV-hαSyn (1 x 1010 vg/ ratón). La presencia de células T CD4+ que expresan Foxp3 y la presencia de neuronas TH+ se analizaron en diferentes puntos temporales (semana 8, semana 11 y semana 13 después de la cirugía) en el SN por inmunofluorescencia. (A) Se muestran imágenes representativas para la inmunotinción única o la fusión. Barras de escala, 100 μm. (B) Se cuantificó el número de células T CD4+ Foxp3+ por área en el SN. Los datos representan el SEM medio ± de 3 ratones por grupo. *p<0.05, células T de Foxp3+ CD4+ ipsilaterales versus contralaterales mediante la prueba t de Student de dos colas. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Diseño experimental para evaluar el efecto de diferentes dosis de vectores AAV sobre la patología de la sinucleína, la neurodegeneración y el deterioro motor. Los ratones machos C57BL/6 de tipo salvaje fueron anestesiados y recibieron inoculación estereotáxica de diferentes dosis (1 x 10 10 vg/ratón, 1 x 109 vg/ratón, o 1 x 108 vg/ratón) de AAV codificando α-sinucleína humana (AAV-hαSyn) o eGFP (AAV-GFP) bajo el control del promotor CBA en la sustancia negra derecha (SN). Después de 12 semanas, la expresión de GFP y hαSyn en el SN y el cuerpo estriado (Str) se evaluaron por inmunofluorescencia (IF), las células de tirosina hidroxilasa positiva (TH +) se cuantificaron mediante inmunohistoquímica (IHC) en el SN, y el rendimiento motor se evaluó mediante la prueba de haz. El número de ratones en cada grupo experimental se indica entre paréntesis. * indica los grupos en los que un ratón murió antes de los análisis. Cada análisis indica entre paréntesis el número de la figura del cuerpo del papel donde se muestran los resultados correspondientes. Haga clic aquí para descargar este archivo.
Figura complementaria 2: Diseño experimental para determinar la cinética de la infiltración de células T, la neuroinflamación y la expresión de hαSyn. Los ratones reporteros Foxp3gfp fueron anestesiados y recibieron inoculación estereotáxica de AAV (1 x 10 10 vg / ratón) que codifica α-sinucleína humana (AAV-hαSyn) bajo el control del promotor CBA en la sustancia negra derecha (SN) o cirugía simulada (PBS). Los ratones fueron sacrificados en diferentes puntos temporales, y la expresión de hαSyn en el SN y el cuerpo estriado se evaluó mediante inmunofluorescencia (IF), GFP (Foxp3), CD4 y las células de tirosina hidroxilasa positiva (TH+) se cuantificaron por IF en el SN, y la expresión de Iba1 se analizó mediante inmunohistoquímica (IHC) en el cuerpo estriado (Str). Se indica el número de ratones en cada grupo experimental. Se indica el rango de puntos de tiempo incluidos en cada análisis. Cada análisis indica entre paréntesis el número de la figura del cuerpo del papel donde se muestran los resultados correspondientes. Haga clic aquí para descargar este archivo.
Discusión
El modelo de neurodegeneración en ratones analizado aquí podría ayudar a estudiar muchos aspectos críticos involucrados en la fisiopatología de la enfermedad de Parkinson, incluidos los mecanismos involucrados en la patología αSyn y la activación microglial, la participación del sistema inmune periférico en la regulación de la neuroinflamación y los mecanismos de neurodegeneración. Entre los mecanismos implicados en la patología αSyn se encuentran aquellos mecanismos subcelulares asociados a disfunción mitocondrial, lisosomal o proteasómica en presencia de una carga excesiva de αSyn en las neuronas dopaminérgicas del SN2. Es importante considerar que, además de la expresión de hαSyn inducida por la transducción mediada por AAV, el ratón endógeno αSyn también contribuye a la carga de la expresión total de αSyn. Los ratones transgénicos que sobreexpresan αSyn en ratones desarrollan una patología de sinucleína, neuropatología y deterioro motor similares a los modelos de ratón basados en la sobreexpresión de hαSyn32. En cuanto a la activación microglial, el presente modelo de ratón podría utilizarse para estudiar cómo diferentes actores moleculares y celulares como citoquinas, neurotransmisores, astrocitos, neuronas, la barrera hematoencefálica y las células T podrían regular la adquisición de fenotipos funcionales proinflamatorios o antiinflamatorios 8,10,11 . Este modelo también constituye una herramienta importante para estudiar el papel del sistema inmune periférico, incluyendo no solo a las células T sino también a los macrófagos, monocitos y neutrófilos, en los procesos de neuroinflamación y neurodegeneración de las neuronas nigrales 11,33,34. Finalmente, este modelo de ratón también representa un valioso sistema para estudiar los mecanismos celulares y moleculares de la neurodegeneración in vivo, incluidos los inducidos por procesos celulares internos, como el estrés oxidativo, los déficits de energía y los orgánulos dañados 2, o los ejercidos por actores externos, como los factores neurotóxicos producidos por células microgliales, astrocitos y células T citotóxicas8, 28,29,35.
Una limitación de este modelo de ratón es el estudio de cómo la agregación patológica de αSyn en localizaciones extracerebrales podría constituir las etapas iniciales en el desarrollo de la enfermedad de Parkinson36. En este sentido, cada vez hay más pruebas que indican que, antes de la neurodegeneración de las neuronas nigrales y el deterioro motor, la patología αSyn comienza en la mucosa intestinal y el epitelio olfativo36 y, probablemente, también en la respuesta de las células T específicas de αSyn12. Después, los agregados αSyn migrarían a través del nervio vago al tronco encefálico, desencadenando la neuroinflamación y neurodegeneración de las neuronas dopaminérgicas12. Aunque el modelo AAV-hαSyn recapitula la mayoría de los aspectos de la enfermedad de Parkinson, no hay una participación evidente de la agregación patológica de αSyn en ubicaciones extracerebrales en este modelo. Un modelo alternativo que involucra la patología hαSyn apropiado para estudiar estos aspectos de la enfermedad de Parkinson podría ser ratones transgénicos que sobreexpresan hαSyn bajo el control del promotor Thy1, el modelo Thy1-SNCA 37, en el que el desarrollo de la enfermedad depende de la microbiota intestinal e implica un deterioro gastrointestinal evidente38.
Aunque es útil para el estudio de los diversos procesos asociados con la fisiopatología de la enfermedad de Parkinson, el presente modelo de ratón implica pasos críticos que deben verificarse minuciosamente, incluida la entrega correcta de los vectores virales en las coordenadas espaciales correspondientes, la expresión selectiva de hαSyn en las neuronas (que depende del serotipo AAV y la construcción vectorial), y la dosis adecuada de AAV y el momento antes de analizar el fenotipo parkinsoniano. El análisis de la entrega adecuada de los vectores virales en el SN es necesario, ya que el uso de las coordenadas espaciales correctas del SN podría no ser suficiente cuando la aguja no es completamente recta, lo que a veces es imperceptible para el ojo humano. Además, la difusión de los vectores AAV depende del serotipoAAV 39. Por estas razones, es necesario realizar controles de calidad periódicos verificando la correcta entrega y difusión de los vectores AAV-GFP inyectados después de la observación de GFP en cortes cerebrales que contienen el área del SN.
En cuanto a la expresión selectiva de hαSyn en neuronas, en principio, la expresión de hαSyn podría ser modificada para ser controlada por un promotor selectivo para neuronas o, aún más preciso, selectivo para neuronas dopaminérgicas, como el uso del promotor TH en vectores AAV para inducir la expresión selectiva de genes en neuronas dopaminérgicas40 . Sin embargo, esta estrategia no funciona cuando lo que se busca es la sobreexpresión del gen de interés. Por esta razón, en el presente modelo, es esencial utilizar un promotor fuerte (un promotor que induce una alta expresión del gen aguas abajo) y serotipos AAV con tropismo neuronal. En este estudio, el promotor CBA se utilizó como un promotor fuerte para inducir la sobreexpresión de hαSyn, y el serotipo AAV5 se utilizó para el vector viral. Este serotipo se ha utilizado antes para transducir neuronas de ratón y rata41,42. Aquí, los resultados demostraron que, 12 semanas después de la administración de AAV5-GFP en el SN de ratones, la fluorescencia verde estaba selectivamente presente en el lado ipsilateral tanto del SN como del cuerpo estriado (Figura 1), lo que indica la transducción eficiente de las neuronas de la vía nigrostriatal.
Otro aspecto crítico de este modelo de ratón de la enfermedad de Parkinson es el punto de tiempo requerido para analizar un proceso particular después de la cirugía. En este sentido, este trabajo muestra un estudio cinético de diferentes procesos implicados en la patología. Dado que los puntos de tiempo clave cambian con la dosis de genomas virales administrada por ratón, el serotipo de AAV utilizado, o incluso con el lote de AAV utilizado, se realizó primero un análisis dosis-respuesta de la cantidad de AAV-αSyn requerida para inducir una pérdida significativa de neuronas TH + y deterioro motor. Estudios previos han demostrado un deterioro motor significativo y una pérdida de neuronas TH+ de la vía nigrostriatal después de 12 semanas de inyecciones de AAV-αSyn en ratones a dosis que van desde 6 x 108–3 x 1010 genomas virales por ratón 16,17,30,31. En consecuencia, la dosis de AAV-hαSyn utilizada para inducir la expresión de hαSyn en la vía nigrostriatal, la pérdida de neuronas TH + y el deterioro motor en ratones varió de 1 x 108-1 x 1010 genomas virales por ratón. Por otra parte, para controlar que la pérdida de neuronas TH+ y el deterioro motor fueran inducidos por la sobreexpresión de hαSyn en el SN y no por la infección AAV de neuronas del SN, se incluyeron grupos control en los que se entregó unilateralmente la codificación AAV para un gen reportero (AAV-eGFP) en el SN de ratones y se determinó la neurodegeneración y el deterioro motor. Los resultados mostraron que, 12 semanas después de la cirugía estereotáxica, 1 x10 10 genomas virales por ratón fue una dosis adecuada de AAV5-hαSyn, ya que los ratones que recibieron esta carga viral mostraron hαSyn significativo en la vía nigrostriatal (Figura 2 y Figura 3), pérdida de neuronas TH + (Figura 4) y deterioro motor (Figura 5). Por el contrario, las dosis más bajas de AAV5-hαSyn (1 x 108 genomas virales por ratón y 1 x 109 genomas virales por ratón) no fueron lo suficientemente fuertes como para alcanzar cambios significativos en todos estos parámetros juntos (Figuras 2-4). Cabe destacar que la administración de AAV-GFP a 1 x 1010 genomas virales por ratón indujo un grado bajo (~20%), pero significativo de pérdida de neuronas TH+ de neuronas dopaminérgicas nigral (Figura 4A, B). Este resultado concuerda con observaciones anteriores utilizando este modelo41 y es probablemente la consecuencia de un bajo nivel de neuroinflamación inducida por la administración de vectores AAV en el SN. Sin embargo, el grado de pérdida de neuronas TH+ fue significativamente mayor en ratones que recibieron AAV5-hαSyn en comparación con aquellos que recibieron la misma dosis de AAV-GFP (Figura 4C). Cabe destacar que la cinética de la expresión de hαSyn no solo depende de la eficiencia de la transducción, sino también de la extensión de la difusión de AAV39. Dado que la difusión de AAV depende del serotipo AAV, los puntos de tiempo clave precisos en este modelo animal pueden variar cuando se utiliza otro serotipo AAV diferente de AAV5.
Posteriormente, se realizó un análisis cinético utilizando 1 x 1010 genomas virales por ratón para determinar los puntos de tiempo clave en este modelo de ratón. Dado que la evidencia actual ha mostrado algunos síntomas tempranos que aparecen antes del deterioro motor, lo que permitiría el diagnóstico precoz de la enfermedad de Parkinson 43,44, estos experimentos buscaron encontrar el punto de tiempo en el que la expresión de hαSyn ya era evidente pero en ausencia de deterioro motor. Los resultados muestran que el inicio de la expresión de hαSyn en el SN fue a las 5 semanas después de la administración estereotáxica de AAV-hαSyn (Figura 6). Este punto temporal constituye un punto temporal interesante para comenzar a administrar terapias adaptadas para detener los procesos neuroinflamatorios y neurodegenerativos. Otros puntos de tiempo clave determinados aquí fueron los momentos pico para dos eventos críticos asociados con el proceso de neuroinflamación: el momento en que la microglía alcanza el grado máximo de activación y el tiempo de infiltración máxima de células T en el SN. Los resultados mostraron una curva con tendencia que alcanza dos ondas de activación microglial máxima, la primera a las 10 semanas después de la cirugía y la segunda a las 15 semanas después de la cirugía (Figura 7). El análisis cinético de la infiltración de células T mostró el momento pico de infiltración de Treg en el SN a las 11 semanas después de la cirugía estereotáxica (Figura 8). Sorprendentemente, no se detectaron células T efectoras (CD4+ Foxp3-) infiltrándose en el SN durante el período de tiempo analizado (semanas 8-13 después de la cirugía). En conjunto, estos resultados sugieren un marco de tiempo adecuado para comenzar a administrar terapias orientadas a detener el proceso de neuroinflamación y atenuar la infiltración de células T en el SN utilizando este modelo preclínico, que oscila entre la semana 5 después de la cirugía (el inicio de la sobreexpresión de hαSyn) y la semana 10 después de la cirugía (la primera ola de neuroinflamación e infiltración de células T) (Figura 9).
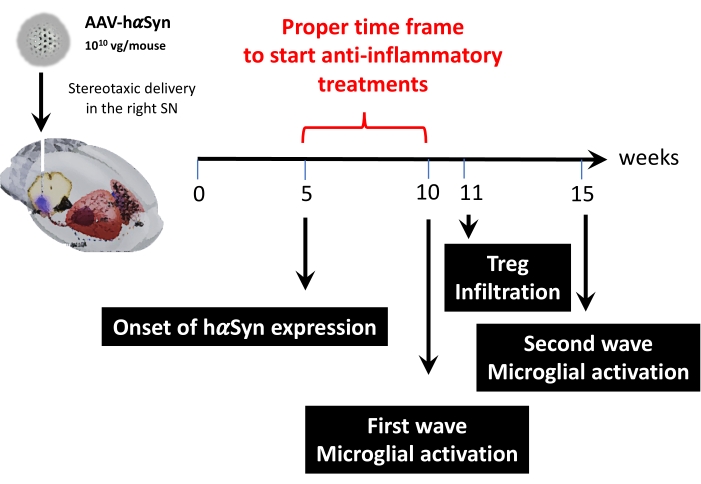
Figura 9: Resumen de los puntos de tiempo clave encontrados para este modelo animal. Haga clic aquí para ver una versión más grande de esta figura.
Divulgaciones
Los autores declaran que la investigación se llevó a cabo en ausencia de intereses financieros o no financieros en competencia.
Agradecimientos
Agradecemos al Dr. Sebastián Valenzuela y a la Dra. Micaela Ricca por su valiosa asistencia veterinaria en nuestra instalación animal. Este trabajo fue apoyado por "Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID" Centro Ciencia & Vida, FB210008 (a Fundación Ciencia & Vida), y el Geroscience Center for Brain Health and Metabolism, FONDAP-15150012. Este trabajo también fue financiado por las subvenciones FONDECYT-1210013 (a R.P.) y FONDECYT-1150766 (a F.C.) de la Agencia Nacional de Investigación y Desarrollo de Chile (ANID)" y MJFF-10332.01 (a R.P.) y MJFF-17303 (a F.C.) de la Fundación Michael J Fox para la Investigación del Parkinson.
Materiales
| Name | Company | Catalog Number | Comments |
| ANIMALS AND ANIMAL FOOD | |||
| Foxp3-GFP C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 023800 | |
| Laboratory Rodent Diet | LabDiet | Rodent Diet 5001 | Standard Rodent diet |
| Wild-type C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 000664 | |
| VIRAL VECTORS | |||
| AAV5-CBA-αSyn | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 10E13 vg/mL |
| AAV5-CBA-eGFP | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 9.5 x 10E12 vg/mL |
| ANESTHETICS AND ANALGESICS | |||
| Isoflurane | Baxter | 218082 | 1% for stereotaxic surgery |
| Ketamine | Drag Pharma | CHE30 | 70 mg/Kg for stereotaxic surgery |
| Sevoflurane | Baxter | VE2L9117 | For before transcardial perfusion |
| Tramadol | Drag Pharma | DPH134 | 30 mg/Kg every 24 h |
| Xylazine | Centrovet | EHL40 | 9 mg/kg for stereotaxic surgery |
| EQUIPMENT | |||
| Beam test | Home made | N/A | horizontal beam 25 cm length and 3 cm width. The beam surface was covered by a metallic grid (1 cm2). |
| Cryostate | Leica | CM1520 | |
| Digital camera | Nikon | S2800 Coolpix | For recording the beam test performance |
| Microscope | Olympus | BX51 | Used for IHC analysis (section 4.4) |
| Microscope | Olympus | IX71 | Used for IF analysis (section 5.3) |
| Microscope | Leica | DMI8 | Used for IF analysis (section 5.7) |
| New Standard Stereotaxic, mouse | Stoelting, Wood Dale, IL, USA | 51500 | stereotaxic frame for surgery |
| Peristaltic Pump | Masterflex | C-flex L/S16 | |
| Power supply unit | Olympus | U-RFL-T | Used for IF analysis (section 5.3) |
| Surgical suture | Sylkam®, B Braun | C0760171 | |
| Syringe 100 U | BD | 324918 | For anesthesia before transcardial perfusion, 29G needle |
| Syringe RN 5uL SYR W/O NEEDLE | Hamilton | HA-7641-01 | For viral vector innoculation |
| BUFFERS AND REAGENTS | |||
| Aviden, Peroxidase Conjugate | Merck, Darmstadt, Germany | 189728 | |
| Bovine Serum Albumin | Merck, Darmstadt, Germany | 9048-46-8 | |
| Cryotrotection buffer | Home made | N/A | 20% glycerine and 2% DMSO in PBS |
| DAPI | Abcam | ab228549 | |
| Diaminobenzidine | Merck, Darmstadt, Germany | D8001 | |
| Fluoromount -G T | Electron Microscopy Science | 17984-25 | |
| Gelatin | Merck, Darmstadt, Germany | 104078 | |
| Normal goat serum | Jackson ImmunoResearch Laboratory | 5000121 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 104005 | |
| PBS | Home made | N/A | 0.125 M, pH 7.4 |
| Peroxidase inactivating buffer | Home made | N/A | 0.03% H2O2 in methanol |
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| Trizma Hydrochloride | Merck, Darmstadt, Germany | 1185-53-1 | |
| Tween 20 | Sigma-Aldrich | 822184 | |
| ANTIBODIES | |||
| Biotin-SP (long spacer) AffiniPure Goat Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch Laboratory | 111065003 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11010 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 647 | ThermoFisher Scientific | A21244 | |
| Goat anti-Rat IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11081 | |
| Rabbit monoclonal anti-alpha-Synuclein | Abcam | ab138501 | |
| Rabbit monoclonal anti-Iba-1 | Abcam | EPR16588 | |
| Rabbit polyclonal anti-Tyrosine Hydroxylase | Millipore | AB152 | |
| Rat monoclonal anti-CD4 | Biolegend | 100402 | |
| SOFTWARES | |||
| GraphPad | Prism | 6.0 | Fos stats analysis |
| ImageJ | National Institute of Health | N/A | For image analysis |
| LAS X | Leica | N/A | For image capture with Leica microscope |
| ProgRes Capture Pro | Jenoptik | N/A | For image capture with Olympus microscope |
| VLC media player | VideoLAN Organization | N/A | For analysis of behavioural tests |
Referencias
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiology of Aging. 24 (2), 197-211 (2003).
- Lim, K. L., Zhang, C. W. Molecular events underlying Parkinson's disease - An interwoven tapestry. Frontiers in Neurology. 4, 33 (2013).
- Abdelmotilib, H., et al. α-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Mori, F., et al. Relationship among alpha-synuclein accumulation, dopamine synthesis, and neurodegeneration in Parkinson disease substantia nigra. The Journal of Neuropathology & Experimental Neurology. 65 (8), 808-815 (2006).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson's disease. Biochimica et Biophysica Acta. 1802 (1), 29-44 (2010).
- Vazquez-Velez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44, 87-108 (2021).
- Dehay, B., et al. Lysosomal impairment in Parkinson's disease. Movement Disorders. 28 (6), 725-732 (2013).
- Gonzalez, H., Elgueta, D., Montoya, A., Pacheco, R. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases. Journal of Neuroimmunology. 274 (1-2), 1-13 (2014).
- Pacheco, R. T-cell based immunotherapies for Parkinson's disease. Exploration of Neuroprotective Therapy. 1 (2), 72-85 (2021).
- Gonzalez, H., Contreras, F., Pacheco, R. Regulation of the neurodegenerative process associated to Parkinson's disease by CD4+ T-cells. Journal of Neuroimmune Pharmacology. 10 (4), 561-575 (2015).
- Gonzalez, H., Pacheco, R. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases. Journal of Neuroinflammation. 11 (1), 201 (2014).
- Campos-Acuna, J., Elgueta, D., Pacheco, R. T-cell-driven inflammation as a mediator of the gut-brain axis involved in Parkinson's disease. Frontiers in Immunology. 10, 239 (2019).
- Blesa, J., Phani, S., Jackson-Lewis, V., Przedborski, S. Classic and new animal models of Parkinson's disease. Journal of Biomedicine and Biotechnology. 2012, 845618 (2012).
- Ulusoy, A., Decressac, M., Kirik, D., Bjorklund, A. Viral vector-mediated overexpression of alpha-synuclein as a progressive model of Parkinson's disease. Progress in Brain Research. 184, 89-111 (2010).
- Gomez-Benito, M., et al. Modeling Parkinson's disease with the alpha-synuclein protein. Frontiers in Pharmacology. 11, 356 (2020).
- Song, L. K., et al. Targeted overexpression of alpha-synuclein by rAAV2/1 vectors induces progressive nigrostriatal degeneration and increases vulnerability to MPTP in mouse. PLoS One. 10 (6), 0131281 (2015).
- Theodore, S., Cao, S., McLean, P. J., Standaert, D. G. Targeted overexpression of human alpha-synuclein triggers microglial activation and an adaptive immune response in a mouse model of Parkinson disease. Journal of Neuropathology and Experimental Neurology. 67 (12), 1149-1158 (2008).
- Sanchez-Guajardo, V., Annibali, A., Jensen, P. H., Romero-Ramos, M. alpha-Synuclein vaccination prevents the accumulation of parkinson disease-like pathologic inclusions in striatum in association with regulatory T cell recruitment in a rat model. Journal of Neuropathology and Experimental Neurology. 72 (7), 624-645 (2013).
- Sanchez-Guajardo, V., Febbraro, F., Kirik, D., Romero-Ramos, M. Microglia acquire distinct activation profiles depending on the degree of alpha-synuclein neuropathology in a rAAV based model of Parkinson's disease. PLoS One. 5 (1), 8784 (2010).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular Neurodegeneration. 8, 44 (2013).
- Cho, C., et al. Evaluating analgesic efficacy and administration route following craniotomy in mice using the grimace scale. Scientific Reports. 9 (1), 359 (2019).
- Flecknell, P. . Laboratory Animal Anaesthesia. 3rd Ed. , (2009).
- Bind, R. H., Minney, S. M., Rosenfeld, S., Hallock, R. M. The role of pheromonal responses in rodent behavior: Future directions for the development of laboratory protocols. Journal of the American Association for Laboratory Animal Science. 52 (2), 124-129 (2013).
- Paxinos, G., Franklin, K. B. J. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Elgueta, D., et al. Dopamine receptor D3 expression is altered in CD4+ T-cells from Parkinson's disease patients and its pharmacologic inhibition attenuates the motor impairment in a mouse model. Frontiers in Immunology. 10, 981 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Fernandez-Suarez, D., et al. The monoacylglycerol lipase inhibitor JZL184 is neuroprotective and alters glial cell phenotype in the chronic MPTP mouse model. Neurobiology of Aging. 35 (11), 2603-2616 (2014).
- Elgueta, D., et al. Pharmacologic antagonism of dopamine receptor D3 attenuates neurodegeneration and motor impairment in a mouse model of Parkinson's disease. Neuropharmacology. 113, 110-123 (2017).
- Montoya, A., et al. Dopamine receptor D3 signalling in astrocytes promotes neuroinflammation. Journal of Neuroinflammation. 16 (1), 258 (2019).
- Williams, G. P., et al. Targeting of the class II transactivator attenuates inflammation and neurodegeneration in an alpha-synuclein model of Parkinson's disease. Journal of Neuroinflammation. 15 (1), 244 (2018).
- Benskey, M. J., et al. Silencing alpha synuclein in mature nigral neurons results in rapid neuroinflammation and subsequent toxicity. Frontiers in Molecular Neuroscience. 11, 36 (2018).
- Rieker, C., et al. Neuropathology in mice expressing mouse alpha-synuclein. PLoS One. 6 (9), 24834 (2011).
- Harms, A. S., et al. alpha-Synuclein fibrils recruit peripheral immune cells in the rat brain prior to neurodegeneration. Acta Neuropathologica Communications. 5 (1), 85 (2017).
- Williams, G. P., et al. CD4 T cells mediate brain inflammation and neurodegeneration in a mouse model of Parkinson disease. Brain. 144 (7), 2047-2059 (2021).
- Matheoud, D., et al. Intestinal infection triggers Parkinson's disease-like symptoms in Pink1(-/-) mice. Nature. 571 (7766), 565-569 (2019).
- Jan, A., Goncalves, N. P., Vaegter, C. B., Jensen, P. H., Ferreira, N. The prion-like spreading of alpha-synuclein in Parkinson's disease: Update on models and hypotheses. International Journal of Molecular Sciences. 22 (15), 8338 (2021).
- Chesselet, M. F., et al. A progressive mouse model of Parkinson's disease: The Thy1-aSyn ("Line 61") mice. Neurotherapeutics. 9 (2), 297-314 (2012).
- Sampson, T. R., et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease. Cell. 167 (6), 1469-1480 (2016).
- Ciron, C., et al. Human alpha-iduronidase gene transfer mediated by adeno-associated virus types 1, 2, and 5 in the brain of nonhuman primates: Vector diffusion and biodistribution. Human Gene Therapy. 20 (4), 350-360 (2009).
- Ben-Shaanan, T. L., et al. Activation of the reward system boosts innate and adaptive immunity. Nature Medicine. 22 (8), 940-944 (2016).
- Albert, K., Voutilainen, M. H., Domanskyi, A., Airavaara, M. AAV vector-mediated gene delivery to substantia nigra dopamine neurons: Implications for gene therapy and disease models. Genes. 8 (2), 63 (2017).
- Bordia, T., Perez, X. A., Heiss, J., Zhang, D., Quik, M. Optogenetic activation of striatal cholinergic interneurons regulates L-dopa-induced dyskinesias. Neurobiology of Disease. 91, 47-58 (2016).
- Kim, A., et al. Upgraded methodology for the development of early diagnosis of Parkinson's disease based on searching blood markers in patients and experimental models. Molecular Neurobiology. 56 (5), 3437-3450 (2018).
- Lei, H., et al. Parkinson's disease diagnosis via joint learning from multiple modalities and relations. IEEE Journal of Biomedical and Health Informatics. 23 (4), 1437-1449 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados