Method Article
Анализ мышиной модели болезни Паркинсона, индуцированной аденоассоциированными вирусными векторами, кодирующими α-синуклеин человека
В этой статье
Резюме
В этой работе анализируется векторная доза и время воздействия, необходимые для индуцирования нейровоспаления, нейродегенерации и двигательных нарушений в этой доклинической модели болезни Паркинсона. Эти векторы, кодирующие α-синуклеин человека, доставляются в черную субстанцию для повторения синуклеиновой патологии, связанной с болезнью Паркинсона.
Аннотация
Болезнь Паркинсона – это нейродегенеративное расстройство, которое предполагает гибель дофаминергических нейронов нигростриатального пути и, как следствие, прогрессирующую потерю контроля над произвольными движениями. Этот нейродегенеративный процесс запускается отложением белковых агрегатов в головном мозге, которые в основном состоят из α-синуклеина. Несколько исследований показали, что нейровоспаление требуется для развития нейродегенерации, связанной с болезнью Паркинсона. Примечательно, что нейровоспалительный процесс включает в себя активацию микроглии, а также инфильтрацию периферических Т-клеток в черную субстанцию (SN). В этой работе анализируется мышиная модель болезни Паркинсона, которая рекапитулирует активацию микроглии, инфильтрацию Т-клеток в SN, нейродегенерацию нигральных дофаминергических нейронов и двигательные нарушения. Эта мышиная модель болезни Паркинсона индуцируется стереотаксической доставкой аденоассоциированных вирусных векторов, кодирующих α-синуклеин дикого типа человека (AAV-hαSyn) в SN. Правильная доставка вирусных векторов в SN была подтверждена с помощью контрольных векторов, кодирующих зеленый флуоресцентный белок (GFP). После этого оценивалось, как доза AAV-hαSyn, вводимая в SN, влияла на степень экспрессии hαSyn, потерю нигральных дофаминергических нейронов и двигательные нарушения. Кроме того, динамика экспрессии hαSyn, активации микроглии и инфильтрации Т-клеток определялась на протяжении всего времени развития заболевания. Таким образом, это исследование предоставляет критические временные точки, которые могут быть полезны для нацеливания на синуклеиновую патологию и нейровоспаление в этой доклинической модели болезни Паркинсона.
Введение
После болезни Альцгеймера болезнь Паркинсона является вторым наиболее распространенным нейродегенеративным заболеванием во всем мире. Первичными нейронами, пораженными при болезни Паркинсона, являются нейроны нигростриатального пути, которые производят дофамин и контролируют произвольное движение. Как следствие, наиболее характерным симптомом, связанным с этим расстройством, является двигательное нарушение. Эта патология также включает в себя отложение белковых агрегатов в головном мозге, которые состоят в основном из α-синуклеина (αSyn)1, цитозольного белка, связанного с пресинаптическими терминалями. Данные показали, что генерация патогенных включений αSyn вызвана неправильным сворачиванием или некоторыми посттрансляционными модификациями этого белка2.
Примечательно, что была установлена тесная связь между патологией αSyn и потерей дофаминергических нейронов нигростриатального пути при болезни Паркинсона человека и животных моделях 3,4. Понимание того, как генерируются агрегаты αSyn и как они вызывают гибель нейронов, представляет собой значительную проблему в этой области. Растущая группа исследований показала, что, увеличивая окислительный стресс, митохондриальная дисфункция является одной из ведущих причин генерации агрегатов αSyn2. Действительно, несколько генов, связанных с риском болезни Паркинсона, кодируют белки, участвующие в митохондриальной функции, морфологии и динамике 5,6. Кроме того, лизосомальная дисфункция, которая приводит к накоплению дисфункциональных митохондрий и неправильно свернутых αSyn, представляет собой еще одно крупное событие, способствующее генерации агрегатов αSyn7.
Новые данные показали, что, как только агрегаты αSyn депонируются в мозге, эти патогенные белки стимулируют толл-подобные рецепторы (TLR) на микроглии, тем самым вызывая активацию микроглии и начальную воспалительную среду в черной субстанции (SN)8,9. Кроме того, данные указывают на то, что агрегаты αSyn захватываются и представляются антигенпрезентирующими клетками т-клеткам, вызывая адаптивный иммунный ответ, специфичный для αSyn10,11. Эти αСин-специфические Т-клетки впоследствии проникают в мозг и рестимулируются активированной микроглией, тем самым способствуя секреции нейротоксических факторов, которые вызывают гибель нейронов 9,10. Интересно, что несколько линий доказательств предполагают, что агрегаты αSyn генерируются сначала в кишечной нервной системе, а затем транспортируются через блуждающий нерв к стволу мозга12.
В течение многих лет использовалось несколько животных моделей болезни Паркинсона, в том числе те, которые индуцировались введением нейротоксических веществ (т.е. 6-гидроксидофамин, паракват, ротенон, 1-метил-4-фенил-1,2,3,6-тетрагидропиридин) и те, которые связаны с генетическими условиями (т.е. мутантная α-синуклеин, мутантная лейцин-богатая повторная киназа 2)13 . Несмотря на модели, включающие нейротоксин-индуцированную нейродегенерацию, воспроизводящую некоторые аспекты болезни Паркинсона, ни одна из них не повторяет все существенные аспекты заболевания или не прогрессирует13. С другой стороны, хотя генетические мышиные модели, включающие экспрессию мутантных версий богатой лейцином повторной киназы 2, мутантные версии α-синуклеина или сверхэкспрессию человеческих α-синуклеина дикого типа, приводят к двигательным нарушениям, а в некоторых случаях также к развитию синуклеинопатии, они не воспроизводят заметную нейродегенерацию нигральных дофаминергических нейронов, что является существенным аспектом болезни Паркинсона13, 14. Третий вид животной модели нейродегенерации сумел удовлетворить большинство существенных аспектов болезни Паркинсона, стереотаксическую доставку аденоассоциированных вирусных векторов (AAV), кодирующих человеческий α-синуклеин (AAV-hαSyn)14,15. Важно отметить, что AAV позволяют трансдукцию нейронов с высокой эффективностью и в долгосрочной перспективе в мозг взрослых млекопитающих. Кроме того, было показано, что стереотаксическая доставка AAV-hαSyn в SN воспроизводит многие из основных аспектов заболевания, включая патологию αSyn, активацию микроглии, нейродегенерацию и двигательные нарушения 16,17,18,19,20. В этом исследовании представлен анализ того, как доза вирусного вектора и время после доставки вирусного вектора влияют на степень экспрессии hαSyn, нейродегенерации и нейровоспаления в нигростриатальном пути, а также на степень двигательных нарушений в мышиной модели односторонней стереотаксической доставки hαSyn в SN.
протокол
Все исследования проводились в рамках 8-го издания Руководства по уходу за лабораторными животными и их использованию. Экспериментальные протоколы были одобрены IACUC в Fundación Ciencia & Vida (Science for Life Foundation), в том числе те, которые включают анестезию, боль, дистресс и эвтаназию (номер разрешения P-035/2022).
1. Стереотаксическая хирургия
- Подготовка к операции (примерно 1 ч)
- Чтобы поддерживать асептическую среду, носите соответствующую хирургическую одежду в течение всей операции, включая бахилы, хирургическую маску, гигиенический барьер, перчатки и хирургический колпачок.
- Распылите 70% этанола на мышь и весь хирургический материал для поддержания асептической среды.
- Чтобы вызвать анальгезию, вводите мышам карпрофен 5 мг/кг подкожно (s.c.) каждые 12 ч21 , начиная с 1 ч до операции и продолжая до 3 дней после операции.
- Чтобы обезболить мышь, поместите животное в индукционную камеру. Откройте поток изофлурана со скоростью 0,5%, а затем медленно увеличивайте его до 5% в течение примерно 5 мин, пока мышь не потеряет свой корректирующий рефлекс22.
- Извлеките животное из индукционной камеры. Немедленно переведите животное в недыхаемый контур с носовым конусом соответствующего размера. Поддерживайте мышиную анестезию изофлураном 1% на протяжении всего времени операции.
- Убедитесь, что мышь полностью обезболена, зажав хвост и лапы. Когда мышь не реагирует на ущемление хвоста и лап, это означает, что мышь полностью обезболена.
- Побрить голову мыши ножницами. Очистите кожу мыши ватным тампоном с хлоргексидином 2% и удалите все волосы.
- Зафиксируйте головку мыши в стереотаксической рамке.
- Поместите защитное средство от роговицы в оба глаза мыши с помощью ватного тампона. Чтобы предотвратить индукцию стресса у других грызунов, избегайте присутствия любой другой мыши в операционной комнате23.
- Операция (приблизительно 30 мин)
- Очистите голову мыши тремя раундами 2% хлоргексидина с последующим 70% этанолом. Обнажите череп с помощью хирургического материала и сделайте тонкое отверстие с помощью сверла в следующих координатах: переднезадняя −2,8 мм, и медиолатеральная 1,4 мм по отношению к медиальной линии.
- Поместите иглу шприца объемом 10 мкл в отверстие и медленно перемещайте иглу внутрь мозга до достижения −7,2 мм дорсовентрального отверстия по отношению к твердой мозговой оболочке24.
- Оставьте иглу в конечном положении на 2 мин, чтобы ткань немного осела, а затем введите 1 мкл AAV5-CBA-hαSyn (AAV-hαSyn), AAV5-CBA-eGFP (AAV-GFP) или транспортное средство (PBS при рН 7,4; фиктивная хирургия) в правую черную субстанцию со скоростью 0,2 мкл /30 с.
- Оставьте иглу в том же положении в течение 5 минут после доставки вирусных векторов, а затем медленно вынимайте ее.
- После операции (приблизительно 5 мин)
- Закройте рану стерильным шелковым нерассасывающимся швом.
- Поместите мышь в домашнюю клетку предварительно расплавленной, положив ее на матрас с электрическим подогревом (25 °C).
ПРИМЕЧАНИЕ: Мышь должна содержаться в одиночестве в домашней клетке до тех пор, пока она не сможет ходить без труда и рана не заживет.
2. Определение производительности двигателя с помощью испытания луча
- Тренировка (примерно 15 минут на мышь)
- Через двенадцать недель после стереотаксической операции оцените двигательные характеристики, используя упрощенную версию лучевого теста, описанного до25. Для этого используют горизонтальную балку длиной 25 см и шириной 3 см. Поверхность балки должна быть покрыта металлической сеткой с квадратами 1 см и приподнята на 1 см над балкой.
- Снимите видео мыши, пересекающей луч поверхности сетки от одного конца до противоположного конца луча, где расположена домашняя клетка. Тренируйте мышь в течение 2 дней до определения двигательных характеристик.
- В первый день научите мышь проходить через луч пять раз без сетки.
- На второй день приучите мышь ходить по лучу в присутствии сетки пять раз.
- Тест (примерно 5 минут на мышь)
- На третий день оцените работоспособность двигателя. Для этого количественно оцените количество ошибок, выполняемых левыми лапами или правыми лапами отдельно, просматривая видео в замедленном режиме.
ПРИМЕЧАНИЕ: Ошибка определяется как случай, когда лапа неправильно наступает на сетку и, следовательно, становится видимой на стороне сетки или между сеткой и поверхностью луча.
- На третий день оцените работоспособность двигателя. Для этого количественно оцените количество ошибок, выполняемых левыми лапами или правыми лапами отдельно, просматривая видео в замедленном режиме.
3. Обработка тканей
- Транскардиальная перфузия (приблизительно 15 мин на мышь)
- Чтобы обезболить мышь, вводят смесь кетамина (80 мг/кг) и ксилазина (10 мг/кг) внутрибрюшинно (т..) с использованием шприца 1 мл и иглы26 г.
- После того, как мышь будет полностью обезболена (подтверждено, как на шаге 1.1.6.), откройте грудную клетку хирургическим материалом и обнажите сердце.
- Затем вставьте иглу весом 21 г (сделайте наконечник плоским с помощью дрели) в левый желудочек сердца.
- Соединив иглу с трубой, перфьюируйте 50 мл PBS (pH 7,4) со скоростью 9,5 мл / мин с помощью перистальтического насоса.
- Фиксация и криозащита мозга (примерно 10 минут на мозг)
- Удаляют мозг ножницами и пинцетом, а затем фиксируют его погружением в 5 мл 4% параформальдегида в PBS (рН 7,4) при 4 °C в течение 24 ч.
- После этого поместите фиксированный мозг в 15 мл 30% сахарозы при 4 °C в течение 48 ч.
- Затем поместите мозг в 4 мл криопротекторного раствора (20% глицерина и 2% ДМСО в PBS) и сохраните мозг при -80 ° C или используйте его сразу на следующем этапе.
- Получение срезов мозга (примерно 20 мин на мозг).
ПРИМЕЧАНИЕ: Убедитесь, что мозг помещен в криостат в правильном положении, чтобы сделать корональные разрезы.- Чтобы получить срезы SN, разрежьте мозг на участки толщиной 40 мкм, начиная с −2,92 мм и заканчивая −3,64 мм24.
- Соберите каждый ломтик в лунке (содержащей 1 мл криопротекторного раствора) 24-луночной пластины в переднезаднем порядке, как описано выше 25,27,28.
- Для выполнения иммуногистохимического (раздел 4.) и иммунофлуоресцентного анализа (раздел 5.) в SN выберите шесть корональных срезов SN, взятых с равномерными интервалами (120 мкм), которые охватывают всю рострокодальную протяженность ядра (всего 720 мкм), как описано выше 25,27,28.
- Для получения стриатальных срезов разрежьте мозг на участки толщиной 40 мкм, начиная с +1,34 мм и заканчивая −0,26 мм24.
- Соберите каждый ломтик в криотрубу объемом 2 мл (содержащую 1 мл криопротекторного раствора) в переднезаднем порядке.
- Для проведения иммуногистохимического (раздел 4.) и иммунофлуоресцентного анализа (раздел 5.) в полосатом теле выбирают пять корональных полосатых срезов, взятых с равными интервалами (320 мкм), которые охватывают всю рострокодальную протяженность ядра (всего 1600 мкм).
4. Иммуногистохимический анализ для количественной оценки дофаминергических нейронов и микроглиоза (приблизительно 2 дня)
- Для иммуногистохимического анализа стриатальных или нигральных срезов поместите набор из пяти (полосатое тело) или шести (SN) ломтиков из одного и того же мозга в одну лунку из 24-луночной пластины.
- Промыть участки 3x 1 мл PBS и затем инкубировать с 0,5 мл 0,03% H2O 2в метаноле при комнатной температуре и с перемешиванием в течение 30 мин для инактивации эндогенной пероксидазной активности.
- Промыть секции 3x 1 мл PBS и инкубировать с 0,5 мл блокирующего раствора (4% козьей сыворотки, 0,05% Triton X-100 и 4% BSA в PBS) при комнатной температуре и с перемешиванием в течение 40 мин.
- После этого инкубируют с 0,5 мл блокирующего раствора, содержащего первичное антитело (антитирозингидроксилаза кролика [TH] pAb, разбавленное 1:1000 [см. Таблицу 1]; или антитело против Iba1 кролика, разбавленное 1:1000) при комнатной температуре и с перемешиванием в течение ночи.
- Промыть участки 3x 1 мл PBS и инкубировать с 0,5 мл блокирующего раствора, содержащего биотинилированный козий анти-кролик pAb (1:500, см. Таблицу 1) при комнатной температуре и с перемешиванием в течение 2 ч.
- Затем промыть участки 3х 1 мл ПБС и инкубировать с 0,5 мл пероксидазно-конъюгированного авидина (1:5000, см. табл. 1) в блокирующем растворе при комнатной температуре и с перемешиванием в течение 90 мин.
- Промыть секции 3x 1 мл PBS и инкубировать с 0,5 мл субстратного раствора (0,05% диаминобензидина в 0,03% H2O2/Trizma-HCl буфер при рН 7,6). Наденьте перчатки и лабораторное пальто для этого шага, так как диаминобензидин является потенциальным канцерогеном.
- Когда специфическое окрашивание очевидно (обычно 30 сек для TH и 5 мин для Iba1), выньте раствор подложки и промыть секции 3x 1 мл PBS при комнатной температуре и с перемешиванием. Всегда проводите иммуноокрашивание срезов всех мозгов, включенных в один и тот же эксперимент одновременно.
ПРИМЕЧАНИЕ: Специфическое окрашивание TH проявляется, когда иммуноокрашание TH появляется в области SN, которая отображает характерную форму в мозге. Специфическая отметка Iba1 определяется при появлении иммуноокрашивания Iba1 на контрольных срезах мозга с типичными формами микроглии, которые подтверждаются при наблюдении под микроскопом. Таким образом, точное время экспозиции субстрата для анализа IHC определяется для каждого отдельного эксперимента. - Монтируйте участки мозга на стеклянные слайды с помощью раствора 0,2% желатина в 0,05 М Трис (рН 7,6). Поместите каждый набор из пяти (striatum) или шести (SN) срезов, полученных из одного и того же мозга, в рострокодальном порядке на один и тот же стеклянный слайд.
- Количественно оцените количество нейронов TH+ в SN.
- Чтобы количественно оценить нейроны TH+ в SN, получите фотографии шести срезов с 20-кратным увеличением с помощью микроскопа яркого поля, как описано ранее 25,27,28. Используйте следующую настройку цвета: цветовая температура 3200 К, голубо-красный 40%, пурпурно-зеленый 39%, желто-синий 54%, гамма 0,5, контрастность 37, яркость 13, насыщенность 5.
- С помощью программного обеспечения Image J выберите периметр SN pars compacta в анализируемом полушарии. Избегайте выбора нейронов TH+ из вентральной тегментальной области (VTA).
- После этого попросите программное обеспечение рассчитать выбранную площадь (обычно 0,04-0,07 мм2 / полусфера, в зависимости от рострокодального положения). Затем, используя многоточечный инструмент, пометьте каждый нейрон TH+ точкой.
- Используя инструмент «Точка», попросите программное обеспечение подсчитать общее количество точек. С количеством общих точек (нейронов TH+ ) и площадью SNpc рассчитайте плотность нейронов TH+ /мм2.
- Повторите одно и то же вычисление в обоих полушариях на шести срезах SN, а затем вычислите среднее значение нейронов TH+ /мм2 на ипсилатеральной и контралатеральной сторонах.
- Количественная оценка количества активированных микроглий в полосатом теле
- Чтобы количественно оценить активированную микроглию в полосатом теле, получите две фотографии в каждом полушарии для всех пяти стриатальных срезов при 20-кратном увеличении с помощью микроскопа яркого поля и тех же настроек, указанных на шаге 4.10.1. Используя программное обеспечение Image J, на каждой фотографии (отображающей площадь 660 мкм x 877 мкм) помечайте точкой каждую клетку, выражающую высокую интенсивность Iba1 и форму амебоида с помощью многоточечного инструмента. Используя инструмент «Точка», попросите программное обеспечение подсчитать общее количество точек.
- С количеством общих точек и площадью фотографии рассчитайте плотность активированной микроглии (Iba1высокие ячейки /мм2), как это было выполнено до29.
| Антиген-мишень | В сочетании с | Клональность | Хост-тип | Реакционная способность specie* | Разбавление** |
| Тирозингидроксилаза | Н/Д | Поликлональный | Кролик | Мышь, Крыса, Человек | 1/200 - 1/1000 |
| Иба1 | Н/Д | Моноклональный | Кролик | Мышь, Крыса, Человек | 1/1000 |
| альфа-синуклеин | Н/Д | Моноклональный | Кролик | Человеческий | 1/150 |
| СД4 | Н/Д | Моноклональный | Крыса | Мышь | 1/250 |
| IgG (H+L) | Биотинилированный | Поликлональный | Коза | Кролик | 1/500 |
| IgG (H+L) | АлексаФтор 546 | Поликлональный | Коза | Кролик | 1/500 |
| IgG (H+L) | АлексаФтор 647 | Поликлональный | Коза | Кролик | 1/500 |
| IgG (H+L) | АлексаФтор 546 | Поликлональный | Коза | Крыса | 1/500 |
Таблица 1: Разведение антителами. Н/Д, не применимо. *, Указывается только при наличии реактивности у мыши, крысы и человека, независимо от реактивности у других видов. **, Указывается однократное разбавление или диапазон разбавления.
5. Иммунофлуоресцентный анализ для оценки инфильтрации Т-клеток в нигростриатальном пути (приблизительно 2 дня)
- Для иммунофлуоресцентного анализа hαSyn или TH/GFP на стриатальных или нигральных срезах соберите набор из пяти (полосатого) или шести (SN) срезов из одного и того же мозга в одну лунку 24-луночной пластины.
- Промыть участки 3x 1 мл PBS, а затем инкубировать с 0,5 мл блокирующего раствора (0,3% Triton X-100, 0,05% tween20 и 5% BSA в PBS) при комнатной температуре и с перемешиванием в течение 40 мин.
- После этого инкубируют с 0,5 мл блокирующего раствора, содержащего первичное антитело (кролик анти-TH pAb разбавляют 1:500; или антитело против hαSyn кролика, разбавленное 1:150, см. Таблицу 1) при комнатной температуре и с перемешиванием в течение ночи.
- Промыть участки 3x 1 мл PBS и инкубировать с 0,5 мл блокирующего раствора, содержащего AlexaFluor546-связанное анти-кроликово вторичное антитело (1:500, см. Таблицу 1) и 4',6-диамидино-2-фенилиндол (DAPI; 1:1000) при комнатной температуре и с перемешиванием в течение 2 ч. Затем промыть секции 3x 1 мл PBS.
- Установите секции мозга на стеклянные слайды, как описано выше (шаг 4.9.). Изображения были получены с помощью инвертированного флуоресцентного микроскопа, соединенного с блоком питания.
- Для иммунофлуоресцентного анализа TH/CD4/GFP(Foxp3) на нигральных срезах поместите набор из шести (SN) срезов из одного и того же мозга в одну лунку 24-луночной пластины. Промыть участки 3x 1 мл PBS и затем инкубировать с 0,5 мл блокирующего раствора (0,5% Triton X-100, 0,5% желатина рыбьей кожи в PBS) при комнатной температуре и с перемешиванием в течение 2 ч.
- Инкубировать с 0,5 мл блокирующего раствора, содержащего первичные антитела кролика анти-TH pAb (1:200, см. Таблицу 1) и крысиного анти-CD4 (1:250) при 4 °C и с перемешиванием в течение ночи.
- Промыть секции 3x 1 мл PBS и инкубировать с 0,5 мл блокирующего раствора, содержащего анти-кролиководство, связанное с AlexaFluor 647 (1:500, см. Таблицу 1) и анти-крысиное соединение с AlexaFluor 546 (1:500) при комнатной температуре и с перемешиванием в течение 2 ч. Затем промыть секции 3x 1 мл PBS.
- Поместите каждый набор из шести (SN) срезов, полученных из одного и того же мозга в рострокаудальном порядке, на один и тот же стеклянный слайд и установите их с помощью Fluoromount G. Получайте изображения с помощью микроскопа Leica DMi8. Используйте настройки конфокального микроскопа, указанные в таблице 2 , для получения изображений из иммунофлуоресцентного анализа.
| Имя Шанель | Куб | Длина волн излучения | Имя таблицы подстановки | Время экспозиции | Прибыль | Разрешение XY | Резолюция Z |
| Канал 1 | Y5 | 700нм | Серый | 1 011,727 мс | высокая пропускная способность скважины | 2.237 мкм | 24.444 мкм |
| Канал 2 | ГФП | 525нм | Зеленый | 326,851 мс | высокая пропускная способность скважины | 2.237 мкм | 24.444 мкм |
| Канал 3 | ТХР | 630нм | Красный | 406,344 мс | высокая пропускная способность скважины | 2.237 мкм | 24.444 мкм |
| Канал 4 | Дапи | 460нм | Синий | 91,501 мс | высокая пропускная способность скважины | 2.237 мкм | 24.444 мкм |
Таблица 2: Настройки конфокального микроскопа, используемые для получения изображений из иммунофлуоресцентного анализа.
6. Статистический анализ
- Для сравнения данных, полученных с ипсилатеральной и контралатеральной сторон, используют парный двуххвостый t-тест Стьюдента.
- Чтобы сравнить данные, полученные от мышей, получавших AAV-hαSyn, и от мышей, получавших AAV-GFP или фиктивную операцию, используйте непарный двуххвостый t-тест Стьюдента. Учитывайте существенные различия, когда значения P < 0,05.
Результаты
Проверка правильной доставки векторов AAV в дофаминергических нейронах нигростриатального пути
Для изучения процессов нейровоспаления, нейродегенерации и двигательных нарушений, способствующих синуклеиновой патологии, была использована мышиная модель болезни Паркинсона, индуцированная односторонней стереотаксической доставкой AAV, кодирующей hαSyn в SN 16,17,30,31 (см. экспериментальный дизайн на дополнительном рисунке 1 ). Чтобы проверить правильную доставку векторов AAV в дофаминергические нейроны нигростриатального пути, в SN был введен AAV кодирующий GFP (AAV-GFP), а через 12 недель флуоресценция GFP и иммунореактивность тирозингидроксилазы (TH) были проанализированы в SN и полосатом теле иммунофлуоресценцией. Флуоресценция, связанная с GFP, наблюдалась исключительно на ипсилатеральной стороне, и наблюдалась значительная колокализация с иммунореактивностью TH как в SN, так и в полосатом теле, что указывает на правильную доставку векторов AAV в дофаминергические нейроны нигростриатального пути (рисунок 1).
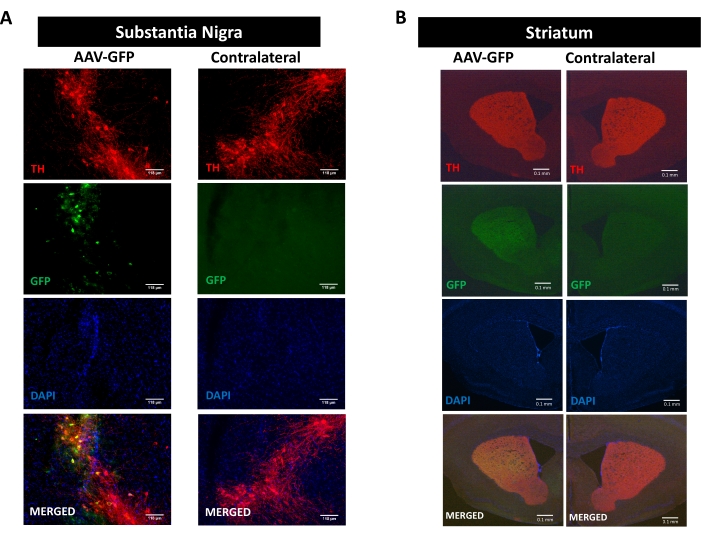
Рисунок 1: Анализ доставки AAV-GFP в нигростриатальном пути. Мыши получали AAV-GFP (1 x 1010 vg/мышь) и через 12 недель были принесены в жертву, а TH был иммуноокрашен в (A) SN (шкала 118 мкм) и (B) полосатом теле (шкала баров 100 мкм). Флуоресценция, связанная с TH и GFP, анализировалась с помощью эпифлуоресцентной микроскопии. Ядра окрашивали DAPI. Показаны репрезентативные изображения объединенного или одиночного окрашивания TH (красный), GFP (зеленый) и DAPI (синий). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Настройка дозы вирусного вектора, вводимого для индуцирования нейродегенерации и двигательных нарушений в мышиной модели болезни Паркинсона, индуцированной AAV-hαSyn
Чтобы проверить дозу AAV-hαSyn, необходимую для индуцирования значительной гиперэкспрессии hαSyn, которая способствует нейродегенерации нигральных дофаминергических нейронов, были введены различные дозы (1 x 108 вирусных геномов [vg] / мышь, 1 x 109 vg / мышь или 1 x10 10 vg / мышь) AAV-hαSyn, а через 12 недель иммунореактивность hαSyn и степень иммунореактивности TH были оценены в нигростриатальном пути. Хотя иммунореактивность hαSyn была очевидна со всеми дозами, протестированными в SN (рисунок 2), только мыши, получавшие 1 x 1010 vg / мышь, имели очевидную иммунореактивность hαSyn в полосатом теле (рисунок 3). Кроме того, мыши, получавшие 1 x 1010 vg/мышь AAV-hαSyn, демонстрировали значительную потерю дофаминергических нейронов в SN (рисунок 4A,B). Хотя мыши, получавшие 1 x 1010 vg/мышь AAV-GFP, демонстрировали низкую степень (~20%) потери нейронов (рисунок 4A,B), мыши, получавшие ту же дозу AAV-hαSyn, имели значительно более высокую степень нейродегенерации нигральных дофаминергических нейронов (рисунок 4C). Соответственно, дальнейшие эксперименты проводились с использованием 1 x 1010 vg/мышь AAV-hαSyn. Кроме того, степень двигательных нарушений определяли у мышей, получавших различные дозы AAV-hαSyn, с помощью лучевого теста (рисунок 5А), как описано ранее25. Значительное снижение производительности двигателя было обнаружено исключительно с помощью 1 x 1010 vg/мышь AAV-hαSyn в лучевом тесте как при сравнении количества ошибок, допущенных правой и левой подушками (рисунок 5B), так и при сравнении общего числа ошибок мышей, получавших AAV-hαSyn, по сравнению с мышами, получавшими контрольный вектор AAV-GFP (рисунок 5C). Соответственно, дальнейшие эксперименты проводились с использованием 1 x 1010 vg/мышь AAV-hαSyn.
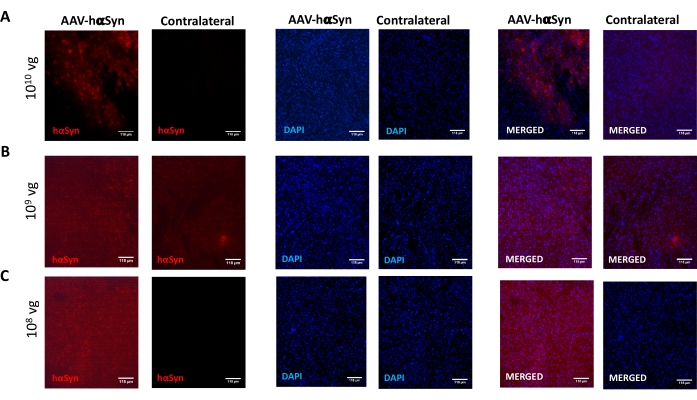
Рисунок 2: Анализ экспрессии человеческого α-синуклеина в SN мышей, получавших различные дозы AAV-hαSyn. Мыши получали AAV-hαSyn при (A) 1 x 1010 vg/мышь, (B) 1 x 109 vg/мышь или (C) 1 x 108 vg/мышь и через 12 недель приносили в жертву, а экспрессию hαSyn анализировали иммунофлуоресценцией в SN с использованием эпифлуоресцентной микроскопии. Ядра окрашивали DAPI. Показаны репрезентативные изображения объединенного или одиночного окрашивания hαSyn (красный) или DAPI (синий). Шкала 118 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
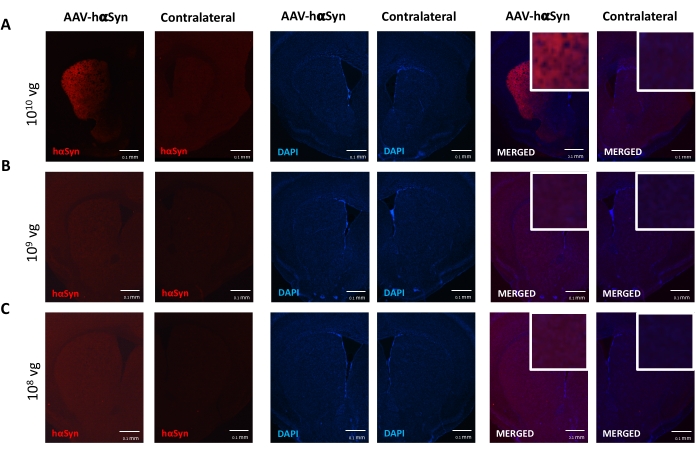
Рисунок 3: Анализ экспрессии человеческого α-синуклеина в полосатом теле мышей, получавших различные дозы AAV-hαSyn. Мыши получали AAV-hαSyn при (A) 1 x 1010 vg/мышь, (B) 1 x 109 vg/мышь или (C) 1 x 108 vg/мышь) и через 12 недель приносили в жертву, а экспрессию hαSyn анализировали иммунофлуоресценцией в полосатом теле с помощью эпифлуоресцентной микроскопии. Ядра окрашивали DAPI. Показаны репрезентативные изображения объединенного или одиночного окрашивания hαSyn (красный) или DAPI (синий). Шкала стержней составляет 100 мкм. Вставка в правом верхнем углу объединенных изображений показывает область интереса с более высоким увеличением. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
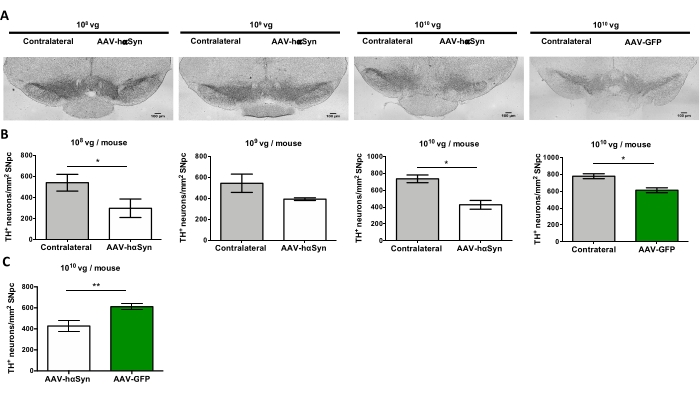
Рисунок 4: Потеря дофаминергических нейронов SN у мышей, получавших различные дозы AAV-hαSyn или контрольного вектора. Мыши получали AAV-hαSyn (1 x 1010 vg/мышь, 1 x 109 vg/мышь или 1 x 108 vg/мышь) или AAV-GFP (1 x 1010 vg/мышь) и через 12 недель приносили в жертву, а TH анализировали в SNpc методом иммуногистохимии. (A) Репрезентативные изображения. Шкала баров, 100 мкм. (B,C) Плотность нейронов была количественно определена как количество нейронов TH+/мм2. Данные представляют среднюю ± SEM. n = 3–8 мышей на группу. (B) Сравнение ипсилатерального с контралатеральными сторонами проводилось с использованием двуххвостого парного t-теста Стьюдента. (C) Было проведено сравнение ипсилатеральных сторон у мышей, получавших 1x 10 10 vg/мышь AAV-hαSyn или AAV-GFP. (В,С) В то время как белые полосы указывают на количественную оценку нейронов TH+ на ипсилатеральной стороне мышей, получающих AAV-hαSyn, зеленые полосы указывают на количественную оценку нейронов TH+ на ипсилатеральной стороне мышей, получающих AAV-GFP. Серые полосы указывают на количественную оценку нейронов TH+ на контралатеральной стороне соответствующей группы. Сравнения проводились с помощью двуххвостого непарного t-теста Student. *p < 0,05; **p < 0,01. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
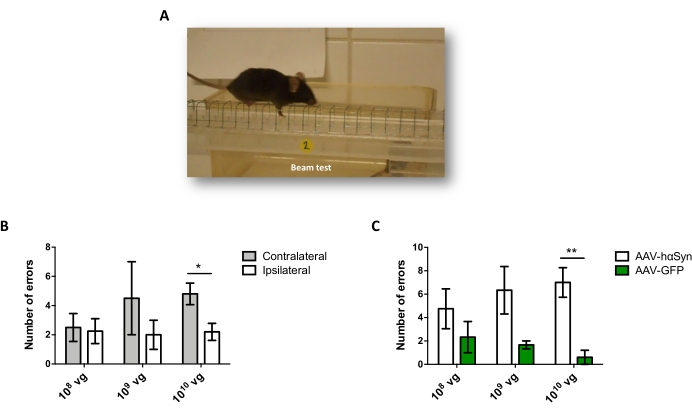
Рисунок 5: Анализ двигательных характеристик у мышей, получавших различные дозы AAV-hαSyn. Мыши получали различные дозы (1 x 1010 vg/мышь, 1 x 109 vg/мышь или 1 x 108 vg/мышь) AAV-hαSyn или AAV-GFP, а через 12 недель двигательные характеристики оценивались с помощью лучевого теста. (A) Изображение мыши, идущей по балке. (B) Количество ошибок, выполняемых левыми конечностями (контралатеральными) по сравнению с правыми конечностями (ипсилатеральными), было количественно определено в группах мышей, получавших AAV-hαSyn. (C) Общее количество ошибок сравнивалось между различными экспериментальными группами, получавшими одинаковую дозу AAV-hαSyn или AAV-GFP. Данные представляют среднюю ± SEM. n = 3–5 мышей на группу. Сравнения проводились с помощью (B) парного t-теста двуххвостого студента или (C) непарного t-теста двуххвостого студента. *p < 0,05; **p < 0,01. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Настройка кинетики модели болезни Паркинсона, индуцированной AAV-αSyn
После определения правильной дозы AAV-hαSyn, используемой для индуцирования значительного уровня нейродегенерации и двигательных нарушений, были проведены эксперименты по определению начала гиперэкспрессии hαSyn. Для этой цели мышей лечили 1 x 1010 vg/мышь AAV-hαSyn или фиктивной хирургией. Степень экспрессии hαSyn анализировали в SN один раз в неделю в течение 2-5 недель после стереотаксической хирургии (см. экспериментальный дизайн на дополнительном рисунке 2). Результаты показывают, что, несмотря на то, что экспрессия hαSyn была обнаружена на низких уровнях уже через 2 недели после операции, кластеры hαSyn появились на 5-й неделе после стереотаксической операции (рисунок 6).

Рисунок 6: Анализ временного хода экспрессии α-синуклеина человека в СН мышей, получавших AAV-hαSyn. Мыши получали AAV-hαSyn (1 x 1010 vg/мышь) или просто фиктивную стереотаксическую операцию, а экспрессию hαSyn в SN анализировали (A) через 2 недели, (B) 3 недели, (C) 4 недели или (D) через 5 недель иммунофлуоресценцией с использованием эпифлуоресцентной микроскопии. Ядра окрашивали DAPI. Показаны репрезентативные изображения объединенного или одиночного окрашивания hαSyn (красный) или DAPI (синий). Шкала стержней, 100 мкм. Вставка в правом верхнем углу объединенных изображений показывает область интереса с более высоким увеличением. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
После этого были проведены эксперименты по определению подходящих временных точек для анализа нейровоспаления и инфильтрации Т-клеток в центральной нервной системе (ЦНС) после стереотаксической доставки AAV-hαSyn. Чтобы определить пик активации микроглии после лечения мышей AAV-hαSyn, степень клеток, экспрессирующих высокий уровень Iba1 в полосатом теле, оценивали один раз в неделю в течение 2-15 недель после стереотаксической операции. Результаты показывают значительное увеличение активации микроглии ипсилатеральной стороны по сравнению с контралатеральной стороной мышей через 15 недель после лечения AAV-hαSyn (рисунок 7). Количество клеток Treg (CD4 + Foxp3+), инфильтрированных в SNpc, также оценивали в разные моменты времени после стереотаксической доставки AAV-hαSyn иммунофлуоресценцией после наблюдения конфокальной микроскопии. Результаты показывают, что пик инфильтрации Treg в SNpc был через 11 недель после операции, тогда как степень проникновения Treg в эту область мозга была ниже на 8-й неделе или 13-й неделе после операции (рисунок 8). Не было обнаружено CD4+ Т-клеток, проникающих в полосатое тело (данные не показаны). В целом, эти результаты показывают, что при использовании 1 x 1010 vg / мышь AAV-hαSyn наиболее подходящей точкой времени для анализа нейровоспаления является неделя 15 после стереотаксической операции, в то время как правильной временной точкой для анализа инфильтрации Т-клеток в ЦНС, по-видимому, является неделя 11 после лечения AAV-hαSyn.
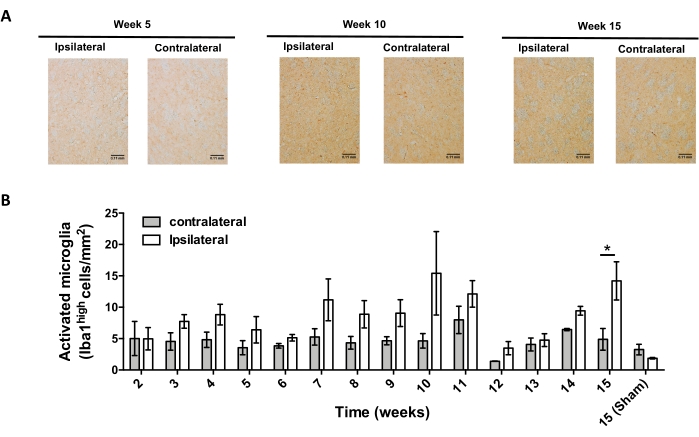
Рисунок 7: Анализ временного хода активации микроглии у мышей, инокулированных AAV-hαSyn. Мыши получали AAV-hαSyn (1 x 1010 vg/мышь), а активацию микроглии оценивали иммуногистохимическим анализом Iba1 в полосатом теле в разные моменты времени после операции. (A) Показаны репрезентативные обзорные изображения иммуногистохимического анализа Iba1 у мышей, принесенных в жертву через 5 недель, 10 недель или 15 недель после инокуляции AAV-hαSyn. Шкала баров, 110 мкм. (B) Плотность активированной микроглии была количественно определена как количество клеток, экспрессирующих высокие уровни Iba1 и амебоидной формы на площадь. Данные представляют среднюю ± SEM. n = 3 мыши на группу. Двуххвостый парный t-тест Стьюдента использовался для определения статистических различий между ипсилатеральным и контралатеральным Iba1 в каждой группе. *p < 0,05. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
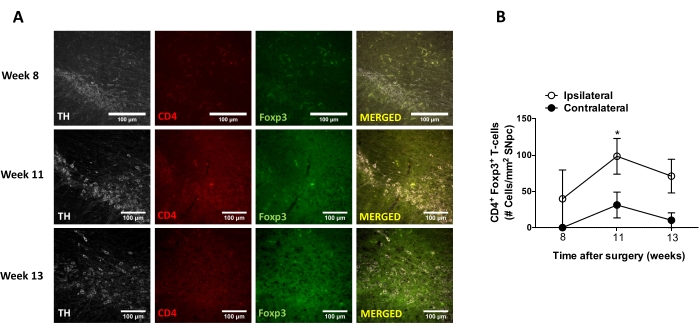
Рисунок 8: Анализ временного хода инфильтрации CD4+ Т-клеток в SN мышей, инокулированных AAV-hαSyn. Мыши-репортеры Foxp3gfp получили AAV-hαSyn (1 x 1010 vg/мышь). Наличие CD4+ Т-клеток, экспрессирующих Foxp3, и присутствие нейронов TH+ анализировали в разные моменты времени (неделя 8, неделя 11 и неделя 13 после операции) в SN путем иммунофлуоресценции. (A) Показаны репрезентативные изображения для одиночного иммуноокрашивания или слияния. Шкала баров, 100 мкм. (B) Количество CD4+ Foxp3+ Т-клеток на площадь в SN было количественно определено. Данные представляют среднюю ± SEM от 3 мышей в группе. *p<0,05, ипсилатеральные и контралатеральные CD4+ Foxp3+ Т-клетки с помощью двуххвостого т-теста Стьюдента. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Экспериментальный проект для оценки влияния различных доз векторов AAV на патологию синуклеина, нейродегенерацию и двигательные нарушения. Самцов мышей C57BL/6 дикого типа анестезировали и получали стереотаксическую инокуляцию различных доз (1 x10 10 vg/мышь, 1 x 109 vg/мышь или 1 x 108 vg/мышь) AAV, кодирующего человеческий α-синуклеин (AAV-hαSyn) или eGFP (AAV-GFP) под контролем промотора CBA в правую черную субстанцию (SN). Через 12 недель экспрессия GFP и hαSyn в SN и striatum (Str) оценивалась иммунофлуоресценцией (IF), тирозингидроксилазо-положительные (TH+) клетки были количественно определены иммуногистохимией (IHC) в SN, а двигательные характеристики оценивались лучевым тестом. Количество мышей в каждой экспериментальной группе указывается в скобках. * указывает группы, в которых одна мышь умерла до анализов. Каждый анализ указывает в скобках номер рисунка из тела статьи, где показаны соответствующие результаты. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Экспериментальный проект для определения кинетики инфильтрации Т-клеток, нейровоспаления и экспрессии hαSyn. Мышей-репортеров Foxp3gfp анестезировали и получали стереотаксическую инокуляцию AAV (1 x 1010 vg /мышь), кодирующую человеческий α-синуклеин (AAV-hαSyn) под контролем промотора CBA в правую черную субстанцию (SN) или фиктивную хирургию (PBS). Мышей приносили в жертву в разные моменты времени, и экспрессия hαSyn в SN и striatum оценивалась иммунофлуоресценцией (IF), GFP (Foxp3), CD4 и тирозингидроксилазой положительными (TH+) клетками, количественно оценивалась IF в SN, а экспрессия Iba1 была проанализирована иммуногистохимией (IHC) в полосатом теле (Str). Указано количество мышей в каждой экспериментальной группе. Указывается диапазон временных точек, включенных в каждый анализ. Каждый анализ указывает в скобках номер рисунка из тела статьи, где показаны соответствующие результаты. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Анализируемая здесь мышиная модель нейродегенерации может помочь изучить многие критические аспекты, связанные с патофизиологией болезни Паркинсона, включая механизмы, участвующие в патологии αSyn и активации микроглии, вовлечение периферической иммунной системы в регуляцию нейровоспаления и механизмы нейродегенерации. К числу механизмов, участвующих в патологии αSyn, относятся субклеточные механизмы, связанные с митохондриальной, лизосомальной или протеазомальной дисфункцией при наличии чрезмерной нагрузки αSyn в дофаминергических нейронах SN2. Важно учитывать, что в дополнение к экспрессии hαSyn, индуцированной AAV-опосредованной трансдукцией, эндогенная мышь αSyn также вносит свой вклад в нагрузку общей экспрессии αSyn. У трансгенных мышей, чрезмерно экспрессирующих мышь αSyn, развивается аналогичная патология синуклеина, невропатология и двигательные нарушения, чем у этих моделей мышей, основанных на гиперэкспрессии hαSyn32. Что касается активации микроглии, настоящая модель мыши может быть использована для изучения того, как различные молекулярные и клеточные игроки, такие как цитокины, нейротрансмиттеры, астроциты, нейроны, гематоэнцефалический барьер и Т-клетки, могут регулировать приобретение провоспалительных или противовоспалительных функциональных фенотипов 8,10,11 . Данная модель также представляет собой важный инструмент для изучения роли периферической иммунной системы, включающей не только Т-клетки, но и макрофаги, моноциты и нейтрофилы, на процессы нейровоспаления и нейродегенерации нигральных нейронов 11,33,34. Наконец, эта модель мыши также представляет собой ценную систему для изучения клеточных и молекулярных механизмов нейродегенерации in vivo, включая те, которые индуцируются внутренними клеточными процессами, такими как окислительный стресс, дефицит энергии и поврежденные органеллы 2, или те, которые проявляются внешними игроками, такими как нейротоксические факторы, продуцируемые микроглиальными клетками, астроцитами и цитотоксическими Т-клетками8. 28,29,35.
Ограничением этой мышиной модели является изучение того, как патологическая агрегация αSyn во внецеребральных местах может представлять собой начальные стадии развития болезни Паркинсона36. В связи с этим появляется все больше данных, свидетельствующих о том, что до нейродегенерации нигральных нейронов и двигательных нарушений в слизистой оболочке кишечника и обонятельном эпителии36 начинается патология αSyn и, вероятно, специфический для αSyn Т-клеточный ответ12. После этого агрегаты αSyn мигрируют через блуждающий нерв к стволу мозга, вызывая нейровоспаление и нейродегенерацию дофаминергических нейронов12. Хотя модель AAV-hαSyn повторяет большинство аспектов болезни Паркинсона, в этой модели нет очевидного участия патологической агрегации αSyn во внецеребральных местах. Альтернативной моделью, включающей патологию hαSyn, подходящей для изучения этих аспектов болезни Паркинсона, могут быть трансгенные мыши, чрезмерно экспрессирующие hαSyn под контролем промотора Thy1, модели Thy1-SNCA37, в которой развитие заболевания зависит от микробиоты кишечника и включает в себя очевидные желудочно-кишечные нарушения38.
Хотя она полезна для изучения разнообразных процессов, связанных с патофизиологией болезни Паркинсона, настоящая модель мыши включает в себя критические шаги, которые должны быть тщательно проверены, включая правильную доставку вирусных векторов в соответствующих пространственных координатах, селективную экспрессию hαSyn в нейронах (которая зависит от серотипа AAV и векторной конструкции), и правильная доза И сроки AAV перед анализом фенотипа Паркинсона. Анализ правильной доставки вирусных векторов в SN необходим, так как использования правильных пространственных координат SN может быть недостаточно, когда игла не совсем прямая, что иногда незаметно для человеческого глаза. Кроме того, диффузия векторов AAV зависит от серотипа AAV39. По этим причинам необходимо проводить периодический контроль качества, проверяя правильную доставку и диффузию введенных векторов AAV-GFP после наблюдения GFP в срезах мозга, содержащих область SN.
Что касается селективной экспрессии hαSyn в нейронах, в принципе, экспрессия hαSyn может быть спроектирована так, чтобы контролироваться промотором, селективным для нейронов или, что еще более точно, селективным для дофаминергических нейронов, таким как использование промотора TH в векторах AAV для индуцирования селективной экспрессии генов в дофаминергических нейронах40 . Однако эта стратегия не работает, когда речь идет о чрезмерной экспрессии интересующего гена. По этой причине в настоящей модели важно использовать сильный промотор (промотор, индуцирующий высокую экспрессию нисходящего гена) и серотипы AAV с нейрональным тропизмом. В этом исследовании промотор CBA использовался в качестве сильного промотора для индуцирования сверхэкспрессии hαSyn, а серотип AAV5 использовался для вирусного вектора. Этот серотип использовался ранее для трансдукции нейронов мыши и крысы41,42. Здесь результаты показали, что через 12 недель после доставки AAV5-GFP в SN мышей зеленая флуоресценция избирательно присутствовала на ипсилатеральной стороне как SN, так и полосатого тела (рисунок 1), что указывает на эффективную трансдукцию нейронов нигростриатального пути.
Другим важным аспектом этой мышиной модели болезни Паркинсона является точка времени, необходимая для анализа конкретного процесса после операции. В связи с этим данная работа показывает кинетическое исследование различных процессов, участвующих в патологии. Поскольку ключевые временные точки изменяются с дозой вирусных геномов, данных на мышь, используемым серотипом AAV или даже с используемой партией AAV, сначала был проведен анализ «доза-реакция» количества AAV-αSyn, необходимого для индуцирования значительной потери нейронов TH+ и двигательных нарушений. Предыдущие исследования показали значительные двигательные нарушения и потерю нейронов TH+ нигростриатального пути после 12 недель инъекций AAV-αSyn у мышей в дозах от 6 х 108–3 х 1010 вирусных геномов на мышь 16,17,30,31. Соответственно, доза AAV-hαSyn, используемая для индуцирования экспрессии hαSyn в нигростриатальном пути, потери нейронов TH+ и двигательных нарушений у мышей, варьировалась от 1 x 108–1 x 1010 вирусных геномов на мышь. Более того, чтобы контролировать, что потеря нейронов TH+ и двигательные нарушения были вызваны сверхэкспрессией hαSyn в SN, а не AAV-инфекцией нейронов SN, были включены контрольные группы, в которые AAV кодирование репортерного гена (AAV-eGFP) доставлялось в одностороннем порядке в SN мышей и определяли нейродегенерацию и двигательные нарушения. Результаты показали, что через 12 недель после стереотаксической операции 1 х 1010 вирусных геномов на мышь была правильной дозой AAV5-hαSyn, поскольку мыши, получавшие эту вирусную нагрузку, демонстрировали значительный hαSyn в нигростриатальном пути (рисунок 2 и рисунок 3), потерю нейронов TH+ (рисунок 4) и двигательные нарушения (рисунок 5). Напротив, более низкие дозы AAV5-hαSyn (1 x 108 вирусных геномов на мышь и 1 x 109 вирусных геномов на мышь) были недостаточно сильными, чтобы достичь значительных изменений во всех этих параметрах вместе (рисунки 2–4). Следует отметить, что введение AAV-GFP при 1 х 1010 вирусных геномах на мышь индуцировало низкую (~20%), но значительную степень потери нейронов TH+ нигральных дофаминергических нейронов (рисунок 4A,B). Этот результат согласуется с предыдущими наблюдениями с использованием этой модели41 и, вероятно, является следствием низкого уровня нейровоспаления, вызванного введением векторов AAV в SN. Тем не менее, степень потери нейронов TH+ была значительно выше у мышей, получавших AAV5-hαSyn, по сравнению с теми, кто получал ту же дозу AAV-GFP (рисунок 4C). Следует отметить, что кинетика экспрессии hαSyn зависит не только от эффективности трансдукции, но и от степени диффузии AAV39. Поскольку диффузия AAV зависит от серотипа AAV, точные ключевые моменты времени в этой модели животных могут варьироваться при использовании другого серотипа AAV, отличного от AAV5.
После этого был проведен кинетический анализ с использованием 1 x 1010 вирусных геномов на мышь для определения ключевых временных точек в этой модели мыши. Поскольку современные данные показали некоторые ранние симптомы, которые появляются до двигательных нарушений, что позволило бы раннюю диагностику болезни Паркинсона 43,44, эти эксперименты стремились найти точку времени, в которой экспрессия hαSyn уже была очевидна, но при отсутствии двигательных нарушений. Результаты показывают, что начало экспрессии hαSyn в SN произошло через 5 недель после стереотаксической доставки AAV-hαSyn (рисунок 6). Этот момент времени представляет собой интересную временную точку для начала применения терапии, предназначенной для остановки нейровоспалительных и нейродегенеративных процессов. Другими ключевыми временными точками, определенными здесь, были пиковые времена для двух критических событий, связанных с процессом нейровоспаления: время, в которое микроглия достигает максимальной степени активации и время максимальной инфильтрации Т-клеток в SN. Результаты показали кривую с тенденцией, достигающей двух волн максимальной активации микроглии, первая через 10 недель после операции, а вторая через 15 недель после операции (рисунок 7). Кинетический анализ инфильтрации Т-клеток показал пиковое время инфильтрации Treg в SN через 11 недель после стереотаксической операции (рисунок 8). Удивительно, но не было обнаружено никаких эффекторных Т-клеток (CD4 + Foxp3-), проникающих в SN в течение анализируемого периода времени (8-13 недель после операции). В целом, эти результаты предполагают надлежащие временные рамки для начала введения терапии, направленной на остановку процесса нейровоспаления и ослабление инфильтрации Т-клеток в SN с использованием этой доклинической модели, которая колеблется между неделей 5 после операции (начало гиперэкспрессии hαSyn) и неделей 10 после операции (первая волна нейровоспаления и инфильтрации Т-клеток) (рисунок 9).
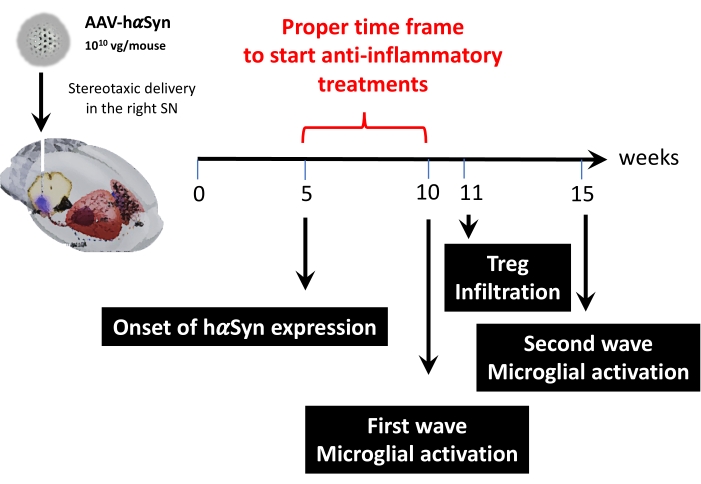
Рисунок 9: Сводка ключевых временных точек, найденных для этой модели животных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Раскрытие информации
Авторы заявляют, что исследование проводилось при отсутствии каких-либо финансовых или нефинансовых конкурирующих интересов.
Благодарности
Мы благодарим д-ра Себастьяна Валенсуэлу и д-ра Микаэлу Рикку за их ценную ветеринарную помощь в нашем учреждении для животных. Эта работа была поддержана "Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID" Centro Ciencia & Vida, FB210008 (для Fundación Ciencia & Vida) и Geroscience Center for Brain Health and Metabolism, FONDAP-15150012. Эта работа также финансировалась грантами FONDECYT-1210013 (для R.P.) и FONDECYT-1150766 (для F.C.) от «Agencia Nacional de Investigación y Desarrollo de Chile (ANID)» и MJFF-10332.01 (для R.P.) и MJFF-17303 (для F.C.) от Фонда Майкла Джей Фокса для исследований Паркинсона.
Материалы
| Name | Company | Catalog Number | Comments |
| ANIMALS AND ANIMAL FOOD | |||
| Foxp3-GFP C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 023800 | |
| Laboratory Rodent Diet | LabDiet | Rodent Diet 5001 | Standard Rodent diet |
| Wild-type C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 000664 | |
| VIRAL VECTORS | |||
| AAV5-CBA-αSyn | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 10E13 vg/mL |
| AAV5-CBA-eGFP | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 9.5 x 10E12 vg/mL |
| ANESTHETICS AND ANALGESICS | |||
| Isoflurane | Baxter | 218082 | 1% for stereotaxic surgery |
| Ketamine | Drag Pharma | CHE30 | 70 mg/Kg for stereotaxic surgery |
| Sevoflurane | Baxter | VE2L9117 | For before transcardial perfusion |
| Tramadol | Drag Pharma | DPH134 | 30 mg/Kg every 24 h |
| Xylazine | Centrovet | EHL40 | 9 mg/kg for stereotaxic surgery |
| EQUIPMENT | |||
| Beam test | Home made | N/A | horizontal beam 25 cm length and 3 cm width. The beam surface was covered by a metallic grid (1 cm2). |
| Cryostate | Leica | CM1520 | |
| Digital camera | Nikon | S2800 Coolpix | For recording the beam test performance |
| Microscope | Olympus | BX51 | Used for IHC analysis (section 4.4) |
| Microscope | Olympus | IX71 | Used for IF analysis (section 5.3) |
| Microscope | Leica | DMI8 | Used for IF analysis (section 5.7) |
| New Standard Stereotaxic, mouse | Stoelting, Wood Dale, IL, USA | 51500 | stereotaxic frame for surgery |
| Peristaltic Pump | Masterflex | C-flex L/S16 | |
| Power supply unit | Olympus | U-RFL-T | Used for IF analysis (section 5.3) |
| Surgical suture | Sylkam®, B Braun | C0760171 | |
| Syringe 100 U | BD | 324918 | For anesthesia before transcardial perfusion, 29G needle |
| Syringe RN 5uL SYR W/O NEEDLE | Hamilton | HA-7641-01 | For viral vector innoculation |
| BUFFERS AND REAGENTS | |||
| Aviden, Peroxidase Conjugate | Merck, Darmstadt, Germany | 189728 | |
| Bovine Serum Albumin | Merck, Darmstadt, Germany | 9048-46-8 | |
| Cryotrotection buffer | Home made | N/A | 20% glycerine and 2% DMSO in PBS |
| DAPI | Abcam | ab228549 | |
| Diaminobenzidine | Merck, Darmstadt, Germany | D8001 | |
| Fluoromount -G T | Electron Microscopy Science | 17984-25 | |
| Gelatin | Merck, Darmstadt, Germany | 104078 | |
| Normal goat serum | Jackson ImmunoResearch Laboratory | 5000121 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 104005 | |
| PBS | Home made | N/A | 0.125 M, pH 7.4 |
| Peroxidase inactivating buffer | Home made | N/A | 0.03% H2O2 in methanol |
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| Trizma Hydrochloride | Merck, Darmstadt, Germany | 1185-53-1 | |
| Tween 20 | Sigma-Aldrich | 822184 | |
| ANTIBODIES | |||
| Biotin-SP (long spacer) AffiniPure Goat Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch Laboratory | 111065003 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11010 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 647 | ThermoFisher Scientific | A21244 | |
| Goat anti-Rat IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11081 | |
| Rabbit monoclonal anti-alpha-Synuclein | Abcam | ab138501 | |
| Rabbit monoclonal anti-Iba-1 | Abcam | EPR16588 | |
| Rabbit polyclonal anti-Tyrosine Hydroxylase | Millipore | AB152 | |
| Rat monoclonal anti-CD4 | Biolegend | 100402 | |
| SOFTWARES | |||
| GraphPad | Prism | 6.0 | Fos stats analysis |
| ImageJ | National Institute of Health | N/A | For image analysis |
| LAS X | Leica | N/A | For image capture with Leica microscope |
| ProgRes Capture Pro | Jenoptik | N/A | For image capture with Olympus microscope |
| VLC media player | VideoLAN Organization | N/A | For analysis of behavioural tests |
Ссылки
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiology of Aging. 24 (2), 197-211 (2003).
- Lim, K. L., Zhang, C. W. Molecular events underlying Parkinson's disease - An interwoven tapestry. Frontiers in Neurology. 4, 33 (2013).
- Abdelmotilib, H., et al. α-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Mori, F., et al. Relationship among alpha-synuclein accumulation, dopamine synthesis, and neurodegeneration in Parkinson disease substantia nigra. The Journal of Neuropathology & Experimental Neurology. 65 (8), 808-815 (2006).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson's disease. Biochimica et Biophysica Acta. 1802 (1), 29-44 (2010).
- Vazquez-Velez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44, 87-108 (2021).
- Dehay, B., et al. Lysosomal impairment in Parkinson's disease. Movement Disorders. 28 (6), 725-732 (2013).
- Gonzalez, H., Elgueta, D., Montoya, A., Pacheco, R. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases. Journal of Neuroimmunology. 274 (1-2), 1-13 (2014).
- Pacheco, R. T-cell based immunotherapies for Parkinson's disease. Exploration of Neuroprotective Therapy. 1 (2), 72-85 (2021).
- Gonzalez, H., Contreras, F., Pacheco, R. Regulation of the neurodegenerative process associated to Parkinson's disease by CD4+ T-cells. Journal of Neuroimmune Pharmacology. 10 (4), 561-575 (2015).
- Gonzalez, H., Pacheco, R. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases. Journal of Neuroinflammation. 11 (1), 201 (2014).
- Campos-Acuna, J., Elgueta, D., Pacheco, R. T-cell-driven inflammation as a mediator of the gut-brain axis involved in Parkinson's disease. Frontiers in Immunology. 10, 239 (2019).
- Blesa, J., Phani, S., Jackson-Lewis, V., Przedborski, S. Classic and new animal models of Parkinson's disease. Journal of Biomedicine and Biotechnology. 2012, 845618 (2012).
- Ulusoy, A., Decressac, M., Kirik, D., Bjorklund, A. Viral vector-mediated overexpression of alpha-synuclein as a progressive model of Parkinson's disease. Progress in Brain Research. 184, 89-111 (2010).
- Gomez-Benito, M., et al. Modeling Parkinson's disease with the alpha-synuclein protein. Frontiers in Pharmacology. 11, 356 (2020).
- Song, L. K., et al. Targeted overexpression of alpha-synuclein by rAAV2/1 vectors induces progressive nigrostriatal degeneration and increases vulnerability to MPTP in mouse. PLoS One. 10 (6), 0131281 (2015).
- Theodore, S., Cao, S., McLean, P. J., Standaert, D. G. Targeted overexpression of human alpha-synuclein triggers microglial activation and an adaptive immune response in a mouse model of Parkinson disease. Journal of Neuropathology and Experimental Neurology. 67 (12), 1149-1158 (2008).
- Sanchez-Guajardo, V., Annibali, A., Jensen, P. H., Romero-Ramos, M. alpha-Synuclein vaccination prevents the accumulation of parkinson disease-like pathologic inclusions in striatum in association with regulatory T cell recruitment in a rat model. Journal of Neuropathology and Experimental Neurology. 72 (7), 624-645 (2013).
- Sanchez-Guajardo, V., Febbraro, F., Kirik, D., Romero-Ramos, M. Microglia acquire distinct activation profiles depending on the degree of alpha-synuclein neuropathology in a rAAV based model of Parkinson's disease. PLoS One. 5 (1), 8784 (2010).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular Neurodegeneration. 8, 44 (2013).
- Cho, C., et al. Evaluating analgesic efficacy and administration route following craniotomy in mice using the grimace scale. Scientific Reports. 9 (1), 359 (2019).
- Flecknell, P. . Laboratory Animal Anaesthesia. 3rd Ed. , (2009).
- Bind, R. H., Minney, S. M., Rosenfeld, S., Hallock, R. M. The role of pheromonal responses in rodent behavior: Future directions for the development of laboratory protocols. Journal of the American Association for Laboratory Animal Science. 52 (2), 124-129 (2013).
- Paxinos, G., Franklin, K. B. J. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Elgueta, D., et al. Dopamine receptor D3 expression is altered in CD4+ T-cells from Parkinson's disease patients and its pharmacologic inhibition attenuates the motor impairment in a mouse model. Frontiers in Immunology. 10, 981 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Fernandez-Suarez, D., et al. The monoacylglycerol lipase inhibitor JZL184 is neuroprotective and alters glial cell phenotype in the chronic MPTP mouse model. Neurobiology of Aging. 35 (11), 2603-2616 (2014).
- Elgueta, D., et al. Pharmacologic antagonism of dopamine receptor D3 attenuates neurodegeneration and motor impairment in a mouse model of Parkinson's disease. Neuropharmacology. 113, 110-123 (2017).
- Montoya, A., et al. Dopamine receptor D3 signalling in astrocytes promotes neuroinflammation. Journal of Neuroinflammation. 16 (1), 258 (2019).
- Williams, G. P., et al. Targeting of the class II transactivator attenuates inflammation and neurodegeneration in an alpha-synuclein model of Parkinson's disease. Journal of Neuroinflammation. 15 (1), 244 (2018).
- Benskey, M. J., et al. Silencing alpha synuclein in mature nigral neurons results in rapid neuroinflammation and subsequent toxicity. Frontiers in Molecular Neuroscience. 11, 36 (2018).
- Rieker, C., et al. Neuropathology in mice expressing mouse alpha-synuclein. PLoS One. 6 (9), 24834 (2011).
- Harms, A. S., et al. alpha-Synuclein fibrils recruit peripheral immune cells in the rat brain prior to neurodegeneration. Acta Neuropathologica Communications. 5 (1), 85 (2017).
- Williams, G. P., et al. CD4 T cells mediate brain inflammation and neurodegeneration in a mouse model of Parkinson disease. Brain. 144 (7), 2047-2059 (2021).
- Matheoud, D., et al. Intestinal infection triggers Parkinson's disease-like symptoms in Pink1(-/-) mice. Nature. 571 (7766), 565-569 (2019).
- Jan, A., Goncalves, N. P., Vaegter, C. B., Jensen, P. H., Ferreira, N. The prion-like spreading of alpha-synuclein in Parkinson's disease: Update on models and hypotheses. International Journal of Molecular Sciences. 22 (15), 8338 (2021).
- Chesselet, M. F., et al. A progressive mouse model of Parkinson's disease: The Thy1-aSyn ("Line 61") mice. Neurotherapeutics. 9 (2), 297-314 (2012).
- Sampson, T. R., et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease. Cell. 167 (6), 1469-1480 (2016).
- Ciron, C., et al. Human alpha-iduronidase gene transfer mediated by adeno-associated virus types 1, 2, and 5 in the brain of nonhuman primates: Vector diffusion and biodistribution. Human Gene Therapy. 20 (4), 350-360 (2009).
- Ben-Shaanan, T. L., et al. Activation of the reward system boosts innate and adaptive immunity. Nature Medicine. 22 (8), 940-944 (2016).
- Albert, K., Voutilainen, M. H., Domanskyi, A., Airavaara, M. AAV vector-mediated gene delivery to substantia nigra dopamine neurons: Implications for gene therapy and disease models. Genes. 8 (2), 63 (2017).
- Bordia, T., Perez, X. A., Heiss, J., Zhang, D., Quik, M. Optogenetic activation of striatal cholinergic interneurons regulates L-dopa-induced dyskinesias. Neurobiology of Disease. 91, 47-58 (2016).
- Kim, A., et al. Upgraded methodology for the development of early diagnosis of Parkinson's disease based on searching blood markers in patients and experimental models. Molecular Neurobiology. 56 (5), 3437-3450 (2018).
- Lei, H., et al. Parkinson's disease diagnosis via joint learning from multiple modalities and relations. IEEE Journal of Biomedical and Health Informatics. 23 (4), 1437-1449 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены