Method Article
ניתוח מודל העכבר של מחלת הפרקינסון המושרה על ידי וקטורים ויראליים הקשורים לאדנו המקודדים α-סינוקלאין אנושי
In This Article
Summary
עבודה זו מנתחת את המינון הווקטורי ואת זמן החשיפה הנדרשים כדי לגרום לדלקת עצבית, ניוון עצבי ופגיעה מוטורית במודל פרה-קליני זה של מחלת פרקינסון. וקטורים אלה המקודדים את α-סינוקלאין האנושי מועברים לתוך הסובסטנטיה ניגרה כדי לשחזר את הפתולוגיה הסינוקליינית הקשורה למחלת פרקינסון.
Abstract
מחלת פרקינסון היא הפרעה נוירודגנרטיבית הכוללת את מותם של הנוירונים הדופמינרגיים של המסלול הניגרוסטריאלי, וכתוצאה מכך, אובדן הדרגתי של שליטה בתנועות רצוניות. תהליך נוירודגנרטיבי זה מופעל על ידי תצהיר של אגרגטים של חלבונים במוח, אשר מורכבים בעיקר α-סינוקלאין. מספר מחקרים הצביעו על כך שנדרשת דלקת עצבית כדי לפתח את הניוון העצבי הקשור למחלת פרקינסון. יש לציין כי התהליך הנוירו-אינפלמטורי כולל הפעלה מיקרוגליאלית, כמו גם חדירה של תאי T היקפיים לתוך הסובסטנטיה ניגרה (SN). עבודה זו מנתחת מודל עכברי של מחלת פרקינסון המשחזרת הפעלה מיקרוגליאלית, חדירת תאי T ל-SN, ניוון עצבי של נוירונים דופמינרגיים ניגרליים ופגיעה מוטורית. מודל עכברי זה של מחלת פרקינסון מושרה על ידי העברה סטריאוטקסית של וקטורים נגיפיים הקשורים לאדנו המקודדים את סוג הבר האנושי α-סינוקלאין (AAV-hαSyn) לתוך SN. המסירה הנכונה של וקטורים ויראליים לתוך SN אושרה באמצעות וקטורים בקרה המקודדים חלבון פלואורסצנטי ירוק (GFP). לאחר מכן, כיצד הוערכו המינון של AAV-hαSyn שניתן ב-SN על היקף הביטוי של hαSyn, על אובדן הנוירונים הדופמינרגיים הניגרליים ועל הפגיעה המוטורית. יתר על כן, הדינמיקה של ביטוי hαSyn, הפעלה מיקרוגליאלית וחדירת תאי T נקבעו לאורך כל מהלך התפתחות המחלה. לפיכך, מחקר זה מספק נקודות זמן קריטיות שעשויות להיות שימושיות למיקוד פתולוגיה של סינוקלאין ודלקת עצבית במודל פרה-קליני זה של מחלת פרקינסון.
Introduction
לאחר מחלת אלצהיימר, מחלת פרקינסון היא המחלה הנוירודגנרטיבית השנייה בשכיחותה בעולם. הנוירונים העיקריים המושפעים ממחלת פרקינסון הם אלה של המסלול הניגרוסטריאלי, המייצרים דופמין ושולטים בתנועה רצונית. כתוצאה מכך, הסימפטום האופייני ביותר הקשור להפרעה זו הוא פגיעה מוטורית. פתולוגיה זו כוללת גם תצהיר של אגרגטי חלבונים במוח, המורכבים בעיקר α-סינוקלאין (αSyn)1, חלבון ציטוזולי הקשור לטרמינלים קדם-סינפטיים. עדויות הראו כי הדור של תכלילים פתוגניים של αSyn מופעל על ידי קיפול שגוי או על ידי כמה שינויים לאחר התרגום של חלבון זה2.
יש לציין כי נוצר קשר הדוק בין הפתולוגיה של αSyn לבין אובדן הנוירונים הדופמינרגיים של המסלול הניגרוסטריאלי במחלת פרקינסון אנושית ובמודלים של בעלי חיים 3,4. הבנת האופן שבו נוצרים אגרגטים של αSyn וכיצד הם גורמים למוות עצבי מייצגת אתגר משמעותי בתחום. קבוצה הולכת וגדלה של מחקרים הראתה כי על ידי הגברת העקה החמצונית, תפקוד לקוי של המיטוכונדריה הוא אחד הגורמים המובילים ליצירת אגרגטים αSyn2. ואכן, מספר גנים הקשורים למחלת פרקינסון מקודדים חלבונים המעורבים בתפקוד המיטוכונדריאלי, במורפולוגיה ובדינמיקה 5,6. בנוסף, תפקוד לקוי ליזוזומי, שמביא להצטברות של מיטוכונדריה לא מתפקדת ו-αSyn מקופלת בצורה שגויה, מהווה אירוע מרכזי נוסף המקדם את יצירתם של αSyn aggregates7.
עדויות חדשות מצביעות על כך שברגע שאגרגטים של αSyn מופקדים במוח, החלבונים הפתוגניים האלה מעוררים קולטנים דמויי אגרה (TLRs) על המיקרוגליה, ובכך מפעילים הפעלה מיקרוגליאלית וסביבה דלקתית ראשונית בסובסטנטיה ניגרה (SN)8,9. יתר על כן, הראיות מצביעות על כך שאגרגטים של αSyn נלכדים ומוצגים על-ידי תאים המציגים אנטיגן לתאי T, מה שגורם לתגובה חיסונית נרכשת ספציפית ל-αSyn10,11. תאי T ספציפיים ל-αSyn אלה מסתננים לאחר מכן למוח ונשענים מחדש על ידי מיקרוגליה מופעלת, ובכך מקדמים את הפרשת הגורמים הנוירוטוקסיים שמעוררים מוות עצבי 9,10. באופן מעניין, מספר שורות של ראיות הצביעו על כך שאגרגטים של αSyn נוצרים תחילה במערכת העצבים האנטרית ולאחר מכן מועברים דרך העצב התועה לגזע המוח12.
מספר מודלים של בעלי חיים של מחלת פרקינסון שימשו במשך שנים רבות, כולל אלה המושרים על ידי מתן חומרים נוירוטוקסיים (כלומר, 6-הידרוקסידופאמין, פרקוואט, רוטנון, 1-מתיל-4-פניל-1,2,3,6-טטרהידרופירידין) ואלה המערבים מצבים גנטיים (כלומר, מוטציה α-סינוקלאין, קינאז חוזר עשיר בלאוצין מוטנטי 2)13 . למרות מודלים המערבים ניוון עצבי הנגרם על ידי נוירוטוקסין המשכפלים היבטים מסוימים של מחלת פרקינסון, אף אחד מהם לא משחזר את כל ההיבטים החיוניים של המחלה או שאינם מתקדמים13. מאידך גיסא, אף על פי שמודלים גנטיים של עכברים גנטיים הכוללים ביטוי של גרסאות מוטנטיות של קינאז חוזר עשיר בלאוצין 2, גרסאות מוטנטיות של α-סינוקלאין, או ביטוי יתר של α-סינוקלאין מסוג פראי אנושי, גורמים לפגיעה מוטורית, ובמקרים מסוימים גם להתפתחות הסינוקלינופתיה, הם אינם משחזרים ניוון עצבי בולט של הנוירונים הדופמינרגיים הניגרליים, המהווים היבט חיוני של מחלת פרקינסון13, 14. סוג שלישי של מודל חייתי של ניוון עצבי הצליח לענות על רוב ההיבטים החיוניים של מחלת פרקינסון, המסירה הסטריאוטקסית של וקטורים ויראליים הקשורים לאדנו (AAVs) המקודדים את α-סינוקלאין האנושי (AAV-hαSyn)14,15. חשוב לציין, AAVs מאפשרים התמרה של נוירונים ביעילות גבוהה ובטווח הארוך במוח הבוגר של יונקים. יתר על כן, ההוכחה כי ההעברה הסטריאוטוקסית של AAV-hαSyn ב-SN משחזרת רבים מההיבטים החיוניים של המחלה, כולל פתולוגיה של αSyn, הפעלה מיקרוגליאלית, ניוון עצבי ופגיעה מוטורית 16,17,18,19,20. מחקר זה מציג ניתוח של האופן שבו המינון של הווקטור הנגיפי והזמן שלאחר מסירת וקטור נגיפי משפיע על היקף הביטוי hαSyn, ניוון עצבי ודלקת עצבית במסלול nigrostriatal, כמו גם את מידת הפגיעה המוטורית במודל העכבר של העברה סטריאוטקסית חד צדדית של hαSyn ב- SN.
Protocol
כל המחקרים בוצעו תחת המהדורה השמינית של המדריך לטיפול בחיות מעבדה ולשימוש בהן. פרוטוקולים ניסיוניים אושרו על ידי ה-IACUC בקרן המדע לחיים (Fundación Ciencia &Vida), כולל אלה הכרוכים בהרדמה, כאב, מצוקה והמתת חסד (מספר היתר P-035/2022).
1. הניתוח הסטריאוטקסי
- הכנה לניתוח (כשעה)
- כדי לשמור על סביבה אספטית, לבשו בגדי ניתוח מתאימים במהלך כל הניתוח, כולל כיסויי נעליים, מסכה כירורגית, מחסום סניטרי, כפפות וכובע כירורגי.
- יש לרסס 70% אתנול על העכבר ועל כל החומר הניתוחי כדי לשמור על סביבה אספטית.
- כדי לגרום לשיכוך כאבים, יש להזריק לעכבר קרפרופן 5 מ"ג/ק"ג תת עורית (s.c.) כל 12 שעות21 החל משעה אחת לפני הניתוח ונמשך עד 3 ימים לאחר הניתוח.
- כדי להרדים את העכבר, הניחו את החיה בתא אינדוקציה. פתחו את זרימת האיזופלורן בקצב של 0.5% ואז הגדילו אותה באיטיות ל-5% במשך כ-5 דקות עד שהעכבר איבד את הרפלקס הימני שלו22.
- הסר את החיה מתא האינדוקציה. מעבירים מיד את החיה למעגל שאינו מתרבה מחדש עם חרוט אף בגודל מתאים. שמור על הרדמה עכבר עם איזופלורן 1% לאורך כל זמן הניתוח.
- אשרו שהעכבר מורדם לחלוטין על ידי צביטה בזנבו ובכפותיו. כאשר העכבר אינו מגיב לצביטת הזנב והכפות, זה אומר שהעכבר מורדם לחלוטין.
- לגלח את ראשו של העכבר באמצעות מספריים. נקו את עור העכבר באמצעות צמר גפן עם כלורהקסידין 2% והסירו את כל השיער.
- תקן את ראש העכבר במסגרת הסטריאוטקסית.
- הניחו מגן קרנית בשתי עיני העכבר באמצעות צמר גפן. כדי למנוע אינדוקציה של לחץ אצל מכרסמים אחרים, הימנעו מנוכחות של כל עכבר אחר בחדר הניתוח23.
- הניתוח (כ-30 דקות)
- נקו את ראש העכבר עם שלושה סיבובים של 2% כלורהקסידין ואחריו 70% אתנול. חשוף את הגולגולת באמצעות חומר כירורגי ועשה חור דק עם מקדחה בקואורדינטות הבאות: anteroposterior −2.8 מ"מ, ו 1.4 מ"מ בינוני ביחס לקו המדיאלי.
- שים את המחט של מזרק 10 μL לתוך החור והזז את המחט בתוך המוח לאט עד שתגיע ל -7.2 מ"מ dorsoventral ביחס לדורה24.
- השאירו את המחט במצב הסופי למשך 2 דקות כדי לאפשר לרקמה להתיישב מעט, ולאחר מכן הזריקו 1 μL של AAV5-CBA-hαSyn (AAV-hαSyn), AAV5-CBA-eGFP (AAV-GFP), או רכב (PBS ב-pH 7.4; ניתוח בושה) לתוך הסובסטנטיה ניגרה הימנית בקצב של 0.2 μL/30 s.
- השאירו את המחט באותה תנוחה במשך 5 דקות לאחר מסירת וקטורים ויראליים ואז למשוך אותה לאט.
- לאחר הניתוח (כ-5 דקות)
- סגור את הפצע באמצעות תפר סטרילי קלוע משי שאינו ניתן לספיגה.
- שים את העכבר בכלוב הביתי מוכן מראש על ידי הנחתו מעל מזרן מחומם חשמלי (25 מעלות צלזיוס).
הערה: העכבר חייב להישמר לבדו בכלוב הביתי עד שהוא מסוגל ללכת ללא קושי והפצע החלים.
2. קביעת ביצועי המנוע באמצעות מבחן הקרן
- אימון (כ-15 דקות לעכבר)
- 12 שבועות לאחר הניתוח הסטריאוטקסי, העריכו את ביצועי המנוע באמצעות גרסה פשוטה יותר של בדיקת הקרן שתוארה לפני25. לשם כך, יש להשתמש בקורה אופקית באורך 25 ס"מ וברוחב של 3 ס"מ. משטח הקרן חייב להיות מכוסה ברשת מתכתית עם ריבועים של 1 ס"מ ומוגבה 1 ס"מ מעל הקורה.
- צלם סרטון של העכבר חוצה את קרן פני השטח של הרשת מקצה אחד לקצה הנגדי של הקרן, שם נמצא הכלוב הביתי. לאמן את העכבר במשך יומיים לפני קביעת הביצועים המוטוריים.
- ביום הראשון, לאמן את העכבר ללכת דרך הקורה חמש פעמים ללא הרשת.
- ביום השני, לאמן את העכבר ללכת דרך הקורה בנוכחות הרשת חמש פעמים.
- הבדיקה (כ-5 דקות לעכבר)
- ביום השלישי, להעריך את הביצועים המוטוריים. כדי לעשות זאת, לכמת את מספר השגיאות שבוצעו על ידי הכפות השמאליות או על ידי כפות ימין בנפרד על ידי צפייה בסרטונים במצב בהילוך איטי.
הערה: שגיאה מוגדרת ככאשר כפה אינה דורכת כראוי על הרשת, ולכן היא הופכת לגלויה בצד הרשת או בין הרשת למשטח הקרן.
- ביום השלישי, להעריך את הביצועים המוטוריים. כדי לעשות זאת, לכמת את מספר השגיאות שבוצעו על ידי הכפות השמאליות או על ידי כפות ימין בנפרד על ידי צפייה בסרטונים במצב בהילוך איטי.
3. עיבוד רקמות
- פרפוזיה טרנסקרדיאלית (כ-15 דקות לעכבר)
- כדי להרדים את העכבר, יש להזריק תערובת של קטמין (80 מ"ג/ק"ג) וקסילזין (10 מ"ג/ק"ג) באופן תוך-צניעי (כלומר) באמצעות מזרק 1 מ"ל ומחט 27 גרם26.
- לאחר שהעכבר מורדם לחלוטין (אושר כמו בשלב 1.1.6.), פתח את בית החזה בחומר כירורגי וחשוף את הלב.
- לאחר מכן, הכנס מחט של 21 גרם (הפוך את הקצה לשטוח באמצעות מקדחה) לחדר השמאלי של הלב.
- על ידי צימוד המחט לצינור, יש להחדיר 50 מ"ל של PBS (pH 7.4) בקצב של 9.5 מ"ל/דקה באמצעות משאבה פריסטלטית.
- תיקון והגנה על המוח בהקפאה (כ-10 דקות לכל מוח)
- הסר את המוח באמצעות מספריים ופינצטה, ולאחר מכן תקן אותו על ידי טבילה ב 5 מ"ל של 4% paraformaldehyde ב- PBS (pH 7.4) ב 4 ° C במשך 24 שעות.
- לאחר מכן, לשים את המוח הקבוע ב 15 מ"ל של 30% סוכרוז ב 4 ° C במשך 48 שעות.
- לאחר מכן, הכניסו את המוח ל-4 מ"ל של תמיסת ההגנה על ההקפאה (20% גליצרין ו-2% DMSO ב-PBS) ושמרו את המוח בטמפרטורה של 80 מעלות צלזיוס או השתמשו בה באופן מיידי בשלב הבא.
- קבלת פרוסות מוח (כ-20 דקות למוח).
הערה: ודא שהמוח ממוקם בקריוסטט במצב מתאים כדי לבצע חתכים קורונליים.- כדי להשיג פרוסות SN, חתכו את המוח למקטעים בעובי 40 מיקרומטר המתחיל ב-2.92 מ"מ − ומסתיים ב-3.64 מ"מ24−.
- קוצרים כל פרוסה בבאר (המכילה 1 מ"ל של תמיסת הגנה על ההקפאה) של צלחת בת 24 בארות בעקבות סדר אנטרופוסטריור כפי שתואר לפני 25,27,28.
- כדי לבצע ניתוחים אימונוהיסטוכימיים (סעיף 4.) ואימונופלואורסצנציה (סעיף 5.) ב- SN, בחר שישה מקטעי SN קורונליים שנלקחו במרווחי זמן אחידים (120 מיקרומטר) המכסים את כל היקף הרוסטרוקואודלים של הגרעין (720 מיקרומטר בסך הכל), כמתואר לפני 25,27,28.
- כדי להשיג פרוסות סטריאליות, חותכים את המוח למקטעים בעובי 40 מיקרומטר, החל מ-1.34 מ"מ + ומסתיימים ב-0.26 מ"מ 24--0.26 מ"מ.
- קוצרים כל פרוסה בקריוטובה של 2 מ"ל (המכילה 1 מ"ל של תמיסת הגנה על ההקפאה) לפי סדר אנטרופוסטריור.
- כדי לבצע ניתוחים אימונוהיסטוכימיים (סעיף 4.) ואימונופלואורסצנציה (סעיף 5.) בסטריאטום, בחרו חמישה מקטעים סטריאליים קורונליים שנלקחו במרווחי זמן אחידים (320 מיקרומטר) המכסים את כל היקף הרוסטרוקואודלים של הגרעין (1600 מיקרומטר בסך הכל).
4. ניתוח אימונוהיסטוכימי לכימות נוירונים דופמינרגיים ומיקרוגליוזיס (בערך יומיים)
- לצורך ניתוח אימונוהיסטוכימי של פרוסות סטריאליות או ניגראליות, הניחו את הסט של חמש פרוסות (סטריאטום) או שש (SN) מאותו מוח בבאר אחת של צלחת בת 24 בארות.
- שטפו את החלקים 3x עם 1 מ"ל של PBS ולאחר מכן דגירו עם 0.5 מ"ל של 0.03% H2O2 במתנול בטמפרטורת החדר ועם תסיסה במשך 30 דקות כדי להשבית פעילות פרוקסידאז אנדוגנית.
- שטפו את החלקים 3x עם 1 מ"ל של PBS ודגמו עם תמיסת חסימה של 0.5 מ"ל (4% סרום עיזים, 0.05% טריטון X-100 ו-4% BSA ב-PBS) בטמפרטורת החדר ועם תסיסה למשך 40 דקות.
- לאחר מכן, דגירה עם 0.5 מ"ל של תמיסת חסימה המכילה את הנוגדן העיקרי (ארנב נגד טירוזין הידרוקסילאז [TH] pAb מדולל 1:1000 [ראה טבלה 1]; או נוגדן ארנב נגד Iba1 מדולל 1:1000) בטמפרטורת החדר ועם תסיסה בן לילה.
- שטפו את החלקים 3x עם 1 מ"ל של PBS ודגרו עם תמיסת חסימה של 0.5 מ"ל המכילה pAb נגד ארנב עזים שעברו ביוטינילציה (1:500, ראו טבלה 1) בטמפרטורת החדר ועם תסיסה למשך שעתיים.
- לאחר מכן, שטפו את החלקים 3x עם 1 מ"ל של PBS ודגרו עם 0.5 מ"ל של אבידין מצומד פרוקסידאז (1:5000, ראו טבלה 1) בתמיסת חסימה בטמפרטורת החדר ועם תסיסה למשך 90 דקות.
- שטפו את החלקים 3x עם 1 מ"ל של PBS ודגרו עם תמיסת מצע של 0.5 מ"ל (0.05% דיאמינובנזידין ב-0.03% H2O2 O 2/Trizma-HCl buffer ב-pH 7.6). לבשו כפפות ומעיל מעבדה לצעד זה, שכן דיאמינובנזידין הוא חומר מסרטן פוטנציאלי.
- כאשר הכתם הספציפי ניכר (בדרך כלל 30 שניות עבור TH ו-5 דקות עבור Iba1), הוציאו את תמיסת המצע ושטפו את החלקים 3x עם 1 מ"ל של PBS בטמפרטורת החדר ועם תסיסה. תמיד לבצע את ההשחתה החיסונית של פרוסות של כל המוחות הכלולים באותו ניסוי בו זמנית.
הערה: ההכתמה הספציפית של TH ניכרת כאשר TH immunostaining מופיע באזור SN, אשר מציג צורה אופיינית במוח. הסימן הספציפי של Iba1 נקבע כאשר חיסון Iba1 מופיע על פרוסות מוח בקרה עם צורות מיקרוגליאליות טיפוסיות, אשר מאושרות על ידי תצפית מיקרוסקופית. בדרך זו נקבע הזמן המדויק של חשיפת המצע לניתוח IHC עבור כל ניסוי בודד. - הרכיבו את חלקי המוח על מגלשות זכוכית באמצעות תמיסה של 0.2% ג'לטין ב-0.05 M Tris (עמ' 7.6). הניחו כל קבוצה של חמש פרוסות (סטריאטום) או שש (SN) המתקבלות מאותו מוח בסדר רוסטרוקאודלי על אותה מגלשת זכוכית.
- לכמת את מספר תאי העצב של TH+ ב-SN.
- כדי לכמת נוירוני TH+ ב-SN, רכשו תמונות של שש הפרוסות בהגדלה של פי 20 באמצעות מיקרוסקופ שדה בהיר, כפי שתואר לפני 25,27,28. השתמש בהתאמה הבאה של צבע: טמפרטורת צבע 3200 K, אדום ציאן 40%, מג'נטה-ירוק 39%, צהוב-כחול 54%, גמא 0.5, ניגודיות 37, בהירות 13, רוויה 5.
- באמצעות תוכנת Image J, בחר את ההיקף של SN pars compacta בחצי הכדור שנותח. הימנע מבחירת נוירוני TH+ מהאזור הטגמנטלי הגחוני (VTA).
- לאחר מכן, בקש מהתוכנה לחשב את השטח שנבחר (בדרך כלל 0.04-0.07 מ"מ2/חצי כדור, בהתאם למיקום הרוסטרוקאודלי). לאחר מכן, באמצעות הכלי multipoint, תייג כל נוירון TH+ בנקודה.
- באמצעות כלי הנקודות, בקש מהתוכנה לספור את המספר הכולל של הנקודות. עם מספר הנקודות הכולל (נוירוני TH+ ) והשטח של ה- SNpc, חשב את הצפיפות של נוירוני TH+ / מ"מ2.
- חזור על אותו חישוב בשתי ההמיספרות על שש פרוסות ה- SN ולאחר מכן חישב את הממוצע של נוירוני TH+ / מ"מ2 בצד האיפסילטרלי והקונטרלטרלי.
- לכמת את מספר המיקרוגליה המופעלת בסטריאטום
- כדי לכמת מיקרוגליה מופעלת בסטריאטום, רכשו שתי תמונות בכל חצי כדור עבור כל חמש פרוסות הסטריטאל בהגדלה של פי 20 באמצעות מיקרוסקופ שדה בהיר ואותן הגדרות שצוינו בשלב 4.10.10.1. באמצעות תוכנת Image J, בכל תמונה בודדת (המציגה שטח של 660 μm x 877 μm), תג עם נקודה כל תא בודד המבטאת עוצמת Iba1 גבוהה וצורת אמבואיד באמצעות הכלי מרובה נקודות. באמצעות כלי הנקודות, בקש מהתוכנה לספור את המספר הכולל של הנקודות.
- עם מספר הנקודות הכולל ושטח התמונה, חשבו את צפיפות המיקרוגליה המופעלת (תאיםגבוהים של Iba1/מ"מ2) כפי שבוצעה לפני29.
| אנטיגן מטרה | מצומד ל | קלונליות | מפרט מארח | תגובתיות מדומה* | דילול** |
| טירוזין הידרוקסילאז | N/A | פוליקלונלי | ארנב | עכבר, חולדה, אדם | 1/200 - 1/1000 |
| Iba1 | N/A | מונוקלונלי | ארנב | עכבר, חולדה, אדם | 1/1000 |
| אלפא-סינוקליין | N/A | מונוקלונלי | ארנב | אנוש | 1/150 |
| תקליטור4 | N/A | מונוקלונלי | חולדה | עכבר | 1/250 |
| IgG (H+L) | ביוטינילציה | פוליקלונלי | עז | ארנב | 1/500 |
| IgG (H+L) | אלכסהפלור 546 | פוליקלונלי | עז | ארנב | 1/500 |
| IgG (H+L) | אלכסהפלור 647 | פוליקלונלי | עז | ארנב | 1/500 |
| IgG (H+L) | אלכסהפלור 546 | פוליקלונלי | עז | חולדה | 1/500 |
טבלה 1: דילול נוגדנים. N/A, לא ישים. *, הוא צוין רק אם יש הפעלות מחדש עם עכבר, חולדה ואדם, ללא קשר לתגובתיות עם מינים אחרים. **, צוין דילול יחיד או טווח דילול.
5. ניתוח אימונופלואורסצנציה להערכת חדירת תאי T במסלול הניגרוסטריאלי (כ-2 ימים)
- לצורך ניתוח אימונופלואורסצנציה של hαSyn או TH/GFP על פרוסות סטריאליות או ניגרליות, הרכיבו את הקבוצה של חמש (סטריאטום) או שש (SN) פרוסות מאותו מוח בבאר אחת של צלחת בת 24 בארות.
- לשטוף את החלקים 3x עם 1 מ"ל של PBS ולאחר מכן לדגום עם 0.5 מ"ל של פתרון חוסם (0.3% Triton X-100, 0.05% tween20, ו 5% BSA ב- PBS) בטמפרטורת החדר ועם תסיסה במשך 40 דקות.
- לאחר מכן, דגירה עם 0.5 מ"ל של תמיסת חסימה המכילה את הנוגדן העיקרי (ארנב נגד TH pAb מדולל 1:500; או נוגדן ארנב נגד hαSyn מדולל 1:150, ראה טבלה 1) בטמפרטורת החדר ועם תסיסה לילה.
- שטפו את החלקים 3x עם 1 מ"ל של PBS ודגרו עם תמיסה חוסמת של 0.5 מ"ל המכילה נוגדן משני נגד ארנב מצומד אלקסהFluor546 (1:500, ראה טבלה 1) ו-4′,6-דיאמידינו-2-פנילינדול (DAPI; 1:1000) בטמפרטורת החדר ועם תסיסה במשך 2 שעות. לאחר מכן, לשטוף את החלקים 3x עם 1 מ"ל של PBS.
- הרכיבו את קטעי המוח על מגלשות זכוכית כמתואר לעיל (שלב 4.9.). התמונות נרכשו באמצעות מיקרוסקופ פלואורסצנטי הפוך המוצמד ליחידת אספקת חשמל.
- לצורך ניתוח אימונופלואורסצנציה של TH/CD4/GFP(Foxp3) על פרוסות ניגריות, הניחו את הסט של שש פרוסות (SN) מאותו מוח בבאר אחת של צלחת בת 24 בארות. שטפו את החלקים 3x עם 1 מ"ל של PBS ולאחר מכן דגרו עם 0.5 מ"ל של תמיסת חסימה (0.5% טריטון X-100, 0.5% ג'לטין עור דגים ב-PBS) בטמפרטורת החדר ועם תסיסה למשך שעתיים.
- דגירה עם 0.5 מ"ל של תמיסת חסימה המכילה את הנוגדנים העיקריים נגד TH pAb (1:200, ראה טבלה 1) ונוגד CD4 של חולדה (1:250) בטמפרטורה של 4 מעלות צלזיוס ועם תסיסה במהלך הלילה.
- שטפו את המקטעים 3x עם 1 מ"ל של PBS ודגרו עם תמיסת חסימה של 0.5 מ"ל המכילה אנטי-ארנב המצומדת ל-AlexaFluor 647 (1:500, ראו טבלה 1) ואנטי-חולדה המצומדת ל-AlexaFluor 546 (1:500) בטמפרטורת החדר ועם תסיסה למשך 2 שעות. לאחר מכן, לשטוף את החלקים 3x עם 1 מ"ל של PBS.
- שים כל קבוצה של שש פרוסות (SN) המתקבלות מאותו מוח בסדר רוסטרוקאודלי על אותה מגלשת זכוכית והרכב אותן באמצעות Fluoromount G. רכוש תמונות באמצעות מיקרוסקופ Leica DMi8. השתמש בהגדרות המיקרוסקופ הקונפוקלי המצוינות בטבלה 2 כדי להשיג תמונות מניתוח אימונופלואורסצנציה.
| שם שאנל | קובייה | פליטת Wavelenght | שם טבלת בדיקת מידע | זמן חשיפה | לקבל | רזולוציה XY | פתרון Z |
| ערוץ 1 | י5 | 700nm | אָפוֹר | 1,011.727 ms | קיבולת באר גבוהה | 2.237 אממ | 24.444 אממ |
| ערוץ 2 | GFP | 525nm | ירוק | 326.851 ms | קיבולת באר גבוהה | 2.237 אממ | 24.444 אממ |
| ערוץ 3 | TXR | 630nm | אדום | 406.344 ms | קיבולת באר גבוהה | 2.237 אממ | 24.444 אממ |
| ערוץ 4 | דאפי | 460nm | כחול | 91.501 ms | קיבולת באר גבוהה | 2.237 אממ | 24.444 אממ |
טבלה 2: הגדרות מיקרוסקופ קונפוקליות המשמשות לרכישת תמונות מניתוח אימונופלואורסצנציה.
6. ניתוח סטטיסטי
- כדי להשוות נתונים שהתקבלו מהצד האיפסילטרלי והקונטרלטרלי, השתמש במבחן t של סטודנט בעל שני זנבים זוגיים.
- כדי להשוות נתונים המתקבלים מעכברים המקבלים AAV-hαSyn ומעכברים המקבלים ניתוח AAV-GFP או sham, השתמש במבחן t של סטודנט בעל שני זנבות לא מזווגים. שקול הבדלים משמעותיים כאשר ערכי P < 0.05.
תוצאות
אימות המסירה הנכונה של וקטורי AAV בתאי העצב הדופמינרגיים של המסלול הניגרוסטריאלי
כדי לחקור את התהליכים של דלקת עצבית, ניוון עצבי ופגיעה מוטורית המקודמים על ידי פתולוגיה של סינוקליין, נעשה שימוש במודל עכברי של מחלת פרקינסון המושרה על ידי העברה סטריאוטקסית חד-צדדית של קידוד AAV hαSyn ב-SN 16,17,30,31 (ראו את תכנון הניסוי באיור משלים 1 ). כדי לאמת את המסירה הנכונה של וקטורים AAV בתאי העצב הדופמינרגיים של המסלול הניגרוסטריאלי, AAV המקודד GFP (AAV-GFP) הוזרק ב-SN, ו-12 שבועות לאחר מכן, פלואורסצנציה של GFP וטירוזין הידרוקסילאז (TH) נותחו ב-SN ובסטריאטום על ידי אימונופלואורסצנציה. הפלואורסצנציה הקשורה ל-GFP נצפתה באופן בלעדי בצד האיפסילטרלי, והייתה קולוקליזציה משמעותית עם אימונו-פעילות חיסונית של TH הן ב-SN והן בסטריאטום, מה שמצביע על העברה נכונה של וקטורים של AAV בתאי העצב הדופמינרגיים של המסלול הניגרוסטריאלי (איור 1).
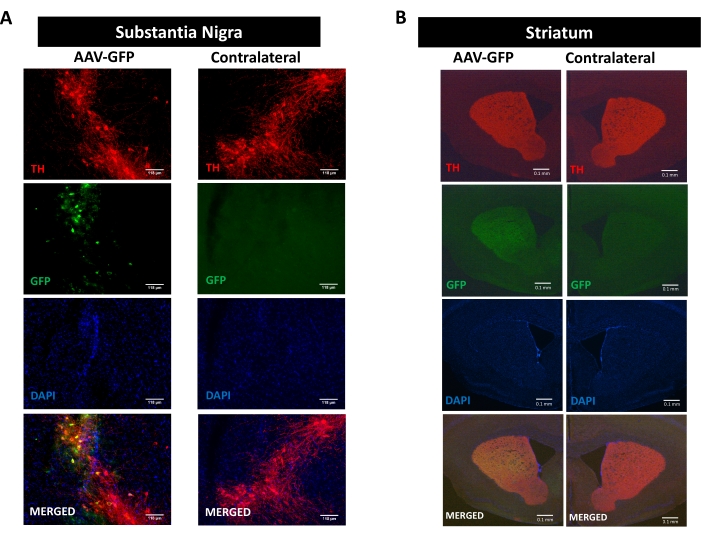
איור 1: ניתוח מסירת AAV-GFP במסלול הניגרוסטריאלי. עכברים קיבלו AAV-GFP (1 x 1010 vg/mouse) ו-12 שבועות לאחר מכן הוקרבו, ו-TH הוכתם ב-(A) ה-SN (פסי קנה המידה הם 118 מיקרומטר) ו-(B) הסטריאטום (פסי קנה מידה הם 100 מיקרומטר). פלואורסצנציה הקשורה ל-TH ול-GFP נותחה על ידי מיקרוסקופיה אפיפלואורסצנטית. הגרעינים היו מוכתמים ב-DAPI. מוצגות תמונות מייצגות של מיזוג או צביעה יחידה של TH (אדום), GFP (ירוק) ו- DAPI (כחול). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
הגדרת המינון של וקטור ויראלי הניתן כדי לגרום לניוון עצבי ולפגיעה מוטורית במודל העכבר של מחלת פרקינסון המושרה על ידי AAV-hαSyn
כדי לבחון את המינון של AAV-hαSyn הנדרש כדי לגרום לביטוי יתר משמעותי של hαSyn המקדם ניוון עצבי של הנוירונים הדופמינרגיים הניגרליים, הוזרקו מינונים שונים (1 x 108 גנומים נגיפיים [vg]/עכבר, 1 x 109 vg/mouse, או 1 x10 10 vg/mouse) של AAV-hαSyn, ו-12 שבועות לאחר מכן, הוערכו האימונו-פעילות החיסונית של hαSyn ומידת הפעילות החיסונית של TH במסלול הניגרוסטריאלי. אף על פי שהפעילות החיסונית של hαSyn ניכרה בכל המינונים שנבדקו ב-SN (איור 2), רק עכברים שקיבלו 1 x 1010 10 vg/עכבר הציגו פעילות חיסונית ניכרת של hαSyn בסטריאטום (איור 3). יתר על כן, עכברים שקיבלו 1 x 1010 10 vg/mouse של AAV-hαSyn הראו אובדן משמעותי של נוירונים דופמינרגיים ב-SN (איור 4A,B). אף על פי שעכברים שקיבלו 1 x 1010 vg/mouse של AAV-GFP הציגו דרגה נמוכה (כ-20%) של אובדן עצבי (איור 4A,B), עכברים שקיבלו את אותה מינון של AAV-hαSyn הציגו רמה גבוהה יותר באופן משמעותי של ניוון עצבי של נוירונים דופמינרגיים ניגרליים (איור 4C). בהתאם לכך, ניסויים נוספים בוצעו באמצעות 1 x 1010 10 vg/mouse של AAV-hαSyn. בנוסף, היקף הפגיעה המוטורית נקבע בעכברים שקיבלו מינונים שונים של AAV-hαSyn באמצעות בדיקת הקרן (איור 5A), כפי שתואר לפני25. ירידה משמעותית בביצועי המנוע זוהתה באופן בלעדי עם 1 x10 10 10 vg/mouse של AAV-hαSyn במבחן הקרן הן כאשר משווים את מספר השגיאות שבוצעו על ידי הרפידות הימניות והשמאליות (איור 5B) והן כאשר משווים את המספר הכולל של שגיאות של עכברים המקבלים AAV-hαSyn בהשוואה לעכברים המקבלים את וקטור הבקרה AAV-GFP (איור 5C). בהתאם לכך, ניסויים נוספים בוצעו באמצעות 1 x 1010 10 vg/mouse של AAV-hαSyn.
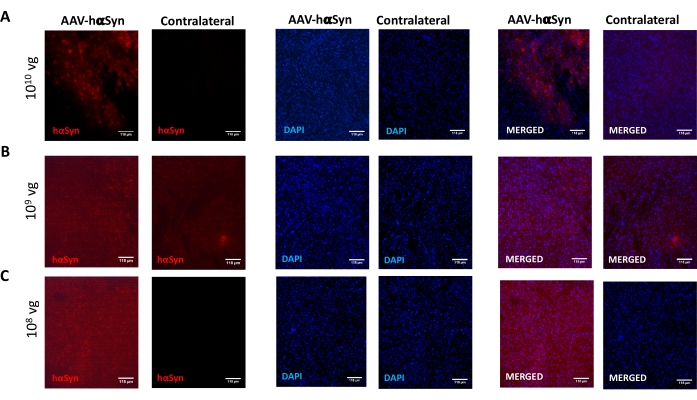
איור 2: ניתוח של ביטוי α-סינוקלאין אנושי ב-SN של עכברים שטופלו במינונים שונים של AAV-hαSyn. עכברים קיבלו AAV-hαSyn ב-(A) 1 x 1010 10 vg/mouse, (B) 1 x 109 vg/mouse, או (C) 1 x 108 vg/mouse ו-12 שבועות לאחר מכן הוקרבו, וביטוי hαSyn נותח על ידי אימונופלואורסצנציה ב-SN באמצעות מיקרוסקופיה אפיפלואורסצנטית. הגרעינים היו מוכתמים ב-DAPI. מוצגות תמונות מייצגות של כתמים ממוזגים או יחידים של hαSyn (אדום) או DAPI (כחול). סרגלי קנה מידה הם 118 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
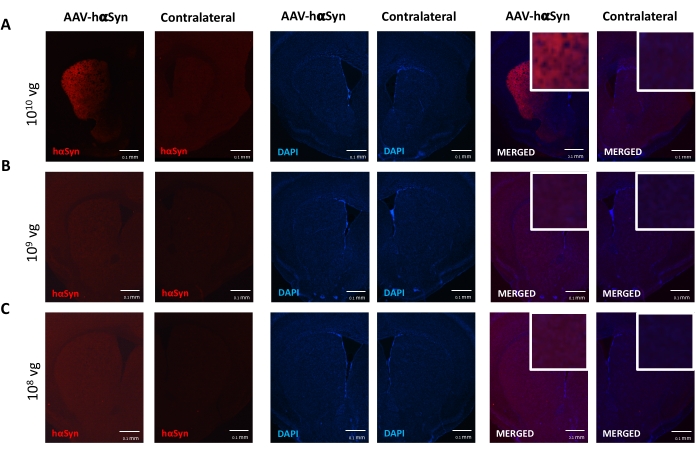
איור 3: ניתוח ביטוי α-סינוקלאין אנושי בסטריאטום של עכברים שטופלו במינונים שונים של AAV-hαSyn. עכברים קיבלו AAV-hαSyn ב-(A) 1 x 1010 10 vg/mouse, (B) 1 x 109 vg/mouse, או (C) 1 x 108 vg/mouse) ו-12 שבועות לאחר מכן הוקרבו, וביטוי hαSyn נותח על ידי אימונופלואורסצנציה בסטריאטום באמצעות מיקרוסקופיה אפיפלואורסצנטית. הגרעינים היו מוכתמים ב-DAPI. מוצגות תמונות מייצגות של כתמים ממוזגים או יחידים של hαSyn (אדום) או DAPI (כחול). סרגלי קנה מידה הם 100 מיקרומטר. ההוספה בפינה השמאלית העליונה של התמונות הממוזגות מציגה אזור עניין בהגדלה גבוהה יותר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
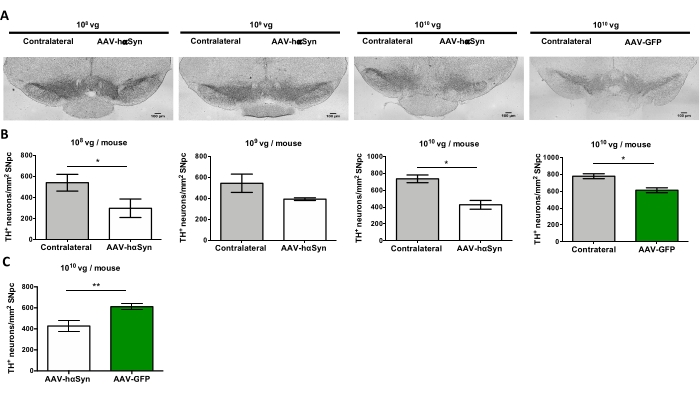
איור 4: אובדן נוירונים דופמינרגיים של ה-SN בעכברים שטופלו במינונים שונים של AAV-hαSyn או וקטור בקרה. עכברים קיבלו AAV-hαSyn (1 x 1010 vg/mouse, 1 x 109 vg/mouse, או 1 x 108 vg/mouse) או AAV-GFP (1 x 1010 vg/mouse) ו-12 שבועות לאחר מכן הוקרבו, ו-TH נותח ב-SNpc על ידי אימונוהיסטוכימיה. (א) תמונות מייצגות. סרגלי קנה מידה, 100 מיקרומטר( B,C) צפיפות הנוירונים כומתה כמספר תאי העצב של TH+ / מ"מ2. הנתונים מייצגים ממוצע ± SEM. n = 3-8 עכברים לכל קבוצה. (B) השוואה של ipsilateral עם צדדים קונטרלטרליים בוצעה באמצעות מבחן t של סטודנט דו-זנב זוגי. (C) נערכה השוואה של צדדים איפסילטרליים מעכברים שקיבלו 1 x10 10 vg/mouse של AAV-hαSyn או AAV-GFP. (ב,ג) בעוד שפסים לבנים מציינים את הכימות של נוירוני TH+ בצד האיפסילטרלי של עכברים המקבלים AAV-hαSyn, פסים ירוקים מציינים את הכימות של נוירוני TH+ בצד האיפסילטרלי של עכברים המקבלים AAV-GFP. פסים אפורים מציינים את הכימות של נוירוני TH+ בצד הקונטרה-צדדי של הקבוצה המתאימה. ההשוואות בוצעו על ידי מבחן t של סטודנט בעל שני זנבות לא מזווגים. *עמ' < 0.05; **עמ' < 0.01. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
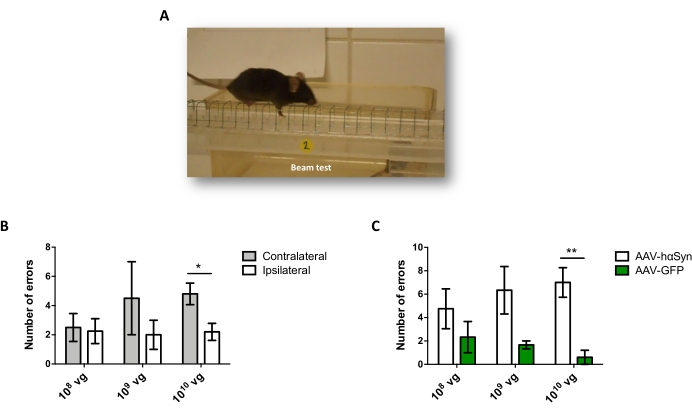
איור 5: ניתוח הביצועים המוטוריים בעכברים שטופלו במינונים שונים של AAV-hαSyn. עכברים קיבלו מינונים שונים (1 x 1010 vg/mouse, 1 x 109 vg/mouse, או 1 x 108 vg/mouse) של AAV-hαSyn או AAV-GFP, ו-12 שבועות לאחר מכן, ביצועי המנוע הוערכו על ידי בדיקת הקרן. (A) תמונה של עכבר הולך על הקורה. (B) מספר השגיאות שבוצעו על ידי גפיים שמאליות (קונטרלטרליות) לעומת גפיים ימניות (ipsilateral) כומת בקבוצות העכברים שקיבלו AAV-hαSyn. (C) המספר הכולל של השגיאות הושווה בין קבוצות ניסוי שונות שקיבלו את אותו מינון של AAV-hαSyn או AAV-GFP. הנתונים מייצגים ממוצע ± SEM. n = 3-5 עכברים לכל קבוצה. ההשוואות בוצעו על ידי (B) מבחן t של סטודנט בעל שני זנבות זוגיים או על ידי (C) מבחן t של סטודנט בעל שני זנבות לא מזווגים. *עמ' < 0.05; **עמ' < 0.01. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
הגדרת הקינטיקה של מודל מחלת הפרקינסון המושרה על ידי AAV-αSyn
לאחר קביעת המינון הנכון של AAV-hαSyn המשמש להשראת רמה משמעותית של ניוון עצבי ופגיעה מוטורית, נערכו ניסויים להגדרת הופעת ביטוי יתר של hαSyn. לשם כך, עכברים טופלו עם 1 x 1010 10 vg / עכבר של AAV-hαSyn או ניתוח sham. היקף הביטוי hαSyn נותח ב-SN פעם בשבוע במהלך שבועות 2-5 לאחר הניתוח הסטריאוטקסי (ראו את התכנון הניסיוני באיור המשלים 2). התוצאות מראות שלמרות שהבעת hαSyn זוהתה ברמות נמוכות כבר שבועיים לאחר הניתוח, אשכולות hαSyn הופיעו בשבוע 5 לאחר הניתוח הסטריאוטקסי (איור 6).

איור 6: ניתוח מהלך הזמן של ביטוי α-סינוקלאין אנושי ב-SN של עכברים שטופלו ב-AAV-hαSyn. עכברים קיבלו AAV-hαSyn (1 x 1010 vg/mouse) או רק את הניתוח הסטריאוטקסי המביש, והביטוי של hαSyn ב-SN נותח (A) 2 שבועות, (B) 3 שבועות, (C) 4 שבועות, או (D) 5 שבועות לאחר מכן על ידי אימונופלואורסצנציה באמצעות מיקרוסקופיה אפיפלואורסצנטית. הגרעינים היו מוכתמים ב-DAPI. מוצגות תמונות מייצגות של כתמים ממוזגים או יחידים של hαSyn (אדום) או DAPI (כחול). סרגלי קנה מידה, 100 מיקרומטר. ההוספה בפינה השמאלית העליונה של התמונות הממוזגות מציגה אזור עניין בהגדלה גבוהה יותר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
לאחר מכן, נערכו ניסויים כדי לקבוע את נקודות הזמן המתאימות לניתוח דלקת עצבית וחדירת תאי T במערכת העצבים המרכזית (CNS) לאחר המסירה הסטריאוטקסית של AAV-hαSyn. כדי לקבוע את שיא ההפעלה המיקרוגליאלית לאחר הטיפול בעכברים עם AAV-hαSyn, היקף התאים המבטאים רמות גבוהות של Iba1 בסטריאטום הוערך פעם בשבוע במהלך שבועות 2-15 לאחר הניתוח הסטריאוטקסי. התוצאות מראות עלייה משמעותית בהפעלה המיקרוגליאלית של הצד האיפסילטרלי בהשוואה לצד הקונטרה-צדדי של עכברים 15 שבועות לאחר הטיפול ב-AAV-hαSyn (איור 7). מספר תאי ה-Treg (CD4+ Foxp3+) שחדרו ל-SNpc הוערך גם הוא בנקודות זמן שונות לאחר שההעברה הסטריאוטקסית של AAV-hαSyn על ידי אימונופלואורסצנציה עקבה אחר תצפית מיקרוסקופיה קונפוקלית. התוצאות מראות ששיא חדירת ה-Treg ל-SNpc היה 11 שבועות לאחר הניתוח, בעוד שהיקף חדירתו של טרג לאזור זה במוח היה נמוך יותר בשבוע 8 או בשבוע 13 לאחר הניתוח (איור 8). לא זוהו תאי CD4+ T החודרים לסטריאטום (נתונים שלא הוצגו). בסך הכל, תוצאות אלה מצביעות על כך שבשימוש ב-1 x10 10 10 vg/mouse של AAV-hαSyn, נקודת הזמן המתאימה ביותר לניתוח דלקת עצבית היא שבוע 15 לאחר הניתוח הסטריאוטקסי, בעוד שנקודת זמן נכונה לניתוח חדירת תאי T למערכת העצבים המרכזית נראית כשבוע 11 לאחר טיפול AAV-hαSyn.
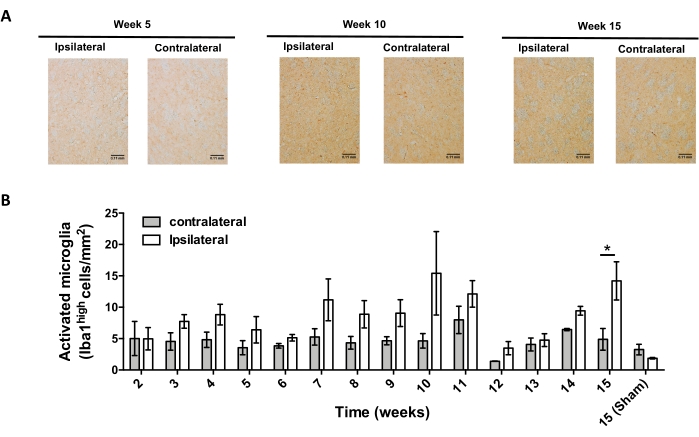
איור 7: ניתוח מהלך הזמן של הפעלה מיקרוגליאלית בעכברים שחוסנו ב-AAV-hαSyn. עכברים קיבלו AAV-hαSyn (1 x 1010 vg/mouse), והפעלה מיקרוגליאלית הוערכה על ידי ניתוח אימונוהיסטוכימי של Iba1 בסטריאטום בנקודות זמן שונות לאחר הניתוח. (A) מוצגות תמונות סקירה מייצגת של ניתוח אימונוהיסטוכימי של Iba1 מעכברים שהוקרבו 5 שבועות, 10 שבועות או 15 שבועות לאחר החיסון עם AAV-hαSyn. סרגלי קנה מידה, 110 מיקרומטר. (B) צפיפות המיקרוגליה הפעילה כומתה כמספר התאים המבטאים רמות גבוהות של Iba1 וצורת אמבואיד לכל אזור. הנתונים מייצגים ממוצע ± SEM. n = 3 עכברים לכל קבוצה. מבחן t של סטודנט זוגי בעל שני זנבים שימש לקביעת הבדלים סטטיסטיים בין Iba1 איפסילטרלי וקונטרלטרלי בכל קבוצה. *עמ' < 0.05. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
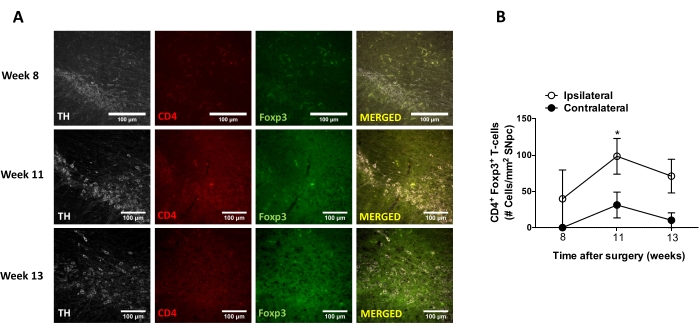
איור 8: ניתוח מהלך הזמן של חדירת תאי T מסוג CD4+ ל-SN של עכברים שחוסנו ב-AAV-hαSyn. עכברי הכתבים של Foxp3gfp קיבלו AAV-hαSyn (1 x 1010 vg/mouse). נוכחותם של תאי T מסוג CD4+ המבטאים את Foxp3 ונוכחותם של תאי עצב מסוג TH+ נותחו בנקודות זמן שונות (שבוע 8, שבוע 11 ושבוע 13 לאחר הניתוח) ב-SN על ידי אימונופלואורסצנציה. (A) מוצגות תמונות מייצגות עבור חיסון יחיד או מיזוג. סרגלי קנה מידה, 100 μm. (B) מספר תאי ה-T של CD4+ Foxp3+ לכל אזור ב-SN כומת. הנתונים מייצגים ממוצע ± SEM מ-3 עכברים לכל קבוצה. *p<0.05, תאי T ipsilateral לעומת תאי T מסוג CD4+ Foxp3+ מנוגדים על ידי מבחן t של סטודנט בעל שני זנבות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
איור משלים 1: תכנון ניסיוני להערכת ההשפעה של מינונים שונים של וקטורים של AAV על פתולוגיה של סינוקלאין, ניוון עצבי ופגיעה מוטורית. עכברי C57BL/6 זכרים מסוג בר הורדו וקיבלו חיסון סטריאוטקסי במינונים שונים (1 x 1010 vg/mouse, 1 x 109 vg/mouse, או 1 x 108 vg/mouse) של AAV המקודד α-סינוקלאין אנושי (AAV-hαSyn) או eGFP (AAV-GFP) בשליטת מקדם ה-CBA לתוך הסובסטנטיה ניגרה הימנית (SN). לאחר 12 שבועות, הביטוי של GFP ו-hαSyn ב-SN ובסטריאטום (Str) הוערך על ידי אימונופלואורסצנציה (IF), תאי טירוזין הידרוקסילאז חיוביים (TH+) כומתו על ידי אימונוהיסטוכימיה (IHC) ב-SN, והביצועים המוטוריים הוערכו על ידי בדיקת הקרן. מספר העכברים בכל קבוצת ניסוי מצוין בסוגריים. * מציין קבוצות שבהן עכבר אחד מת לפני הניתוחים. כל ניתוח מציין בסוגריים את מספר האיור מגוף המאמר שבו מוצגות התוצאות המתאימות. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 2: תכנון ניסיוני לקביעת הקינטיקה של חדירת תאי T, דלקת עצבית וביטוי hαSyn. עכברי הכתבים של Foxp3gfp הורדו מורדמים וקיבלו חיסון סטריאוטקסי של AAV (1 x 1010 vg/mouse) המקודד α-סינוקלאין אנושי (AAV-hαSyn) תחת שליטתו של מקדם ה-CBA לתוך ניתוח ה-substantia nigra (SN) או ה-sham (PBS). עכברים הוקרבו בנקודות זמן שונות, והביטוי של hαSyn ב-SN ובסטריאטום הוערך על ידי אימונופלואורסצנציה (IF), GFP (Foxp3), CD4 וטירוזין הידרוקסילאז חיובי (TH+) תאים כומתו על ידי IF ב-SN, וביטוי Iba1 נותח על ידי אימונוהיסטוכימיה (IHC) בסטריאטום (Str). מספר העכברים בכל קבוצת ניסוי מצוין. טווח נקודות הזמן הכלולות בכל ניתוח מצוין. כל ניתוח מציין בסוגריים את מספר האיור מגוף המאמר שבו מוצגות התוצאות המתאימות. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
מודל העכברים של ניוון עצבי שנותח כאן עשוי לסייע בחקר היבטים קריטיים רבים המעורבים בפתופיזיולוגיה של מחלת פרקינסון, כולל המנגנונים המעורבים בפתולוגיה של αSyn והפעלה מיקרוגליאלית, המעורבות של מערכת החיסון ההיקפית בוויסות של דלקת עצבית, ומנגנוני הניוון העצבי. בין המנגנונים המעורבים בפתולוגיה של αSyn הם אותם מנגנונים תת-תאיים הקשורים לתפקוד מיטוכונדריאלי, ליזוזומלי או פרוטאסומלי בנוכחות עומס מוגזם של αSyn בתאי העצב הדופמינרגיים של SN2. חשוב לקחת בחשבון שבנוסף לביטוי hαSyn המושרה על ידי התמרה בתיווך AAV, העכבר האנדוגני αSyn תורם גם הוא לעומס של ביטוי αSyn הכולל. עכברים מהונדסים המבטאים יתר על המידה עכבר αSyn מפתחים פתולוגיה סינוקלאינית דומה, נוירופתולוגיה ופגיעה מוטורית למודלים של עכברים המבוססים על ביטוי יתר של hαSyn32. בנוגע להפעלה מיקרוגליאלית, מודל העכבר הנוכחי עשוי לשמש כדי לחקור כיצד שחקנים מולקולריים ותאיים שונים כגון ציטוקינים, נוירוטרנסמיטורים, אסטרוציטים, נוירונים, מחסום הדם-מוח ותאי T עשויים לווסת את הרכישה של פנוטיפים פונקציונליים פרו-דלקתיים או אנטי-דלקתיים 8,10,11 . מודל זה מהווה גם כלי חשוב לחקר תפקידה של מערכת החיסון ההיקפית, כולל לא רק תאי T אלא גם מקרופאגים, מונוציטים ונייטרופילים, על תהליכי הדלקת העצבים והניוון העצבי של נוירונים ניגרליים 11,33,34. לבסוף, מודל עכבר זה מייצג גם מערכת רבת ערך לחקר המנגנונים התאיים והמולקולריים של ניוון עצבי in vivo, כולל אלה המושרים על ידי תהליכים תאיים פנימיים, כגון עקה חמצונית, ליקויים באנרגיה ואברונים פגומים 2, או אלה המופעלים על ידי שחקנים חיצוניים, כגון גורמים נוירוטוקסיים המיוצרים על ידי תאים מיקרוגליאליים, אסטרוציטים ותאי T ציטוטוקסיים8, 28,29,35.
מגבלה של מודל עכבר זה היא המחקר של האופן שבו הצבירה הפתולוגית של αSyn במיקומים חוץ-מוחיים עשויה להוות את השלבים הראשונים בהתפתחות מחלת פרקינסון36. בהקשר זה, ישנן עדויות הולכות וגוברות המצביעות על כך שלפני הניוון העצבי של נוירונים ניגרליים ופגיעה מוטורית, הפתולוגיה של αSyn מתחילה ברירית המעיים ובאפיתל חוש הריח36, וככל הנראה גם בתגובת תאי ה-T הספציפיים ל-αSyn12. לאחר מכן, אגרגטים של αSyn היו נודדים דרך עצב הוואגוס אל גזע המוח, ומפעילים את הדלקת העצבית והניוון העצבי של נוירונים דופמינרגיים12. למרות שמודל AAV-hαSyn משחזר את רוב ההיבטים של מחלת פרקינסון, אין מעורבות ניכרת של הצבירה הפתולוגית של αSyn במיקומים חוץ-מוחיים במודל זה. מודל חלופי הכולל פתולוגיה של hαSyn המתאים לחקר היבטים אלה של מחלת פרקינסון עשוי להיות עכברים מהונדסים המבטאים יתר על המידה את hαSyn תחת שליטתו של מקדם Thy1, מודל Thy1-SNCA37, שבו התפתחות המחלה תלויה במיקרוביוטה של המעיים וכוללת פגיעה ניכרת במערכת העיכול38.
למרות שזה מועיל לחקר התהליכים המגוונים הקשורים לפתופיזיולוגיה של מחלת פרקינסון, מודל העכבר הנוכחי כולל צעדים קריטיים שיש לבדוק בדקדקנות, כולל העברה נכונה של הווקטורים הנגיפיים בקואורדינטות המרחביות המתאימות, הביטוי הסלקטיבי של hαSyn בתאי עצב (התלוי בסרוטיפ AAV ובמבנה הווקטורי), ומינון ותזמון AAV תקינים לפני ניתוח הפנוטיפ הפרקינסון. ניתוח המסירה הנכונה של הווקטורים הנגיפיים ב- SN הוא הכרחי, שכן השימוש בקואורדינטות המרחביות הנכונות של ה- SN עשוי שלא להספיק כאשר המחט אינה ישרה לחלוטין, שלעתים אינה מורגשת לעין האנושית. יתר על כן, הדיפוזיה של וקטורי AAV תלויה בסרוטיפ AAV39. מסיבות אלה, יש צורך לבצע בקרות איכות תקופתיות הבודקות את המסירה הנכונה והדיפוזיה של וקטורי AAV-GFP המוזרקים בעקבות תצפית של GFP בפרוסות מוח המכילות את שטח ה- SN.
לגבי הביטוי הסלקטיבי של hαSyn בתאי עצב, באופן עקרוני, הביטוי של hαSyn יכול להיות מהונדס להיות נשלט על ידי מקדם סלקטיבי עבור נוירונים או, אפילו יותר מדויק, סלקטיבי עבור נוירונים דופמינרגיים, כגון השימוש של מקדם TH בווקטורים AAV כדי לגרום לביטוי סלקטיבי של גנים בתאי עצב דופמינרגיים40 . עם זאת, אסטרטגיה זו אינה פועלת כאשר מה שמתבקש הוא ביטוי יתר של הגן של העניין. מסיבה זו, במודל הנוכחי, חיוני להשתמש במקדם חזק (מקדם הגורם לביטוי גבוה של הגן במורד הזרם) ובסרוטיפים של AAV עם טרופיזם עצבי. במחקר זה, מקדם ה- CBA שימש כמקדם חזק כדי לגרום לביטוי יתר של hαSyn, והסרוטיפ AAV5 שימש לווקטור הנגיפי. סרוטיפ זה שימש בעבר לתמרת נוירונים של עכברים וחולדות41,42. כאן, התוצאות הראו כי 12 שבועות לאחר מסירת AAV5-GFP ב-SN של עכברים, הפלואורסצנציה הירוקה הייתה נוכחת באופן סלקטיבי הן בצד האיפסילטרלי של ה-SN והן של הסטריאטום (איור 1), מה שמצביע על התמרה יעילה של נוירונים של המסלול הניגרוסטריאלי.
היבט קריטי נוסף של מודל העכבר הזה של מחלת פרקינסון הוא נקודת הזמן הנדרשת לניתוח תהליך מסוים לאחר הניתוח. בהקשר זה, עבודה זו מראה מחקר קינטי של תהליכים שונים המעורבים בפתולוגיה. מאחר שנקודות זמן מרכזיות משתנות עם המינון של הגנומים הנגיפיים הניתנים לכל עכבר, הסרוטיפ של AAV שבו נעשה שימוש, או אפילו עם אצווה של AAV בשימוש, בוצע תחילה ניתוח מינון-תגובה של כמות ה-AAV-αSyn הנדרשת כדי לגרום לאובדן משמעותי של נוירוני TH+ ולפגיעה מוטורית. מחקרים קודמים הראו פגיעה מוטורית משמעותית ואובדן נוירוני TH+ של המסלול הניגרוסטריאלי לאחר 12 שבועות של זריקות AAV-αSyn בעכברים במינונים הנעים בין 6 x 108-3 x 1010 גנומים ויראליים לכל עכבר 16,17,30,31. בהתאם לכך, המינון של AAV-hαSyn ששימש להשראת ביטוי hαSyn במסלול הניגרוסטריאלי, אובדן נוירוני TH+ ופגיעה מוטורית בעכברים נעו בין 1 x 108-1 x 1010 10 גנומים נגיפיים לכל עכבר. יתר על כן, כדי לשלוט בכך שאובדן נוירוני TH+ ופגיעה מוטורית הושרו על ידי ביטוי יתר של hαSyn ב- SN ולא על ידי זיהום AAV של נוירונים של SN, נכללו קבוצות ביקורת שבהן קידוד AAV עבור גן מדווח (AAV-eGFP) נמסר באופן חד צדדי ב- SN של עכברים ונקבעו ניוון עצבי ופגיעה מוטורית. התוצאות הראו ש-12 שבועות לאחר הניתוח הסטריאוטקסי, 1 x 1010 גנומים נגיפיים לכל עכבר היו מינון תקין של AAV5-hαSyn, שכן עכברים שקיבלו את העומס הנגיפי הזה הראו hαSyn משמעותי במסלול הניגרוסטריאטלי (איור 2 ואיור 3), אובדן נוירוני TH+ (איור 4) ופגיעה מוטורית (איור 5). לעומת זאת, מינונים נמוכים יותר של AAV5-hαSyn (1 x 108 גנומים נגיפיים לעכבר ו-1 x 109 גנומים נגיפיים לכל עכבר) לא היו חזקים מספיק כדי להגיע לשינויים משמעותיים בכל הפרמטרים האלה יחד (איורים 2-4). יש לציין כי מתן AAV-GFP ב-1 x 1010 10 גנומים נגיפיים לכל עכבר גרם לרמה נמוכה (כ-20%), אך משמעותית של אובדן תאי עצב מסוג TH+ של נוירונים דופמינרגיים ניגריים (איור 4A,B). תוצאה זו מסכימה עם תצפיות קודמות שהשתמשו במודל זה41 והיא ככל הנראה תוצאה של רמה נמוכה של דלקת עצבית המושרה על ידי מתן וקטורי AAV ב- SN. אף על פי כן, היקף האובדן של תאי עצב מסוג TH+ היה גבוה משמעותית בעכברים שקיבלו AAV5-hαSyn בהשוואה לאלה שקיבלו את אותו מינון של AAV-GFP (איור 4C). יש לציין כי הקינטיקה של ביטוי hαSyn תלויה לא רק ביעילות ההעתקה אלא גם בהיקף הדיפוזיה של AAV39. מאחר שדיפוזיית AAV תלויה בסרוטיפ AAV, נקודות הזמן המדויקות של המפתח במודל חייתי זה עשויות להשתנות בעת שימוש בסרוטיפ AAV אחר השונה מ-AAV5.
לאחר מכן, נערך ניתוח קינטי באמצעות 1 x 1010 10 גנומים נגיפיים לכל עכבר כדי לקבוע נקודות זמן מרכזיות במודל העכבר הזה. מכיוון שהראיות הנוכחיות הראו כמה תסמינים מוקדמים המופיעים לפני פגיעה מוטורית, אשר יאפשרו אבחון מוקדם של מחלת פרקינסון43,44, ניסויים אלה ביקשו למצוא את נקודת הזמן שבה ביטוי hαSyn כבר ניכר אך בהיעדר פגיעה מוטורית. התוצאות מראות כי הופעת הביטוי hαSyn ב-SN הייתה ב-5 שבועות לאחר המסירה הסטריאוטקסית של AAV-hαSyn (איור 6). נקודת זמן זו מהווה נקודה טמפורלית מעניינת להתחיל במתן טיפולים המותאמים לעצירת התהליכים הנוירו-דלקתיים והנוירודגנרטיביים. נקודות זמן מרכזיות נוספות שנקבעו כאן היו זמני השיא של שני אירועים קריטיים הקשורים לתהליך הדלקת העצבית: הזמן שבו המיקרוגליה מגיעה לדרגת ההפעלה המרבית וזמן החדירה המקסימלית של תאי T לתוך ה-SN. התוצאות הראו עקומה עם מגמה המגיעה לשני גלים של הפעלה מיקרוגליאלית מקסימלית, הראשון ב-10 שבועות לאחר הניתוח והשני ב-15 שבועות לאחר הניתוח (איור 7). הניתוח הקינטי של חדירת תאי T הראה את זמן השיא של חדירת Treg ל-SN ב-11 שבועות לאחר הניתוח הסטריאוטקסי (איור 8). באופן מפתיע, לא זוהו תאי T משפיעים (CD4+ Foxp3-) שחודרים ל-SN במהלך מסגרת הזמן שנותחה (שבועות 8-13 לאחר הניתוח). בסך הכל, תוצאות אלה מצביעות על פרק זמן מתאים להתחלת מתן טיפולים המיועדים לעצירת תהליך הדלקת העצבית והחלשת חדירת תאי T ל-SN באמצעות מודל פרה-קליני זה, שנע בין שבוע 5 לאחר הניתוח (תחילת ביטוי יתר של hαSyn) לבין שבוע 10 לאחר הניתוח (הגל הראשון של דלקת עצבית והסתננות תאי T) (איור 9).
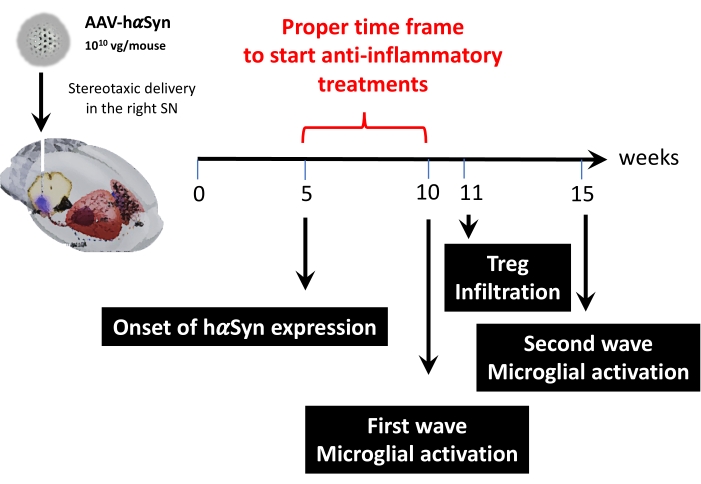
איור 9: סיכום של נקודות הזמן העיקריות שנמצאו עבור מודל זה של בעלי חיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Disclosures
המחברים מצהירים כי המחקר נערך בהיעדר אינטרסים מתחרים כספיים או לא פיננסיים.
Acknowledgements
אנו מודים לד"ר סבסטיאן ולנצואלה ולד"ר מיכאלה ריקה על הסיוע הווטרינרי החשוב שלהם במתקן בעלי החיים שלנו. עבודה זו נתמכה על ידי "Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID" Centro Ciencia &Vida, FB210008 (to Fundación Ciencia &Vida), והמרכז Geroscience לבריאות המוח ומטבוליזם, FONDAP-15150012. עבודה זו מומנה גם על ידי מענקים FONDECYT-1210013 (ל- R.P.) ו- FONDECYT-1150766 (ל- F.C.) מ-"Agencia Nacional de Investigación y Desarrollo de Chile (ANID)" ו- MJFF-10332.01 (ל- R.P.) ו- MJFF-17303 (ל- F.C.) מקרן מייקל ג'יי פוקס לחקר פרקינסון.
Materials
| Name | Company | Catalog Number | Comments |
| ANIMALS AND ANIMAL FOOD | |||
| Foxp3-GFP C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 023800 | |
| Laboratory Rodent Diet | LabDiet | Rodent Diet 5001 | Standard Rodent diet |
| Wild-type C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 000664 | |
| VIRAL VECTORS | |||
| AAV5-CBA-αSyn | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 10E13 vg/mL |
| AAV5-CBA-eGFP | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 9.5 x 10E12 vg/mL |
| ANESTHETICS AND ANALGESICS | |||
| Isoflurane | Baxter | 218082 | 1% for stereotaxic surgery |
| Ketamine | Drag Pharma | CHE30 | 70 mg/Kg for stereotaxic surgery |
| Sevoflurane | Baxter | VE2L9117 | For before transcardial perfusion |
| Tramadol | Drag Pharma | DPH134 | 30 mg/Kg every 24 h |
| Xylazine | Centrovet | EHL40 | 9 mg/kg for stereotaxic surgery |
| EQUIPMENT | |||
| Beam test | Home made | N/A | horizontal beam 25 cm length and 3 cm width. The beam surface was covered by a metallic grid (1 cm2). |
| Cryostate | Leica | CM1520 | |
| Digital camera | Nikon | S2800 Coolpix | For recording the beam test performance |
| Microscope | Olympus | BX51 | Used for IHC analysis (section 4.4) |
| Microscope | Olympus | IX71 | Used for IF analysis (section 5.3) |
| Microscope | Leica | DMI8 | Used for IF analysis (section 5.7) |
| New Standard Stereotaxic, mouse | Stoelting, Wood Dale, IL, USA | 51500 | stereotaxic frame for surgery |
| Peristaltic Pump | Masterflex | C-flex L/S16 | |
| Power supply unit | Olympus | U-RFL-T | Used for IF analysis (section 5.3) |
| Surgical suture | Sylkam®, B Braun | C0760171 | |
| Syringe 100 U | BD | 324918 | For anesthesia before transcardial perfusion, 29G needle |
| Syringe RN 5uL SYR W/O NEEDLE | Hamilton | HA-7641-01 | For viral vector innoculation |
| BUFFERS AND REAGENTS | |||
| Aviden, Peroxidase Conjugate | Merck, Darmstadt, Germany | 189728 | |
| Bovine Serum Albumin | Merck, Darmstadt, Germany | 9048-46-8 | |
| Cryotrotection buffer | Home made | N/A | 20% glycerine and 2% DMSO in PBS |
| DAPI | Abcam | ab228549 | |
| Diaminobenzidine | Merck, Darmstadt, Germany | D8001 | |
| Fluoromount -G T | Electron Microscopy Science | 17984-25 | |
| Gelatin | Merck, Darmstadt, Germany | 104078 | |
| Normal goat serum | Jackson ImmunoResearch Laboratory | 5000121 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 104005 | |
| PBS | Home made | N/A | 0.125 M, pH 7.4 |
| Peroxidase inactivating buffer | Home made | N/A | 0.03% H2O2 in methanol |
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| Trizma Hydrochloride | Merck, Darmstadt, Germany | 1185-53-1 | |
| Tween 20 | Sigma-Aldrich | 822184 | |
| ANTIBODIES | |||
| Biotin-SP (long spacer) AffiniPure Goat Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch Laboratory | 111065003 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11010 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 647 | ThermoFisher Scientific | A21244 | |
| Goat anti-Rat IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11081 | |
| Rabbit monoclonal anti-alpha-Synuclein | Abcam | ab138501 | |
| Rabbit monoclonal anti-Iba-1 | Abcam | EPR16588 | |
| Rabbit polyclonal anti-Tyrosine Hydroxylase | Millipore | AB152 | |
| Rat monoclonal anti-CD4 | Biolegend | 100402 | |
| SOFTWARES | |||
| GraphPad | Prism | 6.0 | Fos stats analysis |
| ImageJ | National Institute of Health | N/A | For image analysis |
| LAS X | Leica | N/A | For image capture with Leica microscope |
| ProgRes Capture Pro | Jenoptik | N/A | For image capture with Olympus microscope |
| VLC media player | VideoLAN Organization | N/A | For analysis of behavioural tests |
References
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiology of Aging. 24 (2), 197-211 (2003).
- Lim, K. L., Zhang, C. W. Molecular events underlying Parkinson's disease - An interwoven tapestry. Frontiers in Neurology. 4, 33(2013).
- Abdelmotilib, H., et al. α-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Mori, F., et al. Relationship among alpha-synuclein accumulation, dopamine synthesis, and neurodegeneration in Parkinson disease substantia nigra. The Journal of Neuropathology & Experimental Neurology. 65 (8), 808-815 (2006).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson's disease. Biochimica et Biophysica Acta. 1802 (1), 29-44 (2010).
- Vazquez-Velez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44, 87-108 (2021).
- Dehay, B., et al. Lysosomal impairment in Parkinson's disease. Movement Disorders. 28 (6), 725-732 (2013).
- Gonzalez, H., Elgueta, D., Montoya, A., Pacheco, R. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases. Journal of Neuroimmunology. 274 (1-2), 1-13 (2014).
- Pacheco, R. T-cell based immunotherapies for Parkinson's disease. Exploration of Neuroprotective Therapy. 1 (2), 72-85 (2021).
- Gonzalez, H., Contreras, F., Pacheco, R. Regulation of the neurodegenerative process associated to Parkinson's disease by CD4+ T-cells. Journal of Neuroimmune Pharmacology. 10 (4), 561-575 (2015).
- Gonzalez, H., Pacheco, R. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases. Journal of Neuroinflammation. 11 (1), 201(2014).
- Campos-Acuna, J., Elgueta, D., Pacheco, R. T-cell-driven inflammation as a mediator of the gut-brain axis involved in Parkinson's disease. Frontiers in Immunology. 10, 239(2019).
- Blesa, J., Phani, S., Jackson-Lewis, V., Przedborski, S. Classic and new animal models of Parkinson's disease. Journal of Biomedicine and Biotechnology. 2012, 845618(2012).
- Ulusoy, A., Decressac, M., Kirik, D., Bjorklund, A. Viral vector-mediated overexpression of alpha-synuclein as a progressive model of Parkinson's disease. Progress in Brain Research. 184, 89-111 (2010).
- Gomez-Benito, M., et al. Modeling Parkinson's disease with the alpha-synuclein protein. Frontiers in Pharmacology. 11, 356(2020).
- Song, L. K., et al. Targeted overexpression of alpha-synuclein by rAAV2/1 vectors induces progressive nigrostriatal degeneration and increases vulnerability to MPTP in mouse. PLoS One. 10 (6), 0131281(2015).
- Theodore, S., Cao, S., McLean, P. J., Standaert, D. G. Targeted overexpression of human alpha-synuclein triggers microglial activation and an adaptive immune response in a mouse model of Parkinson disease. Journal of Neuropathology and Experimental Neurology. 67 (12), 1149-1158 (2008).
- Sanchez-Guajardo, V., Annibali, A., Jensen, P. H., Romero-Ramos, M. alpha-Synuclein vaccination prevents the accumulation of parkinson disease-like pathologic inclusions in striatum in association with regulatory T cell recruitment in a rat model. Journal of Neuropathology and Experimental Neurology. 72 (7), 624-645 (2013).
- Sanchez-Guajardo, V., Febbraro, F., Kirik, D., Romero-Ramos, M. Microglia acquire distinct activation profiles depending on the degree of alpha-synuclein neuropathology in a rAAV based model of Parkinson's disease. PLoS One. 5 (1), 8784(2010).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular Neurodegeneration. 8, 44(2013).
- Cho, C., et al. Evaluating analgesic efficacy and administration route following craniotomy in mice using the grimace scale. Scientific Reports. 9 (1), 359(2019).
- Flecknell, P. Laboratory Animal Anaesthesia. 3rd Ed. , ElsevierAcademic Press. Cambridge, MA. (2009).
- Bind, R. H., Minney, S. M., Rosenfeld, S., Hallock, R. M. The role of pheromonal responses in rodent behavior: Future directions for the development of laboratory protocols. Journal of the American Association for Laboratory Animal Science. 52 (2), 124-129 (2013).
- Paxinos, G., Franklin, K. B. J. The Mouse Brain in Stereotaxic Coordinates. , Academic Press. Cambridge, MA. (2001).
- Elgueta, D., et al. Dopamine receptor D3 expression is altered in CD4+ T-cells from Parkinson's disease patients and its pharmacologic inhibition attenuates the motor impairment in a mouse model. Frontiers in Immunology. 10, 981(2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Fernandez-Suarez, D., et al. The monoacylglycerol lipase inhibitor JZL184 is neuroprotective and alters glial cell phenotype in the chronic MPTP mouse model. Neurobiology of Aging. 35 (11), 2603-2616 (2014).
- Elgueta, D., et al. Pharmacologic antagonism of dopamine receptor D3 attenuates neurodegeneration and motor impairment in a mouse model of Parkinson's disease. Neuropharmacology. 113, 110-123 (2017).
- Montoya, A., et al. Dopamine receptor D3 signalling in astrocytes promotes neuroinflammation. Journal of Neuroinflammation. 16 (1), 258(2019).
- Williams, G. P., et al. Targeting of the class II transactivator attenuates inflammation and neurodegeneration in an alpha-synuclein model of Parkinson's disease. Journal of Neuroinflammation. 15 (1), 244(2018).
- Benskey, M. J., et al. Silencing alpha synuclein in mature nigral neurons results in rapid neuroinflammation and subsequent toxicity. Frontiers in Molecular Neuroscience. 11, 36(2018).
- Rieker, C., et al. Neuropathology in mice expressing mouse alpha-synuclein. PLoS One. 6 (9), 24834(2011).
- Harms, A. S., et al. alpha-Synuclein fibrils recruit peripheral immune cells in the rat brain prior to neurodegeneration. Acta Neuropathologica Communications. 5 (1), 85(2017).
- Williams, G. P., et al. CD4 T cells mediate brain inflammation and neurodegeneration in a mouse model of Parkinson disease. Brain. 144 (7), 2047-2059 (2021).
- Matheoud, D., et al. Intestinal infection triggers Parkinson's disease-like symptoms in Pink1(-/-) mice. Nature. 571 (7766), 565-569 (2019).
- Jan, A., Goncalves, N. P., Vaegter, C. B., Jensen, P. H., Ferreira, N. The prion-like spreading of alpha-synuclein in Parkinson's disease: Update on models and hypotheses. International Journal of Molecular Sciences. 22 (15), 8338(2021).
- Chesselet, M. F., et al. A progressive mouse model of Parkinson's disease: The Thy1-aSyn ("Line 61") mice. Neurotherapeutics. 9 (2), 297-314 (2012).
- Sampson, T. R., et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease. Cell. 167 (6), 1469-1480 (2016).
- Ciron, C., et al. Human alpha-iduronidase gene transfer mediated by adeno-associated virus types 1, 2, and 5 in the brain of nonhuman primates: Vector diffusion and biodistribution. Human Gene Therapy. 20 (4), 350-360 (2009).
- Ben-Shaanan, T. L., et al. Activation of the reward system boosts innate and adaptive immunity. Nature Medicine. 22 (8), 940-944 (2016).
- Albert, K., Voutilainen, M. H., Domanskyi, A., Airavaara, M. AAV vector-mediated gene delivery to substantia nigra dopamine neurons: Implications for gene therapy and disease models. Genes. 8 (2), 63(2017).
- Bordia, T., Perez, X. A., Heiss, J., Zhang, D., Quik, M. Optogenetic activation of striatal cholinergic interneurons regulates L-dopa-induced dyskinesias. Neurobiology of Disease. 91, 47-58 (2016).
- Kim, A., et al. Upgraded methodology for the development of early diagnosis of Parkinson's disease based on searching blood markers in patients and experimental models. Molecular Neurobiology. 56 (5), 3437-3450 (2018).
- Lei, H., et al. Parkinson's disease diagnosis via joint learning from multiple modalities and relations. IEEE Journal of Biomedical and Health Informatics. 23 (4), 1437-1449 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved