Method Article
ヒトα-シヌクレインをコードするアデノ随伴ウイルスベクターにより誘導されるパーキンソン病マウスモデルの解析
要約
この研究は、パーキンソン病の前臨床モデルにおける神経炎症、神経変性、および運動障害を誘発するのに必要なベクター用量および曝露時間を解析する。ヒトα−シヌクレインをコードするこれらのベクターは、パーキンソン病に関連するシヌクレイン病理を再現するために黒質に送達される。
要約
パーキンソン病は、黒質線条体経路のドーパミン作動性ニューロンの死、およびその結果、随意運動の制御の進行性の喪失を伴う神経変性障害である。この神経変性プロセスは、主にα-シヌクレインで構成される脳内のタンパク質凝集体の沈着によって引き起こされる。いくつかの研究は、神経炎症がパーキンソン病に関連する神経変性を発症するために必要であることを示した。特に、神経炎症過程は、ミクログリア活性化ならびに末梢T細胞の黒質(SN)への浸潤を含む。本研究では、ミクログリアの活性化、SNへのT細胞浸潤、黒質ドーパミン作動性ニューロンの神経変性、運動障害を再現するパーキンソン病のマウスモデルを解析する。パーキンソン病のこのマウスモデルは、ヒト野生型α−シヌクレイン(AAV−hαSyn)をコードするアデノ随伴ウイルスベクターのSNへの定位送達によって誘導される。SNへのウイルスベクターの正しい送達を、緑色蛍光タンパク質(GFP)をコードする対照ベクターを用いて確認した。その後、SNに投与されたAAV-hαSynの投与量がhαSyn発現の程度、黒質ドーパミン作動性ニューロンの喪失、および運動障害にどのように影響するかを評価した。さらに、hαSyn発現、ミクログリア活性化、およびT細胞浸潤の動態は、疾患発症の経時変化を通して決定された。したがって、この研究は、パーキンソン病のこの前臨床モデルにおけるシヌクレイン病理および神経炎症を標的とするために有用であり得る重要な時点を提供する。
概要
アルツハイマー病に次いで、パーキンソン病は世界で2番目に流行している神経変性疾患です。パーキンソン病に罹患した主要なニューロンは、ドーパミンを産生し、随意運動を制御する黒質線条体経路のニューロンである。結果として、この障害に関連する最も特徴的な症状は運動障害である。この病理はまた、シナプス前末端に関連する細胞質ゾルタンパク質であるα-シヌクレイン(αSyn)1を主成分とする脳内のタンパク質凝集体の沈着を伴う。αSynの病原性封入体の生成は、ミスフォールディングまたはこのタンパク質のいくつかの翻訳後修飾によって誘発されるという証拠が示されている2。
特に、αSyn病理とヒトパーキンソン病および動物モデルにおける黒質線条体経路のドーパミン作動性ニューロンの喪失との間に密接な関係が確立されている3,4。αSyn凝集体がどのように生成され、どのようにニューロンの死を誘発するかを理解することは、この分野で大きな課題を表しています。増え続ける研究グループは、酸化ストレスを増加させることによって、ミトコンドリア機能不全がαSyn凝集体2の生成の主要な原因の1つであることを示している。実際、パーキンソン病リスクに関連するいくつかの遺伝子は、ミトコンドリア機能、形態、およびダイナミクスに関与するタンパク質をコードする5,6。加えて、機能不全ミトコンドリアおよびミスフォールディングαSynの蓄積をもたらすリソソーム機能障害は、αSyn凝集体7の生成を促進する別の主要な事象を構成する。
新たな証拠は、αSyn凝集体が脳内に沈着すると、これらの病原性タンパク質がミクログリア上のトール様受容体(TLR)を刺激し、ミクログリア活性化および黒質(SN)における初期炎症環境を引き起こすことを示している8,9。さらに、この証拠は、αSyn凝集体が抗原提示細胞によって捕捉され、T細胞に提示され、αSyn10、11に特異的な適応免疫応答を誘導することを示している。これらのαSyn特異的T細胞は、その後脳に浸潤し、活性化ミクログリアによって再刺激され、したがってニューロン死を誘発する神経毒性因子の分泌を促進する9,10。興味深いことに、いくつかの証拠は、αSyn凝集体が最初に腸神経系で生成され、次いで迷走神経を通って脳幹12に輸送されることを示唆している。
神経毒性物質(すなわち、6-ヒドロキシドーパミン、パラコート、ロテノン、1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)の投与によって誘導されるものおよび遺伝的条件を伴うもの(すなわち、変異型α-シヌクレイン、変異型ロイシンリッチリピートキナーゼ2)13の投与によって誘導されるものを含む、パーキンソン病のいくつかの動物モデルが長年にわたって使用されてきた13.神経毒誘発性神経変性を含むモデルがパーキンソン病のいくつかの側面を複製しているにもかかわらず、それらのどれもが疾患のすべての本質的な側面を反復していないか、または進行性ではない13。一方、ロイシンリッチリピートキナーゼ2の変異バージョンの発現を含む遺伝子マウスモデルであるが、α-シヌクレインの変異バージョン、またはヒト野生型α-シヌクレインの過剰発現は運動障害をもたらし、場合によっては、シヌクレイノパシーの発症も、パーキンソン病の本質的な側面である黒質ドーパミン作動性ニューロンの顕著な神経変性を再現しない13、14。神経変性の第3の種の動物モデルは、パーキンソン病の本質的な側面のほとんどを満たすことに成功した、ヒトα−シヌクレイン(AAV−hαSyn)をコードするアデノ随伴ウイルスベクター(AAV)の定位送達である14,15。重要なことに、AAVは、哺乳類の成体脳において、高い有効性を有するニューロンの形質導入を長期的に可能にする。さらに、SNにおけるAAV−hαSynの定位送達は、αSyn病理、ミクログリア活性化、神経変性、および運動障害を含む疾患の本質的な側面の多くを再現することが示されている16、17、18、19、20。本研究は、ウイルスベクターの用量およびウイルスベクター送達後の時間が、黒質線条体経路におけるhαSyn発現、神経変性、および神経炎症の程度にどのように影響するか、ならびにSNにおけるhαSynの一方的定位送達のマウスモデルにおける運動障害の程度の分析を提示する。
プロトコル
すべての研究は、実験動物の世話と使用のためのガイドの第8版の下で実施されました。実験プロトコルは、麻酔、疼痛、苦痛、安楽死を含むものを含む、Fundación Ciencia & Vida(Science for Life Foundation)のIACUCによって承認されました(許可番号P-035/2022)。
1. 定位手術
- 手術準備(約1時間)
- 無菌環境を維持するために、手術中は、靴カバー、手術用マスク、衛生バリア、手袋、手術用キャップなど、適切な手術用服を着用してください。
- 無菌環境を維持するために、マウスおよびすべての手術材料に70%エタノールを噴霧する。
- 鎮痛を誘発するには、12時間21日ごとにカルプロフェン5mg/kgを皮下注射し(s.c.)、手術の1 時間前から手術後3日まで続けます。
- マウスを麻酔するには、動物を誘導チャンバーに入れます。イソフルラン流を0.5%の速度で開き、次いでマウスがその右反射22を失うまで約5分間にわたってそれをゆっくりと5%まで増加させる。
- 誘導チャンバーから動物を取り外します。直ちに動物を適切な大きさの鼻円錐で非再呼吸回路に移す。手術の全時間を通してイソフルラン1%でマウス麻酔を維持する。
- マウスの尾と足をつまんで完全に麻酔をかけていることを確認します。マウスが尾と足をつまむことに反応しない場合、それはマウスが完全に麻酔をかけられたことを意味します。
- はさみを使ってマウスの頭を剃ります。クロルヘキシジン2%の綿棒を使用してマウスの皮膚をきれいにし、すべての髪を取り除きます。
- マウスの頭を定位フレームに固定します。
- 綿棒を用いてマウスの両眼に角膜保護剤を置く。他のげっ歯類におけるストレス誘発を防ぐために、手術室23内の他のマウスの存在を避ける。
- 手術(約30分)
- マウスの頭を2%クロルヘキシジン3ラウンドとそれに続く70%エタノールできれいにする。外科用材料を使用して頭蓋骨を露出させ、内側の線に対して前後−2.8mm、および中側1.4mmの座標にドリルで細い穴を開ける。
- 10μLシリンジの針を穴に入れ、硬膜24に対して−7.2mm背側腹部に到達するまで、針を脳内でゆっくりと動かす。
- 組織が少し落ち着くように針を最終位置に2分間放置し、次に1 μLのAAV5-CBA-hαSyn(AAV-hαSyn)、AAV5-CBA-eGPP(AAV-GFP)、またはビヒクル(pH 7.4のPBS;偽の手術)を右黒質に0.2 μL/30秒の割合で注入する。
- ウイルスベクターの送達後5分間針を同じ位置に放置し、その後ゆっくりと引き抜く。
- 術後(約5分)
- 滅菌絹編組非吸収性縫合糸を用いて創傷を閉じる。
- マウスを電気加熱マットレス(25°C)の上に置いて予温したホームケージに入れます。
注:マウスは、問題なく歩くことができ、傷が治癒するまで、家のケージで一人で維持する必要があります。
2. ビーム試験によるモータ性能の判定
- トレーニング (マウスあたり約 15 分)
- 定位手術の12週間後、25の前に記載したビーム試験の簡略化されたバージョンを用いて運動性能を評価する。このためには、長さ25cm、幅3cmの水平ビームを使用してください。ビーム表面は、1cmの正方形の金属グリッドで覆われ、ビームから1cm上に高くなければなりません。
- グリッドサーフェスビームを、ホームケージがあるビームの一端から反対側の端まで横断するマウスのビデオを撮ります。運動性能の決定の前にマウスを2日間訓練する。
- 初日に、グリッドなしでビームを5回歩くようにマウスを訓練します。
- 2日目に、グリッドの存在下でビームを5回歩くようにマウスを訓練します。
- テスト (マウスあたり約 5 分)
- 3日目に、運動性能を評価する。これを行うには、スローモーションモードでビデオを見て、左足または右足によって別々に実行されたエラーの数を定量化します。
注記: エラーとは、足がグリッドを正しく踏まなかったため、グリッドの側面またはグリッドとビームサーフェスの間に表示されるようになった場合と定義されます。
- 3日目に、運動性能を評価する。これを行うには、スローモーションモードでビデオを見て、左足または右足によって別々に実行されたエラーの数を定量化します。
3. 組織処理
- 経心経灌流(マウス1匹あたり約15分)
- マウスを麻酔するには、ケタミン(80mg/kg)とキシラジン(10mg/kg)の混合物を、1mLシリンジと27G針26を用いて腹腔内に注射する。
- マウスが完全に麻酔をかけられたら(ステップ1.1.6のように確認)、手術材料で胸郭を開き、心臓を露出させる。
- 次に、21G針(ドリルを使用して先端を平らにする)を心臓の左心室に挿入します。
- 針をパイプに結合させて、蠕動ポンプを用いて50mLのPBS(pH7.4)を9.5mL/minの速度で灌流する。
- 脳の固定と凍結保護(脳あたり約10分)
- はさみとピンセットを使って脳を取り出し、PBS中の4%パラホルムアルデヒド5mL(pH7.4)に4°Cで24時間浸漬して固定します。
- その後、固定した脳を30%スクロースの15mLに入れ、4°Cで48時間。
- その後、脳を4mLの凍結保護溶液(PBS中の20%グリセリンおよび2%DMSO)に入れ、脳を−80°Cで保存するか、次のステップで直ちに使用する。
- 脳スライスの取得(脳あたり約20分)。
注:脳がコロナカットを行うための適切な位置のクライオスタットに置かれていることを確認してください。- SNスライスを得るには、脳を-2.92 mmから-3.64 mm 24で終わる厚さ40 μmのセクションに切断します。
- 各スライスを、24ウェルプレートのウェル(1mLの凍結保護溶液を含む)に収穫し、25、27、28の前に記載したように、後段の順序に従います。
- SNにおける免疫組織化学的(セクション4.)および免疫蛍光分析(セクション5.)を実行するには、前述のように、核の吻側尾部全体(合計720μm)をカバーする均一な間隔(120μm)で採取された6つの冠状SN切片を選択する。
- 線条体スライスを得るには、脳を+1.34mmから-0.26mm24で終わる厚さ40μmの切片に切断する。
- 各スライスを2 mLのクライオチューブ(1 mLの凍結保護溶液を含む)で前後順序に従って収穫する。
- 線条体における免疫組織化学的(セクション4.)および免疫蛍光分析(セクション5.)を行うには、核の吻側尾部全体(合計1600μm)をカバーする均一な間隔(320μm)で採取した5つの冠状線条体切片を選択する。
4. ドーパミン作動性ニューロンとミクログリオーシスを定量するための免疫組織化学的解析(約2日間)
- 線条体または黒体スライスの免疫組織化学的分析のために、同じ脳からの5つの(線条体)または6つの(SN)スライスのセットを24ウェルプレートの1つのウェルに配置する。
- 切片3xを1mLのPBSで洗浄し、次いで0.5mLの0.03%H2O2メタノール中で室温で30分間撹拌して内因性ペルオキシダーゼ活性を不活性化する。
- 切片3xを1mLのPBSで洗浄し、0.5mLのブロッキング溶液(4%ヤギ血清、0.05%Triton X-100、およびPBS中の4%BSA)と共に室温で40分間撹拌しながらインキュベートする。
- その後、一次抗体(ウサギ抗チロシンヒドロキシラーゼ[TH]pAbを1:1000に希釈した[ 表1参照];又はウサギ抗Iba1抗体を1:1000に希釈)を含むブロッキング溶液0.5mLと共に室温でインキュベートし、一晩撹拌した。
- 切片3xを1mLのPBSで洗浄し、ビオチン化ヤギ抗ウサギpAb(1:500、 表1参照)を含む0.5mLのブロッキング溶液と共に室温で2時間撹拌しながらインキュベートする。
- 次いで、切片3xを1mLのPBSで洗浄し、0.5mLのペルオキシダーゼ結合アビジン(1:5000、 表1参照)をブロッキング溶液中で室温で90分間撹拌しながらインキュベートする。
- 切片3xを1mLのPBSで洗浄し、0.5mLの基質溶液(pH7.6の0.03%H2O2/Trizma-HCl緩衝液中の0.05%ジアミノベンジジン)でインキュベートする。ジアミノベンジジンは潜在的な発癌物質であるため、このステップでは手袋と白衣を着用してください。
- 特定の染色が明らかな場合(THの場合は通常30秒、Iba1の場合は5分間)、基質溶液を取り出し、室温および攪拌しながら1mLのPBSで切片3xを洗浄する。常に同じ実験に含まれるすべての脳のスライスの免疫染色を同時に行う。
注:THの特異的染色は、TH免疫染色が脳内に特徴的な形状を示すSNの領域に現れるときに明らかである。Iba1の特異的マークは、Iba1免疫染色が典型的なミクログリア形状を有する対照脳スライスに現れたときに決定され、顕微鏡観察によって確認される。このようにして、IHC分析のための基質博覧会の正確な時間は、すべての単一の実験について決定される。 - 0.05Mトリス(pH7.6)中の0.2%ゼラチンの溶液を用いて脳切片をスライドガラス上に取り付ける。同じ脳から得られた5つ(線条体)または6つ(SN)のスライスの各セットを、同じスライドガラス上に吻側尾の順序で配置する。
- SN中のTH+ ニューロンの数を定量化する。
- SN中のTH+ニューロンを定量化するために、前述のように、明視野顕微鏡を用いて20倍の倍率で6つのスライスの写真を取得する(前述のように)。色温度3200 K、シアン - 赤40%、マゼンタ - グリーン39%、黄青54%、ガンマ0.5、コントラスト37、明るさ13、彩度5。
- Image Jソフトウェアを使用して、分析した半球のSNパースコンパクタの周囲を選択します。腹側被蓋領域(VTA)からのTH+ ニューロンの選択は避けてください。
- その後、選択した面積を計算するようにソフトウェアに依頼します(通常、吻側尾の位置に応じて、0.04〜0.07 mm2/半球)。次に、マルチポイントツールを使用して、すべてのTH+ ニューロンにドットでタグを付けます。
- ポイントツールを使用して、ソフトウェアにドットの総数をカウントするように依頼します。総ドット数(TH+ニューロン)とSNpcの面積を用いて、TH+ニューロン/mm2の密度を計算します。
- 6つのSNスライスの両半球で同じ計算を繰り返し、同側側と反対側のTH+ ニューロン/mm2 の平均を計算します。
- 線条体中の活性化ミクログリアの数を定量化する
- 線条体中の活性化ミクログリアを定量化するために、明視野顕微鏡およびステップ4.10.1に示されたのと同じ設定を使用して、20倍の倍率で5つの線条体スライスすべてについて、各半球で2枚の写真を取得する。Image Jソフトウェアを用いて、1枚の写真(660μm×877μmの領域を表示)に、マルチポイントツールを使用して、高いIba1強度とアメーブ状を発現する細胞ごとにドットでタグ付けした。ポイントツールを使用して、ソフトウェアにドットの総数をカウントするように依頼します。
- 総ドット数と写真の面積を用いて、29の前に行ったように活性化ミクログリア(Iba1高細胞/mm2)の密度を計算する。
| 標的抗原 | に結合 | クローナリティ | ホスト仕様 | 正種の反応性* | 希釈** |
| チロシンヒドロキシラーゼ | 該当なし | ポリクローナル | 兎 | マウス、ラット、ヒト | 1/200 - 1/1000 |
| イバ1 | 該当なし | モノクローナル | 兎 | マウス、ラット、ヒト | 1/1000 |
| α-シヌクレイン | 該当なし | モノクローナル | 兎 | 人間 | 1/150 |
| CD4 | 該当なし | モノクローナル | 鼠 | 鼠 | 1/250 |
| IgG (H+L) | ビオチン化 | ポリクローナル | 山羊 | 兎 | 1/500 |
| IgG (H+L) | アレクサフルオール546 | ポリクローナル | 山羊 | 兎 | 1/500 |
| IgG (H+L) | アレクサフルオール647 | ポリクローナル | 山羊 | 兎 | 1/500 |
| IgG (H+L) | アレクサフルオール546 | ポリクローナル | 山羊 | 鼠 | 1/500 |
表1:抗体希釈液。 該当なし。*、他の種との反応性に関係なく、マウス、ラット、およびヒトとの反応性がある場合にのみ指定されます。**、単一の希釈または希釈範囲が指定されています。
5. 黒質線条体経路におけるT細胞浸潤を評価するための免疫蛍光解析(約2日間)
- 線条体または黒質スライス上のhαSynまたはTH/GFPの免疫蛍光分析のために、同じ脳からの5つの(線条体)または6つの(SN)スライスのセットを24ウェルプレートの1つのウェルにまとめる。
- 切片3xを1mLのPBSで洗浄し、次いで0.5mLのブロッキング溶液(PBS中の0.3%Triton X-100、0.05%tween20、および5%BSA)と共に室温で40分間撹拌しながらインキュベートする。
- その後、一次抗体を含む0.5 mLのブロッキング溶液(1:500に希釈したウサギ抗TH pAb;または1:150に希釈したウサギ抗hαSyn抗体、 表1参照)と共に室温でインキュベートし、一晩撹拌した。
- 切片3xを1mLのPBSで洗浄し、AlexaFluor546結合抗ウサギ二次抗体(1:500、 表1参照)および4',6-ジアミジノ-2-フェニルインドール(DAPI;1:1000)を含む0.5mLのブロッキング溶液と共に室温で2時間撹拌しながらインキュベートする。次いで、切片3xを1mLのPBSで洗浄する。
- 上記のようにスライドガラスに脳切片を取り付けます(ステップ4.9)。画像は、電源ユニットに結合された倒立蛍光顕微鏡で取得した。
- 黒質スライス上のTH/CD4/GFP(Foxp3)の免疫蛍光分析のために、同じ脳からの6つの(SN)スライスのセットを24ウェルプレートの1つのウェルに配置する。切片3xを1mLのPBSで洗浄し、次いで0.5mLのブロッキング溶液(0.5%Triton X-100、PBS中の0.5%魚皮ゼラチン)と共に室温で2時間撹拌しながらインキュベートする。
- 一次抗体ウサギ抗TH pAb(1:200、表1参照)およびラット抗CD4( 1:250)を含むブロッキング溶液0.5 mLと共に4°Cでインキュベートし、一晩撹拌した。
- 切片3xを1mLのPBSで洗浄し、AlexaFluor 647に結合された抗ウサギ(1:500、表1参照)およびAlexaFluor 546に結合した抗ラット( 1:500)を含む0.5mLのブロッキング溶液と共に室温で2時間撹拌しながらインキュベートする。次いで、切片3xを1mLのPBSで洗浄する。
- 同じ脳から得られた6枚(SN)スライスの各セットを吻側尾の順に同じスライドガラスの上に置き、Fluoromount G.を用いてそれらをマウントする。 表2 に示す共焦点顕微鏡設定を使用して、免疫蛍光分析から画像を取得します。
| シャネル名 | 三乗 | エミッション・ウェーブレント | ルックアップテーブル名 | 露光時間 | 得 | 解像度 XY | 解像度 Z |
| チャンネル1 | Y5 | 700ナノメートル | 灰色 | 1,011.727 ミリ秒 | 高い井戸容量 | 2.237 ウム | 24.444 um |
| チャンネル2 | ティッカー | 525nm | 緑 | 326.851 ミリ秒 | 高い井戸容量 | 2.237 ウム | 24.444 um |
| チャンネル3 | ティッカー | 630ナノメートル | 赤い | 406.344 ミリ秒 | 高い井戸容量 | 2.237 ウム | 24.444 um |
| チャンネル4 | ダピ | 460ナノメートル | 青い | 91.501 ミリ秒 | 高い井戸容量 | 2.237 ウム | 24.444 um |
表2:免疫蛍光分析からの画像の取得に使用される共焦点顕微鏡の設定。
6. 統計解析
- 同側側と対側から得られたデータを比較するには、ペアの両側スチューデントのt検定を使用します。
- AAV-hαSynを投与されたマウスとAAV-GFPまたは偽手術を受けたマウスから得られたデータを比較するには、不対の両側スチューデントのt検定を使用します。P値が0.05の<有意差を考慮してください。
結果
黒質線条体経路のドーパミン作動性ニューロンにおけるAAVベクターの正しい送達の検証
シヌクレイン病理によって促進される神経炎症、神経変性、および運動障害のプロセスを研究するために、SN16、17、30、31におけるhαSynをコードするAAVの一方的定位送達によって誘発されるパーキンソン病のマウスモデルを使用した(補足図1の実験デザインを参照のこと).黒質線条体経路のドーパミン作動性ニューロンにおけるAAVベクターの正しい送達を検証するために、GFP(AAV−GFP)をコードするAAVをSNに注射し、そして12週間後に、GFP蛍光およびチロシンヒドロキシラーゼ(TH)免疫蛍光によるSNおよび線条体における免疫反応性を分析した。GFP関連蛍光はもっぱら同側側で観察され、SNおよび線条体の両方でTH免疫反応性との有意な共局在が見られ、黒質線条体経路のドーパミン作動性ニューロンにおけるAAVベクターの正しい送達が示された(図1)。
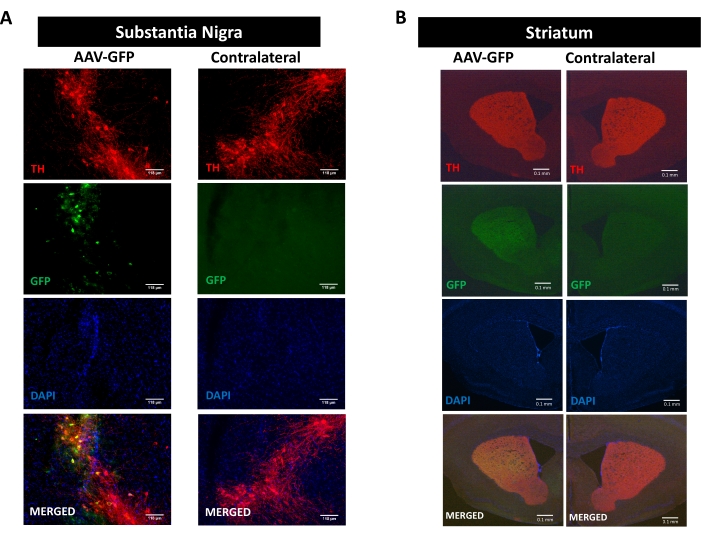
図1:黒質線条体経路におけるAAV−GFPの送達の分析。AAV-GFP(1 x 1010 vg/マウス)を投与し、12週間後に屠殺し、THを(A)SN(スケールバーは118μm)および(B)線条体(スケールバーは100μm)で免疫染色した。TH−およびGFP関連蛍光を、落射蛍光顕微鏡によって分析した。核はDAPIで染色した。TH(赤)、GFP(緑)、およびDAPI(青)のマージまたは単一染色の代表的な画像が示されている。この図の拡大版を表示するには、ここをクリックしてください。
AAV-hαSynにより誘導されるパーキンソン病のマウスモデルにおける神経変性および運動障害を誘導するために投与されるウイルスベクターの用量の設定
黒質ドーパミン作動性ニューロンの神経変性を促進するhαSynの有意な過剰発現を誘導するために必要なAAV-hαSynの用量を試験するために、異なる用量(1 x108ウイルスゲノム[vg]/マウス、1 x109 vg/マウス、または1 x 1010 vg/マウス)のAAV-hαSynを注射し、12週間後に、hαSyn免疫反応性およびTH免疫反応性の程度を黒質線条体経路で評価した。hαSyn免疫反応性はSNで試験されたすべての用量で明らかであったが(図2)、1 x 1010 vg/マウスを投与されたマウスのみが線条体において明らかなhαSyn免疫反応性を示した(図3)。さらに、AAV-hαSynを1 x1010 vg/マウス投与したマウスでは、SNにおけるドーパミン作動性ニューロンの有意な喪失が示された(図4A、B)。AAV-GFPを1 x1010 vg/マウス投与されたマウスは、低度(〜20%)のニューロン喪失を示したが(図4A、B)、同じ用量のAAV-hαSynを投与されたマウスは、ニグラルドーパミン作動性ニューロンの神経変性の有意に高い程度を示した(図4C)。したがって、AAV-hαSynの1 x10 10 vg/マウスを用いてさらなる実験を行った。さらに、運動障害の程度は、前述のように、ビーム試験(図5A)を用いて異なる用量のAAV−hαSynを投与されたマウスにおいて決定された(図5A)。ビーム試験において、AAV-hαSynの1 x 10 10 vg/マウスでのみ、左右のパッドによる誤差の数を比較した場合(図5B)、およびAAV-hαSynを投与されたマウスの総誤差数を対照ベクターAAV-GFPを投与したマウスと比較した場合(図5C)において、運動性能の有意な低下が排他的に検出された。したがって、AAV-hαSynの1 x10 10 vg/マウスを用いてさらなる実験を行った。
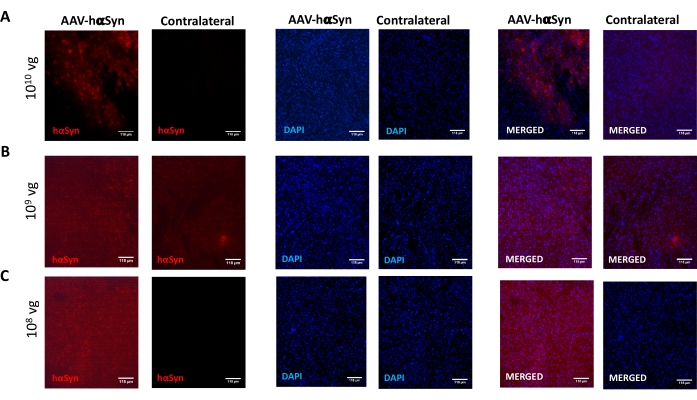
図2:異なる用量のAAV−hαSynで処置したマウスのSNにおけるヒトα−シヌクレイン発現の分析。(A)1 x 1010 vg/マウス、(B)1 x109 vg/マウス、または(C)1 x108 vg/マウスでAAV-hαSynを投与し、12週間後に屠殺し、蛍光模倣を用いてSN中の免疫蛍光によりhαSyn発現を解析した。核はDAPIで染色した。hαSyn(赤)またはDAPI(青)のマージまたは単一染色の代表的な画像が示されている。スケール バーは 118 μm です。この図の拡大版を表示するには、ここをクリックしてください。
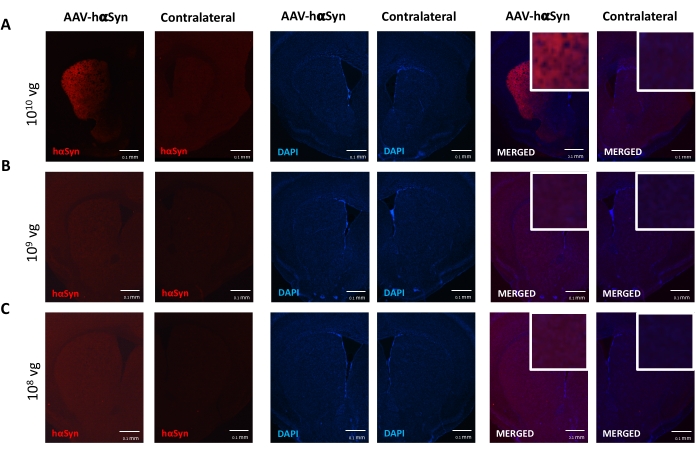
図3:異なる用量のAAV-hαSynで処置したマウスの線条体におけるヒトα-シヌクレイン発現の分析。(A)1 x 10 10 vg/マウス、(B)1 x 109 vg/マウス、または(C)1 x 108 vg/マウス)でAAV-hαSynを投与したマウスを屠殺し、12週間後に屠殺し、線条体における免疫蛍光を落射蛍光顕微鏡を用いてhαSyn発現を解析した。核はDAPIで染色した。hαSyn(赤)またはDAPI(青)のマージまたは単一染色の代表的な画像が示されている。スケールバーは100μmです。結合された画像の右上隅にあるインサートは、より高い倍率で関心のある領域を示しています。この図の拡大版を表示するには、ここをクリックしてください。
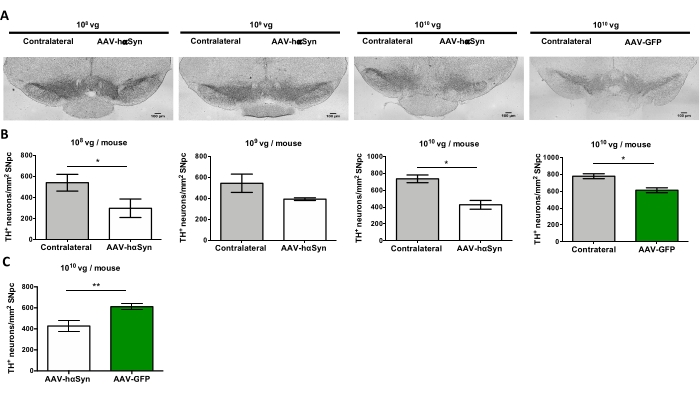
図4:異なる用量のAAV−hαSynまたは対照ベクターで処置したマウスにおけるSNのドーパミン作動性ニューロンの喪失。マウスはAAV-hαSyn(1 x 10 10 vg/マウス、1 x109 vg/マウス、または1 x108 vg/マウス)またはAAV-GFP(1 x10 10 vg/マウス)を投与され、12週間後に屠殺され、THは免疫組織化学によってSNpcで分析された。(A) 代表的な画像。スケールバー、100μm(B,C)ニューロンの密度は、TH+ニューロン数/mm2として定量化した。データはSEM±平均を表す。(B)両側と対側との同側比較を、両側ペアのスチューデントのt検定を用いて行った。(C) AAV-hαSynまたはAAV-GFPを1 x1010 vg/マウス投与したマウスの同側側の比較を行った。(B,C)白いバーはAAV-hαSyを投与されたマウスの同側側のTH+ニューロンの定量を示すのに対し、緑色のバーはAAV-GFPを投与されたマウスの同側側のTH+ニューロンの定量を示す。灰色のバーは、対応する群の対側側のTH+ニューロンの定量を示す。比較は、両側非対のスチューデントのt検定によって実施した。*p < 0.05;**p < 0.01.この図の拡大版を表示するには、ここをクリックしてください。
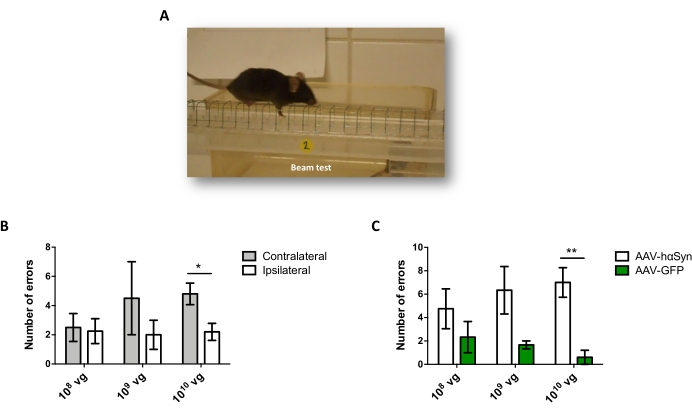
図5:異なる用量のAAV−hαSynで処置したマウスにおける運動性能の分析。マウスは、AAV-hαSynまたはAAV-GFPの異なる用量(1 x 10 10 vg/マウス、1 x109 vg/マウス、または1 x108 vg/マウス)を受け、12週間後、ビーム試験によって運動性能を評価した。(A)梁の上を歩くネズミの画像。(b)左肢(対側)対右肢(同側)によって行われたエラーの数を、AAV−hαSyを投与されたマウス群において定量化した。(c)同じ用量のAAV−hαSynまたはAAV−GFPを受けた異なる実験群間で総誤差数を比較した。データはSEM±平均を表す。比較は、(B)対応のある両側スチューデントのt検定または(C)不対応の両側スチューデントのt検定によって実施された。*p < 0.05;**p < 0.01. この図の拡大版を表示するには、ここをクリックしてください。
AAV-αSynによるパーキンソン病モデルの動態解明
有意なレベルの神経変性および運動障害を誘導するために使用される適切なAAV−hαSyn用量を決定した後、hαSyn過剰発現の発症を定義するための実験が行われた。この目的のために、マウスをAAV-hαSynまたは偽手術の1 x 1010 vg/マウスで処置した。hαSyn発現の程度を、定位手術後2~5週目に週に1回SNで解析した( 補足図2の実験計画を参照)。結果は、hαSyn発現が術後2週間という早い時期に低レベルで検出されたにもかかわらず、hαSynクラスターが定位手術後5週目に出現したことを示している(図6)。

図6:AAV−hαSynで処置したマウスのSNにおけるヒトα−シヌクレイン発現の経時変化の解析。 マウスはAAV-hαSyn(1 x1010 vg/マウス)または偽の定位手術のみを受け、SNにおけるhαSynの発現を(A)2週間、(B)3週間、(C)4週間、または(D)5週間後に落射蛍光顕微鏡を用いた免疫蛍光で解析した。核はDAPIで染色した。hαSyn(赤)またはDAPI(青)のマージまたは単一染色の代表的な画像が示されている。スケールバー、100μm。結合された画像の右上隅にあるインサートは、より高い倍率で関心のある領域を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
その後、AAV-hαSynの定位送達後の中枢神経系(CNS)における神経炎症およびT細胞浸潤を分析するのに適した時点を決定するための実験を行った。AAV−hαSynでマウスを処置した後のミクログリア活性化のピークを決定するために、線条体において高レベルのIba1を発現する細胞の程度を、定位手術後2〜15週の間に週に1回評価した。結果は、AAV−hαSyn処置の15週間後のマウスの対側側と比較して、同側側のミクログリア活性化の有意な増加を示す(図7)。SNpcに浸潤したTreg(CD4+ Foxp3+)細胞の数も、共焦点顕微鏡観察に続く免疫蛍光によるAAV−hαSynの定位送達後の異なる時点で評価した。その結果、SNpcへのTreg浸潤のピークは術後11週目であったのに対し、Tregが脳のこの領域に浸潤する程度は術後8週目または13週目には低かった(図8)。線条体に浸潤するCD4+ T細胞は検出されなかった(データは示さず)。全体として、これらの結果は、AAV-hαSynの1 x1010 vg/マウスを使用して、神経炎症を分析するのに最も適した時点は定位手術後15週であり、CNSへのT細胞浸潤を分析するのに適切な時点はAAV-hαSyn治療後11週であると思われることを示している。
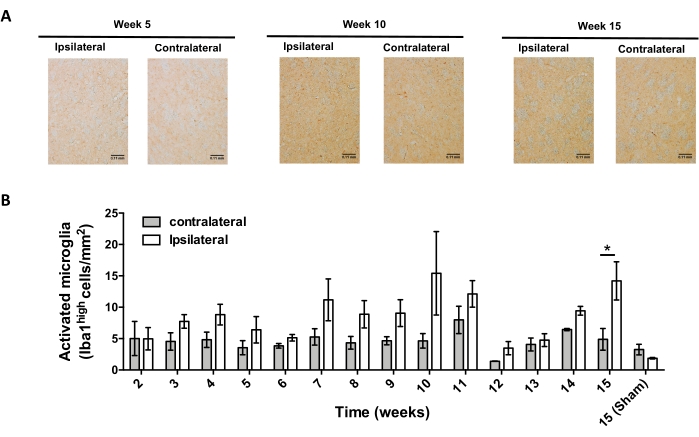
図7:AAV-hαSynを接種したマウスにおけるミクログリア活性化の経時変化の解析。 マウスはAAV-hαSyn(1 x1010 vg/マウス)を投与し、手術後の異なる時点での線条体中のIba1の免疫組織化学的分析によってミクログリア活性化を評価した。(a)AAV-hαSynの接種後5週間、10週間、または15週間に屠殺したマウスからのIba1の免疫組織化学的分析の代表的な概要画像が示されている。(B)活性化ミクログリアの密度を、面積当たりの高レベルのIba1およびアメバ様形状を発現する細胞の数として定量した。データはSEM±平均を表す。両側ペアのスチューデントのt検定を用いて、各群における同側および対側Iba1間の統計的差異を決定した。*p < 0.05 この図の拡大版を表示するには、ここをクリックしてください。
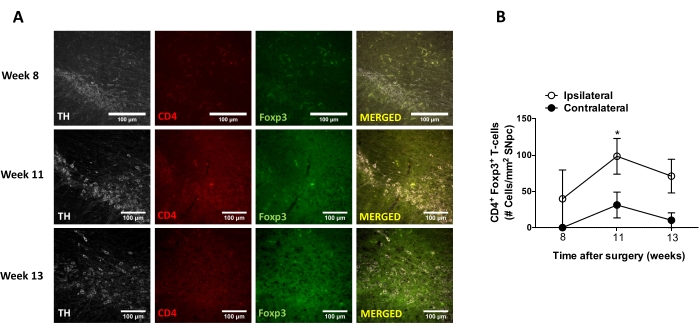
図8:AAV-hαSynを接種したマウスのSNへのCD4+ T細胞浸潤の経時変化の解析。Foxp3gfpレポーターマウスはAAV-hαSyn(1 x 1010 vg/マウス)を受けた。Foxp3を発現するCD4+ T細胞の存在およびTH+ニューロンの存在を、免疫蛍光によってSN中の異なる時点(手術後8週目、11週目、および13週目)で分析した。(a)単一免疫染色またはマージのための代表的な画像が示されている。(B)SN中の面積当たりのCD4+Foxp3+ T細胞の数を定量した。データは、1群あたり3匹のマウスからのSEM±平均を表す。*p<0.05、両側スチューデントのt検定による同側対対対外CD4+ Foxp3+ T細胞。この図の拡大版を表示するには、ここをクリックしてください。
補足図1:シヌクレイン病理、神経変性、および運動障害に対する異なる用量のAAVベクターの効果を評価するための実験計画。野生型雄性C57BL/6マウスを麻酔し、CBAプロモーターの制御下でヒトα-シヌクレイン(AAV-hαSyn)またはeGFP(AAV-GFP)をコードするAAVの異なる用量(1 x 10 10 vg/マウス、1 x109 vg/マウス、または1 x108 vg/マウス)の立体接種を右黒質(SN)に受けた。12週間後、SNおよび線条体(Str)におけるGFPおよびhαSynの発現を免疫蛍光(IF)により評価し、チロシンヒドロキシラーゼ陽性(TH+)細胞をSNにおける免疫組織化学(IHC)により定量し、運動性能をビーム試験により評価した。各実験群におけるマウスの数を括弧内に示している。*は、解析前に1匹のマウスが死亡したグループを示します。各分析は、対応する結果が示されている論文の本文からの図の番号を括弧内に示している。このファイルをダウンロードするには、ここをクリックしてください。
補足図2:T細胞浸潤、神経炎症、およびhαSyn発現の動態を決定するための実験計画。 Foxp3gfp レポーターマウスを麻酔し、CBAプロモーターの制御下でヒトα-シヌクレイン(AAV-hαSyn)をコードするAAV(1 x 1010vg /マウス)の右黒質(SN)または偽手術(PBS)への定位接種を受けた。異なる時点でマウスを屠殺し、SNおよび線条体におけるhαSynの発現を免疫蛍光(IF)によって評価し、GFP(Foxp3)、CD4、およびチロシンヒドロキシラーゼ陽性(TH+)細胞をSNにおけるIFによって定量し、線条体(Str)における免疫組織化学(IHC)によってIba1発現を解析した。各実験群におけるマウスの数が示される。各分析に含まれる時点の範囲が示される。各分析は、対応する結果が示されている論文の本文からの図の番号を括弧内に示している。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで解析した神経変性のマウスモデルは、αSyn病態およびミクログリア活性化に関与するメカニズム、神経炎症の調節における末梢免疫系の関与、および神経変性のメカニズムを含む、パーキンソン病の病態生理学に関与する多くの重要な側面を研究するのに役立つ可能性がある。αSyn病態に関与する機序の中には、SN2のドーパミン作動性ニューロンにおけるαSynの過剰な負荷の存在下でのミトコンドリア、リソソーム、またはプロテアソーム機能不全に関連する細胞内機序がある。AAV媒介性形質導入によって誘導されるhαSyn発現に加えて、内因性マウスαSynも総αSyn発現の負荷に寄与することを考慮することが重要です。αSynを過剰発現するトランスジェニックマウスは、hαSyn32の過剰発現に基づくこれらのマウスモデルと同様のシヌクレイン病理、神経病理学、および運動障害を発症する。ミクログリア活性化に関して、本マウスモデルは、サイトカイン、神経伝達物質、アストロサイト、ニューロン、血液脳関門、およびT細胞などの異なる分子および細胞プレーヤーが、炎症促進性または抗炎症性機能表現型の獲得をどのように調節するかを研究するために用いられる可能性がある8,10,111。.このモデルはまた、T細胞だけでなく、マクロファージ、単球、および好中球を含む末梢免疫系が、黒質ニューロンの神経炎症および神経変性の過程に及ぼす役割を研究するための重要なツールを構成する11,33,34。最後に、このマウスモデルはまた、酸化ストレス、エネルギー欠損、および損傷した細胞小器官2などの内部細胞プロセスによって誘導されるもの、またはミクログリア細胞、アストロサイト、および細胞傷害性T細胞8によって産生される神経毒性因子などの外部プレーヤーによって発揮されるものを含む、インビボでの神経変性の細胞および分子メカニズムを研究するための貴重なシステムを表し、28,29,35。
このマウスモデルの限界は、脳外におけるαSynの病理学的凝集がパーキンソン病の発症の初期段階をどのように構成するかの研究である36。これに関して、黒質ニューロンの神経変性および運動障害の前に、αSyn病理が腸粘膜および嗅上皮36 において、そしておそらくαSyn特異的T細胞応答において同様に始まることを示す証拠が増えている12。その後、αSyn凝集体は迷走神経を通って脳幹に移動し、ドーパミン作動性ニューロン12の神経炎症および神経変性を引き起こす。AAV-hαSynモデルはパーキンソン病のほとんどの側面を反復しているが、このモデルでは大脳外位置におけるαSynの病理学的凝集の明らかな関与はない。パーキンソン病のこれらの側面を研究するのに適したhαSyn病理を含む代替モデルは、Thy1プロモーターの制御下でhαSynを過剰発現するトランスジェニックマウスであるThy1-SNCA モデル37であり、疾患の発症は腸内微生物叢に依存し、明らかな胃腸障害38を伴う。
パーキンソン病の病態生理学に関連する多様なプロセスの研究には有用であるが、現在のマウスモデルは、対応する空間座標におけるウイルスベクターの正しい送達、ニューロンにおけるhαSynの選択的発現(AAV血清型およびベクター構築物に依存する)を含む、細かくチェックされるべき重要なステップを含む、 パーキンソン病表現型を分析する前の適切なAAV用量およびタイミング。針が完全にまっすぐでない場合、SNの正しい空間座標の使用が十分でない場合があり、時には人間の目には知覚できないため、SNにおけるウイルスベクターの適切な送達の分析が必要である。さらに、AAVベクターの拡散は、AAV血清型39に依存する。これらの理由から、SNの領域を含む脳切片におけるGFPの観察に続いて、注入されたAAV−GFPベクターの正しい送達および拡散をチェックする定期的な品質管理を行う必要がある。
ニューロンにおけるhαSynの選択的発現に関しては、原則として、hαSynの発現は、ニューロンに選択的なプロモーターによって制御されるように、またはさらに正確には、ドーパミン作動性ニューロンにおける遺伝子の選択的発現を誘導するためのAAVベクターにおけるTHプロモーターの使用など、ドーパミン作動性ニューロンに対して選択的に制御されるように操作することができる40.しかし、この戦略は、求められているのが目的の遺伝子の過剰発現である場合には機能しません。このため、本モデルでは、神経指向性を有する強力なプロモーター(下流遺伝子の高発現を誘導するプロモーター)やAAV血清型を用いることが必須である。本研究では、hαSynの過剰発現を誘導する強力なプロモーターとしてCBAプロモーターを用い、ウイルスベクターにはAAV5血清型を用いた。この血清型は、マウスおよびラットのニューロン41、42を形質導入するために以前に使用されてきた。ここで、この結果は、マウスのSNにおけるAAV5−GFPの送達の12週間後に、緑色蛍光がSNおよび線条体の両方の同側側に選択的に存在していたことを実証し(図1)、黒質線条体経路のニューロンの効率的な形質導入を示す。
パーキンソン病のこのマウスモデルのもう一つの重要な側面は、手術後の特定のプロセスを分析するために必要な時点である。この点で、この研究は、病理学に関与する異なるプロセスの動態学的研究を示している。マウス1匹当たりに与えられたウイルスゲノムの用量、使用されるAAVの血清型、または使用されたAAVのバッチでさえも重要な時点が変化するので、TH+ニューロンの有意な喪失および運動障害を誘導するために必要なAAV-αSynの量についての用量反応分析が最初に行われた。以前の研究では、マウス16,17,30,31匹あたり6 x 10 8-3 x 10 10ウイルスゲノムの範囲の用量で、マウスにAAV-αSyn注射を12週間行った後、有意な運動障害および黒質線条体経路のTH+ニューロンの喪失が示されている。したがって、マウスにおける黒質線条体経路におけるhαSyn発現、TH+ニューロンの喪失、および運動障害を誘導するために使用されるAAV-hαSynの用量は、マウス当たり1 x108–1 x1010ウイルスゲノムの範囲であった。また、TH+ニューロンの消失および運動障害がSNにおけるhαSynの過剰発現によって誘導され、SNのニューロンのAAV感染によって誘導されることを制御するために、レポーター遺伝子(AAV-eGFP)をコードするAAVをマウスのSNに一方的に送達し、神経変性および運動障害を決定した対照群を包含した。その結果、定位手術の12週間後、マウス1匹あたり1 x1010個のウイルスゲノムが適切な用量のAAV5-hαSynであり、このウイルス負荷を受けたマウスは黒質線条体経路において有意なhαSynを示し(図2および図3)、TH+ニューロンの喪失(図4)、および運動障害(図5)を示した。対照的に、低用量のAAV5-hαSyn(マウスあたり1 x108ウイルスゲノム、マウスあたり1 x109ウイルスゲノム)は、これらすべてのパラメータを一緒に有意に変化させるのに十分強くありませんでした(図2-4)。注目すべきは、マウス1匹当たり1 x1010個のウイルスゲノムでのAAV−GFPの投与は、低い(〜20%)が、黒質ドーパミン作動性ニューロンのTH+ニューロンの有意な程度の損失を誘導した(図4A、B)。この結果は、このモデル41を用いた以前の観察と一致し、おそらくSNにおけるAAVベクターの投与によって誘導される低レベルの神経炎症の結果である。それにもかかわらず、TH+ニューロンの喪失の程度は、同じ用量のAAV−GFPを投与されたマウスと比較して、AAV5−hαSynを投与されたマウスにおいて有意に高かった(図4C)。注目すべきは、hαSyn発現の動態は、形質導入の効率だけでなく、AAV拡散の程度にも依存する39。AAV拡散はAAV血清型に依存するので、この動物モデルにおける正確な重要な時点は、AAV5とは異なる別のAAV血清型を使用する場合に変化し得る。
その後、マウス1匹あたり1 x 1010個のウイルスゲノムを使用して速度論的解析を行い、このマウスモデルの主要な時点を決定しました。現在の証拠は、パーキンソン病43,44の早期診断を可能にする運動障害の前に現れるいくつかの初期症状を示しているので、これらの実験は、hαSyn発現がすでに明らかであったが、運動障害がない場合に、hαSyn発現が明らかであった時点を見つけようとした。結果は、SNにおけるhαSyn発現の発症がAAV-hαSynの定位送達後5週間であったことを示す(図6)。この時点は、神経炎症および神経変性プロセスを停止するように調整された治療法の投与を開始するための興味深い時間的点を構成する。ここで決定された他の重要な時点は、神経炎症プロセスに関連する2つの重要な事象のピーク時間、すなわちミクログリアが最大活性化度に達する時間とSNへの最大T細胞浸潤時間であった。結果は、最大ミクログリア活性化の2つの波に達する傾向を示す曲線を示し、最初の波は手術後10週目、2番目は手術後15週目であった(図7)。T細胞浸潤の動態解析は、定位手術後11週間におけるSNへのTreg浸潤のピーク時間を示した(図8)。驚くべきことに、分析された時間枠(手術後8〜13週目)の間にSNに浸潤するエフェクターT細胞(CD4+ Foxp3-)は検出されなかった。全体として、これらの結果は、手術後5週目(hαSyn過剰発現の発症)から手術後10週目(神経炎症およびT細胞浸潤の第1波)の間のこの前臨床モデルを用いて、神経炎症の過程を停止し、SNへのT細胞浸潤を減弱させることを目的とした治療の投与を開始するための適切な時間枠を示唆している(図9)。
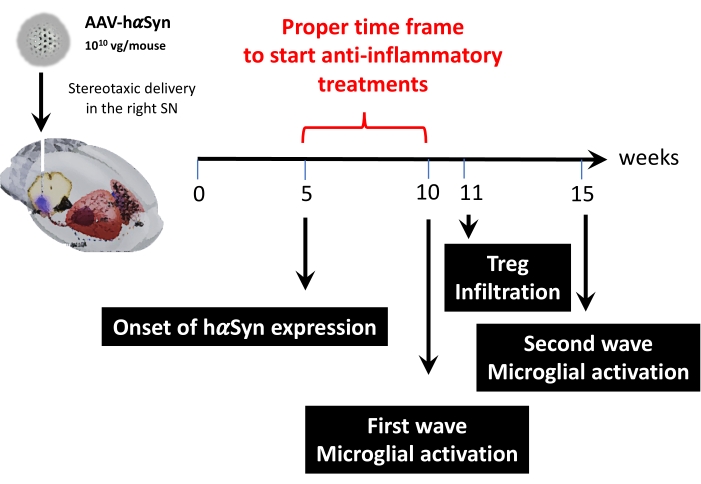
図 9: この動物モデルで見つかった重要な時点の概要。 この図の拡大版を表示するには、ここをクリックしてください。
開示事項
著者らは、この研究は、金銭的または非財務的な競合する利益が存在しない状態で実施されたと宣言している。
謝辞
私たちは、セバスチャン・バレンズエラ博士とミカエラ・リッカ博士に、私たちの動物施設における貴重な獣医の援助に感謝します。この研究は、"Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID" Centro Ciencia & Vida, FB210008 (to Fundación Ciencia & Vida)、およびGeroscience Center for Brain Health and Metabolism, FONDAP-15150012の支援を受けた。この研究はまた、"Agencia Nacional de Investigación y Desarrollo de Chile (ANID)"からのFONDECYT-1210013(R.P.へ)とFONDECYT-1150766(FCへ)と、マイケル・J・フォックス・パーキンソン病研究財団からのMJFF-10332.01(R.P.へ)とMJFF-17303(FCへ)の助成金によっても資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| ANIMALS AND ANIMAL FOOD | |||
| Foxp3-GFP C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 023800 | |
| Laboratory Rodent Diet | LabDiet | Rodent Diet 5001 | Standard Rodent diet |
| Wild-type C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 000664 | |
| VIRAL VECTORS | |||
| AAV5-CBA-αSyn | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 10E13 vg/mL |
| AAV5-CBA-eGFP | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 9.5 x 10E12 vg/mL |
| ANESTHETICS AND ANALGESICS | |||
| Isoflurane | Baxter | 218082 | 1% for stereotaxic surgery |
| Ketamine | Drag Pharma | CHE30 | 70 mg/Kg for stereotaxic surgery |
| Sevoflurane | Baxter | VE2L9117 | For before transcardial perfusion |
| Tramadol | Drag Pharma | DPH134 | 30 mg/Kg every 24 h |
| Xylazine | Centrovet | EHL40 | 9 mg/kg for stereotaxic surgery |
| EQUIPMENT | |||
| Beam test | Home made | N/A | horizontal beam 25 cm length and 3 cm width. The beam surface was covered by a metallic grid (1 cm2). |
| Cryostate | Leica | CM1520 | |
| Digital camera | Nikon | S2800 Coolpix | For recording the beam test performance |
| Microscope | Olympus | BX51 | Used for IHC analysis (section 4.4) |
| Microscope | Olympus | IX71 | Used for IF analysis (section 5.3) |
| Microscope | Leica | DMI8 | Used for IF analysis (section 5.7) |
| New Standard Stereotaxic, mouse | Stoelting, Wood Dale, IL, USA | 51500 | stereotaxic frame for surgery |
| Peristaltic Pump | Masterflex | C-flex L/S16 | |
| Power supply unit | Olympus | U-RFL-T | Used for IF analysis (section 5.3) |
| Surgical suture | Sylkam®, B Braun | C0760171 | |
| Syringe 100 U | BD | 324918 | For anesthesia before transcardial perfusion, 29G needle |
| Syringe RN 5uL SYR W/O NEEDLE | Hamilton | HA-7641-01 | For viral vector innoculation |
| BUFFERS AND REAGENTS | |||
| Aviden, Peroxidase Conjugate | Merck, Darmstadt, Germany | 189728 | |
| Bovine Serum Albumin | Merck, Darmstadt, Germany | 9048-46-8 | |
| Cryotrotection buffer | Home made | N/A | 20% glycerine and 2% DMSO in PBS |
| DAPI | Abcam | ab228549 | |
| Diaminobenzidine | Merck, Darmstadt, Germany | D8001 | |
| Fluoromount -G T | Electron Microscopy Science | 17984-25 | |
| Gelatin | Merck, Darmstadt, Germany | 104078 | |
| Normal goat serum | Jackson ImmunoResearch Laboratory | 5000121 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 104005 | |
| PBS | Home made | N/A | 0.125 M, pH 7.4 |
| Peroxidase inactivating buffer | Home made | N/A | 0.03% H2O2 in methanol |
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| Trizma Hydrochloride | Merck, Darmstadt, Germany | 1185-53-1 | |
| Tween 20 | Sigma-Aldrich | 822184 | |
| ANTIBODIES | |||
| Biotin-SP (long spacer) AffiniPure Goat Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch Laboratory | 111065003 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11010 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 647 | ThermoFisher Scientific | A21244 | |
| Goat anti-Rat IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11081 | |
| Rabbit monoclonal anti-alpha-Synuclein | Abcam | ab138501 | |
| Rabbit monoclonal anti-Iba-1 | Abcam | EPR16588 | |
| Rabbit polyclonal anti-Tyrosine Hydroxylase | Millipore | AB152 | |
| Rat monoclonal anti-CD4 | Biolegend | 100402 | |
| SOFTWARES | |||
| GraphPad | Prism | 6.0 | Fos stats analysis |
| ImageJ | National Institute of Health | N/A | For image analysis |
| LAS X | Leica | N/A | For image capture with Leica microscope |
| ProgRes Capture Pro | Jenoptik | N/A | For image capture with Olympus microscope |
| VLC media player | VideoLAN Organization | N/A | For analysis of behavioural tests |
参考文献
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiology of Aging. 24 (2), 197-211 (2003).
- Lim, K. L., Zhang, C. W. Molecular events underlying Parkinson's disease - An interwoven tapestry. Frontiers in Neurology. 4, 33(2013).
- Abdelmotilib, H., et al. α-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Mori, F., et al. Relationship among alpha-synuclein accumulation, dopamine synthesis, and neurodegeneration in Parkinson disease substantia nigra. The Journal of Neuropathology & Experimental Neurology. 65 (8), 808-815 (2006).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson's disease. Biochimica et Biophysica Acta. 1802 (1), 29-44 (2010).
- Vazquez-Velez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44, 87-108 (2021).
- Dehay, B., et al. Lysosomal impairment in Parkinson's disease. Movement Disorders. 28 (6), 725-732 (2013).
- Gonzalez, H., Elgueta, D., Montoya, A., Pacheco, R. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases. Journal of Neuroimmunology. 274 (1-2), 1-13 (2014).
- Pacheco, R. T-cell based immunotherapies for Parkinson's disease. Exploration of Neuroprotective Therapy. 1 (2), 72-85 (2021).
- Gonzalez, H., Contreras, F., Pacheco, R. Regulation of the neurodegenerative process associated to Parkinson's disease by CD4+ T-cells. Journal of Neuroimmune Pharmacology. 10 (4), 561-575 (2015).
- Gonzalez, H., Pacheco, R. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases. Journal of Neuroinflammation. 11 (1), 201(2014).
- Campos-Acuna, J., Elgueta, D., Pacheco, R. T-cell-driven inflammation as a mediator of the gut-brain axis involved in Parkinson's disease. Frontiers in Immunology. 10, 239(2019).
- Blesa, J., Phani, S., Jackson-Lewis, V., Przedborski, S. Classic and new animal models of Parkinson's disease. Journal of Biomedicine and Biotechnology. 2012, 845618(2012).
- Ulusoy, A., Decressac, M., Kirik, D., Bjorklund, A. Viral vector-mediated overexpression of alpha-synuclein as a progressive model of Parkinson's disease. Progress in Brain Research. 184, 89-111 (2010).
- Gomez-Benito, M., et al. Modeling Parkinson's disease with the alpha-synuclein protein. Frontiers in Pharmacology. 11, 356(2020).
- Song, L. K., et al. Targeted overexpression of alpha-synuclein by rAAV2/1 vectors induces progressive nigrostriatal degeneration and increases vulnerability to MPTP in mouse. PLoS One. 10 (6), 0131281(2015).
- Theodore, S., Cao, S., McLean, P. J., Standaert, D. G. Targeted overexpression of human alpha-synuclein triggers microglial activation and an adaptive immune response in a mouse model of Parkinson disease. Journal of Neuropathology and Experimental Neurology. 67 (12), 1149-1158 (2008).
- Sanchez-Guajardo, V., Annibali, A., Jensen, P. H., Romero-Ramos, M. alpha-Synuclein vaccination prevents the accumulation of parkinson disease-like pathologic inclusions in striatum in association with regulatory T cell recruitment in a rat model. Journal of Neuropathology and Experimental Neurology. 72 (7), 624-645 (2013).
- Sanchez-Guajardo, V., Febbraro, F., Kirik, D., Romero-Ramos, M. Microglia acquire distinct activation profiles depending on the degree of alpha-synuclein neuropathology in a rAAV based model of Parkinson's disease. PLoS One. 5 (1), 8784(2010).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular Neurodegeneration. 8, 44(2013).
- Cho, C., et al. Evaluating analgesic efficacy and administration route following craniotomy in mice using the grimace scale. Scientific Reports. 9 (1), 359(2019).
- Flecknell, P. Laboratory Animal Anaesthesia. 3rd Ed. , ElsevierAcademic Press. Cambridge, MA. (2009).
- Bind, R. H., Minney, S. M., Rosenfeld, S., Hallock, R. M. The role of pheromonal responses in rodent behavior: Future directions for the development of laboratory protocols. Journal of the American Association for Laboratory Animal Science. 52 (2), 124-129 (2013).
- Paxinos, G., Franklin, K. B. J. The Mouse Brain in Stereotaxic Coordinates. , Academic Press. Cambridge, MA. (2001).
- Elgueta, D., et al. Dopamine receptor D3 expression is altered in CD4+ T-cells from Parkinson's disease patients and its pharmacologic inhibition attenuates the motor impairment in a mouse model. Frontiers in Immunology. 10, 981(2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Fernandez-Suarez, D., et al. The monoacylglycerol lipase inhibitor JZL184 is neuroprotective and alters glial cell phenotype in the chronic MPTP mouse model. Neurobiology of Aging. 35 (11), 2603-2616 (2014).
- Elgueta, D., et al. Pharmacologic antagonism of dopamine receptor D3 attenuates neurodegeneration and motor impairment in a mouse model of Parkinson's disease. Neuropharmacology. 113, 110-123 (2017).
- Montoya, A., et al. Dopamine receptor D3 signalling in astrocytes promotes neuroinflammation. Journal of Neuroinflammation. 16 (1), 258(2019).
- Williams, G. P., et al. Targeting of the class II transactivator attenuates inflammation and neurodegeneration in an alpha-synuclein model of Parkinson's disease. Journal of Neuroinflammation. 15 (1), 244(2018).
- Benskey, M. J., et al. Silencing alpha synuclein in mature nigral neurons results in rapid neuroinflammation and subsequent toxicity. Frontiers in Molecular Neuroscience. 11, 36(2018).
- Rieker, C., et al. Neuropathology in mice expressing mouse alpha-synuclein. PLoS One. 6 (9), 24834(2011).
- Harms, A. S., et al. alpha-Synuclein fibrils recruit peripheral immune cells in the rat brain prior to neurodegeneration. Acta Neuropathologica Communications. 5 (1), 85(2017).
- Williams, G. P., et al. CD4 T cells mediate brain inflammation and neurodegeneration in a mouse model of Parkinson disease. Brain. 144 (7), 2047-2059 (2021).
- Matheoud, D., et al. Intestinal infection triggers Parkinson's disease-like symptoms in Pink1(-/-) mice. Nature. 571 (7766), 565-569 (2019).
- Jan, A., Goncalves, N. P., Vaegter, C. B., Jensen, P. H., Ferreira, N. The prion-like spreading of alpha-synuclein in Parkinson's disease: Update on models and hypotheses. International Journal of Molecular Sciences. 22 (15), 8338(2021).
- Chesselet, M. F., et al. A progressive mouse model of Parkinson's disease: The Thy1-aSyn ("Line 61") mice. Neurotherapeutics. 9 (2), 297-314 (2012).
- Sampson, T. R., et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease. Cell. 167 (6), 1469-1480 (2016).
- Ciron, C., et al. Human alpha-iduronidase gene transfer mediated by adeno-associated virus types 1, 2, and 5 in the brain of nonhuman primates: Vector diffusion and biodistribution. Human Gene Therapy. 20 (4), 350-360 (2009).
- Ben-Shaanan, T. L., et al. Activation of the reward system boosts innate and adaptive immunity. Nature Medicine. 22 (8), 940-944 (2016).
- Albert, K., Voutilainen, M. H., Domanskyi, A., Airavaara, M. AAV vector-mediated gene delivery to substantia nigra dopamine neurons: Implications for gene therapy and disease models. Genes. 8 (2), 63(2017).
- Bordia, T., Perez, X. A., Heiss, J., Zhang, D., Quik, M. Optogenetic activation of striatal cholinergic interneurons regulates L-dopa-induced dyskinesias. Neurobiology of Disease. 91, 47-58 (2016).
- Kim, A., et al. Upgraded methodology for the development of early diagnosis of Parkinson's disease based on searching blood markers in patients and experimental models. Molecular Neurobiology. 56 (5), 3437-3450 (2018).
- Lei, H., et al. Parkinson's disease diagnosis via joint learning from multiple modalities and relations. IEEE Journal of Biomedical and Health Informatics. 23 (4), 1437-1449 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved