Method Article
Analisi del modello murino della malattia di Parkinson indotto da vettori virali adeno-associati che codificano la α-sinucleina umana
In questo articolo
Riepilogo
Questo lavoro analizza la dose vettoriale e il tempo di esposizione necessari per indurre neuroinfiammazione, neurodegenerazione e compromissione motoria in questo modello preclinico di malattia di Parkinson. Questi vettori che codificano la α-sinucleina umana vengono consegnati nella substantia nigra per ricapitolare la patologia sinucleina associata al morbo di Parkinson.
Abstract
La malattia di Parkinson è una malattia neurodegenerativa che comporta la morte dei neuroni dopaminergici della via nigrostriatale e, di conseguenza, la progressiva perdita di controllo dei movimenti volontari. Questo processo neurodegenerativo è innescato dalla deposizione di aggregati proteici nel cervello, che sono costituiti principalmente da α-sinucleina. Diversi studi hanno indicato che la neuroinfiammazione è necessaria per sviluppare la neurodegenerazione associata al morbo di Parkinson. In particolare, il processo neuroinfiammatorio coinvolge l'attivazione microgliale e l'infiltrazione di cellule T periferiche nella substantia nigra (SN). Questo lavoro analizza un modello murino della malattia di Parkinson che ricapitola l'attivazione microgliale, l'infiltrazione delle cellule T nel SN, la neurodegenerazione dei neuroni dopaminergici nigrali e la compromissione motoria. Questo modello murino della malattia di Parkinson è indotto dalla somministrazione stereotassica di vettori virali adeno-associati che codificano la α-sinucleina wild-type umana (AAV-hαSyn) nel SN. La corretta consegna di vettori virali nel SN è stata confermata utilizzando vettori di controllo che codificano per la proteina fluorescente verde (GFP). Successivamente, è stato valutato il modo in cui la dose di AAV-hαSyn somministrata nel SN ha influenzato l'estensione dell'espressione di hαSyn, la perdita di neuroni dopaminergici nigrali e la compromissione motoria. Inoltre, le dinamiche dell'espressione di hαSyn, dell'attivazione microgliale e dell'infiltrazione delle cellule T sono state determinate durante il decorso temporale dello sviluppo della malattia. Pertanto, questo studio fornisce punti temporali critici che possono essere utili per indirizzare la patologia della sinucleina e la neuroinfiammazione in questo modello preclinico della malattia di Parkinson.
Introduzione
Dopo il morbo di Alzheimer, il morbo di Parkinson è la seconda malattia neurodegenerativa più diffusa in tutto il mondo. I neuroni primari colpiti nella malattia di Parkinson sono quelli della via nigrostriatale, che producono dopamina e controllano il movimento volontario. Di conseguenza, il sintomo più caratteristico associato a questo disturbo è la compromissione motoria. Questa patologia comporta anche la deposizione di aggregati proteici nel cervello, che sono composti principalmente da α-sinucleina (αSyn)1, una proteina citosolica associata ai terminali presinaptici. L'evidenza ha dimostrato che la generazione di inclusioni patogene di αSyn è innescata da un misfolding o da alcune modifiche post-traduzionali di questa proteina2.
In particolare, è stata stabilita una stretta relazione tra la patologia αSyn e la perdita di neuroni dopaminergici della via nigrostriatale nella malattia di Parkinson umana e nei modelli animali 3,4. Capire come vengono generati gli aggregati αSyn e come inducono la morte neuronale rappresenta una sfida significativa nel campo. Un gruppo crescente di studi ha dimostrato che, aumentando lo stress ossidativo, la disfunzione mitocondriale è una delle principali cause per la generazione di aggregati αSyn2. Infatti, diversi geni associati al rischio di malattia di Parkinson codificano proteine coinvolte nella funzione mitocondriale, nella morfologia e nelladinamica 5,6. Inoltre, la disfunzione lisosomiale, che provoca l'accumulo di mitocondri disfunzionali e αSyn mal ripiegato, costituisce un altro evento importante che promuove la generazione di aggregati αSyn7.
Prove emergenti hanno indicato che, una volta che gli aggregati di αSyn si depositano nel cervello, queste proteine patogene stimolano i recettori toll-like (TLR) sulla microglia, innescando così l'attivazione microgliale e un ambiente infiammatorio iniziale nella substantia nigra (SN)8,9. Inoltre, l'evidenza indica che gli aggregati di αSyn vengono catturati e presentati dalle cellule che presentano l'antigene alle cellule T, inducendo una risposta immunitaria adattativa specifica per αSyn10,11. Queste cellule T αSyn-specifiche successivamente si infiltrano nel cervello e vengono ristimolate da microglia attivate, promuovendo così la secrezione di fattori neurotossici che evocano la morte neuronale 9,10. È interessante notare che diverse linee di prova hanno suggerito che gli aggregati αSyn vengono generati prima nel sistema nervoso enterico e poi trasportati attraverso il nervo vago al tronco cerebrale12.
Diversi modelli animali di morbo di Parkinson sono stati utilizzati per molti anni, compresi quelli indotti dalla somministrazione di sostanze neurotossiche (cioè 6-idrossidopamina, paraquat, rotenone, 1-metil-4-fenil-1,2,3,6-tetraidropiridina) e quelli che coinvolgono condizioni genetiche (cioè α-sinucleina mutante, chinasi ripetuta 2 ricca di leucina mutante)13 . Nonostante i modelli che coinvolgono la neurodegenerazione indotta da neurotossine che replicano alcuni aspetti della malattia di Parkinson, nessuno di essi ricapitola tutti gli aspetti essenziali della malattia o non sono progressivi13. D'altra parte, sebbene i modelli murini genetici che coinvolgono l'espressione di versioni mutanti della chinasi ripetuta 2 ricca di leucina, le versioni mutanti della α-sinucleina o la sovraespressione della α-sinucleina wild-type umana provochino compromissione motoria e, in alcuni casi, anche lo sviluppo della sinucleinopatia, non riproducono una neurodegenerazione prominente dei neuroni dopaminergici ninigrali, che è un aspetto essenziale della malattia di Parkinson13, 14. Un terzo tipo di modello animale di neurodegenerazione è riuscito a soddisfare la maggior parte degli aspetti essenziali della malattia di Parkinson, la somministrazione stereotassica di vettori virali adeno-associati (AAV) che codificano per la α-sinucleina umana (AAV-hαSyn)14,15. È importante sottolineare che gli AAV consentono la trasduzione di neuroni con elevata efficacia e a lungo termine nel cervello adulto dei mammiferi. Inoltre, la somministrazione stereotassica di AAV-hαSyn nel SN ha dimostrato di riprodurre molti degli aspetti essenziali della malattia, tra cui la patologia αSyn, l'attivazione microgliale, la neurodegenerazione e la compromissione motoria 16,17,18,19,20. Questo studio presenta un'analisi di come la dose di vettore virale e il tempo dopo la consegna del vettore virale influenzano l'estensione dell'espressione di hαSyn, la neurodegenerazione e la neuroinfiammazione nella via nigrostriatale, nonché il grado di compromissione motoria nel modello murino di consegna stereotassica unilaterale di hαSyn nel SN.
Protocollo
Tutti gli studi sono stati condotti nell'ambito dell'8a edizione della Guida per la cura e l'uso degli animali da laboratorio. I protocolli sperimentali sono stati approvati dalla IACUC presso la Fundación Ciencia & Vida (Science for Life Foundation), compresi quelli che coinvolgono anestesia, dolore, angoscia ed eutanasia (numero di permesso P-035/2022).
1. La chirurgia stereotassica
- Preparazione per l'intervento chirurgico (circa 1 ora)
- Per mantenere un ambiente asettico, indossare abiti chirurgici appropriati durante l'intero intervento chirurgico, compresi copriscarpe, una maschera chirurgica, una barriera sanitaria, guanti e un cappuccio chirurgico.
- Spruzzare il 70% di etanolo sul topo e tutto il materiale chirurgico per mantenere un ambiente asettico.
- Per indurre l'analgesia, iniettare nel topo carprofene 5 mg/kg per via sottocutanea (s.c.) ogni 12 ore21 a partire da 1 ora prima dell'intervento e continuando fino a 3 giorni dopo l'intervento.
- Per anestetizzare il topo, posizionare l'animale in una camera di induzione. Aprire il flusso di isoflurano ad una velocità dello 0,5% e quindi aumentarlo lentamente fino al 5% per circa 5 minuti fino a quando il mouse non ha perso il riflesso di raddrizzamento22.
- Rimuovere l'animale dalla camera di induzione. Trasferire immediatamente l'animale in un circuito non respirante con un cono nasale di dimensioni appropriate. Mantenere l'anestesia del topo con isoflurano 1% per tutto il tempo dell'intervento chirurgico.
- Conferma che il mouse sia completamente anestetizzato pizzicando la coda e le zampe. Quando il mouse non reagisce al pizzicamento della coda e delle zampe, significa che il mouse è completamente anestetizzato.
- Rasare la testa del topo usando le forbici. Pulire la pelle del topo con un batuffolo di cotone con clorexidina 2% e rimuovere tutti i capelli.
- Fissare la testa del mouse nella cornice stereotassica.
- Posizionare un protettivo corneale in entrambi gli occhi del topo usando un batuffolo di cotone. Per prevenire l'induzione dello stress in altri roditori, evitare la presenza di qualsiasi altro topo nella sala operatoria23.
- L'intervento chirurgico (circa 30 min)
- Pulire la testa del topo con tre cicli di clorexidina al 2% seguiti da etanolo al 70%. Esporre il cranio con materiale chirurgico e praticare un foro sottile con un trapano alle seguenti coordinate: anteroposterior -2,8 mm e mediolaterale 1,4 mm rispetto alla linea mediale.
- Mettere l'ago di una siringa da 10 μL nel foro e spostare lentamente l'ago all'interno del cervello fino ad arrivare a -7,2 mm dorsoventral rispetto alla dura24.
- Lasciare l'ago nella posizione finale per 2 minuti per consentire al tessuto di depositarsi un po ', quindi iniettare 1 μL di AAV5-CBA-hαSyn (AAV-hαSyn), AAV5-CBA-eGFP (AAV-GFP) o veicolo (PBS a pH 7,4; chirurgia fittizia) nella giusta substantia nigra ad una velocità di 0,2 μL / 30 s.
- Lasciare l'ago nella stessa posizione per 5 minuti dopo la consegna dei vettori virali e quindi ritirarlo lentamente.
- Post-operatorio (circa 5 min)
- Chiudere la ferita utilizzando una sutura sterile non riassorbibile intrecciata con seta.
- Metti il mouse nella gabbia di casa prima del riscaldamento posizionandolo su un materasso riscaldato elettricamente (25 ° C).
NOTA: Il topo deve essere mantenuto da solo nella gabbia di casa fino a quando non è in grado di camminare senza difficoltà e la ferita è guarita.
2. Determinazione delle prestazioni del motore mediante la prova del fascio
- Allenamento (circa 15 minuti per mouse)
- Dodici settimane dopo l'intervento stereotassico, valutare le prestazioni motorie utilizzando una versione semplificata del test del fascio descritto primadel 25. A tale scopo, utilizzare una trave orizzontale di 25 cm di lunghezza e 3 cm di larghezza. La superficie della trave deve essere coperta da una griglia metallica con quadrati di 1 cm e rialzati di 1 cm sopra la trave.
- Fai un video del mouse che attraversa il raggio della superficie della griglia da un'estremità all'estremità opposta del raggio, dove si trova la gabbia domestica. Addestrare il mouse per 2 giorni prima della determinazione delle prestazioni del motore.
- Il primo giorno, allena il mouse a camminare attraverso il raggio cinque volte senza la griglia.
- Il secondo giorno, allena il mouse a camminare attraverso il raggio in presenza della griglia cinque volte.
- Il test (circa 5 minuti per mouse)
- Il terzo giorno, valutare le prestazioni del motore. Per fare ciò, quantifica il numero di errori eseguiti dalle zampe sinistre o dalle zampe destre separatamente guardando i video in modalità slow-motion.
NOTA: un errore è definito come quando una zampa non calpesta correttamente la griglia e, quindi, diventa visibile sul lato della griglia o tra la griglia e la superficie del raggio.
- Il terzo giorno, valutare le prestazioni del motore. Per fare ciò, quantifica il numero di errori eseguiti dalle zampe sinistre o dalle zampe destre separatamente guardando i video in modalità slow-motion.
3. Lavorazione dei tessuti
- Perfusione transcardica (circa 15 min per topo)
- Per anestetizzare il topo, iniettare una miscela di ketamina (80 mg/kg) e xilazina (10 mg/kg) per via intraperitoneale (i.p.) utilizzando una siringa da 1 mL e un ago da 27 G26.
- Una volta che il topo è completamente anestetizzato (confermato come nel passaggio 1.1.6.), aprire il torace con materiale chirurgico ed esporre il cuore.
- Quindi, inserire un ago da 21 G (rendere la punta piatta usando un trapano) nel ventricolo sinistro del cuore.
- Accoppiando l'ago a un tubo, perfondere 50 mL di PBS (pH 7,4) ad una velocità di 9,5 ml/min utilizzando una pompa peristaltica.
- Fissare e crioproteggere il cervello (circa 10 minuti per cervello)
- Rimuovere il cervello usando forbici e pinzette, quindi fissarlo per immersione in 5 ml di paraformaldeide al 4% in PBS (pH 7,4) a 4 °C per 24 ore.
- Successivamente, metti il cervello fisso in 15 ml di saccarosio al 30% a 4 ° C per 48 ore.
- Quindi, mettere il cervello in 4 ml di soluzione di crioprotezione (20% di glicerina e 2% DMSO in PBS) e salvare il cervello a -80 ° C o usarlo immediatamente nella fase successiva.
- Ottenere fette di cervello (circa 20 minuti per cervello).
NOTA: Assicurarsi che il cervello sia posto in un criostato in una posizione corretta per effettuare tagli coronali.- Per ottenere fette SN, tagliare il cervello in sezioni spesse 40 μm a partire da -2,92 mm e finendo a -3,64 mm24.
- Raccogliere ogni fetta in un pozzo (contenente 1 mL di soluzione di crioprotezione) di una piastra a 24 pozzetti seguendo un ordine anteroposteriore come descritto primadi 25,27,28.
- Per eseguire analisi immunoistochimiche (sezione 4.) e immunofluorescenza (sezione 5.) nel SN, scegliere sei sezioni SN coronali prese a intervalli uniformi (120 μm) che coprono l'intera estensione rostrocaudale del nucleo (720 μm in totale), come descritto primadi 25,27,28.
- Per ottenere fette striatali, tagliare il cervello in sezioni spesse 40 μm a partire da +1,34 mm e terminando a -0,26 mm24.
- Raccogliere ogni fetta in un criotubo da 2 ml (contenente 1 mL di soluzione di crioprotezione) seguendo un ordine anteroposteriore.
- Per eseguire analisi immunoistochimiche (sezione 4.) e immunofluorescenza (sezione 5.) nello striato, scegliere cinque sezioni striatal coronali prese a intervalli uniformi (320 μm) che coprono l'intera estensione rostrocaudale del nucleo (1600 μm in totale).
4. Analisi immunoistochimiche per quantificare i neuroni dopaminergici e la microgliosi (circa 2 giorni)
- Per l'analisi immunoistochimica di fette striatal o nigrali, posizionare il set di cinque (striato) o sei (SN) fette dallo stesso cervello in un pozzetto di una piastra a 24 pozzetti.
- Lavare le sezioni 3x con 1 mL di PBS e poi incubare con 0,5 mL di 0,03% H2O2 in metanolo a temperatura ambiente e con agitazione per 30 minuti per inattivare l'attività della perossidasi endogena.
- Lavare le sezioni 3x con 1 mL di PBS e incubare con 0,5 mL di soluzione bloccante (4% siero di capra, 0,05% Triton X-100 e 4% BSA in PBS) a temperatura ambiente e con agitazione per 40 min.
- Successivamente, incubare con 0,5 mL di soluzione bloccante contenente l'anticorpo primario (coniglio anti-tirosina idrossilasi [TH] pAb diluito 1:1000 [vedere Tabella 1]; o coniglio anticorpo anti-Iba1 diluito 1:1000) a temperatura ambiente e con agitazione durante la notte.
- Lavare i paragrafi 3x con 1 mL di PBS e incubare con 0,5 mL di soluzione bloccante contenente pAb anti-coniglio di capra biotinilato (1:500, vedere Tabella 1) a temperatura ambiente e con agitazione per 2 ore.
- Quindi, lavare le sezioni 3 volte con 1 mL di PBS e incubare con 0,5 mL di avidina coniugata con perossidasi (1:5000, vedere Tabella 1) in soluzione bloccante a temperatura ambiente e con agitazione per 90 minuti.
- Lavare le sezioni 3x con 1 mL di PBS e incubare con 0,5 mL di soluzione di substrato (0,05% diaminobenzidina in tampone 0,03% H2O2/Trizma-HCl a pH 7,6). Indossare guanti e un cappotto da laboratorio per questo passaggio, poiché la diaminobenzidina è un potenziale cancerogeno.
- Quando la colorazione specifica è evidente (tipicamente 30 sec per TH e 5 min per Iba1), estrarre la soluzione di substrato e lavare le sezioni 3x con 1 mL di PBS a temperatura ambiente e con agitazione. Eseguire sempre l'immunocolorazione di fette di tutti i cervelli inclusi nello stesso esperimento contemporaneamente.
NOTA: La colorazione specifica di TH è evidente quando l'immunocolorazione TH appare nell'area del SN, che mostra una forma caratteristica nel cervello. Il segno specifico di Iba1 è determinato quando l'immunocolorazione Iba1 appare su fette di cervello di controllo con tipiche forme microgliali, che sono confermate dall'osservazione al microscopio. In questo modo, il tempo esatto di esposizione del substrato per l'analisi IHC viene determinato per ogni singolo esperimento. - Montare le sezioni cerebrali su vetrini usando una soluzione di gelatina allo 0,2% in 0,05 M Tris (pH 7,6). Posiziona ogni set di cinque (striato) o sei (SN) fette ottenute dallo stesso cervello in ordine rostrocaudale sullo stesso vetrino.
- Quantificare il numero di neuroni TH+ nel SN.
- Per quantificare i neuroni TH+ nel SN, acquisire le foto delle sei fette con ingrandimento 20x utilizzando un microscopio a campo luminoso, come descritto primadi 25,27,28. Utilizzare la seguente regolazione del colore: temperatura di colore 3200 K, rosso ciano 40%, magenta-verde 39%, giallo-blu 54%, gamma 0,5, contrasto 37, luminosità 13, saturazione 5.
- Utilizzando il software Image J, selezionare il perimetro dell'SN pars compacta nell'emisfero analizzato. Evitare la selezione di neuroni TH+ dall'area tegmentale ventrale (VTA).
- Successivamente, chiedi al software di calcolare l'area selezionata (in genere 0,04-0,07 mm2 / emisfero, a seconda della posizione rostrocaudale). Quindi, utilizzando lo strumento multipunto, tagga ogni singolo neurone TH + con un punto.
- Utilizzando lo strumento punto, chiedi al software di contare il numero totale di punti. Con il numero di punti totali (neuroni TH+ ) e l'area dello SNpc, calcola la densità dei neuroni TH+ /mm2.
- Ripeti lo stesso calcolo in entrambi gli emisferi sulle sei fette SN e poi calcola la media dei neuroni TH+ /mm2 sui lati oplaterale e controlaterale.
- Quantificare il numero di microglia attivate nello striato
- Per quantificare la microglia attivata nello striato, acquisire due foto in ciascun emisfero per tutte e cinque le fette striatali con ingrandimento 20x utilizzando un microscopio a campo luminoso e le stesse impostazioni indicate nel passaggio 4.10.1. Utilizzando il software Image J, in ogni singola foto (che visualizza un'area di 660 μm x 877 μm), tagga con un punto ogni singola cella esprimendo un'elevata intensità Iba1 e forma ameboide utilizzando lo strumento multipunto. Utilizzando lo strumento punto, chiedi al software di contare il numero totale di punti.
- Con il numero di punti totali e l'area della foto, calcolare la densità della microglia attivata (cellealte Iba1/mm2) come eseguita prima di29.
| Antigene bersaglio | Accoppiato a | Clonalità | Specie host | Reattività delle specie* | Diluizione** |
| Tirosina idrossilasi | N/D | Policlonale | Coniglio | Topo, Ratto, Umano | 1/200 - 1/1000 |
| Iba1 · | N/D | Monoclonale | Coniglio | Topo, Ratto, Umano | 1/1000 |
| alfa-sinucleina | N/D | Monoclonale | Coniglio | Umano | 1/150 |
| CD4 · | N/D | Monoclonale | Ratto | Topo | 1/250 |
| IgG (H+L) | Biotinilato | Policlonale | Capra | Coniglio | 1/500 |
| IgG (H+L) | AlexaFluor 546 · | Policlonale | Capra | Coniglio | 1/500 |
| IgG (H+L) | AlexaFluor 647 · | Policlonale | Capra | Coniglio | 1/500 |
| IgG (H+L) | AlexaFluor 546 · | Policlonale | Capra | Ratto | 1/500 |
Tabella 1: Diluizioni anticorpali. N/D, non applicabile. *, È specificato solo se ci sono reattività con topo, ratto e umano, indipendentemente dalla reattività con altre specie. **, viene specificata una singola diluizione o un intervallo di diluizione.
5. Analisi di immunofluorescenza per valutare l'infiltrazione delle cellule T nella via nigrostriatale (circa 2 giorni)
- Per l'analisi di immunofluorescenza di hαSyn o TH / GFP su fette striatali o nigrali, mettere insieme l'insieme di cinque (striato) o sei (SN) fette dallo stesso cervello in un pozzetto di una piastra a 24 pozzetti.
- Lavare le sezioni 3x con 1 mL di PBS e quindi incubare con 0,5 mL di soluzione bloccante (0,3% Triton X-100, 0,05% tween20 e 5% BSA in PBS) a temperatura ambiente e con agitazione per 40 min.
- Successivamente, incubare con 0,5 mL di soluzione bloccante contenente l'anticorpo primario (coniglio anti-TH pAb diluito 1:500; o coniglio anticorpo anti-hαSyn diluito 1:150, vedere Tabella 1) a temperatura ambiente e con agitazione durante la notte.
- Lavare i paragrafi 3x con 1 mL di PBS e incubare con 0,5 mL di soluzione bloccante contenente anticorpo secondario anti-coniglio accoppiato AlexaFluor546 (1:500, vedere Tabella 1) e 4′,6-diamidino-2-fenilindolo (DAPI; 1:1000) a temperatura ambiente e con agitazione per 2 ore. Quindi, lavare le sezioni 3x con 1 mL di PBS.
- Montare le sezioni cerebrali su vetrini come descritto sopra (passo 4.9.). Le immagini sono state acquisite con un microscopio a fluorescenza invertita accoppiato a un alimentatore.
- Per l'analisi di immunofluorescenza di TH / CD4 / GFP (Foxp3) su fette di nigrale, posizionare il set di sei fette (SN) dello stesso cervello in un pozzetto di una piastra a 24 pozzetti. Lavare le sezioni 3x con 1 mL di PBS e quindi incubare con 0,5 mL di soluzione bloccante (0,5% Triton X-100, gelatina di pelle di pesce allo 0,5% in PBS) a temperatura ambiente e con agitazione per 2 ore.
- Incubare con 0,5 mL di soluzione bloccante contenente gli anticorpi primari coniglio anti-TH pAb (1:200, vedere Tabella 1) e ratto anti-CD4 (1:250) a 4 °C e con agitazione durante la notte.
- Lavare i paragrafi 3x con 1 mL di PBS e incubare con 0,5 mL di soluzione bloccante contenente anti-coniglio accoppiato ad AlexaFluor 647 (1:500, vedi Tabella 1) e anti-ratto accoppiato ad AlexaFluor 546 (1:500) a temperatura ambiente e con agitazione per 2 ore. Quindi, lavare le sezioni 3x con 1 mL di PBS.
- Metti ogni set di sei (SN) fette ottenute dallo stesso cervello in ordine rostrocaudale sullo stesso vetrino e montale usando Fluoromount G. Acquisisci immagini usando un microscopio Leica DMi8. Utilizzare le impostazioni del microscopio confocale indicate nella Tabella 2 per acquisire immagini dall'analisi di immunofluorescenza.
| Nome Chanel | Cubo | Emissione Lunghezza d'onda | Nome della tabella di ricerca | Tempo di esposizione | Guadagnare | Risoluzione XY | Risoluzione Z |
| Canale 1 | Y5 · | 700nm | Grigio | 1.011,727 ms | alta capacità del pozzo | 2.237 um | 24.444 um |
| Canale 2 | GFP · | 525nm | Verde | 326,851 ms | alta capacità del pozzo | 2.237 um | 24.444 um |
| Canale 3 | TXR · | 630nm | Rosso | 406,344 ms | alta capacità del pozzo | 2.237 um | 24.444 um |
| Canale 4 | Dapi · | 460nm | Blu | 91,501 ms | alta capacità del pozzo | 2.237 um | 24.444 um |
Tabella 2: Impostazioni del microscopio confocale utilizzate per l'acquisizione di immagini dall'analisi di immunofluorescenza.
6. Analisi statistica
- Per confrontare i dati ottenuti dai lati ipsilaterale e controlaterale, utilizzare un t-test dello studente a due code accoppiato.
- Per confrontare i dati ottenuti da topi che ricevono AAV-hαSyn e da topi che ricevono AAV-GFP o chirurgia fittizia, utilizzare un t-test di Studente a due code spaiato. Considerare le differenze significative quando i valori P < 0,05.
Risultati
Convalida della corretta consegna dei vettori AAV nei neuroni dopaminergici della via nigrostriatale
Per studiare i processi di neuroinfiammazione, neurodegenerazione e compromissione motoria promossi dalla patologia della sinucleina, è stato utilizzato un modello murino di malattia di Parkinson indotto dalla somministrazione stereotassica unilaterale di AAV che codifica hαSyn nel SN 16,17,30,31 (vedere il disegno sperimentale nella Figura supplementare 1 ). Per convalidare la corretta consegna di vettori AAV nei neuroni dopaminergici della via nigrostriatale, aAAV che codifica GFP (AAV-GFP) è stato iniettato nel SN e 12 settimane dopo, la fluorescenza GFP e l'immunoreattività tirosina idrossilasi (TH) sono state analizzate nel SN e nello striato mediante immunofluorescenza. La fluorescenza associata alla GFP è stata osservata esclusivamente sul lato ipsilaterale e c'è stata una significativa colocalizzazione con immunoreattività TH sia nel SN che nello striato, indicando la corretta consegna di vettori AAV nei neuroni dopaminergici della via nigrostriatale (Figura 1).
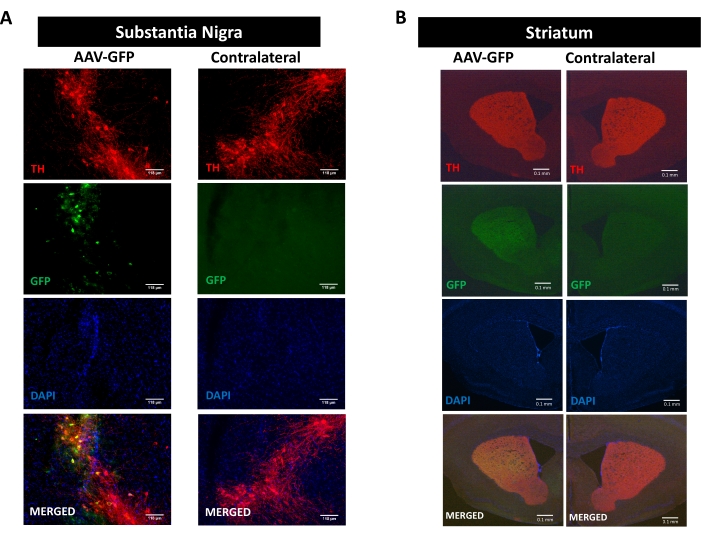
Figura 1: Analisi della somministrazione di AAV-GFP nella via nigrostriatale. I topi hanno ricevuto AAV-GFP (1 x10 10 vg / mouse) e 12 settimane dopo sono stati sacrificati, e TH è stato immunocolorato in (A) SN (le barre di scala sono 118 μm) e (B) lo striato (le barre di scala sono 100 μm). La fluorescenza associata a TH e GFP è stata analizzata mediante microscopia a epifluorescenza. I nuclei sono stati colorati con DAPI. Vengono mostrate immagini rappresentative di colorazione unita o singola di TH (rosso), GFP (verde) e DAPI (blu). Fare clic qui per visualizzare una versione più grande di questa figura.
Impostazione della dose di vettore virale somministrato per indurre neurodegenerazione e compromissione motoria nel modello murino di malattia di Parkinson indotto da AAV-hαSyn
Per testare la dose di AAV-hαSyn necessaria per indurre una significativa sovraespressione di hαSyn che promuove la neurodegenerazione dei neuroni dopaminergici nicrali, sono state iniettate diverse dosi (1 x 108 genomi virali [vg]/topo, 1 x 109 vg/topo, o 1 x10 10 vg/topo) di AAV-hαSyn e 12 settimane dopo, l'immunoreattività hαSyn e l'entità dell'immunoreattività TH sono state valutate nella via nigrostriatale. Sebbene l'immunoreattività hαSyn fosse evidente con tutte le dosi testate nel SN (Figura 2), solo i topi che ricevevano 1 x 1010 vg/topo presentavano un'evidente immunoreattività hαSyn nello striato (Figura 3). Inoltre, i topi che ricevevano 1 x 1010 vg/topo di AAV-hαSyn hanno mostrato una significativa perdita di neuroni dopaminergici nel SN (Figura 4A,B). Sebbene i topi che ricevevano 1 x10 10 vg/topo di AAV-GFP mostrassero un basso grado (~20%) di perdita neuronale (Figura 4A,B), i topi che ricevevano la stessa dose di AAV-hαSyn presentavano un grado significativamente più elevato di neurodegenerazione dei neuroni dopaminergici nigrali (Figura 4C). Di conseguenza, ulteriori esperimenti sono stati eseguiti utilizzando 1 x10 10 vg / mouse di AAV-hαSyn. Inoltre, l'entità della compromissione motoria è stata determinata nei topi che ricevevano dosi diverse di AAV-hαSyn utilizzando il test del fascio (Figura 5A), come descritto primadi 25. Una significativa riduzione delle prestazioni del motore è stata rilevata esclusivamente con 1 x10 10 vg/mouse di AAV-hαSyn nel beam test sia quando si confronta il numero di errori commessi dal pad destro e sinistro (Figura 5B) sia quando si confronta il numero totale di errori dei topi che ricevono AAV-hαSyn rispetto ai topi che ricevono il vettore di controllo AAV-GFP (Figura 5C). Di conseguenza, ulteriori esperimenti sono stati eseguiti utilizzando 1 x10 10 vg / mouse di AAV-hαSyn.
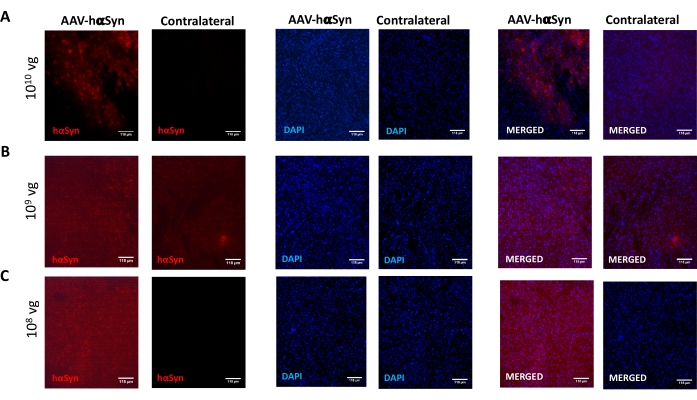
Figura 2: Analisi dell'espressione di α-sinucleina umana nel SN di topi trattati con diverse dosi di AAV-hαSyn. I topi hanno ricevuto AAV-hαSyn a (A) 1 x 1010 vg / mouse, (B) 1 x 109 vg / mouse, o (C) 1 x 108 vg / mouse e 12 settimane dopo sono stati sacrificati e l'espressione di hαSyn è stata analizzata mediante immunofluorescenza nel SN utilizzando la microscopia a epifluorescenza. I nuclei sono stati colorati con DAPI. Vengono mostrate immagini rappresentative di colorazione unita o singola di hαSyn (rosso) o DAPI (blu). Le barre della scala sono 118 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
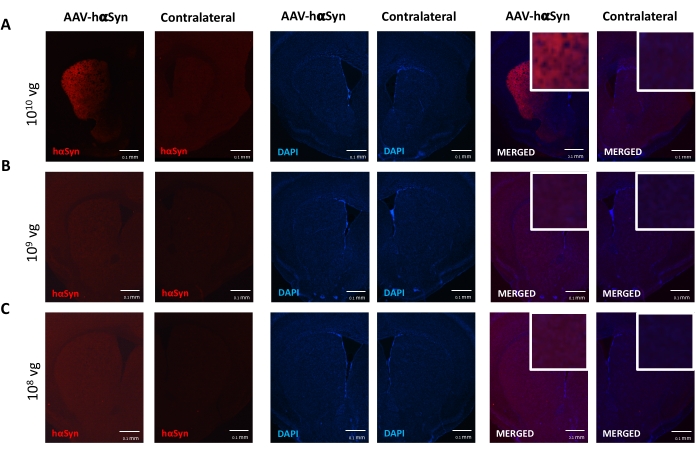
Figura 3: Analisi dell'espressione di α-sinucleina umana nello striato di topi trattati con diverse dosi di AAV-hαSyn. I topi hanno ricevuto AAV-hαSyn a (A) 1 x10 10 vg / mouse, (B) 1 x 109 vg / mouse, o (C) 1 x 108 vg / mouse) e 12 settimane dopo sono stati sacrificati e l'espressione di hαSyn è stata analizzata mediante immunofluorescenza nello striato usando la microscopia a epifluorescenza. I nuclei sono stati colorati con DAPI. Vengono mostrate immagini rappresentative di colorazione unita o singola di hαSyn (rosso) o DAPI (blu). Le barre della scala sono 100 μm. L'inserto nell'angolo in alto a destra delle immagini unite mostra un'area di interesse per un ingrandimento più elevato. Fare clic qui per visualizzare una versione più grande di questa figura.
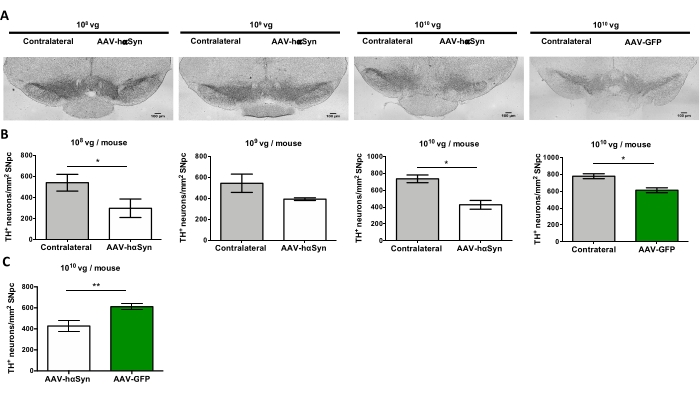
Figura 4: Perdita di neuroni dopaminergici del SN in topi trattati con diverse dosi di AAV-hαSyn o vettore di controllo. I topi hanno ricevuto AAV-hαSyn (1 x10 10 vg/mouse, 1 x 109 vg/mouse, o 1 x 108 vg/mouse) o AAV-GFP (1 x 1010 vg/mouse) e 12 settimane dopo sono stati sacrificati e TH è stato analizzato nel SNpc mediante immunoistochimica. (A) Immagini rappresentative. Barre di scala, 100 μm. (B,C) La densità dei neuroni è stata quantificata come il numero di neuroni TH+/mm2. I dati rappresentano ± medie SEM. n = 3-8 topi per gruppo. (B) Un confronto tra lati omolaterali e controlaterali è stato eseguito utilizzando il t-test di Student accoppiato a due code. (C) È stato effettuato un confronto dei lati ipsilaterali di topi che ricevevano 1 x10 10 vg/mouse di AAV-hαSyn o AAV-GFP. (B,C) Mentre le barre bianche indicano la quantificazione dei neuroni TH+ sul lato ipsilaterale dei topi che ricevono AAV-hαSyn, le barre verdi indicano la quantificazione dei neuroni TH+ sul lato ipsilaterale dei topi che ricevono AAV-GFP. Le barre grigie indicano la quantificazione dei neuroni TH+ sul lato controlaterale del gruppo corrispondente. I confronti sono stati eseguiti da un t-test di uno studente spaiato a due code. *p < 0,05; **p < 0,01. Fare clic qui per visualizzare una versione più grande di questa figura.
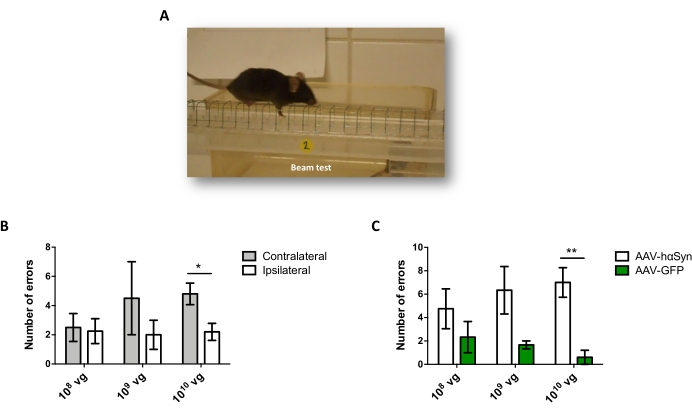
Figura 5: Analisi delle prestazioni motorie in topi trattati con diverse dosi di AAV-hαSyn. I topi hanno ricevuto dosi diverse (1 x10 10 vg/mouse, 1 x 109 vg/mouse o 1 x 108 vg/mouse) di AAV-hαSyn o AAV-GFP e, 12 settimane dopo, le prestazioni del motore sono state valutate dal test del fascio. (A) Immagine di un topo che cammina sul raggio. (B) Il numero di errori effettuati dagli arti sinistri (controlaterali) rispetto agli arti destri (ipsilaterali) è stato quantificato nei gruppi di topi trattati con AAV-hαSyn. (C) Il numero totale di errori è stato confrontato tra diversi gruppi sperimentali che ricevevano la stessa dose di AAV-hαSyn o AAV-GFP. I dati rappresentano ± medie SEM. n = 3-5 topi per gruppo. I confronti sono stati eseguiti da (B) un t-test di uno studente a due code accoppiato o da (C) un t-test di uno studente a due code spaiato. *p < 0,05; **p < 0,01. Fare clic qui per visualizzare una versione più grande di questa figura.
Impostazione della cinetica del modello di malattia di Parkinson indotta da AAV-αSyn
Dopo aver determinato la corretta dose di AAV-hαSyn utilizzata per indurre un livello significativo di neurodegenerazione e compromissione motoria, sono stati condotti esperimenti per definire l'insorgenza della sovraespressione di hαSyn. A tale scopo, i topi sono stati trattati con 1 x 1010 vg / topo di AAV-hαSyn o chirurgia fittizia. L'estensione dell'espressione di hαSyn è stata analizzata nel SN una volta alla settimana durante le settimane 2-5 dopo l'intervento stereotassico (vedere il disegno sperimentale nella Figura supplementare 2). I risultati mostrano che, nonostante l'espressione di hαSyn sia stata rilevata a bassi livelli già 2 settimane dopo l'intervento chirurgico, i cluster di hαSyn sono comparsi alla settimana 5 dopo l'intervento stereotassico (Figura 6).

Figura 6: Analisi del decorso temporale dell'espressione di α-sinucleina umana nel SN di topi trattati con AAV-hαSyn. I topi hanno ricevuto AAV-hαSyn (1 x 1010 vg / mouse) o solo la finta chirurgia stereotassica, e l'espressione di hαSyn nel SN è stata analizzata (A) 2 settimane, (B) 3 settimane, (C) 4 settimane o (D) 5 settimane dopo mediante immunofluorescenza utilizzando la microscopia a epifluorescenza. I nuclei sono stati colorati con DAPI. Vengono mostrate immagini rappresentative di colorazione unita o singola di hαSyn (rosso) o DAPI (blu). Barre di scala, 100 μm. L'inserto nell'angolo in alto a destra delle immagini unite mostra un'area di interesse per un ingrandimento più elevato. Fare clic qui per visualizzare una versione più grande di questa figura.
Successivamente, sono stati condotti esperimenti per determinare i punti temporali adatti per analizzare la neuroinfiammazione e l'infiltrazione delle cellule T nel sistema nervoso centrale (SNC) dopo la somministrazione stereotassica di AAV-hαSyn. Per determinare il picco di attivazione microgliale dopo il trattamento dei topi con AAV-hαSyn, l'estensione delle cellule che esprimono alti livelli di Iba1 nello striato è stata valutata una volta alla settimana durante le settimane 2-15 dopo l'intervento stereotassico. I risultati mostrano un aumento significativo dell'attivazione microgliale del lato ipsilaterale rispetto al lato controlaterale dei topi 15 settimane dopo il trattamento con AAV-hαSyn (Figura 7). Il numero di cellule Treg (CD4+ Foxp3+) infiltrate nel SNpc è stato valutato anche in diversi punti temporali dopo che la somministrazione stereotassica di AAV-hαSyn mediante immunofluorescenza ha seguito l'osservazione al microscopio confocale. I risultati mostrano che il picco di infiltrazione di Treg nello SNpc era a 11 settimane dopo l'intervento chirurgico, mentre l'estensione di Treg che si infiltrava in quest'area del cervello era inferiore alla settimana 8 o alla settimana 13 dopo l'intervento chirurgico (Figura 8). Nessuna cellula T CD4+ è stata rilevata infiltrandosi nello striato (dati non mostrati). Complessivamente, questi risultati indicano che, utilizzando 1 x 1010 vg / mouse di AAV-hαSyn, il punto temporale più adatto per analizzare la neuroinfiammazione è la settimana 15 dopo l'intervento stereotassico, mentre un punto temporale adeguato per analizzare l'infiltrazione delle cellule T nel SNC sembra essere la settimana 11 dopo il trattamento AAV-hαSyn.
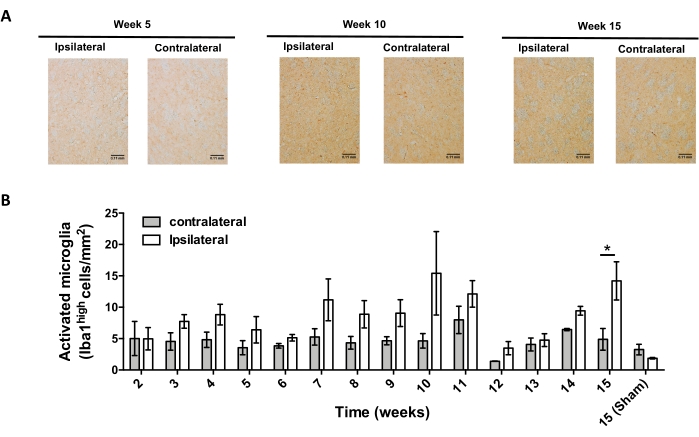
Figura 7: Analisi del decorso temporale dell'attivazione microgliale in topi inoculati con AAV-hαSyn. I topi hanno ricevuto AAV-hαSyn (1 x10 10 vg/mouse) e l'attivazione microgliale è stata valutata mediante analisi immunoistochimica di Iba1 nello striato in diversi punti temporali dopo l'intervento chirurgico. (A) Vengono mostrate immagini di panoramica rappresentative dell'analisi immunoistochimica di Iba1 da topi sacrificati 5 settimane, 10 settimane o 15 settimane dopo l'inoculazione con AAV-hαSyn. Barre di scala, 110 μm. (B) La densità delle microglia attivate è stata quantificata come il numero di cellule che esprimono alti livelli di Iba1 e forma ameboide per area. I dati rappresentano ± medie SEM. n = 3 topi per gruppo. Un t-test di Student accoppiato a due code è stato utilizzato per determinare le differenze statistiche tra Iba1 oplaterale e controlaterale in ciascun gruppo. *p < 0,05. Fare clic qui per visualizzare una versione più grande di questa figura.
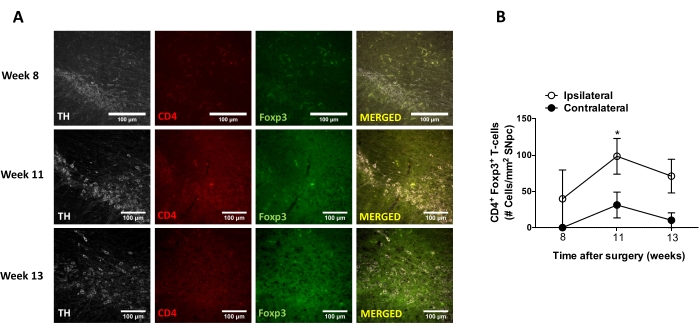
Figura 8: Analisi del decorso temporale dell'infiltrazione di cellule T CD4+ nell'SN di topi inoculati con AAV-hαSyn. I topi reporterFoxp3 gfp hanno ricevuto AAV-hαSyn (1 x 1010 vg/mouse). La presenza di cellule T CD4+ che esprimono Foxp3 e la presenza di neuroni TH+ sono state analizzate in diversi punti temporali (settimana 8, settimana 11 e settimana 13 dopo l'intervento) nel SN mediante immunofluorescenza. (A) Vengono mostrate immagini rappresentative per la singola immunocolorazione o la fusione. Barre di scala, 100 μm. (B) È stato quantificato il numero di cellule T CD4+ Foxp3+ per area nel SN. I dati rappresentano ± SEM medio da 3 topi per gruppo. *p<0.05, cellule T CD4+ Foxp3+ ostallaterali rispetto a quelle controlaterali mediante t-test dello studente a due code. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura 1 supplementare: Disegno sperimentale per la valutazione dell'effetto di diverse dosi di vettori AAV sulla patologia della sinucleina, sulla neurodegenerazione e sulla compromissione motoria. I topi maschi C57BL/6 wild-type sono stati anestetizzati e hanno ricevuto inoculazione stereotassica di diverse dosi (1 x 1010 vg/mouse, 1 x 109 vg/mouse o 1 x 108 vg/mouse) di AAV che codifica per α-sinucleina umana (AAV-hαSyn) o eGFP (AAV-GFP) sotto il controllo del promotore CBA nella giusta substantia nigra (SN). Dopo 12 settimane, l'espressione di GFP e hαSyn nel SN e nello striato (Str) è stata valutata mediante immunofluorescenza (IF), le cellule positive alla tirosina idrossilasi (TH+) sono state quantificate mediante immunoistochimica (IHC) nel SN e le prestazioni motorie sono state valutate mediante il test del fascio. Il numero di topi in ciascun gruppo sperimentale è indicato tra parentesi. * indica i gruppi in cui un topo è morto prima delle analisi. Ogni analisi indica tra parentesi il numero della figura dal corpo del documento in cui sono mostrati i risultati corrispondenti. Fare clic qui per scaricare questo file.
Figura 2 supplementare: Disegno sperimentale per determinare la cinetica dell'infiltrazione delle cellule T, della neuroinfiammazione e dell'espressione di hαSyn. I topi reporter Foxp3gfp sono stati anestetizzati e hanno ricevuto l'inoculazione stereotassica di AAV (1 x10 10 vg / mouse) che codifica la α-sinucleina umana (AAV-hαSyn) sotto il controllo del promotore CBA nella giusta substantia nigra (SN) o chirurgia fittizia (PBS). I topi sono stati sacrificati in diversi punti temporali e l'espressione di hαSyn nel SN e nello striato è stata valutata mediante immunofluorescenza (IF), GFP (Foxp3), CD4 e tirosina idrossilasi positiva (TH+) cellule sono state quantificate da IF nel SN e l'espressione di Iba1 è stata analizzata mediante immunoistochimica (IHC) nello striato (Str). È indicato il numero di topi in ciascun gruppo sperimentale. Viene indicato l'intervallo di punti temporali inclusi in ciascuna analisi. Ogni analisi indica tra parentesi il numero della figura dal corpo del documento in cui sono mostrati i risultati corrispondenti. Fare clic qui per scaricare questo file.
Discussione
Il modello murino di neurodegenerazione qui analizzato potrebbe aiutare a studiare molti aspetti critici coinvolti nella fisiopatologia della malattia di Parkinson, compresi i meccanismi coinvolti nella patologia αSyn e nell'attivazione microgliale, il coinvolgimento del sistema immunitario periferico nella regolazione della neuroinfiammazione e i meccanismi della neurodegenerazione. Tra i meccanismi coinvolti nella patologia αSyn ci sono quei meccanismi subcellulari associati a disfunzione mitocondriale, lisosomiale o proteasomiale in presenza di un carico eccessivo di αSyn nei neuroni dopaminergici dell'SN2. È importante considerare che, oltre all'espressione hαSyn indotta dalla trasduzione mediata da AAV, il topo endogeno αSyn contribuisce anche al carico dell'espressione totale di αSyn. I topi transgenici che sovraesprimono αSyn sviluppano patologia sinucleina, neuropatologia e compromissione motoria simili a quei modelli murini basati sulla sovraespressione di hαSyn32. Per quanto riguarda l'attivazione microgliale, il presente modello murino potrebbe essere utilizzato per studiare come diversi attori molecolari e cellulari come citochine, neurotrasmettitori, astrociti, neuroni, barriera emato-encefalica e cellule T potrebbero regolare l'acquisizione di fenotipi funzionali pro-infiammatori o anti-infiammatori 8,10,11 . Questo modello costituisce anche un importante strumento per studiare il ruolo del sistema immunitario periferico, comprendente non solo le cellule T ma anche macrofagi, monociti e neutrofili, sui processi di neuroinfiammazione e neurodegenerazione dei neuroni nigrali 11,33,34. Infine, questo modello murino rappresenta anche un valido sistema per studiare i meccanismi cellulari e molecolari della neurodegenerazione in vivo, compresi quelli indotti da processi cellulari interni, come lo stress ossidativo, i deficit energetici e gli organelli danneggiati 2, o quelli esercitati da attori esterni, come i fattori neurotossici prodotti da cellule microgliali, astrociti e cellule T citotossiche8, 28,29,35.
Un limite di questo modello murino è lo studio di come l'aggregazione patologica di αSyn in posizioni extra-cerebrali potrebbe costituire le fasi iniziali nello sviluppo della malattia di Parkinson36. A questo proposito, ci sono prove crescenti che indicano che, prima della neurodegenerazione dei neuroni nigrali e della compromissione motoria, la patologia αSyn inizia nella mucosa intestinale e nell'epitelio olfattivo36 e, probabilmente, nella risposta delle cellule T αSyn-specifica anche12. Successivamente, gli aggregati αSyn migrerebbero attraverso il nervo vago verso il tronco cerebrale, innescando la neuroinfiammazione e la neurodegenerazione dei neuroni dopaminergici12. Sebbene il modello AAV-hαSyn ricapitoli la maggior parte degli aspetti della malattia di Parkinson, non vi è alcun evidente coinvolgimento dell'aggregazione patologica di αSyn in posizioni extra-cerebrali in questo modello. Un modello alternativo che coinvolge la patologia hαSyn appropriato per studiare questi aspetti della malattia di Parkinson potrebbe essere topi transgenici che sovraesprimono hαSyn sotto il controllo del promotore Thy1, il modello Thy1-SNCA 37, in cui lo sviluppo della malattia dipende dal microbiota intestinale e comporta un evidente deterioramento gastrointestinale38.
Sebbene sia utile per lo studio dei diversi processi associati alla fisiopatologia della malattia di Parkinson, il presente modello murino comporta passaggi critici che dovrebbero essere minuziosamente controllati, tra cui la corretta consegna dei vettori virali nelle coordinate spaziali corrispondenti, l'espressione selettiva di hαSyn nei neuroni (che dipende dal sierotipo AAV e dal costrutto vettoriale), e la corretta dose di AAV e la tempistica prima di analizzare il fenotipo parkinsoniano. L'analisi della corretta consegna dei vettori virali nel SN è necessaria, in quanto l'uso delle coordinate spaziali corrette del SN potrebbe non essere sufficiente quando l'ago non è completamente dritto, che a volte è impercettibile per l'occhio umano. Inoltre, la diffusione dei vettori AAV dipende dal sierotipoAAV 39. Per questi motivi, è necessario eseguire controlli periodici di qualità verificando la corretta consegna e diffusione dei vettori AAV-GFP iniettati a seguito dell'osservazione della GFP in fette di cervello contenenti l'area del SN.
Per quanto riguarda l'espressione selettiva di hαSyn nei neuroni, in linea di principio, l'espressione di hαSyn potrebbe essere progettata per essere controllata da un promotore selettivo per i neuroni o, ancora più precisamente, selettiva per i neuroni dopaminergici, come l'uso del promotore TH nei vettori AAV per indurre l'espressione selettiva dei geni nei neuroni dopaminergici40 . Tuttavia, questa strategia non funziona quando ciò che si cerca è la sovraespressione del gene di interesse. Per questo motivo, nel presente modello, è essenziale utilizzare un promotore forte (un promotore che induce un'alta espressione del gene a valle) e sierotipi AAV con tropismo neuronale. In questo studio, il promotore CBA è stato utilizzato come promotore forte per indurre la sovraespressione di hαSyn e il sierotipo AAV5 è stato utilizzato per il vettore virale. Questo sierotipo è stato usato in precedenza per trasdurre i neuroni di topo e ratto41,42. Qui, i risultati hanno dimostrato che, 12 settimane dopo la somministrazione di AAV5-GFP nel SN dei topi, la fluorescenza verde era selettivamente presente sul lato ipsilaterale sia del SN che dello striato (Figura 1), indicando l'efficiente trasduzione dei neuroni della via nigrostriatale.
Un altro aspetto critico di questo modello murino della malattia di Parkinson è il punto temporale necessario per analizzare un particolare processo dopo l'intervento chirurgico. A questo proposito, questo lavoro mostra uno studio cinetico di diversi processi coinvolti nella patologia. Poiché i punti temporali chiave cambiano con la dose di genomi virali somministrati per topo, il sierotipo di AAV utilizzato, o anche con il lotto di AAV utilizzato, è stata effettuata per la prima volta un'analisi dose-risposta della quantità di AAV-αSyn necessaria per indurre una significativa perdita di neuroni TH + e compromissione motoria. Studi precedenti hanno mostrato una significativa compromissione motoria e una perdita di neuroni TH+ della via nigrostriatale dopo 12 settimane di iniezioni di AAV-αSyn nei topi a dosi comprese tra 6 x 108-3 x 1010 genomi virali per topo 16,17,30,31. Di conseguenza, la dose di AAV-hαSyn utilizzata per indurre l'espressione di hαSyn nella via nigrostriatale, la perdita di neuroni TH+ e la compromissione motoria nei topi variavano da 1 x 108-1 x 1010 genomi virali per topo. Inoltre, per controllare che la perdita di neuroni TH+ e la compromissione motoria fossero indotte dalla sovraespressione di hαSyn nel SN e non dall'infezione AAV dei neuroni del SN, sono stati inclusi gruppi di controllo in cui AAV codificante per un gene reporter (AAV-eGFP) è stato erogato unilateralmente nel SN di topi e sono stati determinati neurodegenerazione e compromissione motoria. I risultati hanno mostrato che, 12 settimane dopo l'intervento stereotassico, 1 x 1010 genomi virali per topo era una dose corretta di AAV5-hαSyn, poiché i topi che ricevevano questa carica virale mostravano hαSyn significativo nella via nigrostriatale (Figura 2 e Figura 3), perdita di neuroni TH+ (Figura 4) e compromissione motoria (Figura 5). Al contrario, dosi più basse di AAV5-hαSyn (1 x 108 genomi virali per topo e 1 x 109 genomi virali per topo) non erano abbastanza forti da raggiungere cambiamenti significativi in tutti questi parametri insieme (Figure 2-4). Da notare, la somministrazione di AAV-GFP a 1 x 1010 genomi virali per topo ha indotto un basso (~20%), ma significativo grado di perdita di neuroni TH+ di neuroni dopaminergici ninigrali (Figura 4A,B). Questo risultato concorda con le precedenti osservazioni che utilizzano questo modello41 ed è probabilmente la conseguenza di un basso livello di neuroinfiammazione indotto dalla somministrazione di vettori AAV nel SN. Tuttavia, l'entità della perdita di neuroni TH+ era significativamente più alta nei topi che ricevevano AAV5-hαSyn rispetto a quelli che ricevevano la stessa dose di AAV-GFP (Figura 4C). Da notare, la cinetica dell'espressione di hαSyn non dipende solo dall'efficienza della trasduzione, ma anche dall'estensione della diffusione AAV39. Poiché la diffusione dell'AAV dipende dal sierotipo AAV, i punti temporali chiave precisi in questo modello animale possono variare quando si utilizza un altro sierotipo AAV diverso da AAV5.
Successivamente, è stata condotta un'analisi cinetica utilizzando 1 x 1010 genomi virali per topo per determinare i punti temporali chiave in questo modello murino. Poiché le prove attuali hanno mostrato alcuni sintomi precoci che compaiono prima della compromissione motoria, che consentirebbe la diagnosi precoce della malattia di Parkinson43,44, questi esperimenti hanno cercato di trovare il punto temporale in cui l'espressione di hαSyn era già evidente ma in assenza di compromissione motoria. I risultati mostrano che l'insorgenza dell'espressione di hαSyn nel SN è avvenuta a 5 settimane dopo la somministrazione stereotassica di AAV-hαSyn (Figura 6). Questo punto temporale costituisce un punto temporale interessante per iniziare a somministrare terapie su misura per fermare i processi neuroinfiammatori e neurodegenerativi. Altri punti temporali chiave qui determinati sono stati i tempi di picco per due eventi critici associati al processo di neuroinfiammazione: il momento in cui le microglia raggiungono il massimo grado di attivazione e il tempo di infiltrazione massima delle cellule T nel SN. I risultati hanno mostrato una curva con un trend che raggiunge due ondate di massima attivazione microgliale, la prima a 10 settimane dopo l'intervento e la seconda a 15 settimane dopo l'intervento (Figura 7). L'analisi cinetica dell'infiltrazione delle cellule T ha mostrato il tempo di picco dell'infiltrazione di Treg nel SN a 11 settimane dopo l'intervento stereotassico (Figura 8). Sorprendentemente, nessuna cellula T effettrice (CD4 + Foxp3-) è stata rilevata infiltrandosi nel SN durante il periodo di tempo analizzato (settimane 8-13 dopo l'intervento chirurgico). Complessivamente, questi risultati suggeriscono un adeguato lasso di tempo per iniziare a somministrare terapie orientate a fermare il processo di neuroinfiammazione e attenuare l'infiltrazione delle cellule T nel SN utilizzando questo modello preclinico, che varia tra la settimana 5 dopo l'intervento chirurgico (l'inizio della sovraespressione di hαSyn) e la settimana 10 dopo l'intervento chirurgico (la prima ondata di neuroinfiammazione e infiltrazione delle cellule T) (Figura 9).
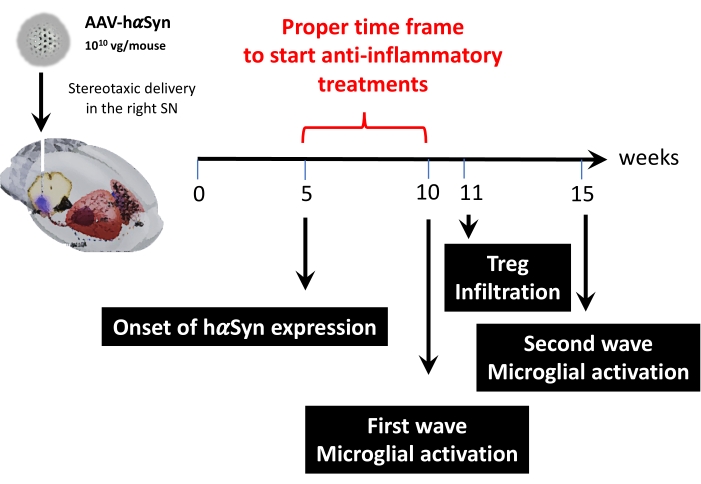
Figura 9: Riepilogo dei punti temporali chiave trovati per questo modello animale. Fare clic qui per visualizzare una versione più grande di questa figura.
Divulgazioni
Gli autori dichiarano che la ricerca è stata condotta in assenza di interessi finanziari o non finanziari concorrenti.
Riconoscimenti
Ringraziamo il Dr. Sebastián Valenzuela e il Dr. Micaela Ricca per la loro preziosa assistenza veterinaria nella nostra struttura per animali. Questo lavoro è stato supportato da "Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID" Centro Ciencia & Vida, FB210008 (a Fundación Ciencia & Vida), e il Geroscience Center for Brain Health and Metabolism, FONDAP-15150012. Questo lavoro è stato anche finanziato dalle sovvenzioni FONDECYT-1210013 (a R.P.) e FONDECYT-1150766 (a F.C.) da "Agencia Nacional de Investigación y Desarrollo de Chile (ANID)" e MJFF-10332.01 (a R.P.) e MJFF-17303 (a F.C.) dalla Michael J Fox Foundation for Parkinson's Research.
Materiali
| Name | Company | Catalog Number | Comments |
| ANIMALS AND ANIMAL FOOD | |||
| Foxp3-GFP C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 023800 | |
| Laboratory Rodent Diet | LabDiet | Rodent Diet 5001 | Standard Rodent diet |
| Wild-type C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 000664 | |
| VIRAL VECTORS | |||
| AAV5-CBA-αSyn | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 10E13 vg/mL |
| AAV5-CBA-eGFP | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 9.5 x 10E12 vg/mL |
| ANESTHETICS AND ANALGESICS | |||
| Isoflurane | Baxter | 218082 | 1% for stereotaxic surgery |
| Ketamine | Drag Pharma | CHE30 | 70 mg/Kg for stereotaxic surgery |
| Sevoflurane | Baxter | VE2L9117 | For before transcardial perfusion |
| Tramadol | Drag Pharma | DPH134 | 30 mg/Kg every 24 h |
| Xylazine | Centrovet | EHL40 | 9 mg/kg for stereotaxic surgery |
| EQUIPMENT | |||
| Beam test | Home made | N/A | horizontal beam 25 cm length and 3 cm width. The beam surface was covered by a metallic grid (1 cm2). |
| Cryostate | Leica | CM1520 | |
| Digital camera | Nikon | S2800 Coolpix | For recording the beam test performance |
| Microscope | Olympus | BX51 | Used for IHC analysis (section 4.4) |
| Microscope | Olympus | IX71 | Used for IF analysis (section 5.3) |
| Microscope | Leica | DMI8 | Used for IF analysis (section 5.7) |
| New Standard Stereotaxic, mouse | Stoelting, Wood Dale, IL, USA | 51500 | stereotaxic frame for surgery |
| Peristaltic Pump | Masterflex | C-flex L/S16 | |
| Power supply unit | Olympus | U-RFL-T | Used for IF analysis (section 5.3) |
| Surgical suture | Sylkam®, B Braun | C0760171 | |
| Syringe 100 U | BD | 324918 | For anesthesia before transcardial perfusion, 29G needle |
| Syringe RN 5uL SYR W/O NEEDLE | Hamilton | HA-7641-01 | For viral vector innoculation |
| BUFFERS AND REAGENTS | |||
| Aviden, Peroxidase Conjugate | Merck, Darmstadt, Germany | 189728 | |
| Bovine Serum Albumin | Merck, Darmstadt, Germany | 9048-46-8 | |
| Cryotrotection buffer | Home made | N/A | 20% glycerine and 2% DMSO in PBS |
| DAPI | Abcam | ab228549 | |
| Diaminobenzidine | Merck, Darmstadt, Germany | D8001 | |
| Fluoromount -G T | Electron Microscopy Science | 17984-25 | |
| Gelatin | Merck, Darmstadt, Germany | 104078 | |
| Normal goat serum | Jackson ImmunoResearch Laboratory | 5000121 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 104005 | |
| PBS | Home made | N/A | 0.125 M, pH 7.4 |
| Peroxidase inactivating buffer | Home made | N/A | 0.03% H2O2 in methanol |
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| Trizma Hydrochloride | Merck, Darmstadt, Germany | 1185-53-1 | |
| Tween 20 | Sigma-Aldrich | 822184 | |
| ANTIBODIES | |||
| Biotin-SP (long spacer) AffiniPure Goat Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch Laboratory | 111065003 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11010 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 647 | ThermoFisher Scientific | A21244 | |
| Goat anti-Rat IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11081 | |
| Rabbit monoclonal anti-alpha-Synuclein | Abcam | ab138501 | |
| Rabbit monoclonal anti-Iba-1 | Abcam | EPR16588 | |
| Rabbit polyclonal anti-Tyrosine Hydroxylase | Millipore | AB152 | |
| Rat monoclonal anti-CD4 | Biolegend | 100402 | |
| SOFTWARES | |||
| GraphPad | Prism | 6.0 | Fos stats analysis |
| ImageJ | National Institute of Health | N/A | For image analysis |
| LAS X | Leica | N/A | For image capture with Leica microscope |
| ProgRes Capture Pro | Jenoptik | N/A | For image capture with Olympus microscope |
| VLC media player | VideoLAN Organization | N/A | For analysis of behavioural tests |
Riferimenti
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiology of Aging. 24 (2), 197-211 (2003).
- Lim, K. L., Zhang, C. W. Molecular events underlying Parkinson's disease - An interwoven tapestry. Frontiers in Neurology. 4, 33(2013).
- Abdelmotilib, H., et al. α-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Mori, F., et al. Relationship among alpha-synuclein accumulation, dopamine synthesis, and neurodegeneration in Parkinson disease substantia nigra. The Journal of Neuropathology & Experimental Neurology. 65 (8), 808-815 (2006).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson's disease. Biochimica et Biophysica Acta. 1802 (1), 29-44 (2010).
- Vazquez-Velez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44, 87-108 (2021).
- Dehay, B., et al. Lysosomal impairment in Parkinson's disease. Movement Disorders. 28 (6), 725-732 (2013).
- Gonzalez, H., Elgueta, D., Montoya, A., Pacheco, R. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases. Journal of Neuroimmunology. 274 (1-2), 1-13 (2014).
- Pacheco, R. T-cell based immunotherapies for Parkinson's disease. Exploration of Neuroprotective Therapy. 1 (2), 72-85 (2021).
- Gonzalez, H., Contreras, F., Pacheco, R. Regulation of the neurodegenerative process associated to Parkinson's disease by CD4+ T-cells. Journal of Neuroimmune Pharmacology. 10 (4), 561-575 (2015).
- Gonzalez, H., Pacheco, R. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases. Journal of Neuroinflammation. 11 (1), 201(2014).
- Campos-Acuna, J., Elgueta, D., Pacheco, R. T-cell-driven inflammation as a mediator of the gut-brain axis involved in Parkinson's disease. Frontiers in Immunology. 10, 239(2019).
- Blesa, J., Phani, S., Jackson-Lewis, V., Przedborski, S. Classic and new animal models of Parkinson's disease. Journal of Biomedicine and Biotechnology. 2012, 845618(2012).
- Ulusoy, A., Decressac, M., Kirik, D., Bjorklund, A. Viral vector-mediated overexpression of alpha-synuclein as a progressive model of Parkinson's disease. Progress in Brain Research. 184, 89-111 (2010).
- Gomez-Benito, M., et al. Modeling Parkinson's disease with the alpha-synuclein protein. Frontiers in Pharmacology. 11, 356(2020).
- Song, L. K., et al. Targeted overexpression of alpha-synuclein by rAAV2/1 vectors induces progressive nigrostriatal degeneration and increases vulnerability to MPTP in mouse. PLoS One. 10 (6), 0131281(2015).
- Theodore, S., Cao, S., McLean, P. J., Standaert, D. G. Targeted overexpression of human alpha-synuclein triggers microglial activation and an adaptive immune response in a mouse model of Parkinson disease. Journal of Neuropathology and Experimental Neurology. 67 (12), 1149-1158 (2008).
- Sanchez-Guajardo, V., Annibali, A., Jensen, P. H., Romero-Ramos, M. alpha-Synuclein vaccination prevents the accumulation of parkinson disease-like pathologic inclusions in striatum in association with regulatory T cell recruitment in a rat model. Journal of Neuropathology and Experimental Neurology. 72 (7), 624-645 (2013).
- Sanchez-Guajardo, V., Febbraro, F., Kirik, D., Romero-Ramos, M. Microglia acquire distinct activation profiles depending on the degree of alpha-synuclein neuropathology in a rAAV based model of Parkinson's disease. PLoS One. 5 (1), 8784(2010).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular Neurodegeneration. 8, 44(2013).
- Cho, C., et al. Evaluating analgesic efficacy and administration route following craniotomy in mice using the grimace scale. Scientific Reports. 9 (1), 359(2019).
- Flecknell, P. Laboratory Animal Anaesthesia. 3rd Ed. , ElsevierAcademic Press. Cambridge, MA. (2009).
- Bind, R. H., Minney, S. M., Rosenfeld, S., Hallock, R. M. The role of pheromonal responses in rodent behavior: Future directions for the development of laboratory protocols. Journal of the American Association for Laboratory Animal Science. 52 (2), 124-129 (2013).
- Paxinos, G., Franklin, K. B. J. The Mouse Brain in Stereotaxic Coordinates. , Academic Press. Cambridge, MA. (2001).
- Elgueta, D., et al. Dopamine receptor D3 expression is altered in CD4+ T-cells from Parkinson's disease patients and its pharmacologic inhibition attenuates the motor impairment in a mouse model. Frontiers in Immunology. 10, 981(2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Fernandez-Suarez, D., et al. The monoacylglycerol lipase inhibitor JZL184 is neuroprotective and alters glial cell phenotype in the chronic MPTP mouse model. Neurobiology of Aging. 35 (11), 2603-2616 (2014).
- Elgueta, D., et al. Pharmacologic antagonism of dopamine receptor D3 attenuates neurodegeneration and motor impairment in a mouse model of Parkinson's disease. Neuropharmacology. 113, 110-123 (2017).
- Montoya, A., et al. Dopamine receptor D3 signalling in astrocytes promotes neuroinflammation. Journal of Neuroinflammation. 16 (1), 258(2019).
- Williams, G. P., et al. Targeting of the class II transactivator attenuates inflammation and neurodegeneration in an alpha-synuclein model of Parkinson's disease. Journal of Neuroinflammation. 15 (1), 244(2018).
- Benskey, M. J., et al. Silencing alpha synuclein in mature nigral neurons results in rapid neuroinflammation and subsequent toxicity. Frontiers in Molecular Neuroscience. 11, 36(2018).
- Rieker, C., et al. Neuropathology in mice expressing mouse alpha-synuclein. PLoS One. 6 (9), 24834(2011).
- Harms, A. S., et al. alpha-Synuclein fibrils recruit peripheral immune cells in the rat brain prior to neurodegeneration. Acta Neuropathologica Communications. 5 (1), 85(2017).
- Williams, G. P., et al. CD4 T cells mediate brain inflammation and neurodegeneration in a mouse model of Parkinson disease. Brain. 144 (7), 2047-2059 (2021).
- Matheoud, D., et al. Intestinal infection triggers Parkinson's disease-like symptoms in Pink1(-/-) mice. Nature. 571 (7766), 565-569 (2019).
- Jan, A., Goncalves, N. P., Vaegter, C. B., Jensen, P. H., Ferreira, N. The prion-like spreading of alpha-synuclein in Parkinson's disease: Update on models and hypotheses. International Journal of Molecular Sciences. 22 (15), 8338(2021).
- Chesselet, M. F., et al. A progressive mouse model of Parkinson's disease: The Thy1-aSyn ("Line 61") mice. Neurotherapeutics. 9 (2), 297-314 (2012).
- Sampson, T. R., et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease. Cell. 167 (6), 1469-1480 (2016).
- Ciron, C., et al. Human alpha-iduronidase gene transfer mediated by adeno-associated virus types 1, 2, and 5 in the brain of nonhuman primates: Vector diffusion and biodistribution. Human Gene Therapy. 20 (4), 350-360 (2009).
- Ben-Shaanan, T. L., et al. Activation of the reward system boosts innate and adaptive immunity. Nature Medicine. 22 (8), 940-944 (2016).
- Albert, K., Voutilainen, M. H., Domanskyi, A., Airavaara, M. AAV vector-mediated gene delivery to substantia nigra dopamine neurons: Implications for gene therapy and disease models. Genes. 8 (2), 63(2017).
- Bordia, T., Perez, X. A., Heiss, J., Zhang, D., Quik, M. Optogenetic activation of striatal cholinergic interneurons regulates L-dopa-induced dyskinesias. Neurobiology of Disease. 91, 47-58 (2016).
- Kim, A., et al. Upgraded methodology for the development of early diagnosis of Parkinson's disease based on searching blood markers in patients and experimental models. Molecular Neurobiology. 56 (5), 3437-3450 (2018).
- Lei, H., et al. Parkinson's disease diagnosis via joint learning from multiple modalities and relations. IEEE Journal of Biomedical and Health Informatics. 23 (4), 1437-1449 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon