Method Article
Analyse des Parkinson-Mausmodells, das durch Adeno-assoziierte virale Vektoren induziert wird, die menschliches α-Synuclein kodieren
In diesem Artikel
Zusammenfassung
Diese Arbeit analysiert die Vektordosis und die Expositionszeit, die erforderlich sind, um Neuroinflammation, Neurodegeneration und motorische Beeinträchtigung in diesem präklinischen Modell der Parkinson-Krankheit zu induzieren. Diese Vektoren, die das menschliche α-Synuclein kodieren, werden in die Substantia nigra geliefert, um die mit der Parkinson-Krankheit verbundene Synuclein-Pathologie zu rekapitulieren.
Zusammenfassung
Die Parkinson-Krankheit ist eine neurodegenerative Erkrankung, die den Tod der dopaminergen Neuronen des nigrostriatalen Weges und folglich den fortschreitenden Verlust der Kontrolle über willkürliche Bewegungen mit sich bringt. Dieser neurodegenerative Prozess wird durch die Ablagerung von Proteinaggregaten im Gehirn ausgelöst, die hauptsächlich aus α-Synuclein bestehen. Mehrere Studien haben gezeigt, dass Neuroinflammation erforderlich ist, um die mit der Parkinson-Krankheit verbundene Neurodegeneration zu entwickeln. Insbesondere beinhaltet der neuroinflammatorische Prozess die Aktivierung von Mikroglia sowie die Infiltration peripherer T-Zellen in die Substantia nigra (SN). Diese Arbeit analysiert ein Mausmodell der Parkinson-Krankheit, das die Mikrogliaaktivierung, die T-Zell-Infiltration in die SN, die Neurodegeneration von nigralen dopaminergen Neuronen und motorische Beeinträchtigungen rekapituliert. Dieses Mausmodell der Parkinson-Krankheit wird durch die stereotaktische Abgabe von adenoassoziierten viralen Vektoren induziert, die für das menschliche Wildtyp-α-Synuclein (AAV-hαSyn) in die SN kodieren. Die korrekte Abgabe von viralen Vektoren in die SN wurde mit Kontrollvektoren bestätigt, die für grün fluoreszierendes Protein (GFP) kodieren. Anschließend wurde untersucht, wie sich die im SN verabreichte Dosis von AAV-hαSyn auf das Ausmaß der hαSyn-Expression, den Verlust nigraler dopaminerger Neuronen und die motorische Beeinträchtigung auswirkte. Darüber hinaus wurde die Dynamik der hαSyn-Expression, der Mikroglia-Aktivierung und der T-Zell-Infiltration während des gesamten Zeitverlaufs der Krankheitsentwicklung bestimmt. Daher liefert diese Studie kritische Zeitpunkte, die für die Bekämpfung der Synucleinpathologie und der Neuroinflammation in diesem präklinischen Modell der Parkinson-Krankheit nützlich sein können.
Einleitung
Nach der Alzheimer-Krankheit ist die Parkinson-Krankheit die zweithäufigste neurodegenerative Erkrankung weltweit. Die primären Neuronen, die bei der Parkinson-Krankheit betroffen sind, sind die des nigrostriatalen Signalwegs, die Dopamin produzieren und die willkürliche Bewegung kontrollieren. Infolgedessen ist das charakteristischste Symptom, das mit dieser Störung verbunden ist, eine motorische Beeinträchtigung. Diese Pathologie beinhaltet auch die Ablagerung von Proteinaggregaten im Gehirn, die hauptsächlich aus α-Synuclein (αSyn)1 bestehen, einem zytosolischen Protein, das mit präsynaptischen Terminals assoziiert ist. Es hat sich gezeigt, dass die Erzeugung pathogener Einschlüsse von αSyn durch Fehlfaltung oder durch einige posttranslationale Modifikationen dieses Proteinsausgelöst wird 2.
Insbesondere wurde eine enge Beziehung zwischen der αSyn-Pathologie und dem Verlust dopaminerger Neuronen des nigrostriatalen Weges bei der menschlichen Parkinson-Krankheit und Tiermodellenhergestellt 3,4. Zu verstehen, wie αSyn-Aggregate erzeugt werden und wie sie den neuronalen Tod induzieren, stellt eine bedeutende Herausforderung in diesem Bereich dar. Eine wachsende Gruppe von Studien hat gezeigt, dass durch die Erhöhung des oxidativen Stresses die mitochondriale Dysfunktion eine der Hauptursachen für die Erzeugung von αSyn-Aggregatenist 2. Tatsächlich kodieren mehrere Gene, die mit dem Parkinson-Risiko assoziiert sind, Proteine, die an der mitochondrialen Funktion, Morphologie und Dynamik beteiligt sind 5,6. Darüber hinaus stellt die lysosomale Dysfunktion, die zur Anhäufung von dysfunktionalen Mitochondrien und fehlgefaltetem αSyn führt, ein weiteres wichtiges Ereignis dar, das die Erzeugung von αSyn-Aggregaten fördert7.
Neue Erkenntnisse deuten darauf hin, dass diese pathogenen Proteine, sobald αSyn-Aggregate im Gehirn abgelagert werden, Toll-like-Rezeptoren (TLRs) auf den Mikroglia stimulieren und so eine Mikroglia-Aktivierung und eine anfängliche entzündliche Umgebung in der Substantia nigra (SN) auslösen.8,9. Darüber hinaus deuten die Beweise darauf hin, dass αSyn-Aggregate von Antigen-präsentierenden Zellen erfasst und den T-Zellen präsentiert werden, was eine adaptive Immunantwort induziert, die spezifisch für αSyn10,11 ist. Diese αSyn-spezifischen T-Zellen infiltrieren anschließend das Gehirn und werden durch aktivierte Mikroglia restimuliert, wodurch die Sekretion neurotoxischer Faktoren gefördert wird, die den neuronalen Tod hervorrufen 9,10. Interessanterweise deuten mehrere Beweislinien darauf hin, dass αSyn-Aggregate zuerst im enterischen Nervensystem erzeugt und dann durch den Vagusnerv zum Hirnstamm12 transportiert werden.
Mehrere Tiermodelle der Parkinson-Krankheit werden seit vielen Jahren verwendet, darunter solche, die durch die Verabreichung neurotoxischer Substanzen (z. B. 6-Hydroxydopamin, Paraquat, Rotenon, 1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridin) induziert werden, und solche, die genetische Bedingungen betreffen (z. B. mutiertes α-Synuclein, mutierte Leucin-reiche Wiederholungskinase 2)13 . Obwohl Modelle mit neurotoxininduzierter Neurodegeneration einige Aspekte der Parkinson-Krankheit replizieren, rekapituliert keines von ihnen alle wesentlichen Aspekte der Krankheit oder ist nicht progressiv13. Auf der anderen Seite, obwohl genetische Mausmodelle, die die Expression von mutierten Versionen der Leucin-reichen Wiederholungskinase 2, mutierte Versionen von α-Synuclein oder die Überexpression von humanem Wildtyp-α-Synuclein beinhalten, zu motorischen Beeinträchtigungen und in einigen Fällen auch zur Entwicklung einer Synucleinopathie führen, reproduzieren sie keine prominente Neurodegeneration der nigralen dopaminergen Neuronen, die ein wesentlicher Aspekt der Parkinson-Krankheitist 13. 14. Eine dritte Art von Tiermodell der Neurodegeneration hat es geschafft, die meisten der wesentlichen Aspekte der Parkinson-Krankheit zu erfüllen, die stereotaktische Abgabe von adeno-assoziierten viralen Vektoren (AAVs), die das menschliche α-Synuclein (AAV-hαSyn) kodieren14,15. Wichtig ist, dass AAVs die Transduktion von Neuronen mit hoher Wirksamkeit und langfristig im erwachsenen Gehirn von Säugetieren ermöglichen. Darüber hinaus wurde gezeigt, dass die stereotaktische Verabreichung von AAV-hαSyn in der SN viele der wesentlichen Aspekte der Krankheit reproduziert, einschließlich αSyn-Pathologie, Mikroglia-Aktivierung, Neurodegeneration und motorische Beeinträchtigung 16,17,18,19,20. Diese Studie stellt eine Analyse vor, wie die Dosis des viralen Vektors und die Zeit nach der viralen Vektorabgabe das Ausmaß der hαSyn-Expression, Neurodegeneration und Neuroinflammation im nigrostriatalen Signalweg sowie den Grad der motorischen Beeinträchtigung im Mausmodell der einseitigen stereotaktischen Abgabe von hαSyn in der SN beeinflussen.
Protokoll
Alle Studien wurden im Rahmen der 8. Ausgabe des Leitfadens für die Pflege und Verwendung von Labortieren durchgeführt. Experimentelle Protokolle wurden von der IACUC bei der Fundación Ciencia & Vida (Science for Life Foundation) genehmigt, einschließlich solcher, die Anästhesie, Schmerzen, Stress und Euthanasie beinhalten (Genehmigungsnummer P-035/2022).
1. Die stereotaktische Chirurgie
- Vorbereitung auf die Operation (ca. 1 h)
- Um eine aseptische Umgebung aufrechtzuerhalten, tragen Sie während der gesamten Operation geeignete chirurgische Kleidung, einschließlich Schuhüberzieher, einer chirurgischen Maske, einer sanitären Barriere, Handschuhen und einer chirurgischen Kappe.
- Sprühen Sie 70% Ethanol auf die Maus und das gesamte chirurgische Material, um eine aseptische Umgebung aufrechtzuerhalten.
- Um eine Analgesie zu induzieren, injizieren Sie der Maus 5 mg/kg subkutan (s.c.) alle 12 h21 ab 1 h vor der Operation und bis 3 Tage nach der Operation Carprofen 5 mg/kg subkutan (s.c.).
- Um die Maus zu betäuben, legen Sie das Tier in eine Induktionskammer. Öffnen Sie den Isofluranfluss mit einer Rate von 0,5% und erhöhen Sie ihn dann langsam auf bis zu 5% über ca. 5 Minuten, bis die Maus ihren Aufrichtreflex22 verloren hat.
- Entfernen Sie das Tier aus der Induktionskammer. Bringen Sie das Tier sofort in einen nicht atmungsaktiven Kreislauf mit einem Nasenkegel in geeigneter Größe. Halten Sie die Mausanästhesie mit Isofluran 1% während der gesamten Operationszeit aufrecht.
- Bestätigen Sie, dass die Maus vollständig betäubt ist, indem Sie ihren Schwanz und ihre Pfoten kneifen. Wenn die Maus nicht darauf reagiert, den Schwanz und die Pfoten zu kneifen, bedeutet dies, dass die Maus vollständig betäubt ist.
- Rasieren Sie den Kopf der Maus mit einer Schere. Reinigen Sie die Haut der Maus mit einem Wattestäbchen mit Chlorhexidin 2% und entfernen Sie alle Haare.
- Fixieren Sie den Kopf der Maus im stereotaktischen Rahmen.
- Legen Sie ein Hornhautschutzmittel mit einem Wattestäbchen in beide Mausaugen. Um eine Stressinduktion bei anderen Nagetieren zu verhindern, vermeiden Sie die Anwesenheit einer anderen Maus im Operationssaal23.
- Die Operation (ca. 30 min)
- Reinigen Sie den Kopf der Maus mit drei Runden 2% Chlorhexidin, gefolgt von 70% Ethanol. Belichten Sie den Schädel mit chirurgischem Material und machen Sie ein dünnes Loch mit einem Bohrer an den folgenden Koordinaten: anteroposterior −2,8 mm und mediolateral 1,4 mm in Bezug auf die mediale Linie.
- Legen Sie die Nadel einer 10-μL-Spritze in das Loch und bewegen Sie die Nadel langsam im Gehirn, bis sie in Bezug auf die Dura24 auf −7,2 mm dorsoventral ankommt.
- Lassen Sie die Nadel für 2 Minuten in der endgültigen Position, damit sich das Gewebe ein wenig absetzen kann, und injizieren Sie dann 1 μL AAV5-CBA-hαSyn (AAV-hαSyn), AAV5-CBA-eGFP (AAV-GFP) oder Vehikel (PBS bei pH 7,4; Scheinoperation) mit einer Rate von 0,2 μL / 30 s in die rechte Substantia Nigra.
- Lassen Sie die Nadel nach der Abgabe viraler Vektoren für 5 Minuten in der gleichen Position und ziehen Sie sie dann langsam zurück.
- Nach der Operation (ca. 5 min)
- Schließen Sie die Wunde mit einer sterilen, seidengeflochtenen, nicht resorbierbaren Naht.
- Legen Sie die Maus vorgewärmt in den Hauskäfig, indem Sie sie über eine elektrisch beheizte Matratze (25 °C) legen.
HINWEIS: Die Maus muss alleine im Hauskäfig gehalten werden, bis sie problemlos laufen kann und die Wunde verheilt ist.
2. Bestimmung der Motorleistung mit Hilfe der Strahlprüfung
- Training (ca. 15 min pro Maus)
- Zwölf Wochen nach der stereotaktischen Operation ist die motorische Leistung mit einer vereinfachten Version des vordem 25. beschriebenen Strahltest zu beurteilen. Verwenden Sie dazu einen horizontalen Balken von 25 cm Länge und 3 cm Breite. Die Balkenoberfläche muss mit einem metallischen Gitter mit Quadraten von 1 cm bedeckt und 1 cm über dem Balken erhöht sein.
- Machen Sie ein Video von der Maus, die den Gitteroberflächenstrahl von einem Ende zum gegenüberliegenden Ende des Strahls durchquert, wo sich der Hauskäfig befindet. Trainieren Sie die Maus 2 Tage lang vor der Bestimmung der motorischen Leistung.
- Trainieren Sie am ersten Tag die Maus, fünfmal ohne das Gitter durch den Strahl zu gehen.
- Trainieren Sie am zweiten Tag die Maus, fünfmal durch den Strahl in Gegenwart des Gitters zu gehen.
- Der Test (ca. 5 min pro Maus)
- Bewerten Sie am dritten Tag die Motorleistung. Quantifizieren Sie dazu die Anzahl der Fehler, die von den linken Pfoten oder von den rechten Pfoten ausgeführt werden, separat, indem Sie die Videos im Zeitlupenmodus ansehen.
HINWEIS: Ein Fehler ist definiert, wenn eine Pfote nicht richtig auf das Gitter tritt und daher auf der Seite des Gitters oder zwischen dem Gitter und der Balkenoberfläche sichtbar wird.
- Bewerten Sie am dritten Tag die Motorleistung. Quantifizieren Sie dazu die Anzahl der Fehler, die von den linken Pfoten oder von den rechten Pfoten ausgeführt werden, separat, indem Sie die Videos im Zeitlupenmodus ansehen.
3. Gewebeverarbeitung
- Transkardiale Perfusion (ca. 15 min pro Maus)
- Um die Maus zu betäuben, injizieren Sie eine Mischung aus Ketamin (80 mg/kg) und Xylazin (10 mg/kg) intraperitoneal (i.p.) mit einer 1 ml Spritze und 27 G Nadel26.
- Sobald die Maus vollständig betäubt ist (bestätigt wie in Schritt 1.1.6.), öffnen Sie den Thorax mit chirurgischem Material und legen Sie das Herz frei.
- Führen Sie dann eine 21-G-Nadel (machen Sie die Spitze mit einem Bohrer flach) in den linken Ventrikel des Herzens ein.
- Durch Koppeln der Nadel an ein Rohr können Sie 50 ml PBS (pH 7,4) mit einer Rate von 9,5 ml / min mit einer Peristaltikpumpe durchbluten.
- Fixierung und Kryoschutz des Gehirns (ca. 10 min pro Gehirn)
- Entfernen Sie das Gehirn mit einer Schere und einer Pinzette und fixieren Sie es dann, indem Sie 24 Stunden lang in 5 ml 4% Paraformaldehyd in PBS (pH 7,4) bei 4 ° C eintauchen.
- Danach legen Sie das festsitzende Gehirn in 15 ml 30% Saccharose bei 4 ° C für 48 h.
- Dann legen Sie das Gehirn in 4 ml Kryoprotektionslösung (20% Glycerin und 2% DMSO in PBS) und speichern Sie das Gehirn bei -80 ° C oder verwenden Sie es sofort im nächsten Schritt.
- Gewinnung von Gehirnschnitten (ca. 20 min pro Gehirn).
HINWEIS: Stellen Sie sicher, dass das Gehirn in einem Kryostaten in der richtigen Position platziert wird, um koronale Schnitte zu machen.- Um SN-Scheiben zu erhalten, schneiden Sie das Gehirn in 40 μm dicke Abschnitte, beginnend bei −2,92 mm und endend bei −3,64 mm24.
- Jede Scheibe wird in einer Vertiefung (mit 1 ml Kryoschutzlösung) einer 24-Well-Platte nach einer anteroposterioren Ordnung, wie vor25,27,28 beschrieben, geerntet.
- Für die Durchführung von immunhistochemischen (Abschnitt 4.) und Immunfluoreszenzanalysen (Abschnitt 5.) im SN sind sechs koronale SN-Abschnitte auszuwählen, die in gleichmäßigen Abständen (120 μm) entnommen werden und die gesamte rostrokaudale Ausdehnung des Kerns (insgesamt 720 μm) abdecken, wie zuvorbeschrieben 25,27,28.
- Um striatale Scheiben zu erhalten, schneiden Sie das Gehirn in 40 μm dicke Abschnitte, beginnend bei +1,34 mm und endend bei −0,26 mm24.
- Ernten Sie jede Scheibe in einer 2 ml Kryotube (mit 1 ml Kryoschutzlösung) nach einer anteroposterioren Ordnung.
- Um immunhistochemische (Abschnitt 4.) und Immunfluoreszenzanalysen (Abschnitt 5.) im Striatum durchzuführen, wählen Sie fünf koronale Striatalabschnitte, die in gleichmäßigen Abständen (320 μm) entnommen werden und die gesamte rostrokaudale Ausdehnung des Kerns (insgesamt 1600 μm) abdecken.
4. Immunhistochemische Analyse zur Quantifizierung dopaminerger Neuronen und Mikrogliose (ca. 2 Tage)
- Für die immunhistochemische Analyse von striatalen oder nigralen Scheiben legen Sie den Satz von fünf (Striatum) oder sechs (SN) Scheiben aus demselben Gehirn in eine Vertiefung einer 24-Well-Platte.
- Waschen Sie die Abschnitte 3x mit 1 ml PBS und inkubieren Sie dann mit 0,5 ml 0,03% H 2 O2in Methanol bei Raumtemperatur und mit Rühren für 30 Minuten, um die endogene Peroxidaseaktivität zu inaktivieren.
- Waschen Sie die Abschnitte 3x mit 1 ml PBS und inkubieren Sie mit 0,5 ml Blockierlösung (4% Ziegenserum, 0,05% Triton X-100 und 4% BSA in PBS) bei Raumtemperatur und mit Rühren für 40 min.
- Danach mit 0,5 ml Blockierlösung, die den primären Antikörper (Kaninchen-Anti-Tyrosin-Hydroxylase [TH] pAb verdünnt 1:1000 [siehe Tabelle 1]; oder Kaninchen-Anti-Iba1-Antikörper verdünnt 1:1000) enthält, bei Raumtemperatur und mit Bewegung über Nacht inkubieren.
- Die Abschnitte 3x mit 1 ml PBS waschen und mit 0,5 ml Blockierlösung, die biotinylierten Ziegen-Anti-Kaninchen-pAb (1:500, siehe Tabelle 1) enthält, bei Raumtemperatur und mit Rühren für 2 h inkubieren.
- Dann waschen Sie die Abschnitte 3x mit 1 ml PBS und inkubieren Sie mit 0,5 ml peroxidasekonjugiertem Avidin (1:5000, siehe Tabelle 1) in Blocklösung bei Raumtemperatur und mit Rühren für 90 min.
- Die Abschnitte werden 3x mit 1 mL PBS gewaschen und mit 0,5 ml Substratlösung (0,05% Diaminobenzidin in 0,03%H2O2/Trizma-HCl-Puffer bei pH 7,6) inkubiert. Tragen Sie für diesen Schritt Handschuhe und einen Laborkittel, da Diaminobenzidin ein potenzielles Karzinogen ist.
- Wenn die spezifische Färbung offensichtlich ist (typischerweise 30 Sekunden für TH und 5 Minuten für Iba1), nehmen Sie die Substratlösung heraus und waschen Sie die Abschnitte 3x mit 1 ml PBS bei Raumtemperatur und mit Rühren. Führen Sie immer die Immunfärbung von Scheiben aller Gehirne durch, die im selben Experiment enthalten sind.
HINWEIS: Die spezifische Färbung von TH ist offensichtlich, wenn TH-Immunfärbung im Bereich des SN auftritt, der eine charakteristische Form im Gehirn aufweist. Die spezifische Markierung von Iba1 wird bestimmt, wenn Iba1-Immunfärbungen auf Kontrollgehirnscheiben mit typischen Mikrogliaformen auftreten, die bei der Mikroskopbeobachtung bestätigt werden. Auf diese Weise wird für jedes einzelne Experiment der genaue Zeitpunkt der Substratexposition für die IHC-Analyse bestimmt. - Montieren Sie die Gehirnabschnitte auf Glasobjektträgern mit einer Lösung von 0,2% Gelatine in 0,05 M Tris (pH 7,6). Legen Sie jeden Satz von fünf (Striatum) oder sechs (SN) Scheiben, die aus demselben Gehirn in rostrocaudaler Reihenfolge erhalten wurden, auf denselben Glasobjektträger.
- Quantifizieren Sie die Anzahl der TH+- Neuronen im SN.
- Um TH+-Neuronen im SN zu quantifizieren, nehmen Sie Fotos der sechs Scheiben mit 20-facher Vergrößerung mit einem Hellfeldmikroskop auf, wie zuvorbeschrieben 25,27,28. Verwenden Sie die folgende Farbeinstellung: Farbtemperatur 3200 K, Cyan-Rot 40%, Magenta-Grün 39%, Gelb-Blau 54%, Gamma 0,5, Kontrast 37, Helligkeit 13, Sättigung 5.
- Wählen Sie mit der Image J-Software den Umfang des SN pars compacta in der analysierten Hemisphäre aus. Vermeiden Sie die Selektion von TH+ Neuronen aus dem ventralen tegmentalen Bereich (VTA).
- Anschließend bitten Sie die Software, die ausgewählte Fläche zu berechnen (typischerweise 0,04-0,07 mm2 / Hemisphäre, abhängig von der rostrocaudalen Position). Markieren Sie dann mit dem Multipoint-Tool jedes einzelne TH+-Neuron mit einem Punkt.
- Bitten Sie die Software mit dem Punktwerkzeug, die Gesamtzahl der Punkte zu zählen. Berechnen Sie mit der Anzahl der Gesamtpunkte (TH+ Neuronen) und der Fläche des SNpc die Dichte der TH+ Neuronen/mm2.
- Wiederholen Sie die gleiche Berechnung in beiden Hemisphären auf den sechs SN-Schichten und berechnen Sie dann den Mittelwert von TH+ Neuronen/mm2 auf der ipsilateralen und der kontralateralen Seite.
- Quantifizieren Sie die Anzahl der aktivierten Mikroglia im Striatum
- Um aktivierte Mikroglia im Striatum zu quantifizieren, nehmen Sie zwei Fotos in jeder Hemisphäre für alle fünf striatalen Scheiben bei 20-facher Vergrößerung mit einem Hellfeldmikroskop und den gleichen Einstellungen auf, die in Schritt 4.10.1 angegeben sind. Mit der Image J-Software markieren Sie in jedem einzelnen Foto (mit einer Fläche von 660 μm x 877 μm) jede einzelne Zelle mit einem Punkt, der mit dem Multipoint-Werkzeug eine hohe Iba1-Intensität und eine ameboide Form ausdrückt. Bitten Sie die Software mit dem Punktwerkzeug, die Gesamtzahl der Punkte zu zählen.
- Berechnen Sie mit der Anzahl der Gesamtpunkte und der Fläche des Fotos die Dichte der aktivierten Mikroglia (Iba1hohe Zellen / mm2) wie vor29 durchgeführt.
| Zielantigen | Gekoppelt mit | Klonalität | Wirtsspezies | Reaktivität der Spezies* | Verdünnung** |
| Tyrosin-Hydroxylase | N/A | Polyklonal | Kaninchen | Maus, Ratte, Mensch | 1/200 - 1/1000 |
| Iba1 | N/A | Monoklonal | Kaninchen | Maus, Ratte, Mensch | 1/1000 |
| alpha-Synuclein | N/A | Monoklonal | Kaninchen | Mensch | 1/150 |
| CD4 | N/A | Monoklonal | Ratte | Maus | 1/250 |
| IgG (H+L) | Biotiniliert | Polyklonal | Ziege | Kaninchen | 1/500 |
| IgG (H+L) | AlexaFluor 546 | Polyklonal | Ziege | Kaninchen | 1/500 |
| IgG (H+L) | AlexaFluor 647 | Polyklonal | Ziege | Kaninchen | 1/500 |
| IgG (H+L) | AlexaFluor 546 | Polyklonal | Ziege | Ratte | 1/500 |
Tabelle 1: Antikörperverdünnungen. N/A, nicht zutreffend. *, Es wird nur angegeben, wenn es Reaktivitäten mit Maus, Ratte und Mensch gibt, unabhängig von der Reaktivität mit anderen Arten. **, Es wird eine einzelne Verdünnung oder ein Verdünnungsbereich angegeben.
5. Immunfluoreszenzanalyse zur Beurteilung der T-Zell-Infiltration im nigrostriatalen Weg (ca. 2 Tage)
- Für die Immunfluoreszenzanalyse von hαSyn oder TH/GFP auf striatalen oder nigralen Scheiben setzen Sie den Satz von fünf (Striatum) oder sechs (SN) Scheiben aus demselben Gehirn in einer Vertiefung einer 24-Well-Platte zusammen.
- Waschen Sie die Abschnitte 3x mit 1 ml PBS und inkubieren Sie dann mit 0,5 ml Blockierlösung (0,3% Triton X-100, 0,05% Tween20 und 5% BSA in PBS) bei Raumtemperatur und mit Rühren für 40 min.
- Danach mit 0,5 ml Blockierlösung, die den primären Antikörper (Kaninchen-Anti-TH-pAb verdünnt 1:500; oder Kaninchen-Anti-hαSyn-Antikörper verdünnt 1:150, siehe Tabelle 1) enthält, bei Raumtemperatur und mit Bewegung über Nacht inkubieren.
- Waschen Sie die Abschnitte 3x mit 1 ml PBS und inkubieren Sie mit 0,5 ml Blockierlösung, die AlexaFluor546-gekoppelte Anti-Kaninchen-Sekundärantikörper (1:500, siehe Tabelle 1) und 4′,6-Diamidino-2-phenylindol (DAPI; 1:1000) enthält, bei Raumtemperatur und mit Rühren für 2 h. Dann waschen Sie die Abschnitte 3x mit 1 ml PBS.
- Montieren Sie die Gehirnabschnitte wie oben beschrieben auf Glasobjektträgern (Schritt 4.9.). Die Bilder wurden mit einem invertierten Fluoreszenzmikroskop aufgenommen, das mit einem Netzteil gekoppelt war.
- Für die Immunfluoreszenzanalyse von TH / CD4 / GFP (Foxp3) auf nigralen Scheiben legen Sie den Satz von sechs (SN) Scheiben aus demselben Gehirn in eine Vertiefung einer 24-Well-Platte. Waschen Sie die Abschnitte 3x mit 1 ml PBS und inkubieren Sie dann mit 0,5 ml Blockierlösung (0,5% Triton X-100, 0,5% Fischhautgelatine in PBS) bei Raumtemperatur und mit Rühren für 2 h.
- Inkubieren mit 0,5 ml blockierender Lösung, die die primären Antikörper Kaninchen-Anti-TH-pAb (1:200, siehe Tabelle 1) und Ratten-Anti-CD4 (1:250) bei 4 °C und mit Bewegung über Nacht enthält.
- Waschen Sie die Abschnitte 3x mit 1 ml PBS und inkubieren Sie mit 0,5 ml Blockierlösung, die Anti-Kaninchen enthält, gekoppelt an AlexaFluor 647 (1:500, siehe Tabelle 1) und Anti-Ratten, gekoppelt an AlexaFluor 546 (1:500) bei Raumtemperatur und mit Bewegung für 2 h. Dann waschen Sie die Abschnitte 3x mit 1 ml PBS.
- Legen Sie jeden Satz von sechs (SN) Scheiben, die Sie aus demselben Gehirn erhalten haben, in rostrocaudaler Reihenfolge auf denselben Glasobjektträger und montieren Sie sie mit Fluoromount G. Erfassen Sie Bilder mit einem Leica DMi8-Mikroskop. Verwenden Sie die in Tabelle 2 angegebenen konfokalen Mikroskopeinstellungen, um Bilder aus der Immunfluoreszenzanalyse aufzunehmen.
| Chanel Name | Würfel | Emissionswellenlänge | Name der Nachschlagetabelle | Belichtungszeit | Gewinnen | Auflösung XY | Auflösung Z |
| Kanal 1 | Y5 | 700nm | Grau | 1.011,727 ms | hohe Bohrlochkapazität | 2.237 um | 24.444 um |
| Kanal 2 | GFP | 525 nm | Grün | 326,851 ms | hohe Bohrlochkapazität | 2.237 um | 24.444 um |
| Kanal 3 | TXR | 630 nm | Rot | 406,344 ms | hohe Bohrlochkapazität | 2.237 um | 24.444 um |
| Kanal 4 | Dapi | 460 nm | Blau | 91,501 ms | hohe Bohrlochkapazität | 2.237 um | 24.444 um |
Tabelle 2: Konfokale Mikroskopeinstellungen, die für die Aufnahme von Bildern aus der Immunfluoreszenzanalyse verwendet werden.
6. Statistische Auswertung
- Um die von der ipsilateralen und der kontralateralen Seite erhaltenen Daten zu vergleichen, verwenden Sie einen gepaarten zweiseitigen Student-t-Test.
- Um Daten von Mäusen, die AAV-hαSyn erhalten, und von Mäusen, die AAV-GFP oder Scheinoperationen erhalten, zu vergleichen, verwenden Sie einen ungepaarten zweischwänzigen Student's t-Test. Berücksichtigen Sie signifikante Unterschiede, wenn P-Werte < 0,05 betragen.
Ergebnisse
Validierung der korrekten Abgabe von AAV-Vektoren in den dopaminergen Neuronen des nigrostriatalen Weges
Um die Prozesse der Neuroinflammation, Neurodegeneration und motorischen Beeinträchtigung zu untersuchen, die durch die Synuclein-Pathologie gefördert werden, wurde ein Mausmodell der Parkinson-Krankheit verwendet, das durch die einseitige stereotaktische Abgabe von AAV, das hαSyn kodiert, in der SN 16,17,30,31 induziert wurde (siehe das experimentelle Design in Ergänzende Abbildung 1 ). Um die korrekte Abgabe von AAV-Vektoren in den dopaminergen Neuronen des nigrostriatalen Weges zu validieren, wurde AAV-kodierendes GFP (AAV-GFP) in die SN injiziert, und 12 Wochen später wurden GFP-Fluoreszenz und Tyrosinhydroxylase (TH) -Immunreaktivität im SN und Striatum durch Immunfluoreszenz analysiert. Die GFP-assoziierte Fluoreszenz wurde ausschließlich auf der ipsilateralen Seite beobachtet, und es gab eine signifikante Kolokalisation mit TH-Immunreaktivität sowohl im SN als auch im Striatum, was auf die korrekte Abgabe von AAV-Vektoren in den dopaminergen Neuronen des nigrostriatalen Weges hinweist (Abbildung 1).
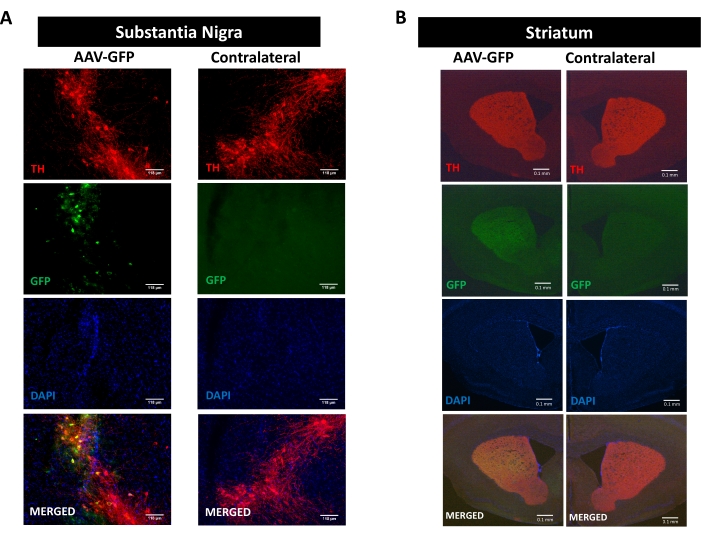
Abbildung 1: Analyse der Abgabe von AAV-GFP im nigrostriatalen Signalweg. Mäuse erhielten AAV-GFP (1 x 10 10 vg/Maus) und wurden 12 Wochen später geopfert, und TH wurde in (A) dem SN (Skalenbalken sind 118 μm) und (B) dem Striatum (Skalenbalken sind100 μm) immungefärbt. TH- und GFP-assoziierte Fluoreszenz wurden mittels Epifluoreszenzmikroskopie analysiert. Kerne wurden mit DAPI gefärbt. Repräsentative Bilder von zusammengeführten oder einfachen Färbungen von TH (rot), GFP (grün) und DAPI (blau) werden angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Einstellung der Dosis des viralen Vektors, die verabreicht wird, um Neurodegeneration und motorische Beeinträchtigung im Mausmodell der durch AAV-hαSyn induzierten Parkinson-Krankheit zu induzieren
Um die Dosis von AAV-hαSyn zu testen, die erforderlich ist, um eine signifikante Überexpression von hαSyn zu induzieren, die die Neurodegeneration der nigralen dopaminergen Neuronen fördert, wurden verschiedene Dosen (1 x 108 virale Genome [vg]/Maus, 1 x 109 vg/Maus oder 1 x10 10 vg/Maus) von AAV-hαSyn injiziert, und 12 Wochen später wurden die hαSyn-Immunreaktivität und das Ausmaß der TH-Immunreaktivität im nigrostriatalen Signalweg untersucht. Obwohl die hαSyn-Immunreaktivität bei allen im SN getesteten Dosen offensichtlich war (Abbildung 2), zeigten nur Mäuse, die 1 x10 10 vg/Maus erhielten, eine offensichtliche hαSyn-Immunreaktivität im Striatum (Abbildung 3). Darüber hinaus zeigten Mäuse, die 1 x10 10 vg/Maus AAV-hαSyn erhielten, einen signifikanten Verlust von dopaminergen Neuronen in der SN (Abbildung 4A,B). Obwohl Mäuse, die 1 x 10 10 vg/Maus AAV-GFP erhielten, einen geringen Grad (~20%) des neuronalen Verlusts aufwiesen (Abbildung 4A,B), zeigten Mäuse, die die gleiche Dosis AAV-hαSyn erhielten, einen signifikant höheren Grad an Neurodegeneration der nigralen dopaminergen Neuronen (Abbildung 4C). Dementsprechend wurden weitere Experimente mit 1 x10 10 vg/Maus von AAV-hαSyn durchgeführt. Darüber hinaus wurde das Ausmaß der motorischen Beeinträchtigung bei Mäusen, die verschiedene Dosen von AAV-hαSyn erhielten, unter Verwendung des Strahltests (Abbildung 5A) bestimmt, wie zuvor25 beschrieben. Eine signifikante Verringerung der Motorleistung wurde ausschließlich mit 1 x 1010 vg/Maus von AAV-hαSyn im Strahltest sowohl beim Vergleich der Anzahl der Fehler des rechten und des linken Pads (Abbildung 5B) als auch beim Vergleich der Gesamtzahl der Fehler von Mäusen, die AAV-hαSyn erhielten, im Vergleich zu Mäusen, die den Kontrollvektor AAV-GFP erhielten, festgestellt (Abbildung 5C). Dementsprechend wurden weitere Experimente mit 1 x10 10 vg/Maus von AAV-hαSyn durchgeführt.
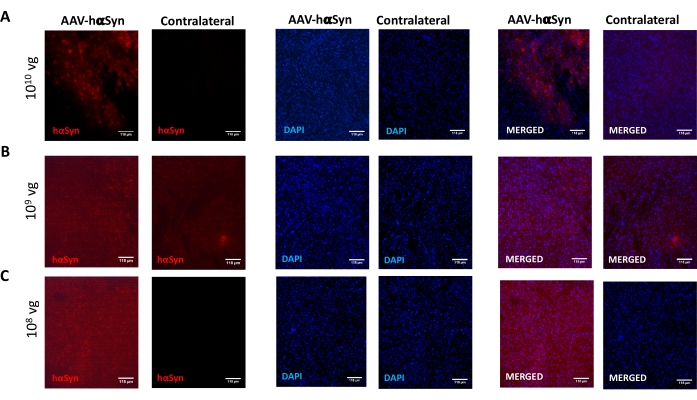
Abbildung 2: Analyse der menschlichen α-Synuclein-Expression im SN von Mäusen, die mit verschiedenen Dosen von AAV-hαSyn behandelt wurden. Mäuse erhielten AAV-hαSyn bei (A) 1 x10 10 vg/Maus, (B) 1 x 109 vg/Maus oder (C) 1 x 108 vg/Maus und wurden 12 Wochen später geopfert, und die hαSyn-Expression wurde durch Immunfluoreszenz in der SN mittels Epifluoreszenzmikroskopie analysiert. Kerne wurden mit DAPI gefärbt. Repräsentative Bilder von zusammengeführten oder einfachen Färbungen von hαSyn (rot) oder DAPI (blau) werden angezeigt. Maßstabsstäbe sind 118 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
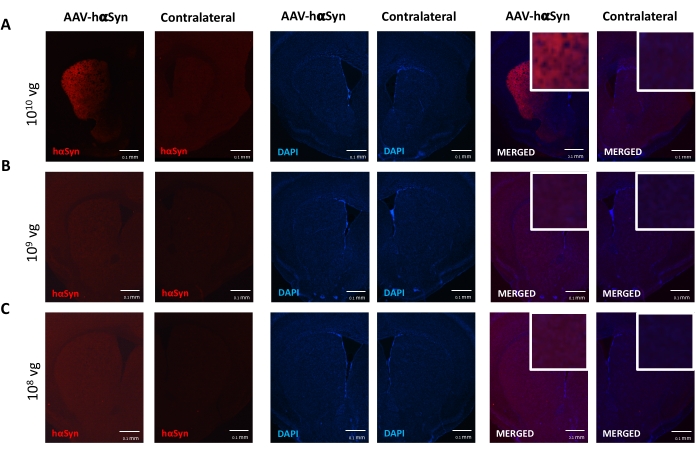
Abbildung 3: Analyse der menschlichen α-Synuclein-Expression im Striatums von Mäusen, die mit verschiedenen Dosen von AAV-hαSyn behandelt wurden. Mäuse erhielten AAV-hαSyn bei (A) 1 x10 10 vg/Maus, (B) 1 x 109 vg/Maus oder (C) 1 x 108 vg/Maus) und wurden 12 Wochen später geopfert, und die hαSyn-Expression wurde durch Immunfluoreszenz im Striatum mittels Epifluoreszenzmikroskopie analysiert. Kerne wurden mit DAPI gefärbt. Repräsentative Bilder von zusammengeführten oder einfachen Färbungen von hαSyn (rot) oder DAPI (blau) werden angezeigt. Maßstabsstäbe sind 100 μm. Die Einfügung in der oberen rechten Ecke der zusammengeführten Bilder zeigt einen Bereich von Interesse an höherer Vergrößerung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
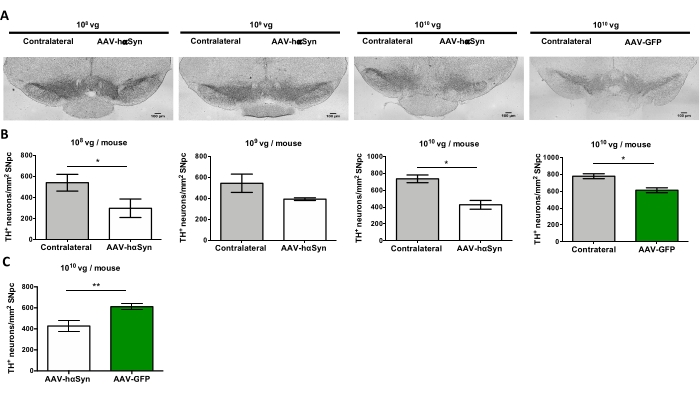
Abbildung 4: Verlust von dopaminergen Neuronen der SN bei Mäusen, die mit unterschiedlichen Dosen von AAV-hαSyn oder Kontrollvektor behandelt wurden. Mäuse erhielten AAV-hαSyn (1 x 10 10 vg/Maus, 1 x 109 vg/Maus oder 1 x 108 vg/Maus) oder AAV-GFP (1 x10 10 vg/Maus) und wurden 12 Wochen später geopfert, und TH wurde im SNpc durch Immunhistochemie analysiert. (A) Repräsentative Bilder. Maßstabsstäbe, 100 μm. (B,C) Die Dichte der Neuronen wurde als Anzahl der TH+-Neuronen/mm2 quantifiziert. Die Daten stellen den Mittelwert ± REM dar. n = 3–8 Mäuse pro Gruppe. (B) Ein Vergleich der ipsilateralen mit den kontralateralen Seiten wurde unter Verwendung des zweiseitig gepaarten Student's t-Tests durchgeführt. (C) Es wurde ein Vergleich der ipsilateralen Seiten von Mäusen durchgeführt, die 1 x10 10 vg/Maus von AAV-hαSyn oder AAV-GFP erhielten. (B,C) Während weiße Balken die Quantifizierung von TH+-Neuronen auf der ipsilateralen Seite von Mäusen anzeigen, die AAV-hαSyn erhalten, zeigen grüne Balken die Quantifizierung von TH+-Neuronen auf der ipsilateralen Seite von Mäusen an, die AAV-GFP erhalten. Graue Balken zeigen die Quantifizierung von TH+-Neuronen auf der kontralateralen Seite der entsprechenden Gruppe an. Vergleiche wurden von einem zweischwänzigen ungepaarten Student's t-Test durchgeführt. *p < 0,05; **p < 0,01. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
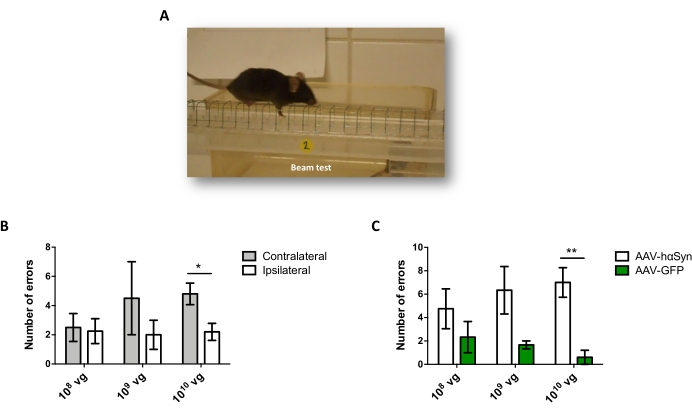
Abbildung 5: Analyse der motorischen Leistung bei Mäusen, die mit verschiedenen Dosen von AAV-hαSyn behandelt wurden. Mäuse erhielten unterschiedliche Dosen (1 x 10 10 vg/Maus, 1 x 109 vg/Maus oder 1 x10 8 vg/Maus) AAV-hαSyn oder AAV-GFP, und 12 Wochen später wurde die motorische Leistung durch den Strahltest bewertet. (A) Bild einer Maus, die auf dem Balken läuft. (B) Die Anzahl der Fehler, die von linken Gliedmaßen (kontralateral) gegenüber rechten Gliedmaßen (ipsilateral) durchgeführt wurden, wurde in den Gruppen von Mäusen, die AAV-hαSyn erhielten, quantifiziert. (C) Die Gesamtzahl der Fehler wurde zwischen verschiedenen Versuchsgruppen verglichen, die die gleiche Dosis AAV-hαSyn oder AAV-GFP erhielten. Die Daten stellen den Mittelwert ± REM dar. n = 3–5 Mäuse pro Gruppe. Vergleiche wurden von (B) einem gepaarten zweiseitigen Student's t-Test oder von (C) einem ungepaarten Two-tailed Student's t-Test durchgeführt. *p < 0,05; **p < 0,01. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Aufbau der Kinetik des durch AAV-αSyn induzierten Parkinson-Modells
Nach der Bestimmung der richtigen AAV-hαSyn-Dosis, die verwendet wurde, um ein signifikantes Maß an Neurodegeneration und motorischen Beeinträchtigungen zu induzieren, wurden Experimente durchgeführt, um den Beginn der hαSyn-Überexpression zu definieren. Zu diesem Zweck wurden Mäuse mit 1 x10 10 vg/Maus AAV-hαSyn oder Scheinoperationen behandelt. Das Ausmaß der hαSyn-Expression wurde in der SN einmal pro Woche in den Wochen 2-5 nach der stereotaktischen Operation analysiert (siehe das experimentelle Design in Ergänzende Abbildung 2). Die Ergebnisse zeigen, dass, obwohl die hαSyn-Expression bereits 2 Wochen nach der Operation in niedrigen Konzentrationen nachgewiesen wurde, hαSyn-Cluster in Woche 5 nach der stereotaktischen Operation auftraten (Abbildung 6).

Abbildung 6: Analyse des Zeitverlaufs der menschlichen α-Synuclein-Expression im SN von Mäusen, die mit AAV-hαSyn behandelt wurden. Mäuse erhielten AAV-hαSyn (1 x10 10 vg/Maus) oder nur die schein-stereotaktische Operation, und die Expression von hαSyn in der SN wurde (A) 2 Wochen, (B) 3 Wochen, (C) 4 Wochen oder (D) 5 Wochen später durch Immunfluoreszenz mittels Epifluoreszenzmikroskopie analysiert. Kerne wurden mit DAPI gefärbt. Repräsentative Bilder von zusammengeführten oder einfachen Färbungen von hαSyn (rot) oder DAPI (blau) werden angezeigt. Maßstabsstäbe, 100 μm. Die Einfügung in der oberen rechten Ecke der zusammengeführten Bilder zeigt einen Bereich von Interesse an höherer Vergrößerung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Anschließend wurden Experimente durchgeführt, um die geeigneten Zeitpunkte für die Analyse von Neuroinflammation und T-Zell-Infiltration im Zentralnervensystem (ZNS) nach der stereotaktischen Verabreichung von AAV-hαSyn zu bestimmen. Um den Höhepunkt der Mikrogliaaktivierung nach der Behandlung von Mäusen mit AAV-hαSyn zu bestimmen, wurde das Ausmaß der Zellen, die hohe Iba1-Spiegel im Striatum exprimierten, einmal pro Woche in den Wochen 2-15 nach der stereotaktischen Operation untersucht. Die Ergebnisse zeigen einen signifikanten Anstieg der Mikrogliaaktivierung der ipsilateralen Seite im Vergleich zur kontralateralen Seite von Mäusen 15 Wochen nach der AAV-hαSyn-Behandlung (Abbildung 7). Die Anzahl der in den SNpc infiltrierten Treg-Zellen (CD4+ Foxp3+) wurde ebenfalls zu verschiedenen Zeitpunkten nach der stereotaktischen Abgabe von AAV-hαSyn durch Immunfluoreszenz nach konfokaler Mikroskopiebeobachtung bewertet. Die Ergebnisse zeigen, dass der Höhepunkt der Treg-Infiltration in den SNpc 11 Wochen nach der Operation lag, während das Ausmaß der Treg-Infiltration dieses Bereichs des Gehirns in Woche 8 oder Woche 13 nach der Operation niedriger war (Abbildung 8). Es wurden keine CD4+-T-Zellen entdeckt, die das Striatum infiltrierten (Daten nicht gezeigt). Insgesamt deuten diese Ergebnisse darauf hin, dass bei Verwendung von 1 x 1010 vg / Maus von AAV-hαSyn der am besten geeignete Zeitpunkt für die Analyse der Neuroinflammation Woche 15 nach der stereotaktischen Operation ist, während ein geeigneter Zeitpunkt für die Analyse der T-Zell-Infiltration in das ZNS Woche 11 nach der AAV-hαSyn-Behandlung zu sein scheint.
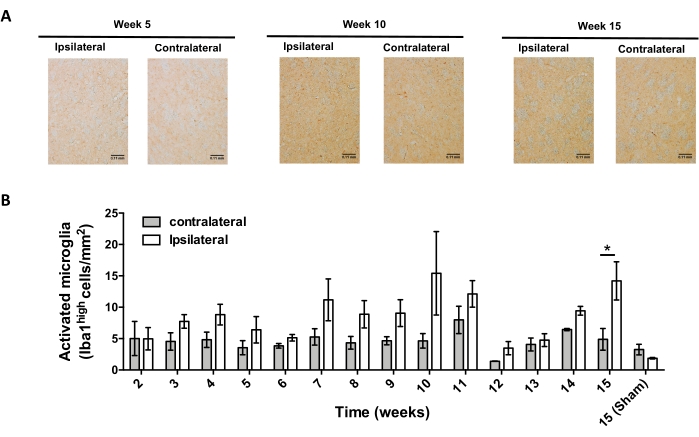
Abbildung 7: Analyse des zeitlichen Verlaufs der Mikrogliaaktivierung bei Mäusen, die mit AAV-hαSyn beimpft wurden. Mäuse erhielten AAV-hαSyn (1 x10 10 vg/Maus), und die Mikrogliaaktivierung wurde durch immunhistochemische Analyse von Iba1 im Striatum zu verschiedenen Zeitpunkten nach der Operation untersucht. (A) Es werden repräsentative Übersichtsbilder der immunhistochemischen Analyse von Iba1 von Mäusen gezeigt, die 5 Wochen, 10 Wochen oder 15 Wochen nach der Impfung mit AAV-hαSyn geopfert wurden. Maßstabsstäbe, 110 μm. (B) Die Dichte der aktivierten Mikroglia wurde als die Anzahl der Zellen quantifiziert, die pro Bereich hohe Mengen an Iba1 und Ameboidform exprimieren. Die Daten stellen den Mittelwert ± REM dar. n = 3 Mäuse pro Gruppe. Ein zweiseitiger gepaarter Student's t-Test wurde verwendet, um statistische Unterschiede zwischen ipsilateralem und kontralateralem Iba1 in jeder Gruppe zu bestimmen. *p < 0,05. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
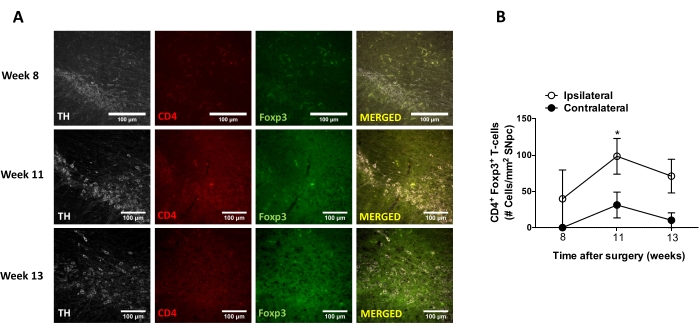
Abbildung 8: Analyse des Zeitverlaufs der CD4+ T-Zell-Infiltration in das SN von Mäusen, die mit AAV-hαSyn geimpft wurden. Foxp3gfp Reportermäuse erhielten AAV-hαSyn (1 x 1010 vg/Maus). Das Vorhandensein von CD4+ T-Zellen, die Foxp3 exprimieren, und das Vorhandensein von TH+ Neuronen wurden zu verschiedenen Zeitpunkten (Woche 8, Woche 11 und Woche 13 nach der Operation) in der SN durch Immunfluoreszenz analysiert. (A) Es werden repräsentative Bilder für die einzelne Immunfärbung oder die Zusammenführung gezeigt. Skalenbalken, 100 μm. (B) Die Anzahl der CD4+ Foxp3+ T-Zellen pro Bereich im SN wurde quantifiziert. Die Daten repräsentieren den Mittelwert ± REM von 3 Mäusen pro Gruppe. *p<0.05, ipsilateral versus contralateral CD4+ Foxp3+ T cells by two-tailed Student's t-test. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1: Experimentelles Design zur Bewertung der Wirkung verschiedener Dosen von AAV-Vektoren auf Synucleinpathologie, Neurodegeneration und motorische Beeinträchtigung. Wildtyp-männliche C57BL/6-Mäuse wurden betäubt und erhielten eine stereotaktische Inokulation verschiedener Dosen (1 x10 10 vg/Maus, 1 x 109 vg/Maus oder 1 x 108 vg/Maus) AAV-Kodierung von menschlichem α-Synuclein (AAV-hαSyn) oder eGFP (AAV-GFP) unter der Kontrolle des CBA-Promotors in die rechte substantia nigra (SN). Nach 12 Wochen wurde die Expression von GFP und hαSyn im SN und Striatum (Str) durch Immunfluoreszenz (IF) bewertet, Tyrosinhydroxylase-positive (TH+) Zellen wurden durch Immunhistochemie (IHC) im SN quantifiziert und die motorische Leistung wurde durch den Strahltest bewertet. Die Anzahl der Mäuse in jeder experimentellen Gruppe ist in Klammern angegeben. * zeigt Gruppen an, bei denen eine Maus vor den Analysen gestorben ist. Jede Analyse gibt in Klammern die Nummer der Abbildung aus dem Hauptteil des Papiers an, in der die entsprechenden Ergebnisse angezeigt werden. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Experimentelles Design zur Bestimmung der Kinetik von T-Zell-Infiltration, Neuroinflammation und hαSyn-Expression. Foxp3gfp-Reportermäuse wurden betäubt und erhielten eine stereotaktische Impfung von AAV (1 x10 10 vg / Maus), die menschliches α-Synuclein (AAV-hαSyn) unter der Kontrolle des CBA-Promotors in die rechte Substantia nigra (SN) oder Scheinchirurgie (PBS) kodiert. Mäuse wurden zu verschiedenen Zeitpunkten geopfert, und die Expression von hαSyn in der SN und im Striatum wurde durch Immunfluoreszenz (IF), GFP (Foxp3), CD4 und Tyrosinhydroxylase-positive (TH +) Zellen wurde durch IF im SN quantifiziert, und die Iba1-Expression wurde durch Immunhistochemie (IHC) im Striatum (Str) analysiert. Die Anzahl der Mäuse in jeder experimentellen Gruppe ist angegeben. Der Bereich der Zeitpunkte, die in jeder Analyse enthalten sind, wird angegeben. Jede Analyse gibt in Klammern die Nummer der Abbildung aus dem Hauptteil des Papiers an, in der die entsprechenden Ergebnisse angezeigt werden. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das hier analysierte Mausmodell der Neurodegeneration könnte dazu beitragen, viele kritische Aspekte der Pathophysiologie der Parkinson-Krankheit zu untersuchen, einschließlich der Mechanismen, die an der αSyn-Pathologie und Mikroglia-Aktivierung beteiligt sind, der Beteiligung des peripheren Immunsystems an der Regulierung der Neuroinflammation und der Mechanismen der Neurodegeneration. Zu den Mechanismen, die an der αSyn-Pathologie beteiligt sind, gehören die subzellulären Mechanismen, die mit einer mitochondrialen, lysosomalen oder proteasomalen Dysfunktion in Gegenwart einer übermäßigen Belastung von αSyn in den dopaminergen Neuronen des SN2 verbunden sind. Es ist wichtig zu berücksichtigen, dass neben der hαSyn-Expression, die durch AAV-vermittelte Transduktion induziert wird, auch die endogene Maus αSyn zur Belastung der gesamten αSyn-Expression beiträgt. Transgene Mäuse, die Maus αSyn überexprimieren, entwickeln eine ähnliche Synucleinpathologie, Neuropathologie und motorische Beeinträchtigung wie diese Mausmodelle, die auf der Überexpression von hαSyn32 basieren. In Bezug auf die Mikroglia-Aktivierung könnte das vorliegende Mausmodell verwendet werden, um zu untersuchen, wie verschiedene molekulare und zelluläre Akteure wie Zytokine, Neurotransmitter, Astrozyten, Neuronen, die Blut-Hirn-Schranke und T-Zellen den Erwerb von entzündungsfördernden oder entzündungshemmenden funktionellen Phänotypen 8,10,11 regulieren könnten. . Dieses Modell stellt auch ein wichtiges Werkzeug für die Untersuchung der Rolle des peripheren Immunsystems, das nicht nur T-Zellen, sondern auch Makrophagen, Monozyten und Neutrophile umfasst, auf die Prozesse der Neuroinflammation und Neurodegeneration von nigralen Neuronendar 11,33,34. Schließlich stellt dieses Mausmodell auch ein wertvolles System dar, um die zellulären und molekularen Mechanismen der Neurodegeneration in vivo zu untersuchen, einschließlich derjenigen, die durch interne zelluläre Prozesse wie oxidativen Stress, Energiedefizite und beschädigte Organellen 2 induziert werden, oder solcher, die von externen Akteuren ausgeübt werden, wie neurotoxische Faktoren, die von Mikrogliazellen, Astrozyten und zytotoxischen T-Zellen produziert werden8. 28,29,35
Eine Einschränkung dieses Mausmodells ist die Untersuchung, wie die pathologische Aggregation von αSyn an außerzerebralen Stellen die Anfangsstadien in der Entwicklung der Parkinson-Krankheitdarstellen könnte 36. In diesem Zusammenhang gibt es immer mehr Hinweise darauf, dass vor der Neurodegeneration von nigralen Neuronen und der motorischen Beeinträchtigung die αSyn-Pathologie in der Darmschleimhaut und im Geruchsepithel 36 und wahrscheinlich auch in derαSyn-spezifischen T-Zell-Antwort beginnt12. Danach würden αSyn-Aggregate durch den Vagusnerv zum Hirnstamm wandern und die Neuroinflammation und Neurodegeneration von dopaminergen Neuronenauslösen 12. Obwohl das AAV-hαSyn-Modell die meisten Aspekte der Parkinson-Krankheit rekapituliert, gibt es in diesem Modell keine offensichtliche Beteiligung der pathologischen Aggregation von αSyn an extrazerebralen Stellen. Ein alternatives Modell mit hαSyn-Pathologie, das für die Untersuchung dieser Aspekte der Parkinson-Krankheit geeignet ist, könnte transgene Mäuse sein, die hαSyn unter der Kontrolle des Thy1-Promotors, des Thy1-SNCA-Modells 37, überexprimieren, bei dem die Krankheitsentwicklung von der Darmmikrobiota abhängt und eine offensichtliche gastrointestinale Beeinträchtigung beinhaltet38.
Obwohl es für die Untersuchung der verschiedenen Prozesse, die mit der Pathophysiologie der Parkinson-Krankheit verbunden sind, hilfreich ist, umfasst das vorliegende Mausmodell kritische Schritte, die minutiös überprüft werden sollten, einschließlich der korrekten Abgabe der viralen Vektoren in den entsprechenden Raumkoordinaten, der selektiven Expression von hαSyn in Neuronen (die vom AAV-Serotyp und dem Vektorkonstrukt abhängt), und die richtige AAV-Dosis und das richtige Timing vor der Analyse des Parkinson-Phänotyps. Die Analyse der korrekten Abgabe der viralen Vektoren im SN ist notwendig, da die Verwendung der korrekten Raumkoordinaten des SN möglicherweise nicht ausreicht, wenn die Nadel nicht ganz gerade ist, was für das menschliche Auge manchmal nicht wahrnehmbar ist. Darüber hinaus hängt die Diffusion der AAV-Vektoren vom AAV-Serotyp39 ab. Aus diesen Gründen ist es notwendig, regelmäßige Qualitätskontrollen durchzuführen, die die korrekte Abgabe und Diffusion der injizierten AAV-GFP-Vektoren nach der Beobachtung von GFP in Gehirnschnitten, die den Bereich des SN enthalten, überprüfen.
In Bezug auf die selektive Expression von hαSyn in Neuronen könnte die Expression von hαSyn im Prinzip so konstruiert werden, dass sie von einem Promotor gesteuert wird, der selektiv für Neuronen oder, noch genauer, selektiv für dopaminerge Neuronen ist, wie die Verwendung des TH-Promotors in AAV-Vektoren, um die selektive Expression von Genen in dopaminergen Neuronen zu induzieren40 . Diese Strategie funktioniert jedoch nicht, wenn das, was gesucht wird, eine Überexpression des interessierenden Gens ist. Aus diesem Grund ist es im vorliegenden Modell wichtig, einen starken Promotor (ein Promotor, der eine hohe Expression des nachgeschalteten Gens induziert) und AAV-Serotypen mit neuronalem Tropismus zu verwenden. In dieser Studie wurde der CBA-Promotor als starker Promotor verwendet, um die Überexpression von hαSyn zu induzieren, und der AAV5-Serotyp wurde für den viralen Vektor verwendet. Dieser Serotyp wurde bereits verwendet, um Maus- und Rattenneuronen41,42 zu transduzieren. Hier zeigten die Ergebnisse, dass 12 Wochen nach der Abgabe von AAV5-GFP in der SN von Mäusen die grüne Fluoreszenz selektiv auf der ipsilateralen Seite sowohl des SN als auch des Striatums vorhanden war (Abbildung 1), was auf die effiziente Transduktion von Neuronen des nigrostriatalen Weges hinweist.
Ein weiterer kritischer Aspekt dieses Mausmodells der Parkinson-Krankheit ist der Zeitpunkt, der erforderlich ist, um einen bestimmten Prozess nach der Operation zu analysieren. In dieser Hinsicht zeigt diese Arbeit eine kinetische Untersuchung verschiedener Prozesse, die an der Pathologie beteiligt sind. Da sich wichtige Zeitpunkte mit der Dosis viraler Genome pro Maus, dem verwendeten Serotyp von AAV oder sogar mit der verwendeten AAV-Charge ändern, wurde zunächst eine Dosis-Wirkungs-Analyse der Menge an AAV-αSyn durchgeführt, die erforderlich ist, um einen signifikanten Verlust von TH+-Neuronen und motorischen Beeinträchtigungen zu induzieren. Frühere Studien haben eine signifikante motorische Beeinträchtigung und einen Verlust von TH+-Neuronen des nigrostriatalen Signalwegs nach 12 Wochen AAV-αSyn-Injektionen bei Mäusen in Dosen im Bereich von 6 x 108-3 x 10 10 viralen Genomen pro Maus 16,17,30,31 gezeigt. Dementsprechend reichte die Dosis von AAV-hαSyn, die zur Induktion der hαSyn-Expression im nigrostriatalen Signalweg, zum Verlust von TH+-Neuronen und zur motorischen Beeinträchtigung bei Mäusen verwendet wurde, von 1 x 108–1 x 1010 viralen Genomen pro Maus. Um zu kontrollieren, dass der Verlust von TH+-Neuronen und die motorische Beeinträchtigung durch die Überexpression von hαSyn in der SN und nicht durch eine AAV-Infektion von Neuronen der SN induziert wurden, wurden Kontrollgruppen eingeschlossen, in denen AAV-Kodierung für ein Reportergen (AAV-eGFP) einseitig in der SN von Mäusen verabreicht wurde und Neurodegeneration und motorische Beeinträchtigung bestimmt wurden. Die Ergebnisse zeigten, dass 12 Wochen nach der stereotaktischen Operation 1 x 1010 virale Genome pro Maus eine angemessene Dosis von AAV5-hαSyn aufwiesen, da Mäuse, die diese Viruslast erhielten, signifikantes hαSyn im nigrostriatalen Signalweg (Abbildung 2 und Abbildung 3), Verlust von TH+ Neuronen (Abbildung 4) und motorische Beeinträchtigung (Abbildung 5) aufwiesen. Im Gegensatz dazu waren niedrigere Dosen von AAV5-hαSyn (1 x 10 8 virale Genome pro Maus und 1 x 109 virale Genome pro Maus) nicht stark genug, um signifikante Veränderungen in all diesen Parametern zusammen zu erreichen (Abbildungen 2–4). Bemerkenswert ist, dass die Verabreichung von AAV-GFP bei 1 x 10 10 viralen Genomen pro Maus einen geringen (~20%), aber signifikanten Verlust von TH + -Neuronen von nigralen dopaminergen Neuronen induzierte (Abbildung 4A, B). Dieses Ergebnis stimmt mit früheren Beobachtungen unter Verwendung dieses Modells41 überein und ist wahrscheinlich die Folge einer geringen Neuroinflammation, die durch die Verabreichung von AAV-Vektoren in der SN induziert wurde. Dennoch war das Ausmaß des Verlustes von TH+-Neuronen bei Mäusen, die AAV5-hαSyn erhielten, signifikant höher als bei Mäusen, die die gleiche Dosis AAV-GFP erhielten (Abbildung 4C). Bemerkenswert ist, dass die Kinetik des hαSyn-Ausdrucks nicht nur von der Effizienz der Transduktion abhängt, sondern auch vom Ausmaß der AAV-Diffusion39. Da die AAV-Diffusion vom AAV-Serotyp abhängt, können die genauen Schlüsselzeitpunkte in diesem Tiermodell variieren, wenn ein anderer AAV-Serotyp als AAV5 verwendet wird.
Anschließend wurde eine kinetische Analyse mit 1 x 1010 viralen Genomen pro Maus durchgeführt, um wichtige Zeitpunkte in diesem Mausmodell zu bestimmen. Da aktuelle Beweise einige frühe Symptome gezeigt haben, die vor einer motorischen Beeinträchtigung auftreten, die die frühzeitige Diagnose der Parkinson-Krankheit43,44 ermöglichen würden, versuchten diese Experimente, den Zeitpunkt zu finden, zu dem die hαSyn-Expression bereits offensichtlich war, jedoch in Abwesenheit einer motorischen Beeinträchtigung. Die Ergebnisse zeigen, dass der Beginn der hαSyn-Expression in der SN 5 Wochen nach der stereotaktischen Verabreichung von AAV-hαSyn war (Abbildung 6). Dieser Zeitpunkt stellt einen interessanten zeitlichen Punkt dar, um mit der Verabreichung von Therapien zu beginnen, die darauf zugeschnitten sind, die neuroinflammatorischen und neurodegenerativen Prozesse zu stoppen. Weitere wichtige Zeitpunkte, die hier bestimmt wurden, waren die Spitzenzeiten für zwei kritische Ereignisse, die mit dem Neuroinflammationsprozess verbunden sind: der Zeitpunkt, zu dem Mikroglia den maximalen Aktivierungsgrad erreichen, und der Zeitpunkt der maximalen T-Zell-Infiltration in die SN. Die Ergebnisse zeigten eine Kurve mit einem Trend, der zwei Wellen maximaler Mikrogliaaktivierung erreichte, die erste 10 Wochen nach der Operation und die zweite 15 Wochen nach der Operation (Abbildung 7). Die kinetische Analyse der T-Zell-Infiltration zeigte die Spitzenzeit der Treg-Infiltration in die SN 11 Wochen nach der stereotaktischen Operation (Abbildung 8). Überraschenderweise wurden während des analysierten Zeitraums (Wochen 8–13 nach der Operation) keine Effektor-T-Zellen (CD4+ Foxp3-) entdeckt, die das SN infiltrierten. Insgesamt deuten diese Ergebnisse auf einen angemessenen Zeitrahmen hin, um mit der Verabreichung von Therapien zu beginnen, die darauf abzielen, den Prozess der Neuroinflammation zu stoppen und die T-Zell-Infiltration in die SN unter Verwendung dieses präklinischen Modells abzuschwächen, das zwischen Woche 5 nach der Operation (Beginn der hαSyn-Überexpression) und Woche 10 nach der Operation (die erste Welle der Neuroinflammation und T-Zell-Infiltration) liegt (Abbildung 9).
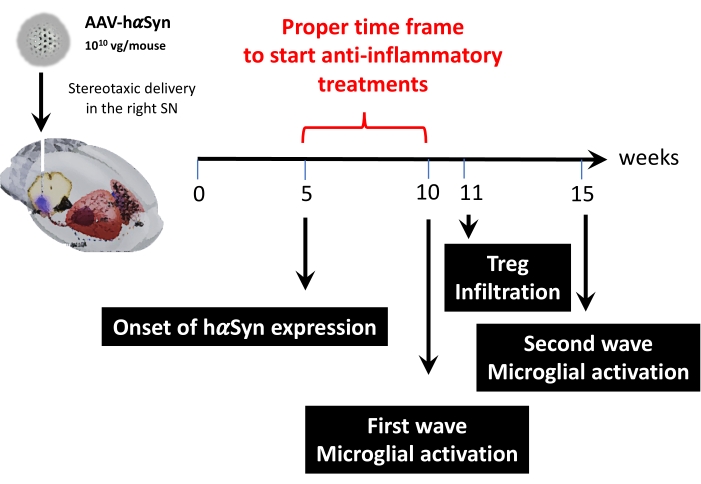
Abbildung 9: Zusammenfassung der wichtigsten Zeitpunkte für dieses Tiermodell. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Offenlegungen
Die Autoren erklären, dass die Forschung in Ermangelung finanzieller oder nichtfinanzieller konkurrierender Interessen durchgeführt wurde.
Danksagungen
Wir danken Dr. Sebastián Valenzuela und Dr. Micaela Ricca für ihre wertvolle tierärztliche Hilfe in unserer Tierhaltung. Diese Arbeit wurde unterstützt von "Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID" Centro Ciencia & Vida, FB210008 (an Fundación Ciencia & Vida), und dem Geroscience Center for Brain Health and Metabolism, FONDAP-15150012. Diese Arbeit wurde auch durch die Zuschüsse FONDECYT-1210013 (an R.P.) und FONDECYT-1150766 (an F.C.) von "Agencia Nacional de Investigación y Desarrollo de Chile (ANID)" und MJFF-10332.01 (an R.P.) und MJFF-17303 (an F.C.) von der Michael J Fox Foundation for Parkinson's Research finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| ANIMALS AND ANIMAL FOOD | |||
| Foxp3-GFP C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 023800 | |
| Laboratory Rodent Diet | LabDiet | Rodent Diet 5001 | Standard Rodent diet |
| Wild-type C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 000664 | |
| VIRAL VECTORS | |||
| AAV5-CBA-αSyn | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 10E13 vg/mL |
| AAV5-CBA-eGFP | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 9.5 x 10E12 vg/mL |
| ANESTHETICS AND ANALGESICS | |||
| Isoflurane | Baxter | 218082 | 1% for stereotaxic surgery |
| Ketamine | Drag Pharma | CHE30 | 70 mg/Kg for stereotaxic surgery |
| Sevoflurane | Baxter | VE2L9117 | For before transcardial perfusion |
| Tramadol | Drag Pharma | DPH134 | 30 mg/Kg every 24 h |
| Xylazine | Centrovet | EHL40 | 9 mg/kg for stereotaxic surgery |
| EQUIPMENT | |||
| Beam test | Home made | N/A | horizontal beam 25 cm length and 3 cm width. The beam surface was covered by a metallic grid (1 cm2). |
| Cryostate | Leica | CM1520 | |
| Digital camera | Nikon | S2800 Coolpix | For recording the beam test performance |
| Microscope | Olympus | BX51 | Used for IHC analysis (section 4.4) |
| Microscope | Olympus | IX71 | Used for IF analysis (section 5.3) |
| Microscope | Leica | DMI8 | Used for IF analysis (section 5.7) |
| New Standard Stereotaxic, mouse | Stoelting, Wood Dale, IL, USA | 51500 | stereotaxic frame for surgery |
| Peristaltic Pump | Masterflex | C-flex L/S16 | |
| Power supply unit | Olympus | U-RFL-T | Used for IF analysis (section 5.3) |
| Surgical suture | Sylkam®, B Braun | C0760171 | |
| Syringe 100 U | BD | 324918 | For anesthesia before transcardial perfusion, 29G needle |
| Syringe RN 5uL SYR W/O NEEDLE | Hamilton | HA-7641-01 | For viral vector innoculation |
| BUFFERS AND REAGENTS | |||
| Aviden, Peroxidase Conjugate | Merck, Darmstadt, Germany | 189728 | |
| Bovine Serum Albumin | Merck, Darmstadt, Germany | 9048-46-8 | |
| Cryotrotection buffer | Home made | N/A | 20% glycerine and 2% DMSO in PBS |
| DAPI | Abcam | ab228549 | |
| Diaminobenzidine | Merck, Darmstadt, Germany | D8001 | |
| Fluoromount -G T | Electron Microscopy Science | 17984-25 | |
| Gelatin | Merck, Darmstadt, Germany | 104078 | |
| Normal goat serum | Jackson ImmunoResearch Laboratory | 5000121 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 104005 | |
| PBS | Home made | N/A | 0.125 M, pH 7.4 |
| Peroxidase inactivating buffer | Home made | N/A | 0.03% H2O2 in methanol |
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| Trizma Hydrochloride | Merck, Darmstadt, Germany | 1185-53-1 | |
| Tween 20 | Sigma-Aldrich | 822184 | |
| ANTIBODIES | |||
| Biotin-SP (long spacer) AffiniPure Goat Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch Laboratory | 111065003 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11010 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 647 | ThermoFisher Scientific | A21244 | |
| Goat anti-Rat IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11081 | |
| Rabbit monoclonal anti-alpha-Synuclein | Abcam | ab138501 | |
| Rabbit monoclonal anti-Iba-1 | Abcam | EPR16588 | |
| Rabbit polyclonal anti-Tyrosine Hydroxylase | Millipore | AB152 | |
| Rat monoclonal anti-CD4 | Biolegend | 100402 | |
| SOFTWARES | |||
| GraphPad | Prism | 6.0 | Fos stats analysis |
| ImageJ | National Institute of Health | N/A | For image analysis |
| LAS X | Leica | N/A | For image capture with Leica microscope |
| ProgRes Capture Pro | Jenoptik | N/A | For image capture with Olympus microscope |
| VLC media player | VideoLAN Organization | N/A | For analysis of behavioural tests |
Referenzen
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiology of Aging. 24 (2), 197-211 (2003).
- Lim, K. L., Zhang, C. W. Molecular events underlying Parkinson's disease - An interwoven tapestry. Frontiers in Neurology. 4, 33(2013).
- Abdelmotilib, H., et al. α-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Mori, F., et al. Relationship among alpha-synuclein accumulation, dopamine synthesis, and neurodegeneration in Parkinson disease substantia nigra. The Journal of Neuropathology & Experimental Neurology. 65 (8), 808-815 (2006).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson's disease. Biochimica et Biophysica Acta. 1802 (1), 29-44 (2010).
- Vazquez-Velez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44, 87-108 (2021).
- Dehay, B., et al. Lysosomal impairment in Parkinson's disease. Movement Disorders. 28 (6), 725-732 (2013).
- Gonzalez, H., Elgueta, D., Montoya, A., Pacheco, R. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases. Journal of Neuroimmunology. 274 (1-2), 1-13 (2014).
- Pacheco, R. T-cell based immunotherapies for Parkinson's disease. Exploration of Neuroprotective Therapy. 1 (2), 72-85 (2021).
- Gonzalez, H., Contreras, F., Pacheco, R. Regulation of the neurodegenerative process associated to Parkinson's disease by CD4+ T-cells. Journal of Neuroimmune Pharmacology. 10 (4), 561-575 (2015).
- Gonzalez, H., Pacheco, R. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases. Journal of Neuroinflammation. 11 (1), 201(2014).
- Campos-Acuna, J., Elgueta, D., Pacheco, R. T-cell-driven inflammation as a mediator of the gut-brain axis involved in Parkinson's disease. Frontiers in Immunology. 10, 239(2019).
- Blesa, J., Phani, S., Jackson-Lewis, V., Przedborski, S. Classic and new animal models of Parkinson's disease. Journal of Biomedicine and Biotechnology. 2012, 845618(2012).
- Ulusoy, A., Decressac, M., Kirik, D., Bjorklund, A. Viral vector-mediated overexpression of alpha-synuclein as a progressive model of Parkinson's disease. Progress in Brain Research. 184, 89-111 (2010).
- Gomez-Benito, M., et al. Modeling Parkinson's disease with the alpha-synuclein protein. Frontiers in Pharmacology. 11, 356(2020).
- Song, L. K., et al. Targeted overexpression of alpha-synuclein by rAAV2/1 vectors induces progressive nigrostriatal degeneration and increases vulnerability to MPTP in mouse. PLoS One. 10 (6), 0131281(2015).
- Theodore, S., Cao, S., McLean, P. J., Standaert, D. G. Targeted overexpression of human alpha-synuclein triggers microglial activation and an adaptive immune response in a mouse model of Parkinson disease. Journal of Neuropathology and Experimental Neurology. 67 (12), 1149-1158 (2008).
- Sanchez-Guajardo, V., Annibali, A., Jensen, P. H., Romero-Ramos, M. alpha-Synuclein vaccination prevents the accumulation of parkinson disease-like pathologic inclusions in striatum in association with regulatory T cell recruitment in a rat model. Journal of Neuropathology and Experimental Neurology. 72 (7), 624-645 (2013).
- Sanchez-Guajardo, V., Febbraro, F., Kirik, D., Romero-Ramos, M. Microglia acquire distinct activation profiles depending on the degree of alpha-synuclein neuropathology in a rAAV based model of Parkinson's disease. PLoS One. 5 (1), 8784(2010).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular Neurodegeneration. 8, 44(2013).
- Cho, C., et al. Evaluating analgesic efficacy and administration route following craniotomy in mice using the grimace scale. Scientific Reports. 9 (1), 359(2019).
- Flecknell, P. Laboratory Animal Anaesthesia. 3rd Ed. , ElsevierAcademic Press. Cambridge, MA. (2009).
- Bind, R. H., Minney, S. M., Rosenfeld, S., Hallock, R. M. The role of pheromonal responses in rodent behavior: Future directions for the development of laboratory protocols. Journal of the American Association for Laboratory Animal Science. 52 (2), 124-129 (2013).
- Paxinos, G., Franklin, K. B. J. The Mouse Brain in Stereotaxic Coordinates. , Academic Press. Cambridge, MA. (2001).
- Elgueta, D., et al. Dopamine receptor D3 expression is altered in CD4+ T-cells from Parkinson's disease patients and its pharmacologic inhibition attenuates the motor impairment in a mouse model. Frontiers in Immunology. 10, 981(2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Fernandez-Suarez, D., et al. The monoacylglycerol lipase inhibitor JZL184 is neuroprotective and alters glial cell phenotype in the chronic MPTP mouse model. Neurobiology of Aging. 35 (11), 2603-2616 (2014).
- Elgueta, D., et al. Pharmacologic antagonism of dopamine receptor D3 attenuates neurodegeneration and motor impairment in a mouse model of Parkinson's disease. Neuropharmacology. 113, 110-123 (2017).
- Montoya, A., et al. Dopamine receptor D3 signalling in astrocytes promotes neuroinflammation. Journal of Neuroinflammation. 16 (1), 258(2019).
- Williams, G. P., et al. Targeting of the class II transactivator attenuates inflammation and neurodegeneration in an alpha-synuclein model of Parkinson's disease. Journal of Neuroinflammation. 15 (1), 244(2018).
- Benskey, M. J., et al. Silencing alpha synuclein in mature nigral neurons results in rapid neuroinflammation and subsequent toxicity. Frontiers in Molecular Neuroscience. 11, 36(2018).
- Rieker, C., et al. Neuropathology in mice expressing mouse alpha-synuclein. PLoS One. 6 (9), 24834(2011).
- Harms, A. S., et al. alpha-Synuclein fibrils recruit peripheral immune cells in the rat brain prior to neurodegeneration. Acta Neuropathologica Communications. 5 (1), 85(2017).
- Williams, G. P., et al. CD4 T cells mediate brain inflammation and neurodegeneration in a mouse model of Parkinson disease. Brain. 144 (7), 2047-2059 (2021).
- Matheoud, D., et al. Intestinal infection triggers Parkinson's disease-like symptoms in Pink1(-/-) mice. Nature. 571 (7766), 565-569 (2019).
- Jan, A., Goncalves, N. P., Vaegter, C. B., Jensen, P. H., Ferreira, N. The prion-like spreading of alpha-synuclein in Parkinson's disease: Update on models and hypotheses. International Journal of Molecular Sciences. 22 (15), 8338(2021).
- Chesselet, M. F., et al. A progressive mouse model of Parkinson's disease: The Thy1-aSyn ("Line 61") mice. Neurotherapeutics. 9 (2), 297-314 (2012).
- Sampson, T. R., et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease. Cell. 167 (6), 1469-1480 (2016).
- Ciron, C., et al. Human alpha-iduronidase gene transfer mediated by adeno-associated virus types 1, 2, and 5 in the brain of nonhuman primates: Vector diffusion and biodistribution. Human Gene Therapy. 20 (4), 350-360 (2009).
- Ben-Shaanan, T. L., et al. Activation of the reward system boosts innate and adaptive immunity. Nature Medicine. 22 (8), 940-944 (2016).
- Albert, K., Voutilainen, M. H., Domanskyi, A., Airavaara, M. AAV vector-mediated gene delivery to substantia nigra dopamine neurons: Implications for gene therapy and disease models. Genes. 8 (2), 63(2017).
- Bordia, T., Perez, X. A., Heiss, J., Zhang, D., Quik, M. Optogenetic activation of striatal cholinergic interneurons regulates L-dopa-induced dyskinesias. Neurobiology of Disease. 91, 47-58 (2016).
- Kim, A., et al. Upgraded methodology for the development of early diagnosis of Parkinson's disease based on searching blood markers in patients and experimental models. Molecular Neurobiology. 56 (5), 3437-3450 (2018).
- Lei, H., et al. Parkinson's disease diagnosis via joint learning from multiple modalities and relations. IEEE Journal of Biomedical and Health Informatics. 23 (4), 1437-1449 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten