Method Article
طريقة تروية عبر القلب تتغذى على الجاذبية للتحليل النسيجي للجهاز العصبي المركزي للفأر
In This Article
Summary
يتم تقديم طريقة تروية مريحة تتغذى على الجاذبية للتحليل النسيجي للجهاز العصبي المركزي للفأر. يظهر الكشف عن الفلورسنت المناعي α-سينوكلين المفسفرة في نموذج فأر لمرض باركنسون. يصف هذا العمل أيضا بشكل شامل التروية عبر القلب ، والتشريح ، وتجميد / تضمين الأنسجة ، وخطوات التقسيم المجمدة.
Abstract
التحليل النسيجي لعينات الدماغ والحبل الشوكي المعزولة من الفئران هو ممارسة شائعة لتقييم علم الأمراض في هذا النظام النموذجي. للحفاظ على مورفولوجيا هذه الأنسجة الحساسة ، من الروتيني إعطاء مثبت كيميائي مثل بارافورمالديهايد عن طريق تعليب القلب في الحيوانات المخدرة (التروية عبر القلب). يعتمد التروية عبر القلب لقلب الفأر تقليديا على استخدام المضخات التمعجية أو ضغط الهواء لتقديم كل من المحاليل المالحة والمثبتة اللازمة لهذه العملية. كبديل يسهل الوصول إليه لهذه الطرق ، يوضح هذا العمل استخدام طريقة تغذية الجاذبية لتوصيل العطريات التي تستخدم المواد المتاحة في معظم متاجر الأجهزة.
للتحقق من صحة طريقة التروية الجديدة هذه ، يوضح هذا العمل جميع الخطوات اللاحقة اللازمة للكشف الحساس عن α-سينوكلين المفسفرة في كل من الدماغ والحبل الشوكي. وتشمل هذه الخطوات تشريح أنسجة الدماغ والحبل الشوكي الثابتة، والتجميد السريع / التضمين والتقسيم بالتبريد للأنسجة، وتلطيخ الفلورسنت المناعي. نظرا لأن هذه الطريقة تؤدي إلى توصيل المثبت للجسم بالكامل ، فقد يتم استخدامه أيضا لإعداد أنسجة غير عصبية أخرى للتحليل النسيجي.
Introduction
التوصيف النسيجي لعلم الأمراض في الجهاز العصبي المركزي للفأر (CNS) هو تقنية روتينية تستخدم في دراسات التنكس العصبي. نظرا لأن الأنسجة العصبية تتحلل بسرعة بعد الوفاة ، فمن الشائع توصيل مثبت كيميائي مثل paraformaldehyde إلى أنسجة الجهاز العصبي المركزي للحفاظ على مورفولوجيتها 1,2. يمكن إجراء التثبيت الكيميائي إما من خلال تروية الجسم بالكامل بمحلول مثبت أو من خلال عزل الأنسجة وغمرها في محلول مثبت (يسمى "تثبيت السقوط"). التروية هي الطريقة المفضلة للتسليم المثبت ، حيث أن تثبيت الإسقاط قد لا يسمح بالاختراق السريع للمحلول المثبت في هياكل الجهاز العصبي المركزي العميقة3،4،5. علاوة على ذلك ، نظرا لأنه من الصعب إزالة الحبل الشوكي غير الثابت من العمود الفقري ، فإن توصيل المحلول المثبت عن طريق التروية يسمح بالحفاظ في الموقع على التشريح المجهري والإجمالي للحبل الشوكي ويقوي الأنسجة لتقليل الضرر أثناء الإزالة.
عادة ما يتم تسليم الحلول العازلة والمثبتة اللازمة للتثبيت باستخدام المضخات المتاحة تجاريا أو ضغط الهواء. قد يكون توصيل الجاذبية للعطر بمثابة بديل لتوصيل المضخة للأسباب التالية: (1) قد يتطلب توصيل المضخة أو ضغط الهواء في بعض الحالات من المستخدم الحفاظ على الضغط يدويا في النظام طوال فترة التروية. يمكن الحفاظ على تسليم الجاذبية للفطريات دون تدخل المستخدم. (2) يمكن بناء جهاز معطر يتم تسليمه بواسطة الجاذبية بتكلفة منخفضة للمستخدم من خلال الحصول على المواد المتاحة من البائعين العلميين القياسيين. يصف هذا العمل كيفية بناء جهاز تروية جاذبية بسيط باستخدام زجاجات الغسيل وأنابيب الفينيل. باستخدام نموذج فأر لمرض باركنسون ، يوضح هذا العمل فعالية هذا النظام في اختراق أنسجة الدماغ والحبل الشوكي قبل عزلها للتقسيم المجمد. يصف هذا العمل بشكل شامل جميع الخطوات والتقنيات والمواد اللازمة لتشريح الأنسجة الثابتة من الحيوان ، وتجميد / تضمين الأنسجة وتقطيعها بالتبريد بسرعة ، والكشف عن وجود α-سينوكلين مفسفرة في كل من الدماغ والحبل الشوكي عبر المجهر المناعي غير المباشر.
Protocol
تم إنشاء البيانات والخطوات التجريبية المقدمة في هذا البروتوكول باستخدام الفئران C57BL/6J. تمت الموافقة على جميع الطرق التي تنطوي على الحيوانات من قبل جامعة ولاية نيويورك الطبية جامعة ولاية شمال الولاية المؤسسية رعاية الحيوانات واستخدامها.
1. بناء جهاز التروية ومنصة التشريح
- كما هو موضح في الشكل 1 ، قم بقص القش الداخلي من زجاجتي غسيل سعة 500 مل عن طريق قطع هذه الحشوات إلى الجانب الداخلي من الغطاء اللولبي باستخدام شفرة حلاقة حادة. قطع حفرة مربعة 4 سم × 4 سم في الجزء السفلي من كل زجاجة عازلة. اقطع ثقبا صغيرا في الجزء السفلي من كل زجاجة للسماح بمرور ملعقة صغيرة منحنية من الفولاذ المقاوم للصدأ.
- قم بإنشاء منحنى على شكل حرف "S" في الملاعق الدقيقة بحيث يمكن استخدامها كخطافات لتعليق زجاجات التخزين المؤقت. أدخل الملاعق الدقيقة المنحنية في الفتحات المناسبة في زجاجات التخزين المؤقت.
- اقطع أنبوبين بطول 25 سم وقم بتوصيلهما بإحكام بمنافذ قش الزجاجة الخارجية. انضم إلى نهايات هذه الأنابيب مع موصل Y. قطع 2 متر من الأنابيب وانضم إلى هذا إلى النهاية الحرة لموصل Y.
- قم بإزالة المكبس من المحقنة سعة 1 مل واقطع المحقنة على بعد حوالي 6 سم من طرف المحقنة. قطع المحقنة عن طريق تسجيل البلاستيك أولا بشفرة حلاقة ثم التقاط البلاستيك حقنة بحدة.
- أدخل الوجه المقطوع للمحقنة في الطرف الحر للأنبوب البلاستيكي. أدخل إلى عمق كاف لضمان ختم محكم.
ملاحظة: من المهم أن تكون جميع الوصلات داخل جهاز التروية ضيقة بما فيه الكفاية لتجنب التسرب. في حالة الوصلات الفضفاضة ، يمكن وضع مشابك خرطوم صغيرة من الفولاذ المقاوم للصدأ وشدها عند التقاطعات حسب الرغبة لضمان ختم محكم إذا لزم الأمر. - قم بتسمية زجاجة عازلة واحدة على أنها PFA وزجاجة واحدة على أنها PBS (مخزن مؤقت). قم بقياس حوالي 1/3من الطول بعيدا عن فتحة الزجاجة وارسم خطا حول محيط الزجاجة عند هذه النقطة للدلالة على مستوى التعبئة المناسب لمحاليل العطر.
- قم بتصويب ثم إنشاء حلقة في مشبك ورق كبير يمكن أن يتناسب مع محيط الأنابيب. ضع هذه الحلقة حول الأنابيب القريبة من المحقنة.
- ضع كتلة من الستايروفوم بحجم مناسب في الدرج الزجاجي. ضع نهايات مشبك الورق في كتلة الستايروفوم لتثبيت الأنابيب.
- باستخدام المناشف الورقية ، ارفع الطرف الأمامي للدرج الزجاجي بمقدار 2 سم تقريبا.
ملاحظة: سيؤدي ذلك إلى وضع الماوس في حوالي 20 درجة من موضع Trendelenburg (الإمالة للخلف) للسماح بتصور أسهل للحجاب الحاجز أثناء التشريح وتشجيع تصريف السوائل أثناء التروية.
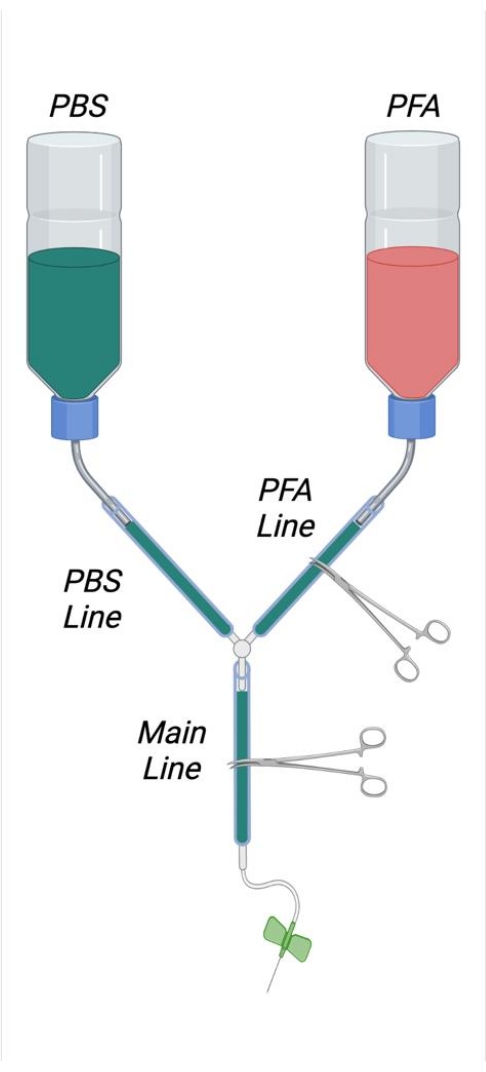
الشكل 1: رسم بياني يصور جهاز التروية المجمع. الاختصارات: PBS = محلول ملحي مخزن بالفوسفات. PFA = بارافورمالديهايد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تحضير محلول بارافورمالديهايد (PFA)
ملاحظة: يجب تحضير محلول PFA طازجا في يوم التروية والتخلص منه في نهاية التروية في حاوية نفايات معينة قبل التخلص منها من قبل موظفين مدربين. يصنع هذا البروتوكول 1 لتر من محلول PFA بنسبة 4٪ ، وهو ما يكفي لاستيعاب ما يقرب من 4 فئران. PFA شديد السمية ، ويجب توخي الحذر لتجنب الاستنشاق أو ملامسة الجلد المباشر إما في شكل مسحوق أو سائل. لذلك يتم تنفيذ معظم خطوات التحضير أثناء ارتداء القفازات والنظارات الواقية ومعطف المختبر تحت غطاء الدخان.
- اشطف دورقا سعة 1 لتر باستخدام الماء المقطر واملأه بحوالي 800 مل من 18 mΩ من الدرجة الجزيئية البيولوجية H2O.
- سخني كوب H2O في الميكروويف لمدة 3 دقائق أو حتى تصل درجة حرارة الماء إلى 65 درجة مئوية. ضعيه على طبق تدفئة/تحريك محفوظ في غطاء الدخان.
- شطف قضيب التحريك بالماء المقطر ووضعه في الماء الساخن. ابدأ تشغيل التحريك واقلب الصفيحة الساخنة حتى درجة حرارة متوسطة. تأكد من أن درجة حرارة الماء لا تتجاوز 70 درجة مئوية.
- ارتد قناعا جراحيا وقفازات ونظارات واقية ومعطفا مختبريا وقاس 40 جم من مسحوق PFA. صب هذا المسحوق في الماء الساخن.
- باستخدام ماصة نقل ، أضف بضع قطرات من 5 M NaOH إلى المحلول. اترك مسحوق PFA يذوب بالكامل. إذا لم يذوب المسحوق بالكامل بعد بضع دقائق ، أضف قطرات من 5 M NaOH حسب الحاجة.
- بمجرد أن يذوب كل PFA تقريبا (سيظهر عكرا قليلا) ، أوقف التحريك / التسخين وأضف على الفور 100 مل من محلول ملحي مخزن بالفوسفات 10x (PBS). أخيرا ، قم بتعبئة الماء إلى علامة 1 لتر على الكأس باستخدام 18 mΩ الجزيئي البيولوجيا - الصف H2O. قم بتغطية الكأس بغلاف بلاستيكي وضعه في ثلاجة -20 درجة مئوية حتى يصل المحلول إلى درجة حرارة الغرفة (حوالي 45 دقيقة).
- معايرة مقياس الأس الهيدروجيني باستخدام المعايير المناسبة. بينما يكون الكوب على صفيحة تحريك ، قم بقياس الرقم الهيدروجيني للمحلول وأضف HCl حتى يصل الرقم الهيدروجيني إلى 7.4. إذا لزم الأمر ، أضف 5 M NaOH لزيادة الرقم الهيدروجيني إذا كان منخفضا جدا.
- قم بتوصيل قارورة فراغ بالمكنسة الكهربائية ووضع قمع Büchner الخزفي النظيف مع ورق الترشيح في القارورة. قم بتشغيل الفراغ وبلل ورق الترشيح باستخدام ماصة نقل مملوءة بمحلول PFA بنسبة 4٪.
- صب محلول PFA بنسبة 4٪ ببطء على ورق الترشيح حتى يتم تصفية كل المحلول.
- انقل المحلول المصفى إلى حاوية نظيفة ومحمية من الضوء وقم بتخزينه على درجة حرارة 4 درجات مئوية حتى الاستخدام (لا يخزن لمدة تزيد عن 24 ساعة).
3. التروية "خالية من المضخة" عبر القلب
- في غطاء الدخان ، ضع كتلة تشريح الستايروفوم في صينية زجاجية. تأكد من أن كتلة التشريح تحتوي على 5-6 إبر قصيرة لتقييد الماوس أثناء الجراحة و 2 إبر طويلة لدعم أنابيب التروية.
- شطف جهاز التروية باستخدام الماء المقطر. اترك كل الماء يستنزف قبل تعليق جهاز التروية. شنق زجاجات التروية على ارتفاع 1 متر فوق الحيوان المنصهر (لفأر 20-30 جم).
- قم بإعداد محلول غير معقم من 1x PBS باستخدام 10x PBS مخفف ب 18 mΩ من الدرجة الجزيئية H2O.
- كما هو موضح في الشكل 2 ، قم بتثبيت الخط الرئيسي لجهاز التروية باستخدام مرقئ. مشبك خط PFA مع مرقئ آخر.
ملاحظة: قد يكون الانسداد باستخدام مرقئ متعدد ضروريا لكل سطر لمنع التدفق تماما. - املأ الحاوية العازلة ب 1x PBS في درجة حرارة الغرفة.
- ضع نهاية المحقنة لجهاز التروية في كوب لجمع المخزن المؤقت للنفايات وإزالة المرقئ الذي يسد الخط الرئيسي (الشكل 2 ، اليسار).
- اسمح ل PBS بالتدفق عبر الخط أثناء إزالة الهواء المحبوس عن طريق النقر بقوة على جدران الأنبوب.
- بمجرد إزالة كل الهواء من المخزن المؤقت والخطوط الرئيسية ، قم بحجب التدفق عن طريق وضع مرقئ على الخط الرئيسي.
- قم بإزالة المرقأة من خط PFA واسمح ل PBS بالتدفق بطريقة رجعية تصل إلى زجاجة PFA أثناء النقر على أي فقاعات في خط PFA (الشكل 2 ، الوسط). استمر في السماح ل PBS بالدخول إلى خط PFA حتى يمكن رؤية PBS فوق فتحة الزجاجة مباشرة. قم بسد خط PFA باستخدام مرقئ لوقف التدفق إلى زجاجة PFA.
- قم بتوصيل إبرة تسريب الفراشة بحقنة التروية وتدفق PBS عبر الخط (عن طريق فتح مرقئ الخط الرئيسي) لإزالة الفقاعات من حقنة التروية. أغلق مرقئ الخط الرئيسي.
- تأكد من أن زجاجة PBS هي الآن حوالي 1/3الثالثة مليئة ب PBS. إذا لزم الأمر ، اغسل PBS عبر الخط الرئيسي أو املأ المزيد من PBS في زجاجة التخزين المؤقت حتى 1/3من سعتها الكاملة.
- بمجرد إزالة جميع الفقاعات من PBS و PFA والخطوط الرئيسية ، املأ زجاجة PFA بمحلول PFA بنسبة 4٪ في درجة حرارة الغرفة حتى العلامة السوداء على الزجاجة (حوالي 1/3rd full) (الشكل 2 ، يمين).
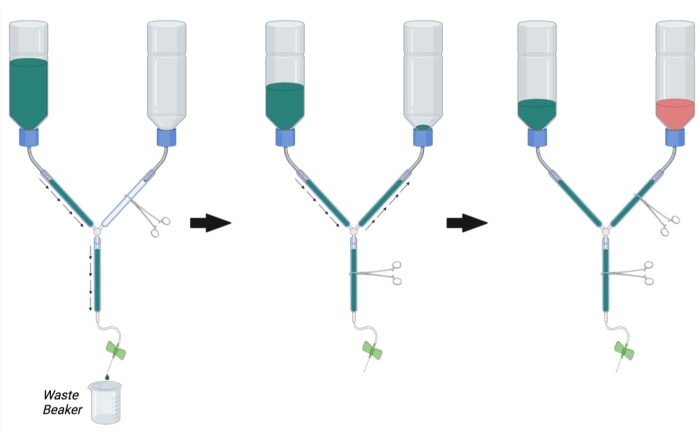
الشكل 2: إعداد جهاز التروية لجراحة التروية. أولا ، أغلق خط PFA hemostat وافتح hemostat على خط PBS والخط الرئيسي. املأ PBS وأزل الفقاعات من خط PBS والخط الرئيسي. بعد ذلك ، املأ خط PFA ب PBS عن طريق فتح المرقأة على خط PFA وإغلاق المرقأة على الخط الرئيسي. إزالة الفقاعات في خط PFA. أخيرا ، أغلق المرقأة على خط PFA عندما يصل PBS إلى فتحة زجاجة PFA. املأ زجاجة PFA 1/3rd المليئة ب PFA. تأكد من أن مستوى PBS في زجاجة PBS هو 1/3rd ممتلئ وإما ملء PBS أو استنزاف PBS عن طريق فتح خط hemostat الرئيسي إذا لزم الأمر. الاختصارات: PBS = محلول ملحي مخزن بالفوسفات. PFA = بارافورمالديهايد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- استعد لجراحة عدم البقاء على قيد الحياة عن طريق تنظيف الأدوات التالية بالماء متبوعا بالإيثانول بنسبة 70٪: مقص كبير ، مقص تشريح دقيق ، ملقط جلدي ، ملقط منحني ناعم.
- تحضير التخدير عن طريق وضع مناديل خالية من الغبار في أنبوب مخروطي 50 مل. في غطاء الدخان ، انقع المناديل الخالية من الغبار جيدا باستخدام الأيزوفلوران وضع الأنبوب المفتوح رأسا على عقب في كوب سعة 500 مل. تأكد من عدم وجود أيسوفلوران سائل في الجزء السفلي من الكأس وتخلص من أي إيسوفلوران سائل قبل وضع الماوس في الدورق.
- ضع الماوس في الكأس وضع غلاف بلاستيكي فوق الفتحة لبدء التخدير.
- قم بالتخدير حتى يتوقف الماوس عن التنفس (حوالي 1 دقيقة و 30 ثانية).
- عندما يتوقف التنفس ، قم بإزالة الماوس على الفور من الكأس واستبدل الغطاء الموجود على الأنبوب المخروطي سعة 50 مل.
- تحقق من أن الماوس مخدر بما فيه الكفاية باستخدام منعكس قرصة إصبع القدم. إذا لم يتم تخدير الحيوان بشكل كاف ، فقم بإدارة المزيد من الأيزوفلوران كما هو موضح في الخطوة 3.15.
- العمل بسرعة ، ضع الماوس على كتلة الستايروفوم وقم بتثبيت الكفوف للخارج باستخدام أربع إبر قصيرة (على سبيل المثال ، إبر حقنة 22 جم).
- رفع جلد البطن باستخدام ملقط الجلد ، استخدم المقص الكبير لقطع جدار البطن. تأكد من عدم قطع أعضاء البطن!
- استمر في قطع البطن بشكل متفوق نحو الكبد. افصل الكبد عن جدار البطن الأمامي واستمر في الشق الأولي بشكل متفوق نحو الحجاب الحاجز. أوقف هذا الشق حوالي 1 سم أقل شأنا من الحجاب الحاجز. احرص على التأكد من عدم قطع الكبد!
- استمر في الشق الأولي أفقيا نحو الجانبين الأيمن والأيسر من الحجاب الحاجز لإجراء شق على شكل حرف "Y" (الشكل 3A).
- عندما يصل الشق إلى الحجاب الحاجز ، قم بعمل ثقب في الحجاب الحاجز باستخدام مقص التشريح الدقيق وقطع الأضلاع على الجانب الأيمن للحيوان. قطع الأضلاع في منتصف الطريق تقريبا إلى الإبطين الأيمن.
- قم بعمل شق مماثل ولكن أطول من خلال الجانب الأيسر من الحجاب الحاجز تقريبا على طول الطريق إلى الإبطين الأيسر.
- اعكس جدار الصدر وقم بتثبيته على كتلة الستايروفوم.
- إذا لزم الأمر ، قم بتشريح الدهون من جميع أنحاء القلب لفضح البطين الأيسر. تحديد البطين الأيسر بناء على اللون الفاتح نسبيا بالمقارنة مع البطين الأيمن.
- بعد تحديد البطين الأيسر، حافظ على ثبات القلب باستخدام الضغط الخفيف باستخدام الملقط المنحني الدقيق. افتح مرقئ الخط الرئيسي للسماح ل PBS بالتدفق عبر الإبرة. اخترق البطين الأيسر على الفور وتأكد من إدخال الإبرة بما لا يزيد عن 0.5 سم في البطين. اسحب الإبرة قليلا إذا لزم الأمر.
ملاحظة: يشار إلى الوضع الدقيق للإبرة في البطين الأيسر عن طريق التدفق الرجعي للدم إلى أنبوب الإبرة. من المهم التأكد من عدم إدخال الإبرة بعمق في البطين. هذا يمكن أن يؤدي إلى تدفق رجعي عبر الأوردة الرئوية أو ثقب الحاجز بين البطينين. - ضع أنبوب الفراشة على X مصنوع في الستايروفوم باستخدام إبرتين كبيرتين بوزن 18 جم.
ملاحظة: هذا أمر بالغ الأهمية لأنه سيتجنب حركة إبرة الفراشة داخل القلب أثناء التروية. - تحديد الوريد الأجوف السفلي عند خروجه من الكبد ونقله باستخدام مقص التشريح الدقيق (الشكل 3B). بدلا من ذلك ، افتح الأذين الأيمن بالمقص.
- افتح الخط الرئيسي على الفور للسماح ببدء تروية PBS (الشكل 3C).
- تأكد من أن PBS يستنزف كتلة الستايروفوم وفي الدرج الزجاجي أدناه. إذا لم يحدث هذا ، فأعد ضبط زاوية الدرج أو كتلة Styrofoak للسماح بتصريف السوائل في الدرج الزجاجي.
- استمر في تروية PBS حتى يصبح السائل المتدفق من الوريد الأجوف السفلي خاليا من الدم (حوالي 3 دقائق).
ملاحظة: سيؤدي الوضع السليم للإبرة في القلب إلى التطهير البصري للدم من الكبد ، والذي سيتحول من اللون الأحمر إلى لون القش. إذا لم يحدث هذا ، فقد يتم علاجه عن طريق إعادة وضع إبرة التسريب داخل البطين الأيسر. يمكن إجراء شق صغير في قاعدة الذيل البطني لتقييم جودة التروية. سيؤدي التروية المناسبة إلى تدفق PBS واضح من شق قاعدة الذيل. - العمل بسرعة ، قم بإغلاق خط PBS باستخدام مرقئ وافتح خط PFA.
- اسمح ل PFA بالنفاذ لبضع دقائق حتى يبدأ الذيل في التجعد. بمجرد أن يبدأ الذيل في التجعد ، ابدأ مؤقت مدته 50 دقيقة. إذا لم يتجعد الذيل بعد 5 دقائق من تروية PFA ، فابدأ مؤقت لمدة 50 دقيقة لتروية PFA.
- راقب مستوى PFA في الزجاجة باستمرار طوال فترة التروية لضمان عدم انخفاض المستوى كثيرا. املأ المزيد من PFA في الزجاجة إذا انخفض المستوى إلى أقل من 2 سم فوق غطاء الزجاجة.
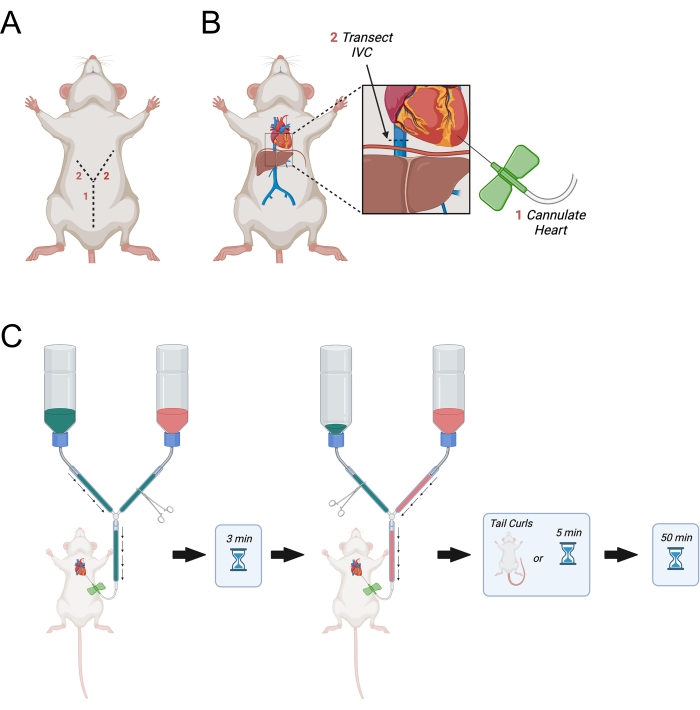
الشكل 3: رسم بياني يصور التروية عبر القلب. (أ) يتم قطع جدار البطن أولا ، يليه شقان موجهان جانبيا نحو الإبطين يشكلان "Y". (ب) بعد دخول التجويف الصدري وكشف القلب ، يتم تمرير الإبرة إلى البطين الأيسر. بعد ذلك ، يتم نقل IVC أو الأذين الأيمن للسماح بتصريف العطور بعد أن يتم تداولها عبر الجسم. يتم قطع IVC متفوقة على الحجاب الحاجز. (ج) إجراءات إدارة العطور. اختصار = IVC = الوريد الأجوف السفلي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- بعد مرور 50 دقيقة ، قم بسد الخط الرئيسي باستخدام مرقئ وسحب الإبرة من البطين الأيسر.
ملاحظة: الماوس بأكمله صلب في هذه المرحلة ويمكن الآن وضعه في حاوية تحمل علامة 4٪ PFA بين عشية وضحاها عند 4 درجات مئوية. في هذه المرحلة ، من الممكن تشريح أنسجة الجهاز العصبي المركزي ووضعها بشكل فردي في تثبيت بين عشية وضحاها. في هذا العمل ، يتم وضع الماوس بأكمله في التثبيت لأن هذا يقصر الفاصل الزمني بين التثبيت والموضع عند 4 درجات مئوية. هذا أيضا يتجنب أي تشويه ميكانيكي محتمل للأنسجة العصبية التي قد تحدث إذا تم تشريح الحيوانات مسبقا قبل اكتمال التثبيت بين عشية وضحاها.
4. تشريح الجهاز العصبي المركزي
- قم بإعداد الأدوات التالية للتشريح عن طريق الغسيل بالماء متبوعا بنسبة 70٪ من الإيثانول: مقص ، ملقط جلدي ، ملقط منحني ، ملقط ناعم منحني ، ملقط ناعم مستقيم ، مقص ناعم.
- قم بتسمية أربعة أنابيب لكل فأر على النحو التالي واملأها بسكروز معقم بنسبة 20٪: معرف الماوس ، الدماغ 1 ، معرف الماوس ، الدماغ 2 ، معرف الماوس ، أسفل الظهر ، معرف الماوس ، عنق الرحم.
- قم بإزالة الماوس من محلول PFA وجففه بمنشفة ورقية لإزالة PFA الزائد.
- باستخدام المقص الكبير ، قم بإزالة رأس الماوس عن طريق القطع عند الرقبة.
- ضع الجسم في محلول PFA. احتفظ بالرأس لتشريح الدماغ من الجمجمة.
- لتشريح الدماغ ، ابدأ بعكس جلد الجمجمة إلى الأمام لفضح الجمجمة بأكملها (الشكل 4A).
- قم بعمل قطع ضحل في القناة السمعية باستخدام مقص تشريح دقيق للدخول إلى الجمجمة
- استمر في هذا القطع على طول الجيوب الأنفية المستعرضة حتى يتم قطع الجمجمة على طول الطريق بين كلتا القناتين السمعيتين.
- قم بعمل قطع عمودي على القطع السابق على طول الشق الطولي على طول الطريق إلى الجزء الأكثر سطوحا من الجمجمة (تقريبا بين العينين).
- باستخدام الملقط المنحني المبطن ، عكس الجمجمة أفقيا لفضح الدماغ الأمامي. استمر في إزالة الجمجمة حتى يتعرض الدماغ الأمامي بأكمله ، بما في ذلك المصابيح الشمية.
- ابدأ في تشريح المنطقة الذيلية من الجمجمة عن طريق إجراء قطع من خلال العظم القذالي ومواصلة هذا القطع ببطء نحو الثقبة العظمية.
- تعكس قطعتي الجمجمة أفقيا لفضح المخيخ وجذع الدماغ بشكل سببي (الشكل 4B).
- استخدم الملقط المنحني متناهي الصغر لفصل المصابيح الشمية عن الجمجمة الأمامية والبدء في تقشير الدماغ بعيدا عن قاعدة الجمجمة بدءا من المصابيح الشمية.
- عندما يتم تقشير الدماغ بعيدا عن قاعدة الجمجمة ، استخدم ملقطا متناهيا جدا لقطع الأعصاب القحفية والسماح بإزالة الدماغ.
- استمر في تقشير الدماغ من قاعدة الجمجمة حتى تتم إزالة الدماغ السليم بالكامل (الشكل 4C ، D).
- قطع الدماغ إلى نصفين على طول الشق الطولي لفصل نصفي الكرة الأيمن والأيسر عن بعضهما البعض (الشكل 4E ، F).
- ضع نصف الكرة الأرضية في أنبوب الدماغ 1 ونصف الكرة الثاني في أنبوب الدماغ 2 . تخزين هذه الأنابيب في 4 درجة مئوية حتى تغرق نصفي الكرة المخية (بين عشية وضحاها تقريبا).
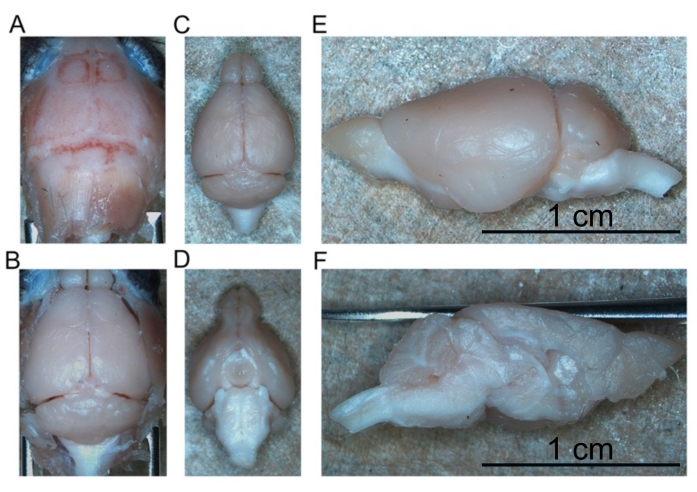
الشكل 4: إزالة الدماغ الثابت . (أ) أعلى الجمجمة. (ب) الدماغ المكشوف داخل الجمجمة. (ج) الدماغ المعزول (الجانب الظهري). (د) الدماغ المعزول (الجانب البطني). (هاء) نصف الكرة الأيسر (الجانب الجانبي). (و) نصف الكرة الأيسر (الجانب الإنسي). أشرطة المقياس = 1 سم (E و F). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- لتشريح الحبل الشوكي ، قم بإزالة جسم الماوس من PFA ولطخه جافا.
- ضع الماوس على كتلة تشريح الستايروفوم في وضع الانبطاح وقم بتثبيت الكفوف في الكتلة باستخدام أربع إبر.
- ابدأ التشريح عن طريق قطع الجلد أسفل خط الوسط للماوس من الرقبة إلى الذيل لفضح الجانب الخلفي بأكمله.
- تعكس العضلات واللفافة على الظهر لفضح الجزء الخلفي من العمود الفقري.
- بدءا من معظم فقرات الجمجمة ، استخدم مقص التشريح الدقيق لقطع الصفيحة مع تجنب الحبل الشوكي (الشكل 5A).
- ضع الملقط المنحني متناهي الصغر تحت الصفيحة واسحبه لأعلى لكسر الفقرات لفضح الحبل الشوكي (الشكل 5B).
- استخدم الملقط المنحني ليعكس الفقرات المكسورة ويكشف عن المناطق الجانبية من الحبل الشوكي.
- استمر في هذه العملية للفقرات التالية عن طريق وضع الملقط المنحني متناهي الصغر أسفل الصفيحة وكسر الفقرات. استمر في كسر الفقرات حتى يتعرض العمود الفقري العنقي والعمود الفقري الصدري بالكامل (الشكل 5C).
- استمر في كشف الحبل الشوكي حتى نهاية الحبل الشوكي القطني (الشكل 5D).
- باستخدام شفرة حلاقة حادة ، قطع على طول الطريق من خلال الحبل الشوكي في منتصف الصدري.
- باستخدام الملقط المنحني متناهي الصغر، قم بنقل الأعصاب الشوكية أفقيا من العمود الفقري واللفافة الأمامية إلى الحبل الشوكي لفصل الحبل الشوكي العنقي ببطء عن العمود الفقري.
- استمر في تشريح الحبل الشوكي العنقي حتى يصبح خاليا من الفقرات (الشكل 5E). ضع الحبل الشوكي العنقي المتوسط الصدر في الأنبوب المسمى عنق الرحم. قم بتخزين هذا الأنبوب عند 4 درجات مئوية حتى يغرق الحبل الشوكي العنقي (بين عشية وضحاها تقريبا).
- استمر في كسر الفقرات الصدرية على طول الطريق إلى ذيل الفرس كما هو مفصل في الخطوات من 4.22 إلى 4.25. عندما تتعرض ذيل الفرس، استخدم شفرة حلاقة حادة لقطع الحبل الشوكي 1 سم أسفل الحبل الشوكي القطني (الشكل 5F).
- تشريح الحبل الشوكي القطني بعيدا عن الفقرات كما هو موضح في الخطوات 4.26-4.27. ضع الحبل الشوكي القطني القطني في منتصف الذيل في الأنبوب المسمى أسفل الظهر. قم بتخزين هذا الأنبوب عند 4 درجات مئوية حتى يغرق الحبل الشوكي القطني (بين عشية وضحاها تقريبا).
- عندما تغرق جميع الأنسجة في 20٪ من السكروز ، انقلها إلى أنابيب ملصقة من 30٪ من السكروز حتى تغرق أو لمدة 3 أيام.
ملاحظة: غالبا ما لا تغرق أنسجة العمود الفقري بنسبة 30٪ من السكروز.
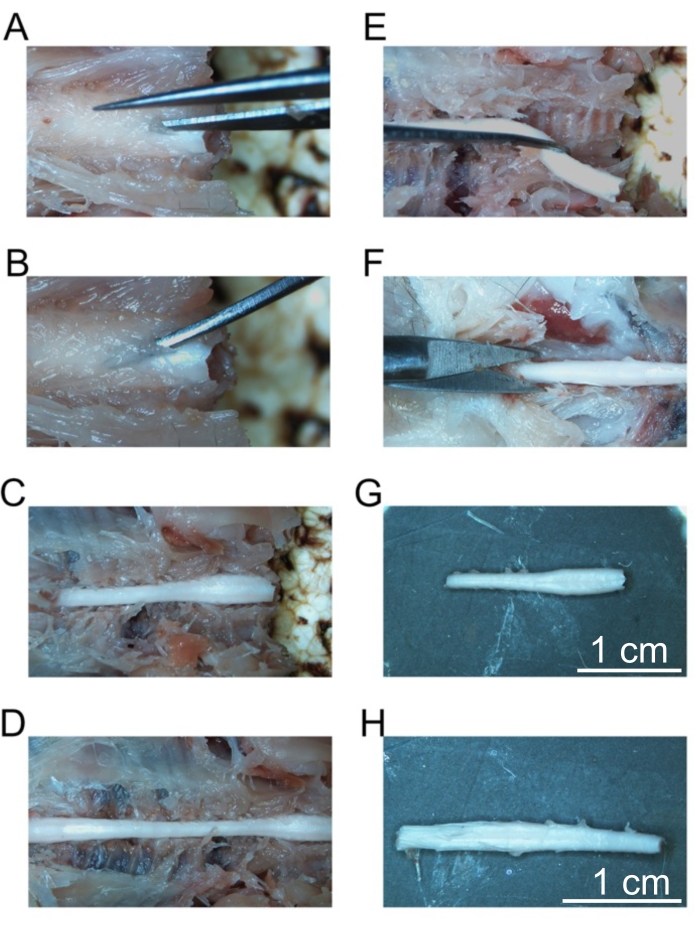
الشكل 5: إزالة أجزاء الحبل الشوكي الثابتة . (أ) قطع أولي في صفيحة الفقرات العنقية. (ب) وضع ملقط منحني لكسر الفقرات الفردية. (ج) العمود الفقري العنقي المكشوف. (د) العمود الفقري العنقي والصدري والقطني المكشوف. (ه) إزالة العمود الفقري العنقي بعد قطع الأعصاب الشوكية. (و) قطع العمود الفقري العجزي. (ز) العمود الفقري العنقي المعزول. (ح) العمود الفقري القطني المعزول. قضبان المقياس = 1 سم (G و H). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تضمين OCT وتخزين الأنسجة
- لكل ماوس، قم بتسمية أربعة قوالب تبريد مستطيلة الشكل: معرف الماوس، نصف الكرة الأيمن، تاريخ التضمين. معرف الماوس، نصف الكرة الأيسر، تاريخ التضمين؛ معرف الماوس ، عنق الرحم ، تاريخ التضمين ؛ معرف الماوس، أسفل الظهر، تاريخ التضمين.
- قم بإعداد حاوية الستايروفوم وقم بتعليق كوب معدني فوق الحاوية.
- املأ حاوية الستايروفوم بالنيتروجين السائل في منتصف الطريق تقريبا. املأ الكوب المعدني ب 2-methylbutane الطازج في منتصف الطريق تقريبا.
ملاحظة: 2-ميثيل بوتان سام وشديد التقلب وقابل للاشتعال. يجب توخي الحذر لتجنب الاستنشاق عن طريق تنفيذ خطوات لاحقة في غطاء الدخان وبعيدا عن مصادر الاحتراق. - اخفض الكوب المعدني ببطء إلى النيتروجين السائل وتجنب أي رش للنيتروجين السائل في الكوب المعدني.
- اسمح ل 2-methylbutane بالبدء في التجميد. أثناء تجميد 2-Methylbutane ، خذ الأنسجة المطلوبة من محلول السكروز بنسبة 30٪ وجففها على منديل خال من الغبار.
- ضع المنديل في بالتبريد مع توجيه منطقة السطح نحو الجزء العلوي (غير الموسوم) من القالب.
- اسكب درجة حرارة القطع المثلى (OCT) على الأنسجة الموجودة في قالب التبريد ، باستخدام ما يكفي فقط لتغطية الأنسجة بالكامل. تجنب استخدام OCT المفرط لأن هذا يمكن أن يسبب تشقق. إزالة أي فقاعات من OCT.
- عندما يغطي 2-methylbutane المجمد بالكامل السطح الداخلي للكوب المعدني ، اغمر cryomold بالكامل في المرحلة السائلة 2-methylbutane لمدة 12 ثانية. بعد 12 ثانية ، ضع المبرد لتصريفه في مربع رقائق الألومنيوم المسمى ولف قالب التبريد بأكمله. ضع المبرد الملفوف على الفور على الثلج الجاف وتجنب الذوبان. تأكد من أن OCT / cryomold المجمدة مغطاة دائما بالثلج الجاف.
- كرر الخطوات من 5.6 إلى 5.8 لكافة الأنسجة. ضع المنديل الخاص بفأر واحد في كيس بلاستيكي صغير مغلق ثم في حاوية محكمة الغلق وآمنة من التبريد. قم بتخزين هذه الحاوية في الفريزر العميق -80 درجة مئوية حتى يتم قطع الأقسام.
6. التقسيم بالتبريد
- قبل التقسيم بالتبريد، تأكد من ضبط درجة حرارة غرفة التبريد ورأس العينة على الإعدادات المناسبة.
ملاحظة: تستخدم درجة حرارة الغرفة -20 درجة مئوية ، ودرجة حرارة رأس العينة -20 درجة مئوية ، وسمك القسم 30 ميكرومتر لقطع أقسام الدماغ. لقطع أقسام الحبل الشوكي ، يتم استخدام درجة حرارة الغرفة -23 درجة مئوية ، ودرجة حرارة رأس العينة -30 درجة مئوية ، وسمك مقطع 30 ميكرومتر. من المهم ملاحظة أن إعدادات cryostat (خاصة درجة حرارة رأس العينة) ستحتاج إلى تعديل أثناء التقسيم لمعالجة مشاكل جودة الأنسجة. بشكل عام ، يتم خفض درجة حرارة رأس العينة لتصحيح تلطيخ الأنسجة. على العكس من ذلك ، يتم زيادة درجة حرارة رأس العينة لتصحيح تجعيد الأنسجة المفرط. - قم بإزالة كتلة OCT المطلوبة من الفريزر -80 درجة مئوية ووضع كتلة cryomold / OCT غير المغلفة في غرفة cryostat.
- اسمح لكتلة OCT بالتأقلم مع درجة حرارة الغرفة لمدة 30 دقيقة.
- نظف ظرفا بالإيثانول بنسبة 70٪ وامسحه جافا بمنديل خال من الغبار. ضع الظرف الذي تم تنظيفه في غرفة cryostat واصنع دائرة بحجم العملة المعدنية من OCT على الظرف. اترك OCT يتجمد (حوالي 1-2 دقيقة).
- عندما يتجمد OCT ، ضع نقطة بحجم حبة البازلاء من OCT الطازج على الظرف وضع كتلة OCT الأنسجة على الفور على الظرف. تأكد من أن الأنسجة عمودية تماما على الظرف قبل أن يتجمد OCT تماما.
ملاحظة: بشكل عام ، يتم وضع المنطقة الأكثر سطوحا من الدماغ نحو تشاك بحيث يبدأ التقسيم من النهاية الذيلية. بالنسبة للحبل الشوكي ، بشكل عام ، يتم وضع المنطقة الأكثر ذيلية على تشاك بحيث يبدأ التقسيم من نهاية السطح. - عندما تصلب OCT ، ضع المزيد من OCT حول قاعدة كتلة OCT لتكون بمثابة دعم هيكلي أثناء التقسيم. عندما يتصلب هذا الدعم قليلا ، ضع الظرف على رأس العينة واسمح لكتلة OCT بالوصول إلى درجة حرارة رأس العينة لمدة 30 دقيقة.
- ضع شفرة ميكروتوم في حامل الشفرة ونظف اللوحة المضادة للتدحرج. اضبط مسافة اللوحة المضادة للتدحرج للتأكد من أن الأنسجة تمر أسفل اللوحة مباشرة أثناء التقسيم. لمزيد من المعلومات حول تحديد الموضع الصحيح للوحة المضادة للتدحرج ، راجع دليل cryostat.
- بعد أن تتأقلم كتلة OCT مع درجة حرارة رأس العينة ، ابدأ في تقليم كتلة OCT حتى يتم الوصول إلى الأنسجة. عندما تكون الأنسجة مرئية ، قم بالتبديل من التشذيب إلى التقسيم وابدأ في قطع أقسام 30 ميكرومتر. حرك اللوحة المضادة للتدحرج جانبا ، وباستخدام شريحة المجهر ، التقط القسم.
- استمر في قص وجمع المقاطع حتى تكون راضية عن الموقع التشريحي للأقسام أو تم قطع جميع الأنسجة. ضع الشرائح لتجف في درجة حرارة الغرفة لمدة 1-3 أيام. بعد التجفيف ، ضع الشرائح في صندوق شرائح وضع هذا الصندوق في كيس بلاستيكي مغلق. قم بتسمية الحقيبة بمعرف الماوس ومعلومات الأنسجة قبل وضع الشرائح في الفريزر العميق -80 درجة مئوية.
7. تلطيخ الفلورسنت المناعي
- قم بإذابة الشرائح لمدة 1 ساعة في درجة حرارة الغرفة.
- ضع الشرائح في جرة انزلاق أفقية واغسل الأقسام 3 مرات في PBS لمدة 10 دقائق كل غسل في درجة حرارة الغرفة على شاكر.
- قم بإعداد المخزن المؤقت للحظر (2٪ BSA + 0.3٪ Triton-X-100 في 1x PBS). استخدم حوالي 1 مل لكل شريحة.
- قم بإنشاء غرفة رطبة عن طريق إضافة الماء إلى القاع. ضع الشرائح وجها لوجه أفقيا ولا تسمح لها بالجفاف. أضف 1 مل من المخزن المؤقت المانع إلى كل شريحة واحتضنها لمدة 1 ساعة على الأقل في درجة حرارة الغرفة.
- تحضير محلول الأجسام المضادة الأولية عن طريق تخفيف الجسم المضاد الأساسي في المخزن المؤقت للأجسام المضادة (0.7٪ BSA + 0.3٪ Triton-X-100 في 1x PBS).
ملاحظة: بالنسبة للجسم المضاد α-سينوكلين المفسفر، تم استخدام عامل تخفيف بنسبة 1:500. - أضف 200-300 ميكرولتر من محلول الأجسام المضادة الأساسي لكل شريحة. يغطى بغطاء لتفريق الجسم المضاد ويحضنه عند 4 درجات مئوية بين عشية وضحاها.
- في اليوم التالي ، قم بإزالة الشرائح من الغرفة الرطبة ووضعها في جرة كوبلن عمودية مملوءة ب 1x PBS للسماح للغطاء بالسقوط. افعل ذلك لكل شريحة على حدة واحرص على عدم إزعاج قسم الأنسجة عند إزالة الغطاء الزجاجي.
- ضع الشرائح في جرة انزلاق أفقية واغسل الأقسام 3 مرات في PBS لمدة 10 دقائق كل غسل في درجة حرارة الغرفة على شاكر.
ملاحظة: يجب تنفيذ جميع الخطوات اللاحقة مع إطفاء الأنوار لتجنب التبييض الضوئي للفلوروفور! - تحضير محلول الأجسام المضادة الثانوي عن طريق تخفيف الجسم المضاد الثانوي في المخزن المؤقت للأجسام المضادة.
ملاحظة: للكشف عن α-سينوكلين المفسفرة ، تم استخدام مضاد للأرانب الثانوية المترافقة مع Alexa 488 مع عامل تخفيف قدره 1: 500 في المخزن المؤقت للأجسام المضادة (0.7 ٪ BSA + 0.3 ٪ Triton-X-100 في 1x PBS). - ضع الشرائح أفقيا في الغرفة الرطبة وأضف 200-300 ميكرولتر من محلول الأجسام المضادة الثانوي لكل شريحة. يغطى بغطاء لتفريق الجسم المضاد. حضانة في درجة حرارة الغرفة لمدة 2 ساعة على الأقل.
- قم بإزالة الشرائح من الغرفة الرطبة وضعها في جرة كوبلن عمودية مملوءة ب 1x PBS للسماح للغطاء بالسقوط. افعل ذلك لكل شريحة على حدة واحرص على عدم إزعاج قسم الأنسجة عند إزالة الغطاء الزجاجي.
- ضع الشرائح في جرة انزلاق أفقية واغسل الأقسام 3 مرات في PBS لمدة 10 دقائق كل غسل في درجة حرارة الغرفة على شاكر.
- قم بتجفيف جانب الشرائح على منشفة وتخلص من PBS الزائد.
- أضف 3 قطرات من وسط التركيب إلى كل شريحة. أضف الغطاء وادفع الفقاعات برفق باستخدام زوج من الملقط عن طريق الضغط على الغطاء قبل التصوير بواسطة المجهر البؤري.
النتائج
يشار إلى التروية عالية الجودة من خلال عدم وجود دم في الكبد والحبل الشوكي وهياكل الجهاز العصبي المركزي العميقة (الشكل 4C والشكل 5G ، H). الدم المحتفظ به أسفل الأم الجافية (على سبيل المثال ، داخل الجيوب الأنفية الوريدية) أو بين الأم الجافية والجمجمة لم يكن مشكلة لأن هذا الدم ليس داخل حمة الدماغ. يقع الدم الظاهر في الشكل 4A بين الجمجمة والمادة الجافية ، وبالتالي فهو لا يمثل مشكلة أو يوحي بالتروية ذات النوعية الرديئة. الدماغ الطازج والحبل الشوكي ناعمان جدا ويتضرران بسهولة أثناء التعامل. الأنسجة الثابتة بشكل كاف ، بالمقارنة ، ثابتة. لتقييم جودة الأنسجة والحفاظ على مورفولوجيا الأنسجة بواسطة طريقة التروية هذه ، يوضح هذا العمل اكتشاف α-سينوكلين المفسفرة في الدماغ الأوسط والحبل الشوكي القطني لفأر يبلغ من العمر 15 شهرا وفأر يبلغ من العمر 7 أشهر يعبر عن A53T البشري α-synuclein (الشكل 6).
يتم تمثيل طفرة A53T بشكل مفرط في المرضى الذين يعانون من مرض باركنسون الصبغي الجسدي المهيمن (PD). علاوة على ذلك ، يمكن أن يلخص α-سينوكلين البشري مع طفرة A53T العديد من ميزات PD البشري عند التعبير عنها في الفئران 6,7. وقد تبين أن فسفرة α-سينوكلين في بقايا سيرين 129 في الجسم الحي وفي المختبر تحفز تجميع α-سينوكلين8. أجسام ليوي هي الاكتشاف النسيجي الكلاسيكي الموجود في المرضى الذين يعانون من PD أو Lewey Body Deentia9. غالبية α-سينوكلين الموجود في أجسام ليوي مفسفرة في سيرين 12910,11. ونتيجة لذلك ، يتم استخدام تراكم α-سينوكلين المفسفرة كعلامة على الشدة النسيجية لأمراض PD. وجدت الدراسة الحالية أن α-سينوكلين المفسفرة تتراكم عند مستوى أعلى بكثير في الفئران التي تظهر عليها أعراض 15.5 شهرا مقارنة بالفئران عديمة الأعراض البالغة من العمر 7 أشهر والتي تعبر عن A53T البشري α-synuclein. وهذا يتفق مع التقارير التي تصف إثراء علم الأمراض الخلوية في القرون الأمامية للحبل الشوكي والدماغ الأوسط لهذه الفئران. 6 من هذا ، يستنتج أن طريقة التروية المبسطة الموصوفة هنا توفر تثبيتا عالي الجودة لأنسجة الجهاز العصبي المركزي للتوصيف النسيجي في المصب.
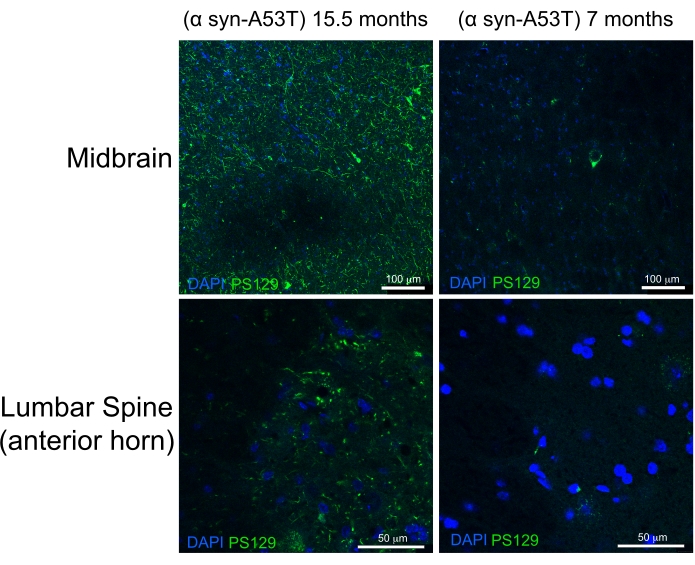
الشكل 6: ملصق لسينوكلين α المفسفرة في أنسجة الدماغ المتوسط والحبل الشوكي القطني من نموذج فأر لمرض باركنسون. تتم مقارنة الفأر المصاب بالشلل في المرحلة النهائية (15.5 شهرا) مع الفأر السليم البالغ من العمر 7 أشهر. يعبر كلا الفئران عن متغير متحور عرضة للطي (A53T) من α-سينوكلين البشري الذي يحفز أمراض تشبه مرض باركنسون. أشرطة المقياس = 100 ميكرومتر (الألواح العلوية) و 50 ميكرومتر (الألواح السفلية). اختصار: α syn-A53T = A53T متحور من α-سينوكلين. DAPI = 4',6-دياميدينو-2-فينيليندول; PS129 = سيرين 129 مفسفرة من α-سينوكلين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يصف هذا العمل الخطوات الحاسمة لإجراء التروية عبر القلب. عند بناء جهاز التروية (قسم البروتوكول 1) ، من المهم استخدام أنابيب مرنة بما يكفي ليتم إغلاقها بالكامل بواسطة مرقئ. قد لا تكون بعض الأنابيب الصلبة مسدودة بما فيه الكفاية بواسطة مرقئ وقد لا تزال تسمح ل PFA بالتسرب إلى الخط الرئيسي أثناء تروية PBS الأولية. عند تحضير محلول PFA بنسبة 4٪ ، من المهم التأكد من أن الرقم الهيدروجيني فسيولوجي (7.4). نظرا لأن تحضير محلول PFA ينطوي على تسخينه إلى 65 درجة مئوية ، يجب تبريد المحلول مرة أخرى إلى 25 درجة مئوية قبل قياس درجة الحموضة لأن هذه هي درجة الحرارة التي تتم عندها معايرة الرقم الهيدروجيني على العداد.
عند إجراء الشق الأولي في البطن ، يجب توخي الحذر لتجنب تمزق أعضاء البطن (قسم البروتوكول 2). عند تشريح الحجاب الحاجز بشكل متفوق ، من المهم تجنب تمزق الكبد لأنه من الشائع أن يكون الكبد ملتصقا بجدار البطن الأمامي. للتغلب على هذا ، يتم تشريح الكبد بعناية وصراحة بعيدا عن الجدار الأمامي قبل الاستمرار في شق نحو الحجاب الحاجز. عند دخول التجويف الصدري من خلال الحجاب الحاجز ، من المهم تجنب تمزق القلب والأوعية الدموية الكبيرة والرئة. لتجنب ذلك ، يتم الاحتفاظ بطرف المقص بشكل سطحي وبزاوية حادة مع القفص الصدري.
يستغرق التشريح الأولي لفضح القلب حوالي 2 دقيقة من الشق الأولي. من المتوقع أنه خلال هذا الوقت ، دخل بعض الهواء إلى طرف إبرة الفراشة. سيؤدي إدخال هذا الهواء في دوران الماوس إلى تروية رديئة الجودة. لذلك ، من الأهمية بمكان أن يتم فتح الخط الرئيسي ويتم مسح PBS من خلال الإبرة مباشرة قبل تعليب القلب لإزالة فقاعات الهواء. من الناحية المثالية ، يتم تعليب القلب بينما يتدفق تدفق PBS صغير عبر طرف الإبرة لضمان الغياب التام للهواء عند ثقب LV.
عندما تدخل الإبرة إلى LV ، يجب ألا تتعمق بحيث تدخل طرف الإبرة في البطين الأيمن (RV). سيؤدي وضع الإبرة إما في RV أو خارج الصمام التاجي إلى "تضخم" فوري في الرئتين عند بدء التروية. هذا غير مرغوب فيه ، ويجب سحب الإبرة قليلا لضمان وضع الجهد المنخفض. إذا تم وضع الإبرة بشكل صحيح ، فستظل الرئتين مسطحة طوال فترة التروية. عندما يبدأ التروية ، يلاحظ أحيانا أن سائلا واضحا يخرج من الفم المفتوح للحيوان. هذا عادة ما يكون بسبب ضغط التروية الذي يكون مرتفعا جدا أو بسبب وضع الإبرة في غير موضعها داخل القلب. يتوقع المؤلفون أن ضغوط التروية المرتفعة تؤدي إلى إسراف العطر من السرير الشعري الشرياني والتدفق الرجعي ل PBS عبر شجرة الشعب الهوائية إلى المريء وتجويف الفم.
يجب خفض ضغط التروية إما عن طريق خفض مستوى PBS في زجاجة PBS أو عن طريق خفض ارتفاع زجاجة PBS. بدلا من ذلك ، إذا تم وضع الإبرة بعمق شديد في البطين الأيسر ، فقد تنتقل عبر الصمام التاجي وتوصيل العطر إلى الأذين الأيسر. قد يؤدي ذلك إلى تدفق رجعي عبر الأوردة الرئوية وإسراف البيرفوسات في الشرايين ، كما هو موضح أعلاه. يعد التطهير الشامل للدم من الدورة الدموية باستخدام PBS مهما بشكل خاص لتجنب الربط المتبادل الناجم عن التثبيت لمكونات الدم مما يؤدي إلى انسداد الأوعية الدموية عند التروية المثبتة اللاحقة. يتم تقييم التخليص بشكل فعال من خلال تغيير لون الكبد وتدفق PBS من شق في قاعدة الذيل البطني. اكتمال إزالة الدم بشكل عام لمدة 3 دقائق من التروية باستخدام PBS. ومع ذلك ، إذا حدثت علامات مرئية للتخليص في أوقات أقصر ، تقديم التثبيت في وقت أقرب من 3 دقائق. لا ينصح بأوقات إزالة أطول لأن التروية المثبتة المتأخرة تؤدي إلى قطع أثرية في بنية CNS الدقيقة1.
عندما يتم إعطاء PFA ، من المهم مراقبة مستوى محلول PFA في زجاجة PFA. املأ زجاجة PFA إذا انخفض مستوى PFA إلى أقل من 4 سم فوق فم زجاجة PFA. بعد الانتهاء من التروية ، يجب شطف جهاز التروية جيدا بالماء المقطر. هذا مهم لأن PFA المتبقي في الخط الرئيسي سوف يلوث تروية PBS الأولية ب PFA ويؤدي إلى تروية رديئة الجودة. أخيرا ، يوصى عموما باستخدام إبر فراشة 25 جم للفئران البالغة متوسطة الحجم في نطاق 20-30 جم. ومع ذلك ، قد تتطلب الفئران الكبيرة أو الأصغر إبر قياس أكبر أو أصغر قليلا بالإضافة إلى تعديل الزجاجات المثبتة لتوفير معدلات تدفق مثالية.
بالنسبة لتشريح الجهاز العصبي المركزي وتضمين OCT (قسم البروتوكول 3) ، من الشائع ألا تغرق أنسجة الحبل الشوكي تماما في 30٪ من السكروز. وبالتالي يتم ترك هذه الأنسجة في السكروز لمدة 2 أيام ثم جزءا لا يتجزأ من OCT ، بغض النظر عما إذا كانت تغرق أم لا. عند تجميد الأنسجة في أكتوبر ، من الممكن أن تتشقق بعض الأنسجة عند وضعها في 2-methylbutane المبرد. هذا هو أكثر شيوعا مع الدماغ وعادة ما يحدث عندما يتم وضع الكثير من OCT على الأنسجة. لتجنب ذلك ، ضع ما يكفي فقط من OCT لتغطية أسطح الأنسجة قبل التجميد الفوري. في بعض البروتوكولات ، يكون التكسير أقل شيوعا على الرغم من الانغماس الكامل في OCT. ويرجع ذلك عادة إلى طريقة تجميد أبطأ مثل عند استخدام 2-methylbutane المبرد بالثلج الجاف أو وضع cryomold على كتلة من الثلج الجاف مباشرة. يفضل في هذا العمل 2-methylbutane المبرد بالنيتروجين السائل لأن معدل التجميد أسرع بكثير وقد يحافظ بشكل أفضل على مورفولوجيا الأنسجة من طرق التجميد الأبطأ.
عند التقسيم المبرد للأنسجة (قسم البروتوكول 4) ، من المهم تجنب دورات التجميد والذوبان المتعددة. لذلك ، من الأفضل قطع جميع الأقسام من كتلة OCT واحدة للحصول على منطقة دماغية محددة للتحليل بدلا من إذابة وإعادة تجميد مناطق محددة. إذا لم يكن هذا قابلا للتطبيق ، بعد الحصول على بعض الأقسام ، يمكن للمستخدمين إعادة تجميد وتخزين كتل OCT في الفريزر العميق -80 درجة مئوية 1-2 مرات أخرى للاستخدام في المستقبل.
الفوائد الرئيسية لهذه الطريقة على المضخة التقليدية أو توصيل ضغط الهواء من البيرفوسات هي كما يلي: (1) التكلفة المنخفضة وإمكانية الوصول إلى جهاز التروية. (2) لا يحتاج المستخدمون إلى الحفاظ يدويا على الضغط في جهاز التروية طوال فترة التروية. (3) ضغط تروية أقل وأكثر اتساقا من البدائل الأخرى المنخفضة التكلفة للإرواء مثل توصيل المحاقن. باستخدام معادلة برنولي ، يتم حساب أن جهاز التروية الذي يغذيه الجاذبية والذي تم إنشاؤه هنا سيحافظ على ضغط تروية يبلغ حوالي 73 مم زئبق عندما يتم وضع زجاجات النفخ على ارتفاع 1 متر بالنسبة للإبرة. بالنظر إلى أن هذا أقل بكثير من ضغط الدم الانقباضي لهذه الحيوانات ، فمن المحتمل أن يكون ضغط التروية هذا منخفضا بما فيه الكفاية لتجنب تمزق الأوعية الدموية12.
وقد نجح المؤلفون حتى الآن في استخدام نظام التروية هذا للكشف عن وجود α-سينوكلين مفسفرة في نموذج فأر لمرض باركنسون. خلال هذا الوقت ، لم تتم مواجهة قيود كبيرة مع طريقة التروية هذه غير موجودة مع طريقة توصيل تروية المضخة. القيد الرئيسي لهذه التقنية هو الطبيعة المستهلكة للوقت من التروية مقابل تثبيت السقوط. هذه التقنية هي الأفضل لإسقاط التثبيت لأن التروية تؤدي إلى اختراق أعمق للمثبت لهياكل الجهاز العصبي المركزي. القيد الثاني لهذه التقنية هو أنها تتطلب بعض المهارات الجراحية لأدائها ، حيث يجب أن يتم تعليب القلب بسرعة بعد الدخول إلى التجويف الصدري. ومع ذلك ، مع الخبرة ، يمكن للمستخدمين المدربين بشكل روتيني تقويم القلب في غضون 1 دقيقة من الشق الأولي في البطن.
Disclosures
ولا يعلن صاحبا البلاغ عن أي مصالح مالية متنافسة.
Acknowledgements
يشكر المؤلفون Xiaowen Wang و Liam Coyne و Jason Grullon على مساعدتهم في تطوير هذا البروتوكول. تم دعم هذا العمل من خلال منح المعاهد الوطنية للصحة AG061204 و AG063499.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Methylbutane (Certified ACS), Fisher Chemical | Fisher Scientific | 03551-4 | |
| Andwin Scientific Tissue-Tek O.C.T Compound | Fisher Scientific | NC1029572 | |
| Artman Instruments 4.5" Straight Castroveijo Spring Action Scissors | Amazon | B0752XHK2X | "fine scissors" |
| BD General Use and PrecisionGlide Hypodermic Needles, 18 G | Fisher Scientific | 14-826-5D | |
| BD General Use and PrecisionGlide Hypodermic Needles, 22 G | Fisher Scientific | 14-826B | |
| Corning PES Syringe Filters | Fisher Scientific | 09-754-29 | |
| Cytiva HyClone Phosphate Buffered Saline (PBS), 10x | Fisher Scientific | SH30258 | |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | |
| Fisher BioReagents Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | |
| Fisherbrand Curved Medium Point General Purpose Forceps | Fisher Scientific | 16-100-110 | "curved fenestrated forceps" |
| Fisherbrand Curved Very Fine Precision Tip Forceps | Fisher Scientific | 16-100-123 | "curved fine forceps" |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisher Scientific | 13-711-9AM | |
| Fisherbrand High Precision Straight Tapered Ultra Fine Point Tweezers/Forceps | Fisher Scientific | 12-000-122 | "straight fine forceps" |
| Fisherbrand Micro Spatulas with Rounded Ends | Fisher Scientific | 21-401-5 | |
| Fisherbrand Porcelain Buchner Funnels with Fixed Perforated Plates | Fisher Scientific | FB966J | |
| Fisherbrand Premium Cover Glass, 24 x 50 | Fisher Scientific | 12-548-5M | |
| Fisherbrand Premium Tissue Forceps 1X2 Teeth 5 in. German Steel | Fisher Scientific | 13-820-074 | "skin forceps" |
| Fisherbrand Reusable Heavy-Wall Filter Flasks | Fisher Scientific | FB3002000 | |
| Fisherbrand Standard Dissecting Scissors | Fisher Scientific | 08-951-20 | "dissecting scissors" |
| Fisherbrand Sterile Syringes for Single Use | Fisher Scientific | 14-955-464 | |
| Fisherbrand Straight Locking Hemostats | Fisher Scientific | 16-100-115 | |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Fisherbrand Vinyl Tubing and Connector Kits, 1/4 in. | Fisher Scientific | 14-174-1C | |
| Fisherbrand Wet-Strengthened Qualitative Filter Paper Circles | Fisher Scientific | 09-790-12F | |
| Fisherbrand Y Connector with 1/4 in. ID - Polypropylene - QC | Fisher Scientific | 01-000-686 | |
| Garvey Economy Single Edge Cutter Blade | Amazon | B001GXFAEQ | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, DyLight 488 | ThermoFisher Scientific | 35552 | |
| Ideal Clamp Stant High-Pressure Clamps | Fisher Scientific | 14-198-5A | "hose clamps" |
| IMEB, Inc Sakura Accu-Edge Low Profile Microtome Blades, Dispoisable | Fisher Scientific | NC9822467 | |
| Kawasumi 25 Gauge Standard Winged Blood Collection Set | Fisher Scientific | 22-010-137 | "butterfly needle" |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | Fisher Scientific | 06-666 | |
| Molecular Probes ProLong Diamond Antifade Mountant with DAPI | Fisher Scientific | P36962 | |
| Nalgene Narrow-Mouth Right-to-Know LDPE Wash Bottles | ThermoFisher Scientific | 2425-0506 | "buffer bottles" |
| PAP pen | abcam | ab2601 | |
| Paraformaldehyde Granular | Electron Microscopy Systems | 19210 | |
| Pyrex Glass Drying Dishes, 34.9 x 24.9 x 6 cm | Fisher Scientific | 15-242D | |
| Recombinant Anti-Alpha-synuclein (phospho S129) antibody [EP1536Y] | abcam | ab51253 | |
| Sodium Hydroxide | Sigma-Aldrich | 221465-2.5kg | |
| Stainless Steel Drinking Cup 18-oz | amazon | B0039PPO9U | |
| Sucrose for Molecular Biology CAS: 57-50-1 | Us Biological | S8010 | |
| Triton X-100 | Us Biological | T8655 | |
| Vetone Fluriso Isoflurane USP | MWI Animal Health | 502017 |
References
- Tao-Cheng, J. H., Gallant, P. E., Brightman, M. W., Dosemeci, A., Reese, T. S. Structural changes at synapses after delayed perfusion fixation in different regions of the mouse brain. Journal of Comparative Neurology. 501 (5), 731-740 (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments: JoVE. (65), e3564 (2012).
- McFadden, W. C., et al. Perfusion fixation in brain banking: a systematic review. Acta Neuropathologica Communications. 7 (1), 146 (2019).
- Lamberts, R., Goldsmith, P. C. Fixation, fine structure, and immunostaining for neuropeptides: perfusion versus immersion of the neuroendocrine hypothalamus. Journal of Histochemistry and Cytochemistry. 34 (3), 389-398 (1986).
- Adickes, E. D., Folkerth, R. D., Sims, K. L. Use of perfusion fixation for improved neuropathologic examination. Archives of Pathology and Laboratory Medicine. 121 (11), 1199-1206 (1997).
- Giasson, B. I., et al. Neuronal alpha-synucleinopathy with severe movement disorder in mice expressing A53T human alpha-synuclein. Neuron. 34 (4), 521-533 (2002).
- Martin, L. J., et al. Parkinson's disease alpha-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. Journal of Neuroscience. 26 (1), 41-50 (2006).
- Fujiwara, H., et al. alpha-Synuclein is phosphorylated in synucleinopathy lesions. Nature Cell Biology. 4 (2), 160-164 (2002).
- Kalia, L. V., Lang, A. E. Parkinson's disease. Lancet. 386 (9996), 896-912 (2015).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. Journal of Biological Chemistry. 281 (40), 29739-29752 (2006).
- Kahle, P. J., et al. Hyperphosphorylation and insolubility of alpha-synuclein in transgenic mouse oligodendrocytes. EMBO Reports. 3 (6), 583-588 (2002).
- Mattson, D. L. Comparison of arterial blood pressure in different strains of mice. American Journal of Hypertension. 14, 405-408 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved