Method Article
Un método de perfusión transcárdica alimentado por gravedad para el análisis histológico del sistema nervioso central del ratón
En este artículo
Resumen
Se presenta un método de perfusión conveniente alimentado por gravedad para el análisis histológico del sistema nervioso central del ratón. La detección inmunofluorescente de α-sinucleína fosforilada se demuestra en un modelo de ratón de la enfermedad de Parkinson. Este trabajo también describe exhaustivamente los pasos de perfusión transcárdica, disección, congelación / incrustación de tejidos y seccionamiento congelado.
Resumen
El análisis histológico de especímenes de cerebro y médula espinal aislados de ratones es una práctica común para la evaluación de la patología en este sistema modelo. Para mantener la morfología de estos delicados tejidos, es rutinario administrar un fijador químico como el paraformaldehído a través de la canulación del corazón en animales anestesiados (perfusión transcárdica). La perfusión transcárdica del corazón de ratón se ha basado tradicionalmente en el uso de bombas peristálticas o presión de aire para entregar soluciones salinas y fijadoras necesarias para este proceso. Como una alternativa de fácil acceso a estos métodos, este trabajo demuestra el uso de un método de entrega de perfusato alimentado por gravedad que utiliza materiales disponibles en la mayoría de las ferreterías.
Para validar este nuevo método de perfusión, este trabajo demuestra todos los pasos posteriores necesarios para la detección sensible de α-sinucleína fosforilada tanto en el cerebro como en la médula espinal. En estos pasos se incluyen la disección de los tejidos fijos del cerebro y la médula espinal, la congelación / incrustación rápida y la crioseccionación de los tejidos, y la tinción inmunofluorescente. Como este método da como resultado la administración de todo el cuerpo del fijador, también se puede usar para preparar otros tejidos no neuronales para el análisis histológico.
Introducción
La caracterización histológica de la patología en el sistema nervioso central (SNC) del ratón es una técnica rutinaria utilizada en estudios de neurodegeneración. A medida que los tejidos neuronales se degradan rápidamente después de la muerte, es una práctica común administrar un fijador químico como el paraformaldehído a los tejidos del SNC para preservar su morfología 1,2. La fijación química se puede realizar a través de la perfusión de todo el cuerpo con una solución fijadora o mediante el aislamiento de los tejidos y su inmersión en una solución fijadora (denominada "fijación de gotas"). La perfusión es el método preferido de administración de fijadores, ya que la fijación por gota puede no permitir la penetración rápida de la solución fijadora en las estructuras profundas del SNC 3,4,5. Además, como es difícil eliminar la médula espinal no fija de la columna vertebral, la entrega de la solución fijadora a través de la perfusión permite la preservación in situ de la médula espinal de la anatomía microscópica y gruesa y endurece el tejido para minimizar el daño durante la extracción.
La entrega de las soluciones tampón y fijadoras necesarias para la fijación se realiza comúnmente utilizando bombas o presión de aire disponibles comercialmente. La entrega por gravedad de perfusato puede servir como una alternativa a la entrega de la bomba por las siguientes razones: (1) La entrega de bomba o presión de aire puede en algunos casos requerir que un usuario mantenga manualmente la presión en el sistema durante toda la perfusión. La entrega por gravedad del perfusato se puede mantener sin la intervención del usuario. (2) Un aparato de perfusato por gravedad puede construirse a bajo costo para el usuario mediante la obtención de materiales disponibles de proveedores científicos estándar. Este trabajo describe cómo construir un dispositivo de perfusión por gravedad simple utilizando botellas de lavado y tubos de vinilo. Utilizando un modelo de ratón de la enfermedad de Parkinson, este trabajo demuestra la eficacia de este sistema en la perfusión de los tejidos del cerebro y la médula espinal antes de su aislamiento para la sección congelada. Este trabajo describe exhaustivamente todos los pasos, técnicas y materiales necesarios para diseccionar el tejido fijo del animal, congelar / incrustar y crioseccionar rápidamente el tejido, y detectar la presencia de α-sinucleína fosforilada tanto en el cerebro como en la médula espinal a través de la microscopía de inmunofluorescencia indirecta.
Protocolo
Los datos y pasos experimentales presentados en este protocolo se generaron utilizando ratones C57BL/6J. Todos los métodos que involucran animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Estatal de Nueva York de la Universidad Médica del Norte del Estado.
1. Construcción de aparatos de perfusión y plataforma de disección
- Como se muestra en la Figura 1, recorte las pajitas internas de dos botellas de lavado de 500 ml cortándolas al ras del lado interno de la tapa atornillada con una cuchilla de afeitar afilada. Corte un agujero cuadrado de 4 cm x 4 cm en el fondo de cada botella tampón. Corte un pequeño agujero en el fondo de cada botella para permitir el paso de una microespatula de acero inoxidable doblada.
- Cree una curva en forma de "S" en las microespatulas para que puedan usarse como ganchos para colgar las botellas tampón. Inserte las microespátulas dobladas en las aberturas apropiadas en las botellas tampón.
- Corte dos tubos de 25 cm de longitud y conéctelos firmemente con las salidas exteriores de paja de la botella. Unir los extremos de estos tubos junto con el conector Y. Corte 2 m de tubería y únala al extremo libre del conector Y.
- Retire el émbolo de la jeringa de 1 ml y corte la jeringa aproximadamente a 6 cm de distancia de la punta de la jeringa. Corte la jeringa anotando primero el plástico con una cuchilla de afeitar y luego rompiendo bruscamente el plástico de la jeringa.
- Inserte la cara cortada de la jeringa en el extremo libre del tubo de plástico. Inserte a una profundidad suficiente para garantizar un sellado hermético.
NOTA: Es importante que todas las conexiones dentro del aparato de perfusión estén lo suficientemente apretadas para evitar fugas. En el caso de conexiones sueltas, se pueden colocar pequeñas abrazaderas de manguera de acero inoxidable y apretarlas en las uniones según se desee para garantizar un sellado hermético si es necesario. - Etiquete una botella tampón como PFA y una botella como PBS (tampón). Mida aproximadamente 1/3 de la longitud de la abertura de la botella y dibuje una línea alrededor de la circunferencia de la botella en este punto para denotar el nivel de llenado apropiado de las soluciones de perfusato.
- Endereza y luego crea un bucle en un clip grande que pueda caber alrededor de la circunferencia del tubo. Coloque este bucle alrededor del tubo justo antes de la jeringa.
- Coloque un bloque de espuma de poliestireno del tamaño adecuado en la bandeja de vidrio. Coloque los extremos del clip en el bloque de espuma de poliestireno para fijar el tubo.
- Usando toallas de papel, levante el extremo frontal de la bandeja de vidrio en aproximadamente 2 cm.
NOTA: Esto colocará el ratón en aproximadamente 20 ° de la posición de Trendelenburg (inclinación hacia atrás) para permitir una visualización más fácil del diafragma durante la disección y fomentar el drenaje de líquidos durante la perfusión.
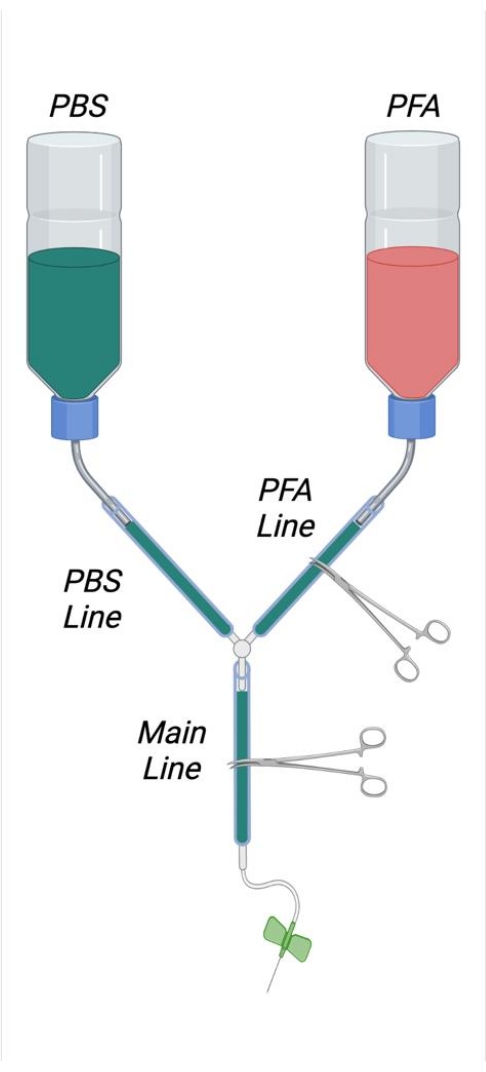
Figura 1: Diagrama que representa el aparato de perfusión ensamblado. Abreviaturas: PBS = solución salina tamponada con fosfato; PFA = paraformaldehído. Haga clic aquí para ver una versión más grande de esta figura.
2. Preparación de solución de paraformaldehído (PFA)
NOTA: La solución de PFA debe prepararse fresca el día de la perfusión y desecharse al final de la perfusión en un contenedor de desechos designado antes de su eliminación por personal capacitado. Este protocolo produce 1 L de solución de PFA al 4%, que es suficiente para perfundir aproximadamente 4 ratones. El PFA es altamente tóxico, y se debe tener cuidado para evitar la inhalación o el contacto directo con la piel, ya sea en forma de polvo o líquido. Por lo tanto, la mayoría de los pasos de preparación se realizan mientras se usan guantes, gafas protectoras y una bata de laboratorio debajo de una capucha de humos.
- Enjuague un vaso de precipitados de 1 L con agua destilada y llénelo con aproximadamente 800 ml de H 2 O de grado de biología molecularde18 mΩ.
- Calentar el vaso de precipitados de H2O en un microondas durante 3 min o hasta que la temperatura del agua alcance los 65 °C. Coloque en una placa de calentamiento/agitación guardada en una campana extractora de humos.
- Enjuague una varilla de agitación con agua destilada y colóquela en el agua caliente. Encienda el agitador y gire la placa caliente a fuego medio. Asegúrese de que la temperatura del agua no supere los 70 °C.
- Use una máscara quirúrgica, guantes, gafas protectoras y bata de laboratorio y mida 40 g de polvo de PFA. Vierta este polvo en el agua caliente.
- Usando una pipeta de transferencia, agregue unas gotas de 5 M de NaOH a la solución. Permita que el polvo de PFA se disuelva por completo. Si el polvo no se ha disuelto completamente después de unos minutos, agregue gotas de 5 M naOH según sea necesario.
- Una vez que casi todo el PFA se haya disuelto (aparecerá ligeramente turbio), detenga la agitación / calentamiento e inmediatamente agregue 100 ml de solución salina tamponada con fosfato (PBS) 10x. Finalmente, rellene el agua hasta la marca de 1 L en el vaso de precipitados utilizando H 2 O de grado de biología molecularde18 mΩ. Cubra el vaso de precipitados con una envoltura de plástico y colóquelo en un congelador de -20 ° C hasta que la solución alcance la temperatura ambiente (aproximadamente 45 min).
- Calibre un medidor de pH utilizando los estándares apropiados. Mientras el vaso de precipitados está en una placa de agitación, mida el pH de la solución y agregue HCl hasta que el pH alcance 7.4. Si es necesario, agregue 5 M de NaOH para aumentar el pH si es demasiado bajo.
- Conecte un matraz de vacío a la aspiradora y coloque un embudo Büchner cerámico limpio con papel de filtro en el matraz. Encienda el vacío y humedezca el papel de filtro con una pipeta de transferencia llena con la solución de PFA al 4%.
- Vierta lentamente la solución de PFA al 4% sobre el papel de filtro hasta que se haya filtrado toda la solución.
- Transfiera la solución filtrada a un recipiente limpio y protegido contra la luz y guárdela a 4 °C hasta su uso (no más de 24 h).
3. Perfusión transcárdica "sin bomba"
- En la campana de humos, coloque un bloque de disección de espuma de poliestireno en una bandeja de vidrio. Asegúrese de que el bloque de disección tenga 5-6 agujas cortas para sujetar al ratón durante la cirugía y 2 agujas largas para soportar el tubo de perfusión.
- Enjuague el aparato de perfusión con agua destilada. Deje que toda el agua se drene antes de colgar el aparato de perfusión. Cuelgue las botellas de perfusión 1 m por encima del animal perfundido (para un ratón de 20-30 g).
- Preparar una solución no estéril de 1x PBS usando 10x PBS diluido con 18 mΩ de grado de biología molecular H2O.
- Como se muestra en la Figura 2, sujete la línea principal del aparato de perfusión utilizando un hemostático. Sujete la línea PFA con otro hemostático.
NOTA: La oclusión con múltiples hemostáticos puede ser necesaria por línea para evitar completamente el flujo. - Llene el recipiente tampón con 1x PBS a temperatura ambiente.
- Coloque el extremo de la jeringa del aparato de perfusión en un vaso de precipitados para recoger el tampón de residuos y retire el hemostático ocluyendo la línea principal (Figura 2, izquierda).
- Permita que PBS fluya a través de la línea mientras elimina el aire atrapado golpeando vigorosamente las paredes del tubo.
- Una vez que se haya eliminado todo el aire del amortiguador y las líneas principales, ocluya el flujo colocando un hemostático en la línea principal.
- Retire el hemostático de la línea de PFA y permita que el PBS fluya de manera retrógrada hasta la botella de PFA mientras golpea cualquier burbuja en la línea de PFA (Figura 2, medio). Continúe permitiendo que el PBS entre en la línea de PFA hasta que se pueda ver PBS justo encima de la abertura de la botella. Ocluya la línea de PFA con un hemostático para detener el flujo hacia la botella de PFA.
- Conecte la aguja de infusión de mariposa a la jeringa de perfusión y enjuague PBS a través de la línea (abriendo el hemostático de la línea principal) para eliminar las burbujas de la jeringa de perfusión. Cierre el hemostático de la línea principal.
- Asegúrese de que la botella de PBS esté ahora aproximadamente 1/3 llena de PBS. Si es necesario, enjuague PBS a travésde la línea principal o llene más PBS en la botella tampón hasta 1/3 de su capacidad total.
- Una vez que se hayan eliminado todas las burbujas del PBS, PFA y líneas principales, llene la botella de PFA con una solución de PFA al 4% a temperatura ambiente hasta la marca negra en la botella (aproximadamente 1/3de lleno) (Figura 2, derecha).
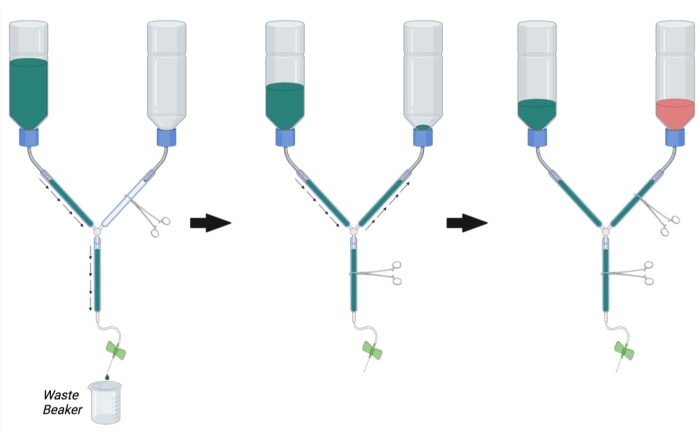
Figura 2: Preparación del aparato de perfusión para cirugía de perfusión. Primero, cierre el hemostático de la línea PFA y abra el hemostático en la línea PBS y la línea principal. Llene PBS y elimine las burbujas de la línea PBS y la línea principal. A continuación, llene la línea PFA con PBS abriendo el hemostático en la línea PFA y cerrando el hemostático en la línea principal. Retire las burbujas en la línea PFA. Finalmente, cierre el hemostático en la línea de PFA cuando el PBS llegue a la abertura de la botella de PFA. Llene la botella de PFA 1/3llena de PFA. Asegúrese de que el nivel de PBS en la botella de PBSesté lleno 1 /3 y llene con PBS o drene PBS abriendo el hemostático de la línea principal si es necesario. Abreviaturas: PBS = solución salina tamponada con fosfato; PFA = paraformaldehído. Haga clic aquí para ver una versión más grande de esta figura.
- Prepárese para la cirugía de no supervivencia limpiando los siguientes instrumentos con agua seguido de etanol al 70%: tijeras grandes, tijeras de disección fina, pinzas de piel, pinzas curvas finas fenestradas.
- Prepare la anestesia colocando toallitas sin polvo en un tubo cónico de 50 ml. En una campana extractora de humos, remoje bien las toallitas libres de polvo con isoflurano y coloque el tubo abierto boca abajo en un vaso de precipitados de 500 ml. Asegúrese de que no haya isoflurano líquido en la parte inferior del vaso de precipitados y deseche cualquier isoflurano líquido antes de colocar un ratón en el vaso de precipitados.
- Coloque el ratón en el vaso de precipitados y coloque una envoltura de plástico sobre la abertura para comenzar la anestesia.
- Administrar anestesia hasta que el ratón deje de respirar (aproximadamente 1 min y 30 s).
- Cuando la respiración se haya detenido, retire inmediatamente el ratón del vaso de precipitados y reemplace la tapa en el tubo cónico de 50 ml.
- Compruebe que el ratón está suficientemente anestesiado mediante el uso del reflejo de pellizco del dedo del pie. Si el animal no está suficientemente anestesiado, administre más isoflurano como se describe en el paso 3.15.
- Trabajando rápidamente, coloque el ratón en el bloque de espuma de poliestireno y fije las patas hacia afuera con cuatro agujas cortas (por ejemplo, agujas de jeringa de 22 G).
- Levantando la piel abdominal con fórceps cutáneos, use las tijeras grandes para cortar a través de la pared abdominal. ¡Asegúrese de que no se corten los órganos abdominales!
- Continúe el corte abdominal superiormente hacia el hígado. Separe el hígado de la pared abdominal anterior y continúe la incisión inicial superiormente hacia el diafragma. Detenga esta incisión aproximadamente 1 cm inferior al diafragma. ¡Tenga cuidado de asegurarse de que el hígado no se corte!
- Continúe la incisión inicial lateralmente hacia los lados derecho e izquierdo del diafragma para hacer una incisión en forma de "Y" (Figura 3A).
- Cuando la incisión llegue al diafragma, haga un agujero en el diafragma con las tijeras finas de disección y corte las costillas en el lado derecho del animal. Corte las costillas aproximadamente hasta la mitad de la axila derecha.
- Haga una incisión similar pero más larga a través del lado izquierdo del diafragma casi hasta la axila izquierda.
- Refleja la pared torácica y pégala al bloque de espuma de poliestireno.
- Si es necesario, diseccione la grasa de alrededor del corazón para exponer el ventrículo izquierdo. Identifique el ventrículo izquierdo en función del color relativamente más claro en comparación con el ventrículo derecho.
- Después de identificar el ventrículo izquierdo, mantenga el corazón estable usando una ligera presión con las finas pinzas curvas. Abra el hemostático de la línea principal para permitir que el PBS fluya a través de la aguja. Perfore inmediatamente el ventrículo izquierdo y asegúrese de que la aguja se inserte no más de 0,5 cm en el ventrículo. Retire la aguja ligeramente si es necesario.
NOTA: La colocación precisa de la aguja en el ventrículo izquierdo está indicada por el flujo retrógrado de sangre en el tubo de la aguja. Es importante asegurarse de que la aguja no se inserte demasiado profundamente en el ventrículo. Esto puede resultar en un flujo retrógrado a través de las venas pulmonares o perforando el tabique interventricular. - Apoye el tubo de mariposa en una X hecha en espuma de poliestireno con dos agujas grandes de 18 G.
NOTA: Esto es crítico, ya que evitará el movimiento de la aguja de mariposa dentro del corazón durante la perfusión. - Identificar la vena cava inferior a medida que sale del hígado y transectarla usando las tijeras finas de disección (Figura 3B). Alternativamente, abra el atrio derecho con tijeras.
- Abra inmediatamente la línea principal para permitir que comience la perfusión de PBS (Figura 3C).
- Asegúrese de que el PBS esté drenando el bloque de espuma de poliestireno y hacia la bandeja de vidrio de abajo. Si esto no ocurre, reajuste el ángulo de la bandeja o el bloque de espuma de poliestireno para permitir el drenaje de líquidos en la bandeja de vidrio.
- Continúe la perfusión de PBS hasta que el líquido que sale de la vena cava inferior esté libre de sangre (aproximadamente 3 min).
NOTA: La colocación adecuada de la aguja en el corazón dará como resultado la limpieza visual de la sangre del hígado, que pasará de rojo a color pajizo. Si esto no ocurre, se puede remediar reposicionando la aguja de infusión dentro del ventrículo izquierdo. Se puede hacer una pequeña incisión en la base de la cola ventral para evaluar la calidad de la perfusión. La perfusión adecuada dará como resultado un PBS claro que fluye desde la incisión de la base de la cola. - Trabajando rápidamente, ocluya la línea PBS con un hemostático y abra la línea PFA.
- Deje que el PFA se perfunda durante unos minutos hasta que la cola comience a curvarse. Una vez que la cola comience a curvarse, comience un temporizador de 50 minutos. Si la cola no se curva después de 5 minutos de perfusión de PFA, comience un temporizador de 50 minutos para la perfusión de PFA.
- Controle el nivel de PFA en el frasco continuamente durante toda la perfusión para asegurarse de que el nivel no baje demasiado. Llene más PFA en la botella si el nivel cae por debajo de 2 cm por encima de la tapa de la botella.
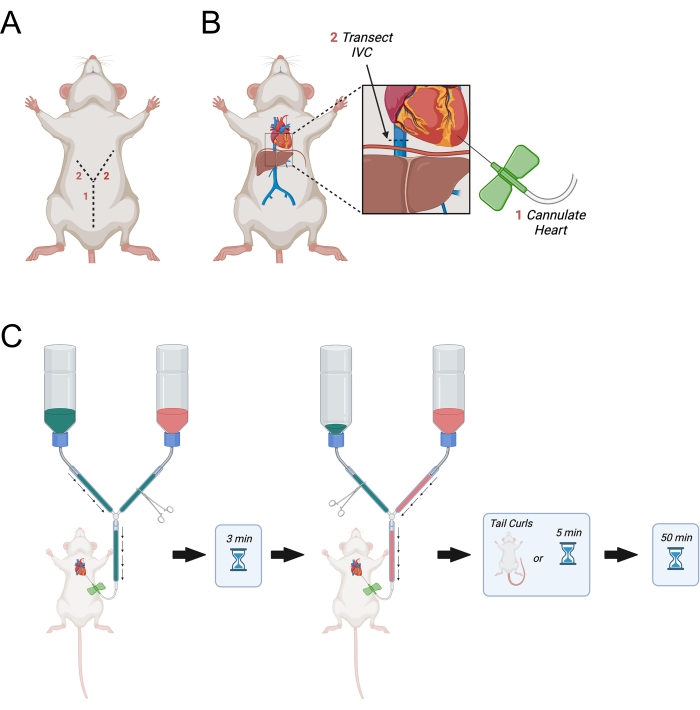
Figura 3: Diagrama que representa la perfusión transcárdica. (A) Primero se corta la pared abdominal, seguida de dos incisiones que apuntan lateralmente hacia la axila formando una "Y". (B) Después de entrar en la cavidad torácica y exponer el corazón, la aguja se pasa al ventrículo izquierdo. A continuación, el IVC o aurícula derecha se transecta para permitir el drenaje de los perfusatos después de que hayan circulado por el cuerpo. El IVC se corta superior al diafragma. C) Procedimiento para la administración de perfusatos. Abreviatura = IVC = vena cava inferior. Haga clic aquí para ver una versión más grande de esta figura.
- Después de que hayan transcurrido 50 min, ocluya la línea principal con un hemostático y retire la aguja del ventrículo izquierdo.
NOTA: Todo el ratón está rígido en este punto y ahora se puede colocar en un recipiente etiquetado de 4% de PFA durante la noche a 4 ° C. En esta etapa, es posible diseccionar los tejidos del SNC y colocarlos individualmente en fijador durante la noche. En este trabajo, todo el ratón se coloca en fijador, ya que esto acorta el intervalo entre la fijación y la colocación a 4 °C. Esto también evita cualquier posible distorsión mecánica del tejido nervioso que pueda ocurrir si los animales son predisecados antes de que se complete la fijación durante la noche.
4. Disección del SNC
- Prepare los siguientes instrumentos para la disección lavando con agua seguido de etanol al 70%: tijeras, pinzas de piel, pinzas fenestradas curvas, pinzas finas curvas, pinzas finas rectas, tijeras finas finas.
- Etiquete cuatro tubos por ratón de la siguiente manera y llénelos con sacarosa estéril al 20%: Mouse ID, Brain 1, Mouse ID, Brain 2, Mouse ID, Lumbar, Mouse ID, Cervical.
- Retire el ratón de la solución de PFA y séquelo con una toalla de papel para eliminar el exceso de PFA.
- Usando las tijeras grandes, retire la cabeza del ratón cortando en el cuello.
- Coloque el cuerpo en la solución de PFA. Retener la cabeza para diseccionar el cerebro del cráneo.
- Para diseccionar el cerebro, comience reflejando la piel craneal hacia adelante para exponer todo el cráneo (Figura 4A).
- Haga un corte poco profundo en el canal auditivo usando las tijeras de disección fina para ingresar al cráneo
- Continúe este corte a lo largo del seno transverso hasta que el cráneo se corte todo el camino entre ambos canales auditivos.
- Haga un corte perpendicular al corte anterior a lo largo de la fisura longitudinal hasta la porción más rostral del cráneo (aproximadamente entre los ojos).
- Usando las pinzas curvas fenestradas, refleje el cráneo lateralmente para exponer el cerebro anterior. Continúe extrayendo el cráneo hasta que todo el cerebro anterior, incluidos los bulbos olfativos, esté expuesto.
- Comience a diseccionar la región caudal del cráneo haciendo un corte a través del hueso occipital y continuando lentamente este corte hacia el foramen magnum.
- Reflejar las dos piezas de cráneo lateralmente para exponer caudalmente el cerebelo y el tronco encefálico (Figura 4B).
- Use las pinzas curvas ultrafinas para separar los bulbos olfativos del cráneo anterior y comience a pelar el cerebro lejos de la base del cráneo comenzando en los bulbos olfativos.
- A medida que el cerebro se despega de la base del cráneo, use fórceps ultrafinos para cortar los nervios craneales y permitir la extirpación del cerebro.
- Continúe pelando el cerebro de la base del cráneo hasta que se elimine todo el cerebro intacto (Figura 4C, D).
- Cortar el cerebro por la mitad a lo largo de la fisura longitudinal para separar los hemisferios derecho e izquierdo entre sí (Figura 4E, F).
- Coloque un hemisferio en el cerebro 1 tubo y el segundo hemisferio en el cerebro 2 tubo. Guarde estos tubos a 4 °C hasta que los hemisferios cerebrales se hundan (aproximadamente durante la noche).
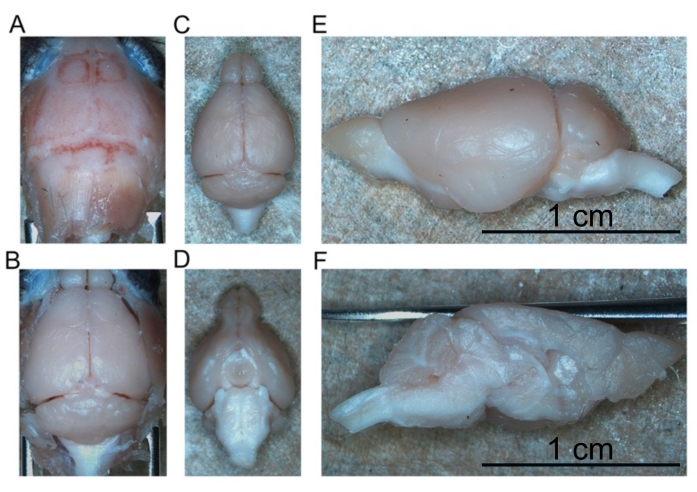
Figura 4: Extirpación del cerebro fijo. (A) Parte superior del cráneo. (B) Cerebro expuesto dentro del cráneo. (C) Cerebro aislado (aspecto dorsal). (D) Cerebro aislado (aspecto ventral). (E) Hemisferio izquierdo (aspecto lateral). (F) Hemisferio izquierdo (aspecto medial). Barras de escala = 1 cm (E y F). Haga clic aquí para ver una versión más grande de esta figura.
- Para diseccionar la médula espinal, retire el cuerpo del ratón del PFA y séquelo.
- Coloque el ratón en un bloque de disección de espuma de poliestireno en la posición prona y fije las patas en el bloque con cuatro agujas.
- Comience la disección cortando la piel por la línea media del ratón desde el cuello hasta la cola para exponer toda la parte posterior.
- Refleja el músculo y la fascia en la espalda para exponer la parte posterior de la columna vertebral.
- Comenzando en la mayoría de las vértebras craneales, use las tijeras de disección fina para cortar la lámina mientras evita la médula espinal (Figura 5A).
- Coloque las pinzas curvas ultrafinas debajo de la lámina y tire hacia arriba para fracturar las vértebras y exponer la médula espinal (Figura 5B).
- Use las pinzas curvas para reflejar las vértebras fracturadas y exponer las regiones más laterales de la médula espinal.
- Continúe este proceso para las siguientes vértebras colocando las pinzas curvas ultrafinas debajo de la lámina y fracturando las vértebras. Continúe fracturando las vértebras hasta que toda la columna cervical y la columna torácica estén expuestas (Figura 5C).
- Continúe exponiendo la médula espinal hasta el final de la médula espinal lumbar (Figura 5D).
- Usando una cuchilla de afeitar afilada, corte todo el camino a través de la médula espinal midtorácica.
- Usando las pinzas curvas ultrafinas, transecte los nervios espinales lateralmente desde la columna vertebral y la fascia anterior a la médula espinal para separar lentamente la médula espinal cervical de la columna vertebral.
- Continúe diseccionando la médula espinal cervical hasta que esté libre de las vértebras (Figura 5E). Coloque la médula espinal cervical-media trarácica en el tubo marcado como cervical. Guarde este tubo a 4 °C hasta que la médula espinal cervical se hunda (aproximadamente durante la noche).
- Continúe fracturando las vértebras torácicas hasta la cauda equina como se detalla en los pasos 4.22 a 4.25. Cuando la cauda equina esté expuesta, use una cuchilla de afeitar afilada para cortar la médula espinal 1 cm por debajo de la médula espinal lumbar (Figura 5F).
- Diseccionar la médula espinal lumbar lejos de las vértebras como se describe en los pasos 4.26-4.27. Coloque la médula espinal lumbar-media cauda equina en el tubo marcado como lumbar. Guarde este tubo a 4 °C hasta que la médula espinal lumbar se hunda (aproximadamente durante la noche).
- Cuando todos los tejidos se hayan hundido en sacarosa al 20%, transfiéralos a tubos marcados de sacarosa al 30% hasta que se hayan hundido o durante 3 días.
NOTA: Los tejidos espinales a menudo no se hunden al 30% de sacarosa.
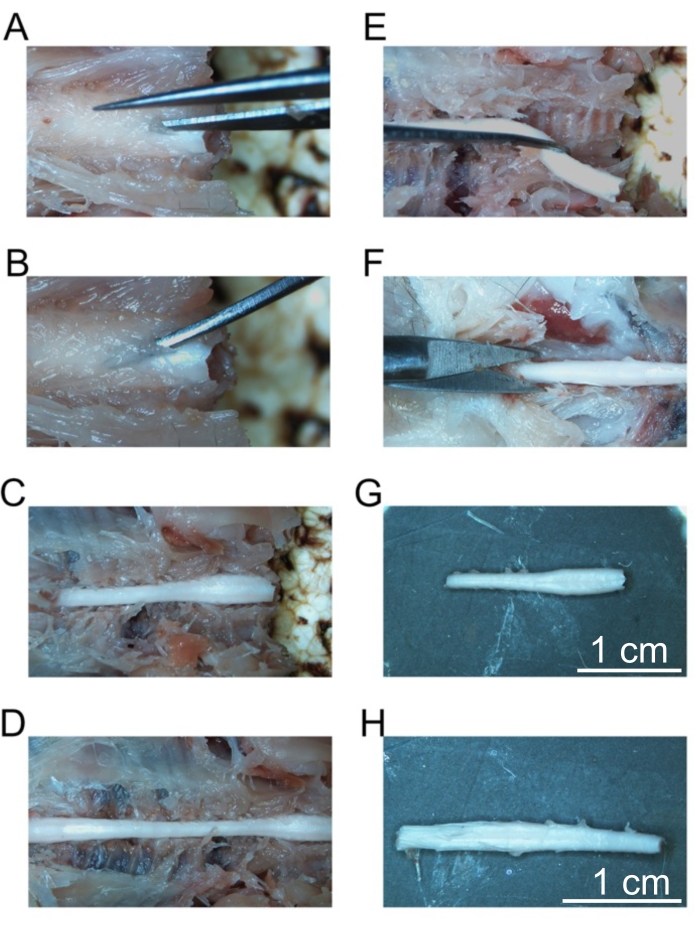
Figura 5: Extirpación de segmentos fijos de la médula espinal. (A) Corte inicial en la lámina de las vértebras cervicales. (B) Colocación de fórceps curvos para fracturar vértebras individuales. (C) La columna cervical expuesta. (D) Columna cervical, torácica y lumbar expuesta. (E) Extirpación de la columna cervical después de cortar los nervios espinales. (F) Corte de la columna sacra. (G) Columna cervical aislada. (H) Columna lumbar aislada. Barras de escala = 1 cm (G y H). Haga clic aquí para ver una versión más grande de esta figura.
5. Incrustación de OCT y almacenamiento de tejidos
- Para cada ratón, etiquete cuatro criomoldes de forma rectangular: ID del ratón, Hemisferio derecho, Fecha de incrustación; ID del ratón, hemisferio izquierdo, fecha de incrustación; ID de ratón, cervical, fecha de incrustación; ID del ratón, Lumbar, Fecha de incrustación.
- Coloque un recipiente de espuma de poliestireno y cuelgue una taza de metal sobre el recipiente.
- Llene el recipiente de espuma de poliestireno con nitrógeno líquido aproximadamente a la mitad. Llene la taza de metal con 2-metilbutano fresco aproximadamente hasta la mitad.
NOTA: El 2-metilbutano es tóxico, altamente volátil e inflamable. Se debe tener cuidado para evitar la inhalación realizando pasos posteriores en una campana de humos y lejos de las fuentes de combustión. - Baje lentamente la taza de metal en el nitrógeno líquido y evite cualquier salpicadura del nitrógeno líquido en la taza de metal.
- Permita que el 2-metilbutano comience a congelarse. Mientras el 2-metilbutano se está congelando, saque el tejido deseado de la solución de sacarosa al 30% y séquelo en una toallita sin polvo.
- Coloque el tejido en un criomold con la región rostral apuntando hacia la parte superior (sin etiquetar) del molde.
- Vierta con moderación el medio de incrustación de temperatura de corte óptima (OCT) sobre el tejido en el criomold, usando solo lo suficiente para cubrir el tejido por completo. Evite el uso excesivo de OCT, ya que esto puede causar agrietamiento. Retire las burbujas de la OCT.
- Cuando el 2-metilbutano congelado haya cubierto completamente la superficie interna de la copa de metal, sumerja completamente el criomold en la fase líquida superpuesta 2-metilbutano durante 12 s. Después de 12 s, coloque el criomold para escurrir en un cuadrado de papel de aluminio etiquetado y envuelva todo el cryomold. Coloque inmediatamente el cryomold envuelto sobre hielo seco y evite descongelar. Asegúrese de que el OCT/criomold congelado esté siempre cubierto con hielo seco.
- Repita los pasos 5.6 a 5.8 para todos los tejidos. Coloque el pañuelo para un ratón en una pequeña bolsa de plástico sellada y luego en un recipiente sellado y crioseguro. Guarde este recipiente en el congelador de -80 °C hasta que se corten las secciones.
6. Crioseccionación
- Antes de la crioseccionación, asegúrese de que la temperatura de la cámara de criostato y el cabezal de la muestra estén ajustados a los ajustes apropiados.
NOTA: Se utiliza una temperatura de la cámara de -20 °C, una temperatura de la cabeza de la muestra de -20 °C y un grosor de sección de 30 μm para cortar secciones cerebrales. Para cortar las secciones de la médula espinal, se utiliza una temperatura de la cámara de -23 ° C, una temperatura de la cabeza de la muestra de -30 ° C y un grosor de sección de 30 μm. Es importante tener en cuenta que los ajustes de criostato (especialmente la temperatura de la cabeza de la muestra) deberán ajustarse durante la sección para abordar los problemas con la calidad del tejido. En general, la temperatura de la cabeza de la muestra se reduce para corregir el frotis de tejido. Por el contrario, la temperatura de la cabeza de la muestra se aumenta para corregir el rizado excesivo del tejido. - Retire el bloque de OCT deseado del congelador de -80 °C y coloque el bloque criomold/OCT sin envolver en la cámara de criostato.
- Permita que el bloque OCT se aclimate a la temperatura de la cámara durante 30 minutos.
- Limpie un mandril con etanol al 70% y séquelo con una toallita sin polvo. Coloque el mandril limpio en la cámara de criostato y haga un círculo de OCT del tamaño de una moneda en el mandril. Deje que la OCT se congele (aproximadamente 1-2 min).
- Cuando la OCT se haya congelado, coloque un punto del tamaño de un guisante de OCT fresca en el mandril e inmediatamente coloque el bloque de OCT de tejido en el mandril. Asegúrese de que el tejido esté perfectamente perpendicular al mandril antes de que la OCT se congele por completo.
NOTA: Generalmente, la región más rostral del cerebro se coloca hacia el mandril para que la seccionamiento comience desde el extremo caudal. Para la médula espinal, generalmente, la región más caudal se coloca en el mandril para que la sección comience desde el extremo rostral. - Cuando la OCT se haya endurecido, coloque más OCT alrededor de la base del bloque de octa para que actúe como soporte estructural durante la sección. Cuando este soporte se haya endurecido ligeramente, coloque el mandril en la cabeza de la muestra y permita que el bloque OCT alcance la temperatura de la cabeza de la muestra durante 30 minutos.
- Coloque una cuchilla de microtomo en el soporte de la cuchilla y limpie la placa antivuelco. Ajuste la distancia de la placa antivuelco para asegurarse de que el tejido pase justo debajo de la placa durante la sección. Para obtener más información sobre el posicionamiento correcto de la placa antivuelco, consulte el manual de criostatos.
- Después de que el bloque de OCT se haya aclimatado a la temperatura de la cabeza de la muestra, comience a recortar el bloque de OCT hasta que se alcance el tejido. Cuando el tejido sea visible, cambie del recorte al seccionamiento y comience a cortar secciones de 30 μm. Aparta la placa antivuelco y, con un portaobjetos de microscopio, recoge la sección.
- Continúe cortando y recolectando secciones hasta que esté satisfecho con la ubicación anatómica de las secciones o todo el tejido haya sido cortado. Coloque los toboganes para que se sequen a temperatura ambiente durante 1-3 días. Después del secado, coloque las diapositivas en una caja deslizante y coloque esta caja en una bolsa de plástico sellada. Etiquete la bolsa con la identificación del ratón y la información del tejido antes de colocar las diapositivas en el congelador profundo de -80 °C.
7. Tinción inmunofluorescente
- Descongele los portaobjetos durante 1 h a temperatura ambiente.
- Coloque las diapositivas en un frasco deslizante horizontal y lave las secciones 3 veces en PBS durante 10 minutos cada lavado a temperatura ambiente en un agitador.
- Prepare el búfer de bloqueo (2% BSA + 0.3% Triton-X-100 en 1x PBS). Utilice aproximadamente 1 ml por diapositiva.
- Cree una cámara humidificada agregando agua al fondo. Coloque los toboganes boca arriba horizontalmente y no permita que se sequen. Agregue 1 ml de tampón de bloqueo a cada diapositiva e incube durante al menos 1 h a temperatura ambiente.
- Preparar la solución de anticuerpos primarios diluyendo el anticuerpo primario en tampón de anticuerpos (0,7% BSA + 0,3% Triton-X-100 en 1x PBS).
NOTA: Para el anticuerpo fosforilado α-sinucleína, se utilizó un factor de dilución de 1:500. - Añadir 200-300 μL de solución de anticuerpos primarios por portaobjetos. Cubra con un coverlip para dispersar el anticuerpo e incubar a 4 °C durante la noche.
- Al día siguiente, retire las diapositivas de la cámara humidificada y colóquelas en un frasco vertical de Coplin lleno de 1x PBS para permitir que la cubierta se caiga. Haga esto para cada diapositiva individualmente y tenga cuidado de no perturbar la sección de tejido al quitar el deslizamiento.
- Coloque las diapositivas en un frasco deslizante horizontal y lave las secciones 3 veces en PBS durante 10 minutos cada lavado a temperatura ambiente en un agitador.
NOTA: ¡Todos los pasos posteriores deben realizarse con las luces apagadas para evitar el fotoblanqueo del fluoróforo! - Prepare la solución de anticuerpos secundarios diluyendo el anticuerpo secundario en un tampón de anticuerpos.
NOTA: Para la detección de α-sinucleína fosforilada, se utilizó anti-conejo secundario conjugado a Alexa 488 con un factor de dilución de 1:500 en tampón de anticuerpos (0,7% BSA + 0,3% Triton-X-100 en 1x PBS). - Coloque las diapositivas horizontalmente en la cámara humidificada y agregue 200-300 μL de solución secundaria de anticuerpos por diapositiva. Cúbralo con un coverlip para dispersar el anticuerpo. Incubar a temperatura ambiente durante al menos 2 h.
- Retire las diapositivas de la cámara humidificada y colóquelas en un frasco vertical de Coplin lleno de 1x PBS para permitir que la cubierta se caiga. Haga esto para cada diapositiva individualmente y tenga cuidado de no perturbar la sección de tejido al quitar el deslizamiento.
- Coloque las diapositivas en un frasco deslizante horizontal y lave las secciones 3 veces en PBS durante 10 minutos cada lavado a temperatura ambiente en un agitador.
- Seque el lado de los toboganes en una toalla y sacuda el exceso de PBS.
- Agregue 3 gotas de medio de montaje a cada diapositiva. Agregue el lape de cubierta y empuje suavemente las burbujas con un par de fórceps presionando la hoja de cubierta antes de obtener imágenes por microscopía confocal.
Resultados
La perfusión de alta calidad está indicada por la ausencia de sangre en el hígado, la médula espinal y las estructuras profundas del SNC (Figura 4C y Figura 5G, H). La sangre retenida debajo de la duramadre (por ejemplo, dentro de los senos venosos) o entre la duramadre y el cráneo no ha sido problemática ya que esta sangre no está dentro del parénquima cerebral. La sangre observada en la Figura 4A se encuentra entre el cráneo y la materia dura y, por lo tanto, no es problemática o sugestiva de perfusión de mala calidad. El cerebro fresco y la médula espinal son bastante blandos y se dañan fácilmente durante la manipulación. Los tejidos adecuadamente fijos, en comparación, son firmes. Para evaluar la calidad del tejido y la preservación de la morfología de los tejidos mediante este método de perfusión, este trabajo demuestra la detección de α-sinucleína fosforilada en el mesencéfalo y la médula espinal lumbar de un ratón de 15 meses de edad y un ratón de 7 meses de edad que expresa A53T humano α-sinucleína (Figura 6).
La mutación A53T está sobrerrepresentada en pacientes con enfermedad de Parkinson (EP) autosómica dominante. Además, la α-sinucleína humana con la mutación A53T puede recapitular muchas de las características de la EP humana cuando se expresa en ratones 6,7. Se ha demostrado in vivo e in vitro que la fosforilación de α-sinucleína en el residuo de serina 129 induce la agregación de α-sinucleína8. Los cuerpos de Lewey son el hallazgo histológico clásico presente en pacientes con EP o demencia corporal de Lewey9. La mayoría de los α-sinucleína presentes en los cuerpos de Lewey se fosforilan en la serina 12910,11. Como resultado, la acumulación de α-sinucleína fosforilada se utiliza como marcador de la gravedad histológica de la patología de la EP. El presente estudio encuentra que la α-sinucleína fosforilada se acumula a un nivel significativamente mayor en ratones sintomáticos de 15,5 meses de edad en relación con ratones asintomáticos de 7 meses de edad que expresan A53T humano α-sinucleína. Esto es consistente con los informes que describen un enriquecimiento de la citopatología en los cuernos anteriores de la médula espinal y el mesencéfalo de estos ratones. 6 De esto se concluye que el método de perfusión simplificado descrito aquí proporciona una fijación de alta calidad de los tejidos del SNC para la caracterización histológica posterior.
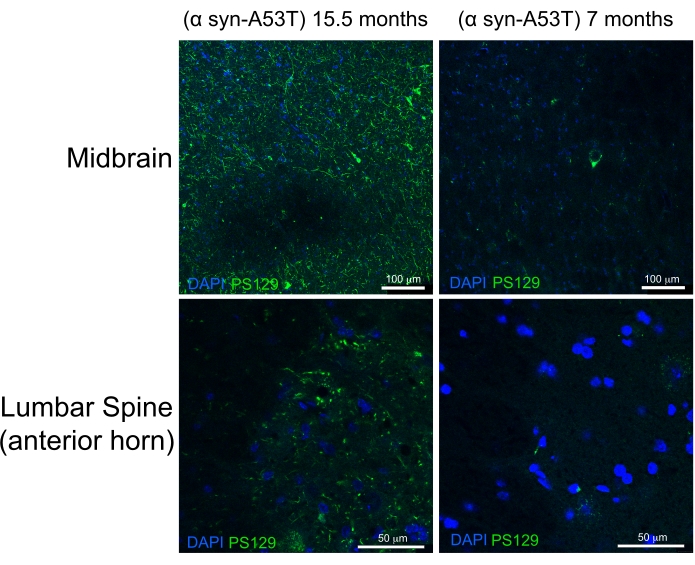
Figura 6: Etiqueta para α-sinucleína fosforilada en tejidos de la médula espinal media y lumbar de un modelo de ratón de la enfermedad de Parkinson. El ratón paralizado de etapa final envejecido (15,5 meses de edad) se compara con el ratón sano de 7 meses de edad. Ambos ratones expresan una variante mutante propensa al plegamiento incorrecto (A53T) de α-sinucleína humana que induce una patología similar al Parkinson. Barras de escala = 100 μm (paneles superiores) y 50 μm (paneles inferiores). Abreviatura: α syn-A53T = A53T mutante de α-sinucleína; DAPI = 4',6-diamidino-2-fenilindol; PS129 = serina fosforilada 129 de α-sinucleína. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este trabajo describe los pasos críticos para realizar la perfusión transcárdica. Al construir el aparato de perfusión (sección 1 del protocolo), es importante utilizar tubos que sean lo suficientemente flexibles como para estar completamente ocluidos por un hemostático. Algunos tubos rígidos pueden no estar suficientemente ocluidos por un hemostático y aún pueden permitir que el PFA se filtre en la línea principal durante la perfusión inicial de PBS. Al preparar la solución de PFA al 4%, es importante asegurarse de que el pH sea fisiológico (7.4). Como la preparación de la solución de PFA implica calentarla a 65 ° C, la solución debe enfriarse de nuevo a 25 ° C antes de medir el pH, ya que esta es la temperatura a la que se calibra el pH en el medidor.
Al realizar la incisión inicial en el abdomen, se debe tener cuidado para evitar la laceración de los órganos abdominales (protocolo sección 2). Al diseccionar superiormente hacia el diafragma, es importante evitar la laceración del hígado, ya que es común que el hígado se adhiera a la pared abdominal anterior. Para superar esto, el hígado se disecciona cuidadosa y contundentemente lejos de la pared anterior antes de continuar una incisión hacia el diafragma. Al ingresar a la cavidad torácica a través del diafragma, es importante evitar la laceración del corazón, los grandes vasos y el pulmón. Para evitar esto, la punta de la tijera se mantiene superficialmente y en un ángulo agudo con la caja torácica.
La disección inicial para exponer el corazón toma aproximadamente 2 minutos desde la incisión inicial. Se espera que durante este tiempo, algo de aire haya entrado en la punta de la aguja de la mariposa. La introducción de este aire en la circulación del ratón producirá una perfusión de mala calidad. Por lo tanto, es fundamental que la línea principal se abra y el PBS se enjuague a través de la aguja inmediatamente antes de la canulación del corazón para eliminar las burbujas de aire. Idealmente, el corazón se canula mientras que un pequeño goteo de PBS fluye a través de la punta de la aguja para garantizar la ausencia completa de aire al perforar el VI.
Cuando la aguja entra en el VI, no debe ir tan profundo como para introducir la punta de la aguja en el ventrículo derecho (RV). La colocación de la aguja en el RV o más allá de la válvula mitral dará como resultado un "inflado" inmediato de los pulmones cuando se inicie la perfusión. Esto no es deseable, y la aguja debe retirarse ligeramente para garantizar la colocación del VI. Si la aguja se coloca correctamente, los pulmones permanecerán planos durante toda la perfusión. Cuando se inicia la perfusión, a veces se observa que un líquido transparente está emergiendo de la boca abierta del animal. Esto generalmente se debe a una presión de perfusión que es demasiado alta o debido a un extravío de la aguja dentro del corazón. Los autores especulan que las presiones de perfusión elevadas resultan en la extravasación del perfusato del lecho capilar arteriolar y el flujo retrógrado de PBS a través del árbol bronquial hacia el esófago y la cavidad oral.
La presión de perfusión debe reducirse disminuyendo el nivel de PBS en la botella de PBS o bajando la altura de la botella de PBS. Alternativamente, si la aguja se coloca demasiado profundamente en el ventrículo izquierdo, puede viajar a través de la válvula mitral y administrar perfusato a la aurícula izquierda. Esto puede resultar en flujo retrógrado a través de las venas pulmonares y extravasación de perfusato en las arteriolas, como se describió anteriormente. La eliminación completa de la sangre del sistema circulatorio con PBS es especialmente importante para evitar la reticulación inducida por fijadores de los componentes sanguíneos que resulta en la oclusión de los vasos en la posterior perfusión fijadora. El aclaramiento se evalúa efectivamente mediante un cambio de color del hígado y el flujo de PBS de una incisión en la base de la cola ventral. El aclaramiento sanguíneo generalmente se completa a los 3 minutos de perfusión con PBS; sin embargo, si los signos visuales de aclaramiento ocurren en tiempos más cortos, entonces el fijador se introduce antes de los 3 minutos. No se recomiendan tiempos de aclaramiento más largos, ya que la perfusión fija retardada conduce a artefactos en la estructura fina delSNC 1.
Cuando se administra PFA, es importante controlar el nivel de solución de PFA en el frasco de PFA. Llene la botella de PFA si el nivel de PFA desciende a menos de 4 cm por encima de la boca de la botella de PFA. Una vez completada la perfusión, el aparato de perfusión debe enjuagarse bien con agua destilada. Esto es importante ya que el PFA residual en la línea principal contaminará la perfusión inicial de PBS con PFA y dará como resultado una perfusión de mala calidad. Finalmente, las agujas de mariposa de 25 G generalmente se recomiendan para ratones adultos de tamaño promedio en el rango de 20-30 g. Sin embargo, los ratones más grandes o más pequeños pueden requerir agujas de calibre ligeramente más grandes o más pequeños, además del ajuste de las botellas fijadoras para proporcionar tasas de flujo óptimas.
Para la disección del SNC y la incrustación de OCT (sección 3 del protocolo), es común que los tejidos de la médula espinal no se hundan completamente en sacarosa al 30%. Por lo tanto, estos tejidos se dejan en sacarosa durante 2 días y luego se incrustan en oct, independientemente de si se hunden o no. Al congelar los tejidos en la OCT, es posible que ciertos tejidos se agrieten cuando se colocan en 2-metilbutano enfriado. Esto es más común con el cerebro y generalmente ocurre cuando se coloca demasiada OCT en el tejido. Para evitar esto, coloque solo suficiente OCT para cubrir las superficies del tejido antes de la congelación inmediata. En algunos protocolos, el agrietamiento es menos común a pesar de la inmersión completa en oct. Esto generalmente se debe a un método de congelación más lento, como cuando se usa 2-metilbutano enfriado por hielo seco o se coloca el criomold en un bloque de hielo seco directamente. El 2-metilbutano refrigerado por nitrógeno líquido es preferido en este trabajo, ya que la tasa de congelación es sustancialmente más rápida y puede preservar mejor la morfología del tejido que los métodos de congelación más lentos.
Al crioseccionar el tejido (sección 4 del protocolo), es importante evitar múltiples ciclos de congelación-descongelación. Por lo tanto, es óptimo cortar todas las secciones de un solo bloque de OCT para obtener una región cerebral específica para el análisis en lugar de descongelar y volver a congelar áreas seleccionadas. Si esto no es viable, después de obtener algunas secciones, los usuarios pueden volver a congelar y almacenar los bloques de OCT en el congelador profundo de -80 ° C 1-2 veces más para su uso futuro.
Los principales beneficios de este método sobre la bomba más tradicional o la entrega de perfusato a presión de aire son los siguientes: (1) bajo costo y accesibilidad del aparato de perfusión. (2) Los usuarios no necesitan mantener manualmente la presión en el aparato de perfusión durante toda la perfusión. (3) Presión de perfusión más baja y más consistente que otras alternativas de bajo costo para la perfusión, como a través de la administración de jeringas. Usando la ecuación de Bernoulli, se calcula que el aparato de perfusión alimentado por gravedad construido aquí mantendrá una presión de perfusión de aproximadamente 73 mm Hg cuando las botellas de perfusato se colocan a 1 m de elevación en relación con la aguja. Dado que esto está significativamente por debajo de la presión arterial sistólica de estos animales, es probable que esta presión de perfusión sea lo suficientemente baja como para evitar la ruptura vascular12.
Hasta ahora, los autores han utilizado con éxito este sistema de perfusión para detectar la presencia de α-sinucleína fosforilada en un modelo de ratón de la enfermedad de Parkinson. Durante este tiempo, no se han encontrado limitaciones significativas con este método de perfusión que no estén presentes con un método de administración de perfusión con bomba. La principal limitación de esta técnica es la naturaleza lenta de la perfusión frente a la fijación por gotas. Esta técnica es preferible a la fijación por caída, ya que la perfusión da como resultado una penetración más profunda del fijador en las estructuras del SNC. Una segunda limitación de esta técnica es que requiere cierta habilidad quirúrgica para realizarse, ya que el corazón debe ser canulado rápidamente después de la entrada en la cavidad torácica. Sin embargo, con la experiencia, los usuarios capacitados pueden canular rutinariamente el corazón dentro de 1 minuto de la incisión inicial en el abdomen.
Divulgaciones
Los autores no declaran intereses financieros contrapuestos.
Agradecimientos
Los autores agradecen a Xiaowen Wang, Liam Coyne y Jason Grullon por su ayuda en el desarrollo de este protocolo. Este trabajo fue apoyado por las subvenciones de los NIH AG061204 y AG063499.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-Methylbutane (Certified ACS), Fisher Chemical | Fisher Scientific | 03551-4 | |
| Andwin Scientific Tissue-Tek O.C.T Compound | Fisher Scientific | NC1029572 | |
| Artman Instruments 4.5" Straight Castroveijo Spring Action Scissors | Amazon | B0752XHK2X | "fine scissors" |
| BD General Use and PrecisionGlide Hypodermic Needles, 18 G | Fisher Scientific | 14-826-5D | |
| BD General Use and PrecisionGlide Hypodermic Needles, 22 G | Fisher Scientific | 14-826B | |
| Corning PES Syringe Filters | Fisher Scientific | 09-754-29 | |
| Cytiva HyClone Phosphate Buffered Saline (PBS), 10x | Fisher Scientific | SH30258 | |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | |
| Fisher BioReagents Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | |
| Fisherbrand Curved Medium Point General Purpose Forceps | Fisher Scientific | 16-100-110 | "curved fenestrated forceps" |
| Fisherbrand Curved Very Fine Precision Tip Forceps | Fisher Scientific | 16-100-123 | "curved fine forceps" |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisher Scientific | 13-711-9AM | |
| Fisherbrand High Precision Straight Tapered Ultra Fine Point Tweezers/Forceps | Fisher Scientific | 12-000-122 | "straight fine forceps" |
| Fisherbrand Micro Spatulas with Rounded Ends | Fisher Scientific | 21-401-5 | |
| Fisherbrand Porcelain Buchner Funnels with Fixed Perforated Plates | Fisher Scientific | FB966J | |
| Fisherbrand Premium Cover Glass, 24 x 50 | Fisher Scientific | 12-548-5M | |
| Fisherbrand Premium Tissue Forceps 1X2 Teeth 5 in. German Steel | Fisher Scientific | 13-820-074 | "skin forceps" |
| Fisherbrand Reusable Heavy-Wall Filter Flasks | Fisher Scientific | FB3002000 | |
| Fisherbrand Standard Dissecting Scissors | Fisher Scientific | 08-951-20 | "dissecting scissors" |
| Fisherbrand Sterile Syringes for Single Use | Fisher Scientific | 14-955-464 | |
| Fisherbrand Straight Locking Hemostats | Fisher Scientific | 16-100-115 | |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Fisherbrand Vinyl Tubing and Connector Kits, 1/4 in. | Fisher Scientific | 14-174-1C | |
| Fisherbrand Wet-Strengthened Qualitative Filter Paper Circles | Fisher Scientific | 09-790-12F | |
| Fisherbrand Y Connector with 1/4 in. ID - Polypropylene - QC | Fisher Scientific | 01-000-686 | |
| Garvey Economy Single Edge Cutter Blade | Amazon | B001GXFAEQ | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, DyLight 488 | ThermoFisher Scientific | 35552 | |
| Ideal Clamp Stant High-Pressure Clamps | Fisher Scientific | 14-198-5A | "hose clamps" |
| IMEB, Inc Sakura Accu-Edge Low Profile Microtome Blades, Dispoisable | Fisher Scientific | NC9822467 | |
| Kawasumi 25 Gauge Standard Winged Blood Collection Set | Fisher Scientific | 22-010-137 | "butterfly needle" |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | Fisher Scientific | 06-666 | |
| Molecular Probes ProLong Diamond Antifade Mountant with DAPI | Fisher Scientific | P36962 | |
| Nalgene Narrow-Mouth Right-to-Know LDPE Wash Bottles | ThermoFisher Scientific | 2425-0506 | "buffer bottles" |
| PAP pen | abcam | ab2601 | |
| Paraformaldehyde Granular | Electron Microscopy Systems | 19210 | |
| Pyrex Glass Drying Dishes, 34.9 x 24.9 x 6 cm | Fisher Scientific | 15-242D | |
| Recombinant Anti-Alpha-synuclein (phospho S129) antibody [EP1536Y] | abcam | ab51253 | |
| Sodium Hydroxide | Sigma-Aldrich | 221465-2.5kg | |
| Stainless Steel Drinking Cup 18-oz | amazon | B0039PPO9U | |
| Sucrose for Molecular Biology CAS: 57-50-1 | Us Biological | S8010 | |
| Triton X-100 | Us Biological | T8655 | |
| Vetone Fluriso Isoflurane USP | MWI Animal Health | 502017 |
Referencias
- Tao-Cheng, J. H., Gallant, P. E., Brightman, M. W., Dosemeci, A., Reese, T. S. Structural changes at synapses after delayed perfusion fixation in different regions of the mouse brain. Journal of Comparative Neurology. 501 (5), 731-740 (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments: JoVE. (65), e3564 (2012).
- McFadden, W. C., et al. Perfusion fixation in brain banking: a systematic review. Acta Neuropathologica Communications. 7 (1), 146 (2019).
- Lamberts, R., Goldsmith, P. C. Fixation, fine structure, and immunostaining for neuropeptides: perfusion versus immersion of the neuroendocrine hypothalamus. Journal of Histochemistry and Cytochemistry. 34 (3), 389-398 (1986).
- Adickes, E. D., Folkerth, R. D., Sims, K. L. Use of perfusion fixation for improved neuropathologic examination. Archives of Pathology and Laboratory Medicine. 121 (11), 1199-1206 (1997).
- Giasson, B. I., et al. Neuronal alpha-synucleinopathy with severe movement disorder in mice expressing A53T human alpha-synuclein. Neuron. 34 (4), 521-533 (2002).
- Martin, L. J., et al. Parkinson's disease alpha-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. Journal of Neuroscience. 26 (1), 41-50 (2006).
- Fujiwara, H., et al. alpha-Synuclein is phosphorylated in synucleinopathy lesions. Nature Cell Biology. 4 (2), 160-164 (2002).
- Kalia, L. V., Lang, A. E. Parkinson's disease. Lancet. 386 (9996), 896-912 (2015).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. Journal of Biological Chemistry. 281 (40), 29739-29752 (2006).
- Kahle, P. J., et al. Hyperphosphorylation and insolubility of alpha-synuclein in transgenic mouse oligodendrocytes. EMBO Reports. 3 (6), 583-588 (2002).
- Mattson, D. L. Comparison of arterial blood pressure in different strains of mice. American Journal of Hypertension. 14, 405-408 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados