Method Article
Fare Merkezi Sinir Sisteminin Histolojik Analizi için Yerçekimi Beslemeli Transkardiyal Perfüzyon Yöntemi
Bu Makalede
Özet
Fare merkezi sinir sisteminin histolojik analizi için uygun bir yerçekimi beslemeli perfüzyon yöntemi sunulmaktadır. Fosforile α-sinükleinin immünofloresan tespiti, Parkinson hastalığının bir fare modelinde gösterilmiştir. Bu çalışma aynı zamanda transkardiyal perfüzyon, diseksiyon, doku dondurma/gömme ve dondurulmuş kesit adımlarını kapsamlı bir şekilde tanımlamaktadır.
Özet
Farelerden izole edilen beyin ve omurilik örneklerinin histolojik analizi, bu model sistemde patolojinin değerlendirilmesinde yaygın bir uygulamadır. Bu hassas dokuların morfolojisini korumak için, anestezi uygulanan hayvanlarda (transkardiyal perfüzyon) kalbin kanülasyonu yoluyla paraformaldehit gibi kimyasal bir fiksatif uygulamak rutindir. Fare kalbinin transkardiyal perfüzyonu, geleneksel olarak, bu işlem için gerekli olan hem tuzlu hem de fiksatif çözeltileri sağlamak için peristaltik pompaların veya hava basıncının kullanılmasına dayanmaktadır. Bu yöntemlere kolayca erişilebilen bir alternatif olarak, bu çalışma, çoğu donanım mağazasında bulunan malzemeleri kullanan yerçekimi beslemeli bir perfüzyon dağıtım yönteminin kullanımını göstermektedir.
Bu yeni perfüzyon yöntemini doğrulamak için, bu çalışma hem beyinde hem de omurilikte fosforile α-sinükleinin hassas tespiti için gerekli tüm sonraki adımları göstermektedir. Bu adımlara sabit beyin ve omurilik dokularının diseksiyonu, dokuların hızlı donması/gömülmesi ve kriyozeksiyonu ve immünofloresan boyama dahildir. Bu yöntem fiksatifin tüm vücuda verilmesiyle sonuçlandığından, diğer nöronal olmayan dokuları histolojik analiz için hazırlamak için de kullanılabilir.
Giriş
Fare santral sinir sisteminde (SSS) patolojinin histolojik karakterizasyonu, nörodejenerasyon çalışmalarında kullanılan rutin bir tekniktir. Nöronal dokular ölümden sonra hızla bozundukça, morfolojilerini korumak için CNS dokularına paraformaldehit gibi kimyasal bir fiksatif vermek yaygın bir uygulamadır 1,2. Kimyasal fiksasyon, fiksatif bir çözelti ile tüm vücut perfüzyonu yoluyla veya dokuların izolasyonu ve fiksatif bir çözeltiye daldırılması ("damla fiksasyonu" olarak adlandırılır) yoluyla gerçekleştirilebilir. Perfüzyon, fiksatif dağıtım için tercih edilen yöntemdir, çünkü damla fiksasyonu, fiksatif çözeltinin derin CNS yapılarına hızlı bir şekilde nüfuz etmesine izin vermeyebilir 3,4,5. Ayrıca, sabitlenmemiş omuriliğin vertebral kolondan çıkarılması zor olduğundan, fiksatif çözeltinin perfüzyon yoluyla verilmesi, omuriliğin mikroskobik ve brüt anatomisinin yerinde korunmasına izin verir ve çıkarma sırasında hasarı en aza indirmek için dokuyu sertleştirir.
Fiksasyon için gerekli tampon ve fiksatif çözeltilerin teslimatı genellikle piyasada bulunan pompalar veya hava basıncı kullanılarak gerçekleştirilir. Perfüzyonatın yerçekimi iletimi, aşağıdaki nedenlerden dolayı pompa dağıtımına alternatif olarak hizmet edebilir: (1) Pompa veya hava basıncı dağıtımı, bazı durumlarda kullanıcının perfüzyon boyunca sistemdeki basıncı manuel olarak korumasını gerektirebilir. Perfüzyonatın yerçekimi iletimi, kullanıcı müdahalesi olmadan korunabilir. (2) Yerçekimi ile verilen bir perfüzyon aparatı, standart bilimsel satıcılardan temin edilebilen malzemeler elde edilerek kullanıcıya düşük maliyetle inşa edilebilir. Bu çalışma, yıkama şişeleri ve vinil borular kullanılarak basit bir yerçekimi perfüzyon cihazının nasıl oluşturulacağını açıklamaktadır. Parkinson hastalığının bir fare modelini kullanarak, bu çalışma, bu sistemin dondurulmuş kesit için izolasyonlarından önce beyin ve omurilik dokularını perfüze etmedeki etkinliğini göstermektedir. Bu çalışma, sabit dokuyu hayvandan ayırmak, dokuyu hızla dondurmak / gömmek ve kriyoseksiyon yapmak ve dolaylı immünofloresan mikroskobu yoluyla hem beyinde hem de omurilikte fosforile α-sinüklein varlığını tespit etmek için gereken tüm adımları, teknikleri ve materyalleri kapsamlı bir şekilde tanımlamaktadır.
Protokol
Bu protokolde sunulan veriler ve deneysel adımlar C57BL/6J fareler kullanılarak oluşturulmuştur. Hayvanları içeren tüm yöntemler, New York Eyalet Üniversitesi Upstate Tıp Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır.
1. Perfüzyon aparatı ve diseksiyon platformunun yapımı
- Şekil 1'de gösterildiği gibi, iki adet 500 mL'lik yıkama şişesinden iç pipetleri, vidalı kapağın iç tarafına doğru keskin bir tıraş bıçağı ile keserek kesin. Her tampon şişesinin dibinde 4 cm x 4 cm kare bir delik kesin. Bükülmüş, paslanmaz çelik bir mikrospatulanın geçişine izin vermek için her şişenin dibinde küçük bir delik açın.
- Mikrospatulalarda "S" şeklinde bir kıvrım oluşturun, böylece tampon şişelerini asmak için kanca olarak kullanılabilirler. Bükülmüş mikrospatulaları tampon şişelerindeki uygun açıklıklara yerleştirin.
- İki adet 25 cm uzunluğundaki boruyu kesin ve bunları dış şişe saman çıkışlarına sıkıca bağlayın. Bu tüplerin uçlarını Y konektörü ile birleştirin. 2 m boru kesin ve bunu Y konektörünün serbest ucuna birleştirin.
- Pistonu 1 mL şırıngadan çıkarın ve şırıngayı şırınga ucundan yaklaşık 6 cm uzağa kesin. Şırıngayı önce plastiği bir tıraş bıçağı ile puanlayarak ve ardından şırınga plastiğini keskin bir şekilde yakalayarak kesin.
- Şırınganın kesilmiş yüzünü plastik borunun serbest ucuna yerleştirin. Sıkı bir sızdırmazlık sağlamak için yeterli derinliğe kadar takın.
NOT: Perfüzyon aparatı içindeki tüm bağlantıların sızıntıyı önlemek için yeterince sıkı olması önemlidir. Gevşek bağlantılarda, gerekirse sıkı bir sızdırmazlık sağlamak için küçük paslanmaz çelik hortum kelepçeleri bağlantı noktalarına istenildiği gibi yerleştirilebilir ve sıkılabilir. - Bir tampon şişesini PFA ve bir şişeyi PBS (tampon) olarak etiketleyin. Şişe açıklığından uzunluğun yaklaşık 1 /3'ünü ölçün ve perfüzyon çözeltilerinin uygun dolum seviyesini belirtmek için bu noktada şişe çevresinin etrafına bir çizgi çizin.
- Düzleştirin ve ardından borunun çevresine sığabilecek büyük bir ataşta bir halka oluşturun. Bu halkayı şırıngaya sadece yakın bir yerde borunun etrafına yerleştirin.
- Cam tepsiye uygun boyutta bir strafor blok yerleştirin. Boruyu yapıştırmak için ataşın uçlarını strafor bloğun içine yerleştirin.
- Kağıt havlu kullanarak, cam tepsinin ön ucunu yaklaşık 2 cm kaldırın.
NOT: Bu, diseksiyon sırasında diyaframın daha kolay görselleştirilmesini sağlamak ve perfüzyon sırasında sıvıların drenajını teşvik etmek için fareyi Trendelenburg konumunun yaklaşık 20 ° 'sine (geriye doğru eğim) yerleştirecektir.
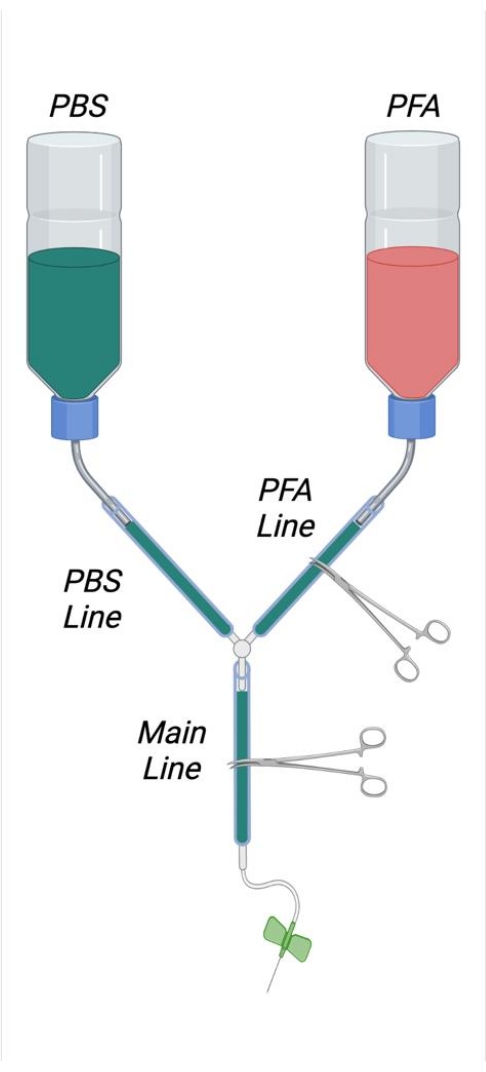
Resim 1: Birleştirilmiş perfüzyon aparatını gösteren diyagram. Kısaltmalar: PBS = fosfat tamponlu salin; PFA = paraformaldehit. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. Paraformaldehit (PFA) çözeltisinin hazırlanması
NOT: PFA çözeltisi, perfüzyon gününde taze olarak hazırlanmalı ve perfüzyonun sonunda, eğitimli personel tarafından bertaraf edilmeden önce belirlenmiş bir atık kabına atılmalıdır. Bu protokol, yaklaşık 4 fareyi perfüze etmek için yeterli olan% 4'lük PFA çözeltisinin 1 L'sini yapar. PFA oldukça toksiktir ve toz veya sıvı formda inhalasyonu veya doğrudan cilt temasını önlemek için özen gösterilmelidir. Bu nedenle çoğu hazırlık adımı eldiven, koruyucu gözlük ve duman başlığı altında laboratuvar önlüğü giyerken gerçekleştirilir.
- Damıtılmış su kullanarak 1 L'lik bir beheri durulayın ve yaklaşık 800 mL 18 mΩ moleküler-biyoloji-sınıfH2O ile doldurun.
- H2 O kabını mikrodalgada3 dakika veya su sıcaklığı 65 ° C'ye ulaşana kadar ısıtın. Bir duman davlumbazında tutulan bir ısıtma / karıştırma plakasına yerleştirin.
- Bir karıştırma çubuğunu damıtılmış suyla durulayın ve sıcak suya yerleştirin. Karıştırıcıyı çalıştırın ve sıcak plakayı orta ateşe kadar çevirin. Su sıcaklığının 70 °C'nin üzerine çıkmadığından emin olun.
- Cerrahi maske, eldiven, koruyucu gözlük ve laboratuvar önlüğü takın ve 40 g PFA tozu ölçün. Bu tozu ısıtılmış suya dökün.
- Bir transfer pipeti kullanarak, çözeltiye birkaç damla 5 M NaOH ekleyin. PFA tozunun tamamen çözünmesine izin verin. Toz birkaç dakika sonra tamamen çözülmediyse, gerektiğinde 5 M NaOH damla ekleyin.
- Neredeyse tüm PFA çözündükten sonra (hafif bulanık görünecektir), karıştırmayı / ısıtmayı durdurun ve hemen 100 mL 10x fosfat tamponlu salin (PBS) ekleyin. Son olarak, 18 mΩ moleküler-biyoloji-sınıf H2O kullanarak suyu beher üzerindeki 1 L işaretine kadar doldurun Beheri plastik ambalajla örtün ve çözelti oda sıcaklığına ulaşana kadar (yaklaşık 45 dakika) -20 ° C'lik bir dondurucuya yerleştirin.
- Uygun standartları kullanarak bir pH metreyi kalibre edin. Beher karıştırma plakası üzerindeyken, çözeltinin pH'ını ölçün ve pH 7.4'e ulaşana kadar HCl ekleyin. Gerekirse, çok düşükse pH'ı artırmak için 5 M NaOH ekleyin.
- Vakuma bir vakum şişesi bağlayın ve şişeye filtre kağıdı ile temiz bir seramik Büchner hunisi yerleştirin. Vakumu açın ve filtre kağıdını %4 PFA çözeltisiyle doldurulmuş bir transfer pipeti kullanarak ıslatın.
- %4'lük PFA çözeltisini, tüm çözelti filtrelenene kadar yavaşça filtre kağıdına dökün.
- Filtrelenmiş çözeltiyi temiz, ışık korumalı bir kaba aktarın ve kullanıma kadar 4 ° C'de saklayın (24 saatten fazla saklamayın).
3. Transkardiyal "pompasız" perfüzyon
- Duman davlumbazında, bir cam tepsiye bir Strafor diseksiyon bloğu yerleştirin. Diseksiyon bloğunun ameliyat sırasında fareyi kısıtlamak için 5-6 kısa iğneye ve perfüzyon tüpünü desteklemek için 2 uzun iğneye sahip olduğundan emin olun.
- Perfüzyon aparatını damıtılmış su kullanarak durulayın. Perfüzyon aparatını asmadan önce tüm suyun boşalmasına izin verin. Perfüzyon şişelerini, perfüze edilmiş hayvanın 1 m yukarısına asın (20-30 g'lık bir fare için).
- 18 mΩ moleküler-biyoloji-sınıfH2O ile seyreltilmiş 10x PBS kullanarak 1x PBS'lik steril olmayan bir çözelti hazırlayın.
- Şekil 2'de gösterildiği gibi, bir hemostat kullanarak perfüzyon aparatının ana hattını kelepçeleyin. PFA hattını başka bir hemostatla kelepçeleyin.
NOT: Akışı tamamen önlemek için hat başına çoklu hemostatlarla tıkanma gerekebilir. - Tampon kabını oda sıcaklığında 1x PBS ile doldurun.
- Atık tamponunu toplamak ve ana hattı tıkayan hemostatı çıkarmak için perfüzyon aparatının şırınga ucunu bir beher içine yerleştirin (Şekil 2, sol).
- PBS'nin hat boyunca akmasına izin verirken, tüpün duvarlarına kuvvetlice dokunarak sıkışmış havayı giderin.
- Tüm hava tampondan ve ana hatlardan çıkarıldıktan sonra, ana hatta bir hemostat yerleştirerek akışı engelleyin.
- Hemostatı PFA hattından çıkarın ve PFA hattındaki kabarcıklara dokunurken PBS'nin PFA şişesine kadar geriye dönük bir şekilde akmasına izin verin (Şekil 2, orta). PBS, şişenin açılmasının hemen üzerinde görülebilene kadar PBS'nin PFA hattına girmesine izin vermeye devam edin. PFA şişesine akışı durdurmak için PFA hattını bir hemostatla tıkayın.
- Kelebek infüzyon iğnesini perfüzyon şırıngasına bağlayın ve perfüzyon şırıngasından kabarcıkları çıkarmak için PBS'yi hattan yıkayın (ana hat hemostatını açarak). Ana hat hemostatını kapatın.
- PBS şişesinin şu anda yaklaşık 1/3'ünün PBS dolu olduğundan emin olun. Gerekirse, PBS'yi ana hattan yıkayın veya tam kapasitesinin 1/3'üne kadar tampon şişesine daha fazla PBS doldurun.
- Tüm kabarcıklar PBS, PFA ve ana hatlardan çıkarıldıktan sonra, PFA şişesini, şişe üzerindeki siyah işarete kadar (yaklaşık 1/3'ü dolu) oda sıcaklığında% 4 PFA çözeltisi ile doldurun (Şekil 2, sağda).
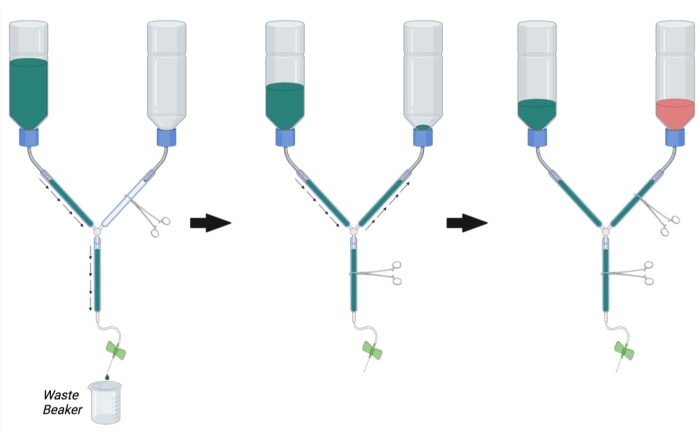
Şekil 2: Perfüzyon cerrahisi için perfüzyon aparatının hazırlanması. İlk olarak, PFA hattı hemostatını kapatın ve PBS hattındaki ve ana hattaki hemostatı açın. PBS'yi doldurun ve PBS satırından ve ana satırdan kabarcıkları kaldırın. Daha sonra, PFA hattındaki hemostatı açarak ve ana hattaki hemostatı kapatarak PFA hattını PBS ile doldurun. PFA hattındaki kabarcıkları çıkarın. Son olarak, PBS PFA şişesinin açıklığına ulaştığında PFA hattındaki hemostatı kapatın. PFA şişesini PFAile dolu 1/3 doldurun. PBS şişesindeki PBS seviyesinin 1/3'ünün dolu olduğundan emin olun ve gerekirse ana hat hemostatını açarak PBS ile doldurun veya PBS'yi boşaltın. Kısaltmalar: PBS = fosfat tamponlu salin; PFA = paraformaldehit. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Aşağıdaki aletleri su ve ardından %70 etanol ile temizleyerek hayatta kalmama ameliyatına hazırlanın: büyük makas, ince diseksiyon makasları, cilt forsepsleri, ince federe kavisli forsepsler.
- Tozsuz mendilleri 50 mL'lik bir konik tüpe yerleştirerek anesteziyi hazırlayın. Bir duman davlumbazında, tozsuz mendilleri izofluran ile iyice ıslatın ve açılan tüpü 500 mL'lik bir beherin içine baş aşağı yerleştirin. Beherin dibinde sıvı izofluran bulunmadığından emin olun ve beherin içine fare yerleştirmeden önce sıvı izofluranları atın.
- Fareyi beherin içine yerleştirin ve anesteziye başlamak için açıklığın üzerine plastik sargı yerleştirin.
- Fare nefes almayı durdurana kadar anestezi uygulayın (yaklaşık 1 dakika ve 30 sn).
- Solunum durduğunda, fareyi hemen beherden çıkarın ve 50 mL konik tüp üzerindeki kapağı değiştirin.
- Ayak parmağı kıstırma refleksini kullanarak farenin yeterince uyuşturulup uyuşturulmadığını kontrol edin. Hayvan yeterince uyuşturulmamışsa, adım 3.15'te açıklandığı gibi daha fazla izofluran uygulayın.
- Hızlı bir şekilde çalışarak, fareyi strafor bloğuna yerleştirin ve dört kısa iğne (örneğin, 22 G şırınga iğneleri) kullanarak pençeleri dışa doğru sabitleyin.
- Karın derisini deri forsepsleriyle kaldırarak, karın duvarını kesmek için büyük makas kullanın. Hiçbir karın organının kesilmediğinden emin olun!
- Karın kesimini karaciğere doğru üstün bir şekilde devam ettirin. Karaciğeri ön karın duvarından ayırın ve ilk kesiye diyaframa doğru üstün bir şekilde devam edin. Bu kesiyi diyaframdan yaklaşık 1 cm aşağıda durdurun. Karaciğerin kesilmemesine dikkat edin!
- "Y" şeklinde bir kesi yapmak için diyaframın sağ ve sol taraflarına doğru ilk insizyonu lateral olarak yukarı doğru devam ettirin (Şekil 3A).
- Kesi diyaframa ulaştığında, ince diseksiyon makasını kullanarak diyaframda bir delik açın ve hayvanın sağ tarafındaki kaburgaları kesin. Kaburgaları sağ aksillanın yaklaşık yarısına kadar kesin.
- Diyaframın sol tarafından neredeyse sol aksillaya kadar benzer fakat daha uzun bir kesi yapın.
- Göğüs duvarını yansıtın ve strafor bloğuna sabitleyin.
- Gerekirse, sol ventrikülü açığa çıkarmak için yağları kalbin etrafından disseke edin. Sol ventrikülü, sağ ventrikülle karşılaştırıldığında nispeten daha açık renge dayanarak tanımlayın.
- Sol ventrikülü tanımladıktan sonra, ince kavisli forseps ile hafif basınç kullanarak kalbi sabit tutun. PBS'nin iğneden akmasına izin vermek için ana hat hemostatını açın. Hemen sol ventrikülü delin ve iğnenin ventriküle en fazla 0,5 cm sokulmasını sağlayın. Gerekirse iğneyi hafifçe çekin.
NOT: İğnenin sol ventriküle doğru yerleştirilmesi, kanın iğne borusuna geriye doğru akışı ile gösterilir. İğnenin ventriküle çok derin yerleştirilmediğinden emin olmak önemlidir. Bu, pulmoner venlerden retrograd akışa veya interventriküler septumun delinmesine neden olabilir. - Kelebek borusunu, iki büyük 18 G iğne kullanarak strafordan yapılmış bir X üzerinde dinlendirin.
NOT: Perfüzyon sırasında kelebek iğnesinin kalp içindeki hareketini önleyeceği için bu çok önemlidir. - İnferior vena kavayı karaciğerden çıkarken tanımlayın ve ince diseksiyon makası kullanarak transekte edin (Şekil 3B). Alternatif olarak, sağ atriyumu makasla açın.
- PBS perfüzyonunun başlamasına izin vermek için hemen ana hattı açın (Şekil 3C).
- PBS'nin strafor bloğundan ve aşağıdaki cam tepsiye boşaltıldığından emin olun. Bu gerçekleşmezse, sıvıların cam tepsiye boşaltılmasına izin vermek için tepsinin veya Styrofoak bloğunun açısını yeniden ayarlayın.
- İnferior vena kavadan akan sıvı kansız olana kadar PBS perfüzyonuna devam edin (yaklaşık 3 dakika).
NOT: İğnenin kalbe uygun şekilde yerleştirilmesi, kanın karaciğerden görsel olarak temizlenmesine neden olacak ve bu da kırmızıdan saman rengine dönüşecektir. Bu gerçekleşmezse, infüzyon iğnesini sol ventrikül içinde yeniden konumlandırarak düzeltilebilir. Perfüzyon kalitesini değerlendirmek için ventral kuyruk tabanında küçük bir kesi yapılabilir. Uygun perfüzyon, kuyruk tabanı insizyonundan net PBS akmasına neden olacaktır. - Hızlı çalışarak, PBS hattını bir hemostat ile kapatın ve PFA hattını açın.
- PFA'nın kuyruk kıvrılmaya başlayana kadar birkaç dakika boyunca perfüzyona izin verin. Kuyruk kıvrılmaya başladığında, 50 dakikalık bir zamanlayıcıya başlayın. Kuyruk 5 dakikalık PFA perfüzyonundan sonra kıvrılmazsa, PFA perfüzyonu için 50 dakikalık bir zamanlayıcıya başlayın.
- Seviyenin çok düşmediğinden emin olmak için şişedeki PFA seviyesini perfüzyon boyunca sürekli olarak izleyin. Seviye şişe kapağının 2 cm'nin altına düşerse şişeye daha fazla PFA doldurun.
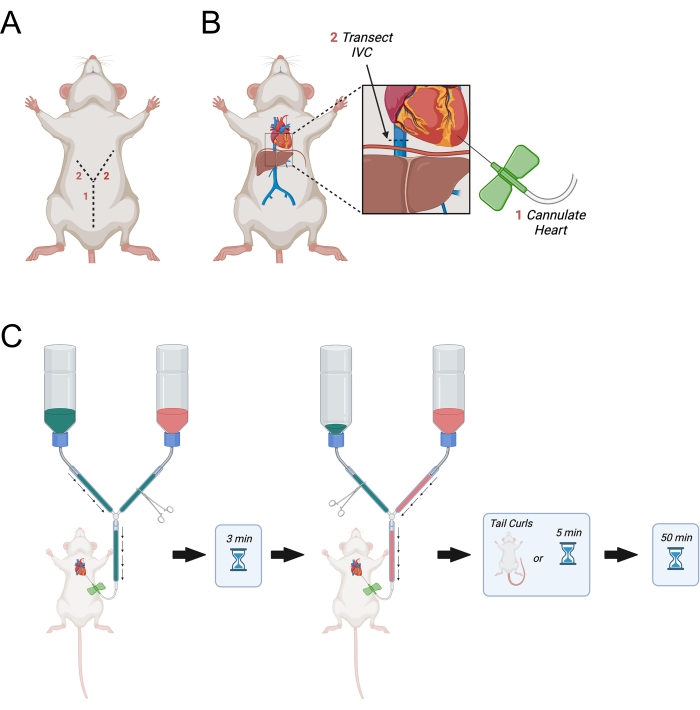
Şekil 3: Transkardiyal perfüzyonu gösteren diyagram. (A) Karın duvarı önce kesilir, ardından "Y" oluşturan aksillaya doğru yanal olarak işaret eden iki kesi yapılır. (B) Göğüs boşluğuna girdikten ve kalbi açığa çıkardıktan sonra, iğne sol ventriküle geçirilir. Daha sonra, IVC veya sağ atriyum, vücutta dolaştıktan sonra perfüzyonların drenajına izin vermek için transekte edilir. IVC, diyaframdan daha üstün kesilir. (C) Perfüzyonların uygulanmasına ilişkin prosedür. Kısaltma = IVC = inferior vena kava. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- 50 dakika geçtikten sonra, ana hattı bir hemostat ile tıkayın ve iğneyi sol ventrikülden çekin.
NOT: Bu noktada farenin tamamı serttir ve artık 4 °C'de gece boyunca% 4 PFA'lık etiketli bir kaba yerleştirilebilir. Bu aşamada, CNS dokularını diseke etmek ve bunları bir gecede fiksatif olarak ayrı ayrı yerleştirmek mümkündür. Bu çalışmada, farenin tamamı fiksatif olarak yerleştirilir, çünkü bu, 4 ° C'de sabitleme ve yerleştirme arasındaki aralığı kısaltır. Bu aynı zamanda, gece boyunca fiksasyon tamamlanmadan önce hayvanların önceden diseke edilmesi durumunda ortaya çıkabilecek sinir dokusunun olası mekanik bozulmasını da önler.
4. CNS diseksiyonu
- Aşağıdaki aletleri su ile yıkayarak ve ardından% 70 etanol ile yıkayarak diseksiyon için hazırlayın: makas, cilt forsepsleri, kavisli federe forsepsler, kavisli ince forsepsler, düz ince forsepsler, ince makaslar.
- Fare başına dört tüpü aşağıdaki gibi etiketleyin ve% 20 safroz steril ile doldurun: Fare Kimliği, Beyin 1, Fare Kimliği, Beyin 2, Fare Kimliği, Bel, Fare Kimliği, Servikal.
- Fareyi PFA çözeltisinden çıkarın ve fazla PFA'yı gidermek için bir kağıt havluyla kurulayın.
- Büyük makası kullanarak, boynundan keserek farenin başını çıkarın.
- Gövdeyi PFA çözeltisine yerleştirin. Beyni kafatasından ayırmak için kafayı tutun.
- Beyni diseke etmek için, kafatasının tamamını ortaya çıkarmak için kafatası derisini öne doğru yansıtarak başlayın (Şekil 4A).
- Kafatasına girmek için ince diseksiyon makaslarını kullanarak işitsel kanala sığ bir kesim yapın
- Bu kesimi, kafatası her iki işitsel kanal arasında kesilene kadar enine sinüs boyunca devam ettirin.
- Boyuna çatlak boyunca kafatasının en rostral kısmına (yaklaşık gözler arasında) kadar önceki kesime dik bir kesim yapın.
- Federe kavisli forsepsleri kullanarak, ön beyni ortaya çıkarmak için kafatasını yanal olarak yansıtın. Koku alma ampulleri de dahil olmak üzere tüm ön beyin açığa çıkana kadar kafatasını çıkarmaya devam edin.
- Oksipital kemikten bir kesim yaparak kafatasının kaudal bölgesini diseke etmeye başlayın ve bu kesimi foramen magnumuna doğru yavaşça devam ettirin.
- Beyincik ve beyin sapını kaudal olarak ortaya çıkarmak için iki kafatası parçasını yanal olarak yansıtın (Şekil 4B).
- Koku alma ampullerini ön kafatasından ayırmak için ultra ince kavisli forseps kullanın ve koku ampullerinden başlayarak beyni kafatası tabanından soymaya başlayın.
- Beyin kafatası tabanından soyulurken, kraniyal sinirleri kesmek ve beynin çıkarılmasına izin vermek için ultra ince forseps kullanın.
- Sağlam beynin tamamı çıkarılana kadar beyni kafatası tabanından soymaya devam edin (Şekil 4C, D).
- Sağ ve sol yarımküreleri birbirinden ayırmak için beyni uzunlamasına çatlak boyunca ikiye bölün (Şekil 4E, F).
- Bir yarımküreyi beyin 1 tüpüne ve ikinci yarımküreyi beyin 2 tüpüne yerleştirin. Bu tüpleri beyin yarımküreleri batana kadar (yaklaşık bir gecede) 4 ° C'de saklayın.
Şekil 4: Sabit beynin çıkarılması . (A) Kafatasının tepesi. (B) Kafatası içinde açıkta kalan beyin. (C) İzole beyin (dorsal yön). (D) İzole beyin (ventral açı). (E) Sol yarımküre (yanal yön). (F) Sol yarımküre (medial yön). Ölçek çubukları = 1 cm (E ve F). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Omuriliği diseke etmek için, fare gövdesini PFA'dan çıkarın ve kurulayın.
- Fareyi eğilimli pozisyonda bir Strafor diseksiyon bloğuna yerleştirin ve pençeleri dört iğne kullanarak bloğa sabitleyin.
- Diseksiyona, tüm arka tarafı ortaya çıkarmak için cildi farenin orta çizgisinden boyundan kuyruğa doğru keserek başlayın.
- Vertebral kolonun arka kısmını ortaya çıkarmak için kas ve fasyayı arkaya yansıtın.
- En kraniyal omurlardan başlayarak, omurilikten kaçınırken laminayı kesmek için ince diseksiyon makası kullanın (Şekil 5A).
- Ultra ince kavisli forsepsleri laminanın altına yerleştirin ve omuriliği açığa çıkarmak için omurları kırmak için yukarı doğru çekin (Şekil 5B).
- Kırık omurları yansıtmak ve omuriliğin en yanal bölgelerini ortaya çıkarmak için kavisli forseps kullanın.
- Ultra ince kavisli forsepsleri laminanın altına yerleştirerek ve omurları kırarak bir sonraki omurlar için bu işleme devam edin. Servikal omurganın tamamı ve torasik omurga açığa çıkana kadar omurları kırmaya devam edin (Şekil 5C).
- Bel omuriliğinin sonuna kadar omuriliği açığa çıkarmaya devam edin (Şekil 5D).
- Keskin bir tıraş bıçağı kullanarak, orta torasik omurilikten sonuna kadar kesin.
- Ultra ince kavisli forseps kullanarak, servikal omuriliği yavaşça vertebral kolondan ayırmak için spinal sinirleri omurgadan lateral olarak ve fasya anteriorundan omuriliğe aktarın.
- Omurlardan kurtulana kadar servikal omuriliği diseke etmeye devam edin (Şekil 5E). Servikal-midtorasik omuriliği servikal etiketli tüpe yerleştirin. Servikal omurilik batana kadar bu tüpü 4 ° C'de saklayın (yaklaşık bir gecede).
- Torasik omurları, 4.22 ila 4.25 arasındaki adımlarda ayrıntılı olarak açıklandığı gibi kauda equina'ya kadar kırmaya devam edin. Cauda equina açığa çıktığında, omuriliği lomber omuriliğin 1 cm altında kesmek için keskin bir tıraş bıçağı kullanın (Şekil 5F).
- Lomber omuriliği 4.26-4.27. adımlarda belirtildiği gibi omurlardan uzaklaştırın. Bel-orta kauda equina omuriliğini bel etiketli tüpe yerleştirin. Bel omuriliği batana kadar (yaklaşık gece boyunca) bu tüpü 4 ° C'de saklayın.
- Tüm dokular% 20 sakkarozda battığında, batana kadar veya 3 gün boyunca% 30 sakkarozlu etiketli tüplere aktarın.
NOT: Omurilik dokuları genellikle% 30 sakarozda batmaz.
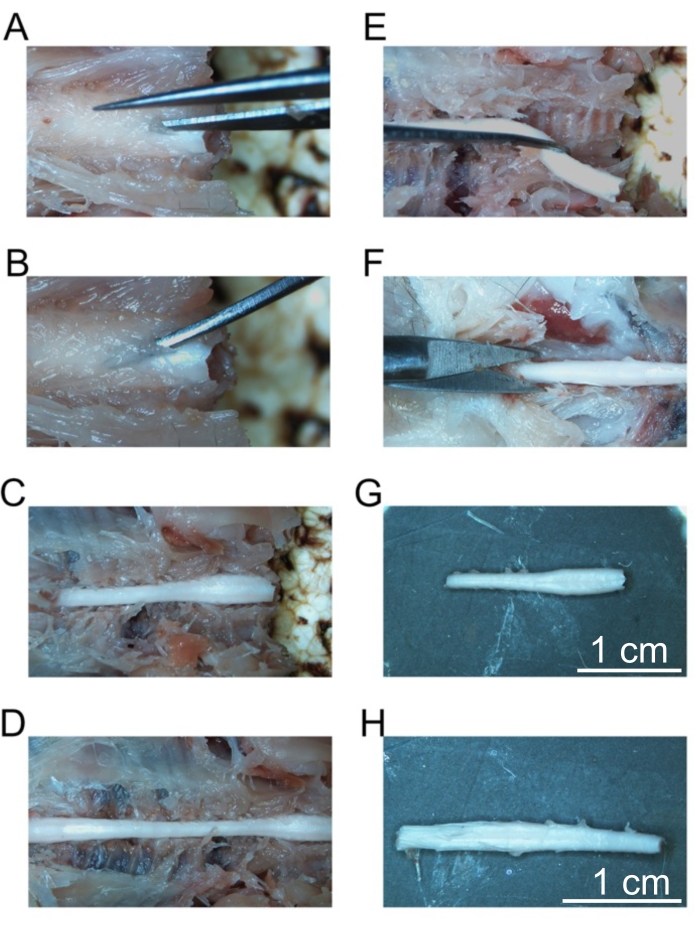
Şekil 5: Sabit omurilik segmentlerinin çıkarılması . (A) Servikal omurların laminasına ilk kesim. (B) Bireysel omurları kırmak için kavisli forsepslerin yerleştirilmesi. (C) Maruz kalan servikal omurga. (D) Maruz kalan servikal, torasik ve lomber omurga. (E) Spinal sinirler kesildikten sonra servikal omurganın çıkarılması. (F) Sakral omurganın kesilmesi. (G) İzole servikal omurga. (H) İzole lomber omurga. Ölçek çubukları = 1 cm (G ve H). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
5. OCT gömme ve doku depolama
- Her fare için dört dikdörtgen şekilli kriyokalıbı etiketleyin: Fare Kimliği, Sağ Yarımküre, Gömme tarihi; Fare Kimliği, Sol Yarımküre, Katıştırma Tarihi; Fare Kimliği , Servikal, Gömme tarihi; Fare Kimliği, Bel, Katıştırma tarihi.
- Bir strafor kabı kurun ve kabın üzerine metal bir bardak asın.
- Strafor kabını yaklaşık yarısı kadar sıvı azotla doldurun. Metal kabı yaklaşık yarısına kadar taze 2-metilbütan ile doldurun.
NOT: 2-Metilbütan toksik, oldukça uçucu ve yanıcıdır. Bir duman davlumbazında ve yanma kaynaklarından uzakta sonraki adımları uygulayarak solunmasını önlemek için özen gösterilmelidir. - Metal kabı yavaşça sıvı nitrojene indirin ve sıvı azotun metal kaba sıçramasını önleyin.
- 2-metilbütanın donmaya başlamasına izin verin. 2-Metilbütan donarken, istenen dokuyu% 30 sakkaroz çözeltisinden çıkarın ve tozsuz bir mendille kurutun.
- Dokuyu, rostral bölge kalıbın üst (etiketsiz) kısmına doğru işaret edecek şekilde bir kriyomolda yerleştirin.
- Kriyokalıptaki dokunun üzerine optimum kesme sıcaklığı gömme ortamını (OCT) idareli bir şekilde dökün, sadece dokuyu tamamen örtecek kadar kullanın. Aşırı OCT kullanmaktan kaçının, çünkü bu çatlamaya neden olabilir. OCT'deki baloncukları kaldırın.
- Dondurulmuş 2-metilbütan, metal kabın iç yüzeyini tamamen kapladığında, kriyomoldu 12 s boyunca üstteki sıvı faz 2-metilbütan'a tamamen batırın. 12 s'den sonra, cryomold'u etiketli bir alüminyum folyo karesine boşaltmak için yerleştirin ve tüm kriyomold'u sarın. Sarılmış cryomold'u hemen kuru buz üzerine yerleştirin ve çözülmekten kaçının. Dondurulmuş OCT/cryomold'un her zaman kuru buzla kaplandığından emin olun.
- Tüm dokular için 5,6 ile 5,8 arasındaki adımları yineleyin. Bir farenin mendilini kapalı küçük bir plastik torbaya ve ardından kriyo-güvenli, kapalı bir kaba yerleştirin. Bu kabı -80 °C derin dondurucuda bölümler kesilene kadar saklayın.
6. Kriyoseksiyon
- Kriyoseksiyondan önce, kriyostat odası sıcaklığının ve numune kafasının uygun ayarlara ayarlandığından emin olun.
NOT: Beyin bölümlerini kesmek için -20 °C'lik bir oda sıcaklığı, -20 °C'lik bir numune kafa sıcaklığı ve 30 μm'lik bir kesit kalınlığı kullanılır. Omurilik bölümlerini kesmek için -23 °C'lik bir oda sıcaklığı, -30 °C'lik bir numune kafa sıcaklığı ve 30 μm'lik bir kesit kalınlığı kullanılır. Kriyostat ayarlarının (özellikle numune kafa sıcaklığının) doku kalitesiyle ilgili sorunları gidermek için bölümleme sırasında ayarlanması gerekeceğine dikkat etmek önemlidir. Genel olarak, doku bulaşmasını düzeltmek için numune kafa sıcaklığı düşürülür. Tersine, aşırı doku kıvrılmasını düzeltmek için numune kafa sıcaklığı arttırılır. - İstenilen OCT bloğunu -80 °C dondurucudan çıkarın ve ambalajlanmamış kriyomold/OCT bloğunu kriyostat odasına yerleştirin.
- OCT bloğunun 30 dakika boyunca oda sıcaklığına alışmasına izin verin.
- Bir aynayı% 70 etanol ile temizleyin ve tozsuz bir mendille kurulayın. Temizlenmiş mandren kriyostat odasına yerleştirin ve ayna üzerinde bozuk para büyüklüğünde bir OCT çemberi yapın. OCT'nin donmasına izin verin (yaklaşık 1-2 dakika).
- OCT donduğunda, mandren üzerine bezelye büyüklüğünde bir taze OCT noktası yerleştirin ve hemen doku OCT bloğunu mandren üzerine yerleştirin. OCT tamamen donmadan önce dokunun mandrene mükemmel şekilde dik olduğundan emin olun.
NOT: Genel olarak, beynin en rostral bölgesi, kaudal uçtan başlayarak mandrene doğru yerleştirilir. Omurilik için, genellikle, en kaudal bölge mandren üzerine yerleştirilir, böylece kesitleme rostral uçtan başlar. - OCT sertleştiğinde, kesitleme sırasında yapısal destek görevi görmesi için OCT bloğunun tabanının etrafına daha fazla OCT yerleştirin. Bu destek hafifçe sertleştiğinde, mandren kafasına yerleştirin ve OCT bloğunun 30 dakika boyunca numune kafasının sıcaklığına ulaşmasına izin verin.
- Bıçak tutucuya bir mikrotom bıçak yerleştirin ve yuvarlanma önleyici plakayı temizleyin. Kesitleme sırasında dokunun plakanın hemen altından geçtiğinden emin olmak için antiroll plaka mesafesini ayarlayın. Antiroll plakanın doğru konumlandırılması hakkında daha fazla bilgi için, kriyostat kılavuzuna bakın.
- OCT bloğu numune kafa sıcaklığına alıştıktan sonra, dokuya ulaşana kadar OCT bloğunu kesmeye başlayın. Doku görünür olduğunda, kırpmadan kesitlemeye geçin ve 30 μm kesitleri kesmeye başlayın. Antiroll plakayı bir kenara bırakın ve mikroskop slaytı kullanarak bölümü alın.
- Kesitlerin anatomik konumundan memnun kalana veya tüm doku kesilinceye kadar kesitleri kesmeye ve toplamaya devam edin. Slaytları 1-3 gün oda sıcaklığında kurumaya bırakın. Kuruduktan sonra, slaytları bir sürgülü kutuya yerleştirin ve bu kutuyu kapalı bir plastik torbaya yerleştirin. Slaytları -80 °C derin dondurucuya yerleştirmeden önce torbayı fare kimliği ve doku bilgileriyle etiketleyin.
7. İmmünofloresan boyama
- Slaytları oda sıcaklığında 1 saat boyunca çözün.
- Slaytları yatay bir sürgü kavanozuna yerleştirin ve bölümleri PBS'de 3 kez 10 dakika boyunca yıkayın, oda sıcaklığında bir çalkalayıcı üzerinde yıkayın.
- Blokaj tamponunu hazırlayın (%2 BSA + 1x PBS'de %0,3 Triton-X-100). Slayt başına yaklaşık 1 mL kullanın.
- Tabana su ekleyerek nemlendirilmiş bir oda oluşturun. Slaytları yatay olarak yukarı bakacak şekilde yerleştirin ve kurumasına izin vermeyin. Her slayta 1 mL blokaj tamponu ekleyin ve oda sıcaklığında en az 1 saat inkübe edin.
- Birincil antikoru antikor tamponunda seyrelterek birincil antikor çözeltisi hazırlayın (1x PBS'de% 0.7 BSA +% 0.3 Triton-X-100).
NOT: Fosforile α-sinüklein antikoru için, 1:500'lük bir seyreltme faktörü kullanılmıştır. - Slayt başına 200-300 μL birincil antikor çözeltisi ekleyin. Antikoru dağıtmak ve gece boyunca 4 ° C'de inkübe etmek için bir kapak kayması ile örtün.
- Ertesi gün, slaytları nemlendirilmiş odadan çıkarın ve kapak kaymasının düşmesine izin vermek için 1x PBS ile doldurulmuş dikey bir Coplin kavanozuna yerleştirin. Bunu her slayt için ayrı ayrı yapın ve kapak kaymasını çıkarırken doku bölümünü rahatsız etmemeye dikkat edin.
- Slaytları yatay bir sürgü kavanozuna yerleştirin ve bölümleri PBS'de 3 kez 10 dakika boyunca yıkayın, oda sıcaklığında bir çalkalayıcı üzerinde yıkayın.
NOT: Floroforun fotobeyazlatılmasını önlemek için sonraki tüm adımlar ışıklar kapalıyken gerçekleştirilmelidir! - İkincil antikoru antikor tamponunda seyrelterek ikincil antikor çözeltisini hazırlayın.
NOT: Fosforile α-sinükleinin tespiti için, antikor tamponunda 1:500 seyreltme faktörü ile Alexa 488'e konjuge edilmiş anti-tavşan sekonder (1x PBS'de %0.7 BSA + %0.3 Triton-X-100) kullanılmıştır. - Slaytları nemlendirilmiş odaya yatay olarak yerleştirin ve slayt başına 200-300 μL ikincil antikor çözeltisi ekleyin. Antikoru dağıtmak için bir kapak kayması ile örtün. Oda sıcaklığında en az 2 saat inkübe edin.
- Slaytları nemlendirilmiş odadan çıkarın ve kapak kaymasının düşmesini sağlamak için 1x PBS ile doldurulmuş dikey bir Coplin kavanozuna yerleştirin. Bunu her slayt için ayrı ayrı yapın ve kapak kaymasını çıkarırken doku bölümünü rahatsız etmemeye dikkat edin.
- Slaytları yatay bir sürgü kavanozuna yerleştirin ve bölümleri PBS'de 3 kez 10 dakika boyunca yıkayın, oda sıcaklığında bir çalkalayıcı üzerinde yıkayın.
- Slaytların kenarını bir havlu üzerinde kurutun ve fazla PBS'yi sallayın.
- Her slayda 3 damla montaj ortamı ekleyin. Kapak kaymasını ekleyin ve konfokal mikroskopi ile görüntülemeden önce kapak kaymasına basarak bir çift forseps ile kabarcıkları yavaşça itin.
Sonuçlar
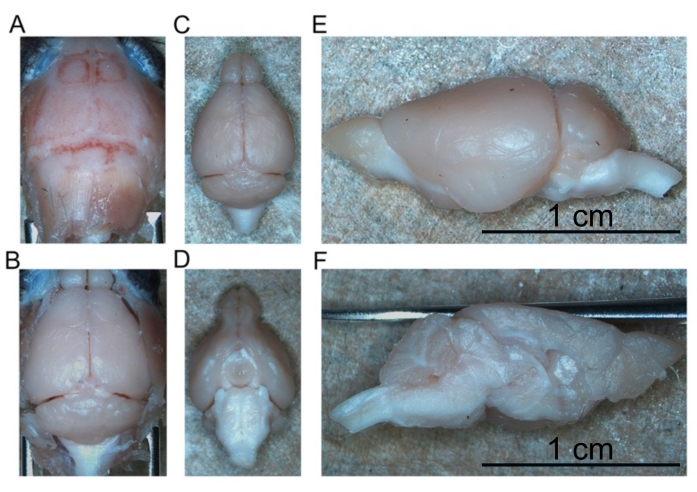
Yüksek kaliteli perfüzyon, karaciğerde, omurilikte ve derin CNS yapılarında kan yokluğu ile gösterilir (Şekil 4C ve Şekil 5G, H). Dura materin altında (örneğin, venöz sinüsler içinde) veya dura mater ile kafatası arasında tutulan kan, bu kan beyin parankimi içinde olmadığı için sorunlu olmamıştır. Şekil 4A'da görülen kan, kafatası ile dura maddesi arasında yer alır ve bu nedenle sorunlu değildir veya düşük kaliteli perfüzyonu düşündürmez. Taze beyin ve omurilik oldukça yumuşaktır ve kullanım sırasında kolayca hasar görebilir. Yeterince sabit dokular, karşılaştırıldığında, sağlamdır. Bu perfüzyon yöntemi ile doku kalitesini ve dokuların morfolojisinin korunmasını değerlendirmek için, bu çalışma 15 aylık bir farenin ve insan A53T α-sinükleini eksprese eden 7 aylık bir farenin orta beyin ve lomber omuriliğinde fosforile α-sinükleinin saptanmasını göstermektedir (Şekil 6).
A53T mutasyonu, otozomal dominant Parkinson hastalığı (PD) olan hastalarda aşırı temsil edilir. Ayrıca, A53T mutasyonuna sahip insan α-sinüklein, farelerde 6,7 olarak ifade edildiğinde insan PD'sinin birçok özelliğini özetleyebilir. Serin 129 kalıntısında α-sinükleinin fosforilasyonunun, α-sinüklein agregasyonunu indüklemek için in vivo ve in vitro olarak gösterilmiştir8. Lewey cisimleri, PD veya Lewey cisim demansı9 olan hastalarda mevcut olan klasik histolojik bulgudur. Lewey cisimlerinde bulunan α-sinükleinin çoğunluğu Serin 129 10,11'de fosforile edilir. Sonuç olarak, fosforile α-sinüklein birikimi, PD patolojisinin histolojik şiddetinin bir göstergesi olarak kullanılır. Bu çalışma, fosforile α-sinükleinin, insan A53T α-sinükleini eksprese eden 7 aylık asemptomatik farelere kıyasla 15.5 aylık semptomatik farelerde anlamlı derecede daha yüksek bir seviyede biriktiğini bulmuştur. Bu, omuriliğin ön boynuzlarında ve bu farelerin orta beyninde sitopatolojinin zenginleşmesini tanımlayan raporlarla tutarlıdır. 6 Buradan, burada tarif edilen basitleştirilmiş perfüzyon yönteminin, aşağı akış histolojik karakterizasyonu için CNS dokularının yüksek kalitede fiksasyonunu sağladığı sonucuna varılmıştır.
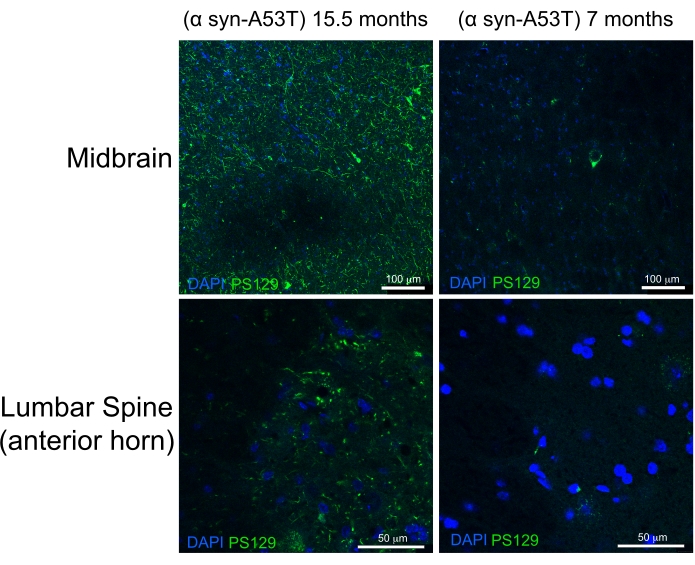
Şekil 6: Parkinson Hastalığının bir fare modelinden orta beyin ve lomber omurilik dokularında fosforile α-sinüklein etiketi. Yaşlı (15.5 aylık) son dönem felçli fare, 7 aylık sağlıklı fare ile karşılaştırılır. Her iki fare de, Parkinson benzeri patolojiyi indükleyen insan α-sinükleinin yanlış katlanmaya eğilimli bir mutant varyantını (A53T) ifade eder. Ölçek çubukları = 100 μm (üst paneller) ve 50 μm (alt paneller). Kısaltma: α syn-A53T = α-sinükleinin A53T mutantıdır; DAPI = 4',6-diamidino-2-fenilindol; PS129 = α-sinükleinin fosforile Serin 129'u. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışmada transkardiyal perfüzyon gerçekleştirmenin kritik adımları açıklanmaktadır. Perfüzyon aparatını inşa ederken (protokol bölüm 1), bir hemostat tarafından tamamen tıkanacak kadar esnek boru kullanmak önemlidir. Bazı sert borular bir hemostat tarafından yeterince tıkanmayabilir, ve ilk PBS perfüzyonu sırasında PFA'nın ana hatta sızmasına izin verebilir. % 4 PFA çözeltisini hazırlarken, pH'ın fizyolojik olduğundan emin olmak önemlidir (7.4). PFA çözeltisinin hazırlanması 65 ° C'ye ısıtılmasını gerektirdiğinden, pH'ın ölçüm cihazında kalibre edildiği sıcaklık olduğu için çözelti pH'ı ölçmeden önce 25 ° C'ye kadar soğutulmalıdır.
Karın içine ilk kesiyi yaparken, karın organlarının yırtılmasını önlemek için özen gösterilmelidir (protokol bölüm 2). Diyaframa doğru üstün diseksiyon yaparken, karaciğerin ön karın duvarına yapışması yaygın olduğu için karaciğerin yırtılmasını önlemek önemlidir. Bunun üstesinden gelmek için, karaciğer diyaframa doğru bir kesiye devam etmeden önce ön duvardan dikkatlice ve açıkça diseke edilir. Diyaframdan göğüs boşluğuna girerken, kalbin, büyük damarların ve akciğerin yırtılmasını önlemek önemlidir. Bunu önlemek için, makas ucu yüzeysel olarak ve göğüs kafesi ile keskin bir açıyla tutulur.
Kalbi açığa çıkarmak için ilk diseksiyon, ilk kesiden yaklaşık 2 dakika sürer. Bu süre zarfında kelebek iğnesinin ucuna bir miktar hava girmesi beklenir. Bu havanın farenin dolaşımına girmesi, düşük kaliteli perfüzyon sağlayacaktır. Bu nedenle, hava kabarcıklarını gidermek için ana hattın açılması ve PBS'nin kalbin kanülasyonundan hemen önce iğneden yıkanması çok önemlidir. İdeal olarak, LV'yi delerken havanın tamamen yokluğunu sağlamak için küçük bir PBS damlaması iğne ucundan akarken kalp kanüle edilir.
İğne LV'ye girdiğinde, iğne ucunu sağ ventriküle (RV) sokacak kadar derine inmemelidir. İğnenin RV'ye veya mitral kapağın ötesine yerleştirilmesi, perfüzyon başlatıldığında akciğerlerin derhal "şişmesine" neden olacaktır. Bu istenmeyen bir durumdur ve AG yerleşimini sağlamak için iğnenin hafifçe çekilmesi gerekir. İğne düzgün bir şekilde yerleştirilirse, akciğerler perfüzyon boyunca düz kalacaktır. Perfüzyon başlatıldığında, bazen hayvanın açık ağzından berrak bir sıvının çıktığı gözlenir. Bu genellikle çok yüksek bir perfüzyon basıncından veya iğnenin kalp içinde yanlış yerleştirilmesinden kaynaklanır. Yazarlar, yüksek perfüzyon basınçlarının, arteriyolar kılcal yataktan perfüzyonun ekstravazasyonuna ve PBS'nin bronşiyal ağaç yoluyla yemek borusuna ve ağız boşluğuna retrograd akışına neden olduğunu tahmin etmektedir.
Perfüzyon basıncı, PBS şişesindeki PBS seviyesini azaltarak veya PBS şişesinin yüksekliğini düşürerek düşürülmelidir. Alternatif olarak, iğne sol ventriküle çok derin yerleştirilirse, mitral kapaktan geçebilir ve sol atriyuma perfüzyon verebilir. Bu, pulmoner damarlardan retrograd akışa ve yukarıda tarif edildiği gibi arteriollere perfüzyonun ekstravazasyonuna neden olabilir. PBS ile dolaşım sisteminden kanın tamamen temizlenmesi, kan bileşenlerinin fiksatif kaynaklı çapraz bağlanmasını önlemek için özellikle önemlidir, bu da müteakip fiksatif perfüzyon üzerine damar tıkanıklığına neden olur. Gümrükleme, karaciğerin renk değişikliği ve ventral kuyruk tabanındaki bir kesiden PBS akışı ile etkili bir şekilde değerlendirilir. Kan temizliği genellikle PBS ile 3 dakikalık perfüzyon ile tamamlanır; Bununla birlikte, görsel klirens belirtileri daha kısa sürede ortaya çıkarsa, fiksatif 3 dakikadan daha erken verilir. Gecikmiş fiksatif perfüzyon CNS ince yapı1'de artefaktlara yol açtığından daha uzun boşluk süreleri önerilmez.
PFA uygulanırken, PFA şişesindeki PFA çözeltisinin seviyesini izlemek önemlidir. PFA seviyesi, PFA şişesinin ağzının 4 cm'den daha az yukarısına düşerse PFA şişesini doldurun. Perfüzyon tamamlandıktan sonra, perfüzyon aparatı damıtılmış su ile iyice durulanmalıdır. Ana hattaki artık PFA, ilk PBS perfüzyonunu PFA ile kirleteceği ve düşük kaliteli perfüzyona neden olacağı için bu önemlidir. Son olarak, 20-30 g aralığındaki ortalama büyüklükteki yetişkin fareler için genellikle 25 G kelebek iğneleri önerilir. Bununla birlikte, daha büyük veya daha küçük fareler, optimum akış hızları sağlamak için fiksatif şişelerin ayarlanmasına ek olarak biraz daha büyük veya daha küçük gösterge iğneleri gerektirebilir.
CNS diseksiyonu ve OCT gömme (protokol bölüm 3) için, omurilik dokularının% 30 sakarozda tamamen batmaması yaygındır. Bu nedenle bu dokular 2 gün boyunca sakkarozda bırakılır ve daha sonra batıp batmadıklarına bakılmaksızın OCT'ye gömülür. OKT'de dokuları dondururken, soğutulmuş 2-metilbütan içine yerleştirildiğinde bazı dokuların çatlaması mümkündür. Bu beyinde daha yaygındır ve genellikle dokuya çok fazla OCT yerleştirildiğinde ortaya çıkar. Bunu önlemek için, hemen donmadan önce doku yüzeylerini örtmek için yeterli OCT yerleştirin. Bazı protokollerde, OCT'ye tamamen daldırılmasına rağmen çatlama daha az yaygındır. Bu genellikle kuru buz soğutmalı 2-metilbütan kullanırken veya cryomold'u doğrudan bir kuru buz bloğuna yerleştirirken olduğu gibi daha yavaş bir dondurma yönteminden kaynaklanmaktadır. Sıvı-azot soğutmalı 2-metilbütan bu çalışmada tercih edilir, çünkü donma hızı önemli ölçüde daha hızlıdır ve doku morfolojisini daha yavaş dondurma yöntemlerinden daha iyi koruyabilir.
Dokuyu kriyoseksiyon yaparken (protokol bölüm 4), çoklu donma-çözülme döngülerinden kaçınmak önemlidir. Bu nedenle, seçilen alanları çözmek ve yeniden dondurmak yerine, analiz için belirli bir beyin bölgesi elde etmek için tüm bölümleri tek bir OCT bloğundan kesmek en uygunudur. Bu uygun değilse, birkaç bölüm elde ettikten sonra, kullanıcılar OCT bloklarını yeniden dondurabilir ve gelecekte kullanmak üzere -80 °C derin dondurucuda 1-2 kez daha saklayabilirler.
Bu yöntemin daha geleneksel pompa veya perfüzyonatın hava basıncı dağıtımına göre başlıca faydaları şunlardır: (1) perfüzyon cihazının düşük maliyeti ve erişilebilirliği. (2) Kullanıcıların perfüzyon boyunca perfüzyon aparatındaki basıncı manuel olarak korumaları gerekmez. (3) Şırınga dağıtımı gibi perfüzyon için diğer düşük maliyetli alternatiflerden daha düşük ve daha tutarlı perfüzyon basıncı. Bernoulli denklemi kullanılarak, burada inşa edilen yerçekimi beslemeli perfüzyon aparatının, perfüzyon şişeleri iğneye göre 1 m yüksekliğe yerleştirildiğinde yaklaşık 73 mm Hg'lik bir perfüzyon basıncını koruyacağı hesaplanmıştır. Bunun, bu hayvanların sistolik kan basıncının önemli ölçüde altında olduğu göz önüne alındığında, bu perfüzyon basıncı muhtemelen vasküler rüptürü önlemek için yeterince düşüktür12.
Yazarlar şimdiye kadar Parkinson hastalığının bir fare modelinde fosforile α-sinükleinin varlığını tespit etmek için bu perfüzyon sistemini başarıyla kullandılar. Bu süre zarfında, bu perfüzyon yönteminde, pompa perfüzyon dağıtım yönteminde bulunmayan önemli sınırlamalarla karşılaşılmamıştır. Bu tekniğin en büyük sınırlaması, damla fiksasyonuna karşı perfüzyonun zaman alıcı doğasıdır. Bu teknik, perfüzyonun fiksatın CNS yapılarına daha derin nüfuz etmesine neden olduğu için fiksasyonu düşürmek için tercih edilir. Bu tekniğin ikinci bir sınırlaması, kalbin göğüs boşluğuna girdikten sonra hızlı bir şekilde kanüle edilmesi gerektiğinden, gerçekleştirilmesi için bazı cerrahi beceriler gerektirmesidir. Bununla birlikte, tecrübeyle, eğitimli kullanıcılar kalbi karın içine ilk kesiden sonraki 1 dakika içinde rutin olarak kanüle edebilir.
Açıklamalar
Yazarlar rakip finansal çıkarlar olmadığını beyan ederler.
Teşekkürler
Yazarlar, bu protokolün geliştirilmesindeki yardımları için Xiaowen Wang, Liam Coyne ve Jason Grullon'a teşekkür ediyor. Bu çalışma NIH hibeleri AG061204 ve AG063499 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-Methylbutane (Certified ACS), Fisher Chemical | Fisher Scientific | 03551-4 | |
| Andwin Scientific Tissue-Tek O.C.T Compound | Fisher Scientific | NC1029572 | |
| Artman Instruments 4.5" Straight Castroveijo Spring Action Scissors | Amazon | B0752XHK2X | "fine scissors" |
| BD General Use and PrecisionGlide Hypodermic Needles, 18 G | Fisher Scientific | 14-826-5D | |
| BD General Use and PrecisionGlide Hypodermic Needles, 22 G | Fisher Scientific | 14-826B | |
| Corning PES Syringe Filters | Fisher Scientific | 09-754-29 | |
| Cytiva HyClone Phosphate Buffered Saline (PBS), 10x | Fisher Scientific | SH30258 | |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | |
| Fisher BioReagents Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | |
| Fisherbrand Curved Medium Point General Purpose Forceps | Fisher Scientific | 16-100-110 | "curved fenestrated forceps" |
| Fisherbrand Curved Very Fine Precision Tip Forceps | Fisher Scientific | 16-100-123 | "curved fine forceps" |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisher Scientific | 13-711-9AM | |
| Fisherbrand High Precision Straight Tapered Ultra Fine Point Tweezers/Forceps | Fisher Scientific | 12-000-122 | "straight fine forceps" |
| Fisherbrand Micro Spatulas with Rounded Ends | Fisher Scientific | 21-401-5 | |
| Fisherbrand Porcelain Buchner Funnels with Fixed Perforated Plates | Fisher Scientific | FB966J | |
| Fisherbrand Premium Cover Glass, 24 x 50 | Fisher Scientific | 12-548-5M | |
| Fisherbrand Premium Tissue Forceps 1X2 Teeth 5 in. German Steel | Fisher Scientific | 13-820-074 | "skin forceps" |
| Fisherbrand Reusable Heavy-Wall Filter Flasks | Fisher Scientific | FB3002000 | |
| Fisherbrand Standard Dissecting Scissors | Fisher Scientific | 08-951-20 | "dissecting scissors" |
| Fisherbrand Sterile Syringes for Single Use | Fisher Scientific | 14-955-464 | |
| Fisherbrand Straight Locking Hemostats | Fisher Scientific | 16-100-115 | |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Fisherbrand Vinyl Tubing and Connector Kits, 1/4 in. | Fisher Scientific | 14-174-1C | |
| Fisherbrand Wet-Strengthened Qualitative Filter Paper Circles | Fisher Scientific | 09-790-12F | |
| Fisherbrand Y Connector with 1/4 in. ID - Polypropylene - QC | Fisher Scientific | 01-000-686 | |
| Garvey Economy Single Edge Cutter Blade | Amazon | B001GXFAEQ | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, DyLight 488 | ThermoFisher Scientific | 35552 | |
| Ideal Clamp Stant High-Pressure Clamps | Fisher Scientific | 14-198-5A | "hose clamps" |
| IMEB, Inc Sakura Accu-Edge Low Profile Microtome Blades, Dispoisable | Fisher Scientific | NC9822467 | |
| Kawasumi 25 Gauge Standard Winged Blood Collection Set | Fisher Scientific | 22-010-137 | "butterfly needle" |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | Fisher Scientific | 06-666 | |
| Molecular Probes ProLong Diamond Antifade Mountant with DAPI | Fisher Scientific | P36962 | |
| Nalgene Narrow-Mouth Right-to-Know LDPE Wash Bottles | ThermoFisher Scientific | 2425-0506 | "buffer bottles" |
| PAP pen | abcam | ab2601 | |
| Paraformaldehyde Granular | Electron Microscopy Systems | 19210 | |
| Pyrex Glass Drying Dishes, 34.9 x 24.9 x 6 cm | Fisher Scientific | 15-242D | |
| Recombinant Anti-Alpha-synuclein (phospho S129) antibody [EP1536Y] | abcam | ab51253 | |
| Sodium Hydroxide | Sigma-Aldrich | 221465-2.5kg | |
| Stainless Steel Drinking Cup 18-oz | amazon | B0039PPO9U | |
| Sucrose for Molecular Biology CAS: 57-50-1 | Us Biological | S8010 | |
| Triton X-100 | Us Biological | T8655 | |
| Vetone Fluriso Isoflurane USP | MWI Animal Health | 502017 |
Referanslar
- Tao-Cheng, J. H., Gallant, P. E., Brightman, M. W., Dosemeci, A., Reese, T. S. Structural changes at synapses after delayed perfusion fixation in different regions of the mouse brain. Journal of Comparative Neurology. 501 (5), 731-740 (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments: JoVE. (65), e3564 (2012).
- McFadden, W. C., et al. Perfusion fixation in brain banking: a systematic review. Acta Neuropathologica Communications. 7 (1), 146 (2019).
- Lamberts, R., Goldsmith, P. C. Fixation, fine structure, and immunostaining for neuropeptides: perfusion versus immersion of the neuroendocrine hypothalamus. Journal of Histochemistry and Cytochemistry. 34 (3), 389-398 (1986).
- Adickes, E. D., Folkerth, R. D., Sims, K. L. Use of perfusion fixation for improved neuropathologic examination. Archives of Pathology and Laboratory Medicine. 121 (11), 1199-1206 (1997).
- Giasson, B. I., et al. Neuronal alpha-synucleinopathy with severe movement disorder in mice expressing A53T human alpha-synuclein. Neuron. 34 (4), 521-533 (2002).
- Martin, L. J., et al. Parkinson's disease alpha-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. Journal of Neuroscience. 26 (1), 41-50 (2006).
- Fujiwara, H., et al. alpha-Synuclein is phosphorylated in synucleinopathy lesions. Nature Cell Biology. 4 (2), 160-164 (2002).
- Kalia, L. V., Lang, A. E. Parkinson's disease. Lancet. 386 (9996), 896-912 (2015).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. Journal of Biological Chemistry. 281 (40), 29739-29752 (2006).
- Kahle, P. J., et al. Hyperphosphorylation and insolubility of alpha-synuclein in transgenic mouse oligodendrocytes. EMBO Reports. 3 (6), 583-588 (2002).
- Mattson, D. L. Comparison of arterial blood pressure in different strains of mice. American Journal of Hypertension. 14, 405-408 (2001).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır