Method Article
マウス中枢神経系の組織学的解析のための重力供給経心筋灌流法
要約
マウス中枢神経系の組織学的分析のための便利な重力供給灌流法が提示される。リン酸化α-シヌクレインの免疫蛍光検出は、パーキンソン病のマウスモデルにおいて実証されている。この研究はまた、経心経灌流、解剖、組織凍結/埋め込み、および凍結切片化ステップを包括的に記述している。
要約
マウスから単離された脳および脊髄標本の組織学的解析は、このモデル系における病理の評価のための一般的な慣行である。これらの繊細な組織の形態を維持するために、麻酔動物における心臓のカニューレ(経心経心灌流)を介してパラホルムアルデヒドなどの化学固定剤を投与することが日常的である。マウス心臓の経心経灌流は、伝統的に、このプロセスに必要な生理食塩水および固定液の両方を提供するために、蠕動ポンプまたは空気圧の使用に依存してきた。これらの方法に代わる容易にアクセスできる代替手段として、この研究は、ほとんどのハードウェア店で入手可能な材料を使用する重力供給式灌流送達方法の使用を実証する。
この新しい灌流法を検証するために、この研究は、脳と脊髄の両方におけるリン酸化α-シヌクレインの高感度検出に必要なすべての後続のステップを実証する。これらのステップには、固定された脳および脊髄組織の解剖、組織の急速凍結/埋め込みおよび凍結切除、および免疫蛍光染色が含まれる。この方法は、固定液の全身送達をもたらすように、組織学的分析のために他の非ニューロン組織を調製するためにも使用され得る。
概要
マウス中枢神経系(CNS)における病理の組織学的特徴付けは、神経変性の研究に使用される日常的な技術である。ニューロン組織は死後急速に分解するため、パラホルムアルデヒドなどの化学固定剤をCNS組織に送達してその形態を保存するのが一般的である1,2。化学固定は、固定液による全身灌流、または組織の単離および固定液への浸漬(「滴固定」と呼ばれる)のいずれかによって行うことができる。灌流は固定液送達の好ましい方法であり、滴下固定は深部CNS構造3、4、5への固定液の迅速な浸透を可能にしない可能性がある。さらに、椎骨柱から未固定の脊髄を除去することは困難であるため、灌流による固定液の送達は、脊髄の顕微鏡的および肉眼的解剖学のin situ保存を可能にし、組織を硬化させて除去中の損傷を最小限に抑える。
固定に必要な緩衝液および固定液の送達は、一般に、市販のポンプまたは空気圧を用いて行われる。灌流液の重力送達は、以下の理由により、ポンプ送達の代替として役立ち得る:(1)ポンプまたは空気圧送達は、場合によっては、灌流全体を通してシステム内の圧力を手動で維持することを必要とする場合がある。灌流液の重力送達は、ユーザの介入なしに維持することができる。(2)重力式灌流装置は、標準的な科学ベンダーから入手可能な材料を入手することにより、ユーザに低コストで構築することができる。本研究は、洗浄瓶とビニール管を用いた単純な重力灌流装置の構築方法を解説する。この研究は、パーキンソン病のマウスモデルを用いて、凍結切片化のために単離する前に脳および脊髄組織を灌流する上でのこのシステムの有効性を実証した。この研究は、動物から固定組織を解剖し、組織を急速に凍結/埋め込みおよび凍結切除し、間接免疫蛍光顕微鏡を介して脳と脊髄の両方におけるリン酸化α-シヌクレインの存在を検出するために必要なすべてのステップ、技術、および材料を包括的に記述している。
プロトコル
このプロトコルで提示されたデータおよび実験ステップは、C57BL/6Jマウスを用いて生成された。動物を含むすべての方法は、ニューヨーク州立大学アップステート医科大学施設動物ケアおよび使用委員会によって承認されました。
1. 灌流装置及び解剖プラットフォームの構築
- 図 1 に示すように、2 本の 500 mL 洗浄ボトルから内側のストローをトリミングし、これらのフラッシュを鋭利なカミソリの刃でねじ込み式キャップの内側に切断します。各バッファーボトルの底に4 cm x 4 cmの正方形の穴を開けます。各ボトルの底に小さな穴を開けて、曲がったステンレス製のマイクロヘラを通過できるようにします。
- 微小ヘラに「S」字型の曲がり角を作り、バッファーボトルを吊るすためのフックとして使用できるようにします。曲がった微小ヘラをバッファーボトルの適切な開口部に挿入します。
- 長さ25cmのチューブを2本切断し、外側のボトルストローコンセントにしっかりと接続します。これらのチューブの端をYコネクタと結合します。2 m のチューブを切断し、これを Y コネクタの自由端に結合します。
- 1 mLシリンジからプランジャーを取り外し、シリンジ先端から約6cm離してシリンジを切断する。最初にカミソリの刃でプラスチックを採点し、次にシリンジプラスチックを鋭くカチッと鳴らして、シリンジを切断します。
- シリンジの切断面をプラスチックチューブの自由端に挿入します。しっかりとしたシールを確保するために十分な深さまで挿入してください。
メモ:灌流装置内のすべての接続は、漏れを避けるために十分にきつくすることが重要です。緩い接続の場合、必要に応じて、小さなステンレス鋼ホースクランプを配置してジャンクションに締め付け、必要に応じてタイトなシールを確保することができます。 - 1 本のバッファー・ボトル を PFA としてラベル付けし、1 本のボトルを PBS (バッファー) としてラベル付けします。ボトルの開口部から約1/3の長さを測定し、この時点でボトルの円 周の周りに線を引き、灌流液溶液の適切な充填レベルを示します。
- まっすぐにしてから、チューブの円周に収まる大きなペーパークリップにループを作成します。このループをシリンジのすぐ近位のチューブの周りに配置します。
- 適切なサイズの発泡スチロールブロックをガラストレイに入れます。ペーパークリップの端を発泡スチロールブロックに入れてチューブを固定します。
- ペーパータオルを使用して、ガラストレイの前端を約2cm持ち上げます。
注:これにより、マウスをトレンデレンブルクの位置(後方傾き)の約20°に配置して、解剖中のダイヤフラムの視覚化を容易にし、灌流中の液体の排水を促進します。
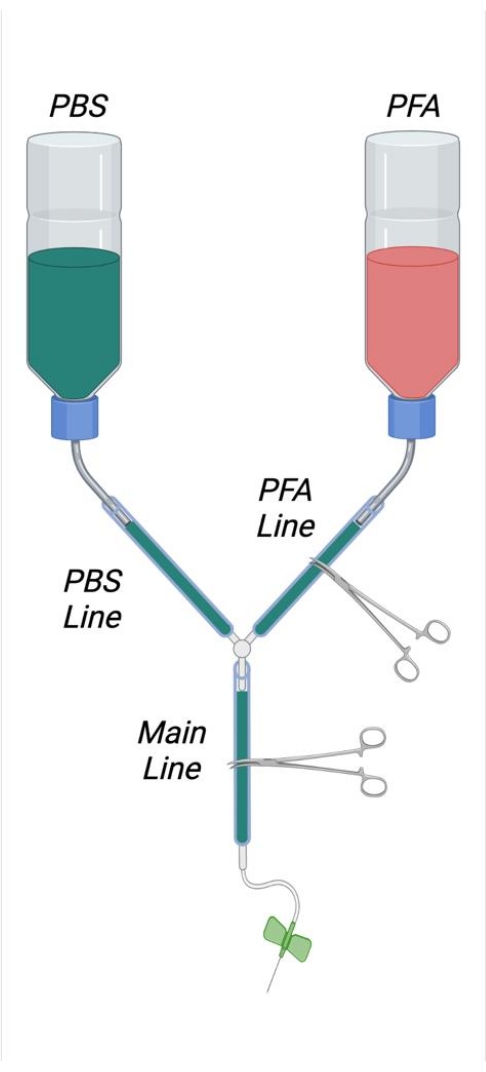
図1:組み立てられた灌流装置を描いた図。 略語: PBS = リン酸緩衝生理食塩水;PFA = パラホルムアルデヒド。 この図の拡大版を表示するには、ここをクリックしてください。
パラホルムアルデヒド(PFA)溶液の調製
注:PFA溶液は、灌流当日に新鮮に調製し、訓練を受けた人員による処分の前に、指定された廃棄物容器内の灌流の終わりに廃棄されなければならない。このプロトコルは、約4匹のマウスを灌流するのに十分である1Lの4%PFA溶液を作る。PFAは非常に毒性が高く、粉末または液体の形態のいずれかで吸入または直接皮膚接触を避けるために注意が必要である。したがって、ほとんどの準備ステップは、手袋、保護ゴーグル、およびヒュームフードの下に白衣を着用しながら行われます。
- 蒸留水を使用して1 Lビーカーをすすぎ、約800 mLの18 mΩ分子生物学グレードのH2Oで満たします。
- H2Oのビーカーをマイクロ波で3分間、または水温が65°Cに達するまで加熱する。 ヒュームフードに保管された加熱/攪拌プレートの上に置きます。
- 攪拌棒を蒸留水ですすぎ、お湯に入れます。スターラーを起動し、ホットプレートを中火に回します。水温が70°C (78 °F) を超えていないことを確認してください。
- サージカルマスク、手袋、保護ゴーグル、白衣を着用し、PFA粉末40gを測定します。この粉末を加熱した水に注ぎます。
- トランスファーピペットを用いて、溶液に数滴の5 M NaOHを加える。PFA粉末を完全に溶解させる。数分後に粉末が完全に溶解しない場合は、必要に応じて5 M NaOHの滴を加える。
- ほぼすべてのPFAが溶解したら(わずかに濁って見える)、攪拌/加熱を停止し、直ちに100mLの10倍リン酸緩衝生理食塩水(PBS)を加える。最後に、18 mΩ 分子生物学グレードのH2Oを使用してビーカーの 1 L マークまで水を補充します。ビーカーをプラスチックラップで覆い、溶液が室温に達するまで -20 °C の冷凍庫に入れます (約 45 分)。
- 適切な標準を使用して pH メーターを校正します。ビーカーを攪拌プレート上に置いた状態で、溶液のpHを測定し、pHが7.4に達するまでHClを加える。必要に応じて、5 M NaOHを加えて、低すぎる場合はpHを上げます。
- 真空フラスコを真空に接続し、フラスコにろ紙を入れたクリーンセラミックビューヒナー漏斗を置きます。真空をオンにし、4%PFA溶液を充填したトランスファーピペットを用いてろ紙を濡らした。
- すべての溶液がろ過されるまで、4%PFA溶液をろ紙にゆっくりと注ぎます。
- ろ過した溶液を清潔で光で保護された容器に移し、使用時まで4°Cで保管します(24時間以内で保管してください)。
3. 経心筋「ポンプフリー」灌流
- ヒュームフードに、発泡スチロール解剖ブロックをガラストレイに入れます。解剖ブロックに、手術中にマウスを拘束するための5〜6本の短い針と、灌流チューブを支持するための2本の長い針があることを確認してください。
- 蒸留水を用いて灌流装置をすすいでください。灌流装置を吊るす前に、すべての水を排水してください。灌流ボトルを灌流動物(20〜30gマウスの場合)の上に1m吊るす。
- 18mΩ分子生物学グレードのH2Oで希釈した10x PBSを使用して、1x PBSの非滅菌溶液を調製する。
- 図2に示すように、止血装置を用いて灌流装置の主線路をクランプする。PFAラインを別の止血剤でクランプします。
注:流れを完全に防ぐために、ラインごとに複数の止血剤による閉塞が必要な場合があります。 - バッファー容器に室温で 1x PBS を充填します。
- 灌流装置のシリンジ端部をビーカーに入れて廃液バッファーを回収し、主線を塞いでいる止血剤を除去します(図2、左)。
- PBSがラインを流れるようにしながら、チューブの壁を激しく叩いて閉じ込められた空気を除去します。
- バッファとメインラインからすべての空気が取り除かれたら、メインラインにヘモスタットを配置して流れを遮断します。
- PFAラインからヘモスタットを取り外し、PFAライン内の気泡を叩き出しながら、PBSをPFAボトルまで逆行的に流します(図2、中央)。PBSがボトルの開口部のすぐ上に見えるまで、PBSをPFAラインに入れ続けます。PFAラインを止血剤で包み込み、PFAボトルへの流れを止めます。
- バタフライ注入針を灌流シリンジに接続し、ラインを通してPBSをフラッシュし(メインライン止血剤を開くことによって)、灌流シリンジから気泡を除去する。メインラインの止血剤を閉じます。
- PBS ボトルが PBSで約 1/3 いっぱいになっていることを確認します。必要に応じて、PBS をメイン ラインからフラッシュするか、最大容量の 1 /3 までバッファー ボトルに PBS をさらに充填します。
- PBS、PFA、およびメインラインからすべての気泡を除去したら、PFAボトルに4%PFA溶液を室温で充填し、ボトルの黒いマーク(約1/3が いっぱい)まで充填します(図2、右)。
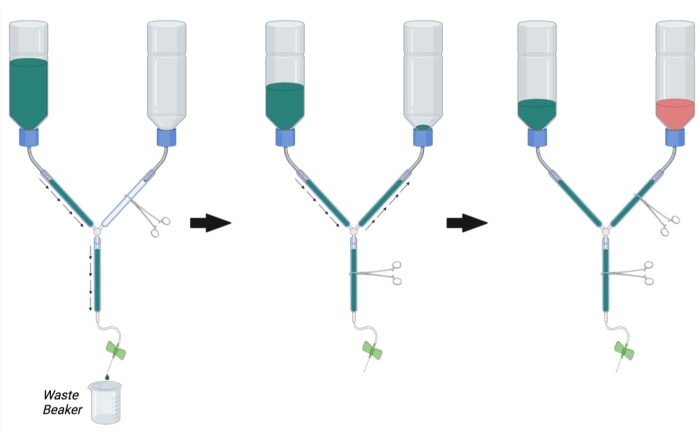
図2:灌流手術用灌流装置の準備。 まず、PFAラインのヘモスタットを閉じ、PBSラインとメインラインのヘモスタットを開きます。PBSを満たし、PBSラインとメインラインから気泡を除去します。次に、PFAラインのヘモスタットを開き、メインラインのヘモスタットを閉じて、PFAラインをPBSで満たします。PFA ラインの気泡を除去します。最後に、PBSがPFAボトルの開口部に達したら、PFAライン上の止血剤を閉じます。PFAボトルを1/3rd にPFAでいっぱいに充填します。PBSボトル内のPBSのレベルが1/3に満杯 であることを確認し、PBSで満たすか、必要に応じてメインラインヘモスタットを開いてPBSを排出します。略語: PBS = リン酸緩衝生理食塩水;PFA = パラホルムアルデヒド。 この図の拡大版を表示するには、ここをクリックしてください。
- 次の器具を水で洗浄し、続いて70%エタノールで洗浄して、非生存手術の準備をします:大きなはさみ、細かい解剖はさみ、皮膚鉗子、細かい窓ガラス張りの湾曲した鉗子。
- ほこりのないワイプを50mLの円錐形のチューブに入れて麻酔を準備します。ヒュームフードに、ほこりのないワイプをイソフルランで十分に浸し、開いたチューブを逆さまに500 mLビーカーに入れます。ビーカーの底部に液体イソフルランが存在しないことを確認し、ビーカーにマウスを置く前に液体イソフルランを捨てます。
- マウスをビーカーに入れ、開口部にプラスチックラップを置いて麻酔を開始します。
- マウスが呼吸を停止するまで麻酔を投与する(約1分30秒)。
- 呼吸が止まったら、直ちにビーカーからマウスを取り外し、50mLの円錐形チューブのキャップを交換してください。
- つま先のピンチ反射を使用して、マウスが十分に麻酔されていることを確認してください。動物が十分に麻酔されていない場合は、ステップ3.15に記載されるように、より多くのイソフルランを投与する。
- すばやく作業し、マウスを発泡スチロールブロックの上に置き、4本の短い針(22Gシリンジ針など)を使用して足を外側に固定します。
- 皮膚鉗子で腹部皮膚を持ち上げ、大きなはさみを使って腹壁を切り裂きます。腹部の臓器が切断されていないことを確認してください!
- 肝臓に向かって優れて腹部の切断を続けます。肝臓を前腹壁から切り離し、横隔膜に向かって初期切開を優れて続ける。この切開部を横隔膜より約1cm下方に止める。肝臓が切られないように注意してください!
- ダイヤフラムの左右に向かって横方向に最初の切開を続け、「Y」字型の切開部を作成します(図3A)。
- 切開部が横隔膜に達したら、細かい解剖ハサミを使用して横隔膜に穴を開け、動物の右側の肋骨を切り裂きます。肋骨を右腋窩の約半分に切る。
- 横隔膜の左側を通って左腋窩までほぼ完全に類似しているが長い切開を行う。
- 胸壁を反射し、発泡スチロールブロックに固定します。
- 必要に応じて、心臓の周りから脂肪を解剖して左心室を露出させます。右心室と比較した場合、比較的明るい色に基づいて左心室を識別します。
- 左心室を特定した後、細かい湾曲した鉗子で軽い圧力を使用して心臓をしっかりと保持します。メインラインの止血剤を開いて、PBSが針を流れるようにします。すぐに左心室を突き刺し、針が心室に0.5cm以下挿入されていることを確認してください。必要に応じて針を少し引き抜きます。
注:左心室への針の正確な配置は、針チューブへの血液の逆行性流によって示される。針が心室に深く挿入されすぎないようにすることが重要です。これは、肺静脈を通る逆行性の流れまたは脳室間中隔を穿刺する結果となり得る。 - 2本の大きな18G針を使用して発泡スチロールで作られた X の上にバタフライチューブを休ませます。
注:灌流中に心臓内の蝶の針の動きを避けるため、これは重要です。 - 肝臓から出る下大静脈を特定し、細かい解剖ハサミを使用してトランセクトします(図3B)。または、はさみで右心房を開きます。
- すぐにメインラインを開き、PBS灌流を開始できるようにします(図3C)。
- PBSが発泡スチロールブロックから下のガラストレイに排出されていることを確認します。これが起こらない場合は、トレイまたはStyrofoakブロックの角度を再調整して、ガラストレイに液体を排出できるようにします。
- 下大静脈から流出した液体が無血になるまでPBS灌流を続ける(約3分)。
注:心臓に針を適切に配置すると、肝臓からの血液が視覚的に除去され、赤色からわら色に変わります。これが起こらない場合は、左心室内に注入針を再配置することによって改善することができる。灌流の質を評価するために、腹側の尾の基部に小さな切開を行うことができる。適切な灌流は、尾基部切開部から流れる透明なPBSをもたらすであろう。 - 素早く作業し、PBSラインを止血剤で塞ぎ、PFAラインを開きます。
- 尾部がカールし始めるまで、PFA が数分間灌流するのを許します。尾がカールし始めたら、50分のタイマーを開始します。PFA灌流の5分後に尾がカールしない場合は、PFA灌流用の50分間のタイマーを開始します。
- 灌流全体を通してボトル内のPFAレベルを継続的に監視し、レベルが低すぎないようにします。レベルがボトルの蓋から2cm下に下がった場合は、ボトルにPFAをさらに充填します。
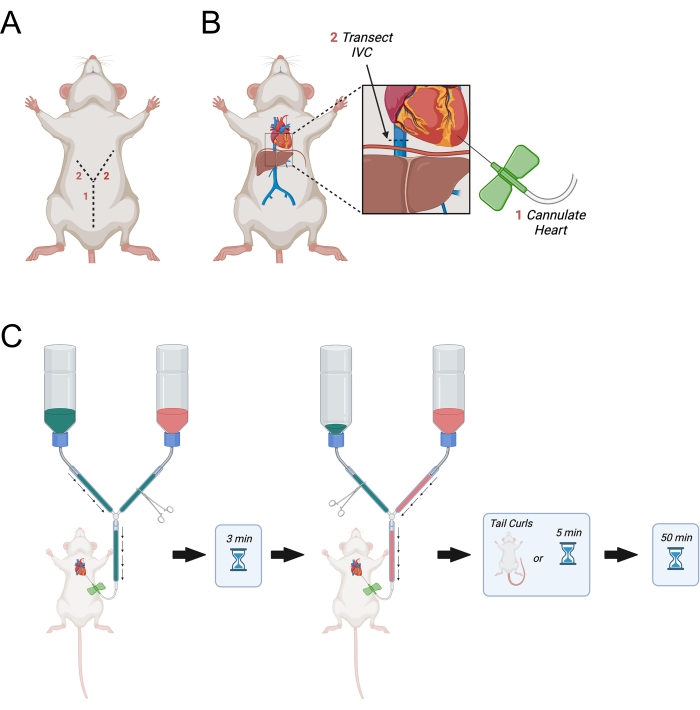
図3:経心膜灌流を描いた図 。(A)腹壁を最初に切断し、続いて「Y」を形成する腋窩に向かって2つの横方向を指す切開部を切断する。(B)胸腔に入り、心臓を露出させた後、針を左心室に通す。次に、IVCまたは右心房をトランスセクトして、灌流液が体内を循環した後の排水を可能にする。IVCはダイヤフラムよりも優れた切断です。(C)灌流の投与手順。略語= IVC = 下大静脈。 この図の拡大版を表示するには、ここをクリックしてください。
- 50分が経過した後、止血剤で本線を閉塞し、左心室から針を抜く。
注:この時点でマウス全体が硬く、4%PFAのラベル付き容器に4°Cで一晩置くことができます。 この段階では、CNS組織を解剖し、それらを一晩固定液中に個々に配置することが可能である。本作では、4°Cでの固定と配置の間隔を短くするため、マウス全体を固定液に入れます。 これにより、一晩の固定が完了する前に動物を事前に解剖した場合に起こり得る神経組織の機械的歪みも回避されます。
4. 中枢神経系解剖
- 水とそれに続く70%エタノールで洗って解剖するための以下の器具を準備する:はさみ、皮膚鉗子、湾曲した窓ガラス、湾曲した微細鉗子、まっすぐな微細鉗子、微細はさみ。
- マウス1匹あたり4本のチューブに次のようにラベルを付け、滅菌20%スクロースで満たします:マウスID、脳 1、マウスID、 脳2、マウスID、 腰椎、マウスID、 子宮頸部。
- PFA溶液からマウスを取り出し、ペーパータオルで拭き取って余分なPFAを除去した。
- 大きなはさみを使って、首を切ってマウスの頭を外します。
- PFA溶液に本体を置きます。頭蓋骨から脳を解剖するために頭を保持します。
- 脳を解剖するには、まず頭蓋皮膚を前方に反射させて頭蓋骨全体を露出させます(図4A)。
- 頭蓋骨への侵入を得るために細かい解剖はさみを使って耳道に浅い切り込みをする
- 頭蓋骨が両方の耳道の間まで切断されるまで、横洞に沿ってこの切断を続けます。
- 縦方向の亀裂に沿って、頭蓋骨の最も吻側部分(ほぼ目の間)まで、前の切断に垂直に切断する。
- フェネストされた湾曲した鉗子を使用して、頭蓋骨を横方向に反射させて前脳を露出させる。嗅球を含む前脳全体が露出するまで頭蓋骨を取り除き続けます。
- 頭蓋骨の尾部領域を解剖し始め、後頭骨を切断し、この切断を有孔マグナムに向かってゆっくりと続けます。
- 2枚の頭蓋骨を横方向に反射させ、小脳と脳幹を尾側に露出させます(図4B)。
- 超微細に湾曲した鉗子を使用して、嗅球を前頭蓋骨から分離し、嗅球から頭蓋骨基部から脳を剥離し始める。
- 脳が頭蓋骨の基部から剥がれるので、超微細な鉗子を使って脳神経を切断し、脳を除去できるようにします。
- 無傷の脳全体が除去されるまで、頭蓋骨の基部から脳を剥がし続けます(図4C、D)。
- 縦断裂に沿って脳を半分に切断し、左右の半球を互いに分離する(図4E、F)。
- 1つの半球を脳 1 チューブに置き、2番目の半球を 脳2 チューブに入れる。これらのチューブを、脳半球が沈むまで(約一晩)4°Cで保管する。
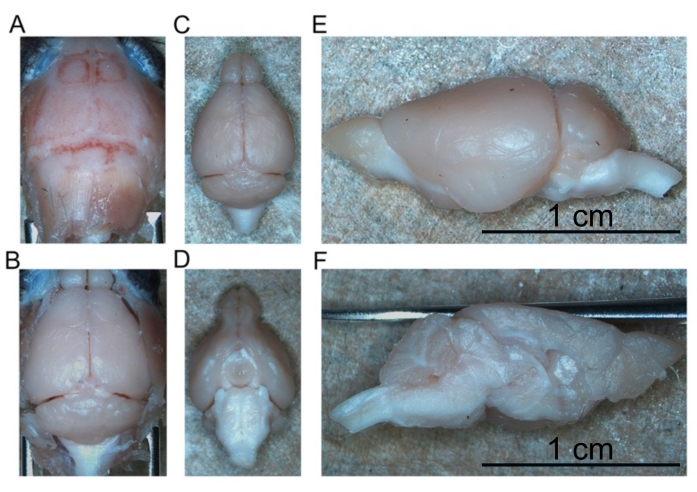
図4:固定された脳の除去。(B)頭蓋骨内の露出した脳。(C)孤立した脳(背側側面)。(D)孤立した脳(腹側側面)。(e)左半球(側方側面)。(f)左半球(内側の態様)。スケール バー = 1 cm (E および F)。この図の拡大版を表示するには、ここをクリックしてください。
- 脊髄を解剖するには、PFAからマウス本体を取り出し、乾燥させて拭き取ります。
- マウスを発泡スチロールの解剖ブロックの上に置き、4本の針を使って足をブロックに固定します。
- マウスの正中線の皮膚を首から尾まで切り取り、背中全体を露出させることから解剖を開始します。
- 背中の筋肉と筋膜を反射して、椎骨柱の後部を露出させます。
- 最も頭蓋椎骨から始めて、脊髄を避けながら薄層を切断するために細かい解剖ハサミを使用します(図5A)。
- 極細の湾曲した鉗子を薄層の下に置き、上方に引っ張って椎骨を骨折させ、脊髄を露出させます(図5B)。
- 湾曲した鉗子を使用して骨折した椎骨を反射し、脊髄の最も外側の領域を露出させます。
- このプロセスを次の椎骨のために続け、極細の湾曲した鉗子を薄層の下に置き、椎骨を破砕します。頸椎および胸椎全体が露出するまで椎骨を骨折し続ける(図5C)。
- 腰椎脊髄の端部まで脊髄を露出させ続ける(図5D)。
- 鋭い剃刀の刃を使用して、中胸部脊髄を最後まで切断する。
- 超微細に湾曲した鉗子を用いて、脊髄神経を脊椎から横方向に、筋膜前部を脊髄にトランステクトし、頸部脊髄を椎骨柱からゆっくりと分離する。
- 頸椎が椎骨から解放されるまで頸椎を解剖し続けます(図5E)。子宮頸部 - 中胸部脊髄を 子宮頸部とラベル付けされたチューブに入れる。子宮頸部脊髄が沈むまで(約一晩)、このチューブを4°Cで保管する。
- ステップ4.22から4.25で詳述されているように、尾鉤まで胸椎を骨折し続けます。尾鉢が露出したら、鋭利なカミソリの刃を使って、腰椎脊髄の1cm下の脊髄を切断します(図5F)。
- ステップ4.26-4.27で概説されているように、椎骨から離れて腰椎脊髄を解剖する。腰椎中枢ウダエクイナ脊髄を 腰椎とラベル付けされた管に入れる。このチューブを腰椎脊髄が沈むまで(約一晩)4°Cで保管してください。
- すべての組織が20%スクロースに沈んだら、沈むまでまたは3日間、30%スクロースの標識チューブに移します。
注:脊髄組織は、しばしば30%スクロースで沈みません。
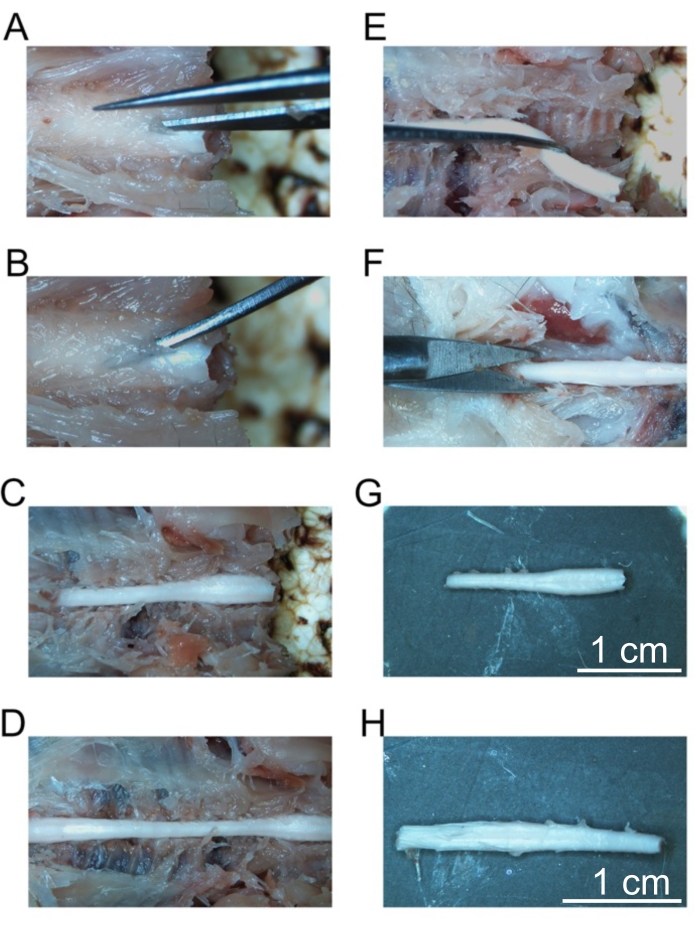
図5:固定された脊髄セグメントの除去 (A)頸椎の薄層への初期切断。(B)個々の椎骨を骨折するための湾曲した鉗子の配置。(C)露出した頸椎。(D)露出した子宮頸部、胸部、腰椎。(E)脊髄神経を切断した後の頸椎の除去。(F)仙骨の背骨を切る。(G)孤立した頸椎。(H)孤立した腰椎。スケール バー = 1 cm (G と H)。 この図の拡大版を表示するには、ここをクリックしてください。
5. OCT埋め込みと組織保存
- 各マウスについて、4つの長方形のクライオモールドにラベルを付けます:マウスID、 右半球、埋め込み日。マウスID、 左半球、埋め込み日;マウスID、 子宮頸部、埋め込み日;マウスID、 腰椎、埋め込み日。
- 発泡スチロール容器を設置し、容器の上に金属製のカップを掛けます。
- 発泡スチロール容器に液体窒素をほぼ半分まで充填する。金属カップに新鮮な2-メチルブタンを約半分まで満たします。
注:2-メチルブタンは毒性があり、揮発性が高く、可燃性です。煙フード内で、燃焼源から離れて後続の手順を実行することによって、吸入を避けるために注意する必要があります。 - 金属カップを液体窒素の中にゆっくりと下ろし、液体窒素が金属カップに飛び散らないようにします。
- 2-メチルブタンが凍結を開始するのを許します。2-メチルブタンが凍結している間に、30%スクロース溶液から目的の組織を取り出し、ほこりのないワイプで拭き取ります。
- 吻側領域が型の上部(ラベル化されていない)部分に向けられた凍結計物に組織を置きます。
- 最適な切断温度包埋剤(OCT)をクライオモールド内の組織上に控えめに注ぎ、組織を完全に覆うのに十分な量だけを使用する。過度のOCTは亀裂の原因となりますので、使用しないでください。OCT からバブルをすべて取り除きます。
- 凍結した2−メチルブタンが金属カップの内面を完全に覆ったら、クライオモルドを2−メチルブタンの上にある液相に12秒間完全に浸漬する。12秒後、クライオモールドを排水してラベルの付いたアルミホイルの正方形に置き、クライオモールド全体を包みます。すぐにラップしたクライオモルドをドライアイスの上に置き、解凍を避けてください。凍結した OCT/クライオモルドが常にドライアイスで覆われていることを確認します。
- すべての組織について、手順5.6~5.8を繰り返します。1匹のマウスのティッシュを密閉された小さなビニール袋に入れ、次にクライオセーフで密閉された容器に入れます。この容器を-80°Cのディープフリーザーに、切片が切れるまで保管してください。
6. クライオセクショニング
- 凍結切除を行う前に、クライオスタットチャンバーの温度と試料ヘッドが適切な設定に設定されていることを確認してください。
注:脳切片の切断には、-20°Cのチャンバ温度、-20°Cの試料ヘッド温度、および30μmの断面厚さが使用されます。脊髄切片の切断には、チャンバー温度-23°C、検体ヘッド温度-30°C、断面厚さ30μmを用いる。組織品質の問題に対処するために、クライオスタットの設定(特に試料ヘッド温度)を切片化中に調整する必要があることに注意することが重要です。一般に、標本ヘッド温度は、組織抹消を補正するために下げられる。逆に、検体ヘッド温度は、過剰な組織カールを補正するために上昇する。 - -80°Cの冷凍庫から目的のOCTブロックを取り出し、包まれていないクライオモールド/OCTブロックをクライオスタットチャンバーに入れます。
- OCTブロックをチャンバー温度に30分間順応させます。
- チャックを70%エタノールで拭き取り、ほこりのないワイプで乾かします。洗浄したチャックをクライオスタットチャンバーに置き、チャックの上にコインサイズのOCTの円を作ります。OCTをフリーズさせます(約1〜2分)。
- OCTが凍結したら、エンドウ豆サイズの新鮮なOCTのドットをチャックの上に置き、すぐに組織OCTブロックをチャックの上に置きます。OCTが完全に凍結する前に、組織がチャックに対して完全に垂直であることを確認してください。
注:一般に、脳の最も吻側領域は、尾端から切除が始まるようにチャックに向かって配置される。脊髄の場合、一般に、最も尾部領域がチャック上に配置され、切片化が吻端から始まる。 - OCTが硬化したら、OCTブロックの基部の周りにOCTを多く配置して、切片化中に構造支持として機能します。この支持体がわずかに硬化したら、チャックを試料ヘッドの上に置き、OCTブロックが試料ヘッドの温度に30分間達するようにします。
- ブレードホルダーにミクロトームブレードを置き、アンチロールプレートをクリーニングします。アンチロールプレートの距離を調整して、切片化中に組織がプレートのすぐ下を通過するようにします。アンチロールプレートの正しい位置決めの詳細については、クライオスタットのマニュアルを参照してください。
- OCTブロックが試料ヘッド温度に順応した後、組織に達するまでOCTブロックのトリミングを開始します。組織が見えたら、 トリミング から 切片化 に切り替え、30μmの切片の切断を開始します。アンチロールプレートを脇に置き、顕微鏡スライドを使用して断面を持ち上げます。
- 切片の解剖学的位置に満足するか、またはすべての組織が切断されるまで、切片を切断して収集し続ける。スライドを室温で1〜3日間乾燥させる。乾燥後、スライドをスライドボックスに入れ、密封されたビニール袋に入れます。スライドを-80°Cのディープフリーザーに入れる前に、マウスIDと組織情報をバッグにラベル付けします。
7. 免疫蛍光染色
- スライドを室温で1時間解凍します。
- スライドを水平スライドジャーに入れ、切片をPBSで3回、シェーカー上で室温で10分間洗浄する。
- ブロッキングバッファー(2% BSA + 0.3% Triton-X-100 を 1x PBS に)を準備します。スライドあたり約 1 mL を使用します。
- 底に水を加えて加湿室を作ります。スライドを水平に上向きに置き、乾燥させないでください。各スライドに1mLのブロッキングバッファーを加え、室温で少なくとも1時間インキュベートする。
- 一次抗体を抗体緩衝液(1x PBS中の0.7%BSA+0.3%Triton-X-100)で希釈して一次抗体溶液を調製する。
注:リン酸化α-シヌクレイン抗体については、1:500の希釈係数を使用した。 - スライドあたり200~300 μLの一次抗体溶液を加える。カバースリップで覆い、抗体を分散させ、4°Cで一晩インキュベートした。
- 翌日、加湿チャンバーからスライドを取り出し、カバースリップが落ちるように1x PBSで満たされた垂直コプリンジャーに入れます。スライドごとに個別に行い、カバースリップを取り外すときに組織切片を乱さないように注意してください。
- スライドを水平スライドジャーに入れ、切片をPBSで3回、シェーカー上で室温で10分間洗浄する。
注:蛍光色素分子のフォトブリーチングを避けるために、その後のすべての手順はライトを消した状態で実行する必要があります。 - 二次抗体を抗体緩衝液で希釈して二次抗体溶液を調製する。
注:リン酸化α-シヌクレインの検出のために、抗体緩衝液中で1:500の希釈係数でAlexa 488にコンジュゲートした抗ウサギ二次(1x PBS中の0.7%BSA + 0.3%Triton-X-100)を使用した。 - スライドを加湿チャンバー内に水平に置き、スライドごとに200〜300μLの二次抗体溶液を加える。抗体を分散させるためにカバースリップで覆う。室温で少なくとも2時間インキュベートする。
- 加湿チャンバーからスライドを取り出し、カバースリップが落ちるように、1x PBSで満たされた垂直コプリンジャーに入れます。スライドごとに個別に行い、カバースリップを取り外すときに組織切片を乱さないように注意してください。
- スライドを水平スライドジャーに入れ、切片をPBSで3回、シェーカー上で室温で10分間洗浄する。
- スライドの側面をタオルで拭き取り、余分なPBSを振り払います。
- 各スライドに3滴のマウント媒体を追加します。カバースリップを追加し、共焦点顕微鏡で撮像する前にカバースリップを押して、一対の鉗子で泡を静かに押し出します。
結果
高品質の灌流は、肝臓、脊髄、および深部CNS構造に血液がないことによって示される(図4C および 図5G、H)。硬膜の下(例えば、静脈洞内)または硬膜と頭蓋骨との間に保持された血液は、この血液が脳実質内にないため、問題にならなかった。 図4A に見られる血液は、頭蓋骨と硬膜物質の間に位置するため、質の悪い灌流の問題や示唆にはなりません。新鮮な脳と脊髄は非常に柔らかく、取り扱い中に簡単に損傷します。適切に固定された組織は、比較して、しっかりしている。本研究は、この灌流法による組織の質と形態の保存を評価するため、ヒトA53T α-シヌクレインを発現する15ヶ月齢マウスと7ヶ月齢マウスの中脳および腰椎脊髄におけるリン酸化α-シヌクレインの検出を実証する(図6)。
A53T変異は、常染色体優性パーキンソン病(PD)の患者において過大評価されている。さらに、A53T変異を有するヒトα-シヌクレインは、マウス6、7で発現させた場合にヒトPDの特徴の多くを再現することができる。セリン129残基におけるα-シヌクレインのリン酸化は 、インビボ および インビトロで α-シヌクレイン凝集を誘導することが示されている8。ルーイ体は、PDまたはルーウィー体認知症9の患者に存在する古典的な組織学的所見である。Lewey体に存在するα-シヌクレインの大部分は、セリン12910、11でリン酸化されている。その結果、リン酸化α-シヌクレインの蓄積は、PD病態の組織学的重症度のマーカーとして使用される。本研究は、リン酸化α-シヌクレインが、ヒトA53T-α-synucleinを発現する7ヶ月齢の無症候性マウスと比較して、15.5ヶ月齢の症候性マウスにおいて有意に高いレベルで蓄積することを見出した。これは、脊髄の前角およびこれらのマウスの中脳における細胞病理学の富化を説明する報告と一致している。6この ことから、ここで説明する単純化された灌流法は、下流の組織学的特徴付けのためにCNS組織の高品質の固定を提供すると結論付けられる。
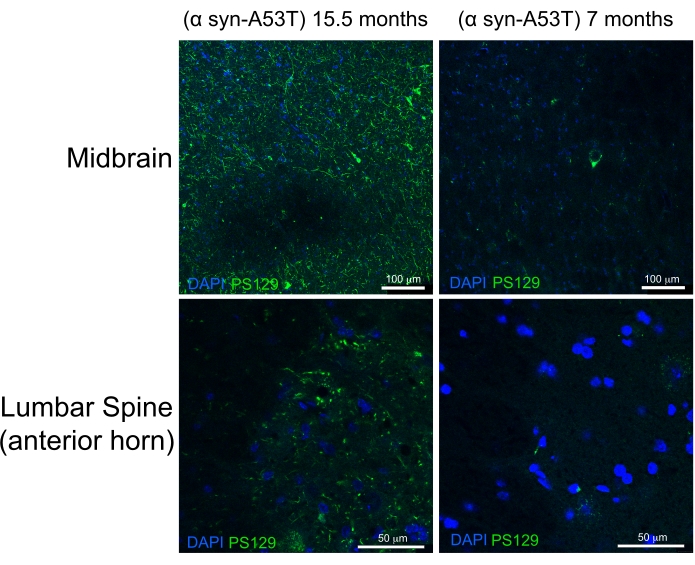
図6:パーキンソン病のマウスモデルからの中脳および腰椎脊髄組織におけるリン酸化α-シヌクレインの標識。 加齢(15.5ヶ月齢)の末期麻痺マウスを、7ヶ月齢の健康なマウスと比較する。両方のマウスは、パーキンソン様病理を誘導するヒトα-シヌクレインのミスフォールディングを起こしやすい変異変異体(A53T)を発現する。スケールバー = 100 μm (上部パネル) および 50 μm (下部パネル)。略語:α-シヌクレインのsyn-A53T=A53T変異体α;DAPI=4',6-ジアミジノ-2-フェニルインドール;PS129=α-シヌクレインのリン酸化セリン129。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この研究は、経心膜灌流を行うための重要なステップを説明する。灌流装置(プロトコルセクション1)を構築する場合、止血によって完全に閉塞されるのに十分な柔軟性を有するチューブを使用することが重要である。一部の硬いチューブは、止血剤によって十分に閉塞されない可能性があり、最初のPBS灌流中にPFAがメインラインに漏れる可能性があります。4%PFA溶液を調製するときは、pHが生理学的であることを確認することが重要です(7.4)。PFA溶液の調製には65°Cに加熱する必要があるため、pHを測定する前に溶液を25°Cまで冷却する必要があります。
腹部への最初の切開を行うときは、腹部器官の裂傷を避けるために注意を払わなければならない(プロトコルセクション2)。横隔膜に向かって優位に解剖するときは、肝臓が前腹壁と密着するのが一般的であるため、肝臓の裂傷を避けることが重要です。これを克服するために、肝臓を横隔膜に向かって切開を続ける前に、前壁から慎重かつ鈍く解剖する。横隔膜を通って胸腔に入るとき、心臓、大きな血管、および肺の裂傷を避けることが重要です。これを避けるために、はさみの先端は表面的にそして胸郭と鋭角に保たれる。
心臓を露出させるための最初の解剖は、最初の切開から約2分かかる。この間、蝶の針の先端にいくらかの空気が入ったことが予想されます。マウスの循環にこの空気を導入すると、質の悪い灌流が得られます。したがって、心臓のカニューレの直前にメインラインを開き、PBSを針を通してフラッシュして気泡を除去することが重要です。理想的には、LVを穿刺するときに空気が完全に存在しないことを保証するために、小さなPBSトリクルが針先を通って流れる間、心臓はカニューレされる。
針がLVに入るとき、針先を右心室(RV)に導入するほど深く行ってはなりません。RVまたは僧帽弁を超えて針を配置すると、灌流が開始されたときに肺の即時の「膨張」が生じる。これは望ましくなく、LVの配置を確実にするために針を少し引き抜く必要があります。針が適切に置かれると、肺は灌流を通して平らに保たれます。灌流が開始されると、透明な液体が動物の開いた口から出てくることが時々観察される。これは通常、灌流圧が高すぎるか、心臓内の針の配置ミスによるものです。著者らは、灌流圧の上昇が動脈毛細血管床からの灌流液の溢血と、気管支樹を介したPBSの食道および口腔への逆行性流をもたらすと推測している。
灌流圧力は、PBSボトル内のPBSのレベルを低下させるか、PBSボトルの高さを下げることによって低下しなければならない。あるいは、針が左心室に深く入りすぎると、僧帽弁を通って左心房に灌流液を送達することがある。これは、上述のように、肺静脈を通る逆行性流および細動脈への灌流液の溢血をもたらし得る。PBSによる循環器系からの血液の徹底的なクリアランスは、その後の固定剤灌流時に血管閉塞をもたらす血液成分の固定剤誘発架橋を避けるために特に重要である。クリアランスは、腹側尾部基部の切開部からの肝臓およびPBS流の色変化によって効果的に評価される。血液クリアランスは、一般に、PBSによる灌流の3分によって完了する。しかし、クリアランスの視覚的徴候がより短い時間で起こる場合、固定液は3分より早く導入される。より長いクリアランス時間は、遅延固定灌流がCNS微細構造1のアーチファクトをもたらすので推奨されない。
PFAを投与するときは、PFAボトル内のPFA溶液のレベルを監視することが重要です。PFAのレベルがPFAボトルの口から4cm未満まで下がった場合は、PFAボトルをいっぱいにします。灌流が完了した後、灌流装置を蒸留水で十分にすすいでいなければならない。これは、メインライン内の残留PFAがPFAで初期PBS灌流を汚染し、質の悪い灌流をもたらすため重要です。最後に、25Gのバタフライニードルは、20〜30gの範囲の平均サイズの成体マウスに一般的に推奨されます。しかしながら、より大きくまたはより小さいマウスは、最適な流速を提供するために固定剤ボトルの調整に加えて、わずかに大きいまたはより小さいゲージ針を必要とし得る。
CNS解剖およびOCT埋め込み(プロトコルセクション3)の場合、脊髄組織が30%スクロース中に完全に沈み込まないのが一般的である。したがって、これらの組織は、沈むかどうかにかかわらず、スクロース中に2日間放置され、次いでOCTに埋め込まれる。OCTで組織を凍結させると、冷却された2-メチルブタンに入れたときに特定の組織が割れる可能性があります。これは脳でより一般的であり、通常、あまりにも多くのOCTが組織に置かれたときに起こる。これを避けるには、即時凍結の前に組織表面を覆うのに十分なOCTのみを配置してください。一部のプロトコルでは、OCTに完全に浸漬されているにもかかわらず、クラッキングはあまり一般的ではありません。これは通常、ドライアイス冷却された 2-メチルブタンを使用したり、ドライアイスのブロック上にクライオモルドを直接配置したりする場合など、凍結速度が遅いためです。液体 - 窒素冷却2-メチルブタンは、凍結速度が実質的により速く、遅い凍結法よりも組織形態をよりよく保存する可能性があるため、この研究において好ましい。
組織を凍結切除する場合(プロトコルセクション4)、複数回の凍結融解サイクルを避けることが重要です。したがって、単一のOCTブロックからすべての切片を切断して、選択した領域を解凍および再凍結するのではなく、分析用の特定の脳領域を取得することが最適である。これが実行可能でない場合は、いくつかのセクションを取得した後、ユーザーはOCTブロックを再凍結し、将来の使用のために-80°Cのディープフリーザーに1〜2回以上保管することができます。
灌流液のより伝統的なポンプまたは空気圧送達に対するこの方法の主な利点は、以下の通りである:(1)灌流装置の低コストおよびアクセス性。(2)ユーザーは、灌流全体を通して灌流装置内の圧力を手動で維持する必要はない。(3)シリンジ送達を介した灌流のための他の低コストの代替手段よりも低く、より一貫した灌流圧力。ベルヌーイの式を用いて、ここで構築された重力供給灌流装置は、灌流瓶を針に対して1mの標高に置いたときに、約73mmHgの灌流圧力を維持すると計算される。これがこれらの動物の収縮期血圧を有意に下回っていることを考えると、この灌流圧は血管破裂12を回避するのに十分低い可能性が高い。
著者らはこれまでに、この灌流システムを使用して、パーキンソン病のマウスモデルにおけるリン酸化α-シヌクレインの存在を検出することに成功している。この間、この灌流法ではポンプ灌流送達法には存在しないという重大な制限に遭遇していない。この技術の主な制限は、灌流対滴固定の時間のかかる性質です。この技術は、灌流がCNS構造への固定液のより深い浸透をもたらすように固着を落とすことが好ましい。この技術の2番目の制限は、胸腔への入り口に続いて心臓を素早くカニューレにしなければならないため、実行するために何らかの外科的スキルが必要であることである。しかし、経験上、訓練を受けたユーザーは、腹部への最初の切開から1分以内に心臓を日常的にカニューレートすることができる。
開示事項
著者らは、競合する金銭的利益はないと宣言している。
謝辞
著者らは、Xiaowen Wang、Liam Coyne、Jason Grullonに、このプロトコルの開発における彼らの支援に感謝している。この研究は、NIH助成金AG061204およびAG063499によって支援された。
資料
| Name | Company | Catalog Number | Comments |
| 2-Methylbutane (Certified ACS), Fisher Chemical | Fisher Scientific | 03551-4 | |
| Andwin Scientific Tissue-Tek O.C.T Compound | Fisher Scientific | NC1029572 | |
| Artman Instruments 4.5" Straight Castroveijo Spring Action Scissors | Amazon | B0752XHK2X | "fine scissors" |
| BD General Use and PrecisionGlide Hypodermic Needles, 18 G | Fisher Scientific | 14-826-5D | |
| BD General Use and PrecisionGlide Hypodermic Needles, 22 G | Fisher Scientific | 14-826B | |
| Corning PES Syringe Filters | Fisher Scientific | 09-754-29 | |
| Cytiva HyClone Phosphate Buffered Saline (PBS), 10x | Fisher Scientific | SH30258 | |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | |
| Fisher BioReagents Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | |
| Fisherbrand Curved Medium Point General Purpose Forceps | Fisher Scientific | 16-100-110 | "curved fenestrated forceps" |
| Fisherbrand Curved Very Fine Precision Tip Forceps | Fisher Scientific | 16-100-123 | "curved fine forceps" |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisher Scientific | 13-711-9AM | |
| Fisherbrand High Precision Straight Tapered Ultra Fine Point Tweezers/Forceps | Fisher Scientific | 12-000-122 | "straight fine forceps" |
| Fisherbrand Micro Spatulas with Rounded Ends | Fisher Scientific | 21-401-5 | |
| Fisherbrand Porcelain Buchner Funnels with Fixed Perforated Plates | Fisher Scientific | FB966J | |
| Fisherbrand Premium Cover Glass, 24 x 50 | Fisher Scientific | 12-548-5M | |
| Fisherbrand Premium Tissue Forceps 1X2 Teeth 5 in. German Steel | Fisher Scientific | 13-820-074 | "skin forceps" |
| Fisherbrand Reusable Heavy-Wall Filter Flasks | Fisher Scientific | FB3002000 | |
| Fisherbrand Standard Dissecting Scissors | Fisher Scientific | 08-951-20 | "dissecting scissors" |
| Fisherbrand Sterile Syringes for Single Use | Fisher Scientific | 14-955-464 | |
| Fisherbrand Straight Locking Hemostats | Fisher Scientific | 16-100-115 | |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Fisherbrand Vinyl Tubing and Connector Kits, 1/4 in. | Fisher Scientific | 14-174-1C | |
| Fisherbrand Wet-Strengthened Qualitative Filter Paper Circles | Fisher Scientific | 09-790-12F | |
| Fisherbrand Y Connector with 1/4 in. ID - Polypropylene - QC | Fisher Scientific | 01-000-686 | |
| Garvey Economy Single Edge Cutter Blade | Amazon | B001GXFAEQ | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, DyLight 488 | ThermoFisher Scientific | 35552 | |
| Ideal Clamp Stant High-Pressure Clamps | Fisher Scientific | 14-198-5A | "hose clamps" |
| IMEB, Inc Sakura Accu-Edge Low Profile Microtome Blades, Dispoisable | Fisher Scientific | NC9822467 | |
| Kawasumi 25 Gauge Standard Winged Blood Collection Set | Fisher Scientific | 22-010-137 | "butterfly needle" |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | Fisher Scientific | 06-666 | |
| Molecular Probes ProLong Diamond Antifade Mountant with DAPI | Fisher Scientific | P36962 | |
| Nalgene Narrow-Mouth Right-to-Know LDPE Wash Bottles | ThermoFisher Scientific | 2425-0506 | "buffer bottles" |
| PAP pen | abcam | ab2601 | |
| Paraformaldehyde Granular | Electron Microscopy Systems | 19210 | |
| Pyrex Glass Drying Dishes, 34.9 x 24.9 x 6 cm | Fisher Scientific | 15-242D | |
| Recombinant Anti-Alpha-synuclein (phospho S129) antibody [EP1536Y] | abcam | ab51253 | |
| Sodium Hydroxide | Sigma-Aldrich | 221465-2.5kg | |
| Stainless Steel Drinking Cup 18-oz | amazon | B0039PPO9U | |
| Sucrose for Molecular Biology CAS: 57-50-1 | Us Biological | S8010 | |
| Triton X-100 | Us Biological | T8655 | |
| Vetone Fluriso Isoflurane USP | MWI Animal Health | 502017 |
参考文献
- Tao-Cheng, J. H., Gallant, P. E., Brightman, M. W., Dosemeci, A., Reese, T. S. Structural changes at synapses after delayed perfusion fixation in different regions of the mouse brain. Journal of Comparative Neurology. 501 (5), 731-740 (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments: JoVE. (65), e3564(2012).
- McFadden, W. C., et al. Perfusion fixation in brain banking: a systematic review. Acta Neuropathologica Communications. 7 (1), 146(2019).
- Lamberts, R., Goldsmith, P. C. Fixation, fine structure, and immunostaining for neuropeptides: perfusion versus immersion of the neuroendocrine hypothalamus. Journal of Histochemistry and Cytochemistry. 34 (3), 389-398 (1986).
- Adickes, E. D., Folkerth, R. D., Sims, K. L. Use of perfusion fixation for improved neuropathologic examination. Archives of Pathology and Laboratory Medicine. 121 (11), 1199-1206 (1997).
- Giasson, B. I., et al. Neuronal alpha-synucleinopathy with severe movement disorder in mice expressing A53T human alpha-synuclein. Neuron. 34 (4), 521-533 (2002).
- Martin, L. J., et al. Parkinson's disease alpha-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. Journal of Neuroscience. 26 (1), 41-50 (2006).
- Fujiwara, H., et al. alpha-Synuclein is phosphorylated in synucleinopathy lesions. Nature Cell Biology. 4 (2), 160-164 (2002).
- Kalia, L. V., Lang, A. E. Parkinson's disease. Lancet. 386 (9996), 896-912 (2015).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. Journal of Biological Chemistry. 281 (40), 29739-29752 (2006).
- Kahle, P. J., et al. Hyperphosphorylation and insolubility of alpha-synuclein in transgenic mouse oligodendrocytes. EMBO Reports. 3 (6), 583-588 (2002).
- Mattson, D. L. Comparison of arterial blood pressure in different strains of mice. American Journal of Hypertension. 14, 405-408 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved