Method Article
Um método de perfusão transcárvia alimentado pela gravidade para análise histológica do sistema nervoso central do rato
Neste Artigo
Resumo
Um método conveniente de perfusão alimentado pela gravidade para análise histológica do sistema nervoso central do rato é apresentado. A detecção imunofluorescente de α-sinucleína fosfoilada é demonstrada em um modelo de camundongo da doença de Parkinson. Este trabalho também descreve de forma abrangente as etapas de perfusão transcárdia, dissecção, congelamento/incorporação de tecidos e etapas de secção congelada.
Resumo
A análise histológica de amostras cerebrais e medulas isoladas de camundongos é prática comum para a avaliação da patologia neste sistema modelo. Para manter a morfologia desses tecidos delicados, é rotina administrar um fixador químico como o paraformaldeído via cannulação do coração em animais anestesiados (perfusão transcárdia). A perfusão transcárvia do coração do camundongo tem tradicionalmente se apoiado no uso de bombas peristálticas ou pressão de ar para fornecer soluções salinas e fixativas necessárias para este processo. Como uma alternativa de fácil acesso a esses métodos, este trabalho demonstra o uso de um método alimentado pela gravidade de entrega perfusada que utiliza materiais disponíveis na maioria das lojas de hardware.
Para validar este novo método de perfusão, este trabalho demonstra todas as etapas subsequentes necessárias para a detecção sensível de α-sinucleína fosforilada no cérebro e na medula espinhal. Estão incluídos nestas etapas a dissecção dos tecidos fixos do cérebro e da medula espinhal, congelamento/incorporação rápida e criosecção dos tecidos e coloração imunofluorescente. Como este método resulta na entrega do corpo inteiro do fixador, ele também pode ser usado para preparar outros tecidos não neuronais para análise histológica.
Introdução
Caracterização histológica da patologia no sistema nervoso central do camundongo (SNC) é uma técnica de rotina usada em estudos de neurodegeneração. À medida que os tecidos neuronais se degradam rapidamente após a morte, é prática comum fornecer um fixador químico como paraformaldeído aos tecidos do SNC para preservar sua morfologia 1,2. A fixação química pode ser realizada através da perfusão do corpo inteiro com uma solução fixa ou através do isolamento dos tecidos e sua imersão em uma solução fixa (chamada de "fixação de queda"). A perfusão é o método preferido de entrega fixativa, pois a fixação de gotas pode não permitir a penetração rápida da solução fixativa em estruturas profundas de CNS 3,4,5. Além disso, como é difícil remover a medula espinhal não fixada da coluna vertebral, a entrega da solução fixa por perfusão permite a preservação in situ da anatomia microscópica e grosseira da medula espinhal e endurece o tecido para minimizar os danos durante a remoção.
A entrega das soluções tampão e fixação necessárias para fixação é comumente realizada usando bombas comercialmente disponíveis ou pressão de ar. A entrega de gravidade do perfusato pode servir como uma alternativa à entrega da bomba pelos seguintes motivos: (1) A entrega de bomba ou pressão de ar pode, em alguns casos, exigir que o usuário mantenha manualmente a pressão no sistema durante toda a perfusão. A entrega de gravidade do perfusato pode ser mantida sem intervenção do usuário. (2) Um aparelho de perfusato fornecido pela gravidade pode ser construído a baixo custo para o usuário, obtendo materiais disponíveis de fornecedores científicos padrão. Este trabalho descreve como construir um simples dispositivo de perfusão de gravidade usando garrafas de lavagem e tubos de vinil. Usando um modelo de camundongo da doença de Parkinson, este trabalho demonstra a eficácia deste sistema na perfusão dos tecidos cerebrais e medulas espinhais antes de seu isolamento para seção congelada. Este trabalho descreve de forma abrangente todas as etapas, técnicas e materiais necessários para dissecar o tecido fixo do animal, congelar/incorporar e crioseccionar rapidamente o tecido, e detectar a presença de α-sinucleína fosforilada no cérebro e na medula espinhal através de microscopia de imunofluorescência indireta.
Protocolo
Os dados e etapas experimentais apresentados neste protocolo foram gerados utilizando camundongos C57BL/6J. Todos os métodos envolvendo animais foram aprovados pelo Comitê de Cuidados e Uso Institucional de Animais da Universidade Médica do Estado de Nova York.
1. Construção de aparelhos de perfusão e plataforma de dissecção
- Como mostrado na Figura 1, corte os canudos internos de duas garrafas de lavagem de 500 mL cortando estas descargas para o lado interno da tampa do parafuso com uma lâmina afiada. Corte um orifício quadrado de 4 cm x 4 cm na parte inferior de cada garrafa tampão. Corte um pequeno orifício no fundo de cada garrafa para permitir a passagem de uma microspatula de aço inoxidável dobrado.
- Crie uma dobra em forma de "S" nas microspatulas para que possam ser usadas como ganchos para pendurar as garrafas tampão. Insira as micropatulas dobradas nas aberturas apropriadas nas garrafas tampão.
- Corte dois comprimentos de tubo de 25 cm e conecte-os firmemente com as saídas externas de palha da garrafa. Junte as extremidades desses tubos juntamente com o conector Y. Corte 2 m de tubulação e junte-se a isso à extremidade livre do conector Y.
- Retire o êmbolo da seringa de 1 mL e corte a seringa aproximadamente 6 cm da ponta da seringa. Corte a seringa marcando primeiro o plástico com uma lâmina de barbear e, em seguida, estalando bruscamente o plástico da seringa.
- Insira a face cortada da seringa na extremidade livre do tubo plástico. Insira em uma profundidade suficiente para garantir uma vedação apertada.
NOTA: É importante que todas as conexões dentro do aparelho de perfusão estejam suficientemente apertadas para evitar vazamentos. No caso de conexões soltas, pequenos grampos de mangueira de aço inoxidável podem ser colocados e apertados nas junções conforme desejado para garantir uma vedação apertada, se necessário. - Rotule uma garrafa tampão como PFA e uma garrafa como PBS (buffer). Meça aproximadamente 1/3do comprimento da abertura da garrafa e desenhe uma linha em torno da circunferência da garrafa neste momento para denotar o nível de enchimento adequado das soluções perfusadas.
- Endireitar e, em seguida, criar um loop em um clipe de papel grande que pode caber em torno da circunferência da tubulação. Coloque este laço ao redor da tubulação apenas proximal para a seringa.
- Coloque um bloco de isopor de tamanho apropriado na bandeja de vidro. Coloque as extremidades do clipe de papel no bloco de isopor para fixar a tubulação.
- Usando toalhas de papel, levante a parte frontal da bandeja de vidro em aproximadamente 2 cm.
NOTA: Isso colocará o mouse em aproximadamente 20° da posição Trendelenburg (inclinação para trás) para permitir uma visualização mais fácil do diafragma durante a dissecção e incentivar a drenagem de fluidos durante a perfusão.
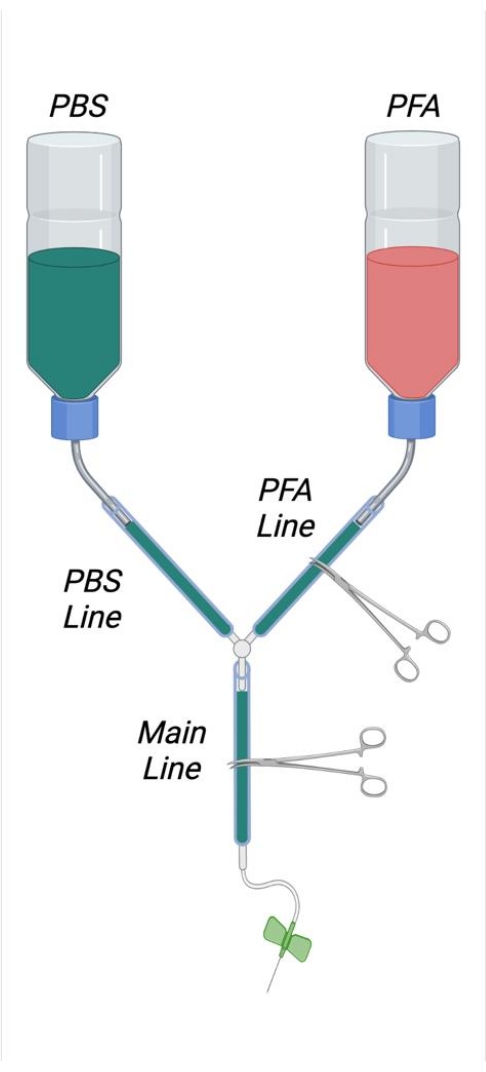
Figura 1: Diagrama representando o aparelho de perfusão montado. Abreviaturas: PBS = soro fisiológico tamponado com fosfato; PFA = paraformaldeído. Clique aqui para ver uma versão maior desta figura.
2. Preparação da solução paraformaldeído (PFA)
NOTA: A solução PFA deve ser preparada fresca no dia da perfusão e descartada no final da perfusão em um recipiente de resíduos designado antes do descarte por pessoal treinado. Este protocolo faz 1 L de 4% de solução PFA, o que é suficiente para perfundir aproximadamente 4 ratos. O PFA é altamente tóxico, e deve-se tomar cuidado para evitar a inalação ou o contato direto da pele na forma em pó ou líquida. A maioria das etapas de preparação são, portanto, realizadas usando luvas, óculos protetores e um jaleco sob um capô de fumaça.
- Enxágüe um béquer 1 L usando água destilada e preencha com aproximadamente 800 mL de 18 mΩ grau de biologia molecular H2O.
- Aqueça o béquer de H2O em um micro-ondas por 3 minutos ou até que a temperatura da água atinja 65 °C. Coloque em uma placa de aquecimento/agitação mantida em um capô de fumaça.
- Enxágüe uma haste de agitação com água destilada e coloque-a na água quente. Inicie o agitador e gire a placa quente em fogo médio. Certifique-se de que a temperatura da água não vá acima de 70 °C.
- Use uma máscara cirúrgica, luvas, óculos de proteção e jaleco e meça 40 g de pó PFA. Despeje esse pó na água aquecida.
- Usando uma pipeta de transferência, adicione algumas gotas de 5 M NaOH à solução. Permita que o pó PFA se dissolva completamente. Se o pó não tiver totalmente dissolvido após alguns minutos, adicione gotas de 5 M NaOH conforme necessário.
- Uma vez que quase todo o PFA tenha dissolvido (vai parecer ligeiramente turvo), pare a agitação/aquecimento e adicione imediatamente 100 mL de soro fisiológico tamponado com fosfato de 10x (PBS). Por fim, cubra a água até a marca 1 L no béquer usando 18 mΩ molecular-biologia-grau H2O. Cubra o béquer com plástico e coloque-o em um congelador de -20 °C até que a solução atinja a temperatura ambiente (aproximadamente 45 min).
- Calibrar um medidor de pH usando as normas apropriadas. Enquanto o béquer estiver em uma placa de agitação, meça o pH da solução e adicione HCl até que o pH atinja 7,4. Se necessário, adicione 5 M NaOH para aumentar o pH se estiver muito baixo.
- Conecte um frasco de vácuo ao vácuo e coloque um funil Büchner de cerâmica limpa com papel filtro no frasco. Ligue o vácuo e molhe o papel filtro usando uma pipeta de transferência preenchida com a solução PFA de 4%.
- Despeje lentamente a solução PFA de 4% no papel do filtro até que toda a solução tenha sido filtrada.
- Transfira a solução filtrada para um recipiente limpo e protegido por luz e armazene-a a 4 °C até o uso (armazene não mais do que 24 h).
3. Perfusão transcardial "livre de bomba"
- No capô da fumaça, coloque um bloco de dissecação de isopor em uma bandeja de vidro. Certifique-se de que o bloco de dissecação tenha 5-6 agulhas curtas para conter o rato durante a cirurgia e 2 agulhas longas para suportar o tubo de perfusão.
- Enxágüe o aparelho de perfusão usando água destilada. Deixe toda a água escorrada antes de pendurar o aparelho de perfusão. Pendure as garrafas de perfusão 1 m acima do animal perfusado (para um rato de 20-30 g).
- Prepare uma solução não estéril de 1x PBS usando PBS 10x diluída com 18 mΩ molecular-biologia grau H2O.
- Como mostrado na Figura 2, aperte a linha principal do aparelho de perfusão usando um hemostat. Aperte a linha PFA com outro hemostat.
NOTA: A oclusão com hemostatas múltiplas pode ser necessária por linha para evitar completamente o fluxo. - Encha o recipiente tampão com 1x PBS em temperatura ambiente.
- Coloque a extremidade da seringa do aparelho de perfusão em um béquer para coletar o tampão de resíduos e remova o hemostat ocluindo a linha principal (Figura 2, à esquerda).
- Permita que o PBS flua através da linha enquanto remove o ar preso tocando vigorosamente nas paredes do tubo.
- Uma vez que todo o ar tenha sido removido do buffer e das linhas principais, oclui o fluxo colocando um hemostat na linha principal.
- Remova o hemostat da linha PFA e permita que o PBS flua de forma retrógrada até a garrafa PFA enquanto toca quaisquer bolhas na linha PFA (Figura 2, meio). Continue a permitir que o PBS entre na linha PFA até que o PBS possa ser visto logo acima da abertura da garrafa. Oclua a linha PFA com um hemostat para parar o fluxo na garrafa PFA.
- Conecte a agulha de infusão de borboleta à seringa de perfusão e lave PBS através da linha (abrindo o hemosta da linha principal) para remover bolhas da seringa de perfusão. Feche o hemostat da linha principal.
- Certifique-se de que a garrafa PBS está agora aproximadamente 1/3ª cheia de PBS. Se necessário, lave o PBS através da linha principal ou encha mais PBS na garrafa tampão até 1/3da sua capacidade total.
- Uma vez que todas as bolhas tenham sido removidas das linhas PBS, PFA e principal, encha a garrafa PFA com solução PFA de 4% à temperatura ambiente até a marca preta na garrafa (aproximadamente 1/3ª cheia) (Figura 2, à direita).
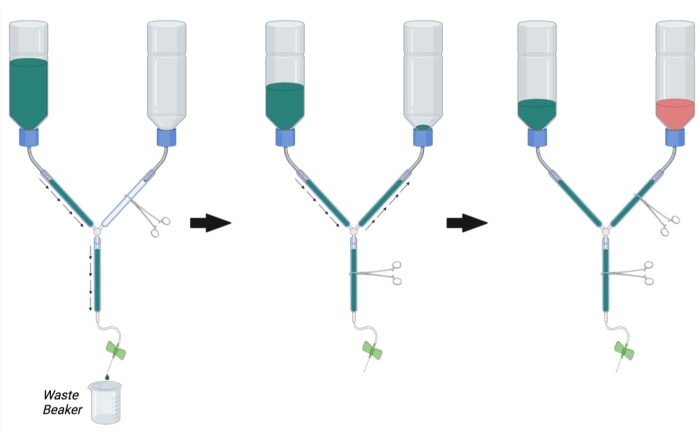
Figura 2: Preparação do aparelho de perfusão para cirurgia de perfusão. Primeiro, feche a linha PFA hemostat e abra o hemostat na linha PBS e na linha principal. Encha PBS e remova bolhas da linha PBS e da linha principal. Em seguida, preencha a linha PFA com PBS abrindo o hemostat na linha PFA e fechando o hemostat na linha principal. Remova bolhas na linha PFA. Por fim, feche o hemostat na linha PFA quando o PBS chegar à abertura da garrafa PFA. Encha a garrafa PFA 1/3ª cheia de PFA. Certifique-se de que o nível de PBS na garrafa PBS esteja 1/3completo e preencha com PBS ou escorra PBS abrindo o hemostat da linha principal, se necessário. Abreviaturas: PBS = soro fisiológico tamponado com fosfato; PFA = paraformaldeído. Clique aqui para ver uma versão maior desta figura.
- Prepare-se para a cirurgia de não sobrevivência limpando os seguintes instrumentos com água seguido de 70% de etanol: tesoura grande, tesoura de dissecação fina, fórceps da pele, fórceps curvos fenestrados finos.
- Prepare a anestesia colocando lenços sem poeira em um tubo cônico de 50 mL. Em um capô de fumaça, mergulhe os lenços sem poeira completamente com isoflurano e coloque o tubo aberto de cabeça para baixo em um béquer de 500 mL. Certifique-se de que não há isoflurano líquido na parte inferior do béquer e descarte qualquer isoflurane líquido antes de colocar um rato no béquer.
- Coloque o mouse no béquer e coloque plástico sobre a abertura para começar a anestesia.
- Administre anestesia até que o rato pare de respirar (aproximadamente 1 min e 30 s).
- Quando a respiração parar, remova imediatamente o rato do béquer e substitua a tampa no tubo cônico de 50 mL.
- Verifique se o mouse está suficientemente anestesiado usando o reflexo de beliscar o dedo do dedo do dedo do dedo. Se o animal não for suficientemente anestesiado, administre mais isoflurane como descrito na etapa 3.15.
- Trabalhando rapidamente, coloque o rato no bloco de isopor e fixe as patas para fora usando quatro agulhas curtas (por exemplo, agulhas de seringa de 22 G).
- Levantando a pele abdominal com fórceps de pele, use a tesoura grande para cortar a parede abdominal. Certifique-se de que nenhum órgão abdominal seja cortado!
- Continue o corte abdominal superiormente em direção ao fígado. Retire o fígado da parede abdominal anterior e continue a incisão inicial superiormente em direção ao diafragma. Pare esta incisão aproximadamente 1 cm inferior ao diafragma. Tome cuidado para garantir que o fígado não seja cortado!
- Continue a incisão inicial lateralmente até os lados direito e esquerdo do diafragma para fazer uma incisão em forma de "Y" (Figura 3A).
- Quando a incisão chegar ao diafragma, faça um furo no diafragma usando a tesoura de dissecação fina e corte as costelas do lado direito do animal. Corte as costelas aproximadamente a meio caminho da axila direita.
- Faça uma incisão semelhante, mas mais longa através do lado esquerdo do diafragma quase todo o caminho até a axila esquerda.
- Reflita a parede do peito e fixe-a no bloco de isopor.
- Se necessário, disseca a gordura ao redor do coração para expor o ventrículo esquerdo. Identifique o ventrículo esquerdo com base na cor relativamente mais clara quando comparado com o ventrículo direito.
- Depois de identificar o ventrículo esquerdo, mantenha o coração firme usando pressão leve com os fórceps curvos finos. Abra o hemostat da linha principal para permitir que o PBS flua através da agulha. Fure imediatamente o ventrículo esquerdo e assegure-se de que a agulha seja inserida não mais do que 0,5 cm no ventrículo. Retire a agulha ligeiramente se necessário.
NOTA: A colocação precisa da agulha no ventrículo esquerdo é indicada pelo fluxo retrógrado de sangue na tubulação da agulha. É importante garantir que a agulha não esteja muito profundamente inserida no ventrículo. Isso pode resultar em fluxo retrógrado através das veias pulmonares ou perfurando o septo interventricular. - Descanse a tubulação de borboleta em um X feito no isopor usando duas agulhas grandes de 18 G.
NOTA: Isso é crítico, pois evitará o movimento da agulha borboleta dentro do coração durante a perfusão. - Identifique a veia cava inferior quando sair do fígado e transectá-la usando a tesoura de dissecação fina (Figura 3B). Alternativamente, abra o átrio direito com uma tesoura.
- Abra imediatamente a linha principal para permitir que a perfusão do PBS comece (Figura 3C).
- Certifique-se de que o PBS está drenando o bloco de isopor e para a bandeja de vidro abaixo. Se isso não estiver ocorrendo, reajuste o ângulo da bandeja ou do bloco de istyrofoak para permitir a drenagem de fluidos na bandeja de vidro.
- Continue a perfusão pbs até que o líquido que flui para fora da veia cava inferior esteja livre de sangue (aproximadamente 3 min).
NOTA: A colocação adequada da agulha no coração resultará na limpeza visual do sangue do fígado, que passará de vermelho para cor de palha. Se isso não ocorrer, pode ser remediado reposicionando a agulha de infusão dentro do ventrículo esquerdo. Uma pequena incisão pode ser feita na base da cauda ventral para avaliar a qualidade da perfusão. A perfusão adequada resultará em pbs claro fluindo da incisão da base traseira. - Trabalhando rapidamente, oclui a linha PBS com um hemostat e abre a linha PFA.
- Deixe a PFA perfundir por alguns minutos até que a cauda comece a enrolar. Uma vez que a cauda começa a enrolar, comece um temporizador de 50 minutos. Se a cauda não se enrolar após 5 min de perfusão pfa, comece um temporizador de 50 minutos para a perfusão PFA.
- Monitore o nível pfa na garrafa continuamente durante toda a perfusão para garantir que o nível não caia muito baixo. Encha mais PFA na garrafa se o nível cair abaixo de 2 cm acima da tampa da garrafa.
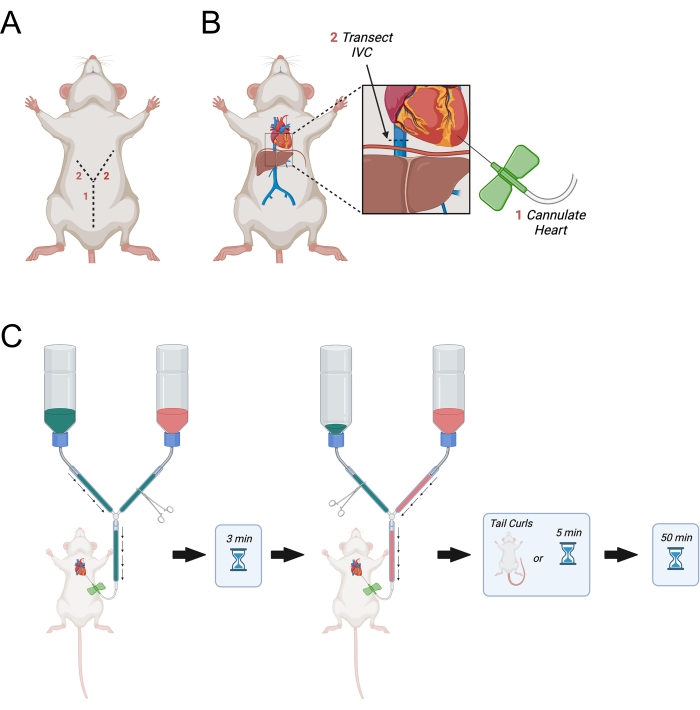
Figura 3: Diagrama representando perfusão transcárrica. (A) A parede abdominal é cortada pela primeira vez, seguida por duas incisões apontando lateralmente em direção à axila formando um "Y". (B) Depois de entrar na cavidade torácica e expor o coração, a agulha é passada para o ventrículo esquerdo. Em seguida, o IVC ou átrio direito é transeccionado para permitir a drenagem de perfusados depois de terem circulado pelo corpo. O IVC é cortado superior ao diafragma. (C) Procedimento para administração de perfusados. Abreviação = IVC = veia cava inferior. Clique aqui para ver uma versão maior desta figura.
- Depois de 50 min terem transcorrido, oclua a linha principal com um hemostat e retire a agulha do ventrículo esquerdo.
NOTA: O mouse inteiro está duro neste ponto e agora pode ser colocado em um recipiente rotulado de 4% PFA durante a noite a 4 °C. Nesta fase, é possível dissecar os tecidos do CNS e colocá-los individualmente em fixação durante a noite. Neste trabalho, todo o mouse é colocado em fixação, pois isso encurta o intervalo entre fixação e colocação a 4 °C. Isso também evita qualquer possível distorção mecânica do tecido nervoso que possa ocorrer se os animais forem pré-dissecados antes que a fixação noturna seja concluída.
4. Dissecção do CNS
- Prepare os seguintes instrumentos para dissecção lavando com água seguida de 70% de etanol: tesoura, fórceps da pele, fórceps fenestrados curvos, fórceps finos curvos, fórceps finos retos, tesoura fina.
- Rotule quatro tubos por mouse da seguinte forma e preencha com sacarose estéril de 20%: Mouse ID, Brain 1, Mouse ID, Brain 2, Mouse ID, Lumbar, Mouse ID, Cervical.
- Remova o mouse da solução PFA e limpe-o com uma toalha de papel para remover o excesso de PFA.
- Usando a tesoura grande, remova a cabeça do mouse cortando o pescoço.
- Coloque o corpo na solução PFA. Retenha a cabeça para dissecar o cérebro do crânio.
- Para dissecar o cérebro, comece refletindo a pele craniana para a frente para expor todo o crânio (Figura 4A).
- Faça um corte raso no canal auditivo usando a tesoura de dissecação fina para obter entrada no crânio
- Continue este corte ao longo do seio transversal até que o crânio seja cortado todo o caminho entre ambos os canais auditivos.
- Faça um corte perpendicular ao corte anterior ao longo da fissura longitudinal até a porção mais rostral do crânio (aproximadamente entre os olhos).
- Usando as fórceps curvas fenestradas, reflita o crânio lateralmente para expor o cérebro. Continue removendo o crânio até que todo o cérebro, incluindo as lâmpadas olfativas, sejam expostos.
- Comece a dissecar a região caudal do crânio fazendo um corte através do osso occipital e lentamente continuando este corte em direção ao foien magnum.
- Reflita os dois pedaços do crânio lateralmente para expor o cerebelo e o tronco cerebral caudalmente (Figura 4B).
- Use as fórceps curvas ultrafinas para separar as lâmpadas olfativas do crânio anterior e comece a descascar o cérebro da base do crânio começando pelas lâmpadas olfativas.
- À medida que o cérebro é descascado da base do crânio, use fórceps ultrafinos para cortar os nervos cranianos e permitir a remoção do cérebro.
- Continue retirando o cérebro da base do crânio até que todo o cérebro intacto seja removido (Figura 4C,D).
- Corte o cérebro ao meio ao longo da fissura longitudinal para separar os hemisférios direito e esquerdo um do outro (Figura 4E,F).
- Coloque um hemisfério no tubo do cérebro 1 e o segundo hemisfério no tubo do cérebro 2 . Armazene esses tubos a 4 °C até que os hemisférios cerebrais afundem (aproximadamente durante a noite).
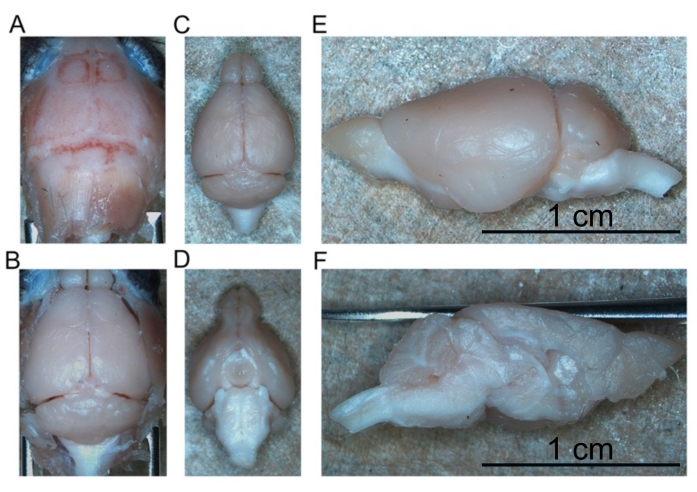
Figura 4: Remoção do cérebro fixo. (A) Topo do crânio. (B) Cérebro exposto dentro do crânio. (C) Cérebro isolado (aspecto dorsal). (D) Cérebro isolado (aspecto ventral). (E) Hemisfério esquerdo (aspecto lateral). (F) Hemisfério esquerdo (aspecto medial). Barras de escala = 1 cm (E e F). Clique aqui para ver uma versão maior desta figura.
- Para dissecar a medula espinhal, remova o corpo do rato do PFA e borre-o seco.
- Coloque o mouse sobre um bloco de dissecação de isopor na posição propensa e fixe as patas no bloco usando quatro agulhas.
- Comece a dissecção cortando a pele pela linha média do rato do pescoço à cauda para expor toda a parte traseira.
- Reflita o músculo e a fáscia nas costas para expor a parte posterior da coluna vertebral.
- Começando na mais vértebra craniana, use a tesoura de dissecação fina para cortar a lâmina, evitando a medula espinhal (Figura 5A).
- Coloque os fórceps curvos ultrafinos sob a lâmina e puxe para cima para fraturar as vértebras para expor a medula espinhal (Figura 5B).
- Use os fórceps curvos para refletir as vértebras fraturadas e expor as regiões mais laterais da medula espinhal.
- Continue este processo para as próximas vértebras colocando os fórceps curvados ultrafinos abaixo da lâmina e fraturando as vértebras. Continue a fraturar vértebras até que toda a coluna cervical e a coluna torácica sejam expostas (Figura 5C).
- Continue expondo a medula espinhal até o fim da medula espinhal lombar (Figura 5D).
- Usando uma lâmina afiada, corte todo o caminho através da medula espinhal midtorácica.
- Usando os fórceps curvos ultrafinos, transecte os nervos espinhais lateralmente da coluna vertebral e da fáscia anterior à medula espinhal para separar a medula espinhal cervical lentamente da coluna vertebral.
- Continue dissecando a medula espinhal cervical até que esteja livre das vértebras (Figura 5E). Coloque a medula espinhal cervical-midthoracic no tubo rotulado cervical. Armazene este tubo a 4 °C até que a medula espinhal cervical afunde (aproximadamente durante a noite).
- Continue a fraturar as vértebras torácicas até a cauda equina conforme detalhado nas etapas 4.22 a 4.25. Quando a cauda equina estiver exposta, use uma lâmina afiada para cortar a medula espinhal 1 cm abaixo da medula espinhal lombar (Figura 5F).
- Disseque a medula espinhal lombar longe das vértebras como descrito nas etapas 4.26-4.27. Coloque a medula espinhal cauda equina lombar-midina no tubo rotulado lombar. Armazene este tubo a 4 °C até que a medula espinhal lombar afunde (aproximadamente durante a noite).
- Quando todos os tecidos tiverem afundado em 20% de sacarose, transfira-os para tubos rotulados de 30% de sacarose até que tenham afundado ou por 3 dias.
NOTA: Os tecidos espinhais muitas vezes não afundam a 30% de sacarose.
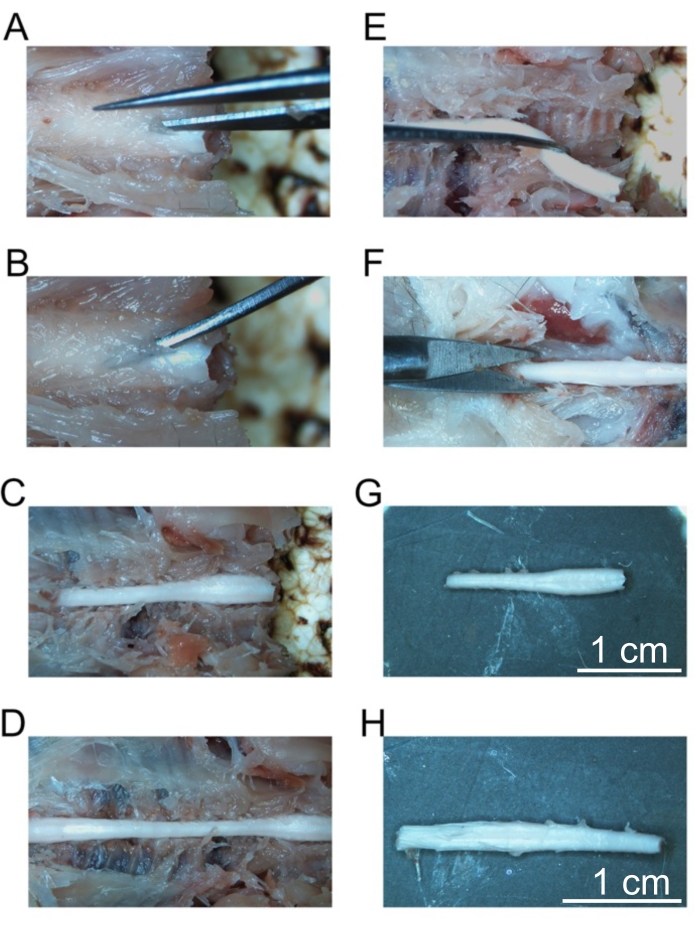
Figura 5: Remoção de segmentos fixos da medula espinhal. (A) Corte inicial na lâmina das vértebras cervicais. (B) Colocação de fórceps curvos para fraturar vértebras individuais. (C) A coluna cervical exposta. (D) Coluna cervical, torácica e lombar exposta. (E) Remoção da coluna cervical após cortar os nervos espinhais. (F) Corte da coluna sacral. (G) Coluna cervical isolada. (H) Coluna lombar isolada. Barras de escala = 1 cm (G e H). Clique aqui para ver uma versão maior desta figura.
5. Incorporação de OCT e armazenamento de tecidos
- Para cada mouse, rotule quatro criomolds em forma retangular: Mouse ID, Right Hemisfério, Data de incorporação; ID do Mouse, Hemisfério Esquerdo, Data de incorporação; ID do mouse, cervical, data de incorporação; ID do mouse, Lombar, Data de incorporação.
- Configure um recipiente de isopor e pendure um copo de metal acima do recipiente.
- Encha o recipiente de isopor com nitrogênio líquido aproximadamente no meio do caminho. Encha o copo de metal com 2-metilbutano fresco aproximadamente no meio do caminho.
NOTA: 2-Metilbutano é tóxico, altamente volátil e inflamável. Deve-se tomar cuidado para evitar a inalação, realizando etapas subsequentes em um capô de fumaça e longe das fontes de combustão. - Abaixe lentamente o copo de metal no nitrogênio líquido e evite qualquer respingo do nitrogênio líquido no copo de metal.
- Deixe o 2-metilbutano começar a congelar. Enquanto o 2-Metilbutano está congelando, tire o tecido desejado da solução de sacarose de 30% e limpe-o em um lenço sem poeira.
- Coloque o tecido em uma criomolda com a região rostral apontada para a parte superior (sem rótulo) do molde.
- Despeje com moderação a temperatura de corte ideal incorporando o meio (OCT) sobre o tecido no criomold, usando apenas o suficiente para cobrir o tecido completamente. Evite usar OCT excessivo, pois isso pode causar rachaduras. Remova quaisquer bolhas do OCT.
- Quando congelado 2-metilbutano tiver coberto totalmente a superfície interna do copo de metal, mergulhe totalmente o criomold na fase líquida de 2-metilbutano por 12 s. Depois dos 12, coloque o criomold para drenar em um quadrado de papel alumínio rotulado e enrolar todo o criomold. Coloque imediatamente o criomold embrulhado em gelo seco e evite descongelar. Certifique-se de que o OCT/criomold congelado esteja sempre coberto com gelo seco.
- Repita as etapas 5.6 a 5.8 para todos os tecidos. Coloque o tecido para um rato em um pequeno saco plástico selado e, em seguida, em um recipiente selado e crio-seguro. Guarde este recipiente no congelador profundo de -80 °C até que as seções sejam cortadas.
6. Criosectioning
- Antes de criocendo, certifique-se de que a temperatura da câmara criostat e a cabeça do espécime sejam definidas para as configurações apropriadas.
NOTA: Uma temperatura de câmara de -20 °C, uma temperatura da cabeça de uma amostra de -20 °C, e uma espessura de seção de 30 μm são usadas para cortar seções cerebrais. Para cortar seções da medula espinhal, são utilizadas uma temperatura de câmara de -23 °C, uma temperatura da cabeça de uma amostra de -30 °C e uma espessura de seção de 30 μm. É importante notar que as configurações de criostat (especialmente a temperatura da cabeça da amostra) precisarão ser ajustadas durante a secção para resolver problemas com a qualidade do tecido. Geralmente, a temperatura da cabeça da amostra é reduzida para corrigir a mancha de tecido. Por outro lado, a temperatura da cabeça da amostra é aumentada para corrigir o excesso de enrolamento tecidual. - Retire o bloco OCT desejado do congelador -80 °C e coloque o bloco criomold/OCT desembrulhado na câmara criostat.
- Deixe o bloco OCT se aclimatar à temperatura da câmara por 30 minutos.
- Limpe um mandril com 70% de etanol e limpe-o com um lenço sem poeira. Coloque o mandril limpo na câmara criostat e faça um círculo do tamanho de uma moeda de OCT no mandril. Deixe o OCT congelar (aproximadamente 1-2 min).
- Quando o OCT tiver congelado, coloque um ponto do tamanho de ervilha de OCT fresco no mandril e coloque imediatamente o bloco de OCT de tecido no mandril. Certifique-se de que o tecido está perfeitamente perpendicular ao mandril antes que o OCT congele completamente.
NOTA: Geralmente, a região mais rostral do cérebro é colocada em direção ao mandril para que a secção comece a partir da extremidade caudal. Para a medula espinhal, geralmente, a região mais caudal é colocada no mandril para que a seção comece a partir da extremidade rostral. - Quando o OCT tiver endurecido, coloque mais OCT ao redor da base do bloco OCT para agir como suporte estrutural durante a secção. Quando este suporte tiver endurecido ligeiramente, coloque o mandril na cabeça do espécime e permita que o bloco OCT atinja a temperatura da cabeça do espécime por 30 minutos.
- Coloque uma lâmina de microtome no suporte da lâmina e limpe a placa antiroll. Ajuste a distância da placa antiroll para garantir que o tecido esteja passando logo abaixo da placa durante a secção. Para obter mais informações sobre o posicionamento correto da placa antiroll, consulte o manual criostat.
- Depois que o bloco OCT se aclimatar à temperatura da cabeça da amostra, comece a aparar o bloco OCT até que o tecido seja atingido. Quando o tecido estiver visível, mude de corte para seção e comece a cortar seções de 30 μm. Mova-se de lado a placa antiroll e, usando um slide de microscópio, pegue a seção.
- Continue cortando e coletando seções até que esteja satisfeito com a localização anatômica das seções ou todo o tecido tenha sido cortado. Coloque os slides para secar à temperatura ambiente por 1-3 dias. Após a secagem, coloque os slides em uma caixa de slides e coloque esta caixa em um saco plástico selado. Rotule a bolsa com o ID do mouse e informações de tecido antes de colocar os slides no congelador profundo de -80 °C.
7. Coloração imunofluorescente
- Descongele os slides por 1h em temperatura ambiente.
- Coloque os slides em um frasco de slides horizontais e lave as seções 3 vezes em PBS por 10 minutos cada lavagem à temperatura ambiente em um shaker.
- Prepare o buffer de bloqueio (2% BSA + 0,3% Triton-X-100 em 1x PBS). Use aproximadamente 1 mL por slide.
- Crie uma câmara umidificada adicionando água ao fundo. Coloque os slides voltados para cima horizontalmente e não deixe que eles sequem. Adicione 1 mL de tampão de bloqueio a cada slide e incubar por pelo menos 1 h em temperatura ambiente.
- Prepare a solução de anticorpos primários diluindo o anticorpo primário no tampão de anticorpos (0,7% BSA + 0,3% Triton-X-100 em 1x PBS).
NOTA: Para o anticorpo fosforilado α-sinucleína, utilizou-se um fator de diluição de 1:500. - Adicione 200-300 μL de solução de anticorpos primários por slide. Cubra com uma mancha de cobertura para dispersar o anticorpo e incubar a 4 °C durante a noite.
- No dia seguinte, remova os slides da câmara umidificada e coloque-os em um frasco de Coplin vertical cheio de 1x PBS para permitir que o deslizamento de tampas caia. Faça isso para cada slide individualmente e tome cuidado para não perturbar a seção de tecido ao remover a mancha de cobertura.
- Coloque os slides em um frasco de slides horizontais e lave as seções 3 vezes em PBS por 10 minutos cada lavagem à temperatura ambiente em um shaker.
NOTA: Todas as etapas subsequentes devem ser executadas com as luzes apagadas para evitar fotobleaching do fluoróforo! - Prepare a solução de anticorpos secundários diluindo o anticorpo secundário no tampão de anticorpos.
NOTA: Para a detecção de α-sinucleína fosfoilada, foi utilizado o anti-coelho secundário conjugado à Alexa 488 com fator de diluição de 1:500 no tampão de anticorpos (0,7% BSA + 0,3% Triton-X-100 em 1x PBS). - Coloque os slides horizontalmente na câmara umidificada e adicione 200-300 μL de solução de anticorpos secundários por slide. Cubra com um deslizamento para dispersar o anticorpo. Incubar em temperatura ambiente por pelo menos 2 h.
- Remova os slides da câmara umidificada e coloque-os em um frasco de Coplin vertical preenchido com 1x PBS para permitir que a mancha de cobertura caia. Faça isso para cada slide individualmente e tome cuidado para não perturbar a seção de tecido ao remover a mancha de cobertura.
- Coloque os slides em um frasco de slides horizontais e lave as seções 3 vezes em PBS por 10 minutos cada lavagem à temperatura ambiente em um shaker.
- Seque o lado dos slides sobre uma toalha e agite o excesso de PBS.
- Adicione 3 gotas de meio de montagem a cada slide. Adicione a mancha de cobertura e empurre suavemente bolhas com um par de fórceps pressionando o deslizamento antes da imagem por microscopia confocal.
Resultados
A perfusão de alta qualidade é indicada pela ausência de sangue no fígado, medula espinhal e estruturas profundas de CNS (Figura 4C e Figura 5G,H). O sangue retido abaixo da dura-mãe (por exemplo, dentro dos seios venosos) ou entre a dura-mater e o crânio não tem sido problemático, pois este sangue não está dentro do parênquimo cerebral. O sangue visto na Figura 4A está localizado entre o crânio e a matéria dura e, portanto, não é problemático ou sugestivo de má qualidade de perfusão. O cérebro fresco e a medula espinhal são bastante macios e facilmente danificados durante o manuseio. Tecidos adequadamente fixos, em comparação, são firmes. Para avaliar a qualidade do tecido e a preservação da morfologia dos tecidos por este método de perfusão, este trabalho demonstra a detecção de α-sinucleína fosforilada na medula espinhal midbrain e lombar de um rato de 15 meses de idade e de um rato de 7 meses de idade expressando a53T α-sinucleína (Figura 6).
A mutação A53T é superrepresentada em pacientes com doença de Parkinson (DP) autossômica dominante. Além disso, a α-sinucleína humana com a mutação A53T pode recapitular muitas das características da DP humana quando expressa em camundongos 6,7. A fosforilação de α-sinucleína no resíduo Serine 129 foi mostrada in vivo e in vitro para induzir a agregação de α-sinucleína8. Os corpos de Lewey são o achado histológico clássico presente em pacientes com DP ou demência corporal de Lewey9. A maioria dos α-sinucleína presentes nos corpos de Lewey é fosforylated em Serine 12910,11. Como resultado, o acúmulo de α-sinucleína fosfoilada é usado como um marcador da gravidade histólógica da patologia pd. O presente estudo conclui que a α-sinucleína fosfoilada acumula-se em um nível significativamente maior em camundongos sintomáticos de 15,5 meses em relação a camundongos assintomáticos de 7 meses de idade que expressam A53T α-sinucleína humana. Isso é consistente com relatórios que descrevem um enriquecimento da citopatologia nos chifres anteriores da medula espinhal e no cérebro médio desses camundongos. 6 A partir disso, conclui-se que o método simplificado de perfusão descrito aqui fornece fixação de alta qualidade dos tecidos CNS para caracterização histológica a jusante.
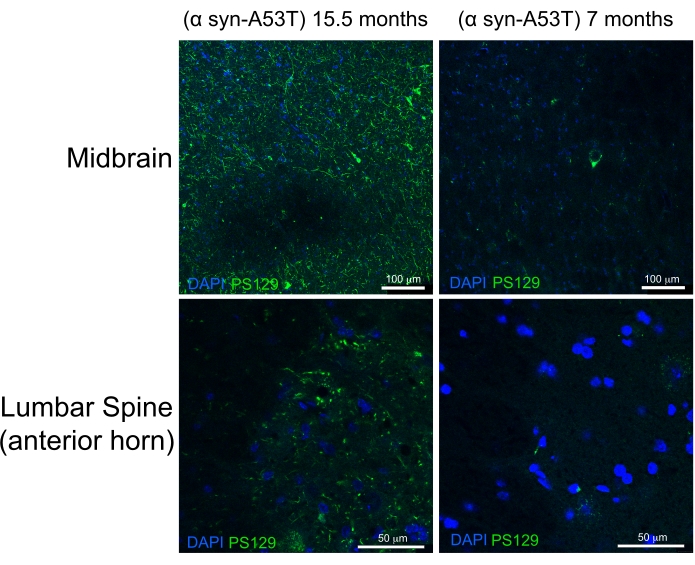
Figura 6: Rótulo para α-sinucleína fosfoilada em tecidos medular midbrain e lombar de um modelo de camundongo da Doença de Parkinson. O rato paralisado em fase final (15,5 meses) é comparado com o rato saudável de 7 meses. Ambos os camundongos expressam uma variante mutante propensa a dobras (A53T) da α-sinucleína humana que induz a patologia semelhante ao Parkinson. Barras de escala = 100 μm (painéis superiores) e 50 μm (painéis inferiores). Abreviação: α syn-A53T = Mutante A53T de α-sinucleína; DAPI = 4',6-diamidino-2-fenildole; PS129 = Serina fosfoilada 129 de α-sinucleína. Clique aqui para ver uma versão maior desta figura.
Discussão
Este trabalho descreve os passos críticos para a realização da perfusão transcárvia. Ao construir o aparelho de perfusão (seção de protocolo 1), é importante usar tubos flexíveis o suficiente para serem completamente ocluídos por um hemostat. Alguns tubos rígidos podem não ser suficientemente ocluídos por um hemostat e ainda podem permitir que pfa vaze na linha principal durante a perfusão inicial pbs. Ao preparar a solução de 4% pfa, é importante garantir que o pH seja fisiológico (7.4). Como a preparação da solução PFA envolve aquecê-lo a 65 °C, a solução deve ser resfriada até 25 °C antes de medir o pH, pois esta é a temperatura em que o pH é calibrado no medidor.
Ao fazer a incisão inicial no abdômen, deve-se tomar cuidado para evitar a laceração dos órgãos abdominais (seção 2 do protocolo). Ao dissecar superiormente em direção ao diafragma, é importante evitar a laceração do fígado, pois é comum o fígado ser aderente com a parede abdominal anterior. Para superar isso, o fígado é cuidadosamente e sem rodeios longe da parede anterior antes de continuar uma incisão em direção ao diafragma. Ao entrar na cavidade torácica através do diafragma, é importante evitar a laceração do coração, grandes vasos e o pulmão. Para evitar isso, a ponta da tesoura é mantida superficialmente e em um ângulo agudo com a caixa torácica.
A dissecção inicial para expor o coração leva aproximadamente 2 minutos da incisão inicial. Espera-se que durante este tempo, algum ar tenha entrado na ponta da agulha borboleta. A introdução deste ar na circulação do mouse produzirá perfusão de má qualidade. Portanto, é fundamental que a linha principal seja aberta e o PBS seja lavado pela agulha imediatamente antes da cannulação do coração para remover bolhas de ar. Idealmente, o coração é cânulado enquanto uma pequena gota de PBS flui através da ponta da agulha para garantir a completa ausência de ar ao perfurar o LV.
Quando a agulha entra na LV, não deve ir tão fundo a respeito de introduzir a ponta da agulha no ventrículo direito (RV). A colocação da agulha no RV ou além da válvula mitral resultará em "inflação" imediata dos pulmões quando a perfusão for iniciada. Isto é indesejável, e a agulha deve ser retirada ligeiramente para garantir a colocação da LV. Se a agulha for colocada corretamente, os pulmões permanecerão planos durante toda a perfusão. Quando a perfusão é iniciada, às vezes é observado que um líquido claro está emergindo da boca aberta do animal. Isso geralmente é devido a uma pressão de perfusão que é muito alta ou devido ao deslocamento da agulha dentro do coração. Os autores especulam que pressões elevadas de perfusão resultam em extravasão do perfusato do leito capilar arteriolar e fluxo retrógrado de PBS através da árvore brônquica para o esôfago e cavidade oral.
A pressão de perfusão deve ser reduzida diminuindo o nível de PBS na garrafa PBS ou baixando a altura da garrafa PBS. Alternativamente, se a agulha for colocada muito profundamente no ventrículo esquerdo, ela pode viajar através da válvula mitral e entregar perfusado ao átrio esquerdo. Isso pode resultar em fluxo retrógrado através das veias pulmonares e extravasação de perfusato nas artérias, como descrito acima. O despejo minucioso de sangue do sistema circulatório com PBS é especialmente importante para evitar a ligação cruzada induzida por fixação de componentes sanguíneos, resultando em oclusão do vaso após a posterior perfusão fixa. A liberação é efetivamente avaliada por uma mudança de cor do fígado e do fluxo de PBS a partir de uma incisão na base da cauda ventral. A liberação sanguínea é geralmente completa por 3 minutos de perfusão com PBS; no entanto, se os sinais visuais de liberação ocorrerem em tempos mais curtos, então fixação é introduzida antes de 3 min. Tempos de liberação mais longos não são recomendados, pois a perfusão fixação retardada leva a artefatos na estrutura fina cns1.
Quando o PFA está sendo administrado, é importante monitorar o nível da solução PFA na garrafa PFA. Encha a garrafa PFA se o nível de PFA cair para menos de 4 cm acima da boca da garrafa PFA. Após a conclusão da perfusão, o aparelho de perfusão deve ser completamente enxaguado com água destilada. Isso é importante, pois o PFA residual na linha principal contaminará a perfusão inicial do PBS com PFA e resultará em má qualidade da perfusão. Finalmente, agulhas de borboleta de 25 G são geralmente recomendadas para ratos adultos de tamanho médio na faixa de 20-30 g. No entanto, camundongos maiores ou menores podem exigir agulhas de bitola ligeiramente maiores ou menores, além do ajuste das garrafas fixas para fornecer taxas de fluxo ideais.
Para dissecção cns e incorporação de OCT (seção de protocolo 3), é comum que os tecidos da medula espinhal não afundem completamente em 30% de sacarose. Esses tecidos são, portanto, deixados em sacarose por 2 dias e depois incorporados em OUTUBRO, independentemente de afundarem ou não. Ao congelar tecidos em OUTUBRO, é possível que certos tecidos possam rachar quando colocados em 2-metilbutano resfriado. Isso é mais comum com o cérebro e geralmente ocorre quando muito OCT é colocado no tecido. Para evitar isso, coloque apenas o suficiente de OCT para cobrir as superfícies do tecido antes do congelamento imediato. Em alguns protocolos, rachaduras são menos comuns apesar da imersão completa em OUTUBRO. Isso geralmente é devido a um método de congelamento mais lento, como ao usar 2-metilbutano resfriado com gelo seco ou colocar o criomold em um bloco de gelo seco diretamente. O 2-metilbutano refrigerado a nitrogênio líquido é preferido neste trabalho, pois a taxa de congelamento é substancialmente mais rápida e pode preservar melhor a morfologia tecidual do que métodos de congelamento mais lentos.
Ao crioseccionar o tecido (seção de protocolo 4), é importante evitar múltiplos ciclos de congelamento. Portanto, é ideal cortar todas as seções de um único bloco de OCT para obter uma região cerebral específica para análise em vez de descongelar e recongelar áreas selecionadas. Se isso não for viável, depois de obter algumas seções, os usuários podem recongelar e armazenar os blocos OCT no congelador profundo de -80 °C mais 1-2 vezes para uso futuro.
Os principais benefícios deste método em relação à entrega mais tradicional de bomba ou pressão de ar de perfusato são os seguintes: (1) baixo custo e acessibilidade do aparelho de perfusão. (2) Os usuários não precisam manter manualmente a pressão no aparelho de perfusão durante toda a perfusão. (3) Pressão de perfusão menor e mais consistente do que outras alternativas de baixo custo para a perfusão, como a entrega de seringas. Usando a equação de Bernoulli, calcula-se que o aparelho de perfusão alimentado pela gravidade construído aqui manterá uma pressão de perfusão de aproximadamente 73 mm Hg quando as garrafas de perfusato forem colocadas a 1 m de elevação em relação à agulha. Dado que isso está significativamente abaixo da pressão arterial sistólica desses animais, esta pressão de perfusão é provavelmente suficientemente baixa para evitar a ruptura vascular12.
Até agora, os autores usaram com sucesso este sistema de perfusão para detectar a presença de α-sinucleína fosforilalada em um modelo de camundongos da doença de Parkinson. Durante este período, não foram encontradas limitações significativas com este método de perfusão que não estejam presentes com um método de entrega de perfusão da bomba. A maior limitação desta técnica é a natureza demorada da perfusão versus fixação de queda. Esta técnica é preferível a queda da fixação, pois a perfusão resulta na penetração mais profunda da fixação às estruturas do CNS. Uma segunda limitação desta técnica é que ela requer alguma habilidade cirúrgica para realizar, pois o coração deve ser cânulado rapidamente após a entrada na cavidade torácica. No entanto, com a experiência, usuários treinados podem rotineiramente canular o coração dentro de 1 minuto da incisão inicial no abdômen.
Divulgações
Os autores não declaram interesses financeiros concorrentes.
Agradecimentos
Os autores agradecem a Xiaowen Wang, Liam Coyne e Jason Grullon por sua ajuda no desenvolvimento deste protocolo. Este trabalho foi apoiado pelas bolsas NIH AG061204 e AG063499.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-Methylbutane (Certified ACS), Fisher Chemical | Fisher Scientific | 03551-4 | |
| Andwin Scientific Tissue-Tek O.C.T Compound | Fisher Scientific | NC1029572 | |
| Artman Instruments 4.5" Straight Castroveijo Spring Action Scissors | Amazon | B0752XHK2X | "fine scissors" |
| BD General Use and PrecisionGlide Hypodermic Needles, 18 G | Fisher Scientific | 14-826-5D | |
| BD General Use and PrecisionGlide Hypodermic Needles, 22 G | Fisher Scientific | 14-826B | |
| Corning PES Syringe Filters | Fisher Scientific | 09-754-29 | |
| Cytiva HyClone Phosphate Buffered Saline (PBS), 10x | Fisher Scientific | SH30258 | |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | |
| Fisher BioReagents Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | |
| Fisherbrand Curved Medium Point General Purpose Forceps | Fisher Scientific | 16-100-110 | "curved fenestrated forceps" |
| Fisherbrand Curved Very Fine Precision Tip Forceps | Fisher Scientific | 16-100-123 | "curved fine forceps" |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisher Scientific | 13-711-9AM | |
| Fisherbrand High Precision Straight Tapered Ultra Fine Point Tweezers/Forceps | Fisher Scientific | 12-000-122 | "straight fine forceps" |
| Fisherbrand Micro Spatulas with Rounded Ends | Fisher Scientific | 21-401-5 | |
| Fisherbrand Porcelain Buchner Funnels with Fixed Perforated Plates | Fisher Scientific | FB966J | |
| Fisherbrand Premium Cover Glass, 24 x 50 | Fisher Scientific | 12-548-5M | |
| Fisherbrand Premium Tissue Forceps 1X2 Teeth 5 in. German Steel | Fisher Scientific | 13-820-074 | "skin forceps" |
| Fisherbrand Reusable Heavy-Wall Filter Flasks | Fisher Scientific | FB3002000 | |
| Fisherbrand Standard Dissecting Scissors | Fisher Scientific | 08-951-20 | "dissecting scissors" |
| Fisherbrand Sterile Syringes for Single Use | Fisher Scientific | 14-955-464 | |
| Fisherbrand Straight Locking Hemostats | Fisher Scientific | 16-100-115 | |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Fisherbrand Vinyl Tubing and Connector Kits, 1/4 in. | Fisher Scientific | 14-174-1C | |
| Fisherbrand Wet-Strengthened Qualitative Filter Paper Circles | Fisher Scientific | 09-790-12F | |
| Fisherbrand Y Connector with 1/4 in. ID - Polypropylene - QC | Fisher Scientific | 01-000-686 | |
| Garvey Economy Single Edge Cutter Blade | Amazon | B001GXFAEQ | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, DyLight 488 | ThermoFisher Scientific | 35552 | |
| Ideal Clamp Stant High-Pressure Clamps | Fisher Scientific | 14-198-5A | "hose clamps" |
| IMEB, Inc Sakura Accu-Edge Low Profile Microtome Blades, Dispoisable | Fisher Scientific | NC9822467 | |
| Kawasumi 25 Gauge Standard Winged Blood Collection Set | Fisher Scientific | 22-010-137 | "butterfly needle" |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | Fisher Scientific | 06-666 | |
| Molecular Probes ProLong Diamond Antifade Mountant with DAPI | Fisher Scientific | P36962 | |
| Nalgene Narrow-Mouth Right-to-Know LDPE Wash Bottles | ThermoFisher Scientific | 2425-0506 | "buffer bottles" |
| PAP pen | abcam | ab2601 | |
| Paraformaldehyde Granular | Electron Microscopy Systems | 19210 | |
| Pyrex Glass Drying Dishes, 34.9 x 24.9 x 6 cm | Fisher Scientific | 15-242D | |
| Recombinant Anti-Alpha-synuclein (phospho S129) antibody [EP1536Y] | abcam | ab51253 | |
| Sodium Hydroxide | Sigma-Aldrich | 221465-2.5kg | |
| Stainless Steel Drinking Cup 18-oz | amazon | B0039PPO9U | |
| Sucrose for Molecular Biology CAS: 57-50-1 | Us Biological | S8010 | |
| Triton X-100 | Us Biological | T8655 | |
| Vetone Fluriso Isoflurane USP | MWI Animal Health | 502017 |
Referências
- Tao-Cheng, J. H., Gallant, P. E., Brightman, M. W., Dosemeci, A., Reese, T. S. Structural changes at synapses after delayed perfusion fixation in different regions of the mouse brain. Journal of Comparative Neurology. 501 (5), 731-740 (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments: JoVE. (65), e3564 (2012).
- McFadden, W. C., et al. Perfusion fixation in brain banking: a systematic review. Acta Neuropathologica Communications. 7 (1), 146 (2019).
- Lamberts, R., Goldsmith, P. C. Fixation, fine structure, and immunostaining for neuropeptides: perfusion versus immersion of the neuroendocrine hypothalamus. Journal of Histochemistry and Cytochemistry. 34 (3), 389-398 (1986).
- Adickes, E. D., Folkerth, R. D., Sims, K. L. Use of perfusion fixation for improved neuropathologic examination. Archives of Pathology and Laboratory Medicine. 121 (11), 1199-1206 (1997).
- Giasson, B. I., et al. Neuronal alpha-synucleinopathy with severe movement disorder in mice expressing A53T human alpha-synuclein. Neuron. 34 (4), 521-533 (2002).
- Martin, L. J., et al. Parkinson's disease alpha-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. Journal of Neuroscience. 26 (1), 41-50 (2006).
- Fujiwara, H., et al. alpha-Synuclein is phosphorylated in synucleinopathy lesions. Nature Cell Biology. 4 (2), 160-164 (2002).
- Kalia, L. V., Lang, A. E. Parkinson's disease. Lancet. 386 (9996), 896-912 (2015).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. Journal of Biological Chemistry. 281 (40), 29739-29752 (2006).
- Kahle, P. J., et al. Hyperphosphorylation and insolubility of alpha-synuclein in transgenic mouse oligodendrocytes. EMBO Reports. 3 (6), 583-588 (2002).
- Mattson, D. L. Comparison of arterial blood pressure in different strains of mice. American Journal of Hypertension. 14, 405-408 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados