Method Article
Un metodo di perfusione transcardica alimentato per gravità per l'analisi istologica del sistema nervoso centrale del topo
In questo articolo
Riepilogo
Viene presentato un comodo metodo di perfusione alimentato a gravità per l'analisi istologica del sistema nervoso centrale del topo. Il rilevamento immunofluorescente della α-sinucleina fosforilata è dimostrato in un modello murino di malattia di Parkinson. Questo lavoro descrive anche in modo completo le fasi di perfusione transcardica, dissezione, congelamento / incorporamento dei tessuti e sezionamento congelato.
Abstract
L'analisi istologica di campioni di cervello e midollo spinale isolati dai topi è una pratica comune per la valutazione della patologia in questo sistema modello. Per mantenere la morfologia di questi tessuti delicati, è di routine somministrare un fissativo chimico come la paraformaldeide attraverso la cannulazione del cuore in animali anestetizzati (perfusione transcardica). La perfusione transcardica del cuore del topo si è tradizionalmente basata sull'uso di pompe peristaltiche o pressione dell'aria per fornire sia le soluzioni saline che fissative necessarie per questo processo. Come alternativa facilmente accessibile a questi metodi, questo lavoro dimostra l'uso di un metodo di consegna perfusato alimentato a gravità che utilizza materiali disponibili nella maggior parte dei negozi di ferramenta.
Per convalidare questo nuovo metodo di perfusione, questo lavoro dimostra tutti i passaggi successivi necessari per il rilevamento sensibile della α-sinucleina fosforilata sia nel cervello che nel midollo spinale. Inclusi in questi passaggi sono la dissezione dei tessuti fissi del cervello e del midollo spinale, il rapido congelamento / incorporamento e la criosezione dei tessuti e la colorazione immunofluorescente. Poiché questo metodo si traduce nella consegna di tutto il corpo del fissativo, può anche essere usato per preparare altri tessuti non neuronali per l'analisi istologica.
Introduzione
La caratterizzazione istologica della patologia nel sistema nervoso centrale del topo (SNC) è una tecnica di routine utilizzata negli studi di neurodegenerazione. Poiché i tessuti neuronali si degradano rapidamente dopo la morte, è pratica comune fornire un fissativo chimico come la paraformaldeide ai tessuti del SNC per preservare la loro morfologia 1,2. La fissazione chimica può essere eseguita sia attraverso la perfusione di tutto il corpo con una soluzione fissativa o attraverso l'isolamento dei tessuti e la loro immersione in una soluzione fissativa (chiamata "fissazione della goccia"). La perfusione è il metodo preferito di somministrazione fissativa, poiché la fissazione delle gocce potrebbe non consentire una rapida penetrazione della soluzione fissativa nelle strutture profonde del SNC 3,4,5. Inoltre, poiché è difficile rimuovere il midollo spinale non fissato dalla colonna vertebrale, la consegna della soluzione fissativa tramite perfusione consente la conservazione in situ dell'anatomia microscopica e grossolana del midollo spinale e irrigidisce il tessuto per ridurre al minimo i danni durante la rimozione.
La fornitura del tampone e delle soluzioni fissative necessarie per la fissazione viene comunemente eseguita utilizzando pompe disponibili in commercio o pressione dell'aria. L'erogazione per gravità del perfusato può servire come alternativa all'erogazione della pompa per i seguenti motivi: (1) L'erogazione della pressione della pompa o dell'aria può in alcuni casi richiedere all'utente di mantenere manualmente la pressione nel sistema durante la perfusione. La somministrazione per gravità del perfusato può essere mantenuta senza l'intervento dell'utente. (2) Un apparecchio perfusato erogato per gravità può essere costruito a basso costo per l'utente ottenendo materiali disponibili da fornitori scientifici standard. Questo lavoro descrive come costruire un semplice dispositivo di perfusione per gravità usando flaconi di lavaggio e tubi in vinile. Utilizzando un modello murino della malattia di Parkinson, questo lavoro dimostra l'efficacia di questo sistema nel perfondere i tessuti del cervello e del midollo spinale prima del loro isolamento per il sezionamento congelato. Questo lavoro descrive in modo completo tutti i passaggi, le tecniche e i materiali necessari per sezionare il tessuto fisso dall'animale, congelare / incorporare rapidamente e criosezionare il tessuto e rilevare la presenza di α-sinucleina fosforilata sia nel cervello che nel midollo spinale tramite microscopia a immunofluorescenza indiretta.
Protocollo
I dati e le fasi sperimentali presentati in questo protocollo sono stati generati utilizzando topi C57BL/ 6J. Tutti i metodi che coinvolgono animali sono stati approvati dalla State University of New York Upstate Medical University Institutional Animal Care and Use Committee.
1. Costruzione di apparati di perfusione e piattaforma di dissezione
- Come mostrato nella Figura 1, tagliare le cannucce interne da due flaconi di lavaggio da 500 ml tagliandole a filo sul lato interno del tappo avvitato con una lama di rasoio affilata. Tagliare un foro quadrato di 4 cm x 4 cm sul fondo di ogni flacone tampone. Tagliare un piccolo foro sul fondo di ogni bottiglia per consentire il passaggio di una microspatula piegata in acciaio inossidabile.
- Creare una curva a forma di "S" nelle microspatule in modo che possano essere utilizzate come ganci per appendere le bottiglie tampone. Inserire le microspatule piegate nelle apposite aperture nelle bottiglie tampone.
- Tagliare due tubi di 25 cm di lunghezza e collegarli strettamente con le uscite esterne della cannuccia della bottiglia. Unire le estremità di questi tubi insieme al connettore Y. Tagliare 2 m di tubo e unirlo all'estremità libera del connettore a Y.
- Rimuovere lo stantuffo dalla siringa da 1 mL e tagliare la siringa a circa 6 cm di distanza dalla punta della siringa. Tagliare la siringa segnando prima la plastica con una lama di rasoio e poi spezzando bruscamente la plastica della siringa.
- Inserire la faccia tagliata della siringa nell'estremità libera del tubo di plastica. Inserire a una profondità sufficiente per garantire una tenuta ermetica.
NOTA: è importante che tutte le connessioni all'interno dell'apparecchio di perfusione siano sufficientemente strette da evitare perdite. In caso di connessioni allentate, piccoli morsetti per tubi flessibili in acciaio inossidabile possono essere posizionati e serrati alle giunzioni come desiderato per garantire una tenuta ermetica, se necessario. - Etichettare una bottiglia tampone come PFA e una bottiglia come PBS (buffer). Misurare circa 1/3 della lunghezza lontano dall'apertura della bottiglia e tracciare una linea attorno alla circonferenza della bottiglia a questo punto per indicare il livello di riempimento appropriato delle soluzioni perfusate.
- Raddrizzare e quindi creare un anello in una grande graffetta che può adattarsi alla circonferenza del tubo. Posizionare questo anello attorno al tubo appena prossimale alla siringa.
- Posizionare un blocco di polistirolo di dimensioni appropriate nel vassoio di vetro. Posizionare le estremità della graffetta nel blocco di polistirolo per fissare il tubo.
- Utilizzando asciugamani di carta, sollevare l'estremità anteriore del vassoio di vetro di circa 2 cm.
NOTA: Questo posizionerà il mouse a circa 20 ° della posizione di Trendelenburg (inclinazione all'indietro) per consentire una più facile visualizzazione del diaframma durante la dissezione e incoraggiare il drenaggio dei liquidi durante la perfusione.
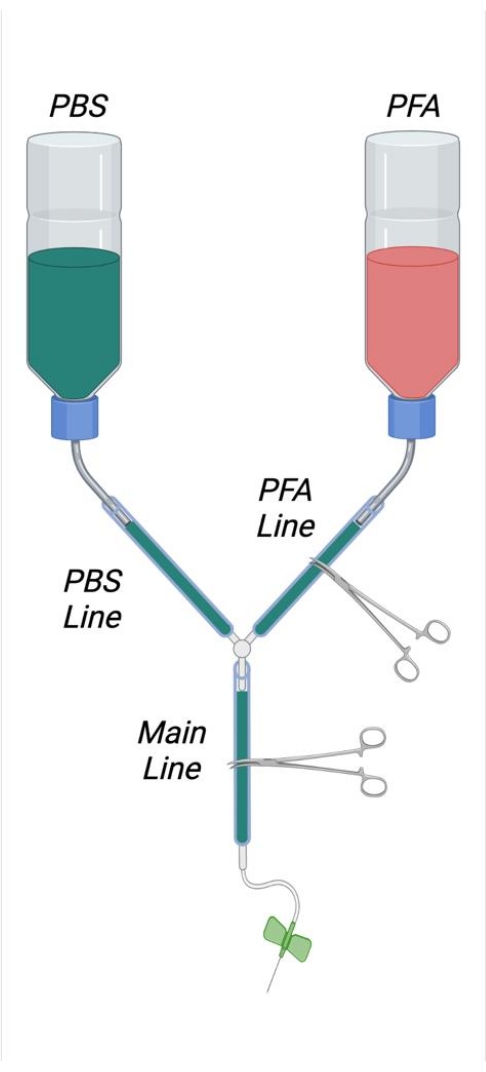
Figura 1: Diagramma raffigurante l'apparato di perfusione assemblato. Abbreviazioni: PBS = soluzione salina tamponata con fosfato; PFA = paraformaldeide. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Preparazione della soluzione di paraformaldeide (PFA)
NOTA: la soluzione di PFA deve essere preparata fresca il giorno della perfusione e scartata alla fine della perfusione in un contenitore di rifiuti designato prima dello smaltimento da parte di personale qualificato. Questo protocollo produce 1 L di soluzione di PFA al 4%, che è sufficiente per perfondere circa 4 topi. Il PFA è altamente tossico e bisogna fare attenzione per evitare l'inalazione o il contatto diretto con la pelle in polvere o liquido. La maggior parte delle fasi di preparazione vengono quindi eseguite indossando guanti, occhiali protettivi e un cappotto da laboratorio sotto un cappuccio di fumo.
- Risciacquare un becher da 1 L con acqua distillata e riempire con circa 800 mL di 18 mΩ di biologia molecolare H2O.
- Riscaldare il becher di H2O in un forno a microonde per 3 minuti o fino a quando la temperatura dell'acqua raggiunge i 65 °C. Disporre su una piastra riscaldante/agitatrice conservata in una cappa aspirante.
- Risciacquare una canna da agitazione con acqua distillata e metterla nell'acqua calda. Avviare l'agitatore e girare la piastra calda a fuoco medio. Assicurarsi che la temperatura dell'acqua non superi i 70 °C.
- Indossare una maschera chirurgica, guanti, occhiali protettivi e camice da laboratorio e misurare 40 g di polvere di PFA. Versare questa polvere nell'acqua riscaldata.
- Utilizzando una pipetta di trasferimento, aggiungere alcune gocce di 5 M NaOH alla soluzione. Lasciare che la polvere di PFA si dissolva completamente. Se la polvere non si è completamente sciolta dopo pochi minuti, aggiungere gocce di 5 M NaOH secondo necessità.
- Una volta che quasi tutto il PFA si è sciolto (apparirà leggermente torbido), interrompere l'agitazione / riscaldamento e aggiungere immediatamente 100 ml di 10x soluzione salina tamponata con fosfato (PBS). Infine, rabboccare l'acqua al segno di 1 L sul becher usando 18 mΩ di biologia molecolare H2O. Coprire il becher con un involucro di plastica e metterlo in un congelatore a -20 °C fino a quando la soluzione raggiunge la temperatura ambiente (circa 45 min).
- Calibrare un pHmetro utilizzando gli standard appropriati. Mentre il becher è su una piastra di agitazione, misurare il pH della soluzione e aggiungere HCl fino a quando il pH raggiunge 7,4. Se necessario, aggiungere 5 M NaOH per aumentare il pH se è troppo basso.
- Collegare un pallone sottovuoto per aspirare e posizionare un imbuto Büchner in ceramica pulita con carta da filtro nel pallone. Accendere il vuoto e bagnare la carta da filtro utilizzando una pipetta di trasferimento riempita con la soluzione di PFA al 4%.
- Versare lentamente la soluzione di PFA al 4% sulla carta da filtro fino a quando tutta la soluzione non è stata filtrata.
- Trasferire la soluzione filtrata in un contenitore pulito e protetto dalla luce e conservarla a 4 °C fino all'uso (conservare non più di 24 ore).
3. Perfusione transcardica "senza pompa"
- Nella cappa aspirante, posizionare un blocco di dissezione in polistirolo in un vassoio di vetro. Assicurarsi che il blocco di dissezione abbia 5-6 aghi corti per trattenere il topo durante l'intervento chirurgico e 2 aghi lunghi per sostenere il tubo di perfusione.
- Risciacquare l'apparecchio di perfusione con acqua distillata. Lasciare defluire tutta l'acqua prima di appendere l'apparato di perfusione. Appendere le bottiglie di perfusione 1 m sopra l'animale perfuso (per un topo da 20-30 g).
- Preparare una soluzione non sterile di 1x PBS utilizzando 10x PBS diluito con 18 mΩ di biologia molecolare H2O.
- Come mostrato nella Figura 2, bloccare la linea principale dell'apparato di perfusione usando un emostato. Blocca la linea PFA con un altro emostato.
NOTA: l'occlusione con più emostati può essere necessaria per linea per impedire completamente il flusso. - Riempire il contenitore tampone con 1x PBS a temperatura ambiente.
- Posizionare l'estremità della siringa dell'apparecchio di perfusione in un becher per raccogliere il tampone di scarto e rimuovere l'emostato che occlude la linea principale (Figura 2, a sinistra).
- Consentire al PBS di fluire attraverso la linea rimuovendo l'aria intrappolata picchiettando vigorosamente le pareti del tubo.
- Una volta che tutta l'aria è stata rimossa dal buffer e dalle linee principali, occludere il flusso posizionando un emostato sulla linea principale.
- Rimuovere l'emostato dalla linea PFA e consentire al PBS di fluire in modo retrogrado fino alla bottiglia di PFA mentre si estraggono eventuali bolle nella linea PFA (Figura 2, al centro). Continuare a consentire al PBS di entrare nella linea PFA fino a quando pbs non può essere visto appena sopra l'apertura della bottiglia. Occludere la linea PFA con un emostato per fermare il flusso nella bottiglia di PFA.
- Collegare l'ago per infusione a farfalla alla siringa per perfusione e lavare PBS attraverso la linea (aprendo l'emostato della linea principale) per rimuovere le bolle dalla siringa di perfusione. Chiudere l'emostato della linea principale.
- Assicurarsi che la bottiglia PBS sia ora circa 1/3 di pieno di PBS. Se necessario, lavare PBS attraverso la linea principale o riempire più PBS nella bottiglia tampone fino a 1/3 della sua piena capacità.
- Una volta che tutte le bolle sono state rimosse dalle linee PBS, PFA e principali, riempire il flacone di PFA con una soluzione di PFA al 4% a temperatura ambiente fino al segno nero sul flacone (circa 1/3° pieno) (Figura 2, a destra).
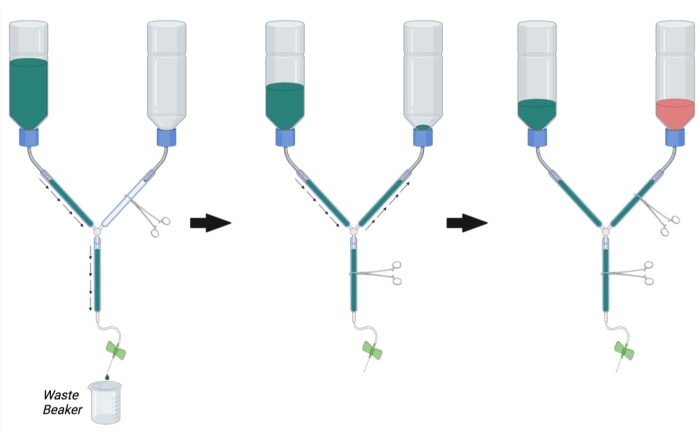
Figura 2: Preparazione dell'apparato di perfusione per la chirurgia di perfusione. Innanzitutto, chiudere l'emostato della linea PFA e aprire l'emostato sulla linea PBS e sulla linea principale. Riempire PBS e rimuovere le bolle dalla linea PBS e dalla linea principale. Quindi, riempire la linea PFA con PBS aprendo l'emostato sulla linea PFA e chiudendo l'emostato sulla linea principale. Rimuovere le bolle nella linea PFA. Infine, chiudere l'emostato sulla linea PFA quando il PBS raggiunge l'apertura del flacone PFA. Riempire la bottiglia di PFA 1/3 dipieno di PFA. Assicurarsi che il livello di PBS nella bottiglia PBS sia 1/3° pieno e riempire con PBS o scaricare PBS aprendo l'emostato della linea principale, se necessario. Abbreviazioni: PBS = soluzione salina tamponata con fosfato; PFA = paraformaldeide. Fare clic qui per visualizzare una versione più grande di questa figura.
- Preparati per la chirurgia di non sopravvivenza pulendo i seguenti strumenti con acqua seguita da etanolo al 70%: grandi forbici, forbici sezionanti fini, pinze cutanee, pinze curve fenestrate fini.
- Preparare l'anestesia posizionando salviette prive di polvere in un tubo conico da 50 ml. In una cappa aspirante, immergere accuratamente le salviette prive di polvere con isoflurano e posizionare il tubo aperto a testa in giù in un becher da 500 ml. Assicurarsi che non sia presente isoflurano liquido nella parte inferiore del becher e scartare qualsiasi isoflurano liquido prima di posizionare un topo nel becher.
- Posizionare il mouse nel becher e posizionare l'involucro di plastica sopra l'apertura per iniziare l'anestesia.
- Somministrare l'anestesia fino a quando il topo smette di respirare (circa 1 minuto e 30 s).
- Quando la respirazione si è fermata, rimuovere immediatamente il mouse dal becher e sostituire il cappuccio sul tubo conico da 50 ml.
- Verificare che il mouse sia sufficientemente anestetizzato utilizzando il riflesso del pizzico della punta. Se l'animale non è sufficientemente anestetizzato, somministrare più isoflurano come descritto al punto 3.15.
- Lavorando rapidamente, posizionare il mouse sul blocco di polistirolo e fissare le zampe verso l'esterno usando quattro aghi corti (ad esempio, aghi per siringhe da 22 G).
- Sollevando la pelle addominale con una pinza cutanea, utilizzare le grandi forbici per tagliare la parete addominale. Assicurati che nessun organo addominale venga tagliato!
- Continuare il taglio addominale superiormente verso il fegato. Staccare il fegato dalla parete addominale anteriore e continuare l'incisione iniziale in modo superiore verso il diaframma. Fermare questa incisione di circa 1 cm inferiore al diaframma. Fai attenzione a non tagliare il fegato!
- Continuare l'incisione iniziale lateralmente verso i lati destro e sinistro del diaframma per fare un'incisione a forma di "Y" (Figura 3A).
- Quando l'incisione raggiunge il diaframma, fai un buco nel diaframma usando le forbici di dissezione fine e taglia le costole sul lato destro dell'animale. Tagliare le costole approssimativamente a metà strada verso l'ascella destra.
- Fai un'incisione simile ma più lunga attraverso il lato sinistro del diaframma quasi fino all'ascella sinistra.
- Rifletti la parete toracica e fissala al blocco di polistirolo.
- Se necessario, sezionare il grasso da tutto il cuore per esporre il ventricolo sinistro. Identificare il ventricolo sinistro in base al colore relativamente più chiaro rispetto al ventricolo destro.
- Dopo aver identificato il ventricolo sinistro, tenere il cuore fermo usando una leggera pressione con la pinza curva fine. Aprire l'emostato della linea principale per consentire al PBS di fluire attraverso l'ago. Forare immediatamente il ventricolo sinistro e assicurarsi che l'ago sia inserito non più di 0,5 cm nel ventricolo. Prelevare leggermente l'ago se necessario.
NOTA: il posizionamento accurato dell'ago nel ventricolo sinistro è indicato dal flusso retrogrado di sangue nel tubo dell'ago. È importante assicurarsi che l'ago non sia inserito troppo in profondità nel ventricolo. Ciò può provocare un flusso retrogrado attraverso le vene polmonari o perforare il setto interventricolare. - Appoggiare il tubo della farfalla su una X realizzata in polistirolo utilizzando due grandi aghi da 18 G.
NOTA: Questo è fondamentale in quanto eviterà il movimento dell'ago della farfalla all'interno del cuore durante la perfusione. - Identificare la vena cava inferiore mentre esce dal fegato e transettarla usando le forbici di dissezione fine (Figura 3B). In alternativa, aprire l'atrio destro con le forbici.
- Aprire immediatamente la linea principale per consentire l'avvio della perfusione PBS (Figura 3C).
- Assicurarsi che il PBS stia drenando il blocco di polistirolo e nel vassoio di vetro sottostante. Se ciò non si verifica, regolare nuovamente l'angolo del vassoio o del blocco di polistirolo per consentire lo scarico dei liquidi nel vassoio di vetro.
- Continuare la perfusione PBS fino a quando il liquido che fuoriesce dalla vena cava inferiore è privo di sangue (circa 3 minuti).
NOTA: Il corretto posizionamento dell'ago nel cuore comporterà la pulizia visiva del sangue dal fegato, che diventerà di colore rosso a paglierino. Se ciò non si verifica, può essere risolto riposizionando l'ago per infusione all'interno del ventricolo sinistro. Una piccola incisione può essere fatta nella base della coda ventrale per valutare la qualità della perfusione. Una corretta perfusione si tradurrà in un chiaro PBS che scorre dall'incisione della base della coda. - Lavorando rapidamente, occludere la linea PBS con un emostato e aprire la linea PFA.
- Lasciare che il PFA si perfonda per alcuni minuti fino a quando la coda inizia ad arricciarsi. Una volta che la coda inizia ad arricciarsi, inizia un timer di 50 minuti. Se la coda non si arriccia dopo 5 minuti di perfusione di PFA, iniziare un timer di 50 minuti per la perfusione di PFA.
- Monitorare continuamente il livello di PFA nel flacone durante la perfusione per assicurarsi che il livello non scenda troppo in basso. Riempire più PFA nella bottiglia se il livello scende sotto i 2 cm sopra il coperchio della bottiglia.
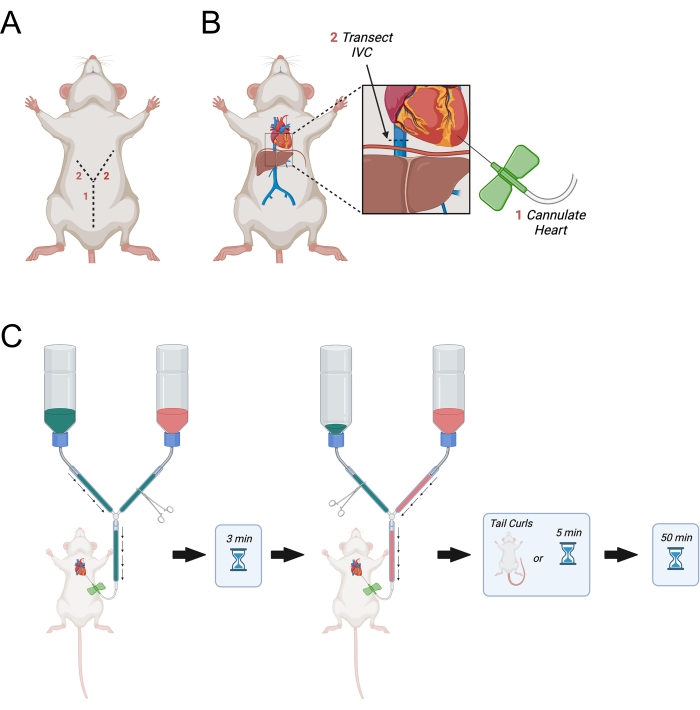
Figura 3: Diagramma raffigurante la perfusione transcardica. (A) La parete addominale viene prima tagliata, seguita da due incisioni che puntano lateralmente verso l'ascella formando una "Y". (B) Dopo essere entrati nella cavità toracica ed aver esposto il cuore, l'ago viene passato nel ventricolo sinistro. Successivamente, l'IVC o l'atrio destro viene transetto per consentire il drenaggio dei perfusati dopo che sono circolati attraverso il corpo. L'IVC è tagliato superiore al diaframma. C) Procedura di somministrazione dei perfusati. Abbreviazione = IVC = vena cava inferiore. Fare clic qui per visualizzare una versione più grande di questa figura.
- Dopo 50 minuti, occludere la linea principale con un emostato e prelevare l'ago dal ventricolo sinistro.
NOTA: l'intero mouse è rigido a questo punto e ora può essere collocato in un contenitore etichettato di PFA al 4% durante la notte a 4 °C. In questa fase, è possibile sezionare i tessuti del SNC e metterli individualmente in fissativo durante la notte. In questo lavoro, l'intero mouse viene posto in fissativo in quanto ciò riduce l'intervallo tra la fissazione e il posizionamento a 4 °C. Ciò evita anche qualsiasi possibile distorsione meccanica del tessuto nervoso che può verificarsi se gli animali vengono pre-sezionati prima che la fissazione notturna sia completa.
4. Dissezione del SNC
- Preparare i seguenti strumenti per la dissezione lavando con acqua seguita da etanolo al 70%: forbici, pinze cutanee, pinze fenestrate curve, pinze fini curve, pinze fini dritte, forbici fini.
- Etichettare quattro tubi per topo come segue e riempire con saccarosio sterile al 20%: ID topo, cervello 1, ID topo, cervello 2, ID topo, lombare, ID topo, cervicale.
- Rimuovere il mouse dalla soluzione di PFA e asciugarlo con un tovagliolo di carta per rimuovere il PFA in eccesso.
- Usando le grandi forbici, rimuovere la testa del mouse tagliando al collo.
- Posizionare il corpo nella soluzione di PFA. Trattenere la testa per sezionare il cervello dal cranio.
- Per sezionare il cervello, iniziare riflettendo la pelle cranica in avanti per esporre l'intero cranio (Figura 4A).
- Fai un taglio superficiale nel canale uditivo usando le forbici di dissezione fine per ottenere l'ingresso nel cranio
- Continua questo taglio lungo il seno trasversale fino a quando il cranio non viene tagliato completamente tra entrambi i canali uditivi.
- Fai un taglio perpendicolare al taglio precedente lungo la fessura longitudinale fino alla porzione più rostrale del cranio (approssimativamente tra gli occhi).
- Usando la pinza curva fenestrata, riflettere il cranio lateralmente per esporre il proencefalo. Continuare a rimuovere il cranio fino a quando l'intero proencefalo, compresi i bulbi olfattivi, è esposto.
- Inizia a sezionare la regione caudale del cranio facendo un taglio attraverso l'osso occipitale e continuando lentamente questo taglio verso il forame magnum.
- Riflettere i due pezzi di cranio lateralmente per esporre il cervelletto e il tronco cerebrale per via caudale (Figura 4B).
- Usa la pinza curva ultrafine per separare i bulbi olfattivi dal cranio anteriore e iniziare a staccare il cervello dalla base cranica a partire dai bulbi olfattivi.
- Mentre il cervello viene staccato dalla base del cranio, utilizzare pinze ultrafini per tagliare i nervi cranici e consentire la rimozione del cervello.
- Continuare a staccare il cervello dalla base del cranio fino a quando l'intero cervello intatto non viene rimosso (Figura 4C, D).
- Tagliare il cervello a metà lungo la fessura longitudinale per separare gli emisferi destro e sinistro l'uno dall'altro (Figura 4E, F).
- Posiziona un emisfero nel tubo 1 del cervello e il secondo emisfero nel tubo del cervello 2 . Conservare questi tubi a 4 °C fino a quando gli emisferi cerebrali non affondano (circa durante la notte).
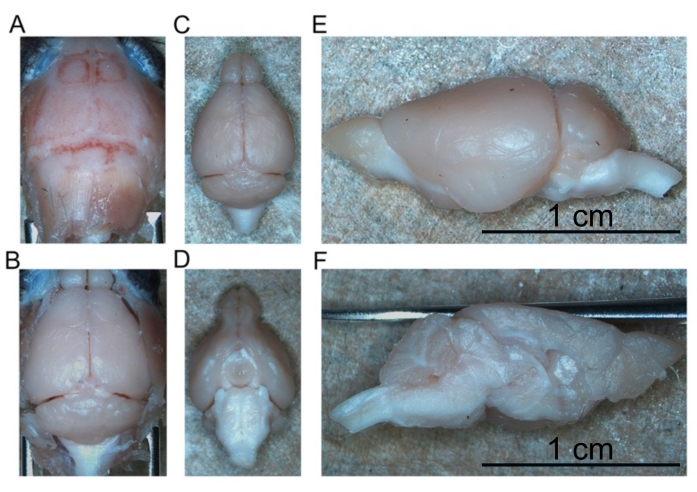
Figura 4: Rimozione del cervello fisso. (A) Parte superiore del cranio. (B) Cervello esposto all'interno del cranio. (C) Cervello isolato (aspetto dorsale). (D) Cervello isolato (aspetto ventrale). (E) Emisfero sinistro (aspetto laterale). (F) Emisfero sinistro (aspetto mediale). Barre della scala = 1 cm (E e F). Fare clic qui per visualizzare una versione più grande di questa figura.
- Per sezionare il midollo spinale, rimuovere il corpo del topo dal PFA e asciugarlo.
- Posizionare il mouse su un blocco di dissezione in polistirolo in posizione prona e fissare le zampe nel blocco usando quattro aghi.
- Inizia la dissezione tagliando la pelle lungo la linea mediana del mouse dal collo alla coda per esporre l'intera parte posteriore.
- Riflettere il muscolo e la fascia sulla schiena per esporre la parte posteriore della colonna vertebrale.
- A partire dalla maggior parte delle vertebre craniche, utilizzare le forbici di dissezione fine per tagliare la lamina evitando il midollo spinale (Figura 5A).
- Posizionare la pinza curva ultrafine sotto la lamina e tirare verso l'alto per fratturare le vertebre per esporre il midollo spinale (Figura 5B).
- Utilizzare la pinza curva per riflettere le vertebre fratturate ed esporre le regioni più laterali del midollo spinale.
- Continua questo processo per le vertebre successive posizionando la pinza curva ultrafine sotto la lamina e fratturando le vertebre. Continuare a fratturare le vertebre fino a quando l'intero rachide cervicale e il rachide toracico sono esposti (Figura 5C).
- Continuare a esporre il midollo spinale fino alla fine del midollo spinale lombare (Figura 5D).
- Usando una lama di rasoio affilata, tagliare fino in fondo attraverso il midollo spinale medio-toracico.
- Utilizzando la pinza curva ultrafine, transecare i nervi spinali lateralmente dalla colonna vertebrale e la fascia anteriore al midollo spinale per separare lentamente il midollo spinale cervicale dalla colonna vertebrale.
- Continuare a sezionare il midollo spinale cervicale fino a quando non è libero dalle vertebre (Figura 5E). Posizionare il midollo spinale cervicale-medio-toracico nel tubo etichettato cervicale. Conservare questo tubo a 4 °C fino a quando il midollo spinale cervicale non affonda (circa durante la notte).
- Continua a fratturare le vertebre toraciche fino alla cauda equina come dettagliato nei passaggi da 4.22 a 4.25. Quando la cauda equina è esposta, utilizzare una lama di rasoio affilata per tagliare il midollo spinale 1 cm sotto il midollo spinale lombare (Figura 5F).
- Sezionare il midollo spinale lombare lontano dalle vertebre come indicato nei passaggi 4.26-4.27. Posizionare il midollo spinale della cauda equina lombare-media nel tubo etichettato come lombare. Conservare questo tubo a 4 °C fino a quando il midollo spinale lombare affonda (circa durante la notte).
- Quando tutti i tessuti sono affondati nel 20% di saccarosio, trasferirli in tubi marcati al 30% di saccarosio fino a quando non sono affondati o per 3 giorni.
NOTA: I tessuti spinali spesso non affondano al 30% di saccarosio.
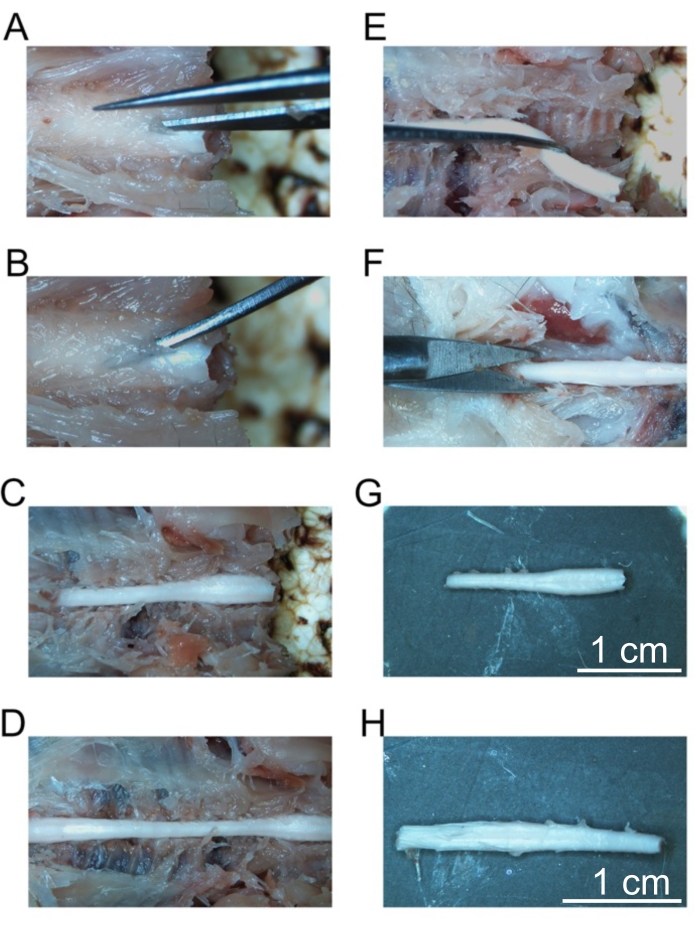
Figura 5: Rimozione di segmenti fissi del midollo spinale. (A) Taglio iniziale nella lamina delle vertebre cervicali. (B) Posizionamento di pinze curve per fratturare singole vertebre. (C) Il rachide cervicale esposto. (D) Colonna cervicale, toracica e lombare esposta. (E) Rimozione del rachide cervicale dopo il taglio dei nervi spinali. (F) Taglio della colonna vertebrale sacrale. (G) Rachide cervicale isolato. (H) Colonna lombare isolata. Barre della scala = 1 cm (G e H). Fare clic qui per visualizzare una versione più grande di questa figura.
5. Integrazione e stoccaggio dei tessuti da parte dei PTOM
- Per ogni mouse, etichettare quattro criomostidi di forma rettangolare: ID mouse, emisfero destro, data di incorporamento; ID mouse, emisfero sinistro, data di incorporamento; ID mouse, cervicale, data di incorporamento; ID mouse, lombare, data di incorporamento.
- Installare un contenitore di polistirolo e appendere una tazza di metallo sopra il contenitore.
- Riempire il contenitore di polistirolo con azoto liquido circa a metà strada. Riempire la tazza di metallo con 2-metilbutano fresco circa a metà strada.
NOTA: il 2-metilbutano è tossico, altamente volatile e infiammabile. Bisogna fare attenzione per evitare l'inalazione eseguendo passaggi successivi in una cappa aspirante e lontano da fonti di combustione. - Abbassare lentamente la tazza di metallo nell'azoto liquido ed evitare qualsiasi spruzzo di azoto liquido nella tazza di metallo.
- Lasciare che il 2-metilbutano inizi a congelarsi. Mentre il 2-metilbutano si congela, estrarre il tessuto desiderato dalla soluzione di saccarosio al 30% e asciugarlo con una salvietta priva di polvere.
- Posizionare il tessuto in un criostampo con la regione rostrale puntata verso la parte superiore (non etichettata) dello stampo.
- Versare con parsimonia il mezzo di incorporamento (OCT) a temperatura di taglio ottimale sul tessuto nel criostampo, utilizzando solo quanto basta per coprire completamente il tessuto. Evitare l'uso eccessivo di Strumenti di personalizzazione di Office in quanto ciò può causare cracking. Rimuovere eventuali bolle dallo Strumento di personalizzazione di Office.
- Quando il 2-metilbutano congelato ha completamente coperto la superficie interna della tazza di metallo, immergere completamente il criostampo nella fase liquida sovrastante 2-metilbutano per 12 s. Dopo 12 s, posizionare il criostampo per drenare in un foglio di alluminio etichettato quadrato e avvolgere l'intero criostampo. Posizionare immediatamente il criostampo avvolto su ghiaccio secco ed evitare lo scongelamento. Assicurarsi che l'OCT/criostampo congelato sia sempre coperto con ghiaccio secco.
- Ripetere i passaggi da 5,6 a 5,8 per tutti i tessuti. Posizionare il tessuto per un topo in un piccolo sacchetto di plastica sigillato e quindi in un contenitore crio-sicuro e sigillato. Conservare questo contenitore nel congelatore a -80 °C fino al taglio delle sezioni.
6. Criosezione
- Prima della criosezione, assicurarsi che la temperatura della camera del criostato e la testa del campione siano impostate sulle impostazioni appropriate.
NOTA: per tagliare le sezioni cerebrali vengono utilizzate una temperatura della camera di -20 °C, una temperatura della testa del campione di -20 °C e uno spessore della sezione di 30 μm. Per il taglio di sezioni del midollo spinale vengono utilizzate una temperatura della camera di -23 °C, una temperatura della testa del campione di -30 °C e uno spessore della sezione di 30 μm. È importante notare che le impostazioni del criostato (in particolare la temperatura della testa del campione) dovranno essere regolate durante il sezionamento per affrontare i problemi con la qualità dei tessuti. Generalmente, la temperatura della testa del campione viene abbassata per correggere la sbavatura dei tessuti. Al contrario, la temperatura della testa del campione viene aumentata per correggere l'eccessivo arricciamento dei tessuti. - Rimuovere il blocco OCT desiderato dal congelatore a -80 °C e posizionare il blocco criostampo/OCT non avvolto nella camera del criostato.
- Lasciare che il blocco OCT si acclimati alla temperatura della camera per 30 minuti.
- Pulire un mandrino con etanolo al 70% e asciugarlo con una salvietta priva di polvere. Posizionare il mandrino pulito nella camera criostata e creare un cerchio di OCT delle dimensioni di una moneta sul mandrino. Lasciare che lo Strumento di personalizzazione di Office si blocchi (circa 1-2 minuti).
- Quando l'OCT si è congelato, posizionare un punto di OCT fresco delle dimensioni di un pisello sul mandrino e posizionare immediatamente il blocco OCT di tessuto sul mandrino. Assicurarsi che il tessuto sia perfettamente perpendicolare al mandrino prima che l'OCT si congeli completamente.
NOTA: Generalmente, la regione più rostrale del cervello è posizionata verso il mandrino in modo che il sezionamento inizi dall'estremità caudale. Per il midollo spinale, generalmente, la regione più caudale è posizionata sul mandrino in modo che il sezionamento inizi dall'estremità rostrale. - Quando lo Strumento di personalizzazione di Office si è rafforzato, posizionare più Server di personalizzazione di Office attorno alla base del blocco di Opzioni Desktop remoto per fungere da supporto strutturale durante il sezionamento. Quando questo supporto si è leggermente indurito, posizionare il mandrino sulla testa del campione e consentire al blocco OCT di raggiungere la temperatura della testa del campione per 30 minuti.
- Posizionare una lama microtomatica nel supporto della lama e pulire la piastra antirollio. Regolare la distanza della piastra antirollio per assicurarsi che il tessuto passi appena sotto la piastra durante il sezionamento. Per maggiori informazioni sul corretto posizionamento della piastra antirollio, consultare il manuale del criostato.
- Dopo che il blocco OCT si è acclimatato alla temperatura della testa del campione, iniziare a tagliare il blocco OCT fino a raggiungere il tessuto. Quando il tessuto è visibile, passare dal taglio al sezionamento e iniziare a tagliare sezioni da 30 μm. Spostare la piastra antirollio e, utilizzando un vetrino per microscopio, raccogliere la sezione.
- Continuare a tagliare e raccogliere sezioni fino a quando non si è soddisfatti della posizione anatomica delle sezioni o di tutto il tessuto è stato tagliato. Posizionare le diapositive ad asciugare a temperatura ambiente per 1-3 giorni. Dopo l'asciugatura, posizionare i vetrini in una scatola di scorrimento e posizionare questa scatola in un sacchetto di plastica sigillato. Etichettare il sacchetto con l'ID del mouse e le informazioni sui tessuti prima di posizionare i vetrini nel congelatore a -80 °C.
7. Colorazione immunofluorescente
- Scongelare le diapositive per 1 ora a temperatura ambiente.
- Posizionare i vetrini in un barattolo orizzontale e lavare le sezioni 3 volte in PBS per 10 minuti ogni lavaggio a temperatura ambiente su uno shaker.
- Preparare il buffer di blocco (2% BSA + 0,3% Triton-X-100 in 1x PBS). Utilizzare circa 1 mL per diapositiva.
- Creare una camera umidificata aggiungendo acqua sul fondo. Disporre le diapositive rivolte orizzontalmente e non lasciarle asciugare. Aggiungere 1 mL di tampone bloccante a ciascun vetrino e incubare per almeno 1 ora a temperatura ambiente.
- Preparare la soluzione anticorpale primaria diluendo l'anticorpo primario in un tampone anticorpale (0,7% BSA + 0,3% Triton-X-100 in 1x PBS).
NOTA: Per l'anticorpo fosforilato α-sinucleina, è stato utilizzato un fattore di diluizione di 1:500. - Aggiungere 200-300 μL di soluzione anticorpale primaria per vetrino. Coprire con un coperchio per disperdere l'anticorpo e incubare a 4 °C durante la notte.
- Il giorno successivo, rimuovere i vetrini dalla camera umidificata e metterli in un barattolo coplin verticale riempito con 1x PBS per consentire alla slitta di cadere. Fallo per ogni diapositiva individualmente e fai attenzione a non disturbare la sezione del tessuto durante la rimozione del coperchio.
- Posizionare i vetrini in un barattolo orizzontale e lavare le sezioni 3 volte in PBS per 10 minuti ogni lavaggio a temperatura ambiente su uno shaker.
NOTA: Tutti i passaggi successivi devono essere eseguiti con le luci spente per evitare di fotosbiancare il fluoroforo! - Preparare la soluzione anticorpale secondaria diluendo l'anticorpo secondario in un tampone anticorpale.
NOTA: Per il rilevamento di α-sinucleina fosforilata, è stato utilizzato un anti-coniglio secondario coniugato ad Alexa 488 con un fattore di diluizione di 1:500 in tampone anticorpale (0,7% BSA + 0,3% Triton-X-100 in 1x PBS). - Posare i vetrini orizzontalmente nella camera umidificata e aggiungere 200-300 μL di soluzione anticorpale secondaria per vetrino. Coprire con una coverslip per disperdere l'anticorpo. Incubare a temperatura ambiente per almeno 2 ore.
- Rimuovere i vetrini dalla camera umidificata e metterli in un barattolo coplin verticale riempito con 1x PBS per consentire la caduta del coperchio. Fallo per ogni diapositiva individualmente e fai attenzione a non disturbare la sezione del tessuto durante la rimozione del coperchio.
- Posizionare i vetrini in un barattolo orizzontale e lavare le sezioni 3 volte in PBS per 10 minuti ogni lavaggio a temperatura ambiente su uno shaker.
- Asciugare il lato delle diapositive su un asciugamano e scrollarsi di dosso l'eccesso di PBS.
- Aggiungere 3 gocce di mezzo di montaggio a ciascuna diapositiva. Aggiungere il coverslip e spingere delicatamente le bolle con un paio di pinze premendo il coverslip prima dell'imaging al microscopio confocale.
Risultati
La perfusione di alta qualità è indicata dall'assenza di sangue nel fegato, nel midollo spinale e nelle strutture profonde del SNC (Figura 4C e Figura 5G, H). Il sangue trattenuto sotto la dura madre (ad esempio, all'interno dei seni venosi) o tra la dura madre e il cranio non è stato problematico in quanto questo sangue non è all'interno del parenchima cerebrale. Il sangue visto in Figura 4A si trova tra il cranio e la materia dura e quindi non è problematico o suggestivo di una perfusione di scarsa qualità. Il cervello fresco e il midollo spinale sono abbastanza morbidi e facilmente danneggiati durante la manipolazione. I tessuti adeguatamente fissati, al confronto, sono solidi. Per valutare la qualità del tessuto e la conservazione della morfologia dei tessuti con questo metodo di perfusione, questo lavoro dimostra il rilevamento di α-sinucleina fosforilata nel mesencefalo e nel midollo spinale lombare di un topo di 15 mesi e di un topo di 7 mesi che esprimono A53T umano α-sinucleina (Figura 6).
La mutazione A53T è sovrarappresentata nei pazienti con malattia di Parkinson autosomica dominante (PD). Inoltre, la α-sinucleina umana con la mutazione A53T può ricapitolare molte delle caratteristiche del PD umano quando espresse nei topi 6,7. La fosforilazione della α-sinucleina al residuo di serina 129 ha dimostrato in vivo e in vitro di indurre l'aggregazione α-sinucleina8. I corpi di Lewey sono il classico reperto istologico presente nei pazienti con PD o demenza corporea di Lewey9. La maggior parte della α-sinucleina presente nei corpi di Lewey è fosforilata in Serina 129 10,11. Di conseguenza, l'accumulo di α-sinucleina fosforilata viene utilizzato come marcatore della gravità istologica della patologia PD. Il presente studio rileva che la α-sinucleina fosforilata si accumula a un livello significativamente più alto nei topi sintomatici di 15,5 mesi rispetto ai topi asintomatici di 7 mesi che esprimono A53T umano α-sinucleina. Ciò è coerente con i rapporti che descrivono un arricchimento della citopatologia nelle corna anteriori del midollo spinale e nel mesencefalo di questi topi. 6 Da ciò si conclude che il metodo di perfusione semplificato qui descritto fornisce una fissazione di alta qualità dei tessuti del SNC per la caratterizzazione istologica a valle.
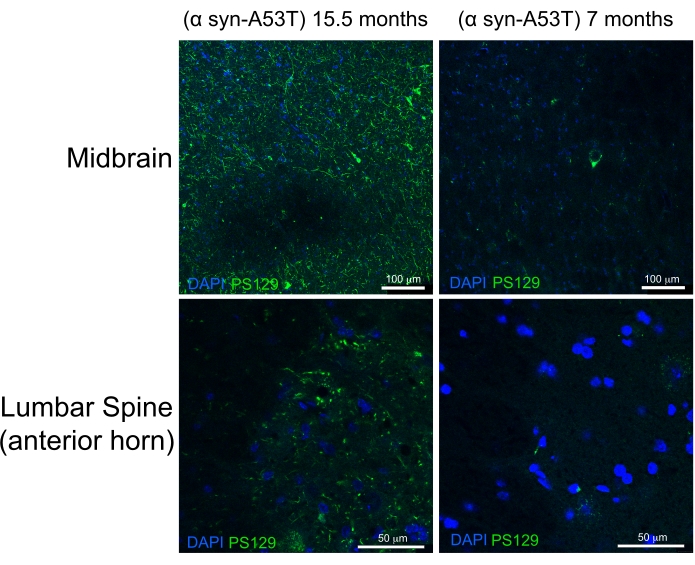
Figura 6: Etichetta per α-sinucleina fosforilata nei tessuti del midollo spinale mesencefalo e lombare da un modello murino di morbo di Parkinson. Il topo paralizzato allo stadio terminale invecchiato (15,5 mesi) viene confrontato con il topo sano di 7 mesi. Entrambi i topi esprimono una variante mutante incline al misfolding (A53T) della sinucleina α umana che induce la patologia simile al Parkinson. Barre di scala = 100 μm (pannelli superiori) e 50 μm (pannelli inferiori). Abbreviazione: α syn-A53T = mutante A53T di α-sinucleina; DAPI = 4',6-diamidino-2-fenilindolo; PS129 = serina fosforilata 129 di α-sinucleina. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Questo lavoro descrive i passaggi critici per l'esecuzione della perfusione transcardica. Quando si costruisce l'apparato di perfusione (sezione di protocollo 1), è importante utilizzare tubi abbastanza flessibili da essere completamente occlusi da un emostato. Alcuni tubi rigidi potrebbero non essere sufficientemente occlusi da un emostato e potrebbero comunque consentire al PFA di fuoriuscire nella linea principale durante la perfusione PBS iniziale. Quando si prepara la soluzione di PFA al 4%, è importante assicurarsi che il pH sia fisiologico (7.4). Poiché la preparazione della soluzione di PFA comporta il riscaldamento a 65 °C, la soluzione deve essere raffreddata fino a 25 °C prima di misurare il pH poiché questa è la temperatura alla quale il pH viene calibrato sul misuratore.
Quando si esegue l'incisione iniziale nell'addome, è necessario prestare attenzione per evitare la lacerazione degli organi addominali (sezione del protocollo 2). Quando si seziona in modo superiore verso il diaframma, è importante evitare la lacerazione del fegato in quanto è comune che il fegato aderisca alla parete addominale anteriore. Per ovviare a questo, il fegato viene accuratamente e senza mezzi termini sezionato lontano dalla parete anteriore prima di continuare un'incisione verso il diaframma. Quando si entra nella cavità toracica attraverso il diaframma, è importante evitare la lacerazioni del cuore, dei grandi vasi e del polmone. Per evitare ciò, la punta della forbice viene mantenuta superficialmente e ad angolo acuto con la gabbia toracica.
La dissezione iniziale per esporre il cuore richiede circa 2 minuti dall'incisione iniziale. Si prevede che durante questo periodo, un po 'd'aria sia entrata nella punta dell'ago della farfalla. L'introduzione di quest'aria nella circolazione del mouse produrrà una perfusione di scarsa qualità. Pertanto, è fondamentale che la linea principale sia aperta e PBS venga lavato attraverso l'ago immediatamente prima della cannulazione del cuore per rimuovere le bolle d'aria. Idealmente, il cuore è cannulato mentre un piccolo rivolo PBS scorre attraverso la punta dell'ago per garantire la completa assenza di aria durante la perforazione del LV.
Quando l'ago entra nel LV, non deve andare così in profondità da introdurre la punta dell'ago nel ventricolo destro (RV). Il posizionamento dell'ago nel camper o oltre la valvola mitrale comporterà un immediato "gonfiaggio" dei polmoni quando viene avviata la perfusione. Questo è indesiderabile e l'ago deve essere leggermente ritirato per garantire il posizionamento LV. Se l'ago è posizionato correttamente, i polmoni rimarranno piatti per tutta la perfusione. Quando viene avviata la perfusione, a volte si osserva che un liquido chiaro sta emergendo dalla bocca aperta dell'animale. Ciò è solitamente dovuto a una pressione di perfusione troppo alta o a causa di uno spostamento errato dell'ago all'interno del cuore. Gli autori ipotizzano che pressioni di perfusione elevate provochino lo stravaso del perfusato dal letto capillare arteriolare e il flusso retrogrado di PBS attraverso l'albero bronchiale nell'esofago e nella cavità orale.
La pressione di perfusione deve essere abbassata diminuendo il livello di PBS nella bottiglia PBS o abbassando l'altezza della bottiglia PBS. In alternativa, se l'ago viene posizionato troppo in profondità nel ventricolo sinistro, può viaggiare attraverso la valvola mitrale e fornire perfusare all'atrio sinistro. Ciò può provocare un flusso retrogrado attraverso le vene polmonari e uno stravaso di perfusato nelle arteriole, come descritto sopra. L'accurata eliminazione del sangue dal sistema circolatorio con PBS è particolarmente importante per evitare la reticolazione indotta da fissativi dei componenti del sangue con conseguente occlusione dei vasi alla successiva perfusione fissativa. La clearance è efficacemente valutata da un cambiamento di colore del fegato e dal flusso PBS da un'incisione nella base della coda ventrale. La clearance del sangue è generalmente completa di 3 minuti di perfusione con PBS; tuttavia, se i segni visivi di clearance si verificano in tempi più brevi, il fissativo viene introdotto prima di 3 minuti. Tempi di clearance più lunghi non sono raccomandati in quanto la perfusione fissativa ritardata porta ad artefatti nella struttura finedel SNC 1.
Quando viene somministrato PFA, è importante monitorare il livello di soluzione di PFA nel flacone di PFA. Riempire il flacone di PFA se il livello di PFA scende a meno di 4 cm sopra la bocca del flacone di PFA. Dopo che la perfusione è stata completata, l'apparecchio di perfusione deve essere accuratamente risciacquato con acqua distillata. Questo è importante in quanto il PFA residuo nella linea principale contaminerà la perfusione PBS iniziale con PFA e si tradurrà in una perfusione di scarsa qualità. Infine, gli aghi a farfalla da 25 G sono generalmente raccomandati per topi adulti di medie dimensioni nell'intervallo 20-30 g. Tuttavia, i topi più grandi o più piccoli possono richiedere aghi di calibro leggermente più grandi o più piccoli oltre alla regolazione delle bottiglie fissative per fornire portate ottimali.
Per la dissezione del SNC e l'incorporamento oct (sezione 3 del protocollo), è comune che i tessuti del midollo spinale non affondino completamente nel 30% di saccarosio. Questi tessuti vengono quindi lasciati in saccarosio per 2 giorni e poi incorporati in OCT, indipendentemente dal fatto che affondino o meno. Quando si congelano i tessuti in OCT, è possibile che alcuni tessuti possano rompersi quando collocati in 2-metilbutano raffreddato. Questo è più comune con il cervello e di solito si verifica quando troppo OCT viene posizionato sul tessuto. Per evitare ciò, posizionare solo un numero sufficiente di OCT per coprire le superfici del tessuto prima del congelamento immediato. In alcuni protocolli, il cracking è meno comune nonostante la completa immersione in OCT. Ciò è solitamente dovuto a un metodo di congelamento più lento, come quando si utilizza 2-metilbutano raffreddato a secco o si posiziona direttamente il criostampo su un blocco di ghiaccio secco. Il 2-metilbutano raffreddato con azoto liquido è preferito in questo lavoro in quanto il tasso di congelamento è sostanzialmente più rapido e può preservare meglio la morfologia dei tessuti rispetto ai metodi di congelamento più lenti.
Quando si crioseziona il tessuto (sezione del protocollo 4), è importante evitare cicli multipli di congelamento-disgelo. Pertanto, è ottimale tagliare tutte le sezioni da un singolo blocco OCT per ottenere una specifica regione del cervello per l'analisi invece di scongelare e ricongelare le aree selezionate. Se ciò non è fattibile, dopo aver ottenuto alcune sezioni, gli utenti possono ricongelare e conservare i blocchi OCT nel congelatore a -80 °C altre 1-2 volte per un uso futuro.
I principali vantaggi di questo metodo rispetto alla pompa più tradizionale o all'erogazione della pressione dell'aria del perfusato sono i seguenti: (1) basso costo e accessibilità dell'apparato di perfusione. (2) Gli utilizzatori non hanno bisogno di mantenere manualmente la pressione nell'apparato di perfusione per tutta la durata della perfusione. (3) Pressione di perfusione più bassa e più consistente rispetto ad altre alternative a basso costo per la perfusione, ad esempio tramite somministrazione di siringhe. Usando l'equazione di Bernoulli, si calcola che l'apparato di perfusione alimentato a gravità costruito qui manterrà una pressione di perfusione di circa 73 mm Hg quando le bottiglie di perfusato sono posizionate a 1 m di altitudine rispetto all'ago. Dato che questo è significativamente al di sotto della pressione arteriosa sistolica di questi animali, questa pressione di perfusione è probabilmente sufficientemente bassa da evitare la rottura vascolare12.
Gli autori hanno finora utilizzato con successo questo sistema di perfusione per rilevare la presenza di α-sinucleina fosforilata in un modello murino di malattia di Parkinson. Durante questo periodo, non sono state riscontrate limitazioni significative con questo metodo di perfusione che non sono presenti con un metodo di erogazione della perfusione della pompa. Il principale limite di questa tecnica è la natura dispendiosa in termini di tempo della perfusione rispetto alla fissazione della goccia. Questa tecnica è preferibile alla fissazione a goccia poiché la perfusione provoca una penetrazione più profonda del fissativo alle strutture del SNC. Una seconda limitazione di questa tecnica è che richiede una certa abilità chirurgica per eseguire, poiché il cuore deve essere cannulato rapidamente dopo l'ingresso nella cavità toracica. Tuttavia, con l'esperienza, gli utenti addestrati possono regolarmente canulare il cuore entro 1 minuto dall'incisione iniziale nell'addome.
Divulgazioni
Gli autori non dichiarano interessi finanziari concorrenti.
Riconoscimenti
Gli autori ringraziano Xiaowen Wang, Liam Coyne e Jason Grullon per la loro assistenza nello sviluppo di questo protocollo. Questo lavoro è stato supportato dalle sovvenzioni NIH AG061204 e AG063499.
Materiali
| Name | Company | Catalog Number | Comments |
| 2-Methylbutane (Certified ACS), Fisher Chemical | Fisher Scientific | 03551-4 | |
| Andwin Scientific Tissue-Tek O.C.T Compound | Fisher Scientific | NC1029572 | |
| Artman Instruments 4.5" Straight Castroveijo Spring Action Scissors | Amazon | B0752XHK2X | "fine scissors" |
| BD General Use and PrecisionGlide Hypodermic Needles, 18 G | Fisher Scientific | 14-826-5D | |
| BD General Use and PrecisionGlide Hypodermic Needles, 22 G | Fisher Scientific | 14-826B | |
| Corning PES Syringe Filters | Fisher Scientific | 09-754-29 | |
| Cytiva HyClone Phosphate Buffered Saline (PBS), 10x | Fisher Scientific | SH30258 | |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | |
| Fisher BioReagents Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | |
| Fisherbrand Curved Medium Point General Purpose Forceps | Fisher Scientific | 16-100-110 | "curved fenestrated forceps" |
| Fisherbrand Curved Very Fine Precision Tip Forceps | Fisher Scientific | 16-100-123 | "curved fine forceps" |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisher Scientific | 13-711-9AM | |
| Fisherbrand High Precision Straight Tapered Ultra Fine Point Tweezers/Forceps | Fisher Scientific | 12-000-122 | "straight fine forceps" |
| Fisherbrand Micro Spatulas with Rounded Ends | Fisher Scientific | 21-401-5 | |
| Fisherbrand Porcelain Buchner Funnels with Fixed Perforated Plates | Fisher Scientific | FB966J | |
| Fisherbrand Premium Cover Glass, 24 x 50 | Fisher Scientific | 12-548-5M | |
| Fisherbrand Premium Tissue Forceps 1X2 Teeth 5 in. German Steel | Fisher Scientific | 13-820-074 | "skin forceps" |
| Fisherbrand Reusable Heavy-Wall Filter Flasks | Fisher Scientific | FB3002000 | |
| Fisherbrand Standard Dissecting Scissors | Fisher Scientific | 08-951-20 | "dissecting scissors" |
| Fisherbrand Sterile Syringes for Single Use | Fisher Scientific | 14-955-464 | |
| Fisherbrand Straight Locking Hemostats | Fisher Scientific | 16-100-115 | |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Fisherbrand Vinyl Tubing and Connector Kits, 1/4 in. | Fisher Scientific | 14-174-1C | |
| Fisherbrand Wet-Strengthened Qualitative Filter Paper Circles | Fisher Scientific | 09-790-12F | |
| Fisherbrand Y Connector with 1/4 in. ID - Polypropylene - QC | Fisher Scientific | 01-000-686 | |
| Garvey Economy Single Edge Cutter Blade | Amazon | B001GXFAEQ | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, DyLight 488 | ThermoFisher Scientific | 35552 | |
| Ideal Clamp Stant High-Pressure Clamps | Fisher Scientific | 14-198-5A | "hose clamps" |
| IMEB, Inc Sakura Accu-Edge Low Profile Microtome Blades, Dispoisable | Fisher Scientific | NC9822467 | |
| Kawasumi 25 Gauge Standard Winged Blood Collection Set | Fisher Scientific | 22-010-137 | "butterfly needle" |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | Fisher Scientific | 06-666 | |
| Molecular Probes ProLong Diamond Antifade Mountant with DAPI | Fisher Scientific | P36962 | |
| Nalgene Narrow-Mouth Right-to-Know LDPE Wash Bottles | ThermoFisher Scientific | 2425-0506 | "buffer bottles" |
| PAP pen | abcam | ab2601 | |
| Paraformaldehyde Granular | Electron Microscopy Systems | 19210 | |
| Pyrex Glass Drying Dishes, 34.9 x 24.9 x 6 cm | Fisher Scientific | 15-242D | |
| Recombinant Anti-Alpha-synuclein (phospho S129) antibody [EP1536Y] | abcam | ab51253 | |
| Sodium Hydroxide | Sigma-Aldrich | 221465-2.5kg | |
| Stainless Steel Drinking Cup 18-oz | amazon | B0039PPO9U | |
| Sucrose for Molecular Biology CAS: 57-50-1 | Us Biological | S8010 | |
| Triton X-100 | Us Biological | T8655 | |
| Vetone Fluriso Isoflurane USP | MWI Animal Health | 502017 |
Riferimenti
- Tao-Cheng, J. H., Gallant, P. E., Brightman, M. W., Dosemeci, A., Reese, T. S. Structural changes at synapses after delayed perfusion fixation in different regions of the mouse brain. Journal of Comparative Neurology. 501 (5), 731-740 (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments: JoVE. (65), e3564(2012).
- McFadden, W. C., et al. Perfusion fixation in brain banking: a systematic review. Acta Neuropathologica Communications. 7 (1), 146(2019).
- Lamberts, R., Goldsmith, P. C. Fixation, fine structure, and immunostaining for neuropeptides: perfusion versus immersion of the neuroendocrine hypothalamus. Journal of Histochemistry and Cytochemistry. 34 (3), 389-398 (1986).
- Adickes, E. D., Folkerth, R. D., Sims, K. L. Use of perfusion fixation for improved neuropathologic examination. Archives of Pathology and Laboratory Medicine. 121 (11), 1199-1206 (1997).
- Giasson, B. I., et al. Neuronal alpha-synucleinopathy with severe movement disorder in mice expressing A53T human alpha-synuclein. Neuron. 34 (4), 521-533 (2002).
- Martin, L. J., et al. Parkinson's disease alpha-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. Journal of Neuroscience. 26 (1), 41-50 (2006).
- Fujiwara, H., et al. alpha-Synuclein is phosphorylated in synucleinopathy lesions. Nature Cell Biology. 4 (2), 160-164 (2002).
- Kalia, L. V., Lang, A. E. Parkinson's disease. Lancet. 386 (9996), 896-912 (2015).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. Journal of Biological Chemistry. 281 (40), 29739-29752 (2006).
- Kahle, P. J., et al. Hyperphosphorylation and insolubility of alpha-synuclein in transgenic mouse oligodendrocytes. EMBO Reports. 3 (6), 583-588 (2002).
- Mattson, D. L. Comparison of arterial blood pressure in different strains of mice. American Journal of Hypertension. 14, 405-408 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon