Method Article
Une méthode de perfusion transcardique alimentée par gravité pour l’analyse histologique du système nerveux central de la souris
Dans cet article
Résumé
Une méthode pratique de perfusion par gravité pour l’analyse histologique du système nerveux central de la souris est présentée. La détection immunofluorescente de la α-synucléine phosphorylée est démontrée dans un modèle murin de la maladie de Parkinson. Ce travail décrit également de manière exhaustive les étapes de perfusion transcardique, de dissection, de congélation /intégration des tissus et de sectionnement congelé.
Résumé
L’analyse histologique d’échantillons de cerveau et de moelle épinière isolés de souris est une pratique courante pour l’évaluation de la pathologie dans ce système modèle. Pour maintenir la morphologie de ces tissus délicats, il est courant d’administrer un fixateur chimique tel que le paraformaldéhyde via la canulation du cœur chez les animaux anesthésiés (perfusion transcardique). La perfusion transcardique du cœur de la souris repose traditionnellement sur l’utilisation de pompes péristaltiques ou de pression d’air pour fournir à la fois les solutions salines et fixatrices nécessaires à ce processus. En tant qu’alternative facilement accessible à ces méthodes, ce travail démontre l’utilisation d’une méthode de livraison de perfusat alimentée par gravité qui utilise des matériaux disponibles dans la plupart des quincailleries.
Pour valider cette nouvelle méthode de perfusion, ce travail démontre toutes les étapes ultérieures nécessaires à la détection sensible de la α-synucléine phosphorylée dans le cerveau et la moelle épinière. Ces étapes comprennent la dissection des tissus fixes du cerveau et de la moelle épinière, la congélation / incorporation rapide et la cryosection des tissus et la coloration immunofluorescente. Comme cette méthode entraîne l’administration du fixateur par tout le corps, elle peut également être utilisée pour préparer d’autres tissus non neuronaux à l’analyse histologique.
Introduction
La caractérisation histologique de la pathologie dans le système nerveux central (SNC) de la souris est une technique de routine utilisée dans les études sur la neurodégénérescence. Comme les tissus neuronaux se dégradent rapidement après la mort, il est courant de délivrer un fixateur chimique tel que le paraformaldéhyde aux tissus du SNC pour préserver leur morphologie 1,2. La fixation chimique peut être réalisée soit par perfusion du corps entier avec une solution fixatrice, soit par l’isolement des tissus et leur immersion dans une solution fixatrice (appelée « fixation par goutte »). La perfusion est la méthode préférée d’administration fixative, car la fixation de goutte peut ne pas permettre une pénétration rapide de la solution fixative dans les structures profondes du SNC 3,4,5. De plus, comme il est difficile d’enlever la moelle épinière non fixée de la colonne vertébrale, l’administration de la solution fixatrice par perfusion permet la préservation in situ de la moelle épinière microscopique et de l’anatomie globale et raidit le tissu pour minimiser les dommages lors du retrait.
La livraison des solutions tampons et fixatrices nécessaires à la fixation est généralement effectuée à l’aide de pompes ou de pression d’air disponibles dans le commerce. L’administration par gravité de perfusat peut servir d’alternative à la distribution par pompe pour les raisons suivantes : (1) La distribution de pression de pompe ou d’air peut, dans certains cas, obliger un utilisateur à maintenir manuellement la pression dans le système tout au long de la perfusion. La livraison par gravité du perfusat peut être maintenue sans intervention de l’utilisateur. (2) Un appareil de perfusat livré par gravité peut être construit à faible coût pour l’utilisateur en obtenant des matériaux disponibles auprès de fournisseurs scientifiques standard. Ce travail décrit comment construire un dispositif de perfusion par gravité simple à l’aide de bouteilles de lavage et de tubes en vinyle. En utilisant un modèle murin de la maladie de Parkinson, ce travail démontre l’efficacité de ce système dans la perfusion des tissus du cerveau et de la moelle épinière avant leur isolement pour une section congelée. Ce travail décrit de manière exhaustive toutes les étapes, techniques et matériaux nécessaires pour disséquer le tissu fixe hors de l’animal, congeler / intégrer et cryosectionner rapidement le tissu et détecter la présence de α-synucléine phosphorylée dans le cerveau et la moelle épinière par microscopie à immunofluorescence indirecte.
Protocole
Les données et les étapes expérimentales présentées dans ce protocole ont été générées à l’aide de souris C57BL/6J. Toutes les méthodes impliquant des animaux ont été approuvées par le Comité institutionnel de soins et d’utilisation des animaux de l’Université médicale de l’État de New York.
1. Construction d’un appareil de perfusion et d’une plate-forme de dissection
- Comme le montre la figure 1, coupez les pailles intérieures de deux bouteilles de lavage de 500 mL en les coupant sur le côté intérieur du bouchon vissé à l’aide d’une lame de rasoir tranchante. Coupez un trou carré de 4 cm x 4 cm dans le fond de chaque bouteille tampon. Coupez un petit trou dans le fond de chaque bouteille pour permettre le passage d’un microspatule plié en acier inoxydable.
- Créez une courbure en forme de « S » dans les microspatules afin qu’elles puissent être utilisées comme crochets pour suspendre les bouteilles tampons. Insérez les microspatules pliées dans les ouvertures appropriées dans les bouteilles tampons.
- Coupez deux tubes de 25 cm de longueur et reliez-les hermétiquement aux sorties extérieures de paille de la bouteille. Joignez les extrémités de ces tubes avec le connecteur en Y. Coupez 2 m de tube et joignez-le à l’extrémité libre du connecteur en Y.
- Retirez le piston de la seringue de 1 mL et coupez la seringue à environ 6 cm de l’extrémité de la seringue. Coupez la seringue en marquant d’abord le plastique avec une lame de rasoir, puis en claquant brusquement le plastique de la seringue.
- Insérez la face coupée de la seringue dans l’extrémité libre du tube en plastique. Insérez à une profondeur suffisante pour assurer une étanchéité étanche.
REMARQUE: Il est important que toutes les connexions à l’intérieur de l’appareil de perfusion soient suffisamment serrées pour éviter les fuites. Dans le cas de connexions lâches, de petites pinces de tuyau en acier inoxydable peuvent être placées et serrées aux jonctions comme souhaité pour assurer une étanchéité hermétique si nécessaire. - Étiquetez une bouteille tampon comme PFA et une bouteille comme PBS (tampon). Mesurez environ 1/3 de la longueur de l’ouverture de la bouteille et tracez une ligne autour de la circonférence de la bouteille à cet endroit pour indiquer le niveau de remplissage approprié des solutions de perfusat.
- Redressez, puis créez une boucle dans un grand trombone qui peut s’adapter à la circonférence du tube. Placez cette boucle autour du tube juste proximal à la seringue.
- Placez un bloc de polystyrène de taille appropriée dans le plateau en verre. Placez les extrémités du trombone dans le bloc de polystyrène pour apposer le tube.
- À l’aide d’essuie-tout, soulevez l’extrémité avant du plateau en verre d’environ 2 cm.
REMARQUE: Cela placera la souris à environ 20 ° de la position Trendelenburg (inclinaison vers l’arrière) pour permettre une visualisation plus facile du diaphragme pendant la dissection et encourager le drainage des fluides pendant la perfusion.
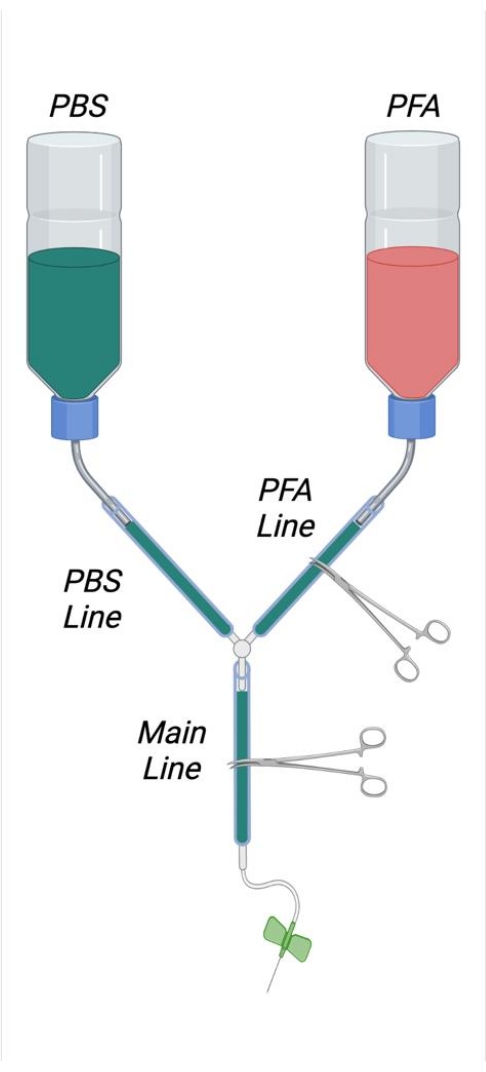
Figure 1 : Schéma représentant l’appareil de perfusion assemblé. Abréviations : PBS = solution saline tamponnée au phosphate; PFA = paraformaldéhyde. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Préparation de la solution de paraformaldéhyde (PFA)
REMARQUE: La solution de PFA doit être préparée fraîche le jour de la perfusion et jetée à la fin de la perfusion dans un conteneur à déchets désigné avant l’élimination par un personnel qualifié. Ce protocole fait 1 L de solution pfa à 4%, ce qui est suffisant pour perfuser environ 4 souris. Le PFA est très toxique et il faut prendre soin d’éviter l’inhalation ou le contact direct avec la peau sous forme de poudre ou de liquide. La plupart des étapes de préparation sont donc effectuées en portant des gants, des lunettes de protection et une blouse de laboratoire sous une hotte aspirante.
- Rincer un bécher de 1 L à l’eau distillée et remplir d’environ 800 mL de 18 mΩ de qualité moléculaireH2O.
- Chauffer le bécher deH2Oau micro-ondes pendant 3 min ou jusqu’à ce que la température de l’eau atteigne 65 °C. Placer sur une plaque chauffante/remuante conservée dans une hotte.
- Rincez une tige d’agitation avec de l’eau distillée et placez-la dans l’eau chaude. Démarrez l’agitateur et tournez la plaque chauffante à feu moyen. Assurez-vous que la température de l’eau ne dépasse pas 70 °C.
- Portez un masque chirurgical, des gants, des lunettes de protection et une blouse de laboratoire et mesurez 40 g de poudre de PFA. Versez cette poudre dans l’eau chauffée.
- À l’aide d’une pipette de transfert, ajouter quelques gouttes de 5 M NaOH à la solution. Laissez la poudre de PFA se dissoudre complètement. Si la poudre n’est pas complètement dissoute après quelques minutes, ajoutez des gouttes de 5 M NaOH au besoin.
- Une fois que presque tout le PFA s’est dissous (apparaîtra légèrement trouble), arrêtez l’agitation / chauffage et ajoutez immédiatement 100 mL de solution saline tamponnée au phosphate (PBS). Enfin, rechargez l’eau jusqu’à la marque de 1 L sur le bécher en utilisant 18 mΩ de qualité de biologie moléculaireH2O. Couvrez le bécher avec une pellicule de plastique et placez-le dans un congélateur à -20 °C jusqu’à ce que la solution atteigne la température ambiante (environ 45 min).
- Calibrer un pH-mètre en utilisant les étalons appropriés. Pendant que le bécher est sur une plaque d’agitation, mesurez le pH de la solution et ajoutez HCl jusqu’à ce que le pH atteigne 7,4. Si nécessaire, ajoutez 5 M de NaOH pour augmenter le pH s’il est trop bas.
- Connectez une fiole sous vide à l’aspirateur et placez un entonnoir Büchner en céramique propre avec du papier filtre dans la fiole. Allumez le vide et mouillez le papier filtre à l’aide d’une pipette de transfert remplie de la solution de PFA à 4%.
- Versez lentement la solution de PFA à 4 % sur le papier filtre jusqu’à ce que toute la solution ait été filtrée.
- Transférer la solution filtrée dans un récipient propre et protégé contre la lumière et la conserver à 4 °C jusqu’à son utilisation (conserver pas plus de 24 h).
3. Perfusion transcardique « sans pompe »
- Dans la hotte, placez un bloc de dissection en polystyrène dans un plateau en verre. Assurez-vous que le bloc de dissection a 5-6 aiguilles courtes pour retenir la souris pendant la chirurgie et 2 aiguilles longues pour soutenir le tube de perfusion.
- Rincer l’appareil de perfusion à l’eau distillée. Laissez toute l’eau s’écouler avant d’accrocher l’appareil de perfusion. Suspendez les flacons de perfusion à 1 m au-dessus de l’animal perfusé (pour une souris de 20 à 30 g).
- Préparer une solution non stérile de 1x PBS en utilisant 10x PBS dilué avec 18 mΩ de qualité moléculaireH2O.
- Comme le montre la figure 2, serrez la ligne principale de l’appareil de perfusion à l’aide d’un hémostat. Serrez la ligne PFA avec un autre hémostat.
REMARQUE: Une occlusion avec plusieurs hémostats peut être nécessaire par ligne pour empêcher complètement l’écoulement. - Remplissez le récipient tampon avec 1x PBS à température ambiante.
- Placez l’extrémité de la seringue de l’appareil de perfusion dans un bécher pour recueillir le tampon de déchets et retirez l’hémostat obstruant la ligne principale (Figure 2, à gauche).
- Laissez PBS circuler à travers la ligne tout en éliminant l’air emprisonné en tapotant vigoureusement sur les parois du tube.
- Une fois que tout l’air a été retiré du tampon et des lignes principales, obstruez le flux en plaçant un hémostat sur la ligne principale.
- Retirez l’hémostat de la ligne DE PFA et laissez le PBS s’écouler de manière rétrograde jusqu’à la bouteille de PFA tout en tapotant les bulles de la ligne de PFA (Figure 2, au milieu). Continuez à laisser le PBS entrer dans la ligne PFA jusqu’à ce que le PBS puisse être vu juste au-dessus de l’ouverture de la bouteille. Obstruez la ligne PFA avec un hémostat pour arrêter le flux dans la bouteille PFA.
- Connectez l’aiguille de perfusion papillon à la seringue de perfusion et rincez pbS à travers la ligne (en ouvrant l’hémostat de la ligne principale) pour éliminer les bulles de la seringue de perfusion. Fermez l’hémostat de la ligne principale.
- Assurez-vous que la bouteille PBS est maintenant environ 1/3ème pleine de PBS. Si nécessaire, rincez pbS à travers la ligne principale ou remplissez plus de PBS dans la bouteille tampon jusqu’à 1/3 de sa pleine capacité.
- Une fois que toutes les bulles ont été retirées du PBS, du PFA et des lignes principales, remplissez le flacon de PFA avec une solution de PFA à 4% à température ambiante jusqu’à la marque noire sur la bouteille (environ 1/3de remplissage) (Figure 2, à droite).
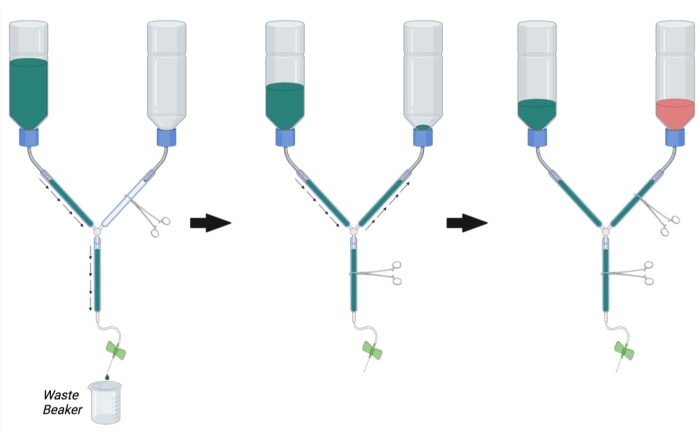
Figure 2 : Préparation de l’appareil de perfusion pour la chirurgie de perfusion. Tout d’abord, fermez l’hémostat de la ligne PFA et ouvrez l’hémostat sur la ligne PBS et la ligne principale. Remplissez PBS et retirez les bulles de la ligne PBS et de la ligne principale. Ensuite, remplissez la ligne PFA avec PBS en ouvrant l’hémostat sur la ligne PFA et en fermant l’hémostat sur la ligne principale. Enlevez les bulles dans la ligne PFA. Enfin, fermez l’hémostat sur la ligne PFA lorsque le PBS atteint l’ouverture de la bouteille PFA. Remplissez la bouteille de PFA 1/3ème pleine de PFA. Assurez-vous que le niveau de PBS dans la bouteille pbS est 1/3ème plein et remplissez avec PBS ou videz PBS en ouvrant l’hémostat de la ligne principale si nécessaire. Abréviations : PBS = solution saline tamponnée au phosphate; PFA = paraformaldéhyde. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Préparez-vous à une chirurgie de non-survie en nettoyant les instruments suivants avec de l’eau suivie d’éthanol à 70%: gros ciseaux, ciseaux à dissection fine, pinces à peau, pinces incurvées fines fenêtrées.
- Préparez l’anesthésie en plaçant des lingettes sans poussière dans un tube conique de 50 mL. Dans une hotte, trempez soigneusement les lingettes sans poussière avec de l’isoflurane et placez le tube ouvert à l’envers dans un bécher de 500 ml. Assurez-vous qu’aucun isoflurane liquide n’est présent au fond du bécher et jetez tout isoflurane liquide avant de placer une souris dans le bécher.
- Placez la souris dans le bécher et placez une pellicule de plastique sur l’ouverture pour commencer l’anesthésie.
- Administrer l’anesthésie jusqu’à ce que la souris cesse de respirer (environ 1 min et 30 s).
- Lorsque la respiration s’est arrêtée, retirez immédiatement la souris du bécher et remplacez le capuchon du tube conique de 50 mL.
- Vérifiez que la souris est suffisamment anesthésiée en utilisant le réflexe de pincement des orteils. Si l’animal n’est pas suffisamment anesthésié, administrer plus d’isoflurane comme décrit à l’étape 3.15.
- En travaillant rapidement, placez la souris sur le bloc de polystyrène et épinglez les pattes vers l’extérieur à l’aide de quatre aiguilles courtes (par exemple, des aiguilles de seringue de 22 G).
- Soulevant la peau abdominale avec des pinces cutanées, utilisez les gros ciseaux pour couper à travers la paroi abdominale. Assurez-vous qu’aucun organe abdominal n’est coupé!
- Continuez la coupe abdominale de manière supérieure vers le foie. Détachez le foie de la paroi abdominale antérieure et continuez l’incision initiale de manière supérieure vers le diaphragme. Arrêtez cette incision à environ 1 cm inférieur au diaphragme. Veillez à ce que le foie ne soit pas coupé !
- Poursuivez l’incision initiale latéralement vers les côtés droit et gauche du diaphragme pour faire une incision en forme de « Y » (figure 3A).
- Lorsque l’incision atteint le diaphragme, faites un trou dans le diaphragme à l’aide des ciseaux à dissection fine et coupez à travers les côtes du côté droit de l’animal. Coupez les côtes environ à mi-chemin de l’aisselle droite.
- Faites une incision similaire mais plus longue à travers le côté gauche du diaphragme presque jusqu’à l’aisselle gauche.
- Réfléchissez la paroi thoracique et épinglez-la au bloc de polystyrène.
- Si nécessaire, disséquez la graisse autour du cœur pour exposer le ventricule gauche. Identifiez le ventricule gauche en fonction de la couleur relativement plus claire par rapport au ventricule droit.
- Après avoir identifié le ventricule gauche, maintenez le cœur stable en utilisant une légère pression avec la pince incurvée fine. Ouvrez l’hémostat de la ligne principale pour permettre au PBS de circuler à travers l’aiguille. Percez immédiatement le ventricule gauche et assurez-vous que l’aiguille n’est pas insérée de plus de 0,5 cm dans le ventricule. Retirez légèrement l’aiguille si nécessaire.
REMARQUE: Le placement précis de l’aiguille dans le ventricule gauche est indiqué par un flux rétrograde de sang dans le tube de l’aiguille. Il est important de s’assurer que l’aiguille n’est pas trop profondément insérée dans le ventricule. Cela peut entraîner un écoulement rétrograde dans les veines pulmonaires ou perçant le septum interventriculaire. - Posez le tube papillon sur un X fabriqué dans la mousse de polystyrène à l’aide de deux grandes aiguilles de 18 G.
REMARQUE: Ceci est essentiel car il évitera le mouvement de l’aiguille papillon dans le cœur pendant la perfusion. - Identifiez la veine cave inférieure lorsqu’elle sort du foie et transectez-la à l’aide des ciseaux à dissection fine (figure 3B). Vous pouvez également ouvrir l’atrium droit avec des ciseaux.
- Ouvrez immédiatement la ligne principale pour permettre au démarrage de la perfusion PBS (Figure 3C).
- Assurez-vous que le PBS s’écoule du bloc de polystyrène et dans le plateau de verre ci-dessous. Si cela ne se produit pas, réajustez l’angle du plateau ou du bloc de polystyrène pour permettre la vidange des fluides dans le plateau en verre.
- Continuer la perfusion de PBS jusqu’à ce que le liquide qui s’écoule de la veine cave inférieure soit exempt de sang (environ 3 min).
REMARQUE: Un placement approprié de l’aiguille dans le cœur entraînera l’élimination visuelle du sang du foie, qui passera du rouge à la couleur paille. Si cela ne se produit pas, il peut être remédié en repositionnant l’aiguille de perfusion dans le ventricule gauche. Une petite incision peut être faite dans la base de la queue ventrale pour évaluer la qualité de la perfusion. Une perfusion appropriée entraînera un PBS clair s’écoulant de l’incision de la base de la queue. - En travaillant rapidement, obstruez la ligne PBS avec un hémostat et ouvrez la ligne PFA.
- Laissez le PFA perfuser pendant quelques minutes jusqu’à ce que la queue commence à s’enrouler. Une fois que la queue commence à s’enrouler, commencez une minuterie de 50 minutes. Si la queue ne s’enroule pas après 5 min de perfusion de PFA, commencez une minuterie de 50 minutes pour la perfusion de PFA.
- Surveillez le niveau de PFA dans le flacon en continu tout au long de la perfusion pour vous assurer que le niveau ne tombe pas trop bas. Remplissez plus de PFA dans la bouteille si le niveau descend en dessous de 2 cm au-dessus du couvercle de la bouteille.
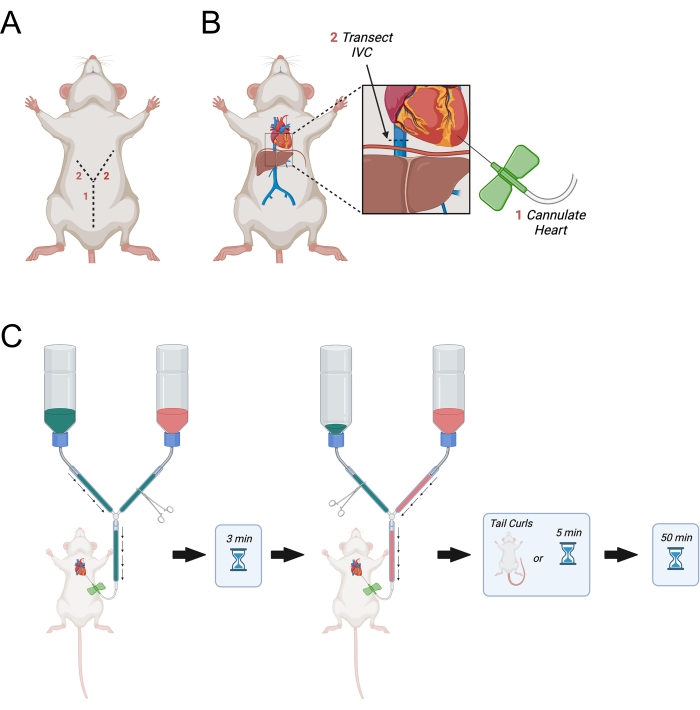
Figure 3: Diagramme représentant la perfusion transcardique. (A) La paroi abdominale est d’abord coupée, suivie de deux incisions pointant latéralement vers l’aisselle formant un « Y ». (B) Après être entré dans la cavité thoracique et avoir exposé le cœur, l’aiguille est passée dans le ventricule gauche. Ensuite, l’IVC ou l’oreillette droite est transectée pour permettre le drainage des perfusats après leur circulation dans le corps. L’IVC est coupé de manière supérieure au diaphragme. C) Procédure d’administration des perfusats. Abréviation = IVC = veine cave inférieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Après 50 minutes, obstruez la ligne principale avec un hémostat et retirez l’aiguille du ventricule gauche.
REMARQUE: La souris entière est rigide à ce stade et peut maintenant être placée dans un récipient étiqueté de 4% PFA pendant la nuit à 4 ° C. À ce stade, il est possible de disséquer les tissus du SNC et de les placer individuellement en fixateur pendant la nuit. Dans ce travail, toute la souris est placée en fixateur car cela raccourcit l’intervalle entre la fixation et le placement à 4 °C. Cela évite également toute distorsion mécanique possible du tissu nerveux qui peut se produire si les animaux sont pré-disséqués avant la fin de la fixation pendant la nuit.
4. Dissection du SNC
- Préparez les instruments suivants pour la dissection en les lavant à l’eau suivie d’éthanol à 70%: ciseaux, pinces à peau, pinces à fenêtre incurvées, pinces fines incurvées, pinces fines droites, ciseaux fins.
- Étiquetez quatre tubes par souris comme suit et remplissez-les de saccharose stérile à 20% : ID de souris, Cerveau 1, ID de souris, Cerveau 2, ID de souris, Lombaire, ID de souris, Cervical.
- Retirez la souris de la solution de PFA et épongez-la avec une serviette en papier pour éliminer l’excès de PFA.
- À l’aide des gros ciseaux, retirez la tête de la souris en coupant au cou.
- Placez le corps dans la solution de PFA. Retenez la tête pour disséquer le cerveau du crâne.
- Pour disséquer le cerveau, commencez par réfléchir la peau crânienne vers l’avant pour exposer tout le crâne (Figure 4A).
- Faites une coupe peu profonde dans le conduit auditif à l’aide des ciseaux à dissection fine pour entrer dans le crâne
- Continuez cette coupe le long du sinus transversal jusqu’à ce que le crâne soit coupé entre les deux canaux auditifs.
- Faites une coupe perpendiculaire à la coupe précédente le long de la fissure longitudinale jusqu’à la partie la plus rostrale du crâne (approximativement entre les yeux).
- À l’aide de la pince incurvée fenestrée, réfléchissez le crâne latéralement pour exposer le cerveau antérieur. Continuez à retirer le crâne jusqu’à ce que tout le cerveau antérieur, y compris les bulbes olfactifs, soit exposé.
- Commencez à disséquer la région caudale du crâne en faisant une coupe à travers l’os occipital et en continuant lentement cette coupe vers le foramen magnum.
- Réfléchissez latéralement les deux morceaux de crâne pour exposer le cervelet et le tronc cérébral caudalement (figure 4B).
- Utilisez la pince incurvée ultrafine pour séparer les bulbes olfactifs du crâne antérieur et commencer à décoller le cerveau de la base du crâne en commençant par les bulbes olfactifs.
- Lorsque le cerveau est décollé de la base du crâne, utilisez une pince ultrafine pour couper les nerfs crâniens et permettre l’ablation du cerveau.
- Continuez à décoller le cerveau de la base du crâne jusqu’à ce que tout le cerveau intact soit retiré (Figure 4C,D).
- Coupez le cerveau en deux le long de la fissure longitudinale pour séparer les hémisphères droit et gauche l’un de l’autre (Figure 4E,F).
- Placez un hémisphère dans le cerveau 1 tube et le deuxième hémisphère dans le cerveau 2 tube. Conservez ces tubes à 4 °C jusqu’à ce que les hémisphères cérébraux coulent (environ toute la nuit).
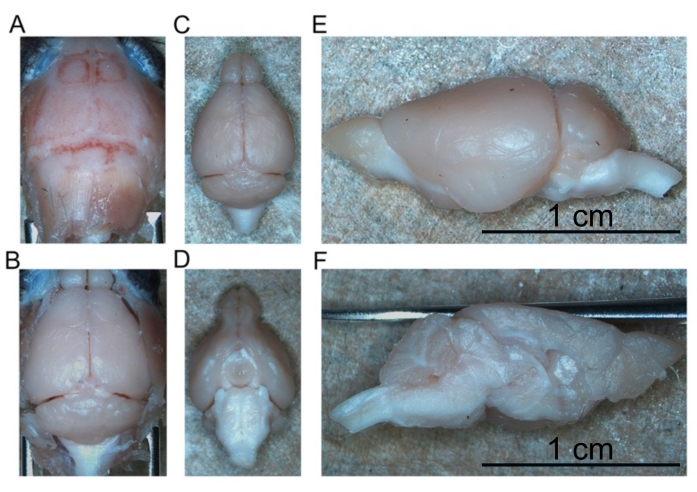
Figure 4: Retrait du cerveau fixe. (A) Haut du crâne. (B) Cerveau exposé dans le crâne. (C) Cerveau isolé (aspect dorsal). (D) Cerveau isolé (aspect ventral). (E) Hémisphère gauche (aspect latéral). (F) Hémisphère gauche (aspect médian). Barres d’échelle = 1 cm (E et F). Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Pour disséquer la moelle épinière, retirez le corps de la souris du PFA et épongez-le à sec.
- Placez la souris sur un bloc de dissection en polystyrène en position couchée et épinglez les pattes dans le bloc à l’aide de quatre aiguilles.
- Commencez la dissection en coupant la peau le long de la ligne médiane de la souris du cou à la queue pour exposer tout le dos.
- Réfléchissez le muscle et le fascia sur le dos pour exposer la partie postérieure de la colonne vertébrale.
- En commençant par les vertèbres les plus crâniennes, utilisez les ciseaux à dissection fine pour couper à travers la lame tout en évitant la moelle épinière (Figure 5A).
- Placez la pince incurvée ultrafine sous la lame et tirez vers le haut pour fracturer les vertèbres afin d’exposer la moelle épinière (Figure 5B).
- Utilisez la pince incurvée pour refléter les vertèbres fracturées et exposer les régions les plus latérales de la moelle épinière.
- Continuez ce processus pour les vertèbres suivantes en plaçant la pince incurvée ultrafine sous la lame et en fracturant les vertèbres. Continuer à fracturer les vertèbres jusqu’à ce que toute la colonne cervicale et la colonne thoracique soient exposées (figure 5C).
- Continuer à exposer la moelle épinière jusqu’à l’extrémité de la moelle épinière lombaire (figure 5D).
- À l’aide d’une lame de rasoir tranchante, coupez tout le long de la moelle épinière mithoracique.
- À l’aide de la pince incurvée ultrafine, transectez les nerfs spinaux latéralement de la colonne vertébrale et du fascia antérieur à la moelle épinière pour séparer lentement la moelle épinière cervicale de la colonne vertébrale.
- Continuer à disséquer la moelle épinière cervicale jusqu’à ce qu’elle soit libre des vertèbres (Figure 5E). Placez la moelle épinière cervicale-mi-thoracique dans le tube étiqueté cervical. Conservez ce tube à 4 °C jusqu’à ce que la moelle épinière cervicale coule (environ toute la nuit).
- Continuez à fracturer les vertèbres thoraciques jusqu’à la queue de cheval, comme indiqué aux étapes 4.22 à 4.25. Lorsque la cauda equina est exposée, utilisez une lame de rasoir tranchante pour couper la moelle épinière à 1 cm sous la moelle épinière lombaire (Figure 5F).
- Disséquez la moelle épinière lombaire loin des vertèbres comme indiqué aux étapes 4.26-4.27. Placez la moelle épinière lombaire-moyenne cauda equina dans le tube étiqueté lombaire. Conservez ce tube à 4 °C jusqu’à ce que la moelle épinière lombaire coule (environ toute la nuit).
- Lorsque tous les tissus ont coulé dans 20% de saccharose, transférez-les dans des tubes marqués de 30% de saccharose jusqu’à ce qu’ils aient coulé ou pendant 3 jours.
REMARQUE: Les tissus rachidiens ne coulent souvent pas à 30% de saccharose.
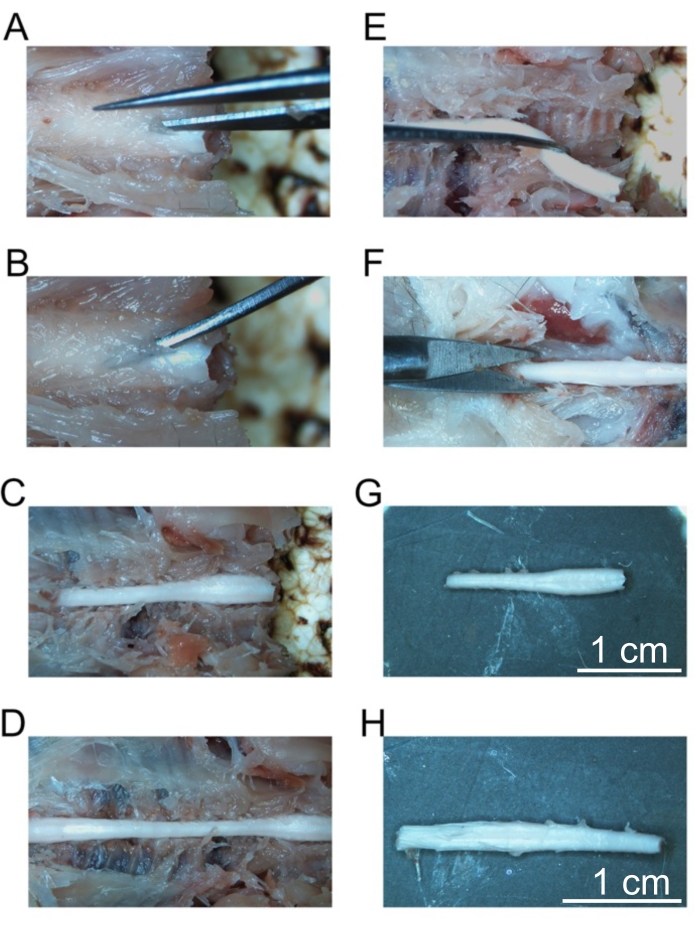
Figure 5: Enlèvement des segments fixes de la moelle épinière. (A) Coupe initiale dans la lame des vertèbres cervicales. (B) Placement de pinces incurvées pour fracturer des vertèbres individuelles. (C) La colonne cervicale exposée. (D) Colonne cervicale, thoracique et lombaire exposée. (E) Ablation de la colonne cervicale après avoir coupé les nerfs spinaux. (F) Couper la colonne vertébrale sacrée. (G) Colonne cervicale isolée. (H) Colonne lombaire isolée. Barres d’échelle = 1 cm (G et H). Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Intégration des PTOM et entreposage des tissus
- Pour chaque souris, étiquetez quatre cryomoulages de forme rectangulaire : ID de la souris, hémisphère droit, date d’intégration; ID de la souris, hémisphère gauche, date d’intégration; ID de la souris, cervical, date d’intégration; ID de la souris, Lombaire, Date d’intégration.
- Installez un récipient en polystyrène et suspendez un gobelet en métal au-dessus du récipient.
- Remplissez le récipient en polystyrène avec de l’azote liquide environ à mi-chemin. Remplissez la tasse en métal avec du 2-méthylbutane frais environ à mi-chemin.
REMARQUE: Le 2-méthylbutane est toxique, très volatil et inflammable. Il faut veiller à éviter l’inhalation en effectuant des étapes ultérieures dans une hotte et à l’écart des sources de combustion. - Abaissez lentement la tasse métallique dans l’azote liquide et évitez toute éclaboussure d’azote liquide dans la tasse métallique.
- Laissez le 2-méthylbutane commencer à geler. Pendant que le 2-méthylbutane est en train de geler, retirez le tissu désiré de la solution de saccharose à 30% et épongez-le sur une lingette sans poussière.
- Placez le tissu dans un cryomoulage avec la région rostrale pointée vers la partie supérieure (non étiquetée) du moule.
- Versez avec parcimonie le milieu d’incorporation de température de coupe optimale (OCT) sur le tissu dans le cryomoulage, en utilisant seulement assez pour couvrir complètement le tissu. Évitez d’utiliser un OCT excessif car cela peut provoquer des fissures. Supprimez toutes les bulles de l’OPO.
- Lorsque le 2-méthylbutane congelé a entièrement recouvert la surface interne de la tasse métallique, immergez complètement le cryomoulage dans la phase liquide sus-jacente 2-méthylbutane pendant 12 s. Après 12 s, placez le cryomoulage à égoutter dans un carré de papier d’aluminium étiqueté et enveloppez le cryomoulage entier. Placez immédiatement le cryomoulage enveloppé sur de la glace carbonique et évitez de décongeler. Assurez-vous que l’OCT/cryomoulage congelé est toujours recouvert de glace carbonique.
- Répétez les étapes 5.6 à 5.8 pour tous les tissus. Placez le tissu d’une souris dans un petit sac en plastique scellé, puis dans un récipient scellé et cryo-sûr. Conservez ce récipient dans le congélateur à -80 °C jusqu’à ce que les sections soient coupées.
6. Cryosection
- Avant la cryosection, assurez-vous que la température de la chambre de cryostat et la tête de l’échantillon sont réglées sur les réglages appropriés.
REMARQUE: Une température de chambre de -20 ° C, une température de tête d’échantillon de -20 ° C et une épaisseur de section de 30 μm sont utilisées pour couper des sections de cerveau. Pour couper des sections de moelle épinière, une température de chambre de -23 °C, une température de tête d’échantillon de -30 °C et une épaisseur de section de 30 μm sont utilisées. Il est important de noter que les réglages du cryostat (en particulier la température de la tête de l’échantillon) devront être ajustés pendant le sectionnement pour résoudre les problèmes de qualité des tissus. Généralement, la température de la tête de l’échantillon est abaissée pour corriger le frottis tissulaire. Inversement, la température de la tête de l’échantillon est augmentée pour corriger le curling excessif des tissus. - Retirez le bloc OCT souhaité du congélateur à -80 °C et placez le bloc cryomoulage/OCT non emballé dans la chambre de cryostat.
- Laissez le bloc OCT s’acclimater à la température de la chambre pendant 30 min.
- Nettoyez un mandrin avec de l’éthanol à 70% et essuyez-le avec une lingette sans poussière. Placez le mandrin nettoyé dans la chambre du cryostat et faites un cercle d’OCT de la taille d’une pièce de monnaie sur le mandrin. Laissez l’OCT geler (environ 1-2 min).
- Lorsque l’OCT a gelé, placez un point d’OCT frais de la taille d’un pois sur le mandrin et placez immédiatement le bloc d’OCT en tissu sur le mandrin. Assurez-vous que le tissu est parfaitement perpendiculaire au mandrin avant que l’OCT ne gèle complètement.
REMARQUE: Généralement, la région la plus rostrale du cerveau est placée vers le mandrin de sorte que la section commence à partir de l’extrémité caudale. Pour la moelle épinière, généralement, la région la plus caudale est placée sur le mandrin de sorte que la section commence à partir de l’extrémité rostrale. - Lorsque l’OCT a durci, placez plus d’OCT autour de la base du bloc OCT pour agir comme support structurel pendant le sectionnement. Lorsque ce support a légèrement durci, placez le mandrin sur la tête de l’échantillon et laissez le bloc OCT atteindre la température de la tête de l’échantillon pendant 30 min.
- Placez une lame de microtome dans le porte-lame et nettoyez la plaque antiroulis. Ajustez la distance de la plaque antiroulis pour vous assurer que le tissu passe juste sous la plaque pendant le sectionnement. Pour plus d’informations sur le positionnement correct de la plaque antiroulis, consultez le manuel du cryostat.
- Une fois que le bloc OCT s’est acclimaté à la température de la tête de l’échantillon, commencez à couper le bloc OCT jusqu’à ce que le tissu soit atteint. Lorsque le tissu est visible, passez de la coupe à la coupe et commencez à couper des sections de 30 μm. Déplacez-vous de côté de la plaque antiroulis et, à l’aide d’une lame de microscope, ramassez la section.
- Continuez à couper et à prélever les sections jusqu’à ce que vous soyez satisfait de l’emplacement anatomique des sections ou que tout le tissu ait été coupé. Placez les lames pour qu’elles sèchent à température ambiante pendant 1 à 3 jours. Après séchage, placez les glissières dans une boîte à glissière et placez cette boîte dans un sac en plastique scellé. Étiquetez le sac avec l’identifiant de la souris et les informations sur les tissus avant de placer les lames dans le congélateur à -80 °C.
7. Coloration immunofluorescente
- Décongeler les glissières pendant 1 h à température ambiante.
- Placez les lames dans un pot à glissière horizontal et lavez les sections 3 fois dans PBS pendant 10 minutes chaque lavage à température ambiante sur un agitateur.
- Préparer un tampon de blocage (2 % BSA + 0,3 % Triton-X-100 dans 1x PBS). Utilisez environ 1 mL par diapositive.
- Créez une chambre humidifiée en ajoutant de l’eau au fond. Posez les glissières vers le haut horizontalement et ne les laissez pas sécher. Ajouter 1 mL de tampon bloquant à chaque lame et incuber pendant au moins 1 h à température ambiante.
- Préparer la solution d’anticorps primaire en diluant l’anticorps primaire dans un tampon d’anticorps (0,7 % de BSA + 0,3 % de Triton-X-100 dans 1x PBS).
REMARQUE: Pour l’anticorps phosphorylé α-synucléine, un facteur de dilution de 1:500 a été utilisé. - Ajouter 200-300 μL de solution d’anticorps primaires par lame. Couvrir avec un couvercle pour disperser l’anticorps et incuber à 4 °C pendant la nuit.
- Le lendemain, retirez les glissières de la chambre humidifiée et placez-les dans un pot Coplin vertical rempli de 1x PBS pour permettre au couvercle de tomber. Faites-le pour chaque lame individuellement et veillez à ne pas déranger la section des tissus lors du retrait de la glissière de couverture.
- Placez les lames dans un pot à glissière horizontal et lavez les sections 3 fois dans PBS pendant 10 minutes chaque lavage à température ambiante sur un agitateur.
REMARQUE: Toutes les étapes suivantes doivent être effectuées avec les lumières éteintes pour éviter de photoblanchiment du fluorophore! - Préparer la solution d’anticorps secondaire en diluant l’anticorps secondaire dans un tampon d’anticorps.
REMARQUE: Pour la détection de la α-synucléine phosphorylée, un anti-lapin secondaire conjugué à Alexa 488 avec un facteur de dilution de 1:500 dans le tampon d’anticorps (0,7% BSA + 0,3% Triton-X-100 dans 1x PBS) a été utilisé. - Déposer les lames horizontalement dans la chambre humidifiée et ajouter 200-300 μL de solution d’anticorps secondaires par lame. Couvrir avec un couvercle pour disperser l’anticorps. Incuber à température ambiante pendant au moins 2 h.
- Retirez les glissières de la chambre humidifiée et placez-les dans un pot Coplin vertical rempli de 1x PBS pour permettre au couvercle de tomber. Faites-le pour chaque lame individuellement et veillez à ne pas déranger la section des tissus lors du retrait de la glissière de couverture.
- Placez les lames dans un pot à glissière horizontal et lavez les sections 3 fois dans PBS pendant 10 minutes chaque lavage à température ambiante sur un agitateur.
- Épongez-séchez le côté des glissières sur une serviette et secouez l’excès de PBS.
- Ajoutez 3 gouttes de support de montage à chaque diapositive. Ajoutez le couvercle et poussez doucement les bulles avec une paire de pinces en appuyant sur le couvercle avant l’imagerie par microscopie confocale.
Résultats
Une perfusion de haute qualité est indiquée par l’absence de sang dans le foie, la moelle épinière et les structures profondes du SNC (Figure 4C et Figure 5G,H). La rétention de sang sous la dure-mère (par exemple, dans les sinus veineux) ou entre la dure-mère et le crâne n’a pas été problématique car ce sang ne se trouve pas dans le parenchyme cérébral. Le sang vu sur la figure 4A est situé entre le crâne et la matière dure-mère et n’est donc pas problématique ou ne suggère pas une perfusion de mauvaise qualité. Le cerveau frais et la moelle épinière sont assez mous et facilement endommagés lors de la manipulation. Les tissus correctement fixés, en comparaison, sont fermes. Pour évaluer la qualité des tissus et la préservation de la morphologie des tissus par cette méthode de perfusion, ces travaux démontrent la détection de α-synucléine phosphorylée dans le mésencéphale et la moelle épinière lombaire d’une souris de 15 mois et d’une souris de 7 mois exprimant l’A53T humaine α-synucléine (Figure 6).
La mutation A53T est surreprésentée chez les patients atteints de la maladie de Parkinson (MP) autosomique dominante. En outre, la α-synucléine humaine avec la mutation A53T peut récapituler de nombreuses caractéristiques de la MP humaine lorsqu’elle est exprimée chez la souris 6,7. Il a été démontré que la phosphorylation de la α-synucléine au résidu de sérine 129 induisait in vivo et in vitro une agrégation α-synucléine8. Les corps de Lewey sont la découverte histologique classique présente chez les patients atteints de MP ou de démence à corps de Lewey9. Une majorité de la α-synucléine présente dans les corps de Lewey est phosphorylée à la sérine 12910,11. En conséquence, l’accumulation de α-synucléine phosphorylée est utilisée comme marqueur de la gravité histologique de la pathologie de la MP. La présente étude révèle que la α-synucléine phosphorylée s’accumule à un niveau significativement plus élevé chez les souris symptomatiques de 15,5 mois par rapport aux souris asymptomatiques de 7 mois exprimant l’A53T humaine α-synucléine. Ceci est cohérent avec les rapports décrivant un enrichissement de la cytopathologie dans les cornes antérieures de la moelle épinière et le mésencéphale de ces souris. 6 Il en résulte que la méthode de perfusion simplifiée décrite ici permet une fixation de haute qualité des tissus du SNC pour la caractérisation histologique en aval.
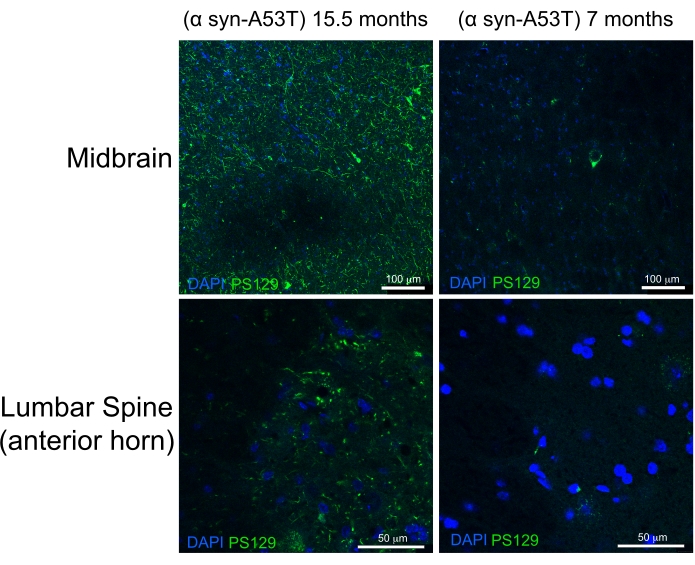
Figure 6 : Étiquette de la α-synucléine phosphorylée dans les tissus du mésencéphale et de la moelle épinière lombaire à partir d’un modèle murin de la maladie de Parkinson. La souris paralysée en phase terminale âgée (15,5 mois) est comparée à la souris en bonne santé de 7 mois. Les deux souris expriment une variante mutante sujette au mauvais repliement (A53T) de la α-synucléine humaine qui induit une pathologie semblable à celle de la maladie de Parkinson. Barres d’échelle = 100 μm (panneaux supérieurs) et 50 μm (panneaux inférieurs). Abréviation : α syn-A53T = mutant A53T de la α-synucléine ; DAPI = 4',6-diamidino-2-phénylindole; PS129 = sérine 129 phosphorylée de α-synucléine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce travail décrit les étapes critiques pour effectuer la perfusion transcardique. Lors de la construction de l’appareil de perfusion (section 1 du protocole), il est important d’utiliser un tube suffisamment flexible pour être complètement obstrué par un hémostat. Certains tubes rigides peuvent ne pas être suffisamment obstrués par un hémostat et peuvent encore permettre au PFA de s’infiltrer dans la conduite principale lors de la perfusion initiale du PBS. Lors de la préparation de la solution de PFA à 4%, il est important de s’assurer que le pH est physiologique (7.4). Comme la préparation de la solution de PFA implique de la chauffer à 65 °C, la solution doit être refroidie à 25 °C avant de mesurer le pH, car il s’agit de la température à laquelle le pH est étalonné sur le compteur.
Lors de l’incision initiale dans l’abdomen, il faut veiller à éviter la lacération des organes abdominaux (section 2 du protocole). Lors de la dissection supérieure vers le diaphragme, il est important d’éviter la lacération du foie car il est courant que le foie adhère à la paroi abdominale antérieure. Pour surmonter cela, le foie est soigneusement et carrément disséqué loin de la paroi antérieure avant de poursuivre une incision vers le diaphragme. Lorsque vous entrez dans la cavité thoracique par le diaphragme, il est important d’éviter la lacération du cœur, des grands vaisseaux et des poumons. Pour éviter cela, la pointe des ciseaux est maintenue superficiellement et à un angle aigu avec la cage thoracique.
La dissection initiale pour exposer le cœur prend environ 2 minutes à partir de l’incision initiale. On s’attend à ce que pendant ce temps, un peu d’air soit entré dans la pointe de l’aiguille du papillon. L’introduction de cet air dans la circulation de la souris donnera une perfusion de mauvaise qualité. Par conséquent, il est essentiel que la ligne principale soit ouverte et que le PBS soit rincé à travers l’aiguille immédiatement avant la canulation du cœur pour éliminer les bulles d’air. Idéalement, le cœur est canulé tandis qu’un petit filet PBS traverse la pointe de l’aiguille pour assurer l’absence totale d’air lors de la perforation du BT.
Lorsque l’aiguille pénètre dans le LV, elle ne doit pas aller assez profondément pour introduire la pointe de l’aiguille dans le ventricule droit (RV). Le placement de l’aiguille dans le VR ou au-delà de la valve mitrale entraînera un « gonflage » immédiat des poumons lorsque la perfusion est commencée. Ceci n’est pas souhaitable et l’aiguille doit être légèrement retirée pour assurer le placement du LV. Si l’aiguille est placée correctement, les poumons resteront plats tout au long de la perfusion. Lorsque la perfusion est initiée, on observe parfois qu’un liquide clair émerge de la bouche ouverte de l’animal. Cela est généralement dû à une pression de perfusion trop élevée ou à un mauvais placement de l’aiguille dans le cœur. Les auteurs spéculent que des pressions de perfusion élevées entraînent une extravasation du perfusate du lit capillaire artériolaire et un écoulement rétrograde du PBS via l’arbre bronchique dans l’œsophage et la cavité buccale.
La pression de perfusion doit être abaissée soit en diminuant le niveau de PBS dans le flacon PBS, soit en abaissant la hauteur du flacon PBS. Alternativement, si l’aiguille est placée trop profondément dans le ventricule gauche, elle peut traverser la valve mitrale et délivrer du perfusate à l’oreillette gauche. Cela peut entraîner un écoulement rétrograde dans les veines pulmonaires et une extravasation du perfusate dans les artérioles, comme décrit ci-dessus. Une clairance complète du sang du système circulatoire avec pbS est particulièrement importante pour éviter la réticulation des composants sanguins induite par un fixateur entraînant une occlusion des vaisseaux lors de la perfusion fixative ultérieure. La clairance est efficacement évaluée par un changement de couleur du foie et du flux de PBS à partir d’une incision dans la base ventrale de la queue. La clairance sanguine est généralement complète par 3 min de perfusion avec PBS; cependant, si des signes visuels de clairance se produisent à des moments plus courts, le fixateur est introduit plus tôt que 3 min. Des temps de dégagement plus longs ne sont pas recommandés car une perfusion fixative retardée conduit à des artefacts dans la structure fine duSNC 1.
Lorsque le PFA est administré, il est important de surveiller le niveau de solution de PFA dans le flacon de PFA. Remplissez la bouteille de PFA si le niveau de PFA tombe à moins de 4 cm au-dessus de la bouche de la bouteille de PFA. Une fois la perfusion terminée, l’appareil de perfusion doit être soigneusement rincé à l’eau distillée. Ceci est important car le PFA résiduel dans la ligne principale contaminera la perfusion initiale de PBS avec du PFA et entraînera une perfusion de mauvaise qualité. Enfin, les aiguilles papillon 25 G sont généralement recommandées pour les souris adultes de taille moyenne comprises entre 20 et 30 g. Cependant, les souris plus grandes ou plus petites peuvent nécessiter des aiguilles de jauge légèrement plus grandes ou plus petites en plus du réglage des bouteilles fixatrices pour fournir des débits optimaux.
Pour la dissection du SNC et l’incorporation d’OCT (section 3 du protocole), il est fréquent que les tissus de la moelle épinière ne coulent pas complètement dans le saccharose à 30%. Ces tissus sont donc laissés dans du saccharose pendant 2 jours puis incrustés dans l’OCT, qu’ils coulent ou non. Lors de la congélation des tissus dans l’OCT, il est possible que certains tissus se fissurent lorsqu’ils sont placés dans du 2-méthylbutane refroidi. Ceci est plus fréquent avec le cerveau et se produit généralement lorsque trop d’OCT est placé sur le tissu. Pour éviter cela, placez seulement assez d’OCT pour couvrir les surfaces tissulaires avant la congélation immédiate. Dans certains protocoles, la fissuration est moins fréquente malgré une immersion complète dans l’OCT. Cela est généralement dû à une méthode de congélation plus lente, par exemple lors de l’utilisation de 2-méthylbutane refroidi à la glace carbonique ou en plaçant directement le cryomoulage sur un bloc de glace carbonique. Le 2-méthylbutane refroidi à l’azote liquide est préféré dans ce travail car le taux de congélation est beaucoup plus rapide et peut mieux préserver la morphologie des tissus que les méthodes de congélation plus lentes.
Lors de la cryosection du tissu (section 4 du protocole), il est important d’éviter les cycles multiples de gel-dégel. Par conséquent, il est optimal de couper toutes les sections d’un seul bloc OCT pour obtenir une région spécifique du cerveau à analyser au lieu de décongeler et de recongeler des zones sélectionnées. Si cela n’est pas viable, après avoir obtenu quelques sections, les utilisateurs peuvent recongeler et stocker les blocs OCT dans le congélateur de -80 ° C 1 à 2 fois de plus pour une utilisation future.
Les principaux avantages de cette méthode par rapport à la pompe plus traditionnelle ou à l’administration de perfusat à pression d’air sont les suivants: (1) faible coût et accessibilité de l’appareil de perfusion. (2) Les utilisateurs n’ont pas besoin de maintenir manuellement la pression dans l’appareil de perfusion tout au long de la perfusion. (3) Pression de perfusion plus faible et plus constante que d’autres alternatives de perfusion à faible coût, telles que l’administration de seringues. En utilisant l’équation de Bernoulli, il est calculé que l’appareil de perfusion alimenté par gravité construit ici maintiendra une pression de perfusion d’environ 73 mm Hg lorsque les bouteilles de perfusat sont placées à 1 m d’altitude par rapport à l’aiguille. Étant donné que celle-ci est significativement inférieure à la pression artérielle systolique de ces animaux, cette pression de perfusion est probablement suffisamment basse pour éviter une rupture vasculaire12.
Les auteurs ont jusqu’à présent utilisé avec succès ce système de perfusion pour détecter la présence de α-synucléine phosphorylée dans un modèle murin de la maladie de Parkinson. Pendant ce temps, aucune limitation significative de cette méthode de perfusion n’a été rencontrée qui n’est pas présente avec une méthode d’administration par perfusion par pompe. La principale limite de cette technique est la nature chronophage de la perfusion par rapport à la fixation des gouttes. Cette technique est préférable à la fixation des gouttes car la perfusion entraîne une pénétration plus profonde du fixateur dans les structures du SNC. Une deuxième limitation de cette technique est qu’elle nécessite une certaine habileté chirurgicale pour fonctionner, car le cœur doit être canulé rapidement après l’entrée dans la cavité thoracique. Cependant, avec l’expérience, les utilisateurs formés peuvent systématiquement canuler le cœur dans les 1 minutes suivant l’incision initiale dans l’abdomen.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
Les auteurs remercient Xiaowen Wang, Liam Coyne et Jason Grullon pour leur aide dans l’élaboration de ce protocole. Ce travail a été soutenu par les subventions des NIH AG061204 et AG063499.
matériels
| Name | Company | Catalog Number | Comments |
| 2-Methylbutane (Certified ACS), Fisher Chemical | Fisher Scientific | 03551-4 | |
| Andwin Scientific Tissue-Tek O.C.T Compound | Fisher Scientific | NC1029572 | |
| Artman Instruments 4.5" Straight Castroveijo Spring Action Scissors | Amazon | B0752XHK2X | "fine scissors" |
| BD General Use and PrecisionGlide Hypodermic Needles, 18 G | Fisher Scientific | 14-826-5D | |
| BD General Use and PrecisionGlide Hypodermic Needles, 22 G | Fisher Scientific | 14-826B | |
| Corning PES Syringe Filters | Fisher Scientific | 09-754-29 | |
| Cytiva HyClone Phosphate Buffered Saline (PBS), 10x | Fisher Scientific | SH30258 | |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | |
| Fisher BioReagents Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | |
| Fisherbrand Curved Medium Point General Purpose Forceps | Fisher Scientific | 16-100-110 | "curved fenestrated forceps" |
| Fisherbrand Curved Very Fine Precision Tip Forceps | Fisher Scientific | 16-100-123 | "curved fine forceps" |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisher Scientific | 13-711-9AM | |
| Fisherbrand High Precision Straight Tapered Ultra Fine Point Tweezers/Forceps | Fisher Scientific | 12-000-122 | "straight fine forceps" |
| Fisherbrand Micro Spatulas with Rounded Ends | Fisher Scientific | 21-401-5 | |
| Fisherbrand Porcelain Buchner Funnels with Fixed Perforated Plates | Fisher Scientific | FB966J | |
| Fisherbrand Premium Cover Glass, 24 x 50 | Fisher Scientific | 12-548-5M | |
| Fisherbrand Premium Tissue Forceps 1X2 Teeth 5 in. German Steel | Fisher Scientific | 13-820-074 | "skin forceps" |
| Fisherbrand Reusable Heavy-Wall Filter Flasks | Fisher Scientific | FB3002000 | |
| Fisherbrand Standard Dissecting Scissors | Fisher Scientific | 08-951-20 | "dissecting scissors" |
| Fisherbrand Sterile Syringes for Single Use | Fisher Scientific | 14-955-464 | |
| Fisherbrand Straight Locking Hemostats | Fisher Scientific | 16-100-115 | |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Fisherbrand Vinyl Tubing and Connector Kits, 1/4 in. | Fisher Scientific | 14-174-1C | |
| Fisherbrand Wet-Strengthened Qualitative Filter Paper Circles | Fisher Scientific | 09-790-12F | |
| Fisherbrand Y Connector with 1/4 in. ID - Polypropylene - QC | Fisher Scientific | 01-000-686 | |
| Garvey Economy Single Edge Cutter Blade | Amazon | B001GXFAEQ | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, DyLight 488 | ThermoFisher Scientific | 35552 | |
| Ideal Clamp Stant High-Pressure Clamps | Fisher Scientific | 14-198-5A | "hose clamps" |
| IMEB, Inc Sakura Accu-Edge Low Profile Microtome Blades, Dispoisable | Fisher Scientific | NC9822467 | |
| Kawasumi 25 Gauge Standard Winged Blood Collection Set | Fisher Scientific | 22-010-137 | "butterfly needle" |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | Fisher Scientific | 06-666 | |
| Molecular Probes ProLong Diamond Antifade Mountant with DAPI | Fisher Scientific | P36962 | |
| Nalgene Narrow-Mouth Right-to-Know LDPE Wash Bottles | ThermoFisher Scientific | 2425-0506 | "buffer bottles" |
| PAP pen | abcam | ab2601 | |
| Paraformaldehyde Granular | Electron Microscopy Systems | 19210 | |
| Pyrex Glass Drying Dishes, 34.9 x 24.9 x 6 cm | Fisher Scientific | 15-242D | |
| Recombinant Anti-Alpha-synuclein (phospho S129) antibody [EP1536Y] | abcam | ab51253 | |
| Sodium Hydroxide | Sigma-Aldrich | 221465-2.5kg | |
| Stainless Steel Drinking Cup 18-oz | amazon | B0039PPO9U | |
| Sucrose for Molecular Biology CAS: 57-50-1 | Us Biological | S8010 | |
| Triton X-100 | Us Biological | T8655 | |
| Vetone Fluriso Isoflurane USP | MWI Animal Health | 502017 |
Références
- Tao-Cheng, J. H., Gallant, P. E., Brightman, M. W., Dosemeci, A., Reese, T. S. Structural changes at synapses after delayed perfusion fixation in different regions of the mouse brain. Journal of Comparative Neurology. 501 (5), 731-740 (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments: JoVE. (65), e3564 (2012).
- McFadden, W. C., et al. Perfusion fixation in brain banking: a systematic review. Acta Neuropathologica Communications. 7 (1), 146 (2019).
- Lamberts, R., Goldsmith, P. C. Fixation, fine structure, and immunostaining for neuropeptides: perfusion versus immersion of the neuroendocrine hypothalamus. Journal of Histochemistry and Cytochemistry. 34 (3), 389-398 (1986).
- Adickes, E. D., Folkerth, R. D., Sims, K. L. Use of perfusion fixation for improved neuropathologic examination. Archives of Pathology and Laboratory Medicine. 121 (11), 1199-1206 (1997).
- Giasson, B. I., et al. Neuronal alpha-synucleinopathy with severe movement disorder in mice expressing A53T human alpha-synuclein. Neuron. 34 (4), 521-533 (2002).
- Martin, L. J., et al. Parkinson's disease alpha-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. Journal of Neuroscience. 26 (1), 41-50 (2006).
- Fujiwara, H., et al. alpha-Synuclein is phosphorylated in synucleinopathy lesions. Nature Cell Biology. 4 (2), 160-164 (2002).
- Kalia, L. V., Lang, A. E. Parkinson's disease. Lancet. 386 (9996), 896-912 (2015).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. Journal of Biological Chemistry. 281 (40), 29739-29752 (2006).
- Kahle, P. J., et al. Hyperphosphorylation and insolubility of alpha-synuclein in transgenic mouse oligodendrocytes. EMBO Reports. 3 (6), 583-588 (2002).
- Mattson, D. L. Comparison of arterial blood pressure in different strains of mice. American Journal of Hypertension. 14, 405-408 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon