Method Article
انعكاس التداخل المتزامن والمجهر الفلوري للانعكاس الداخلي الكلي لتصوير الأنابيب الدقيقة الديناميكية والبروتينات المرتبطة بها
In This Article
Summary
نقدم بروتوكولا لتنفيذ الفحص المجهري لانعكاس التداخل والمجهر الفلوري الداخلي الكلي للتصوير المتزامن للأنابيب الدقيقة الديناميكية والبروتينات المرتبطة بالأنابيب الدقيقة ذات العلامات الفلورية.
Abstract
تم استخدام العديد من التقنيات للتصور المباشر للخيوط الهيكلية الخلوية والبروتينات المرتبطة بها. يحتوي الفحص المجهري الكلي الداخلي للانعكاس والتألق (TIRF) على نسبة إشارة إلى خلفية عالية ، لكنه يعاني من التبييض الضوئي والتلف الضوئي للبروتينات الفلورية. التقنيات الخالية من الملصقات مثل الفحص المجهري لانعكاس التداخل (IRM) والفحص المجهري للتشتت التداخل (iSCAT) تتحايل على مشكلة التبييض الضوئي ولكنها لا تستطيع تصور جزيئات مفردة بسهولة. تقدم هذه الورقة بروتوكولا للجمع بين IRM ومجهر TIRF التجاري للتصوير المتزامن للبروتينات المرتبطة بالأنابيب الدقيقة (MAPs) والأنابيب الدقيقة الديناميكية في المختبر. يسمح هذا البروتوكول بمراقبة عالية السرعة ل MAPs التي تتفاعل مع الأنابيب الدقيقة الديناميكية. يعمل هذا على تحسين إعدادات TIRF الحالية ذات اللونين من خلال القضاء على كل من الحاجة إلى وضع العلامات على الأنابيب الدقيقة والحاجة إلى العديد من المكونات البصرية الإضافية ، مثل ليزر الإثارة الثاني. يتم تصوير كلتا القناتين على نفس شريحة الكاميرا لتجنب مشاكل تسجيل الصور ومزامنة الإطارات. يتم توضيح هذا الإعداد من خلال تصور جزيئات كينيسين واحدة تمشي على الأنابيب الدقيقة الديناميكية.
Introduction
يستخدم المجهر الكلي الداخلي الانعكاسي الفلوري (TIRF) بشكل شائع لتصور جزيئات الفلورسنت المفردة. بالمقارنة مع التصوير اللافلوري ، يحقق TIRF قمعا فائقا للخلفية ، مما يسمح بتوطين عالي الدقة وتتبع الفلوروفورات المفردة. لهذا السبب ، فإن TIRF هي الطريقة المفضلة لتصور البروتينات المرتبطة بالأنابيب الدقيقة المصنفة بالفلورسنت وكثيرا ما تستخدم لتصوير الأنابيب الدقيقة 1,2.
للتحقيق في تنظيم ديناميكيات الأنابيب الدقيقة بواسطة MAPs ، غالبا ما يكون من الضروري تصوير كل من الأنابيب الدقيقة و MAPs في وقت واحد. معظم الطرق الحالية لهذا الغرض باهظة الثمن أو تعاني من عيوب فنية. على سبيل المثال ، يتطلب TIRF ثنائي اللون في وقت واحد اثنين من ليزر الإثارة وكاميرتين. بالإضافة إلى التكلفة العالية ، فإن الحاجة إلى كاميرات منفصلة تطرح مشاكل في مزامنة الإطار وتسجيل الصور. يمكن التحايل على هذه الحاجة إذا تم استخدام مكعب مرشح دوار للتبديل فعليا بين ليزر الإثارة في إطارات متتالية3. في مثل هذا الإعداد ، يمكن استخدام شريحة كاميرا واحدة ، وتتناوب الإطارات بين صور الأنابيب الدقيقة و MAPs. ومع ذلك ، فإن هذه التقنية محدودة بسرعة تغيير المرشح ، والتي عادة ما تقيد معدل الإطارات إلى أقل من 0.5 إطار في الثانية3 (fps). معدل الإطار هذا غير كاف لحل العمليات الديناميكية السريعة ، مثل انكماش النبيب الدقيق الذي يحدث بسرعة تصل إلى 500 نانومتر / ثانية ، أو سير كينيسين بسرعة 800 نانومتر / ثانية ، أو انتشار MAP يحدث مع معاملات انتشار تتجاوز 0.3 ميكرومتر2 / ث4. ويمثل ذلك إشكالية خاصة عند تتبع المواقع النسبية لهدفين متحركين في كل قناة، مثل موضع MAP بالنسبة لموضع طرف الأنابيب الدقيقة المتحركة5.
بالإضافة إلى هذه القيود البصرية ، يتطلب الفحص المجهري TIRF ثنائي اللون وضع علامة على MAPs و microtubules مع الفلوروفورات المختلفة التي يتم فصل أطياف انبعاثاتها بشكل كاف. يمكن أن يغير وضع العلامات الفلورية للتوبولين ديناميكيات الأنابيب الدقيقة6 ، ويحد التبييض الضوئي للفلوروفورات من سرعة التصوير7. بسبب هذه المشكلات ، تم تطوير تقنيات تصوير خالية من الملصقات لتصور الأنابيب الدقيقة. وتشمل هذه المجهر التداخل التداخل (iSCAT)8,9 ، والمجهر الدوار المتماسك المبعثر (ROCS)10 ، ومجهر تداخل الضوء المكاني (SLIM)11 ، ومجهر انعكاس التداخل (IRM) 12,13. تسمح هذه التقنيات بالتصوير السريع الخالي من الملصقات للأنابيب الدقيقة دون عيوب التصوير الفلوري ، ولكن لا يمكن استخدامها لتصور MAPs الفردية.
من بين هذه التقنيات الخالية من الملصقات ، تبرز IRM لتكلفتها المنخفضة ومطالبها المتواضعة على الأجهزة. لقد قدمنا مؤخرا بروتوكولا للجمع بين IRM ومجهر TIRF التجاري ، مما يسمح بتصوير الأنابيب الدقيقة و MAPs الفلورية في إطارات متناوبة 3,13. تقدم هذه الورقة بروتوكولا لتعديل هذا الإعداد لالتقاط صور TIRF و IRM في وقت واحد على شريحة كاميرا واحدة. يتضمن ذلك إضافة مقسم شعاع غير مكلف في مسار الإثارة لإلقاء الضوء على العينة في وقت واحد باستخدام ليزر TIRF ومصدر ضوء IRM LED. يتم استخدام مقسم صور تجاري معدل لفصل إشارات TIRF و IRM بشكل مرئي وعرضها على نصفين منفصلين من نفس شريحة الكاميرا. كما أننا نستخدم نظام الموائع الدقيقة الذي يسمح بالتبادل السريع للكواشف أثناء التصوير. يصف هذا البروتوكول كيفية استخدام هذا الإعداد لتصوير الأنابيب الدقيقة الديناميكية و MAPs. يتم إثبات قدرة الجهاز من خلال تقديم أول تصور لبروتينات كينيسين -1 التي تمشي على الأنابيب الدقيقة المتقلصة ، والتي يتم التقاطها بمعدل إطار 10 s-1.
Protocol
1. إعداد غرف التدفق
ملاحظة: سيتم بناء غرف تدفق الموائع الدقيقة عن طريق لصق القنوات الدقيقة متعددة الميثيل سيلوكسان (PDMS) بزجاج غطاء نظيف وعملي. سيتم صب القنوات الدقيقة في قالب رئيسي.
-
إعداد قنوات PDMS
- قم بإعداد نظارات غطاء نظيفة و / أو وظيفية مع كيمياء السطح المناسبة للفحص المحدد الذي يتم تصويره.
ملاحظة: بالنسبة لاختبارات حركية كينيسين ، يتم استخدام نظارات الغطاء السيلانية التي تم تنظيفها بواسطة أسماك البيرانا. يتم إعداد هذه كما هو موضح في جيل وآخرون. al.1 بدلا من ذلك ، فإن الإجراء الأبسط هو سونيك أغطية النظارات في الأيزوبروبانول متبوعا بالميثانول لمدة 3 × 20 دقيقة. - لإعداد قالب رئيسي ، قم بقطع شرائط من الشريط الثابت أحادي الجانب إلى حجم قناة التدفق المطلوب. قم بلصق الشرائط في الجزء السفلي من طبق بتري 10 سم ، وقم بترتيبها جنبا إلى جنب مع تباعد 1 سم على الأقل بين الشرائط.
ملاحظة: إذا كانت هناك حاجة إلى أبعاد قناة دقيقة ، فيمكن تصنيع القالب على رقائق السيليكون باستخدام الطباعة الحجرية الضوئية14. - لتحضير بوليمر PDMS ، اجمع بين عامل المعالجة والمطاط الصناعي الأساسي بنسبة كتلة 1:10. اخلطي لمدة 2 دقيقة.
ملاحظة: يمكن تغيير نسبة الخلط هذه لضبط صلابة البوليمر. تؤدي النسبة الأعلى من القاعدة إلى عامل المعالجة إلى بوليمر أكثر ليونة. - قم بفك الخليط في غرفة فراغ حتى تختفي جميع الفقاعات.
- صب الخليط على القالب الرئيسي في طبقة بسمك ~ 0.5 سم ، مع الحرص على تجنب إنشاء فقاعات.
- يخبز الخليط في فرن مسخن مسبقا على حرارة 70 درجة مئوية لمدة 40 دقيقة.
ملاحظة: قد تكون هناك حاجة إلى وقت معالجة أطول إذا كانت كتلة PDMS سميكة (>1 سم). استمر في التسخين بزيادات لمدة 5 دقائق حتى يتم علاجه بالكامل. - قطع المناطق المنظمة من البوليمر. ثقب ثقوب في كل طرف من أطراف القناة باستخدام مثقاب PDMS.
ملاحظة: في هذا البروتوكول، يتم ضبط قطر الثقب على 0.75 مم ويمكن تعديله وفقا لمعدلات التدفق المطلوبة. يمكن تخزين قنوات PDMS في البيئات الجافة لفترات طويلة ولكن يجب تنظيفها قبل الاستخدام. - قم بتنظيف الجانب المنظم من كتلة PDMS. استخدم شريطا ثابتا لإزالة الجسيمات الكبيرة. شطف مع الأيزوبروبانول ثم الميثانول. كرر هذه الشطف 3x ، وشطف بالماء فائق النقاء ، وجفف السطح.
- تقوم البلازما بتنظيف PDMS باستخدام الأكسجين أو بلازما الهواء.
ملاحظة: في هذا البروتوكول، يتم استخدام بلازما الهواء 18 واط. - ضع PDMS الذي تم تنظيفه بالبلازما على زجاج غطاء نظيف بشكل مناسب وسخن على صفيحة ساخنة عند 80 درجة مئوية لمدة 15 دقيقة.
ملاحظة: يمكن تطبيق راتنجات الايبوكسي على جوانب كتلة PDMS لإلصاقها بشكل أفضل بزجاج الغطاء. - أدخل أنابيب البولي إيثيلين منخفضة الكثافة (LDPE) ذات الحجم المناسب في الثقوب. قم بتوصيل أنبوب المخرج بحقنة 0.5 مل.
ملاحظة: في هذا البروتوكول، يتم توصيل الأنابيب التي يبلغ قطرها الداخلي 0.023 بوصة ب PDMS عبر محول معدني قطره الخارجي يبلغ 0.025. - تدفق المحاليل إلى القنوات الدقيقة عن طريق غمر أنبوب المدخل في المحلول ورسم الحجم المطلوب باستخدام المحقنة.
- قم بإعداد نظارات غطاء نظيفة و / أو وظيفية مع كيمياء السطح المناسبة للفحص المحدد الذي يتم تصويره.
2. الإعداد البصري
-
تعديل المجهر (الشكل 1)
- تعديل مجهر TIRF لتمكين تصوير IRM13. استبدل مقسم الشعاع 50/50 (الانعكاس (R)/ناقل الحركة (T)) المستخدم في عجلة مرشح المجهر بفاصل شعاع 10/90 (R/T).
- أدخل فاصل صور بين الكاميرا والمجهر.
- في مكعب المرشح الخاص بأداة تقسيم الصورة، أدخل مقسم شعاع 10/90 (R/T). ضع مرشحا طويل التمرير 600 نانومتر أمام الشعاع المنعكس ومرشح مناسب لانبعاث التألق أمام الحزمة المرسلة.
ملاحظة: يمكن استخدام مقسمات الحزم ذات نسب R/T المختلفة لضبط كسور ضوء الانبعاثات IRM وTIRF التي يتم جمعها. - قم بمحاذاة فاصل الصور وفقا لمواصفات الشركة المصنعة لفصل إشارات TIRF و IRM مكانيا على شريحة الكاميرا.
ملاحظة: يلزم الفصل المكاني للإشارات لأن إشارة TIRF للفلوروفورات النموذجية أضعف بكثير من إشارة IRM للأنابيب الدقيقة ولن يكون من الممكن اكتشافها إذا تم تراكب الإشارتين.
3. تصوير الأنابيب الدقيقة الديناميكية وجزيئات كينيسين المفردة
- تشغيل السطح والتخميل
- تدفق BRB80 المخزن المؤقت (80 mM Na-PIPES ، 1 mM EGTA ، 1 mM MgCl2 ، معاير إلى الرقم الهيدروجيني 7.8 مع NaOH) في غرفة التفاعل.
- محلول تدفق مضاد البيوتين المخفف إلى 0.025 ملغم / مل في BRB80 ويحضن في درجة حرارة الغرفة لمدة 10 دقائق.
- اغسل القناة باستخدام BRB80.
- التدفق في محلول F-127 (1٪ Pluronic F-127 (w / v) يذوب في BRB80 بين عشية وضحاها) ويحضن لمدة 20 دقيقة على الأقل لتخميل السطح.
ملاحظة: إذا تم استخدام نظارات الغطاء سهلة التنظيف بدلا من نظارات الغطاء المعزولة، فقم بالتخميل باستخدام 2 ملغم/مل من الكازين في BRB80 لمدة >20 دقيقة في درجة حرارة الغرفة. - اغسل القناة باستخدام BRB80.
- التحضير للتصوير
- إذا كان التحكم في درجة الحرارة مطلوبا ، فاستخدم سخان موضوعي واضبطه على درجة الحرارة الصحيحة.
ملاحظة: في هذا البروتوكول، يتم إجراء جميع التجارب عند 28 درجة مئوية. - ضع العينة على مرحلة المجهر وقم بتشغيل مصدر ضوء الإضاءة (>600 نانومتر) لتصوير IRM.
ملاحظة: في هذا البروتوكول، يتم استخدام مصدر ضوء LED أبيض مع مرشح تمرير طويل 600 نانومتر. - ركز المجهر على سطح العينة. ابحث عن المستوى البؤري الصحيح بالقرب من واجهة حل PDMS.
ملاحظة: في IRM ، يجب أن يظهر الجزء الداخلي المائي للقناة أكثر إشراقا من بوليمر PDMS. - اختر مجال رؤية بالقرب من مركز القناة.
- قم بإعداد محلول من ميكروبيدات الفلورسنت 0.1 ميكرومتر في BRB80 (الكثافة: 109 حبات / مل ، المقابلة لتخفيف 200 ضعف للخرز المستخدم في هذا البروتوكول).
- تدفق في حجم قناة واحدة على الأقل من محلول الميكروبيد.
- راقب التفاعل عبر IRM. انتظر حتى "تهبط الميكروبيدات" تدريجيا على السطح. عندما يتم تحقيق الكثافة المطلوبة من الميكروبيدات ، اغسل الفائض باستخدام BRB80.
- إذا كان التحكم في درجة الحرارة مطلوبا ، فاستخدم سخان موضوعي واضبطه على درجة الحرارة الصحيحة.
- زراعة غوانيليل البيوتينيل 5'-α,β-ميثيلين ديفوسفونات (GMPCPP)-بذور الأنابيب الدقيقة المستقرة
- في أنبوب جهاز طرد مركزي 0.6 مل ، قم بإعداد 50 ميكرولتر من محلول يحتوي على 1 mM GMPCPP و 1 mM MgCl 2 و2 μM tubulin biotinylated (5-10٪ وضع العلامات على stoichiometry) في BRB80.
ملاحظة: يمكن تحقيق قياس ستويشيومتري الصحيح عن طريق الجمع بين توبولين البيوتينيل عالي الكثافة مع التوبولين البقري غير المسمى في النسبة الصحيحة. - احتضن المحلول على الثلج لمدة 5 دقائق ، ثم احتضنه عند 37 درجة مئوية لمدة 12.5 دقيقة.
ملاحظة: يمكن التحكم في طول البذور عن طريق ضبط وقت البلمرة. - أوقف البلمرة بإضافة 100 ميكرولتر من درجة حرارة الغرفة BRB80.
- قم بتدوير المحلول في جهاز طرد مركزي فائق في درجة حرارة الغرفة (126000 × جم ، 5 دقائق). تخلص من السوبرناتانت باستخدام ماصة لإزالة التوبولين غير المبلمر.
ملاحظة: في هذا البروتوكول، يتم استخدام جهاز طرد مركزي فائق يعمل بالهواء. - أضف 200 ميكرولتر من درجة حرارة الغرفة BRB80 إلى الكرية. أعد تعليق الكريات عن طريق السحب بلطف ولكن بدقة. استخدم ماصة 200 ميكرولتر مع طرف مقطوع لتقليل قص الأنابيب الدقيقة.
- في أنبوب جهاز طرد مركزي 0.6 مل ، قم بإعداد 50 ميكرولتر من محلول يحتوي على 1 mM GMPCPP و 1 mM MgCl 2 و2 μM tubulin biotinylated (5-10٪ وضع العلامات على stoichiometry) في BRB80.
- تزايد ديناميكية غوانوزين ثنائي الفوسفات (الناتج المحلي الإجمالي) - توبولين "امتدادات"
ملاحظة: سيتم تجميد البذور على سطح المضاد الحيوي لقناة التدفق. سيتم زراعة "امتدادات" GTP / الناتج المحلي الإجمالي الديناميكية من نهايات البذور المجمدة.- تمييع البذور 20x في BRB80. تدفق البذور المخففة إلى غرفة التفاعل.
- راقب التفاعل عبر IRM. انتظر حتى "تهبط البذور" تدريجيا على السطح وترتبط بها. عندما يتم تحقيق الكثافة المطلوبة من البذور ، اغسل الفائض باستخدام BRB80.
- تحضير خليط تمديد الأنابيب الدقيقة: 12 ميكرومتر توبولين غير مسمى ، 1 mM GTP ، 5 mM dithiothreitol (DTT) في المخزن المؤقت BRB80.
- تدفق في حجم قناة واحدة على الأقل من خليط التمديد. تأكد من أن درجة حرارة التفاعل هي 28 درجة مئوية.
- انتظر حتى تنمو امتدادات الأنابيب الدقيقة من البذور بمرور الوقت.
ملاحظة: عادة ما يتم تحقيق طول الحالة الثابتة في أقل من 20 دقيقة. - استخدم الأنابيب الدقيقة الديناميكية للتصوير. أضف وتصور MAPs الفلورية على الأنابيب الدقيقة ، كما هو موضح في الخطوة 3.5 ل kinesin-1.
ملاحظة: نظرا لأن الأنابيب الدقيقة مرتبطة بالسطح ، فإنها مرئية بسهولة بواسطة TIRF.
- فحص حركية كينيسين
ملاحظة: تصف هذه الخطوة بروتوكولا لتصور بروتين الفلورسنت الأخضر المتحرك (GFP) المسمى kinesin-1 على الأنابيب الدقيقة المتقلصة. تم التعبير عن بنية كينيسين الفئران المبتورة -1 المنصهرة في eGFP (rKin430-eGFP) وتنقيتها ، كما هو موضح سابقا15,16.- تحضير المخزن المؤقت للحركية: 1 mM ATP و 0.2 mg / mL casein في BRB80.
- تمييع kinesin-eGFP في المخزن المؤقت للحركة إلى 10 نانومتر.
- قم بإعداد محلول زبال الأكسجين 2x لمواجهة التبييض الضوئي التأكسدي (80 mM glucose ، 80 mg / mL glucose oxidase ، 32 mg / mL catalase ، 0.2 mg / mL casein ، 20 mM DTT) مع 2 mM ATP.
- اجمع بين 10 أجزاء من كاسح الأكسجين و 9 أجزاء من BRB80 وجزء واحد من 10 نانومتر كينيسين-eGFP للحصول على تركيز كينيسين نهائي يبلغ 0.5 نانومتر.
ملاحظة: يجب أن يكون إجمالي الحجم أكبر بمقدار 1.5 ضعف على الأقل من حجم القناة. - اضبط إعدادات التصوير على برنامج المجهر.
ملاحظة: في هذا البروتوكول، يتم تسجيل مقاطع الفيديو بمعدل 10 إطارات في الثانية مع وقت تعرض يبلغ 100 مللي ثانية. كثافة الليزر ~ 0.05 كيلو واط / سم2. - ابدأ التصوير واتدفق محلول كينيسين إلى الغرفة.
- بعد اكتمال القياس ، سجل مقطع فيديو قصيرا (~ 5 ثوان) يتم فيه ترجمة المرحلة ببطء في حركة دائرية أو جانبية. استخدم متوسط الإسقاط لهذا الفيديو كصورة خلفية واطرحه من القياسات الأولية.
4. معالجة الصور وتحليلها
ملاحظة: تمت معالجة الصور باستخدام NIH ImageJ2 (imagej.nih.gov/ij/). تم تطوير ماكرو لأتمتة تقسيم ومحاذاة قنوات TIRF و IRM. يتطلب هذا الماكرو تثبيت المكون الإضافي GaussFit_OnSpot (متوفر في مستودع المكونات الإضافية ImageJ).
- من تسجيل الخلفية، قم بإنشاء إسقاط متوسط في ImageJ بالنقر فوق Image | مكدسات | Z-المشروع.
- اطرح متوسط إسقاط الخلفية من بيانات الصورة الخام بالنقر فوق معالجة | حاسبة الصور.
ملاحظة: تأكد من التحقق من الخيار "نتيجة 32 بت (تعويم)". - لتسجيل الصور ، اختر مجموعة من الميكروبيدات بالقرب من الأنابيب الدقيقة ذات الأهمية واستخدمها لمحاذاة صور TIRF و IRM.
- لكل حبة في هذه المجموعة، استخدم أداة التحديد متعدد النقاط لتحديد الموقع التقريبي في قناة TIRF ثم الموقع المقابل في قناة IRM.
ملاحظة: على سبيل المثال، إذا كان هناك خرزتان (1 و2)، فسيكون للاختيار متعدد النقاط أربع نقاط بالترتيب التالي: (1) حبة 1 في TIRF، (2) خرزة 1 في IRM، (3) خرزة 2 في TIRF، (4) خرزة 2 في IRM. - قم بتشغيل ماكرو ImageJ المتوفر (ImageSplitterRegistration.ijm).
ملاحظة: يعمل هذا على أتمتة الخطوات التالية: أ) تقدير الموقع المركزي لكل حبة عن طريق تركيبها مع غاوسي. ب) لكل حبة ، حساب متجه الإزاحة الذي يفصل المركز في قناة TIRF عن المركز في قناة IRM ؛ ج) حساب متوسط متجه الإزاحة هذا عبر جميع الخرز ؛ iv) تقسيم قنوات TIRF و IRM إلى صور منفصلة ؛ v) ترجمة صورة TIRF بواسطة متوسط متجه الإزاحة المحسوب في iii ؛ vi) تراكب صور TIRF و IRM في ملف .tiff متعدد القنوات.
النتائج
يتم تخطيط الإعداد البصري في الشكل 1. يتم توجيه كل من إضاءة IRM وضوء الإثارة TIRF إلى الفتحة الخلفية للهدف (100x ، NA: 1.49) عبر فاصل شعاع 10/90 (R / T) (BS1). تمر الإشارة المنبعثة عبر نفس مقسم الشعاع (BS1) وتنعكس على مقسم الصورة عبر مرآة (M1). تفصل مكونات مقسم الصور (المحاطة بخطوط متقطعة في الشكل 1) إشارات IRM و TIRF عبر مقسم شعاع 90/10 (R / T) (BS2) مع مرشحات طيفية مناسبة. أخيرا ، يتم عرض الصور المقسمة على شريحة الكاميرا للتصور. محاذاة مقسم الصور بحيث يتم عرض إشارات TIRF و IRM على نصفين منفصلين من الشريحة.
في المجهر المحاذي بشكل جيد ، يجب أن تعرض صورة الكاميرا صورة مقسمة في منتصف الطريق ، كما هو موضح في الشكل 2. يجب أن تكون الأنابيب الدقيقة المرتبطة بالسطح مرئية بسهولة في قناة IRM13 ، ويجب أن يكون الكينيسين الفلوري مرئيا في قناة TIRF.
تظهر الميكروبيدات المستخدمة لمحاذاة وتسجيل القناتين كنقاط مضيئة في صور TIRF وبقع داكنة في صور IRM. على الرغم من أن الخرز مرئي في البيانات الخام ، إلا أن طرح الخلفية يحسن التباين بشكل كبير (الشكل 2). صورة الخلفية المستخدمة للطرح هي الوسيط الزمني لمقطع فيديو مسجل بمرحلة متحركة. كما هو موضح في البروتوكول ، تم إجراء محاذاة الصورة عن طريق تحديد مجموعة من الخرز بالقرب من المنطقة محل الاهتمام وتنفيذ الماكرو المقدم (imageSplitterRegistration.ijm). يناسب الماكرو النقاط إلى Gaussians ويحاذي الصور عن طريق تقليل متوسط المسافة بين نقاط مركز التناسبات في كل قناة. يتم تمثيل هذه العملية في الشكل 2 ، والذي يوضح محاذاة جيدة للميكروبيدات الفلورية (الأخضر في قناة TIRF ، الأسود في قناة IRM).
أخيرا ، يتم إثبات قدرات إعداد التصوير المتزامن هذا من خلال مراقبة جزيئات كينيسين المفردة التي تسير نحو الأطراف المتقلصة للأنابيب الدقيقة. يوضح الشكل 3 كيموغراف لجزيئات كينيسين (خضراء) تحمل علامة eGFP وهي تمشي على أنبوب دقيق متقلص (رمادي). كما يتم تقديم سلسلة من اللقطات من التسجيل الذي تم إنشاء الكيموجراف منه.
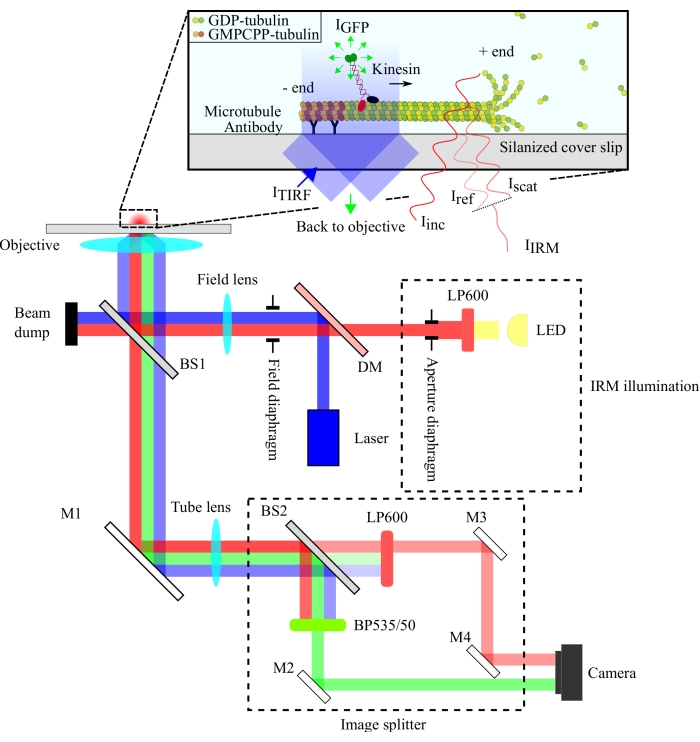
الشكل 1: تمثيل تخطيطي للإعداد البصري لتصوير IRM و TIRF المتزامن لحركية الكينيسين. تمر الإضاءة الفوقية من مصدر ضوء LED عبر الحجاب الحاجز لفتحة العدسة وتصل إلى مقسم الشعاع 10/90 (R / T) (BS1). يعكس مقسم الشعاع جزئيا ضوء إضاءة IRM الأحمر وضوء الإثارة TIRF 488 نانومتر حتى الهدف المتمثل في إضاءة العينة. يتم جمع الإشارة من العينة بواسطة نفس الهدف وتوجيهها إلى مجموعة تقسيم الصور حيث يتم فصل صور IRM و TIRF مكانيا بواسطة فاصل شعاع 90/10 (R / T) (BS2). ثم يتم تصفية الإشارات الطيفية قبل الوصول إلى شريحة الكاميرا. الاختصارات: IRM = المجهر انعكاس التداخل; TIRF = الانعكاس الداخلي الكلي - التألق ؛ LED = الصمام الثنائي الباعث للضوء. I TIRF = إضاءةTIRF ؛ IGFP = GFP التألق; Iinc = إضاءة IRM ؛ Iref = ضوء متناثر في واجهة الزجاج / الماء ؛ Iscat = ضوء متناثر من الأنابيب الدقيقة. I IRM = إشارةIRM (تداخل Iref و Iscat) ؛ R / T = منعكسة / مرسلة ؛ LP600: مرشح تمرير طويل (600 نانومتر) ؛ DM = مرآة ثنائية اللون ؛ BS1 و BS2 = مقسمات الحزم 1 و 2 ؛ M1 ، M2 ، M3 ، M4 = المرايا ؛ BP535/50 = تمرير النطاق (535/50 نانومتر) ؛ GFP = بروتين الفلورسنت الأخضر; GMPCPP = غوانيليل 5'-α,β-ميثيلين ديفوسفونات; الناتج المحلي الإجمالي = ثنائي فوسفات الغوانوزين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
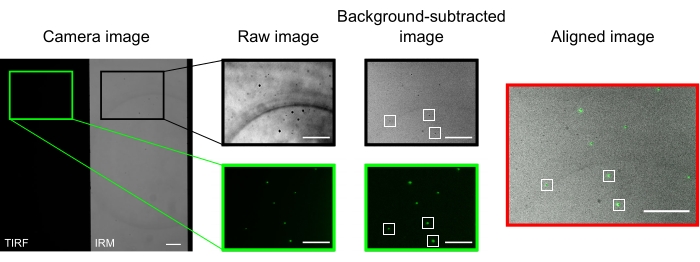
الشكل 2: طرح الخلفية ومحاذاة الصورة. تظهر صور TIRF (النصف الأيسر) و IRM (النصف الأيمن) في وقت واحد على نصفين من نفس شريحة الكاميرا (صورة الكاميرا). يزيد طرح الخلفية الوسيطة الزمنية من تباين الخرز (الصورة المطروحة في الخلفية) ، والتي تظهر داكنة في IRM ومشرقة في صور TIRF. تتم محاذاة صور IRM و TIRF بواسطة الترجمة (يمين) استنادا إلى تعريب الخرز المحدد (المستطيلات البيضاء). أشرطة المقياس = 10 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: Kymograph ولقطات من حركة Kinesins أثناء انكماش الأنابيب الدقيقة. يظهر الكيموغراف (يسار) eGFP-kinesin-1 (أخضر) يسير نحو الطرف الزائد من الأنابيب الدقيقة (رمادي داكن). يتم عرض لقطات من السلسلة الزمنية المقابلة (يمين). تظهر الأسهم البيضاء جزيئات كينيسين -1 مفردة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملف تسجيل ImageSplitter: يرجى النقر هنا لتنزيل هذا الملف.
Discussion
غالبا ما تتطلب دراسة تنظيم ديناميكيات الأنابيب الدقيقة بواسطة البروتينات المرتبطة بالأنابيب الدقيقة (MAPs) تصويرا متزامنا للأنابيب الدقيقة و MAPs. عادة ما يتم استخدام تقنيات الفحص المجهري الفلوري مثل TIRF لهذا الغرض. ومع ذلك ، فهي محدودة بعيوب التصوير الفلوري ، والتي تشمل التبييض الضوئي ، والضرر الضوئي ، والحاجة إلى وضع العلامات الفلورية. الطرق الخالية من الملصقات ، مثل IRM ، مناسبة لتصور الأنابيب الدقيقة ولكنها غير قادرة على تصوير الفلوروفورات المفردة. يجمع هذا البروتوكول بين تصوير IRM الخالي من الملصقات والفحص المجهري TIRF للتصوير المتزامن للأنابيب الدقيقة الديناميكية و MAPs.
يستخدم إعداد IRM مصدر إضاءة LED تمت تصفيته إلى >600 نانومتر ، بينما يستخدم إعداد TIRF ليزر 488 نانومتر. استخدمنا مقسم شعاع لوحة غير مكلف لعكس ضوء الإضاءة على العينة ونقل الإشارة المجمعة إلى الكاشف (الشكل 1). تم اختيار مقسم شعاع مع انعكاس 10٪ وانتقال 90٪ لتقليل فقدان إشارة الجزيء الواحد. يتم تعويض الخسارة بنسبة 90٪ في شدة ضوء الإضاءة عن طريق زيادة قوة ليزر الإضاءة و LED.
وتحقق الفصل الطيفي للإشارات باستخدام مقسم شعاع 90/10 (R/T) ومرشحين طيفيين (600 نانومتر للتمرير الطويل ل IRM وتمرير النطاق 535/50 نانومتر ل TIRF). يتم عرض إشارات IRM و TIRF المنفصلة طيفيا على نصفين من شريحة كاميرا واحدة باستخدام مجموعة مقسم الصور. يضحي استخدام مقسم شعاع 90/10 بنسبة 90٪ من إشارة IRM ، ولكن يتم تعويض ذلك عن طريق زيادة شدة مصدر إضاءة LED. يمكن أيضا استخدام مرآة ثنائية اللون هنا لفصل إشارات IRM و TIRF بشكل أكثر كفاءة. تتيح الميكروبيدات الفلورية المضمنة في الفحوصات محاذاة دقيقة لصور TIRF و IRM وتعمل كمرجع لتركيز الهدف.
العنصر البصري الأكثر أهمية في هذا البروتوكول هو هدف الفتحة العددية العالية (NA). هذا أمر ضروري ليس فقط لتحقيق الانعكاس الداخلي الكلي ولكن أيضا لتحقيق أقصى قدر من كفاءة المجموعة وتباين الصورة. تعتمد جودة الصور التي تم الحصول عليها أيضا على نظافة السطح الزجاجي والحصول على صورة خلفية واضحة لتصحيح الإضاءة غير الموحدة وإزالة الميزات الثابتة. بالنسبة لتصوير IRM ، نوصي باستخدام إضاءة الطول الموجي الطويل (>600 نانومتر) لتقليل الضرر الضوئي للأنابيب الدقيقة والبروتينات. هذا مهم بشكل خاص إذا تم استخدام مصدر ضوء LED أبيض ، وفي هذه الحالة يجب تضمين مرشح طويل المرور لإزالة أي ضوء للأشعة فوق البنفسجية.
يسمح هذا البروتوكول بالتصوير عالي السرعة بدون ملصقات للأنابيب الدقيقة الديناميكية والتصور المتزامن عالي الدقة ل MAPs17 الفلورية. بالمقارنة مع تقنية تبديل مكعب المرشح ، والتي تتناوب بين التقاط صور للأنابيب الدقيقة و MAPs ، فإن هذا الإعداد قادر على معدلات إطارات أعلى بكثير لأنه لا يعتمد على الدوران المادي لمكعب المرشح. بالمقارنة مع تقنيات التصوير TIRF بلونين ، تستخدم هذه التقنية إعدادا بصريا أقل تطلبا وتتحايل على الحاجة إلى وضع العلامات الفلورية على الأنابيب الدقيقة. ترجع القيود الأساسية لهذا الإعداد إلى تصوير TIRF ل MAPs. معدل الإطار محدود بوقت التعرض للفلوروفور ، ولا يزال التبييض الضوئي للفلوروفورات احتمالا. ومع ذلك ، فإن هذا البروتوكول يحسن التقنيات الحالية لأنه يستخدم TIRF فقط عند الضرورة (أي لتصور MAPs ولكن ليس microtubules) ويحقق أعلى سرعة ممكنة في حدود TIRF. لا يمكن إجراء المزيد من التحسينات إلا إذا تم تصور كل من الأنابيب الدقيقة و MAPs عبر تقنية قياس التداخل ، ولكن هذا يتطلب وضع علامات على MAPs بجسيمات نانوية معدنية ، والتي لها حدودها وتحدياتها التجريبية.
لإثبات قدرات هذه التقنية ، قمنا في وقت واحد بتصور عمليتين ديناميكيتين سريعتين عبر IRM و TIRF: انكماش الأنابيب الدقيقة والمشي في جزيء كينيسين الفلورسنت. تم استخدام هذه التقنية سابقا لتصور الانتشار السريع للسباستين على الأنابيب الدقيقة المتقلصة5. بالإضافة إلى هذا التطبيق على MAPs و microtubules ، يمكن استخدام هذا البروتوكول لتصور جزيئات الفلورسنت المفردة في وقت واحد مع أي بنية جزيئية كبيرة ضخمة بما يكفي لتصورها عبر IRM ، مثل غشاء الخلية أو خيوط الأكتين.
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نشكر مختبر تييري إيمونيه على مشاركة معدات غرف الأبحاث. نشكر Yin-Wei Kuo على إعداد eGFP-kinesin المنقى المستخدم في هذه الدراسة. تعترف Y.T. بدعم مؤسسة ألكسندر فون هومبولت من خلال زمالة فيودور لينين للأبحاث. تم دعم هذا العمل من قبل NIH Grant R01 GM139337 (إلى J.H.).
Materials
| Name | Company | Catalog Number | Comments |
| 10/90 (R/T) beam splitter | Thorlabs | BSN10R | Plane beam splitter used in the excitation beam path |
| 90/10 (R/T) beam splitter | Thorlabs | BSX10R | Plane beam splitter used in the image splitter |
| Anti-biotin antibody | Sigma-Aldrich | B3640 | Used to functionalize surface for bonding biotinylated microtubules |
| ATP | Sigma-Aldrich | FLAAS | Used for preparing the motility buffer |
| Band-pass filter | Newport | HPM535-50 | Hard-coated band-pas filter is used in image splitter to image GFP signal |
| Biotinylated tubulin | Cytoskeleton, Inc. | T333P-A | Used to bind microtubule seeds to the surface of the flow channel |
| Casein | Sigma-Aldrich | C8654 | Casein is used to block nonspesific interactions |
| Catalase | Sigma-Aldrich | C9322 | Used for preparing the oxygen scavenger solution |
| Desiccator chamber | Southern Labware | 55207 | Desiccator is used for degasing the resin |
| DTT | Sigma-Aldrich | D0632 | Used for preparing the oxygen scavenger solution |
| EGTA | Sigma-Aldrich | E4378 | Used for preparing the BRB80 buffer |
| Glucose | Sigma-Aldrich | G7528 | Used for preparing the oxygen scavenger solution |
| Glucose oxidase | Sigma-Aldrich | G7016 | Used for preparing the oxygen scavenger solution |
| GMPCPP nucleotides | Jena Bioscience | NU-405L | Used for the polymerization of stabilized microtubules |
| Image splitter | Teledyne-Photometrics Imaging | OptoSplit II | An image splitter is used to split the images spatially. When buying, make sure about the compatibility with the microscope |
| ImajeJ2 | NIH | ImageJ2 is used for image analysis | |
| Kinesin | prepared in house (see references in text) | ||
| LDPE tubing | Thomas Scientific | 9565S22 | Non-toxic, lower density polyethylene micro bore tubing is used for fluid transfers |
| LED light source | Lumencor | Lumencor sola light engine | Used for IRM imaging |
| Long-pass filters | Thorlabs | FELH0600 | Hard-coated long pass filters. One is used as an excitation filter, other is used in image splitter to image IRM signal |
| Magnesium chloride | Sigma-Aldrich | 63068 | Used for preparing the BRB80 buffer |
| Micoscope objective heater | okolab | H401-T-DUAL-BL | Used to keep sample temperature constant via heating the objective |
| Microscope | Nikon | Ti-Eclipse | An inverted microscope that is used in the experiments |
| Na-PIPES | Sigma-Aldrich | P2949 | Used for preparing the BRB80 buffer |
| Nikon CFI Apochromat TIRF 100XC Oil objective | Nikon | MRD01991 | The imaging objective has 1.49 numerical aperture |
| PDMS and curing agent | Electron Microscopy Sciences | Sylgard 184 (24236-10) | Used for contructing the flow channels |
| PDMS puncher | World Precision Instruments LLC | 504529 | Used to punch hole into the PDMS |
| Plasma cleaner | Harrick Plasma | DPC-32G | The air plasma is used to remove organic contamination from the PDMS surface |
| Poloxamer 407 (commercial name Pluronic F-127) | Sigma-aldrich | P2443 | Used for channel surface passivation to minimize nonspecific binding |
| Sodium hydroxide | Sigma-Aldrich | 567530 | Used for preparing the BRB80 buffer |
| Stabilized microtubules | prepared in house (see references in text) | ||
| Table-top ultracentrifuge | Beckman Coulter | 340400 | Used to spin down microtubule seeds |
| TetraSpeck beads | ThermoFisher Scientific | T7279 | Used as a reference for aligning images |
| Zyla 4.2 camera | Andor | Zyla 4.2 | Scientific CMOS camera with spesifications: 2048 x 2048 pixels (6.5 μm pixel size) with quantum efficiency of 72% and 16 bit dynamic range |
References
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biology. 95, 221-245 (2010).
- Axelrod, D. Chapter 7: Total internal reflection fluorescence microscopy. Methods in Cell Biology. 89, 169-221 (2008).
- Kuo, Y. -. W., Trottier, O., Mahamdeh, M., Howard, J. Spastin is a dual-function enzyme that severs microtubules and promotes their regrowth to increase the number and mass of microtubules. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5533-5541 (2019).
- Hinrichs, M. H., et al. Tau protein diffuses along the microtubule lattice. The Journal of Biological Chemistry. 287 (46), 38559-38568 (2012).
- Al-Hiyasat, A., Tuna, Y., Kuo, Y. -. W., Howard, J. Herding of proteins by the ends of shrinking polymers. arXiv:. , (2021).
- Guo, H., et al. Mechanism and dynamics of breakage of fluorescent microtubules. Biophysical Journal. 90 (6), 2093-2098 (2006).
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Taylor, R. W., Sandoghdar, V., Astratov, V. . Interferometric scattering (iSCAT) microscopy and related techniques. in Label-free super-resolution microscopy. , 25-65 (2019).
- Young, G., Kukura, P. Interferometric scattering microscopy). Annual Review of Physical Chemistry. 70 (1), 301-322 (2019).
- Koch, M. D., Rohrbach, A. Label-free imaging and bending analysis of microtubules by ROCS microscopy and optical trapping. Biophysical Journal. 114 (1), 168-177 (2018).
- Kandel, M. E., Teng, K. W., Selvin, P. R., Popescu, G. Label-free imaging of single microtubule dynamics using spatial light interference microscopy. ACS Nano. 11 (1), 647-655 (2017).
- Mahamdeh, M., Simmert, S., Luchniak, A., Schäffer, E., Howard, J. Label-free high-speed wide-field imaging of single microtubules using interference reflection microscopy. Journal of Microscopy. 272 (1), 60-66 (2018).
- Mahamdeh, M., Howard, J. Implementation of interference reflection microscopy for label-free, high-speed imaging of microtubules. Journal of Visualized Experiments: JoVE. (150), e59520 (2019).
- Voldman, J., Gray, M. L., Schmidt, M. A. Microfabrication in biology and medicine. Annual Review of Biomedical Engineering. 1, 401-425 (1999).
- Rogers, K. R., et al. KIF1D is a fast non-processive kinesin that demonstrates novel K-loop-dependent mechanochemistry. The EMBO Journal. 20 (18), 5101-5113 (2001).
- Leduc, C., Ruhnow, F., Howard, J., Diez, S. Detection of fractional steps in cargo movement by the collective operation of kinesin-1 motors. Proceedings of the National Academy of Sciences of the United States of America. 104 (26), 10847-10852 (2007).
- Tuna, Y., Al-Hiyasat, A., Howard, J. Imaging dynamic microtubules and associated proteins by Simultaneous Interference-Reflection and Total-Internal-Reflection-Fluorescence Microscopy. arXiv. , (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved