Method Article
Reflexão de Interferência Simultânea e Microscopia de Fluorescência De Reflexão Interna Total para Microtúbulos Dinâmicos de Imagem e Proteínas Associadas
Neste Artigo
Resumo
Apresentamos um protocolo para a implementação de microscopia de reflexão de interferência e microscopia de reflexão interna-fluorescência para a imagem simultânea de microtúbulos dinâmicos e proteínas fluorescentes rotuladas como microtubulas.
Resumo
Várias técnicas têm sido empregadas para a visualização direta de filamentos citoesqueléticos e suas proteínas associadas. A microscopia de reflexão total-interna-fluorescência (TIRF) tem uma alta relação sinal-fundo, mas sofre de fotobleaching e fotodamage das proteínas fluorescentes. Técnicas livres de rótulos como microscopia de reflexão de interferência (IRM) e microscopia de dispersão interferométrica (iSCAT) contornam o problema do fotobleaching, mas não conseguem visualizar prontamente moléculas únicas. Este artigo apresenta um protocolo para combinar IRM com um microscópio de TIRF comercial para a imagem simultânea de proteínas associadas a microtúbulos (MAPs) e microtúbulos dinâmicos in vitro. Este protocolo permite a observação em alta velocidade de MAPs interagindo com microtúbulos dinâmicos. Isso melhora as configurações de TIRF de duas cores existentes, eliminando tanto a necessidade de rotulagem de microtúbulos quanto a necessidade de vários componentes ópticos adicionais, como um segundo laser de excitação. Ambos os canais são filmados no mesmo chip de câmera para evitar problemas de registro de imagem e sincronização de quadros. Esta configuração é demonstrada visualizando moléculas de quinase única andando em microtúbulos dinâmicos.
Introdução
A microscopia de reflexão total-interna -fluorescência (TIRF) é comumente empregada para a visualização de moléculas fluorescentes únicas. Comparado com a imagem de epifluorescência, o TIRF consegue uma supressão de fundo superior, permitindo a localização e o rastreamento de fluoroforos de alta resolução. Por essa razão, o TIRF é o método preferido para visualizar proteínas fluorescentes com microtúbulos e é frequentemente usado para imagens de microtúbulos 1,2.
Para investigar a regulação da dinâmica dos microtúbulos pelos MAPs, muitas vezes é necessário a imagem de microtúbulos e MAPs simultaneamente. A maioria dos métodos existentes para este fim são caros ou sofrem de desvantagens técnicas. TIRF de duas cores simultânea, por exemplo, requer dois lasers de excitação e duas câmeras. Além do alto custo, a necessidade de câmeras separadas coloca problemas de sincronização de quadros e registro de imagem. Essa necessidade pode ser contornada se um cubo de filtro rotativo for usado para alternar fisicamente entre lasers de excitação em quadros consecutivos3. Em tal configuração, um único chip de câmera pode ser usado, e os quadros alternam entre imagens de microtúbulos e MAPs. Essa técnica, no entanto, é limitada pela velocidade da mudança do filtro, que normalmente restringe a taxa de quadros a menos de 0,5 quadros por segundo3 (fps). Tal taxa de quadros é insuficiente para resolver processos dinâmicos rápidos, como o encolhimento de um microtúbulo que ocorre a uma velocidade de até 500 nm/s, a caminhada de uma quinase a uma velocidade na ordem de 800 nm/s, ou a difusão de um MAP ocorrendo com coeficientes de difusão superiores a 0,3 μm2/s4. Isso é particularmente problemático ao rastrear as posições relativas de dois alvos móveis em cada canal, como a posição de um MAP em relação à posição de uma ponta de microtúbulo5 em movimento.
Além dessas restrições ópticas, a microscopia TIRF de duas cores requer que MAPs e microtúbulos sejam rotulados com diferentes fluoroforos cujos espectros de emissão são suficientemente separados. A rotulagem fluorescente de tubulina pode alterar a dinâmica do microtúbulo6, e o fotobleaching de fluoroforos limita a velocidade de imagem7. Por causa dessas questões, técnicas de imagem sem rótulos foram desenvolvidas para visualizar microtúbulos. Estes incluem microscopia de dispersão interferométrica (iSCAT)8,9, microscopia de dispersão coerente rotativa (ROCS)10, microscopia de interferência de luz espacial (SLIM)11 e microscopia de reflexo de interferência (IRM)12,13. Essas técnicas permitem imagens rápidas sem rótulos de microtúbulos sem as desvantagens da imagem de fluorescência, mas não podem ser usadas para visualizar maps únicos.
Dessas técnicas sem rótulos, a IRM se destaca por seu baixo custo e suas modestas demandas de instrumentação. Recentemente apresentamos um protocolo para combinar IRM com um microscópio TIRF comercial, permitindo que microtúbulos e MAPs fluorescentes sejam imagens em quadros alternados 3,13. Este artigo apresenta um protocolo para modificar esta configuração para capturar simultaneamente imagens TIRF e IRM em um único chip de câmera. Isso envolve a adição de um divisor de feixe barato no caminho de excitação para iluminar simultaneamente a amostra com um laser TIRF e uma fonte de luz LED IRM. Um divisor de imagens comercial modificado é usado para separar espectralmente os sinais TIRF e IRM e projetá-los em metades separadas do mesmo chip de câmera. Também empregamos um sistema microfluido que permite a rápida troca de reagentes durante a imagem. Este protocolo descreve como essa configuração pode ser usada para imagens dinâmicas de microtúbulos e MAPs. A capacidade do aparelho é demonstrada apresentando a primeira visualização de proteínas cinesina-1 andando sobre microtúbulos de encolhimento, que é capturado a uma taxa de quadros de 10 s-1.
Protocolo
1. Preparação de câmaras de fluxo
NOTA: As câmaras de fluxo microfluidas serão construídas adingerindo microcanais de polidimetilatilaxitano (PDMS) a um vidro de cobertura limpo e funcionalizado. Os microcanais serão lançados em um molde mestre.
-
Preparação de canais PDMS
- Prepare óculos de cobertura limpos e/ou funcionais com química superficial adequada ao ensaio específico que está sendo imagedo.
NOTA: Para ensaios de motilidade de quinase, são utilizados óculos de cobertura silanizados limpos com piranha. Estes são preparados como descrito em Gell et. al.1 Alternativamente, um procedimento mais simples é sonicar óculos de cobertura em isopropanol seguido de metanol para ciclos de 3x 20 min. - Para preparar um molde mestre, corte as tiras de fita estacionária unilateral para o tamanho do canal de fluxo desejado. Adere as tiras ao fundo de uma placa de Petri de 10 cm, organizando-as lado a lado com pelo menos 1 cm de espaçamento entre as tiras.
NOTA: Se forem necessárias dimensões precisas do canal, o molde pode ser fabricado em wafers de silício usando fotolitografia14. - Para preparar o polímero PDMS, combine o agente de cura e o elastômero base em uma proporção de massa de 1:10. Misture por 2 minutos.
NOTA: Esta razão de mistura pode ser variada para ajustar a rigidez do polímero. Uma maior proporção de base para agente de cura resulta em um polímero mais macio. - Desgas a mistura em uma câmara de vácuo até que todas as bolhas desapareçam.
- Despeje a mistura sobre o molde mestre em uma camada de ~0,5 cm de espessura, tomando cuidado para evitar criar bolhas.
- Asse a mistura em forno pré-aquecido a 70 °C por 40 min.
NOTA: Um tempo de cura mais longo pode ser necessário se o bloco PDMS for espesso (>1 cm). Continue aquecendo em incrementos de 5 minutos até que esteja totalmente curado. - Corte as regiões estruturadas do polímero. Faça furos em cada extremidade do canal usando um perfurador PDMS.
NOTA: Neste protocolo, o diâmetro do furo é ajustado para 0,75 mm e pode ser ajustado de acordo com as taxas de fluxo exigidas. Os canais PDMS podem ser armazenados em ambientes secos por longos períodos, mas devem ser limpos antes do uso. - Limpe o lado estruturado do bloco PDMS. Use fita estacionária para remover partículas grandes. Enxágüe com isopropanol e depois metanol. Repita estas enxágües 3x, enxágue com água ultrauso e seque a superfície.
- Limpar o PDMS usando oxigênio ou plasma de ar.
NOTA: Neste protocolo, é usado plasma de ar de 18 W. - Coloque o PDMS limpo de plasma em um vidro de cobertura apropriadamente limpo e aqueça em uma placa quente a 80 °C por 15 minutos.
NOTA: A resina Epóxi pode ser aplicada nas laterais do bloco PDMS para aderir melhor ao vidro de cobertura. - Insira tubos de polietileno de baixa densidade (LDPE) de tamanho adequado nos orifícios. Conecte a tubulação de saída a uma seringa de 0,5 mL.
NOTA: Neste protocolo, tubos com diâmetro interno de 0,023 em estão conectados ao PDMS através de um adaptador metálico de diâmetro externo de 0,025. - Escorraça soluções nos microcanais imergindo o tubo de entrada na solução e desenhando o volume necessário com a seringa.
- Prepare óculos de cobertura limpos e/ou funcionais com química superficial adequada ao ensaio específico que está sendo imagedo.
2. Configuração óptica
-
Modificação do microscópio (Figura 1)
- Modifique um microscópio TIRF para ativar a imagem IRM13. Substitua o divisor de feixe 50/50 (Reflectance (R)/Transmission (T)) usado na roda do filtro do microscópio por um divisor de feixe de 10/90 (R/T).
- Insira um divisor de imagens entre a câmera e o microscópio.
- No cubo de filtro do divisor de imagens, insira um divisor de feixe 10/90 (R/T). Coloque um filtro de passagem longa de 600 nm na frente do feixe refletido e um filtro apropriado de emissão de fluorescência na frente do feixe transmitido.
NOTA: Os divisores de feixe com diferentes proporções de R/T podem ser usados para ajustar as frações da luz de emissão IRM e TIRF coletadas. - Alinhe o divisor de imagens de acordo com as especificações do fabricante para separar espacialmente os sinais DE TIRF e IRM no chip da câmera.
NOTA: A separação espacial dos sinais é necessária porque o sinal de TIRF de fluoroforos típicos é muito mais fraco que o sinal IRM de um microtúbulo e não seria detectável se os dois sinais fossem sobrepostos.
3. Microtúbulos dinâmicos de imagem e moléculas únicas de Quinasina
- Funcionalização e passivação de superfície
- Flow BRB80 buffer (80 mM Na-PIPES, 1 mM EGTA, 1 mM MgCl2, titulado para pH 7.8 com NaOH) na câmara de reação.
- Solução de antibiotina de fluxo diluída a 0,025 mg/mL no BRB80 e incubada à temperatura ambiente por 10 minutos.
- Lave o canal com BRB80.
- Fluxo na solução F-127 (1% Pluronic F-127 (w/v) dissolvido no BRB80 durante a noite) e incubar por pelo menos 20 min para a passivação da superfície.
NOTA: Se os óculos de cobertura de fácil limpeza forem usados em vez de óculos de cobertura silanizados, passivate usando caixa de 2 mg/mL em BRB80 por >20 min à temperatura ambiente. - Lave o canal com BRB80.
- Preparação para imagens
- Se for necessário controlar a temperatura, use um aquecedor objetivo e ajuste-o à temperatura correta.
NOTA: Neste protocolo, todos os experimentos são realizados a 28 °C. - Coloque a amostra no estágio do microscópio e ligue a fonte de luz de epiilluminação (>600 nm) para imagens IRM.
NOTA: Neste protocolo, uma fonte de luz LED branca é usada com um filtro de passagem longa de 600 nm. - Concentre o microscópio na superfície da amostra. Procure o plano focal correto perto da interface de solução PDMS.
NOTA: No IRM, o interior aquoso do canal deve parecer muito mais brilhante que o polímero PDMS. - Escolha um campo de visão perto do centro do canal.
- Prepare uma solução de microesferas fluorescentes de 0,1 μm em BRB80 (densidade: 109 contas/mL, correspondente a uma diluição de 200 vezes para as contas utilizadas neste protocolo).
- Flua em pelo menos um volume de canal da solução de microesferas.
- Monitore a reação via IRM. Aguarde que as microesferas gradualmente "aterrissem" na superfície. Quando a densidade desejada de microesferas for alcançada, lave o excesso com BRB80.
- Se for necessário controlar a temperatura, use um aquecedor objetivo e ajuste-o à temperatura correta.
- Cultivo biotiningilado guanylyl 5'-α,β-metilenediphosphonato (GMPCPP)-sementes de microtúbulos estabilizadas
- Em um tubo de centrífugas de 0,6 mL, prepare 50 μL de uma solução contendo 1 mM GMPCPP, 1 mM MgCl2 e 2 μM de tubulina biotinilada (5-10% de stoichiometria de rotulagem) no BRB80.
NOTA: A rotulagem correta pode ser alcançada combinando tubulina biotiningada de alta densidade com tubulina bovina sem rótulo na razão correta. - Incubar a solução no gelo por 5 minutos e incubar a 37 °C por 12,5 min.
NOTA: O comprimento das sementes pode ser controlado afinando o tempo de polimerização. - Pare a polimerização adicionando 100 μL de temperatura ambiente BRB80.
- Gire a solução em uma ultracentrifugação à temperatura ambiente (126.000 x g, 5 min). Descarte o supernatante usando uma pipeta para remover tubulina não imersa.
NOTA: Neste protocolo, é usado um ultracentrifuuge acionado pelo ar. - Adicione 200 μL de temperatura ambiente BRB80 à pelota. Resuspenque a pelota pipetando suavemente, mas completamente. Use uma pipeta de 200 μL com uma ponta de corte para reduzir a tesoura dos microtúbulos.
- Em um tubo de centrífugas de 0,6 mL, prepare 50 μL de uma solução contendo 1 mM GMPCPP, 1 mM MgCl2 e 2 μM de tubulina biotinilada (5-10% de stoichiometria de rotulagem) no BRB80.
- Crescente difosfato dinâmico guanosina (PIB)-extensões tubulinas
NOTA: As sementes serão imobilizadas na superfície antibiotina do canal de fluxo. As "extensões" dinâmicas de GTP/PIB serão cultivadas a partir das extremidades das sementes imobilizadas.- Diluir as sementes 20x em BRB80. Flua as sementes diluídas na câmara de reação.
- Monitore a reação via IRM. Espere que as sementes gradualmente "aterrissem" na superfície e se liguem a ela. Quando a densidade desejada de sementes for alcançada, lave o excesso com BRB80.
- Prepare uma mistura de extensão de microtúbulo: 12 μM tubulin sem rótulo, 1 mM GTP, 5 mM dithiothreitol (DTT) no buffer BRB80.
- Flua em pelo menos um volume de canal da mistura de extensão. Certifique-se de que a temperatura de reação é de 28 °C.
- Aguarde que as extensões dos microtúbulos cresçam a partir das sementes ao longo do tempo.
NOTA: O comprimento de estado estável é geralmente alcançado em menos de 20 minutos. - Use os microtúbulos dinâmicos para imagens. Adicione e visualize maps fluorescentes nos microtúbulos, conforme descrito na etapa 3.5 para a cinesina-1.
NOTA: Como os microtúbulos são ligados à superfície, eles são facilmente visíveis pela TIRF.
- Ensaio de motilidade de cinesina
NOTA: Esta etapa descreve um protocolo para visualizar a proteína fluorescente verde motile (GFP) rotulada de cinesina-1 em microtúbulos de encolhimento. Uma construção de kinesina-1 de rato truncada fundida ao eGFP (rKin430-eGFP) foi expressa e purificada, como descrito anteriormente15,16.- Prepare o tampão de motilidade: 1 mM ATP e 0,2 mg/mL de casein no BRB80.
- Diluir a kinesina-eGFP no tampão de motilidade para 10 nM.
- Prepare uma solução de catalase de oxigênio 2x para neutralizar fotobleaching oxidativo (glicose de 80 mM, 80 mg/mL de glicose oxidase, 32 mg/mL catalase, 0,2 mg/mL de caseína, 20 mM DTT) suplementada com ATP de 2 mM.
- Combine 10 partes de carniceiro de oxigênio, 9 partes de BRB80 e 1 parte de 10 nM cinesina-eGFP para uma concentração final de quinase de 0,5 nM.
NOTA: O volume total deve ser pelo menos 1,5 vezes maior que o volume do canal. - Defina as configurações de imagem no software do microscópio.
NOTA: Neste protocolo, os vídeos são gravados a 10 fps com tempo de exposição de 100 ms. A intensidade do laser é de ~0,05 kW/cm2. - Comece a imagem e flua a solução de cinesina para a câmara.
- Após a medição ser concluída, grave um vídeo curto (~5 s) no qual o estágio é lentamente traduzido em um movimento circular ou lateral. Use a projeção mediana deste vídeo como uma imagem de fundo e subtraia-o das medições brutas.
4. Processamento e análise de imagens
NOTA: O processamento de imagens foi realizado utilizando-se o NIH ImageJ2 (imagej.nih.gov/ij/). Uma macro foi desenvolvida para automatizar a divisão e alinhamento dos canais TIRF e IRM. Esta macro requer que o plugin GaussFit_OnSpot seja instalado (disponível no repositório de plugins ImageJ).
- A partir da gravação de fundo, crie uma projeção mediana no ImageJ clicando em Imagem | Pilhas | Projeto Z.
- Subtraia a projeção de fundo mediana dos dados de imagem bruta clicando em Process | Calculadora de imagens.
NOTA: Certifique-se de verificar a opção "resultado de 32 bits (flutuar). - Para registro de imagens, escolha uma coleção de microesferas perto do microtúbulo de interesse e use-as para alinhar as imagens TIRF e IRM.
- Para cada conta desta coleção, use a ferramenta de seleção de vários pontos para marcar a localização aproximada no canal TIRF e, em seguida, a localização correspondente no canal IRM.
NOTA: Por exemplo, se houver duas contas (1 e 2), a seleção de vários pontos teria quatro pontos na seguinte ordem: (1) bead 1 em TIRF, (2) bead 1 em IRM, (3) contas 2 em TIRF, (4) contas 2 em IRM. - Execute a macro ImageJ fornecida (ImageSplitterRegistration.ijm).
NOTA: Isso automatiza as seguintes etapas: i) estimar a localização central de cada pérola por se encaixar em um gaussiano; ii) para cada pérola, computando o vetor de deslocamento que separa o centro no canal TIRF do centro no canal IRM; iii) uma média desse vetor de deslocamento em todas as contas; iv) dividir os canais TIRF e IRM em imagens separadas; v) traduzir a imagem TIRF pelo vetor de deslocamento médio computado em iii; vi) sobrepor as imagens TIRF e IRM em um arquivo multicanal .tiff.
Resultados
A configuração óptica é esquematizada na Figura 1. Tanto a iluminação IRM quanto a luz de excitação TIRF são direcionadas para a abertura traseira do objetivo (100x, NA: 1.49) através de um divisor de feixes de 10/90 (R/T) (BS1). O sinal emitido passa pelo mesmo divisor de feixe (BS1) e é refletido no divisor de imagens através de um espelho (M1). Os componentes do divisor de imagens (incluídos com linhas tracejadas na Figura 1) separam os sinais IRM e TIRF através de um divisor de feixes 90/10 (R/T) (BS2) juntamente com filtros espectrais apropriados. Finalmente, as imagens divididas são projetadas no chip da câmera para visualização. O alinhamento do divisor de imagens é tal que os sinais TIRF e IRM são projetados em metades separadas do chip.
Em um microscópio bem alinhado, a imagem da câmera deve exibir uma imagem meio dividida, como apresentado na Figura 2. Os microtúbulos ligados à superfície devem ser facilmente visíveis no canalIRM 13, e a cinesina fluorescente deve ser visível no canal TIRF.
As microesferas usadas para alinhar e registrar os dois canais aparecem como pontos brilhantes nas imagens da TIRF e manchas escuras nas imagens do IRM. Embora as contas sejam visíveis nos dados brutos, a subtração em segundo plano melhora significativamente o contraste (Figura 2). A imagem de fundo usada para a subtração é a mediana temporal de um vídeo gravado com um estágio móvel. Conforme descrito no protocolo, o alinhamento da imagem foi realizado selecionando uma coleção de contas próximas à região de interesse e executando a macro fornecida (imageSplitterRegistration.ijm). A macro se encaixa nos pontos aos gaussianos e alinha as imagens minimizando a distância média entre os pontos centrais dos ajustes em cada canal. Esse processo está representado na Figura 2, que mostra um bom alinhamento das microesferas fluorescentes (verde no canal TIRF, preto no canal IRM).
Finalmente, as capacidades desta configuração simultânea de imagem são demonstradas observando moléculas únicas de cinesina caminhando em direção às extremidades de encolhimento dos microtúbulos. A Figura 3 mostra um kymograph de moléculas de cinesina rotuladas por eGFP (verde) andando em um microtúbulo encolhendo (cinza). Também é apresentado uma série de instantâneos da gravação a partir da qual o kymograph foi gerado.
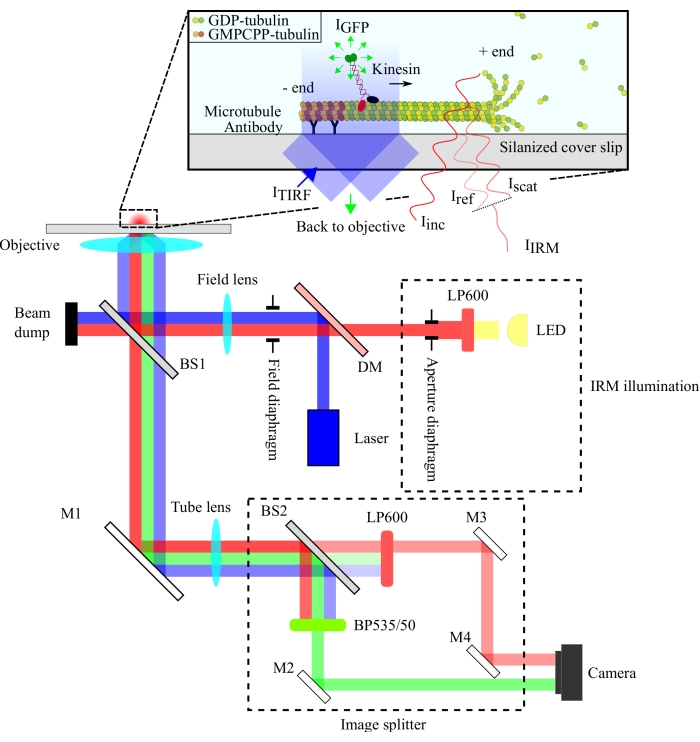
Figura 1: Representação esquemática da configuração óptica para imagem simultânea de IRM e TIRF de motilidade de cinesina. A epiilluminação de uma fonte de luz LED passa pelo diafragma de abertura e atinge o divisor de feixes de 10/90 (R/T) (BS1). O divisor de feixe reflete parcialmente a luz de iluminação irm vermelha e a luz de excitação TIRF de 488 nm até o objetivo de iluminar a amostra. O sinal da amostra é coletado pelo mesmo objetivo e direcionado para o conjunto de divisão de imagens onde as imagens IRM e TIRF são separadas espacialmente pelo divisor de feixes 90/10 (R/T) (BS2). Os sinais são então filtrados espectralmente antes de atingir o chip da câmera. Abreviaturas: IRM = microscopia de reflexão de interferência; TIRF = total-reflexão interna-fluorescência; LED = diodo emissor de luz; ITIRF = Iluminação TIRF; IGFP = Fluorescência GFP; Iinc = Iluminação IRM; Iref = luz dispersa na interface vidro/água; Iscat = luz dispersa do microtúbulo; IIRM = sinal IRM (Interferência de Iref escat); R/T = refletido/transmitido; LP600: filtro de passagem longa (600 nm); DM = espelho dicrómico; BS1 e BS2 = divisores de feixe 1 e 2; M1, M2, M3, M4 = espelhos; BP535/50 = passe de banda (535/50 nm); GFP = proteína fluorescente verde; GMPCPP = guanylyl 5'-α,β-metilenediphosphonate; PIB = difosfato de guanosina. Clique aqui para ver uma versão maior desta figura.
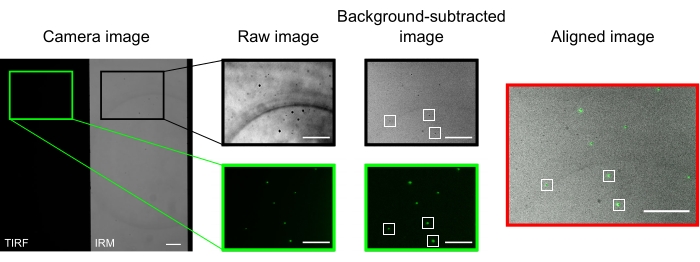
Figura 2: Subtração de fundo e alinhamento de imagem. As imagens TIRF (metade esquerda) e IRM (metade direita) aparecem simultaneamente em duas metades do mesmo chip de câmera (imagem da câmera). A subtração de fundo temporal aumenta o contraste das contas (imagem subtraída em segundo plano), que aparecem escuras em IRM e brilhantes em imagens DE TIRF. As imagens IRM e TIRF são alinhadas por tradução (à direita) com base na localização de contas selecionadas (retângulos brancos). Barras de escala = 10 μm. Clique aqui para ver uma versão maior desta figura.

Figura 3: Kymograph e instantâneos do movimento de Kinesins durante o encolhimento do microtúbulo. O kymograph (à esquerda) mostra eGFP-kinesin-1 (verde) caminhando em direção à extremidade mais alta do microtúbulo (cinza escuro). Instantâneos da série temporal correspondente são mostrados (à direita). Flechas brancas mostram moléculas de kinesina-1. Clique aqui para ver uma versão maior desta figura.
Arquivo de registro de imagens: Clique aqui para baixar este Arquivo.
Discussão
Estudar a regulação da dinâmica dos microtúbulos por proteínas associadas a microtúbulos (MAPs) muitas vezes requer imagens simultâneas de microtúbulos e MAPs. Técnicas de microscopia de fluorescência, como a TIRF, são tipicamente empregadas para este fim. No entanto, eles são limitados pelas desvantagens da imagem de fluorescência, que incluem fotobleaching, fotodamage e a necessidade de rotulagem fluorófora. Métodos livres de rótulos, como o IRM, são adequados para visualizar microtúbulos, mas não são capazes de fotografar fluoroforos únicos. Este protocolo combina imagens IRM sem rótulo e microscopia DE TIRF para a imagem simultânea de microtúbulos dinâmicos e MAPs.
A configuração IRM emprega uma fonte de iluminação LED filtrada para >600 nm, enquanto a configuração TIRF utiliza um laser de 488 nm. Utilizamos um divisor de feixe de placa barato para refletir a luz de iluminação sobre a amostra e transmitir o sinal coletado para o detector (Figura 1). Um divisor de feixe com 10% de reflectância e 90% de transmissão foi escolhido para minimizar a perda do sinal de molécula única. A perda de 90% na intensidade da luz de iluminação é compensada pelo aumento da potência do laser de iluminação e do LED.
A separação espectral dos sinais foi obtida utilizando um divisor de feixe de 90/10 (R/T) e dois filtros espectrais (passagem longa de 600 nm para IRM e band-pass 535/50 nm para TIRF). Os sinais IRM e TIRF separados espectralmente são projetados em duas metades de um único chip de câmera usando um conjunto de divisor de imagens. O uso de um divisor de feixes 90/10 sacrifica 90% do sinal IRM, mas isso é compensado pelo aumento da intensidade da fonte de iluminação LED. Um espelho dicroico também poderia ser usado aqui para separar os sinais IRM e TIRF de forma mais eficiente. As microesferas fluorescentes incluídas nos ensaios permitem o alinhamento preciso das imagens TIRF e IRM e servem de referência para o foco do objetivo.
O elemento óptico mais crítico neste protocolo é o objetivo de alta abertura numérica (NA). Isso é essencial não só para alcançar a reflexão interna total, mas também para maximizar a eficiência da coleção e o contraste de imagem. A qualidade das imagens obtidas também depende da limpeza da superfície do vidro e da aquisição de uma imagem de fundo clara para corrigir a iluminação não uniforme e remover características estáticas. Para imagens IRM, recomendamos o uso de iluminação de comprimento de onda longa (>600 nm) para minimizar a fotodamagem de microtúbulos e proteínas. Isso é particularmente importante se uma fonte de luz LED branca for usada, nesse caso um filtro de passagem longa deve ser incluído para remover qualquer luz UV.
Este protocolo permite imagens sem rótulos e de alta velocidade de microtúbulos dinâmicos e visualização simultânea de alta resolução de MAPs fluorescentes17. Em comparação com a técnica de comutação do cubo do filtro, que alterna entre capturar imagens de microtúbulos e MAPs, essa configuração é capaz de taxas de quadros muito mais altas porque não depende da rotação física de um cubo de filtro. Em comparação com as técnicas de imagem TIRF de duas cores, esta técnica emprega uma configuração óptica menos exigente e contorna a necessidade de rotulagem fluorófora de microtúbulos. As limitações primárias desta configuração devem-se à imagem TIRF dos MAPs; a taxa de quadros é limitada pelo tempo de exposição de um fluoróforo, e o fotobleaching de fluoroforos permanece uma possibilidade. No entanto, este protocolo melhora as técnicas existentes porque utiliza TIRF apenas quando necessário (ou seja, para visualizar MAPs, mas não microtúbulos) e atinge a maior velocidade possível dentro dos limites da TIRF. Melhorias adicionais só são possíveis se os microtúbulos e os MAPs forem visualizados através de uma técnica interferométrica, mas isso requer rotular MAPs com nanopartículas metálicas, que tem suas limitações e desafios experimentais.
Para demonstrar as capacidades dessa técnica, visualizamos simultaneamente dois processos dinâmicos rápidos via IRM e TIRF: o encolhimento de um microtúbulo e a caminhada de uma molécula de cinesina fluorescente. Esta técnica foi previamente empregada para visualizar a rápida difusão da spastina no encolhimento dos microtúbulos5. Além desta aplicação a MAPs e microtúbulos, este protocolo pode ser usado para visualizar moléculas fluorescentes únicas simultaneamente com qualquer estrutura macromolecular massiva o suficiente para ser visualizada via IRM, como uma membrana celular ou filamento de actin.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Agradecemos ao laboratório de Thierry Emonet por compartilhar equipamentos de limpeza. Agradecemos a Yin-Wei Kuo por preparar a eGFP-kinesin purificada utilizada neste estudo. Y.T. reconhece o apoio da Fundação Alexander von Humboldt através da Feodor Lynen Research Fellowship. Este trabalho foi apoiado pelo NIH Grant R01 GM139337 (para J.H.).
Materiais
| Name | Company | Catalog Number | Comments |
| 10/90 (R/T) beam splitter | Thorlabs | BSN10R | Plane beam splitter used in the excitation beam path |
| 90/10 (R/T) beam splitter | Thorlabs | BSX10R | Plane beam splitter used in the image splitter |
| Anti-biotin antibody | Sigma-Aldrich | B3640 | Used to functionalize surface for bonding biotinylated microtubules |
| ATP | Sigma-Aldrich | FLAAS | Used for preparing the motility buffer |
| Band-pass filter | Newport | HPM535-50 | Hard-coated band-pas filter is used in image splitter to image GFP signal |
| Biotinylated tubulin | Cytoskeleton, Inc. | T333P-A | Used to bind microtubule seeds to the surface of the flow channel |
| Casein | Sigma-Aldrich | C8654 | Casein is used to block nonspesific interactions |
| Catalase | Sigma-Aldrich | C9322 | Used for preparing the oxygen scavenger solution |
| Desiccator chamber | Southern Labware | 55207 | Desiccator is used for degasing the resin |
| DTT | Sigma-Aldrich | D0632 | Used for preparing the oxygen scavenger solution |
| EGTA | Sigma-Aldrich | E4378 | Used for preparing the BRB80 buffer |
| Glucose | Sigma-Aldrich | G7528 | Used for preparing the oxygen scavenger solution |
| Glucose oxidase | Sigma-Aldrich | G7016 | Used for preparing the oxygen scavenger solution |
| GMPCPP nucleotides | Jena Bioscience | NU-405L | Used for the polymerization of stabilized microtubules |
| Image splitter | Teledyne-Photometrics Imaging | OptoSplit II | An image splitter is used to split the images spatially. When buying, make sure about the compatibility with the microscope |
| ImajeJ2 | NIH | ImageJ2 is used for image analysis | |
| Kinesin | prepared in house (see references in text) | ||
| LDPE tubing | Thomas Scientific | 9565S22 | Non-toxic, lower density polyethylene micro bore tubing is used for fluid transfers |
| LED light source | Lumencor | Lumencor sola light engine | Used for IRM imaging |
| Long-pass filters | Thorlabs | FELH0600 | Hard-coated long pass filters. One is used as an excitation filter, other is used in image splitter to image IRM signal |
| Magnesium chloride | Sigma-Aldrich | 63068 | Used for preparing the BRB80 buffer |
| Micoscope objective heater | okolab | H401-T-DUAL-BL | Used to keep sample temperature constant via heating the objective |
| Microscope | Nikon | Ti-Eclipse | An inverted microscope that is used in the experiments |
| Na-PIPES | Sigma-Aldrich | P2949 | Used for preparing the BRB80 buffer |
| Nikon CFI Apochromat TIRF 100XC Oil objective | Nikon | MRD01991 | The imaging objective has 1.49 numerical aperture |
| PDMS and curing agent | Electron Microscopy Sciences | Sylgard 184 (24236-10) | Used for contructing the flow channels |
| PDMS puncher | World Precision Instruments LLC | 504529 | Used to punch hole into the PDMS |
| Plasma cleaner | Harrick Plasma | DPC-32G | The air plasma is used to remove organic contamination from the PDMS surface |
| Poloxamer 407 (commercial name Pluronic F-127) | Sigma-aldrich | P2443 | Used for channel surface passivation to minimize nonspecific binding |
| Sodium hydroxide | Sigma-Aldrich | 567530 | Used for preparing the BRB80 buffer |
| Stabilized microtubules | prepared in house (see references in text) | ||
| Table-top ultracentrifuge | Beckman Coulter | 340400 | Used to spin down microtubule seeds |
| TetraSpeck beads | ThermoFisher Scientific | T7279 | Used as a reference for aligning images |
| Zyla 4.2 camera | Andor | Zyla 4.2 | Scientific CMOS camera with spesifications: 2048 x 2048 pixels (6.5 μm pixel size) with quantum efficiency of 72% and 16 bit dynamic range |
Referências
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biology. 95, 221-245 (2010).
- Axelrod, D. Chapter 7: Total internal reflection fluorescence microscopy. Methods in Cell Biology. 89, 169-221 (2008).
- Kuo, Y. -. W., Trottier, O., Mahamdeh, M., Howard, J. Spastin is a dual-function enzyme that severs microtubules and promotes their regrowth to increase the number and mass of microtubules. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5533-5541 (2019).
- Hinrichs, M. H., et al. Tau protein diffuses along the microtubule lattice. The Journal of Biological Chemistry. 287 (46), 38559-38568 (2012).
- Al-Hiyasat, A., Tuna, Y., Kuo, Y. -. W., Howard, J. Herding of proteins by the ends of shrinking polymers. arXiv:. , (2021).
- Guo, H., et al. Mechanism and dynamics of breakage of fluorescent microtubules. Biophysical Journal. 90 (6), 2093-2098 (2006).
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Taylor, R. W., Sandoghdar, V., Astratov, V. . Interferometric scattering (iSCAT) microscopy and related techniques. in Label-free super-resolution microscopy. , 25-65 (2019).
- Young, G., Kukura, P. Interferometric scattering microscopy). Annual Review of Physical Chemistry. 70 (1), 301-322 (2019).
- Koch, M. D., Rohrbach, A. Label-free imaging and bending analysis of microtubules by ROCS microscopy and optical trapping. Biophysical Journal. 114 (1), 168-177 (2018).
- Kandel, M. E., Teng, K. W., Selvin, P. R., Popescu, G. Label-free imaging of single microtubule dynamics using spatial light interference microscopy. ACS Nano. 11 (1), 647-655 (2017).
- Mahamdeh, M., Simmert, S., Luchniak, A., Schäffer, E., Howard, J. Label-free high-speed wide-field imaging of single microtubules using interference reflection microscopy. Journal of Microscopy. 272 (1), 60-66 (2018).
- Mahamdeh, M., Howard, J. Implementation of interference reflection microscopy for label-free, high-speed imaging of microtubules. Journal of Visualized Experiments: JoVE. (150), e59520 (2019).
- Voldman, J., Gray, M. L., Schmidt, M. A. Microfabrication in biology and medicine. Annual Review of Biomedical Engineering. 1, 401-425 (1999).
- Rogers, K. R., et al. KIF1D is a fast non-processive kinesin that demonstrates novel K-loop-dependent mechanochemistry. The EMBO Journal. 20 (18), 5101-5113 (2001).
- Leduc, C., Ruhnow, F., Howard, J., Diez, S. Detection of fractional steps in cargo movement by the collective operation of kinesin-1 motors. Proceedings of the National Academy of Sciences of the United States of America. 104 (26), 10847-10852 (2007).
- Tuna, Y., Al-Hiyasat, A., Howard, J. Imaging dynamic microtubules and associated proteins by Simultaneous Interference-Reflection and Total-Internal-Reflection-Fluorescence Microscopy. arXiv. , (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados