Method Article
השתקפות הפרעה סימולטנית ומיקרוסקופיה פלואורסצנטית של השתקפות פנימית כוללת להדמיה מיקרוטובולים דינמיים וחלבונים נלווים
In This Article
Summary
אנו מציגים פרוטוקול ליישום מיקרוסקופיה של השתקפות הפרעות ומיקרוסקופיה כוללת-פנימית-השתקפות-פלואורסצנטית להדמיה בו-זמנית של מיקרו-טובולים דינמיים וחלבונים הקשורים למיקרו-טובולים המסומנים באופן פלואורסצנטי.
Abstract
מספר טכניקות שימשו להדמיה ישירה של חוטי שלד ציטוסקטליים והחלבונים הקשורים אליהם. למיקרוסקופיה פלואורסצנטית כוללת-פנימית-השתקפות-פלואורסצנטית (TIRF) יש יחס אות-לרקע גבוה, אך היא סובלת מ-photo-הלבנה ופוטו-דאמג'ים של החלבונים הפלואורסצנטיים. טכניקות נטולות תוויות כגון מיקרוסקופיית השתקפות הפרעות (IRM) ומיקרוסקופיית פיזור אינטרפרומטרית (iSCAT) עוקפות את בעיית הפוטו-הלבנה, אך אינן יכולות לדמיין בקלות מולקולות בודדות. מאמר זה מציג פרוטוקול לשילוב IRM עם מיקרוסקופ TIRF מסחרי להדמיה סימולטנית של חלבונים הקשורים למיקרוטובולים (MAPs) ומיקרוטובולים דינמיים במבחנה. פרוטוקול זה מאפשר תצפית במהירות גבוהה על MAPs המקיימים אינטראקציה עם מיקרוטובולים דינמיים. זה משפר את הגדרות ה-TIRF הקיימות בשני צבעים על ידי ביטול הצורך בתיוג מיקרו-טובולים והצורך במספר רכיבים אופטיים נוספים, כגון לייזר עירור שני. שני הערוצים מצולמים על אותו שבב מצלמה כדי למנוע רישום תמונה ובעיות סנכרון מסגרת. הגדרה זו מודגמת על ידי הדמיה של מולקולות קינזין בודדות ההולכות על מיקרוטובולים דינמיים.
Introduction
מיקרוסקופיה כוללת-פנימית-השתקפות-פלואורסצנטית (TIRF) משמשת בדרך כלל להדמיה של מולקולות פלואורסצנטיות בודדות. בהשוואה להדמיית אפיפלואורסצנציה, TIRF משיג דיכוי רקע מעולה, המאפשר לוקליזציה ברזולוציה גבוהה ומעקב אחר פלואורופורים בודדים. מסיבה זו, TIRF היא השיטה המועדפת להדמיה של חלבונים הקשורים למיקרו-טובולים המסומנים באופן פלואורסצנטי, והיא משמשת לעתים קרובות לצילום מיקרוטובולים 1,2.
כדי לחקור את הרגולציה של דינמיקת מיקרוטובולים על ידי MAPs, לעתים קרובות יש צורך לדמות הן microtubules והן MAPs בו זמנית. רוב השיטות הקיימות למטרה זו הן יקרות או סובלות מחסרונות טכניים. TIRF דו-צבעי סימולטני, למשל, דורש שני לייזרי עירור ושתי מצלמות. בנוסף לעלות הגבוהה, הצורך במצלמות נפרדות מציב בעיות של סנכרון פריימים ורישום תמונות. ניתן לעקוף צורך זה אם קוביית מסנן מסתובבת משמשת למעבר פיזי בין לייזרי עירור במסגרותעוקבות 3. בהתקנה כזו, ניתן להשתמש בשבב מצלמה יחיד, והמסגרות מתחלפות בין תמונות של מיקרוטובולים ו- MAPs. עם זאת, טכניקה זו מוגבלת על ידי מהירות שינוי המסנן, שבדרך כלל מגבילה את קצב הפריימים לפחות מ-0.5 פריימים לשנייה3 (fps). קצב פריימים כזה אינו מספיק כדי לפתור תהליכים דינמיים מהירים, כגון התכווצות של מיקרוטובול המתרחש במהירות של עד 500 ננומטר לשנייה, הליכה של קינזין במהירות בסדר גודל של 800 ננומטר לשנייה, או דיפוזיה של MAP המתרחשת עם מקדמי דיפוזיה העולים על 0.3 μm2/s4. זה בעייתי במיוחד כאשר עוקבים אחר המיקומים היחסיים של שתי מטרות נעות בכל ערוץ, כגון מיקום של MAP ביחס למיקום של קצה מיקרוטובול נע5.
בנוסף לאילוצים אופטיים אלה, מיקרוסקופיית TIRF בשני צבעים דורשת ש-MAPs ומיקרוטובולים יתויגו בפלואורופורים שונים שספקטרום הפליטה שלהם מופרד במידה מספקת. תיוג פלואורסצנטי של טובולין יכול לשנות אתהדינמיקה של המיקרוטובולים 6, והלבנת הפוטו של פלואורופורים מגבילה את מהירות ההדמיה7. בגלל בעיות אלה, פותחו טכניקות הדמיה ללא תוויות כדי להמחיש מיקרו-טובולים. אלה כוללים מיקרוסקופיית פיזור אינטרפרומטרית (iSCAT)8,9, מיקרוסקופיה מסתובבת-קוהרנטית-מתפזרת (ROCS)10, מיקרוסקופיית הפרעות אור מרחבית (SLIM)11, ומיקרוסקופיית השתקפות הפרעות (IRM)12,13. טכניקות אלה מאפשרות הדמיה מהירה ללא תוויות של מיקרוטובולים ללא החסרונות של הדמיה פלואורסצנטית, אך לא ניתן להשתמש בהן כדי להמחיש MAPs בודדים.
מבין הטכניקות נטולות התוויות הללו, IRM בולטת בעלותה הנמוכה ובדרישותיה הצנועות למכשור. לאחרונה הצגנו פרוטוקול לשילוב IRM עם מיקרוסקופ TIRF מסחרי, המאפשר צילום של מיקרוטובולים ו-MAPs פלואורסצנטיים במסגרותמתחלפות 3,13. מאמר זה מציג פרוטוקול לשינוי הגדרה זו כדי לצלם בו-זמנית תמונות TIRF ו-IRM בשבב מצלמה יחיד. זה כולל תוספת של מפצל קרן זול בנתיב העירור כדי להאיר את הדגימה בו זמנית עם לייזר TIRF ומקור אור LED IRM. מפצל תמונה מסחרי שונה משמש להפרדת אותות TIRF ו- IRM באופן ספקטרלי ולהקרנתם על חצאים נפרדים של אותו שבב מצלמה. אנו משתמשים גם במערכת מיקרופלואידית המאפשרת החלפה מהירה של ריאגנטים במהלך ההדמיה. פרוטוקול זה מתאר כיצד ניתן להשתמש בהגדרה זו כדי לצלם מיקרו-טובולים דינמיים ו- MAPs. היכולת של המנגנון מודגמת על ידי הצגת ההדמיה הראשונה של חלבוני קינסין-1 ההולכים על מיקרוטובולים מתכווצים, אשר נלכדים בקצב פריימים של 10 s-1.
Protocol
1. הכנת תאי זרימה
הערה: תאי זרימה מיקרופלואידיים ייבנו על ידי הדבקת מיקרו-ערוצים פולידימתילסילוקסן (PDMS) לזכוכית כיסוי מנוקה ומתפקדת. המיקרו-ערוצים יוטלו בתבנית ראשית.
-
הכנת ערוצי PDMS
- הכינו משקפי כיסוי מנוקים ו/או פונקציונליים עם כימיה של פני השטח המתאימה לבדיקה הספציפית המצולמת.
הערה: עבור מבחני תנועתיות קינזין, נעשה שימוש בכוסות כיסוי סילאניות מנוקות על ידי פיראנה. אלה מוכנים כמתואר ב- Gell et. al.1 לחלופין, הליך פשוט יותר הוא לפשוט את משקפי הכיסוי באיזופרופנול ואחריו מתנול במשך 3x 20 דקות מחזורים. - כדי להכין תבנית ראשית, חתכו רצועות של סרט נייח חד-צדדי לגודל ערוץ הזרימה הרצוי. הדביקו את הרצועות לתחתית של צלחת פטרי באורך 10 ס"מ, וסדרו אותן מצד לצד עם מרווח של לפחות 1 ס"מ בין הרצועות.
הערה: אם נדרשות מידות ערוץ מדויקות, ניתן לייצר את התבנית על פרוסות סיליקון באמצעות פוטוליתוגרפיה14. - כדי להכין את פולימר PDMS, שלבו את חומר הריפוי ואת אלסטומר הבסיס ביחס מסה של 1:10. מערבבים במשך 2 דקות.
הערה: ניתן לשנות את יחס הערבוב הזה כדי לכוונן את הנוקשות של הפולימר. יחס גבוה יותר בין בסיס לחומר מרפא גורם לפולימר רך יותר. - דגה את התערובת בתא ואקום עד שכל הבועות נעלמות.
- יוצקים את התערובת על תבנית המאסטר בשכבה בעובי של כ-0.5 ס"מ, תוך הקפדה על הימנעות מיצירת בועות.
- אופים את התערובת בתנור שחומם מראש בטמפרטורה של 70 מעלות צלזיוס למשך 40 דקות.
הערה: ייתכן שיידרש זמן ריפוי ארוך יותר אם בלוק ה-PDMS עבה (>1 ס"מ). ממשיכים להתחמם במרווחים של 5 דקות עד שהוא נרפא במלואו. - חותכים את האזורים המובנים של הפולימר. נקב חורים בכל קצה של הערוץ באמצעות מנקב PDMS.
הערה: בפרוטוקול זה, קוטר החור מוגדר ל-0.75 מ"מ וניתן לכוונן אותו בהתאם לקצבי הזרימה הנדרשים. ניתן לאחסן תעלות PDMS בסביבות יבשות לתקופות ממושכות, אך יש לנקות אותן לפני השימוש. - נקה את הצד המובנה של בלוק PDMS. השתמש בסרט נייח כדי להסיר חלקיקים גדולים. יש לשטוף עם איזופרופנול ולאחר מכן מתנול. חזרו על שטיפות אלה פי 3, שטפו במים אולטרה-פוריים וייבשו את פני השטח.
- פלזמה מנקה את ה-PDMS באמצעות חמצן או פלזמת אוויר.
הערה: בפרוטוקול זה, נעשה שימוש בפלזמת אוויר של 18 W. - הניחו את ה-PDMS המנוקה בפלזמה על זכוכית כיסוי שנוקתה כראוי וחממו על צלחת חמה בטמפרטורה של 80 מעלות צלזיוס למשך 15 דקות.
הערה: ניתן להחיל שרף אפוקסי על דפנות בלוק PDMS כדי להדביק אותו טוב יותר לזכוכית הכיסוי. - הכנס צינורות פוליאתילן בצפיפות נמוכה (LDPE) בגודל מתאים לתוך החורים. חברו את צינורות היציאה למזרק של 0.5 מ"ל.
הערה: בפרוטוקול זה, צינורות בקוטר פנימי של 0.023 אינץ ' מחוברים ל- PDMS באמצעות מתאם מתכת בקוטר חיצוני של 0.025. - פתרונות זרימה לתוך המיקרו-ערוצים על ידי טבילת צינור הכניסה בתמיסה וציור הנפח הנדרש עם המזרק.
- הכינו משקפי כיסוי מנוקים ו/או פונקציונליים עם כימיה של פני השטח המתאימה לבדיקה הספציפית המצולמת.
2. הגדרה אופטית
-
שינוי המיקרוסקופ (איור 1)
- שנה מיקרוסקופ TIRF כדי לאפשר הדמיית IRM13. החלף את מפצל הקרן 50/50 (רפלקציה (R)/תמסורת (T)) המשמש בגלגל הסינון של המיקרוסקופ במפצל קרן 10/90 (R/T).
- הכנס מפצל תמונה בין המצלמה למיקרוסקופ.
- בקוביית הסינון של מפצל התמונה, הכנס מפצל קרן 10/90 (R/T). הניחו מסנן מעבר ארוך של 600 ננומטר מול הקרן המוחזרת ומסנן פליטה פלואורסצנטי מתאים מול הקרן המועברת.
הערה: ניתן להשתמש במפצלי אלומות עם יחסי R/T שונים כדי לכוונן את השברים של נורית הפליטה IRM ו-TIRF הנאספים. - יישר את מפצל התמונה בהתאם למפרט היצרן כדי להפריד מרחבית את אותות TIRF ו- IRM בשבב המצלמה.
הערה: נדרשת הפרדה מרחבית של האותות מכיוון שאות TIRF של פלואורופורים טיפוסיים חלש בהרבה מאות ה-IRM של מיקרוטובול ולא ניתן היה לזהות אותות אם שני האותות היו מכוסים בשכבת-על.
3. הדמיה של מיקרוטובולים דינמיים ומולקולות קינסין בודדות
- פונקציונליזציה של פני השטח ופסיביזציה
- חיץ BRB80 זרימה (80 mM Na-PIPES, 1 mM EGTA, 1 mM MgCl2, מותאם ל-pH 7.8 עם NaOH) לתוך תא התגובה.
- תמיסת אנטיביוטין זרימה מדוללת ל-0.025 מ"ג/מ"ל ב-BRB80 ואינקובציה בטמפרטורת החדר למשך 10 דקות.
- לשטוף את הערוץ עם BRB80.
- זרימה בתמיסת F-127 (1% F-127 פלורוני (w/v) מומסת ב- BRB80 במהלך הלילה) ואינקובציה למשך 20 דקות לפחות לצורך פסיבציה על פני השטח.
הערה: אם נעשה שימוש בכוסות כיסוי קלות לניקוי במקום בכוסות כיסוי מבודדות, יש להשתמש ב-2 מ"ג/מ"ל קזאין ב-BRB80 למשך >20 דקות בטמפרטורת החדר. - לשטוף את הערוץ עם BRB80.
- הכנה להדמיה
- אם נדרשת בקרת טמפרטורה, השתמש בתנור חימום אובייקטיבי והגדר אותו לטמפרטורה הנכונה.
הערה: בפרוטוקול זה, כל הניסויים מבוצעים בטמפרטורה של 28 מעלות צלזיוס. - הניחו את הדגימה על במת המיקרוסקופ והפעילו את מקור האור אפילומינציה (>600 ננומטר) לצורך הדמיית IRM.
הערה: בפרוטוקול זה, נעשה שימוש במקור אור LED לבן עם מסנן מעבר ארוך של 600 ננומטר. - מקד את המיקרוסקופ על משטח הדגימה. חפש את מישור המוקד הנכון ליד ממשק פתרון PDMS.
הערה: ב- IRM, הפנים מימיות של הערוץ אמורות להיראות בהירות בהרבה מפולימר PDMS. - בחר שדה ראייה ליד מרכז הערוץ.
- הכינו תמיסה של מיקרובים פלואורסצנטיים של 0.1 מיקרומטר ב-BRB80 (צפיפות: 109 חרוזים/מ"ל, המתאימה לדילול של פי 200 עבור החרוזים המשמשים בפרוטוקול זה).
- זרימה בנפח ערוץ אחד לפחות של תמיסת המיקרוב.
- עקוב אחר התגובה באמצעות IRM. המתן עד שהמיקרובים "ינחתו" בהדרגה על פני השטח. כאשר הצפיפות הרצויה של microbeads מושגת, לשטוף את עודף עם BRB80.
- אם נדרשת בקרת טמפרטורה, השתמש בתנור חימום אובייקטיבי והגדר אותו לטמפרטורה הנכונה.
- גידול גואניליל 5'-α,β-מתילנדיפוספונט (GMPCPP) - זרעי מיקרוטובול מיוצבים
- בצינור צנטריפוגה של 0.6 מ"ל, הכינו 50 μL של תמיסה המכילה 1 mM GMPCPP, 1 mM MgCl2 ו-2 μM שטופולין ביוטינילי (5-10% תיוג סטואיכיומטריה) ב-BRB80.
הערה: ניתן להשיג את הסטויכיומטריה הנכונה של תיוג על ידי שילוב טובולין ביוטינילציה בצפיפות גבוהה עם טובולין בקר ללא תווית ביחס הנכון. - דגירה של התמיסה על קרח במשך 5 דקות, ולאחר מכן דגירה בטמפרטורה של 37 מעלות צלזיוס למשך 12.5 דקות.
הערה: ניתן לשלוט באורך הזרעים על ידי כוונון זמן הפילמור. - עצור את הפילמור על ידי הוספת 100 μL של טמפרטורת החדר BRB80.
- סובבו את התמיסה ב-ultracentrifuge בטמפרטורת החדר (126,000 x גרם, 5 דקות). השליכו את הסופרנאטנט על ידי שימוש בפיפטה להסרת טובולין לא מפולמר.
הערה: בפרוטוקול זה, נעשה שימוש ב- ultracentrifuge מונע אוויר. - הוסף 200 μL של טמפרטורת החדר BRB80 לכדור. החיזרו את הכדור על ידי צנרת בעדינות אך ביסודיות. השתמש בפיפטה של 200 μL עם קצה חתוך כדי להפחית את הגזירה של המיקרוטובולים.
- בצינור צנטריפוגה של 0.6 מ"ל, הכינו 50 μL של תמיסה המכילה 1 mM GMPCPP, 1 mM MgCl2 ו-2 μM שטופולין ביוטינילי (5-10% תיוג סטואיכיומטריה) ב-BRB80.
- גידול גואנוזין דיפוספט דינמי (תמ"ג)-טובולין "הרחבות"
הערה: הזרעים ישתקו על פני השטח האנטי-ביוטיניים של תעלת הזרימה. "הרחבות" דינמיות של GTP/GDP יגדלו מקצות הזרעים המשותקים.- דיללו את הזרעים פי 20 ב-BRB80. הזרימו את הזרעים המדוללים לתוך תא התגובה.
- עקוב אחר התגובה באמצעות IRM. המתן עד שהזרעים "ינחתו" בהדרגה על פני השטח וייקשרו אליו. כאשר הצפיפות הרצויה של זרעים מושגת, לשטוף את עודף עם BRB80.
- הכינו תערובת הרחבה של מיקרוטובול: 12 μM טובולין ללא תווית, 1 mM GTP, 5 mM dithiothreitol (DTT) במאגר BRB80.
- זרימה בנפח ערוץ אחד לפחות של תערובת ההרחבה. ודא שטמפרטורת התגובה היא 28 °C (76 °F).
- המתן עד שהרחבות המיקרו-טובול יגדלו מהזרעים לאורך זמן.
הערה: אורך המצב היציב מושג בדרך כלל תוך פחות מ-20 דקות. - השתמש במיקרוטובולים הדינמיים להדמיה. הוסף ודמיין MAPs פלואורסצנטיים על המיקרוטובולים, כמתואר בשלב 3.5 עבור kinesin-1.
הערה: מכיוון שהמיקרו-טובולים קשורים לפני השטח, הם נראים בקלות על-ידי TIRF.
- בדיקת תנועתיות קינסין
הערה: שלב זה מתאר פרוטוקול להדמיה של חלבון פלואורסצנטי ירוק תנועתי (GFP) המסומן כ-kinesin-1 על מיקרוטובולים מתכווצים. מבנה kinesin-1 של חולדה חתוכה שהתמזג עם eGFP (rKin430-eGFP) הובטא וטוהר, כפי שתואר קודם לכן15,16.- הכינו מאגר תנועתיות: 1 mM ATP ו-0.2 מ"ג/מ"ל קזאין ב-BRB80.
- דילול kinesin-eGFP במאגר תנועתיות ל-10 ננומטר.
- הכינו תמיסת נבלות חמצן 2x כדי לנטרל את ההלבנה החמצונית (80 מ"מ גלוקוז, 80 מ"ג/מ"ל אוקסידאז גלוקוז, 32 מ"ג/מ"ל קטלאז, 0.2 מ"ג/מ"ל קזאין, 20 מ"מ DTT) בתוספת 2 mM ATP.
- שלבו 10 חלקים של נבלות חמצן, 9 חלקים של BRB80 וחלק אחד של 10 ננומטר קינסין-eGFP לריכוז קינזין סופי של 0.5 ננומטר.
הערה: עוצמת הקול הכוללת צריכה להיות גדולה פי 1.5 לפחות מנפח הערוץ. - הגדר את הגדרות ההדמיה בתוכנת המיקרוסקופ.
הערה: בפרוטוקול זה, סרטונים מוקלטים בקצב של 10 fps עם זמן חשיפה של 100 אלפיות השנייה. עוצמת הלייזר היא ~ 0.05 קילוואט / ס"מ2. - התחילו לדמיין ולהזרים את תמיסת הקינזין לתוך החדר.
- לאחר השלמת המדידה, הקליטו סרטון קצר (~5 שניות) שבו השלב מתורגם באיטיות בתנועה מעגלית או רוחבית. השתמש בהקרנה החציונית של סרטון זה כתמונת רקע והפחת אותה מהמדידות הגולמיות.
4. עיבוד וניתוח תמונה
הערה: עיבוד תמונה בוצע באמצעות NIH ImageJ2 (imagej.nih.gov/ij/). מאקרו פותח כדי להפוך את הפיצול והיישור של ערוצי TIRF ו- IRM לאוטומטיים. מאקרו זה דורש להתקין את תוסף GaussFit_OnSpot (זמין במאגר התוספים של ImageJ).
- מהקלטת הרקע, צור הקרנה חציונית ב- ImageJ על-ידי לחיצה על תמונה | ערימות | פרויקט Z.
- הפחת את הקרנת הרקע החציונית מנתוני התמונה הגולמיים על-ידי לחיצה על תהליך | מחשבון תמונה.
הערה: הקפד לבדוק את האפשרות "תוצאת 32 סיביות (צף)". - לרישום תמונה, בחר אוסף של מיקרובים ליד המיקרוטובול המעניין והשתמש בהם כדי ליישר את תמונות TIRF ו- IRM.
- עבור כל חרוז באוסף זה, השתמש בכלי הבחירה מרובה הנקודות כדי לסמן את המיקום המשוער בערוץ TIRF ולאחר מכן את המיקום המתאים בערוץ IRM.
הערה: לדוגמה, אם ישנם שני חרוזים (1 ו-2), בחירת ריבוי הנקודות תכלול ארבע נקודות בסדר הבא: (1) חרוז 1 ב- TIRF, (2) חרוז 1 ב- IRM, (3) חרוז 2 ב- TIRF, (4) חרוז 2 ב- IRM. - הפעל את המאקרו ImageJ שסופק (ImageSplitterRegistration.ijm).
הערה: פעולה זו הופכת את השלבים הבאים לאוטומטיים: i) הערכת המיקום המרכזי של כל חרוז על ידי התאמה לגאוסיאן; ii) עבור כל חרוז, חישוב וקטור התזוזה המפריד בין המרכז בתעלת TIRF לבין המרכז בערוץ IRM; 3) ממוצע של וקטור תזוזה זה על פני כל החרוזים; 4) פיצול ערוצי TIRF ו- IRM לתמונות נפרדות; v) תרגום תמונת TIRF על ידי וקטור התזוזה הממוצע המחושב ב-iii; vi) כיסוי של תמונות TIRF ו- IRM בקובץ .tiff רב-ערוצי.
תוצאות
ההגדרה האופטית עוברת מיפוי באיור 1. הן תאורת IRM והן תאורת עירור TIRF מופנים לפתח האחורי של המטרה (100x, NA: 1.49) באמצעות מפצל קרן 10/90 (R/T) (BS1). האות הנפלט עובר דרך אותו מפצל קרן (BS1) ומשתקף למפצל התמונה באמצעות מראה (M1). הרכיבים של מפצל התמונה (המוקפים בקווים מקווקווים באיור 1) מפרידים בין אותות ה-IRM וה-TIRF באמצעות מפצל קרן 90/10 (R/T) (BS2) יחד עם מסננים ספקטרליים מתאימים. לבסוף, התמונות המפוצלות מוקרנות על שבב המצלמה לצורך הדמיה. היישור של מפצל התמונה הוא כזה שאותות TIRF ו- IRM מוקרנים על חצאים נפרדים של השבב.
במיקרוסקופ מיושר היטב, תמונת המצלמה אמורה להציג תמונה מפוצלת באמצע הדרך, כפי שהיא מוצגת באיור 2. מיקרוטובולים הקשורים לפני השטח צריכים להיראות בקלות בערוץ IRM13, וקינזין פלואורסצנטי צריך להיות גלוי בערוץ TIRF.
המיקרובים המשמשים ליישור ורישום שני הערוצים מופיעים כנקודות בהירות בתמונות TIRF וככתמים כהים בתמונות ה-IRM. למרות שהחרוזים נראים בנתונים הגולמיים, חיסור הרקע משפר את הניגודיות באופן משמעותי (איור 2). תמונת הרקע המשמשת לחיסור היא החציון הזמני של סרטון שהוקלט עם שלב נע. כפי שתואר בפרוטוקול, יישור התמונה בוצע על ידי בחירת אוסף של חרוזים ליד אזור העניין וביצוע המאקרו שסופק (imageSplitterRegistration.ijm). המאקרו מתאים את הנקודות לגאוסים ומיישר את התמונות על ידי מזעור המרחק הממוצע בין נקודות המרכז של ההתאמות בכל ערוץ. התהליך הזה מיוצג באיור 2, שמראה יישור טוב של המיקרובים הפלואורסצנטיים (ירוק בערוץ TIRF, שחור בערוץ ה-IRM).
לבסוף, היכולות של מערך ההדמיה הסימולטני הזה מודגמות על ידי התבוננות במולקולות קינזין בודדות הצועדות לעבר הקצוות המתכווצים של המיקרוטובולים. איור 3 מראה קיומוגרפיה של מולקולות קינסין (ירוקות) המסומנות על ידי eGFP והולכות על מיקרוטובול מתכווץ (אפור). כמו כן מוצגת סדרה של תמונות מההקלטה שממנה נוצר הקימוגרף.
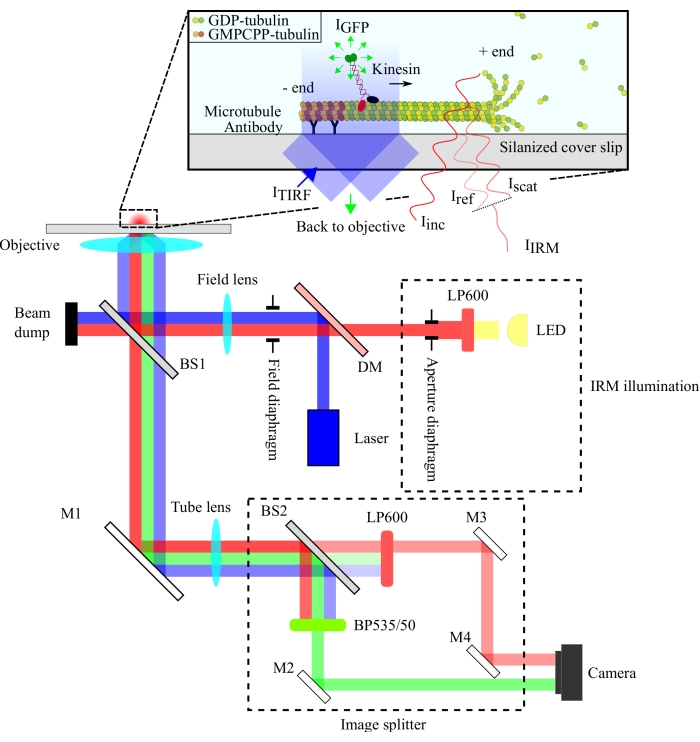
איור 1: ייצוג סכמטי של ההתקנה האופטית להדמיית IRM ו-TIRF בו-זמנית של תנועתיות קינסין. אפילומינציה ממקור אור LED עוברת דרך הסרעפת של הצמצם ומגיעה למפצל הקרן 10/90 (R/T) (BS1). מפצל האלומות משקף באופן חלקי את אור תאורת ה-IRM האדומה ואת אור העירור TIRF בגודל 488 ננומטר עד למטרה להאיר את הדגימה. האות מהדגימה נאסף על ידי אותה מטרה ומופנה למכלול פיצול התמונה שבו תמונות IRM ו- TIRF מופרדות מרחבית על ידי מפצל הקרן 90/10 (R/T) (BS2). לאחר מכן מסוננים האותות באופן ספקטרלי לפני שהם מגיעים לשבב המצלמה. קיצורים: IRM = מיקרוסקופיית השתקפות הפרעה; TIRF = סה"כ-השתקפות-פנימית-פלואורסצנציה; LED = דיודה פולטת אור; ITIRF = תאורת TIRF; IGFP = פלואורסצנציה של GFP; Iinc = תאורת IRM; אניref = אור מפוזר בממשק הזכוכית / מים; אניscat = אור מפוזר מהמיקרוטובול; IIRM = אות IRM (הפרעה של Iref ו- Iscat); R/T = משתקף/משודר; LP600: מסנן מעבר ארוך (600 ננומטר); DM = מראה דיכרואית; BS1 ו- BS2 = מפצלי קורות 1 ו -2; M1, M2, M3, M4 = מראות; BP535/50 = מעבר פס (535/50 ננומטר); GFP = חלבון פלואורסצנטי ירוק; GMPCPP = גואניליל 5'-α,β-מתילנדיפוספונט; תמ"ג = גואנוזין דיפוספט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
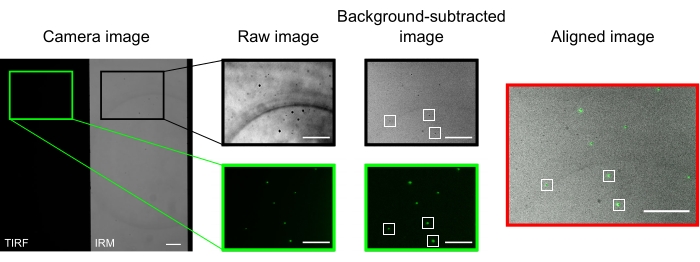
איור 2: חיסור רקע ויישור תמונה. תמונות TIRF (החצי השמאלי) וה-IRM (החצי הימני) מופיעות בו-זמנית על שני חצאים של אותו שבב מצלמה (תמונת מצלמה). חיסור הרקע החציוני הזמני מגביר את הניגודיות של החרוזים (תמונה עם חיסור רקע), הנראים כהים ב-IRM ובהירים בתמונות TIRF. תמונות IRM ו- TIRF מיושרות על ידי תרגום (מימין) בהתבסס על לוקליזציה של חרוזים נבחרים (מלבנים לבנים). סרגלי קנה מידה = 10 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: קימוגרף ותמונות של תנועת קינסינסינים במהלך התכווצות המיקרוטובולים. הקימוגרפיה (משמאל) מראה eGFP-kinesin-1 (ירוק) צועדת לעבר קצה הפלוס של המיקרוטובול (אפור כהה). תמונות מסדרת הזמן המתאימה מוצגות (מימין). חצים לבנים מראים מולקולות קינזין-1 בודדות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
ImageSplitterקובץ רגיסטציה: אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
חקר ויסות הדינמיקה של מיקרוטובולים על ידי חלבונים הקשורים למיקרוטובולים (MAPs) דורש לעתים קרובות הדמיה סימולטנית של מיקרוטובולים ו-MAPs. טכניקות מיקרוסקופיה פלואורסצנטית כגון TIRF משמשות בדרך כלל למטרה זו. עם זאת, הם מוגבלים על ידי החסרונות של הדמיה פלואורסצנטית, הכוללים פוטו-אקונומיקה, פוטו-דיאמג', והצורך בתיוג פלואורופור. שיטות ללא תוויות, כגון IRM, מתאימות להדמיה של מיקרוטובולים אך אינן מסוגלות להדמיית פלואורופורים בודדים. פרוטוקול זה משלב הדמיית IRM ללא תוויות ומיקרוסקופ TIRF להדמיה סימולטנית של מיקרוטובולים דינמיים ו- MAPs.
הגדרת ה-IRM משתמשת במקור תאורת LED המסונן ל->600 ננומטר, בעוד שהגדרת TIRF משתמשת בלייזר של 488 ננומטר. השתמשנו במפצל קרן צלחת זול כדי להחזיר את אור התאורה על הדגימה ולהעביר את האות שנאסף לגלאי (איור 1). מפצל קרן עם 10% רפלקציה ו-90% שידור נבחר כדי למזער את אובדן האות המולקולה הבודדת. ההפסד של 90% בעוצמת אור התאורה מפצה על ידי הגדלת העוצמה של לייזר התאורה והנורית.
ההפרדה הספקטרלית של האותות הושגה באמצעות מפצל קרן 90/10 (R/T) ושני מסננים ספקטרליים (מעבר ארוך של 600 ננומטר עבור IRM ומעבר פס 535/50 ננומטר עבור TIRF). אותות ה-IRM וה-TIRF המופרדים באופן ספקטרלי מוקרנים על שני חצאים של שבב מצלמה יחיד באמצעות מכלול מפצל תמונה. השימוש במפצל קרן 90/10 מקריב 90% מאותות ה-IRM, אך הדבר מפוצה על ידי הגדלת עוצמת מקור תאורת ה-LED. מראה דיכרואית יכולה לשמש כאן גם כדי להפריד את אותות ה-IRM וה-TIRF בצורה יעילה יותר. מיקרובים פלואורסצנטיים הכלולים במבחנים מאפשרים יישור מדויק של תמונות TIRF ו- IRM ומשמשים כהפניה למיקוד המטרה.
האלמנט האופטי הקריטי ביותר בפרוטוקול זה הוא מטרת הצמצם המספרי הגבוה (NA). זה חיוני לא רק כדי להשיג השתקפות פנימית כוללת, אלא גם כדי למקסם את יעילות האוסף ואת ניגודיות התמונה. איכות התמונות המתקבלות תלויה גם בניקיון משטח הזכוכית וברכישת תמונת רקע ברורה כדי לתקן תאורה לא אחידה ולהסיר תכונות סטטיות. עבור הדמיית IRM, אנו ממליצים להשתמש בתאורה באורך גל ארוך (>600 ננומטר) כדי למזער את הפוטו-דמה של מיקרוטובולים וחלבונים. זה חשוב במיוחד אם נעשה שימוש במקור אור LED לבן, ובמקרה זה יש לכלול מסנן מעבר ארוך כדי להסיר כל אור UV.
פרוטוקול זה מאפשר הדמיה ללא תוויות במהירות גבוהה של מיקרו-טובולים דינמיים והדמיה סימולטנית ברזולוציה גבוהה של MAPsפלורסנטיים 17. בהשוואה לטכניקת המיתוג של קוביית המסנן, אשר מתחלפת בין לכידת תמונות של מיקרוטובולים ו- MAPs, הגדרה זו מסוגלת לקצבי פריימים גבוהים בהרבה מכיוון שהיא אינה תלויה בסיבוב הפיזי של קוביית מסנן. בהשוואה לטכניקות הדמיה של TIRF בשני צבעים, טכניקה זו משתמשת במערך אופטי תובעני פחות ועוקפת את הצורך בתיוג פלואורופור של מיקרוטובולים. המגבלות העיקריות של הגדרה זו נובעות מהדמיית TIRF של ה- MAPs; קצב הפריימים מוגבל על ידי זמן החשיפה של פלואורופור, והלבנת תמונות של פלואורופורים נותרה אפשרות. עם זאת, פרוטוקול זה משפר את הטכניקות הקיימות מכיוון שהוא משתמש ב- TIRF רק בעת הצורך (כלומר, כדי לדמיין MAPs אך לא מיקרוטובולים) ומשיג את המהירות הגבוהה ביותר האפשרית בגבולות TIRF. שיפורים נוספים אפשריים רק אם גם המיקרו-טובולים וגם ה-MAPs מודגמים באמצעות טכניקה אינטרפרומטרית, אך הדבר דורש תיוג MAPs עם ננו-חלקיקי מתכת, שיש להם מגבלות ואתגרים ניסיוניים.
כדי להדגים את היכולות של טכניקה זו, דמיינו בו זמנית שני תהליכים דינמיים מהירים באמצעות IRM ו- TIRF: התכווצות של מיקרוטובול והליכה של מולקולת קינסין פלואורסצנטית. טכניקה זו שימשה בעבר כדי לדמיין את הדיפוזיה המהירה של ספסטין על מיקרוטובולים מתכווצים5. מעבר ליישום זה על MAPs ומיקרוטובולים, ניתן להשתמש בפרוטוקול זה כדי לדמיין מולקולות פלואורסצנטיות בודדות בו זמנית עם כל מבנה מקרומולקולרי מסיבי מספיק כדי שניתן יהיה לדמיין באמצעות IRM, כגון קרום התא או חוט אקטין.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים למעבדה של תיירי אמונת על שיתוף ציוד לחדר נקי. אנו מודים ל-Yin-Wei Kuo על הכנת ה-eGFP-kinesin המטוהר ששימש במחקר זה. י.ט. מכיר בתמיכתה של קרן אלכסנדר פון הומבולדט באמצעות מלגת המחקר של פיודור לין. עבודה זו נתמכה על ידי NIH Grant R01 GM139337 (ל- J.H.).
Materials
| Name | Company | Catalog Number | Comments |
| 10/90 (R/T) beam splitter | Thorlabs | BSN10R | Plane beam splitter used in the excitation beam path |
| 90/10 (R/T) beam splitter | Thorlabs | BSX10R | Plane beam splitter used in the image splitter |
| Anti-biotin antibody | Sigma-Aldrich | B3640 | Used to functionalize surface for bonding biotinylated microtubules |
| ATP | Sigma-Aldrich | FLAAS | Used for preparing the motility buffer |
| Band-pass filter | Newport | HPM535-50 | Hard-coated band-pas filter is used in image splitter to image GFP signal |
| Biotinylated tubulin | Cytoskeleton, Inc. | T333P-A | Used to bind microtubule seeds to the surface of the flow channel |
| Casein | Sigma-Aldrich | C8654 | Casein is used to block nonspesific interactions |
| Catalase | Sigma-Aldrich | C9322 | Used for preparing the oxygen scavenger solution |
| Desiccator chamber | Southern Labware | 55207 | Desiccator is used for degasing the resin |
| DTT | Sigma-Aldrich | D0632 | Used for preparing the oxygen scavenger solution |
| EGTA | Sigma-Aldrich | E4378 | Used for preparing the BRB80 buffer |
| Glucose | Sigma-Aldrich | G7528 | Used for preparing the oxygen scavenger solution |
| Glucose oxidase | Sigma-Aldrich | G7016 | Used for preparing the oxygen scavenger solution |
| GMPCPP nucleotides | Jena Bioscience | NU-405L | Used for the polymerization of stabilized microtubules |
| Image splitter | Teledyne-Photometrics Imaging | OptoSplit II | An image splitter is used to split the images spatially. When buying, make sure about the compatibility with the microscope |
| ImajeJ2 | NIH | ImageJ2 is used for image analysis | |
| Kinesin | prepared in house (see references in text) | ||
| LDPE tubing | Thomas Scientific | 9565S22 | Non-toxic, lower density polyethylene micro bore tubing is used for fluid transfers |
| LED light source | Lumencor | Lumencor sola light engine | Used for IRM imaging |
| Long-pass filters | Thorlabs | FELH0600 | Hard-coated long pass filters. One is used as an excitation filter, other is used in image splitter to image IRM signal |
| Magnesium chloride | Sigma-Aldrich | 63068 | Used for preparing the BRB80 buffer |
| Micoscope objective heater | okolab | H401-T-DUAL-BL | Used to keep sample temperature constant via heating the objective |
| Microscope | Nikon | Ti-Eclipse | An inverted microscope that is used in the experiments |
| Na-PIPES | Sigma-Aldrich | P2949 | Used for preparing the BRB80 buffer |
| Nikon CFI Apochromat TIRF 100XC Oil objective | Nikon | MRD01991 | The imaging objective has 1.49 numerical aperture |
| PDMS and curing agent | Electron Microscopy Sciences | Sylgard 184 (24236-10) | Used for contructing the flow channels |
| PDMS puncher | World Precision Instruments LLC | 504529 | Used to punch hole into the PDMS |
| Plasma cleaner | Harrick Plasma | DPC-32G | The air plasma is used to remove organic contamination from the PDMS surface |
| Poloxamer 407 (commercial name Pluronic F-127) | Sigma-aldrich | P2443 | Used for channel surface passivation to minimize nonspecific binding |
| Sodium hydroxide | Sigma-Aldrich | 567530 | Used for preparing the BRB80 buffer |
| Stabilized microtubules | prepared in house (see references in text) | ||
| Table-top ultracentrifuge | Beckman Coulter | 340400 | Used to spin down microtubule seeds |
| TetraSpeck beads | ThermoFisher Scientific | T7279 | Used as a reference for aligning images |
| Zyla 4.2 camera | Andor | Zyla 4.2 | Scientific CMOS camera with spesifications: 2048 x 2048 pixels (6.5 μm pixel size) with quantum efficiency of 72% and 16 bit dynamic range |
References
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biology. 95, 221-245 (2010).
- Axelrod, D. Chapter 7: Total internal reflection fluorescence microscopy. Methods in Cell Biology. 89, 169-221 (2008).
- Kuo, Y. -. W., Trottier, O., Mahamdeh, M., Howard, J. Spastin is a dual-function enzyme that severs microtubules and promotes their regrowth to increase the number and mass of microtubules. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5533-5541 (2019).
- Hinrichs, M. H., et al. Tau protein diffuses along the microtubule lattice. The Journal of Biological Chemistry. 287 (46), 38559-38568 (2012).
- Al-Hiyasat, A., Tuna, Y., Kuo, Y. -. W., Howard, J. Herding of proteins by the ends of shrinking polymers. arXiv:. , (2021).
- Guo, H., et al. Mechanism and dynamics of breakage of fluorescent microtubules. Biophysical Journal. 90 (6), 2093-2098 (2006).
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Taylor, R. W., Sandoghdar, V., Astratov, V. . Interferometric scattering (iSCAT) microscopy and related techniques. in Label-free super-resolution microscopy. , 25-65 (2019).
- Young, G., Kukura, P. Interferometric scattering microscopy). Annual Review of Physical Chemistry. 70 (1), 301-322 (2019).
- Koch, M. D., Rohrbach, A. Label-free imaging and bending analysis of microtubules by ROCS microscopy and optical trapping. Biophysical Journal. 114 (1), 168-177 (2018).
- Kandel, M. E., Teng, K. W., Selvin, P. R., Popescu, G. Label-free imaging of single microtubule dynamics using spatial light interference microscopy. ACS Nano. 11 (1), 647-655 (2017).
- Mahamdeh, M., Simmert, S., Luchniak, A., Schäffer, E., Howard, J. Label-free high-speed wide-field imaging of single microtubules using interference reflection microscopy. Journal of Microscopy. 272 (1), 60-66 (2018).
- Mahamdeh, M., Howard, J. Implementation of interference reflection microscopy for label-free, high-speed imaging of microtubules. Journal of Visualized Experiments: JoVE. (150), e59520 (2019).
- Voldman, J., Gray, M. L., Schmidt, M. A. Microfabrication in biology and medicine. Annual Review of Biomedical Engineering. 1, 401-425 (1999).
- Rogers, K. R., et al. KIF1D is a fast non-processive kinesin that demonstrates novel K-loop-dependent mechanochemistry. The EMBO Journal. 20 (18), 5101-5113 (2001).
- Leduc, C., Ruhnow, F., Howard, J., Diez, S. Detection of fractional steps in cargo movement by the collective operation of kinesin-1 motors. Proceedings of the National Academy of Sciences of the United States of America. 104 (26), 10847-10852 (2007).
- Tuna, Y., Al-Hiyasat, A., Howard, J. Imaging dynamic microtubules and associated proteins by Simultaneous Interference-Reflection and Total-Internal-Reflection-Fluorescence Microscopy. arXiv. , (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved