Method Article
Microscopie à fluorescence par interférence simultanée et à réflexion interne totale pour l’imagerie de microtubules dynamiques et de protéines associées
Dans cet article
Résumé
Nous présentons un protocole pour la mise en œuvre de la microscopie interférence-réflexion et de la microscopie à fluorescence par réflexion interne totale pour l’imagerie simultanée de microtubules dynamiques et de protéines associées à des microtubules marquées par fluorescence.
Résumé
Plusieurs techniques ont été utilisées pour la visualisation directe des filaments du cytosquelette et de leurs protéines associées. La microscopie à fluorescence par réflexion interne totale (TIRF) a un rapport signal/fond élevé, mais elle souffre de photoblanchiment et de photodommages des protéines fluorescentes. Les techniques sans étiquette telles que la microscopie par réflexion par interférence (IRM) et la microscopie à diffusion interférométrique (iSCAT) contournent le problème du photoblanchiment mais ne peuvent pas facilement visualiser des molécules uniques. Cet article présente un protocole pour combiner l’IRM avec un microscope TIRF commercial pour l’imagerie simultanée de protéines associées aux microtubules (MAP) et de microtubules dynamiques in vitro. Ce protocole permet l’observation à grande vitesse des MAP interagissant avec les microtubules dynamiques. Cela améliore les configurations TIRF bicolores existantes en éliminant à la fois le besoin d’étiquetage de microtubules et le besoin de plusieurs composants optiques supplémentaires, tels qu’un deuxième laser d’excitation. Les deux canaux sont imagés sur la même puce de caméra pour éviter les problèmes d’enregistrement d’image et de synchronisation d’images. Cette configuration est démontrée en visualisant des molécules de kinésine unique marchant sur des microtubules dynamiques.
Introduction
La microscopie TIRF (Total-internal-reflection-fluorescence) est couramment utilisée pour la visualisation de molécules fluorescentes uniques. Par rapport à l’imagerie par épifluorescence, le TIRF permet une suppression supérieure de l’arrière-plan, permettant une localisation et un suivi à haute résolution des fluorophores uniques. Pour cette raison, le TIRF est la méthode préférée pour visualiser les protéines associées aux microtubules marquées par fluorescence et est fréquemment utilisé pour imager les microtubules 1,2.
Pour étudier la régulation de la dynamique des microtubules par les MAP, il est souvent nécessaire d’imager simultanément les microtubules et les MAP. La plupart des méthodes existantes à cet effet sont coûteuses ou souffrent d’inconvénients techniques. Le TIRF bicolore simultané, par exemple, nécessite deux lasers d’excitation et deux caméras. En plus du coût élevé, le besoin de caméras séparées pose des problèmes de synchronisation des images et d’enregistrement des images. Ce besoin peut être contourné si un cube filtrant rotatif est utilisé pour basculer physiquement entre les lasers d’excitation dans des images consécutives3. Dans une telle configuration, une seule puce de caméra peut être utilisée et les images alternent entre des images de microtubules et de MAP. Cette technique, cependant, est limitée par la vitesse du changement de filtre, qui limite généralement la fréquence d’images à moins de 0,5 image par seconde3 (fps). Une telle fréquence d’images est insuffisante pour résoudre des processus dynamiques rapides, tels que le retrait d’un microtubule se produisant à une vitesse allant jusqu’à 500 nm/s, la marche d’une kinésine à une vitesse de l’ordre de 800 nm/s, ou la diffusion d’une MAP se produisant avec des coefficients de diffusion supérieurs à 0,3 μm2/s4. Ceci est particulièrement problématique lors du suivi des positions relatives de deux cibles en mouvement dans chaque canal, comme la position d’un MAP par rapport à la position d’une pointe de microtubule en mouvement5.
En plus de ces contraintes optiques, la microscopie TIRF bicolore exige que les MAP et les microtubules soient marqués avec différents fluorophores dont les spectres d’émission sont suffisamment séparés. Le marquage fluorescent de la tubuline peut altérer la dynamique des microtubules6, et le photoblanchiment des fluorophores limite la vitesse d’imagerie7. En raison de ces problèmes, des techniques d’imagerie sans étiquette ont été développées pour visualiser les microtubules. Il s’agit notamment de la microscopie à diffusion interférométrique (iSCAT)8,9, de la microscopie rotative-cohérente-diffusion (ROCS)10, de la microscopie spatiale à interférence lumineuse (SLIM)11 et de la microscopie par réflexion d’interférence (IRM)12,13. Ces techniques permettent une imagerie rapide sans étiquette des microtubules sans les inconvénients de l’imagerie par fluorescence, mais elles ne peuvent pas être utilisées pour visualiser des MAP uniques.
Parmi ces techniques sans étiquette, IRM se distingue par son faible coût et ses exigences modestes en matière d’instrumentation. Nous avons récemment présenté un protocole pour combiner l’IRM avec un microscope TIRF commercial, permettant d’imager des microtubules et des MAP fluorescents dans des images alternées 3,13. Ce document présente un protocole permettant de modifier cette configuration pour capturer simultanément des images TIRF et IRM sur une seule puce de caméra. Cela implique l’ajout d’un séparateur de faisceau peu coûteux dans le chemin d’excitation pour éclairer simultanément l’échantillon avec un laser TIRF et une source de lumière IRM LED. Un séparateur d’images commercial modifié est utilisé pour séparer spectralement les signaux TIRF et IRM et les projeter sur des moitiés distinctes de la même puce de caméra. Nous utilisons également un système microfluidique qui permet l’échange rapide de réactifs lors de l’imagerie. Ce protocole décrit comment cette configuration peut être utilisée pour imager des microtubules dynamiques et des MAP. La capacité de l’appareil est démontrée en présentant la première visualisation de protéines de kinésine-1 marchant sur des microtubules rétrécissants, qui est capturé à une fréquence d’images de 10 s-1.
Protocole
1. Préparation des chambres d’écoulement
REMARQUE: Les chambres d’écoulement microfluidiques seront construites en adhérant des microcanaux de polydiméthylsiloxane (PDMS) à un verre de couverture nettoyé et fonctionnalisé. Les microcanaux seront coulés dans un moule maître.
-
Préparation des canaux PDMS
- Préparer des verres de couverture nettoyés et/ou fonctionnalisés avec une chimie de surface appropriée au test spécifique imagé.
REMARQUE: Pour les tests de motilité de kinésine, des verres de couverture silanisés nettoyés au piranha sont utilisés. Ceux-ci sont préparés comme décrit dans Gell et. al.1 Alternativement, une procédure plus simple consiste à sonicer les verres de couverture en isopropanol suivis de méthanol pendant 3 cycles de 20 minutes. - Pour préparer un moule maître, coupez des bandes de ruban adhésif fixe simple face à la taille de canal d’écoulement souhaitée. Collez les bandes au fond d’une boîte de Petri de 10 cm, en les disposant d’un côté à l’autre avec un espacement d’au moins 1 cm entre les bandes.
REMARQUE: Si des dimensions de canal précises sont requises, le moule peut être fabriqué sur des plaquettes de silicium en utilisant la photolithographie14. - Pour préparer le polymère PDMS, combinez l’agent de durcissement et l’élastomère de base dans un rapport massique de 1:10. Mélanger pendant 2 min.
REMARQUE: Ce rapport de mélange peut être modifié pour ajuster la rigidité du polymère. Un rapport plus élevé de la base à l’agent de durcissement donne un polymère plus doux. - Dégazez le mélange dans une chambre à vide jusqu’à ce que toutes les bulles disparaissent.
- Versez le mélange sur le moule principal en une couche d’environ 0,5 cm d’épaisseur, en prenant soin d’éviter de créer des bulles.
- Cuire le mélange dans un four préchauffé à 70 °C pendant 40 min.
REMARQUE: Un temps de durcissement plus long peut être nécessaire si le bloc PDMS est épais (>1 cm). Continuez à chauffer par incréments de 5 minutes jusqu’à ce qu’il soit complètement durci. - Découpez les régions structurées du polymère. Percez des trous à chaque extrémité du canal à l’aide d’un perforateur PDMS.
REMARQUE: Dans ce protocole, le diamètre du trou est réglé sur 0,75 mm et peut être ajusté en fonction des débits requis. Les canaux PDMS peuvent être stockés dans des environnements secs pendant de longues périodes, mais doivent être nettoyés avant utilisation. - Nettoyez le côté structuré du bloc PDMS. Utilisez du ruban adhésif fixe pour éliminer les grosses particules. Rincer à l’isopropanol puis au méthanol. Répétez ces rinçages 3x, rincez à l’eau ultrapure et séchez la surface.
- Plasma nettoyer le PDMS en utilisant de l’oxygène ou du plasma d’air.
REMARQUE: Dans ce protocole, le plasma d’air de 18 W est utilisé. - Placez le PDMS nettoyé au plasma sur un verre de couverture correctement nettoyé et chauffez sur une plaque chauffante à 80 °C pendant 15 min.
REMARQUE: La résine époxy peut être appliquée sur les côtés du bloc PDMS pour mieux l’adhérer au verre de couverture. - Insérez des tubes en polyéthylène basse densité (PEBD) de taille appropriée dans les trous. Connectez le tuyau de sortie à une seringue de 0,5 mL.
REMARQUE: Dans ce protocole, les tubes d’un diamètre intérieur de 0,023 po sont connectés au PDMS via un adaptateur métallique de 0,025 po de diamètre extérieur. - Faites circuler les solutions dans les microcanaux en immergeant le tube d’entrée dans la solution et en tirant le volume requis avec la seringue.
- Préparer des verres de couverture nettoyés et/ou fonctionnalisés avec une chimie de surface appropriée au test spécifique imagé.
2. Configuration optique
-
Modification du microscope (Figure 1)
- Modifiez un microscope TIRF pour activer l’imagerie IRM13. Remplacez le séparateur de faisceau 50/50 (réflectance (R)/Transmission (T)) utilisé dans la roue filtrante du microscope par un séparateur de faisceau 10/90 (R/T).
- Insérez un séparateur d’image entre la caméra et le microscope.
- Dans le cube de filtre du séparateur d’image, insérez un séparateur de faisceau 10/90 (R/T). Placez un filtre passe-long de 600 nm devant le faisceau réfléchi et un filtre d’émission de fluorescence approprié devant le faisceau transmis.
REMARQUE: Des séparateurs de faisceau avec différents rapports R / T peuvent être utilisés pour régler les fractions de la lumière d’émission IRM et TIRF qui sont collectées. - Alignez le séparateur d’image conformément aux spécifications du fabricant pour séparer spatialement les signaux TIRF et IRM sur la puce de la caméra.
REMARQUE: La séparation spatiale des signaux est nécessaire car le signal TIRF des fluorophores typiques est beaucoup plus faible que le signal IRM d’un microtubule et ne serait pas détectable si les deux signaux étaient superposés.
3. Imagerie de microtubules dynamiques et de molécules uniques de kinésine
- Fonctionnalisation et passivation de surface
- Débit du tampon BRB80 (80 mM Na-PIPES, 1 mM EGTA, 1 mM MgCl2, titré à pH 7,8 avec NaOH) dans la chambre de réaction.
- Appliquer la solution d’antibiotine diluée à 0,025 mg/mL dans le BRB80 et incuber à température ambiante pendant 10 min.
- Lavez le canal avec BRB80.
- S’écouler dans une solution de F-127 (1% de Pluronic F-127 (p/v) dissous dans BRB80 pendant la nuit) et incuber pendant au moins 20 min pour la passivation de surface.
REMARQUE: Si des verres de couverture faciles à nettoyer sont utilisés au lieu de verres de couverture silanisés, passivat en utilisant 2 mg / mL de caséine dans BRB80 pendant >20 min à température ambiante. - Lavez le canal avec BRB80.
- Préparation à l’imagerie
- Si un contrôle de la température est nécessaire, utilisez un appareil de chauffage objectif et réglez-le à la bonne température.
REMARQUE: Dans ce protocole, toutes les expériences sont effectuées à 28 ° C. - Placez l’échantillon sur l’étage du microscope et allumez la source lumineuse d’épiillumination (>600 nm) pour l’imagerie IRM.
REMARQUE: Dans ce protocole, une source de lumière LED blanche est utilisée avec un filtre passe-long de 600 nm. - Focalisez le microscope sur la surface de l’échantillon. Recherchez le plan focal correct près de l’interface pdMS-solution.
REMARQUE: Dans IRM, l’intérieur aqueux du canal doit apparaître beaucoup plus lumineux que le polymère PDMS. - Choisissez un champ de vision près du centre du canal.
- Préparer une solution de microbilles fluorescentes de 0,1 μm dans du BRB80 (densité : 109 billes/mL, correspondant à une dilution de 200 fois pour les billes utilisées dans ce protocole).
- S’écouler dans au moins un volume de canal de la solution de microbilles.
- Surveillez la réaction via IRM. Attendez que les microbilles « atterrissent » progressivement à la surface. Lorsque la densité souhaitée de microbilles est atteinte, lavez l’excès avec BRB80.
- Si un contrôle de la température est nécessaire, utilisez un appareil de chauffage objectif et réglez-le à la bonne température.
- Culture de graines de microtubules biotinylées stabilisées au guanylyl 5'-α,β-méthylènediphosphonate (GMPCPP)
- Dans un tube centrifuge de 0,6 mL, préparer 50 μL d’une solution contenant 1 mM de GMPCPP, 1 mM deMgCl2 et 2 μM de tubuline biotinylée (stœchiométrie de marquage à 5-10 %) dans BRB80.
REMARQUE: La stœchiométrie d’étiquetage correcte peut être obtenue en combinant la tubuline biotinylée à haute densité avec la tubuline bovine non marquée dans le bon rapport. - Incuber la solution sur de la glace pendant 5 min, puis incuber à 37 °C pendant 12,5 min.
REMARQUE: La longueur des graines peut être contrôlée en réglant le temps de polymérisation. - Arrêtez la polymérisation en ajoutant 100 μL de BRB80 à température ambiante.
- Faire tourner la solution dans une ultracentrifugeuse à température ambiante (126 000 x g, 5 min). Jetez le surnageant à l’aide d’une pipette pour éliminer la tubuline non polymérisée.
REMARQUE: Dans ce protocole, une ultracentrifugeuse à air est utilisée. - Ajouter 200 μL de BRB80 à température ambiante à la pastille. Resuspendez la pastille en pipetant doucement mais soigneusement. Utilisez une pipette de 200 μL avec une pointe de coupe pour réduire le cisaillement des microtubules.
- Dans un tube centrifuge de 0,6 mL, préparer 50 μL d’une solution contenant 1 mM de GMPCPP, 1 mM deMgCl2 et 2 μM de tubuline biotinylée (stœchiométrie de marquage à 5-10 %) dans BRB80.
- Croissance dynamique de la guanosine diphosphate (GDP)-tubuline « extensions »
REMARQUE: Les graines seront immobilisées sur la surface de l’antibiotine du canal d’écoulement. Des « extensions » dynamiques GTP/GDP seront cultivées à partir des extrémités des semences immobilisées.- Diluer les graines 20x dans BRB80. Faire couler les graines diluées dans la chambre de réaction.
- Surveillez la réaction via IRM. Attendez que les graines « atterrissent » progressivement sur la surface et s’y lient. Lorsque la densité de graines souhaitée est atteinte, lavez l’excès avec BRB80.
- Préparer un mélange d’extension de microtubules : 12 μM de tubuline non marquée, 1 mM de GTP, 5 mM de dithiothréitol (DTT) dans un tampon BRB80.
- S’écouler dans au moins un volume de canal du mélange d’extension. Assurez-vous que la température de réaction est de 28 °C.
- Attendez que les extensions de microtubules poussent à partir des graines au fil du temps.
REMARQUE: La longueur à l’état d’équilibre est généralement atteinte en moins de 20 minutes. - Utilisez les microtubules dynamiques pour l’imagerie. Ajoutez et visualisez des MAP fluorescents sur les microtubules, comme décrit à l’étape 3.5 pour la kinésine-1.
REMARQUE: Étant donné que les microtubules sont liés à la surface, ils sont facilement visibles par le TIRF.
- Essai de motilité kinésine
REMARQUE: Cette étape décrit un protocole pour visualiser la kinésine-1 marquée par la protéine fluorescente verte mobile (GFP) sur des microtubules rétrécissants. Une construction tronquée de kinésine-1 de rat fusionnée à eGFP (rKin430-eGFP) a été exprimée et purifiée, comme décrit précédemment15,16.- Préparer un tampon de motilité : 1 mM d’ATP et 0,2 mg/mL de caséine dans le BRB80.
- Diluer la kinésine-eGFP dans un tampon de motilité à 10 nM.
- Préparer une solution de piégeage de l’oxygène 2x pour contrer le photoblanchiment oxydatif (80 mM de glucose, 80 mg/mL de glucose oxydase, 32 mg/mL de catalase, 0,2 mg/mL de caséine, 20 mM de TNT) complétée par 2 mM d’ATP.
- Combiner 10 parties de piégeur d’oxygène, 9 parties de BRB80 et 1 partie de kinésine-eGFP de 10 nM pour une concentration finale de kinésine de 0,5 nM.
REMARQUE: Le volume total doit être au moins 1,5 fois plus grand que le volume du canal. - Définissez les paramètres d’imagerie sur le logiciel du microscope.
REMARQUE: Dans ce protocole, les vidéos sont enregistrées à 10 ips avec un temps d’exposition de 100 ms. L’intensité du laser est d’environ 0,05 kW/cm2. - Commencez l’imagerie et faites circuler la solution de kinésine dans la chambre.
- Une fois la mesure terminée, enregistrez une courte vidéo (~5 s) dans laquelle la scène est lentement traduite en un mouvement circulaire ou latéral. Utilisez la projection médiane de cette vidéo comme image d’arrière-plan et soustrayez-la des mesures brutes.
4. Traitement et analyse d’images
REMARQUE: Le traitement de l’image a été effectué à l’aide de NIH ImageJ2 (imagej.nih.gov/ij/). Une macro a été élaborée pour automatiser le fractionnement et l’alignement des canaux TIRF et IRM. Cette macro nécessite l’installation du plugin GaussFit_OnSpot (disponible sur le référentiel des plugins ImageJ).
- À partir de l’enregistrement en arrière-plan, créez une projection médiane dans ImageJ en cliquant sur Image | Piles | Projet Z.
- Soustrayez la projection d’arrière-plan médiane des données d’image brutes en cliquant sur Traiter | Calculatrice d’images.
REMARQUE: Assurez-vous de cocher l’option « Résultat 32 bits (float) ». - Pour l’enregistrement des images, choisissez une collection de microbilles près du microtubule d’intérêt et utilisez-les pour aligner les images TIRF et IRM.
- Pour chaque perle de cette collection, utilisez l’outil de sélection multipoint pour marquer l’emplacement approximatif dans le canal TIRF, puis l’emplacement correspondant dans le canal IRM.
REMARQUE : Par exemple, s’il y a deux perles (1 et 2), la sélection multipoint aurait quatre points dans l’ordre suivant : (1) perle 1 en TIRF, (2) perle 1 en IRM, (3) perle 2 en TIRF, (4) perle 2 en IRM. - Exécutez la macro ImageJ fournie (ImageSplitterRegistration.ijm).
REMARQUE: Cela automatise les étapes suivantes: i) estimer l’emplacement central de chaque perle en l’ajustant à un gaussien; ii) pour chaque perle, calculer le vecteur de déplacement séparant le centre dans le canal TIRF du centre dans le canal IRM; iii) faire la moyenne de ce vecteur de déplacement sur toutes les perles; iv) diviser les canaux TIRF et IRM en images distinctes; v) traduire l’image TIRF par le vecteur de déplacement moyen calculé en iii; vi) superposition des images TIRF et IRM dans un fichier .tiff multicanal.
Résultats
La configuration optique est schématisée à la figure 1. L’éclairage IRM et la lumière d’excitation TIRF sont dirigés vers l’ouverture arrière de l’objectif (100x, NA: 1,49) via un séparateur de faisceau 10/90 (R / T) (BS1). Le signal émis passe par le même séparateur de faisceau (BS1) et est réfléchi vers le séparateur d’image via un miroir (M1). Les composants du séparateur d’image (entourés de lignes pointillées sur la figure 1) séparent les signaux IRM et TIRF via un séparateur de faisceau 90/10 (R/T) (BS2) avec des filtres spectraux appropriés. Enfin, les images fractionnées sont projetées sur la puce de la caméra pour la visualisation. L’alignement du séparateur d’images est tel que les signaux TIRF et IRM sont projetés sur des moitiés distinctes de la puce.
Dans un microscope bien aligné, l’image de la caméra doit afficher une image divisée à mi-chemin, comme illustré à la figure 2. Les microtubules liés à la surface doivent être facilement visibles dans le canal IRM13 et la kinésine fluorescente doit être visible dans le canal TIRF.
Les microbilles utilisées pour aligner et enregistrer les deux canaux apparaissent comme des points lumineux dans les images TIRF et des taches sombres dans les images IRM. Bien que les perles soient visibles dans les données brutes, la soustraction de fond améliore considérablement le contraste (Figure 2). L’image d’arrière-plan utilisée pour la soustraction est la médiane temporelle d’une vidéo enregistrée avec une scène en mouvement. Comme décrit dans le protocole, l’alignement de l’image a été effectué en sélectionnant une collection de perles près de la région d’intérêt et en exécutant la macro fournie (imageSplitterRegistration.ijm). La macro ajuste les points aux gaussiens et aligne les images en minimisant la distance moyenne entre les points centraux des ajustements dans chaque canal. Ce processus est représenté à la figure 2, qui montre un bon alignement des microbilles fluorescentes (vert dans le canal TIRF, noir dans le canal IRM).
Enfin, les capacités de cette configuration d’imagerie simultanée sont démontrées en observant des molécules de kinésine unique marchant vers les extrémités rétrécissantes des microtubules. La figure 3 montre un kymographe de molécules de kinésine marquées eGFP (vert) marchant sur un microtubule rétrécissant (gris). Une série d’instantanés de l’enregistrement à partir duquel le kymographe a été généré est également présentée.
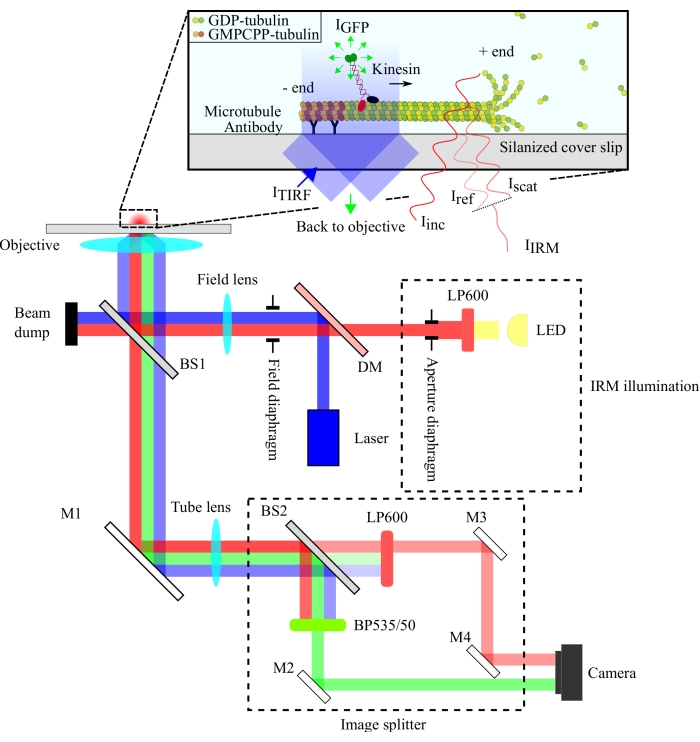
Figure 1 : Représentation schématique de la configuration optique pour l’imagerie IRM et TIRF simultanée de la motilité de la kinésine. L’épiillumination d’une source lumineuse LED passe à travers le diaphragme d’ouverture et atteint le séparateur de faisceau 10/90 (R/T) (BS1). Le séparateur de faisceau réfléchit partiellement la lumière d’éclairage IRM rouge et la lumière d’excitation TIRF de 488 nm jusqu’à l’objectif pour éclairer l’échantillon. Le signal de l’échantillon est collecté par le même objectif et dirigé vers l’ensemble de fractionnement d’image où les images IRM et TIRF sont séparées spatialement par le séparateur de faisceau 90/10 (R/T) (BS2). Les signaux sont ensuite filtrés spectralement avant d’atteindre la puce de la caméra. Abréviations : IRM = microscopie par réflexion d’interférence; TIRF = total-interne-réflexion-fluorescence; LED = diode électroluminescente; ITIRF = Éclairage TIRF; IGFP = fluorescence GFP; Iinc = éclairage IRM; Iref = lumière diffusée à l’interface verre/eau; Iscat = lumière diffusée du microtubule; IIRM = signal IRM (Interférence de Iref et Iscat); R/T = réfléchi/transmis; LP600: filtre passe-long (600 nm); DM = miroir dichroïque; BS1 et BS2 = séparateurs de faisceau 1 et 2; M1, M2, M3, M4 = miroirs; BP535/50 = passe-bande (535/50 nm); GFP = protéine fluorescente verte; GMPCPP = guanylyl 5'-α,β-méthylènediphosphonate; PIB = guanosine diphosphate. Veuillez cliquer ici pour voir une version agrandie de cette figure.
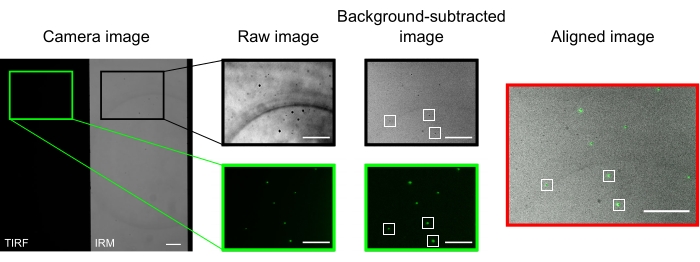
Figure 2 : Soustraction de l’arrière-plan et alignement de l’image. Les images TIRF (moitié gauche) et IRM (moitié droite) apparaissent simultanément sur deux moitiés de la même puce de caméra (image de caméra). La soustraction d’arrière-plan médiane temporelle augmente le contraste des perles (image soustraite en arrière-plan), qui apparaissent sombres dans IRM et lumineuses dans les images TIRF. Les images IRM et TIRF sont alignées par traduction (à droite) en fonction de la localisation des perles sélectionnées (rectangles blancs). Barres d’échelle = 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Kymographe et instantanés du mouvement des Kinesins pendant le retrait des microtubules. Le kymographe (à gauche) montre eGFP-kinésine-1 (vert) marchant vers l’extrémité supérieure du microtubule (gris foncé). Les instantanés des séries chronologiques correspondantes sont affichés (à droite). Les flèches blanches montrent des molécules uniques de kinésine-1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Fichier ImageSplitterRegistration : Veuillez cliquer ici pour télécharger ce fichier.
Discussion
L’étude de la régulation de la dynamique des microtubules par les protéines associées aux microtubules (MAP) nécessite souvent une imagerie simultanée des microtubules et des MAP. Les techniques de microscopie à fluorescence telles que le TIRF sont généralement utilisées à cette fin. Cependant, ils sont limités par les inconvénients de l’imagerie par fluorescence, qui comprennent le photoblanchiment, les photodommages et la nécessité d’un marquage fluorophore. Les méthodes sans étiquette, telles que l’IRM, conviennent à la visualisation de microtubules, mais ne sont pas capables d’imager des fluorophores uniques. Ce protocole combine l’imagerie IRM sans étiquette et la microscopie TIRF pour l’imagerie simultanée de microtubules dynamiques et de MAP.
La configuration IRM utilise une source d’éclairage LED filtrée à >600 nm, tandis que la configuration TIRF utilise un laser 488 nm. Nous avons utilisé un séparateur de faisceau de plaques peu coûteux pour réfléchir la lumière d’éclairage sur l’échantillon et transmettre le signal collecté au détecteur (Figure 1). Un séparateur de faisceau avec une réflectance de 10% et une transmission de 90% a été choisi pour minimiser la perte du signal à molécule unique. La perte de 90% de l’intensité lumineuse de l’éclairage est compensée par l’augmentation de la puissance du laser d’éclairage et de la LED.
La séparation spectrale des signaux a été réalisée à l’aide d’un séparateur de faisceau 90/10 (R/T) et de deux filtres spectraux (passe-long 600 nm pour IRM et passe-bande 535/50 nm pour TIRF). Les signaux IRM et TIRF séparés spectralement sont projetés sur deux moitiés d’une seule puce de caméra à l’aide d’un ensemble de séparateurs d’images. L’utilisation d’un séparateur de faisceau 90/10 sacrifie 90% du signal IRM, mais cela est compensé par l’augmentation de l’intensité de la source d’éclairage LED. Un miroir dichroïque pourrait également être utilisé ici pour séparer plus efficacement les signaux IRM et TIRF. Les microbilles fluorescentes incluses dans les essais permettent un alignement précis des images TIRF et IRM et servent de référence pour la mise au point de l’objectif.
L’élément optique le plus critique de ce protocole est l’objectif à grande ouverture numérique (NA). Ceci est essentiel non seulement pour obtenir une réflexion interne totale, mais aussi pour maximiser l’efficacité de la collection et le contraste de l’image. La qualité des images obtenues dépend également de la propreté de la surface du verre et de l’acquisition d’une image de fond claire pour corriger l’éclairage non uniforme et supprimer les caractéristiques statiques. Pour l’imagerie IRM, nous recommandons d’utiliser un éclairage de longue longueur d’onde (>600 nm) pour minimiser les photodommages des microtubules et des protéines. Ceci est particulièrement important si une source de lumière LED blanche est utilisée, auquel cas un filtre passe-long doit être inclus pour éliminer toute lumière UV.
Ce protocole permet une imagerie haute vitesse sans étiquette de microtubules dynamiques et une visualisation simultanée à haute résolution des MAP fluorescents17. Par rapport à la technique de commutation du cube filtrant, qui alterne entre la capture d’images de microtubules et de MAP, cette configuration est capable de fréquences d’images beaucoup plus élevées car elle ne dépend pas de la rotation physique d’un cube filtrant. Par rapport aux techniques d’imagerie TIRF bicolores, cette technique utilise une configuration optique moins exigeante et contourne le besoin de marquage fluorophore des microtubules. Les principales limites de cette configuration sont dues à l’imagerie TIRF des MAP; la fréquence d’images est limitée par le temps d’exposition d’un fluorophore, et le photoblanchiment des fluorophores reste une possibilité. Néanmoins, ce protocole améliore les techniques existantes car il n’utilise le TIRF que lorsque cela est nécessaire (c’est-à-dire pour visualiser les MAP mais pas les microtubules) et atteint la vitesse la plus élevée possible dans les limites du TIRF. D’autres améliorations ne sont possibles que si les microtubules et les MAP sont visualisés via une technique interférométrique, mais cela nécessite de marquer les MAP avec des nanoparticules métalliques, ce qui présente ses limites et ses défis expérimentaux.
Pour démontrer les capacités de cette technique, nous avons visualisé simultanément deux processus dynamiques rapides via IRM et TIRF : le retrait d’un microtubule et la marche d’une molécule de kinésine fluorescente. Cette technique a déjà été utilisée pour visualiser la diffusion rapide de la spastine sur des microtubules rétractables5. Au-delà de cette application aux MAP et aux microtubules, ce protocole peut être utilisé pour visualiser simultanément des molécules fluorescentes uniques avec n’importe quelle structure macromoléculaire suffisamment massive pour être visualisée via IRM, telle qu’une membrane cellulaire ou un filament d’actine.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous remercions le laboratoire de Thierry Emonet d’avoir partagé les équipements des salles blanches. Nous remercions Yin-Wei Kuo d’avoir préparé l’eGFP-kinésine purifiée utilisée dans cette étude. Y.T. reconnaît le soutien de la Fondation Alexander von Humboldt par le biais de la bourse de recherche Feodor Lynen. Ce travail a été soutenu par NIH Grant R01 GM139337 (à J.H.).
matériels
| Name | Company | Catalog Number | Comments |
| 10/90 (R/T) beam splitter | Thorlabs | BSN10R | Plane beam splitter used in the excitation beam path |
| 90/10 (R/T) beam splitter | Thorlabs | BSX10R | Plane beam splitter used in the image splitter |
| Anti-biotin antibody | Sigma-Aldrich | B3640 | Used to functionalize surface for bonding biotinylated microtubules |
| ATP | Sigma-Aldrich | FLAAS | Used for preparing the motility buffer |
| Band-pass filter | Newport | HPM535-50 | Hard-coated band-pas filter is used in image splitter to image GFP signal |
| Biotinylated tubulin | Cytoskeleton, Inc. | T333P-A | Used to bind microtubule seeds to the surface of the flow channel |
| Casein | Sigma-Aldrich | C8654 | Casein is used to block nonspesific interactions |
| Catalase | Sigma-Aldrich | C9322 | Used for preparing the oxygen scavenger solution |
| Desiccator chamber | Southern Labware | 55207 | Desiccator is used for degasing the resin |
| DTT | Sigma-Aldrich | D0632 | Used for preparing the oxygen scavenger solution |
| EGTA | Sigma-Aldrich | E4378 | Used for preparing the BRB80 buffer |
| Glucose | Sigma-Aldrich | G7528 | Used for preparing the oxygen scavenger solution |
| Glucose oxidase | Sigma-Aldrich | G7016 | Used for preparing the oxygen scavenger solution |
| GMPCPP nucleotides | Jena Bioscience | NU-405L | Used for the polymerization of stabilized microtubules |
| Image splitter | Teledyne-Photometrics Imaging | OptoSplit II | An image splitter is used to split the images spatially. When buying, make sure about the compatibility with the microscope |
| ImajeJ2 | NIH | ImageJ2 is used for image analysis | |
| Kinesin | prepared in house (see references in text) | ||
| LDPE tubing | Thomas Scientific | 9565S22 | Non-toxic, lower density polyethylene micro bore tubing is used for fluid transfers |
| LED light source | Lumencor | Lumencor sola light engine | Used for IRM imaging |
| Long-pass filters | Thorlabs | FELH0600 | Hard-coated long pass filters. One is used as an excitation filter, other is used in image splitter to image IRM signal |
| Magnesium chloride | Sigma-Aldrich | 63068 | Used for preparing the BRB80 buffer |
| Micoscope objective heater | okolab | H401-T-DUAL-BL | Used to keep sample temperature constant via heating the objective |
| Microscope | Nikon | Ti-Eclipse | An inverted microscope that is used in the experiments |
| Na-PIPES | Sigma-Aldrich | P2949 | Used for preparing the BRB80 buffer |
| Nikon CFI Apochromat TIRF 100XC Oil objective | Nikon | MRD01991 | The imaging objective has 1.49 numerical aperture |
| PDMS and curing agent | Electron Microscopy Sciences | Sylgard 184 (24236-10) | Used for contructing the flow channels |
| PDMS puncher | World Precision Instruments LLC | 504529 | Used to punch hole into the PDMS |
| Plasma cleaner | Harrick Plasma | DPC-32G | The air plasma is used to remove organic contamination from the PDMS surface |
| Poloxamer 407 (commercial name Pluronic F-127) | Sigma-aldrich | P2443 | Used for channel surface passivation to minimize nonspecific binding |
| Sodium hydroxide | Sigma-Aldrich | 567530 | Used for preparing the BRB80 buffer |
| Stabilized microtubules | prepared in house (see references in text) | ||
| Table-top ultracentrifuge | Beckman Coulter | 340400 | Used to spin down microtubule seeds |
| TetraSpeck beads | ThermoFisher Scientific | T7279 | Used as a reference for aligning images |
| Zyla 4.2 camera | Andor | Zyla 4.2 | Scientific CMOS camera with spesifications: 2048 x 2048 pixels (6.5 μm pixel size) with quantum efficiency of 72% and 16 bit dynamic range |
Références
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biology. 95, 221-245 (2010).
- Axelrod, D. Chapter 7: Total internal reflection fluorescence microscopy. Methods in Cell Biology. 89, 169-221 (2008).
- Kuo, Y. -. W., Trottier, O., Mahamdeh, M., Howard, J. Spastin is a dual-function enzyme that severs microtubules and promotes their regrowth to increase the number and mass of microtubules. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5533-5541 (2019).
- Hinrichs, M. H., et al. Tau protein diffuses along the microtubule lattice. The Journal of Biological Chemistry. 287 (46), 38559-38568 (2012).
- Al-Hiyasat, A., Tuna, Y., Kuo, Y. -. W., Howard, J. Herding of proteins by the ends of shrinking polymers. arXiv:. , (2021).
- Guo, H., et al. Mechanism and dynamics of breakage of fluorescent microtubules. Biophysical Journal. 90 (6), 2093-2098 (2006).
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Taylor, R. W., Sandoghdar, V., Astratov, V. . Interferometric scattering (iSCAT) microscopy and related techniques. in Label-free super-resolution microscopy. , 25-65 (2019).
- Young, G., Kukura, P. Interferometric scattering microscopy). Annual Review of Physical Chemistry. 70 (1), 301-322 (2019).
- Koch, M. D., Rohrbach, A. Label-free imaging and bending analysis of microtubules by ROCS microscopy and optical trapping. Biophysical Journal. 114 (1), 168-177 (2018).
- Kandel, M. E., Teng, K. W., Selvin, P. R., Popescu, G. Label-free imaging of single microtubule dynamics using spatial light interference microscopy. ACS Nano. 11 (1), 647-655 (2017).
- Mahamdeh, M., Simmert, S., Luchniak, A., Schäffer, E., Howard, J. Label-free high-speed wide-field imaging of single microtubules using interference reflection microscopy. Journal of Microscopy. 272 (1), 60-66 (2018).
- Mahamdeh, M., Howard, J. Implementation of interference reflection microscopy for label-free, high-speed imaging of microtubules. Journal of Visualized Experiments: JoVE. (150), e59520 (2019).
- Voldman, J., Gray, M. L., Schmidt, M. A. Microfabrication in biology and medicine. Annual Review of Biomedical Engineering. 1, 401-425 (1999).
- Rogers, K. R., et al. KIF1D is a fast non-processive kinesin that demonstrates novel K-loop-dependent mechanochemistry. The EMBO Journal. 20 (18), 5101-5113 (2001).
- Leduc, C., Ruhnow, F., Howard, J., Diez, S. Detection of fractional steps in cargo movement by the collective operation of kinesin-1 motors. Proceedings of the National Academy of Sciences of the United States of America. 104 (26), 10847-10852 (2007).
- Tuna, Y., Al-Hiyasat, A., Howard, J. Imaging dynamic microtubules and associated proteins by Simultaneous Interference-Reflection and Total-Internal-Reflection-Fluorescence Microscopy. arXiv. , (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon