Method Article
Одновременное интерференционное отражение и флуоресцентная микроскопия полного внутреннего отражения для визуализации динамических микротрубочек и связанных с ними белков
В этой статье
Резюме
Представлен протокол реализации интерференционно-отражательной микроскопии и тотальной-внутренней-отражательно-флуоресцентной микроскопии для одновременной визуализации динамических микротрубочек и флуоресцентно меченых микротрубочек-ассоциированных белков.
Аннотация
Несколько методов были использованы для прямой визуализации цитоскелетных нитей и связанных с ними белков. Микроскопия тотального внутреннего отражения-флуоресценции (TIRF) имеет высокое отношение сигнала к фону, но она страдает от фотоотбеливания и фотоповреждения флуоресцентных белков. Методы без меток, такие как интерференционная отражательная микроскопия (IRM) и интерферометрическая микроскопия рассеяния (iSCAT), обходят проблему фотоотбеливания, но не могут легко визуализировать отдельные молекулы. В данной работе представлен протокол объединения IRM с коммерческим микроскопом TIRF для одновременной визуализации микротрубочек-ассоциированных белков (MAP) и динамических микротрубочек in vitro. Этот протокол позволяет осуществлять высокоскоростное наблюдение за MAP, взаимодействующими с динамическими микротрубочками. Это улучшает существующие двухцветные установки TIRF, устраняя как необходимость в маркировке микротрубочек, так и необходимость в нескольких дополнительных оптических компонентах, таких как второй лазер возбуждения. Оба канала отображаются на одном чипе камеры, чтобы избежать проблем с регистрацией изображения и синхронизацией кадров. Эта установка демонстрируется визуализацией одиночных молекул кинезина, идущих по динамическим микротрубочкам.
Введение
Тотальная внутренняя флуоресцентная (TIRF) микроскопия обычно используется для визуализации одиночных флуоресцентных молекул. По сравнению с эпифлуоресцентной визуализацией, TIRF достигает превосходного подавления фона, что позволяет локализовать высокое разрешение и отслеживать одиночные флуорофоры. По этой причине TIRF является предпочтительным методом визуализации флуоресцентно меченых микротрубочек-ассоциированных белков и часто используется для изображения микротрубочек 1,2.
Чтобы исследовать регуляцию динамики микротрубочек с помощью MAP, часто необходимо одновременно получать изображения как микротрубочек, так и MAP. Большинство существующих методов для этой цели являются дорогостоящими или страдают техническими недостатками. Одновременная двухцветная TIRF, например, требует двух лазеров возбуждения и двух камер. В дополнение к высокой стоимости, потребность в отдельных камерах создает проблемы синхронизации кадров и регистрации изображений. Эту необходимость можно обойти, если вращающийся куб фильтра используется для физического переключения между лазерами возбуждения в последовательных кадрах3. В такой установке может использоваться один чип камеры, а кадры чередуются между изображениями микротрубочек и MAP. Этот метод, однако, ограничен скоростью смены фильтра, которая обычно ограничивает частоту кадров до менее чем 0,5 кадров в секунду3 (fps). Такая частота кадров недостаточна для разрешения быстрых динамических процессов, таких как усадка микротрубочки, происходящая со скоростью до 500 нм/с, ходьба кинезина со скоростью порядка 800 нм/с или диффузия MAP, происходящая с коэффициентами диффузии, превышающими 0,3 мкм2/с4. Это особенно проблематично при отслеживании относительных положений двух движущихся целей в каждом канале, таких как положение MAP относительно положения движущейся микротрубочкинаконечника 5.
В дополнение к этим оптическим ограничениям двухцветная микроскопия TIRF требует, чтобы MAP и микротрубочки были помечены различными флуорофорами, спектры излучения которых достаточно разделены. Флуоресцентная маркировка тубулина может изменять динамику микротрубочек6, а фотоотбеливание флуорофоров ограничивает скорость изображения7. Из-за этих проблем были разработаны методы визуализации без этикеток для визуализации микротрубочек. К ним относятся интерферометрическая микроскопия рассеяния (iSCAT)8,9, вращательно-когерентно-рассеивающая микроскопия (ROCS)10, пространственная световая интерференционная микроскопия (SLIM)11 и интерференционная отражательная микроскопия (IRM)12,13. Эти методы позволяют быстро визуализировать микротрубочки без меток без недостатков флуоресцентной визуализации, но они не могут быть использованы для визуализации отдельных MAP.
Из этих методов без этикеток IRM выделяется своей низкой стоимостью и скромными требованиями к приборам. Недавно мы представили протокол для объединения IRM с коммерческим микроскопом TIRF, позволяющий визуализировать микротрубочки и флуоресцентные MAP в чередующихся кадрах 3,13. В этом документе представлен протокол для изменения этой настройки для одновременной записи изображений TIRF и IRM на одном чипе камеры. Это включает в себя добавление недорогого светоделителя пучка в траекторию возбуждения для одновременного освещения образца лазером TIRF и светодиодным источником света IRM. Модифицированный коммерческий разветвитель изображений используется для спектрального разделения сигналов TIRF и IRM и проецирования их на отдельные половины одного и того же чипа камеры. Мы также используем микрофлюидную систему, которая позволяет быстро обмениваться реагентами во время визуализации. Этот протокол описывает, как эту установку можно использовать для изображения динамических микротрубочек и MAP. Возможности аппарата демонстрируются путем представления первой визуализации белков кинезина-1, идущих по усадочным микротрубочкам, которая захватывается с частотой кадров 10 с-1.
протокол
1. Подготовка проточных камер
ПРИМЕЧАНИЕ: Микрофлюидные проточные камеры будут построены путем прикрепления микроканалов полидиметилсилоксана (PDMS) к очищенному и функционализированному покровному стеклу. Микроканалы будут отлиты в мастер-форме.
-
Подготовка каналов PDMS
- Подготовьте очищенные и/или функционализированные покровные стекла с химическим составом поверхности, соответствующим конкретному анализу, который визуализируется.
ПРИМЕЧАНИЕ: Для анализа подвижности кинезина используются очищенные пираньями силанизированные покровные стекла. Они подготовлены так, как описано в Gell et. al.1 Альтернативно, более простой процедурой является обработка ультразвуком покровных стекол в изопропаноле с последующим метанолом в течение 3x 20 мин циклов. - Для приготовления мастер-формы нарежьте полоски односторонней стационарной ленты до нужного размера проточного канала. Приклейте полоски к дну чашки Петри 10 см, расположив их из стороны в сторону с расстоянием не менее 1 см между полосками.
ПРИМЕЧАНИЕ: Если требуются точные размеры канала, пресс-форма может быть изготовлена на кремниевых пластинах с использованием фотолитографии14. - Для получения полимера PDMS соедините отверждающий агент и базовый эластомер в массовом соотношении 1:10. Перемешивать в течение 2 мин.
ПРИМЕЧАНИЕ: Это соотношение смешивания может быть изменено для настройки жесткости полимера. Более высокое соотношение основания к отверждающему агенту приводит к более мягкому полимеру. - Дегазируйте смесь в вакуумной камере до тех пор, пока все пузырьки не исчезнут.
- Вылейте смесь на основную форму слоем толщиной ~ 0,5 см, заботясь о том, чтобы избежать образования пузырьков.
- Выпекать смесь в разогретой духовке при 70 °C в течение 40 мин.
ПРИМЕЧАНИЕ: Может потребоваться более длительное время отверждения, если блок PDMS толстый (>1 см). Продолжайте нагревать с шагом 5 минут до полного отверждения. - Вырежьте структурированные области полимера. Пробивайте отверстия на каждом конце канала с помощью перфоратора PDMS.
ПРИМЕЧАНИЕ: В этом протоколе диаметр отверстия устанавливается на 0,75 мм и может быть отрегулирован в соответствии с требуемыми скоростями потока. Каналы PDMS могут храниться в сухих средах в течение длительных периодов времени, но должны быть очищены перед использованием. - Очистите структурированную сторону блока PDMS. Используйте стационарную ленту для удаления крупных частиц. Промыть изопропанолом, а затем метанолом. Повторите эти полоскания 3 раза, промойте сверхчистой водой и высушите поверхность феном.
- Плазменная очистка PDMS с использованием кислорода или воздушной плазмы.
ПРИМЕЧАНИЕ: В этом протоколе используется воздушная плазма мощностью 18 Вт. - Поместите очищенную плазмой PDMS на соответствующим образом очищенное защитное стекло и нагрейте на конфорке при 80 °C в течение 15 минут.
ПРИМЕЧАНИЕ: Эпоксидная смола может быть нанесена на боковые стороны блока PDMS, чтобы лучше приклеить его к покровному стеклу. - Вставьте в отверстия полиэтиленовые трубки низкой плотности (LDPE) соответствующего размера. Подключите выпускную трубку к шприцу объемом 0,5 мл.
ПРИМЕЧАНИЕ: В этом протоколе трубки с внутренним диаметром 0,023 дюйма подключаются к PDMS через металлический адаптер наружного диаметра 0,025 дюйма. - Перетекайте растворы в микроканалы, погружая впускную трубку в раствор и рисуя необходимый объем шприцем.
- Подготовьте очищенные и/или функционализированные покровные стекла с химическим составом поверхности, соответствующим конкретному анализу, который визуализируется.
2. Оптическая настройка
-
Модификация микроскопа (рисунок 1)
- Модифицируйте микроскоп TIRF для включения IRM-визуализации13. Замените светоделитель 50/50 (отражательная способность (R)/передача (T)), используемый в колесе фильтра микроскопа, на разветвитель луча 10/90 (R/T).
- Вставьте разделитель изображения между камерой и микроскопом.
- В куб фильтра разветвителя изображения вставьте разветвитель луча 10/90 (R/T). Поместите 600-нм длинночасттный фильтр перед отраженным лучом и соответствующий флуоресцентный эмиссионный фильтр перед передаваемым лучом.
ПРИМЕЧАНИЕ: Светоделители с различными соотношениями R/T могут использоваться для настройки фракций излучаемого света IRM и TIRF, которые собираются. - Выровняйте разветвитель изображения в соответствии со спецификациями производителя для пространственного разделения сигналов TIRF и IRM на микросхеме камеры.
ПРИМЕЧАНИЕ: Пространственное разделение сигналов требуется, поскольку сигнал TIRF типичных флуорофоров намного слабее, чем сигнал IRM микротрубочки, и не будет обнаруживаться, если эти два сигнала будут наложены.
3. Визуализация динамических микротрубочек и отдельных молекул кинезина
- Функционализация и пассивация поверхности
- Буфер потока BRB80 (80 мМ Na-PIPES, 1 мМ EGTA, 1 мМMgCl2, титрованный до рН 7,8 с NaOH) в реакционную камеру.
- Проточный раствор антибиотика разводят до 0,025 мг/мл в BRB80 и инкубируют при комнатной температуре в течение 10 мин.
- Промывайте канал с помощью BRB80.
- Настаивают в растворе F-127 (1% Pluronic F-127 (мас./об.), растворенном в BRB80 на ночь) и инкубируют в течение не менее 20 мин для поверхностной пассивации.
ПРИМЕЧАНИЕ: Если вместо силанизированных защитных стекол используются легко очищаемые защитные стекла, пассивируйте с использованием казеина 2 мг/мл в BRB80 в течение >20 мин при комнатной температуре. - Промывайте канал с помощью BRB80.
- Подготовка к визуализации
- Если требуется контроль температуры, используйте объективный нагреватель и установите его на правильную температуру.
ПРИМЕЧАНИЕ: В этом протоколе все эксперименты проводятся при 28 °C. - Поместите образец на ступень микроскопа и включите эпииллюминационный источник света (>600 нм) для визуализации IRM.
ПРИМЕЧАНИЕ: В этом протоколе используется белый светодиодный источник света с фильтром длинных проходов 600 нм. - Наведите микроскоп на поверхность образца. Ищите правильную фокальную плоскость рядом с интерфейсом PDMS-решения.
ПРИМЕЧАНИЕ: В IRM водная внутренняя часть канала должна быть намного ярче, чем у PDMS-полимера. - Выберите поле зрения вблизи центра канала.
- Готовят раствор из 0,1 мкм флуоресцентных микрошариков в BRB80 (плотность: 109 бусин/мл, что соответствует 200-кратному разведению для шариков, используемых в этом протоколе).
- Течь по меньшей мере в одном канале объема раствора микрогранул.
- Мониторинг реакции с помощью IRM. Подождите, пока микрошарики постепенно «приземлятся» на поверхность. Когда желаемая плотность микрогранул достигнута, вымойте излишки BRB80.
- Если требуется контроль температуры, используйте объективный нагреватель и установите его на правильную температуру.
- Выращивание биотинилированных гуанилил 5'-α, β-метилендифосфоната (GMPCPP) -стабилизированных семян микротрубочек
- В центрифужной трубке объемом 0,6 мл приготовьте 50 мкл раствора, содержащего 1 мМ GMPCPP, 1 мМ MgCl2 и 2 мкМ биотинилированного тубулина (5-10% маркировка стехиометрии) в BRB80.
ПРИМЕЧАНИЕ: Правильная маркировка стехиометрии может быть достигнута путем объединения биотинилированного тубулина высокой плотности с немаркированным бычьим тубулином в правильном соотношении. - Инкубировать раствор на льду в течение 5 мин, затем инкубировать при 37 °С в течение 12,5 мин.
ПРИМЕЧАНИЕ: Длину семян можно контролировать, настраивая время полимеризации. - Остановить полимеризацию путем добавления 100 мкл комнатной температуры BRB80.
- Раскрутите раствор в ультрацентрифуге при комнатной температуре (126 000 х г, 5 мин). Выбросьте супернатант с помощью пипетки для удаления неполимеризованного тубулина.
ПРИМЕЧАНИЕ: В этом протоколе используется ультрацентрифуга с воздушным приводом. - Добавьте в гранулу 200 мкл комнатной температуры BRB80. Повторно суспендируйте гранулы путем пипетки осторожно, но тщательно. Используйте пипетку объемом 200 мкл с вырезанным наконечником, чтобы уменьшить сдвиг микротрубочек.
- В центрифужной трубке объемом 0,6 мл приготовьте 50 мкл раствора, содержащего 1 мМ GMPCPP, 1 мМ MgCl2 и 2 мкМ биотинилированного тубулина (5-10% маркировка стехиометрии) в BRB80.
- Растущие динамические «расширения» гуанозиндифосфата (ВВП)-тубулина
ПРИМЕЧАНИЕ: Семена будут обездвижены на антибиотиновой поверхности проточного канала. Динамические «расширения» ГТП/ВВП будут выращиваться из концов обездвиженных семян.- Разбавить семена 20x в BRB80. Переведите разбавленные семена в реакционную камеру.
- Мониторинг реакции с помощью IRM. Подождите, пока семена постепенно «приземлятся» на поверхность и привяжутся к ней. Когда желаемая плотность семян будет достигнута, вымойте излишки BRB80.
- Приготовьте смесь для наращивания микротрубочек: 12 мкМ немаркированного тубулина, 1 мМ ГТФ, 5 мМ дитиотрейтола (ДТТ) в буфере BRB80.
- Протекают по меньшей мере в одном канале объема удлинительной смеси. Убедитесь, что температура реакции составляет 28 °C.
- Подождите, пока расширения микротрубочек вырастут из семян с течением времени.
ПРИМЕЧАНИЕ: Стационарная длина обычно достигается менее чем за 20 минут. - Используйте динамические микротрубочки для визуализации. Добавьте и визуализируйте флуоресцентные MAP на микротрубочках, как описано в шаге 3.5 для кинезина-1.
ПРИМЕЧАНИЕ: Поскольку микротрубочки связаны с поверхностью, они легко видны с помощью TIRF.
- Анализ подвижности кинезина
ПРИМЕЧАНИЕ: На этом этапе описывается протокол визуализации подвижного зеленого флуоресцентного белка (GFP), меченого кинезином-1, на уменьшающихся микротрубочках. Усеченную конструкцию кинезина-1 крысы, сплавленную с eGFP (rKin430-eGFP), экспрессировали и очищали, как описано ранее15,16.- Подготовьте буфер подвижности: 1 мМ АТФ и 0,2 мг/мл казеина в BRB80.
- Разбавляют кинезин-эГФП в буфере подвижности до 10 нМ.
- Приготовьте 2-кратный раствор поглотителя кислорода для противодействия окислительному фотоотбеливанию (80 мМ глюкозы, 80 мг/мл глюкозооксидазы, 32 мг/мл каталазы, 0,2 мг/мл казеина, 20 мМ ДТТ) с добавлением 2 мМ АТФ.
- Объедините 10 частей поглотителя кислорода, 9 частей BRB80 и 1 часть 10 нМ кинезин-eGFP для получения конечной концентрации кинезина 0,5 нМ.
ПРИМЕЧАНИЕ: Общий объем должен быть как минимум в 1,5 раза больше объема канала. - Установите параметры визуализации в программном обеспечении микроскопа.
ПРИМЕЧАНИЕ: В этом протоколе видео записываются со скоростью 10 кадров в секунду со временем экспозиции 100 мс. Интенсивность лазера ~0,05 кВт/см2. - Начните визуализацию и перетейте раствор кинезина в камеру.
- После завершения измерения запишите короткое (~5 с) видео, в котором сцена медленно переводится в круговом или боковом движении. Используйте медианную проекцию этого видео в качестве фонового изображения и вычтите ее из необработанных измерений.
4. Обработка и анализ изображений
ПРИМЕЧАНИЕ: Обработка изображений осуществлялась с использованием NIH ImageJ2 (imagej.nih.gov/ij/). Был разработан макрос для автоматизации разделения и выравнивания каналов TIRF и IRM. Этот макрос требует установки плагина GaussFit_OnSpot (доступен в репозитории плагинов ImageJ).
- Из фоновой записи создайте медианную проекцию в ImageJ, нажав на Image | Стеки | Z-проект.
- Вычтите медианную фоновую проекцию из необработанных данных изображения, щелкнув Процесс | Калькулятор изображений.
ПРИМЕЧАНИЕ: Обязательно установите флажок "32-битный (плавающий) результат". - Для регистрации изображений выберите коллекцию микрошариков рядом с интересующей микротрубочкой и используйте их для выравнивания изображений TIRF и IRM.
- Для каждой бусины в этой коллекции используйте инструмент многоточечного выбора, чтобы отметить приблизительное местоположение в канале TIRF, а затем соответствующее местоположение в канале IRM.
ПРИМЕЧАНИЕ: Например, если имеется две бусины (1 и 2), многоточечный выбор будет иметь четыре точки в следующем порядке: (1) бусина 1 в TIRF, (2) бусина 1 в IRM, (3) бусина 2 в TIRF, (4) бусина 2 в IRM. - Запустите предоставленный макрос ImageJ (ImageSplitterRegistration.ijm).
ПРИМЕЧАНИЕ: Это автоматизирует следующие шаги: i) оценка центрального расположения каждой бусины путем установки на гауссову; ii) для каждой бусины вычисление вектора смещения, отделяющего центр в канале TIRF от центра в канале IRM; iii) усреднение этого вектора смещения по всем бусинам; iv) разделение каналов TIRF и IRM на отдельные изображения; v) перевод изображения TIRF по среднему вектору смещения, вычисленному в iii; vi) наложение изображений TIRF и IRM в многоканальный .tiff файл.
Результаты
Оптическая установка схематизирована на рисунке 1. Как подсветка IRM, так и свет возбуждения TIRF направляются на заднюю апертуру объектива (100x, NA: 1,49) через разветвитель луча 10/90 (R/T) (BS1). Излучаемый сигнал проходит через тот же разветвитель луча (BS1) и отражается на разветвитель изображения через зеркало (M1). Компоненты разветвителя изображения (заключенные пунктирными линиями на рисунке 1) разделяют сигналы IRM и TIRF с помощью светоделителя 90/10 (R/T) (BS2) вместе с соответствующими спектральными фильтрами. Наконец, разделенные изображения проецируются на чип камеры для визуализации. Выравнивание разветвителя изображения таково, что сигналы TIRF и IRM проецируются на отдельные половины чипа.
В хорошо выровненном микроскопе изображение камеры должно отображать разделенное наполовину изображение, как показано на рисунке 2. Микротрубочки с поверхностной связью должны быть легко видны в канале13 IRM, а флуоресцентный кинезин должен быть виден в канале TIRF.
Микрошарики, используемые для выравнивания и регистрации двух каналов, выглядят как яркие пятна на изображениях TIRF и темные пятна на изображениях IRM. Хотя бусины видны в необработанных данных, вычитание фона значительно улучшает контрастность (рисунок 2). Фоновое изображение, используемое для вычитания, представляет собой временную медиану видео, записанного с движущейся ступенью. Как описано в протоколе, выравнивание изображения выполнялось путем выбора коллекции бусин вблизи интересующей области и выполнения предоставленного макроса (imageSplitterRegistration.ijm). Макрос подгоняет точки к гауссам и выравнивает изображения, минимизируя среднее расстояние между центральными точками припадков в каждом канале. Этот процесс представлен на рисунке 2, который показывает хорошее выравнивание флуоресцентных микрошариков (зеленый в канале TIRF, черный в канале IRM).
Наконец, возможности этой одновременной настройки визуализации демонстрируются путем наблюдения за одиночными молекулами кинезина, идущими к уменьшающимся концам микротрубочек. На рисунке 3 показан кимограф меченых eGFP молекул кинезина (зеленый), идущих по уменьшающейся микротрубочке (серый). Также представлена серия снимков с записи, из которой был сгенерирован кимограф.
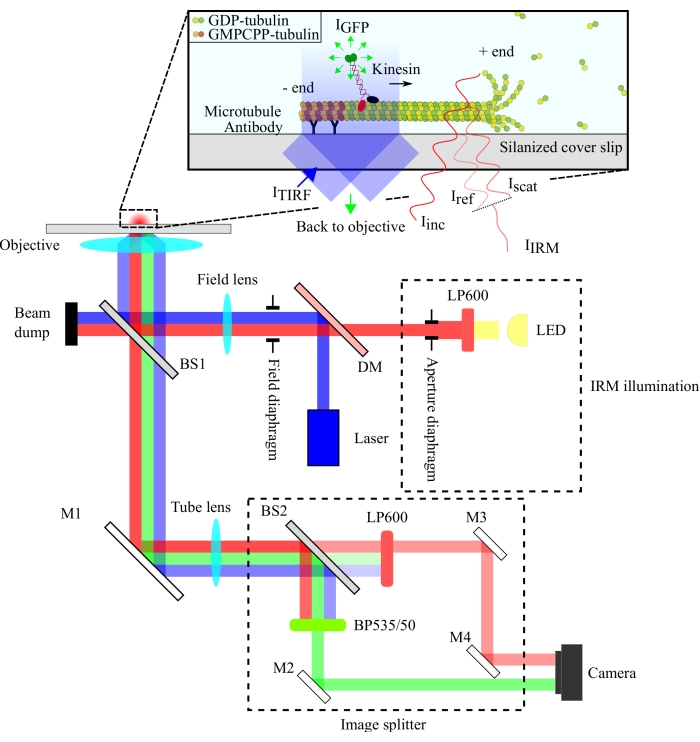
Рисунок 1: Схематическое изображение оптической установки для одновременной визуализации подвижности кинезина в IRM и TIRF. Эпииллюминация от светодиодного источника света проходит через диафрагму диафрагмы и достигает 10/90 (R/T) светоделителя (BS1). Светоделитель частично отражает красный свет освещения IRM и 488-нм индикатор возбуждения TIRF до объектива для освещения образца. Сигнал от образца собирается одним и тем же объективом и направляется на сборку разделения изображения, где изображения IRM и TIRF пространственно разделены делителем луча 90/10 (R/T) (BS2). Затем сигналы спектрально фильтруются, прежде чем достичь чипа камеры. Сокращения: IRM = интерференционная отражательная микроскопия; TIRF = полное внутреннее отражение флуоресценция; LED = светодиод; ITIRF = освещение TIRF; IGFP = флуоресценция GFP; Iinc = освещение IRM; Iref = рассеянный свет на границе раздела стакан/вода; Iscat = рассеянный свет от микротрубочки; IIRM = сигнал IRM (интерференции Iref и Iscat); R/T = отражено/передано; LP600: фильтр длинных частот (600 нм); DM = дихроичное зеркало; BS1 и BS2 = светоделители 1 и 2; M1, M2, M3, M4 = зеркала; BP535/50 = полоса пропускания (535/50 нм); GFP = зеленый флуоресцентный белок; GMPCPP = гуанилил 5'-α,β-метилендифосфонат; ВВП = гуанозиндифосфат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
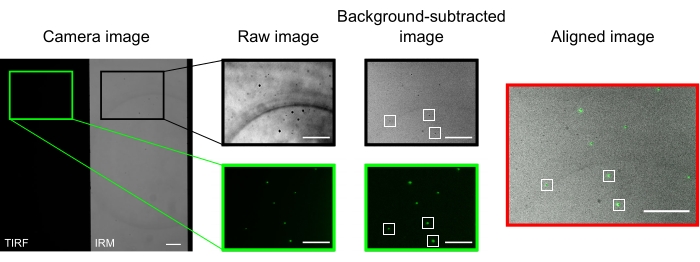
Рисунок 2: Вычитание фона и выравнивание изображения. Изображения TIRF (левая половина) и IRM (правая половина) отображаются одновременно на двух половинах одного и того же чипа камеры (изображение камеры). Временное среднее вычитание фона увеличивает контрастность бусин (фоновое вычитаемое изображение), которые кажутся темными в IRM и яркими на изображениях TIRF. Изображения IRM и TIRF выравниваются путем перевода (справа) на основе локализации выбранных бусин (белые прямоугольники). Шкала стержней = 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Кимограф и снимки движения кинезинов во время усадки микротрубочек. Кимограф (слева) показывает eGFP-kinesin-1 (зеленый), идущий к плюсовому концу микротрубочки (темно-серый). Показаны снимки из соответствующих временных рядов (справа). Белые стрелки показывают одиночные молекулы кинезина-1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
ImageSplitterФайл регистрации: Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Изучение регуляции динамики микротрубочек с помощью микротрубочек-ассоциированных белков (MAP) часто требует одновременной визуализации микротрубочек и MAP. Для этой цели обычно используются методы флуоресцентной микроскопии, такие как TIRF. Однако они ограничены недостатками флуоресцентной визуализации, которые включают фотоотбеливание, фотоповреждения и необходимость маркировки флуорофоров. Методы без меток, такие как IRM, подходят для визуализации микротрубочек, но не способны визуализировать одиночные флуорофоры. Этот протокол сочетает в себе IRM-визуализацию без меток и микроскопию TIRF для одновременной визуализации динамических микротрубочек и MAP.
Установка IRM использует светодиодный источник освещения, отфильтрованный до >600 нм, в то время как установка TIRF использует лазер 488 нм. Мы использовали недорогой пластинчатый разветвитель пучка для отражения света освещения на образец и передачи собранного сигнала на детектор (рисунок 1). Для минимизации потерь одномолекулярного сигнала был выбран светоделитель с 10% отражательной способностью и передачей 90%. 90% потери в интенсивности света освещенности компенсируются увеличением мощности подсветки лазера и светодиода.
Спектральное разделение сигналов было достигнуто с помощью светоделителя 90/10 (R/T) и двух спектральных фильтров (длинночастотные 600 нм для IRM и полосовые 535/50 нм для TIRF). Спектрально разделенные сигналы IRM и TIRF проецируются на две половины одного чипа камеры с помощью разветвителя изображения в сборе. Использование лучового разветвителя 90/10 жертвует 90% сигнала IRM, но это компенсируется увеличением интенсивности светодиодного источника освещения. Здесь также можно использовать дихроичное зеркало для более эффективного разделения сигналов IRM и TIRF. Флуоресцентные микрошарики, включенные в анализы, обеспечивают точное выравнивание изображений TIRF и IRM и служат ориентиром для фокусировки цели.
Наиболее важным оптическим элементом в этом протоколе является цель с высокой числовой апертурой (NA). Это важно не только для достижения полного внутреннего отражения, но и для максимизации эффективности коллекции и контрастности изображения. Качество получаемых изображений также зависит от чистоты поверхности стекла и получения четкого фонового изображения для коррекции на неравномерное освещение и удаления статических особенностей. Для визуализации IRM мы рекомендуем использовать длинноволновое освещение (>600 нм), чтобы свести к минимуму фотоповреждение микротрубочек и белков. Это особенно важно, если используется белый светодиодный источник света, и в этом случае должен быть включен фильтр длинных проходов для удаления любого ультрафиолетового света.
Этот протокол позволяет осуществлять высокоскоростную визуализацию динамических микротрубочек без меток и одновременную визуализацию с высоким разрешением флуоресцентных MAP17. По сравнению с методом переключения кубов фильтров, который чередуется между захватом изображений микротрубочек и MAP, эта настройка способна к гораздо более высокой частоте кадров, поскольку она не зависит от физического вращения куба фильтра. По сравнению с двухцветными методами визуализации TIRF, этот метод использует менее требовательную оптическую установку и обходит необходимость флуорофорной маркировки микротрубочек. Основные ограничения этой установки обусловлены тем, что TIRF получает изображения МАП; частота кадров ограничена временем экспозиции флуорофора, и фотоотбеливание флуорофоров остается возможным. Тем не менее, этот протокол улучшает существующие методы, поскольку он использует TIRF только в случае необходимости (т.е. для визуализации MAP, но не микротрубочек) и достигает максимально возможной скорости в пределах TIRF. Дальнейшие улучшения возможны только в том случае, если микротрубочки и MAP визуализируются с помощью интерферометрического метода, но для этого требуется маркировка MAP металлическими наночастицами, что имеет свои ограничения и экспериментальные проблемы.
Чтобы продемонстрировать возможности этой методики, мы одновременно визуализировали два быстрых динамических процесса с помощью IRM и TIRF: усадку микротрубочки и ходьбу флуоресцентной молекулы кинезина. Этот метод ранее использовался для визуализации быстрой диффузии спастина на уменьшающихся микротрубочках5. Помимо этого применения к MAP и микротрубочкам, этот протокол может быть использован для визуализации отдельных флуоресцентных молекул одновременно с любой макромолекулярной структурой, достаточно массивной для визуализации через IRM, такой как клеточная мембрана или актиновая нить.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Мы благодарим лабораторию Тьерри Эмоне за совместное использование оборудования для чистых помещений. Мы благодарим Инь-Вэй Куо за приготовление очищенного eGFP-кинезина, используемого в этом исследовании. Ю.Т. признает поддержку Фонда Александра фон Гумбольдта через Исследовательскую стипендию Федора Линена. Эта работа была поддержана грантом NIH R01 GM139337 (для J.H.).
Материалы
| Name | Company | Catalog Number | Comments |
| 10/90 (R/T) beam splitter | Thorlabs | BSN10R | Plane beam splitter used in the excitation beam path |
| 90/10 (R/T) beam splitter | Thorlabs | BSX10R | Plane beam splitter used in the image splitter |
| Anti-biotin antibody | Sigma-Aldrich | B3640 | Used to functionalize surface for bonding biotinylated microtubules |
| ATP | Sigma-Aldrich | FLAAS | Used for preparing the motility buffer |
| Band-pass filter | Newport | HPM535-50 | Hard-coated band-pas filter is used in image splitter to image GFP signal |
| Biotinylated tubulin | Cytoskeleton, Inc. | T333P-A | Used to bind microtubule seeds to the surface of the flow channel |
| Casein | Sigma-Aldrich | C8654 | Casein is used to block nonspesific interactions |
| Catalase | Sigma-Aldrich | C9322 | Used for preparing the oxygen scavenger solution |
| Desiccator chamber | Southern Labware | 55207 | Desiccator is used for degasing the resin |
| DTT | Sigma-Aldrich | D0632 | Used for preparing the oxygen scavenger solution |
| EGTA | Sigma-Aldrich | E4378 | Used for preparing the BRB80 buffer |
| Glucose | Sigma-Aldrich | G7528 | Used for preparing the oxygen scavenger solution |
| Glucose oxidase | Sigma-Aldrich | G7016 | Used for preparing the oxygen scavenger solution |
| GMPCPP nucleotides | Jena Bioscience | NU-405L | Used for the polymerization of stabilized microtubules |
| Image splitter | Teledyne-Photometrics Imaging | OptoSplit II | An image splitter is used to split the images spatially. When buying, make sure about the compatibility with the microscope |
| ImajeJ2 | NIH | ImageJ2 is used for image analysis | |
| Kinesin | prepared in house (see references in text) | ||
| LDPE tubing | Thomas Scientific | 9565S22 | Non-toxic, lower density polyethylene micro bore tubing is used for fluid transfers |
| LED light source | Lumencor | Lumencor sola light engine | Used for IRM imaging |
| Long-pass filters | Thorlabs | FELH0600 | Hard-coated long pass filters. One is used as an excitation filter, other is used in image splitter to image IRM signal |
| Magnesium chloride | Sigma-Aldrich | 63068 | Used for preparing the BRB80 buffer |
| Micoscope objective heater | okolab | H401-T-DUAL-BL | Used to keep sample temperature constant via heating the objective |
| Microscope | Nikon | Ti-Eclipse | An inverted microscope that is used in the experiments |
| Na-PIPES | Sigma-Aldrich | P2949 | Used for preparing the BRB80 buffer |
| Nikon CFI Apochromat TIRF 100XC Oil objective | Nikon | MRD01991 | The imaging objective has 1.49 numerical aperture |
| PDMS and curing agent | Electron Microscopy Sciences | Sylgard 184 (24236-10) | Used for contructing the flow channels |
| PDMS puncher | World Precision Instruments LLC | 504529 | Used to punch hole into the PDMS |
| Plasma cleaner | Harrick Plasma | DPC-32G | The air plasma is used to remove organic contamination from the PDMS surface |
| Poloxamer 407 (commercial name Pluronic F-127) | Sigma-aldrich | P2443 | Used for channel surface passivation to minimize nonspecific binding |
| Sodium hydroxide | Sigma-Aldrich | 567530 | Used for preparing the BRB80 buffer |
| Stabilized microtubules | prepared in house (see references in text) | ||
| Table-top ultracentrifuge | Beckman Coulter | 340400 | Used to spin down microtubule seeds |
| TetraSpeck beads | ThermoFisher Scientific | T7279 | Used as a reference for aligning images |
| Zyla 4.2 camera | Andor | Zyla 4.2 | Scientific CMOS camera with spesifications: 2048 x 2048 pixels (6.5 μm pixel size) with quantum efficiency of 72% and 16 bit dynamic range |
Ссылки
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biology. 95, 221-245 (2010).
- Axelrod, D. Chapter 7: Total internal reflection fluorescence microscopy. Methods in Cell Biology. 89, 169-221 (2008).
- Kuo, Y. -. W., Trottier, O., Mahamdeh, M., Howard, J. Spastin is a dual-function enzyme that severs microtubules and promotes their regrowth to increase the number and mass of microtubules. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5533-5541 (2019).
- Hinrichs, M. H., et al. Tau protein diffuses along the microtubule lattice. The Journal of Biological Chemistry. 287 (46), 38559-38568 (2012).
- Al-Hiyasat, A., Tuna, Y., Kuo, Y. -. W., Howard, J. Herding of proteins by the ends of shrinking polymers. arXiv:. , (2021).
- Guo, H., et al. Mechanism and dynamics of breakage of fluorescent microtubules. Biophysical Journal. 90 (6), 2093-2098 (2006).
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Taylor, R. W., Sandoghdar, V., Astratov, V. . Interferometric scattering (iSCAT) microscopy and related techniques. in Label-free super-resolution microscopy. , 25-65 (2019).
- Young, G., Kukura, P. Interferometric scattering microscopy). Annual Review of Physical Chemistry. 70 (1), 301-322 (2019).
- Koch, M. D., Rohrbach, A. Label-free imaging and bending analysis of microtubules by ROCS microscopy and optical trapping. Biophysical Journal. 114 (1), 168-177 (2018).
- Kandel, M. E., Teng, K. W., Selvin, P. R., Popescu, G. Label-free imaging of single microtubule dynamics using spatial light interference microscopy. ACS Nano. 11 (1), 647-655 (2017).
- Mahamdeh, M., Simmert, S., Luchniak, A., Schäffer, E., Howard, J. Label-free high-speed wide-field imaging of single microtubules using interference reflection microscopy. Journal of Microscopy. 272 (1), 60-66 (2018).
- Mahamdeh, M., Howard, J. Implementation of interference reflection microscopy for label-free, high-speed imaging of microtubules. Journal of Visualized Experiments: JoVE. (150), e59520 (2019).
- Voldman, J., Gray, M. L., Schmidt, M. A. Microfabrication in biology and medicine. Annual Review of Biomedical Engineering. 1, 401-425 (1999).
- Rogers, K. R., et al. KIF1D is a fast non-processive kinesin that demonstrates novel K-loop-dependent mechanochemistry. The EMBO Journal. 20 (18), 5101-5113 (2001).
- Leduc, C., Ruhnow, F., Howard, J., Diez, S. Detection of fractional steps in cargo movement by the collective operation of kinesin-1 motors. Proceedings of the National Academy of Sciences of the United States of America. 104 (26), 10847-10852 (2007).
- Tuna, Y., Al-Hiyasat, A., Howard, J. Imaging dynamic microtubules and associated proteins by Simultaneous Interference-Reflection and Total-Internal-Reflection-Fluorescence Microscopy. arXiv. , (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены