Method Article
Reflexión de interferencia simultánea y microscopía de fluorescencia de reflexión interna total para imágenes de microtúbulos dinámicos y proteínas asociadas
En este artículo
Resumen
Presentamos un protocolo para implementar la microscopía de interferencia-reflexión y la microscopía de reflexión-fluorescencia interna-total para la obtención simultánea de imágenes de microtúbulos dinámicos y proteínas asociadas a microtúbulos marcadas fluorescentemente.
Resumen
Se han empleado varias técnicas para la visualización directa de filamentos citoesqueléticos y sus proteínas asociadas. La microscopía de reflexión-fluorescencia interna total (TIRF) tiene una alta relación señal-fondo, pero sufre de fotoblanqueo y fotodaño de las proteínas fluorescentes. Las técnicas sin etiquetas, como la microscopía de reflexión de interferencia (IRM) y la microscopía de dispersión interferométrica (iSCAT) evitan el problema del fotoblanqueo, pero no pueden visualizar fácilmente moléculas individuales. Este artículo presenta un protocolo para combinar IRM con un microscopio TIRF comercial para la obtención simultánea de imágenes de proteínas asociadas a microtúbulos (MAP) y microtúbulos dinámicos in vitro. Este protocolo permite la observación a alta velocidad de los MAP que interactúan con microtúbulos dinámicos. Esto mejora las configuraciones TIRF de dos colores existentes al eliminar tanto la necesidad de etiquetado de microtúbulos como la necesidad de varios componentes ópticos adicionales, como un segundo láser de excitación. Ambos canales se visualizan en el mismo chip de cámara para evitar problemas de registro de imágenes y sincronización de fotogramas. Esta configuración se demuestra visualizando moléculas de quinesina individuales que caminan sobre microtúbulos dinámicos.
Introducción
La microscopía de reflexión-fluorescencia interna total (TIRF) se emplea comúnmente para la visualización de moléculas fluorescentes individuales. En comparación con las imágenes de epifluorescencia, TIRF logra una supresión de fondo superior, lo que permite la localización de alta resolución y el seguimiento de fluoróforos individuales. Por esta razón, TIRF es el método preferido para visualizar proteínas asociadas a microtúbulos marcadas fluorescentemente y se utiliza con frecuencia para obtener imágenes de microtúbulos 1,2.
Para investigar la regulación de la dinámica de los microtúbulos por parte de los MAP, a menudo es necesario obtener imágenes de los microtúbulos y los MAP simultáneamente. La mayoría de los métodos existentes para este propósito son caros o sufren de inconvenientes técnicos. El TIRF bicolor simultáneo, por ejemplo, requiere dos láseres de excitación y dos cámaras. Además del alto costo, la necesidad de cámaras separadas plantea problemas de sincronización de fotogramas y registro de imágenes. Esta necesidad se puede eludir si se utiliza un cubo de filtro giratorio para cambiar físicamente entre láseres de excitación en fotogramas consecutivos3. En tal configuración, se puede usar un solo chip de cámara, y los marcos alternan entre imágenes de microtúbulos y MAP. Esta técnica, sin embargo, está limitada por la velocidad del cambio de filtro, que normalmente restringe la velocidad de fotogramas a menos de 0,5 fotogramas por segundo3 (fps). Tal velocidad de fotogramas es insuficiente para resolver procesos dinámicos rápidos, como la contracción de un microtúbulo que ocurre a una velocidad de hasta 500 nm / s, la marcha de una kinesina a una velocidad del orden de 800 nm / s, o la difusión de un MAP que ocurre con coeficientes de difusión superiores a 0.3 μm2 / s4. Esto es particularmente problemático cuando se rastrean las posiciones relativas de dos objetivos móviles en cada canal, como la posición de un MAP en relación con la posición de una punta5 de un microtúbulo en movimiento.
Además de estas restricciones ópticas, la microscopía TIRF de dos colores requiere que los MAP y los microtúbulos se etiqueten con diferentes fluoróforos cuyos espectros de emisión estén suficientemente separados. El marcado fluorescente de la tubulina puede alterar la dinámica de los microtúbulos6, y el fotoblanqueo de los fluoróforos limita la velocidad de imagen7. Debido a estos problemas, se han desarrollado técnicas de imagen sin etiquetas para visualizar microtúbulos. Estos incluyen microscopía de dispersión interferométrica (iSCAT)8,9, microscopía de dispersión coherente giratoria (ROCS)10, microscopía de interferencia de luz espacial (SLIM)11 y microscopía de reflexión de interferencia (IRM)12,13. Estas técnicas permiten obtener imágenes rápidas sin etiquetas de microtúbulos sin los inconvenientes de las imágenes de fluorescencia, pero no se pueden usar para visualizar MAP individuales.
De estas técnicas sin etiquetas, IRM destaca por su bajo coste y sus modestas exigencias de instrumentación. Recientemente hemos presentado un protocolo para combinar IRM con un microscopio TIRF comercial, permitiendo que los microtúbulos y los MAP fluorescentes se tomen imágenes en fotogramas alternos 3,13. Este documento presenta un protocolo para modificar esta configuración para capturar simultáneamente imágenes TIRF e IRM en un solo chip de cámara. Esto implica la adición de un divisor de haz de bajo costo en la ruta de excitación para iluminar simultáneamente la muestra con un láser TIRF y una fuente de luz LED IRM. Un divisor de imagen comercial modificado se utiliza para separar espectralmente las señales TIRF e IRM y proyectarlas en mitades separadas del mismo chip de cámara. También empleamos un sistema microfluídico que permite el intercambio rápido de reactivos durante la obtención de imágenes. Este protocolo describe cómo se puede utilizar esta configuración para obtener imágenes de microtúbulos dinámicos y MAP. La capacidad del aparato se demuestra al presentar la primera visualización de proteínas de quinesina-1 que caminan sobre microtúbulos en contracción, que se captura a una velocidad de fotogramas de 10 s-1.
Protocolo
1. Preparación de cámaras de flujo
NOTA: Las cámaras de flujo microfluídico se construirán mediante la adhesión de microcanales de polidimetilsiloxano (PDMS) a un vidrio de cubierta limpia y funcionalizado. Los microcanales se fundirán en un molde maestro.
-
Preparación de canales PDMS
- Preparar vidrios de cubierta limpios y/o funcionalizados con química superficial adecuada al ensayo específico que se está fotografiando.
NOTA: Para los ensayos de motilidad de kinesina, se utilizan gafas de cubierta silanizadas limpiadas con pirañas. Estos se preparan como se describe en Gell et. al.1 Alternativamente, un procedimiento más simple es sonicar los vidrios de cubierta en isopropanol seguido de metanol durante 3 ciclos de 20 minutos. - Para preparar un molde maestro, corte tiras de cinta estacionaria de una sola cara al tamaño de canal de flujo deseado. Adhiera las tiras al fondo de una placa de Petri de 10 cm, disponiéndolas de lado a lado con al menos 1 cm de espacio entre las tiras.
NOTA: Si se requieren dimensiones precisas del canal, el molde se puede fabricar en obleas de silicio utilizando fotolitografía14. - Para preparar el polímero PDMS, combine el agente de curado y el elastómero base en una relación de masa de 1:10. Mezclar durante 2 min.
NOTA: Esta relación de mezcla se puede variar para ajustar la rigidez del polímero. Una mayor proporción de base a agente de curado da como resultado un polímero más suave. - Desgasificar la mezcla en una cámara de vacío hasta que desaparezcan todas las burbujas.
- Vierta la mezcla sobre el molde maestro en una capa de ~ 0.5 cm de espesor, teniendo cuidado de evitar la creación de burbujas.
- Hornea la mezcla en un horno precalentado a 70 °C durante 40 min.
NOTA: Es posible que se requiera un tiempo de curado más largo si el bloque PDMS es grueso (>1 cm). Continúe calentando en incrementos de 5 minutos hasta que esté completamente curado. - Cortar las regiones estructuradas del polímero. Perfora agujeros en cada extremo del canal con un perforador PDMS.
NOTA: En este protocolo, el diámetro del orificio se establece en 0,75 mm y se puede ajustar de acuerdo con los caudales requeridos. Los canales PDMS se pueden almacenar en ambientes secos durante períodos prolongados, pero deben limpiarse antes de su uso. - Limpie el lado estructurado del bloque PDMS. Use cinta estacionaria para eliminar partículas grandes. Enjuague con isopropanol y luego metanol. Repita estos enjuagues 3x, enjuague con agua ultrapura y seque la superficie.
- El plasma limpia el PDMS usando oxígeno o plasma de aire.
NOTA: En este protocolo, se utiliza plasma de aire de 18 W. - Coloque el PDMS limpiado con plasma en un vidrio de cubierta limpiado adecuadamente y caliente en una placa caliente a 80 ° C durante 15 min.
NOTA: La resina epoxi se puede aplicar a los lados del bloque PDMS para adherirlo mejor al vidrio de la cubierta. - Inserte tubos de polietileno de baja densidad (LDPE) de tamaño adecuado en los orificios. Conecte el tubo de salida a una jeringa de 0,5 ml.
NOTA: En este protocolo, los tubos con un diámetro interior de 0,023 pulgadas se conectan al PDMS a través de un adaptador metálico de diámetro exterior de 0,025 pulgadas. - Fluya las soluciones en los microcanales sumergiendo el tubo de entrada en la solución y extrayendo el volumen requerido con la jeringa.
- Preparar vidrios de cubierta limpios y/o funcionalizados con química superficial adecuada al ensayo específico que se está fotografiando.
2. Configuración óptica
-
Modificación del microscopio (Figura 1)
- Modifique un microscopio TIRF para habilitar imágenes IRM13. Reemplace el divisor de haz 50/50 (Reflectancia (R)/Transmisión (T)) utilizado en la rueda del filtro del microscopio por un divisor de haz 10/90 (R/T).
- Inserte un divisor de imágenes entre la cámara y el microscopio.
- En el cubo de filtro del divisor de imagen, inserte un divisor de haz 10/90 (R/T). Coloque un filtro de paso largo de 600 nm delante del haz reflejado y un filtro de emisión de fluorescencia apropiado delante del haz transmitido.
NOTA: Los divisores de haz con diferentes relaciones R/T se pueden utilizar para ajustar las fracciones de la luz de emisión IRM y TIRF que se recogen. - Alinee el divisor de imagen de acuerdo con las especificaciones del fabricante para separar espacialmente las señales TIRF e IRM en el chip de la cámara.
NOTA: Se requiere la separación espacial de las señales porque la señal TIRF de los fluoróforos típicos es mucho más débil que la señal IRM de un microtúbulo y no sería detectable si las dos señales se superpusieran.
3. Imágenes de microtúbulos dinámicos y moléculas individuales de quinesina
- Funcionalización y pasivación de superficies
- Flujo brB80 tampón (80 mM Na-PIPES, 1 mM EGTA, 1 mM MgCl2, titulado a pH 7.8 con NaOH) en la cámara de reacción.
- Flujo de solución de antibiotina diluida a 0,025 mg/ml en BRB80 e incubar a temperatura ambiente durante 10 min.
- Lave el canal con BRB80.
- Flujo en solución F-127 (1% Pluronic F-127 (p/v) disuelto en BRB80 durante la noche) e incubar durante al menos 20 min para la pasivación superficial.
NOTA: Si se utilizan gafas de cubierta de fácil limpieza en lugar de gafas de cubierta silanizadas, pasivar con 2 mg/ml de caseína en BRB80 durante >20 min a temperatura ambiente. - Lave el canal con BRB80.
- Preparación para la obtención de imágenes
- Si se requiere control de temperatura, use un calentador objetivo y configúrelo a la temperatura correcta.
NOTA: En este protocolo, todos los experimentos se realizan a 28 °C. - Coloque la muestra en el escenario del microscopio y encienda la fuente de luz de epiiluminación (>600 nm) para obtener imágenes IRM.
NOTA: En este protocolo, se utiliza una fuente de luz LED blanca con un filtro de paso largo de 600 nm. - Enfoque el microscopio en la superficie de la muestra. Busque el plano focal correcto cerca de la interfaz de la solución PDMS.
NOTA: En IRM, el interior acuoso del canal debe aparecer mucho más brillante que el polímero PDMS. - Elija un campo de visión cerca del centro del canal.
- Preparar una solución de microperlas fluorescentes de 0,1 μm en BRB80 (densidad: 109 perlas/ml, correspondiente a una dilución de 200 veces para las perlas utilizadas en este protocolo).
- Flujo en al menos un volumen de canal de la solución de microperlas.
- Supervise la reacción a través de IRM. Espere a que las microperlas "aterricen" gradualmente en la superficie. Cuando se logre la densidad deseada de microperlas, lave el exceso con BRB80.
- Si se requiere control de temperatura, use un calentador objetivo y configúrelo a la temperatura correcta.
- Cultivo de semillas de microtúbulos biotinilados de guanilil 5'-α,β-metilendifosfonato (GMPCPP) estabilizados
- En un tubo centrífugo de 0,6 ml, prepare 50 μL de una solución que contenga 1 mM de GMPCPP, 1 mM de MgCl2 y 2 μM de tubulina biotinilada (estequiometría de etiquetado al 5-10%) en BRB80.
NOTA: La estequiometría de etiquetado correcta se puede lograr combinando tubulina biotinilada de alta densidad con tubulina bovina sin etiquetar en la proporción correcta. - Incubar la solución en hielo durante 5 min, luego incubar a 37 °C durante 12,5 min.
NOTA: La longitud de las semillas se puede controlar ajustando el tiempo de polimerización. - Detenga la polimerización agregando 100 μL de BRB80 a temperatura ambiente.
- Girar la solución en una ultracentrífuga a temperatura ambiente (126.000 x g, 5 min). Deseche el sobrenadante usando una pipeta para eliminar la tubulina no polimerizada.
NOTA: En este protocolo, se utiliza una ultracentrífuga accionada por aire. - Añadir 200 μL de BRB80 a temperatura ambiente al pellet. Resuspend el pellet pipeteando suavemente pero a fondo. Use una pipeta de 200 μL con una punta cortada para reducir el cizallamiento de los microtúbulos.
- En un tubo centrífugo de 0,6 ml, prepare 50 μL de una solución que contenga 1 mM de GMPCPP, 1 mM de MgCl2 y 2 μM de tubulina biotinilada (estequiometría de etiquetado al 5-10%) en BRB80.
- Crecimiento dinámico de las "extensiones" de guanosina difosfato (PIB)-tubulina
NOTA: Las semillas se inmovilizarán en la superficie de antibiotina del canal de flujo. Las "extensiones" dinámicas GTP/GDP se cultivarán desde los extremos de las semillas inmovilizadas.- Diluya las semillas 20x en BRB80. Fluya las semillas diluidas en la cámara de reacción.
- Supervise la reacción a través de IRM. Espere a que las semillas "aterricen" gradualmente en la superficie y se unan a ella. Cuando se logre la densidad deseada de semillas, lave el exceso con BRB80.
- Prepare una mezcla de extensión de microtúbulos: tubulina sin etiquetar 12 μM, GTP de 1 mM, ditiotreitol (TDT) de 5 mM en tampón BRB80.
- Flujo en al menos un volumen de canal de la mezcla de extensión. Asegúrese de que la temperatura de reacción sea de 28 °C.
- Espere a que las extensiones de microtúbulos crezcan a partir de las semillas con el tiempo.
NOTA: La duración del estado estacionario generalmente se logra en menos de 20 minutos. - Utilice los microtúbulos dinámicos para la obtención de imágenes. Agregue y visualice LOS MAP fluorescentes en los microtúbulos, como se describe en el paso 3.5 para la kinesina-1.
NOTA: Debido a que los microtúbulos están unidos a la superficie, son fácilmente visibles por TIRF.
- Ensayo de motilidad de kinesina
NOTA: Este paso describe un protocolo para visualizar la quinesina-1 marcada con la proteína fluorescente verde móvil (GFP) en microtúbulos que se encogen. Se expresó y purificó un constructo truncado de quinesina-1 de rata fusionado con eGFP (rKin430-eGFP), como se describió anteriormente15,16.- Preparar tampón motilidad: 1 mM atp y 0,2 mg/ml de caseína en BRB80.
- Diluir la kinesina-eGFP en tampón de motilidad a 10 nM.
- Prepare una solución eliminadora de oxígeno 2x para contrarrestar el fotoblanqueo oxidativo (80 mM de glucosa, 80 mg/mL de glucosa oxidasa, 32 mg/mL de catalasa, 0,2 mg/mL de caseína, 20 mM de TDT) suplementada con 2 mM de ATP.
- Combine 10 partes de eliminador de oxígeno, 9 partes de BRB80 y 1 parte de 10 nM de kinesina-eGFP para una concentración final de quinesina de 0.5 nM.
NOTA: El volumen total debe ser al menos 1,5 veces mayor que el volumen del canal. - Establezca la configuración de imagen en el software del microscopio.
NOTA: En este protocolo, los videos se graban a 10 fps con un tiempo de exposición de 100 ms. La intensidad del láser es de ~0,05 kW/cm2. - Comience a tomar imágenes y fluya la solución de kinesina hacia la cámara.
- Una vez completada la medición, grabe un video corto (~ 5 s) en el que el escenario se traduzca lentamente en un movimiento circular o lateral. Utilice la proyección mediana de este vídeo como imagen de fondo y quítela de las mediciones en bruto.
4. Procesamiento y análisis de imágenes
NOTA: El procesamiento de imágenes se llevó a cabo utilizando NIH ImageJ2 (imagej.nih.gov/ij/). Se desarrolló una macro para automatizar la división y alineación de los canales TIRF e IRM. Esta macro requiere que se instale el complemento GaussFit_OnSpot (disponible en el repositorio de complementos de ImageJ).
- Desde la grabación de fondo, cree una proyección mediana en ImageJ haciendo clic en Imagen | Pilas | Proyecto Z.
- Reste la proyección de fondo mediana de los datos de imagen sin procesar haciendo clic en Procesar | Calculadora de imágenes.
NOTA: Asegúrese de marcar la opción "Resultado de 32 bits (flotante)". - Para el registro de imágenes, elija una colección de microperlas cerca del microtúbulo de interés y utilícelas para alinear las imágenes TIRF e IRM.
- Para cada cuenta de esta colección, utilice la herramienta de selección multipunto para marcar la ubicación aproximada en el canal TIRF y, a continuación, la ubicación correspondiente en el canal IRM.
NOTA: Por ejemplo, si hay dos cuentas (1 y 2), la selección multipunto tendría cuatro puntos en el siguiente orden: (1) cuenta 1 en TIRF, (2) cuenta 1 en IRM, (3) cuenta 2 en TIRF, (4) cuenta 2 en IRM. - Ejecute la macro ImageJ proporcionada (ImageSplitterRegistration.ijm).
NOTA: Esto automatiza los siguientes pasos: i) estimar la ubicación central de cada cuenta ajustándose a un gaussiano; ii) para cada perla, calcular el vector de desplazamiento que separa el centro en el canal TIRF del centro en el canal IRM; iii) promediar este vector de desplazamiento en todas las cuentas; iv) dividir los canales TIRF e IRM en imágenes separadas; v) traducir la imagen TIRF por el vector de desplazamiento medio calculado en iii; vi) superponer las imágenes TIRF e IRM en un archivo de .tiff multicanal.
Resultados
La configuración óptica se esquematiza en la Figura 1. Tanto la iluminación IRM como la luz de excitación TIRF se dirigen a la apertura posterior del objetivo (100x, NA: 1.49) a través de un divisor de haz 10/90 (R / T) (BS1). La señal emitida pasa a través del mismo divisor de haz (BS1) y se refleja en el divisor de imagen a través de un espejo (M1). Los componentes del divisor de imagen (encerrados con líneas discontinuas en la Figura 1) separan las señales IRM y TIRF a través de un divisor de haz 90/10 (R/T) (BS2) junto con los filtros espectrales apropiados. Finalmente, las imágenes divididas se proyectan en el chip de la cámara para su visualización. La alineación del divisor de imagen es tal que las señales TIRF e IRM se proyectan en mitades separadas del chip.
En un microscopio bien alineado, la imagen de la cámara debe mostrar una imagen dividida a medias, como se presenta en la Figura 2. Los microtúbulos unidos a la superficie deben ser fácilmente visibles en el canalIRM 13, y la quinesina fluorescente debe ser visible en el canal TIRF.
Las microperlas utilizadas para alinear y registrar los dos canales aparecen como puntos brillantes en las imágenes TIRF y manchas oscuras en las imágenes IRM. Aunque las cuentas son visibles en los datos sin procesar, la resta de fondo mejora significativamente el contraste (Figura 2). La imagen de fondo utilizada para la sustracción es la mediana temporal de un video grabado con un escenario en movimiento. Como se describe en el protocolo, la alineación de la imagen se realizó seleccionando una colección de cuentas cerca de la región de interés y ejecutando la macro proporcionada (imageSplitterRegistration.ijm). La macro ajusta los puntos a los gaussianos y alinea las imágenes minimizando la distancia media entre los puntos centrales de los ajustes en cada canal. Este proceso se representa en la Figura 2, que muestra una buena alineación de las microperlas fluorescentes (verde en el canal TIRF, negro en el canal IRM).
Finalmente, las capacidades de esta configuración de imágenes simultáneas se demuestran mediante la observación de moléculas de quinesina individuales que caminan hacia los extremos cada vez más pequeños de los microtúbulos. La Figura 3 muestra un kymograph de moléculas de quinesina marcadas con eGFP (verde) que caminan sobre un microtúbulo que se encoge (gris). También se presenta una serie de instantáneas de la grabación a partir de la cual se generó el kymograph.
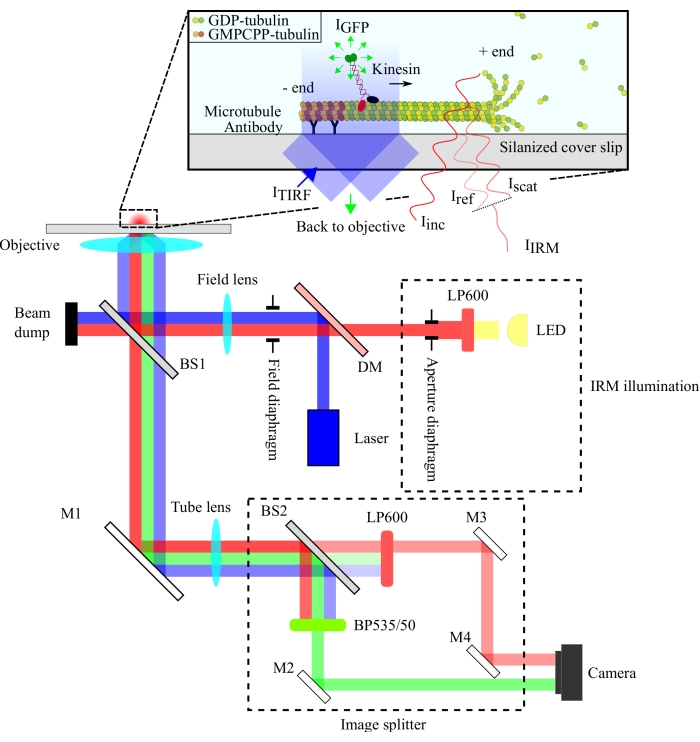
Figura 1: Representación esquemática de la configuración óptica para imágenes simultáneas de IRM y TIRF de la motilidad de la quinesina. La epiiluminación de una fuente de luz LED pasa a través del diafragma de apertura y alcanza el divisor de haz 10/90 (R / T) (BS1). El divisor de haz refleja parcialmente la luz de iluminación roja IRM y la luz de excitación TIRF de 488 nm hasta el objetivo de iluminar la muestra. La señal de la muestra es recogida por el mismo objetivo y dirigida al conjunto de división de imágenes donde las imágenes IRM y TIRF están separadas espacialmente por el divisor de haz 90/10 (R/T) (BS2). Las señales se filtran espectralmente antes de llegar al chip de la cámara. Abreviaturas: IRM = microscopía de reflexión de interferencia; TIRF = fluorescencia de reflexión interna total; LED = diodo emisor de luz; ITIRF = iluminación TIRF; IGFP = fluorescencia GFP; Iinc = iluminación IRM; Iref = luz dispersa en la interfaz vidrio/agua; Iscat = luz dispersa del microtúbulo; IIRM = señal IRM (Interferencia de Iref y Iscat); R/T = reflejado/transmitido; LP600: filtro de paso largo (600 nm); DM = espejo dicroico; BS1 y BS2 = divisores de haz 1 y 2; M1, M2, M3, M4 = espejos; BP535/50 = paso de banda (535/50 nm); GFP = proteína fluorescente verde; GMPCPP = guanilil 5'-α,β-metilendifosfonato; PIB = difosfato de guanosina. Haga clic aquí para ver una versión más grande de esta figura.
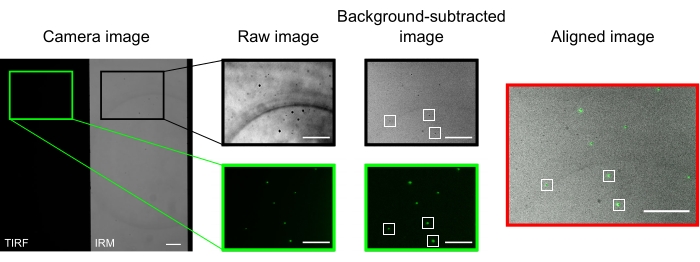
Figura 2: Sustracción de fondo y alineación de imágenes. Las imágenes TIRF (mitad izquierda) e IRM (mitad derecha) aparecen simultáneamente en dos mitades del mismo chip de cámara (imagen de cámara). La sustracción de fondo de la mediana temporal aumenta el contraste de las cuentas (imagen restada de fondo), que aparecen oscuras en IRM y brillantes en las imágenes TIRF. Las imágenes IRM y TIRF se alinean mediante traducción (derecha) en función de la localización de cuentas seleccionadas (rectángulos blancos). Barras de escala = 10 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Kymograph e instantáneas del movimiento de las quinesinas durante la contracción de los microtúbulos. El kymograph (izquierda) muestra eGFP-kinesina-1 (verde) caminando hacia el extremo superior del microtúbulo (gris oscuro). Se muestran instantáneas de las series temporales correspondientes (derecha). Las flechas blancas muestran moléculas individuales de quinesina-1. Haga clic aquí para ver una versión más grande de esta figura.
Archivo imageSplitterRegistration: Haga clic aquí para descargar este archivo.
Discusión
El estudio de la regulación de la dinámica de los microtúbulos por las proteínas asociadas a los microtúbulos (MAP) a menudo requiere imágenes simultáneas de los microtúbulos y los MAP. Las técnicas de microscopía de fluorescencia como TIRF generalmente se emplean para este propósito. Sin embargo, están limitados por los inconvenientes de las imágenes de fluorescencia, que incluyen el fotoblanqueo, el fotodaño y la necesidad de etiquetado de fluoróforos. Los métodos sin etiquetas, como IRM, son adecuados para visualizar microtúbulos, pero no son capaces de obtener imágenes de fluoróforos individuales. Este protocolo combina imágenes IRM sin etiqueta y microscopía TIRF para la obtención simultánea de imágenes de microtúbulos dinámicos y MAP.
La configuración de IRM emplea una fuente de iluminación LED filtrada a >600 nm, mientras que la configuración de TIRF utiliza un láser de 488 nm. Utilizamos un divisor de haz de placa de bajo costo para reflejar la luz de iluminación en la muestra y transmitir la señal recolectada al detector (Figura 1). Se eligió un divisor de haz con 10% de reflectancia y 90% de transmisión para minimizar la pérdida de la señal de una sola molécula. La pérdida del 90% en la intensidad de la luz de iluminación se compensa aumentando la potencia del láser de iluminación y el LED.
La separación espectral de las señales se logró utilizando un divisor de haz 90/10 (R/T) y dos filtros espectrales (paso largo 600 nm para IRM y paso de banda 535/50 nm para TIRF). Las señales IRM y TIRF separadas espectralmente se proyectan en dos mitades de un solo chip de cámara utilizando un conjunto de divisor de imágenes. El uso de un divisor de haz 90/10 sacrifica el 90% de la señal IRM, pero esto se compensa aumentando la intensidad de la fuente de iluminación LED. Un espejo dicroico también podría usarse aquí para separar las señales IRM y TIRF de manera más eficiente. Las microperlas fluorescentes incluidas en los ensayos permiten una alineación precisa de las imágenes TIRF e IRM y sirven como referencia para enfocar el objetivo.
El elemento óptico más crítico en este protocolo es el objetivo de alta apertura numérica (NA). Esto es esencial no solo para lograr una reflexión interna total, sino también para maximizar la eficiencia de la colección y el contraste de la imagen. La calidad de las imágenes obtenidas también depende de la limpieza de la superficie del vidrio y la adquisición de una imagen de fondo clara para corregir la iluminación no uniforme y eliminar las características estáticas. Para las imágenes IRM, recomendamos usar iluminación de longitud de onda larga (>600 nm) para minimizar el fotodaño de microtúbulos y proteínas. Esto es particularmente importante si se utiliza una fuente de luz LED blanca, en cuyo caso se debe incluir un filtro de paso largo para eliminar cualquier luz UV.
Este protocolo permite obtener imágenes de alta velocidad sin etiquetas de microtúbulos dinámicos y visualización simultánea de alta resolución de MAPs fluorescentes17. En comparación con la técnica de conmutación de cubos de filtro, que alterna entre la captura de imágenes de microtúbulos y MAP, esta configuración es capaz de velocidades de fotogramas mucho más altas porque no depende de la rotación física de un cubo de filtro. En comparación con las técnicas de imagen TIRF de dos colores, esta técnica emplea una configuración óptica menos exigente y evita la necesidad de etiquetado fluoróforo de microtúbulos. Las principales limitaciones de esta configuración se deben a las imágenes TIRF de los MAP; la velocidad de fotogramas está limitada por el tiempo de exposición de un fluoróforo, y el fotoblanqueo de fluoróforos sigue siendo una posibilidad. No obstante, este protocolo mejora las técnicas existentes porque utiliza TIRF solo cuando es necesario (es decir, para visualizar MAP pero no microtúbulos) y logra la mayor velocidad posible dentro de los límites de TIRF. Las mejoras adicionales son posibles solo si tanto los microtúbulos como los MAP se visualizan a través de una técnica interferométrica, pero esto requiere etiquetar los MAP con nanopartículas metálicas, lo que tiene sus limitaciones y desafíos experimentales.
Para demostrar las capacidades de esta técnica, visualizamos simultáneamente dos procesos dinámicos rápidos a través de IRM y TIRF: la contracción de un microtúbulo y el caminar de una molécula de quinesina fluorescente. Esta técnica se ha empleado previamente para visualizar la rápida difusión de la espastina en microtúbulos en contracción5. Más allá de esta aplicación a MAP y microtúbulos, este protocolo se puede utilizar para visualizar moléculas fluorescentes individuales simultáneamente con cualquier estructura macromolecular lo suficientemente masiva como para ser visualizada a través de IRM, como una membrana celular o filamento de actina.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Agradecemos al laboratorio de Thierry Emonet por compartir equipos de salas limpias. Agradecemos a Yin-Wei Kuo por preparar la eGFP-kinesina purificada utilizada en este estudio. Y.T. reconoce el apoyo de la Fundación Alexander von Humboldt a través de la Beca de Investigación Feodor Lynen. Este trabajo fue apoyado por NIH Grant R01 GM139337 (a J.H.).
Materiales
| Name | Company | Catalog Number | Comments |
| 10/90 (R/T) beam splitter | Thorlabs | BSN10R | Plane beam splitter used in the excitation beam path |
| 90/10 (R/T) beam splitter | Thorlabs | BSX10R | Plane beam splitter used in the image splitter |
| Anti-biotin antibody | Sigma-Aldrich | B3640 | Used to functionalize surface for bonding biotinylated microtubules |
| ATP | Sigma-Aldrich | FLAAS | Used for preparing the motility buffer |
| Band-pass filter | Newport | HPM535-50 | Hard-coated band-pas filter is used in image splitter to image GFP signal |
| Biotinylated tubulin | Cytoskeleton, Inc. | T333P-A | Used to bind microtubule seeds to the surface of the flow channel |
| Casein | Sigma-Aldrich | C8654 | Casein is used to block nonspesific interactions |
| Catalase | Sigma-Aldrich | C9322 | Used for preparing the oxygen scavenger solution |
| Desiccator chamber | Southern Labware | 55207 | Desiccator is used for degasing the resin |
| DTT | Sigma-Aldrich | D0632 | Used for preparing the oxygen scavenger solution |
| EGTA | Sigma-Aldrich | E4378 | Used for preparing the BRB80 buffer |
| Glucose | Sigma-Aldrich | G7528 | Used for preparing the oxygen scavenger solution |
| Glucose oxidase | Sigma-Aldrich | G7016 | Used for preparing the oxygen scavenger solution |
| GMPCPP nucleotides | Jena Bioscience | NU-405L | Used for the polymerization of stabilized microtubules |
| Image splitter | Teledyne-Photometrics Imaging | OptoSplit II | An image splitter is used to split the images spatially. When buying, make sure about the compatibility with the microscope |
| ImajeJ2 | NIH | ImageJ2 is used for image analysis | |
| Kinesin | prepared in house (see references in text) | ||
| LDPE tubing | Thomas Scientific | 9565S22 | Non-toxic, lower density polyethylene micro bore tubing is used for fluid transfers |
| LED light source | Lumencor | Lumencor sola light engine | Used for IRM imaging |
| Long-pass filters | Thorlabs | FELH0600 | Hard-coated long pass filters. One is used as an excitation filter, other is used in image splitter to image IRM signal |
| Magnesium chloride | Sigma-Aldrich | 63068 | Used for preparing the BRB80 buffer |
| Micoscope objective heater | okolab | H401-T-DUAL-BL | Used to keep sample temperature constant via heating the objective |
| Microscope | Nikon | Ti-Eclipse | An inverted microscope that is used in the experiments |
| Na-PIPES | Sigma-Aldrich | P2949 | Used for preparing the BRB80 buffer |
| Nikon CFI Apochromat TIRF 100XC Oil objective | Nikon | MRD01991 | The imaging objective has 1.49 numerical aperture |
| PDMS and curing agent | Electron Microscopy Sciences | Sylgard 184 (24236-10) | Used for contructing the flow channels |
| PDMS puncher | World Precision Instruments LLC | 504529 | Used to punch hole into the PDMS |
| Plasma cleaner | Harrick Plasma | DPC-32G | The air plasma is used to remove organic contamination from the PDMS surface |
| Poloxamer 407 (commercial name Pluronic F-127) | Sigma-aldrich | P2443 | Used for channel surface passivation to minimize nonspecific binding |
| Sodium hydroxide | Sigma-Aldrich | 567530 | Used for preparing the BRB80 buffer |
| Stabilized microtubules | prepared in house (see references in text) | ||
| Table-top ultracentrifuge | Beckman Coulter | 340400 | Used to spin down microtubule seeds |
| TetraSpeck beads | ThermoFisher Scientific | T7279 | Used as a reference for aligning images |
| Zyla 4.2 camera | Andor | Zyla 4.2 | Scientific CMOS camera with spesifications: 2048 x 2048 pixels (6.5 μm pixel size) with quantum efficiency of 72% and 16 bit dynamic range |
Referencias
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biology. 95, 221-245 (2010).
- Axelrod, D. Chapter 7: Total internal reflection fluorescence microscopy. Methods in Cell Biology. 89, 169-221 (2008).
- Kuo, Y. -. W., Trottier, O., Mahamdeh, M., Howard, J. Spastin is a dual-function enzyme that severs microtubules and promotes their regrowth to increase the number and mass of microtubules. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5533-5541 (2019).
- Hinrichs, M. H., et al. Tau protein diffuses along the microtubule lattice. The Journal of Biological Chemistry. 287 (46), 38559-38568 (2012).
- Al-Hiyasat, A., Tuna, Y., Kuo, Y. -. W., Howard, J. Herding of proteins by the ends of shrinking polymers. arXiv:. , (2021).
- Guo, H., et al. Mechanism and dynamics of breakage of fluorescent microtubules. Biophysical Journal. 90 (6), 2093-2098 (2006).
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Taylor, R. W., Sandoghdar, V., Astratov, V. . Interferometric scattering (iSCAT) microscopy and related techniques. in Label-free super-resolution microscopy. , 25-65 (2019).
- Young, G., Kukura, P. Interferometric scattering microscopy). Annual Review of Physical Chemistry. 70 (1), 301-322 (2019).
- Koch, M. D., Rohrbach, A. Label-free imaging and bending analysis of microtubules by ROCS microscopy and optical trapping. Biophysical Journal. 114 (1), 168-177 (2018).
- Kandel, M. E., Teng, K. W., Selvin, P. R., Popescu, G. Label-free imaging of single microtubule dynamics using spatial light interference microscopy. ACS Nano. 11 (1), 647-655 (2017).
- Mahamdeh, M., Simmert, S., Luchniak, A., Schäffer, E., Howard, J. Label-free high-speed wide-field imaging of single microtubules using interference reflection microscopy. Journal of Microscopy. 272 (1), 60-66 (2018).
- Mahamdeh, M., Howard, J. Implementation of interference reflection microscopy for label-free, high-speed imaging of microtubules. Journal of Visualized Experiments: JoVE. (150), e59520 (2019).
- Voldman, J., Gray, M. L., Schmidt, M. A. Microfabrication in biology and medicine. Annual Review of Biomedical Engineering. 1, 401-425 (1999).
- Rogers, K. R., et al. KIF1D is a fast non-processive kinesin that demonstrates novel K-loop-dependent mechanochemistry. The EMBO Journal. 20 (18), 5101-5113 (2001).
- Leduc, C., Ruhnow, F., Howard, J., Diez, S. Detection of fractional steps in cargo movement by the collective operation of kinesin-1 motors. Proceedings of the National Academy of Sciences of the United States of America. 104 (26), 10847-10852 (2007).
- Tuna, Y., Al-Hiyasat, A., Howard, J. Imaging dynamic microtubules and associated proteins by Simultaneous Interference-Reflection and Total-Internal-Reflection-Fluorescence Microscopy. arXiv. , (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados