Method Article
Microscopia a fluorescenza a riflessione interna simultanea e riflessione interna totale per l'imaging di microtubuli dinamici e proteine associate
In questo articolo
Riepilogo
Presentiamo un protocollo per l'implementazione della microscopia a riflessione di interferenza e della microscopia a riflessione totale interna-fluorescenza per l'imaging simultaneo di microtubuli dinamici e proteine associate a microtubuli marcati fluorescenti.
Abstract
Diverse tecniche sono state impiegate per la visualizzazione diretta dei filamenti citoscheletrici e delle proteine associate. La microscopia a riflessione totale interna (TIRF) ha un elevato rapporto segnale-sfondo, ma soffre di fotosbiancamento e fotodanneggiamento delle proteine fluorescenti. Tecniche prive di etichette come la microscopia a riflessione di interferenza (IRM) e la microscopia a dispersione interferometrica (iSCAT) aggirano il problema del fotosbiancamento ma non possono visualizzare facilmente le singole molecole. Questo documento presenta un protocollo per combinare IRM con un microscopio TIRF commerciale per l'imaging simultaneo di proteine associate a microtubuli (MAP) e microtubuli dinamici in vitro. Questo protocollo consente l'osservazione ad alta velocità delle MAP che interagiscono con microtubuli dinamici. Ciò migliora le configurazioni TIRF a due colori esistenti eliminando sia la necessità di etichettatura dei microtubuli che la necessità di diversi componenti ottici aggiuntivi, come un secondo laser di eccitazione. Entrambi i canali vengono ripresi sullo stesso chip della fotocamera per evitare problemi di registrazione delle immagini e di sincronizzazione dei fotogrammi. Questa configurazione è dimostrata visualizzando singole molecole di chinesina che camminano su microtubuli dinamici.
Introduzione
La microscopia a riflessione totale interna (TIRF) è comunemente impiegata per la visualizzazione di singole molecole fluorescenti. Rispetto all'imaging in epifluorescenza, TIRF raggiunge una soppressione dello sfondo superiore, consentendo la localizzazione ad alta risoluzione e il tracciamento di singoli fluorofori. Per questo motivo, TIRF è il metodo preferito per visualizzare proteine associate a microtubuli marcate fluorescenti ed è spesso utilizzato per visualizzare i microtubuli 1,2.
Per studiare la regolazione della dinamica dei microtubuli da parte delle MAP, è spesso necessario visualizzare contemporaneamente sia i microtubuli che i MAP. La maggior parte dei metodi esistenti per questo scopo sono costosi o soffrono di inconvenienti tecnici. Il TIRF simultaneo a due colori, ad esempio, richiede due laser di eccitazione e due telecamere. Oltre al costo elevato, la necessità di telecamere separate pone problemi di sincronizzazione dei fotogrammi e di registrazione delle immagini. Questa necessità può essere aggirata se si utilizza un cubo filtrante rotante per passare fisicamente da un laser di eccitazione all'altro in fotogrammi consecutivi3. In tale configurazione, è possibile utilizzare un singolo chip della fotocamera e i fotogrammi si alternano tra immagini di microtubuli e MAP. Questa tecnica, tuttavia, è limitata dalla velocità del cambio di filtro, che in genere limita la frequenza dei fotogrammi a meno di 0,5 fotogrammi al secondo3 (fps). Tale frame rate è insufficiente per risolvere processi dinamici veloci, come il restringimento di un microtubulo che si verifica ad una velocità fino a 500 nm/s, la camminata di una chinesina ad una velocità dell'ordine di 800 nm/s, o la diffusione di un MAP che si verifica con coefficienti di diffusione superiori a 0,3 μm2/s4. Ciò è particolarmente problematico quando si tracciano le posizioni relative di due bersagli in movimento in ciascun canale, come la posizione di un MAP rispetto alla posizione di una punta di microtubuli in movimento5.
Oltre a questi vincoli ottici, la microscopia TIRF a due colori richiede che i MAP e i microtubuli siano etichettati con diversi fluorofori i cui spettri di emissione sono sufficientemente separati. L'etichettatura fluorescente della tubulina può alterare la dinamica dei microtubuli6 e la fotosbiancamento dei fluorofori limita la velocità di imaging7. A causa di questi problemi, sono state sviluppate tecniche di imaging senza etichetta per visualizzare i microtubuli. Questi includono la microscopia a dispersione interferometrica (iSCAT)8,9, la microscopia a dispersione coerente rotante (ROCS)10, la microscopia a interferenza della luce spaziale (SLIM)11 e la microscopia a riflessione di interferenza (IRM)12,13. Queste tecniche consentono un'imaging veloce senza etichette di microtubuli senza gli inconvenienti dell'imaging a fluorescenza, ma non possono essere utilizzate per visualizzare singole MAP.
Di queste tecniche senza etichette, IRM si distingue per il suo basso costo e le sue modeste esigenze di strumentazione. Abbiamo recentemente presentato un protocollo per combinare IRM con un microscopio TIRF commerciale, consentendo di visualizzare microtubuli e MAP fluorescenti in fotogrammi alternati 3,13. Questo documento presenta un protocollo per modificare questa configurazione per acquisire contemporaneamente immagini TIRF e IRM su un singolo chip della fotocamera. Ciò comporta l'aggiunta di uno splitter a fascio economico nel percorso di eccitazione per illuminare contemporaneamente il campione con un laser TIRF e una sorgente luminosa LED IRM. Uno splitter di immagini commerciale modificato viene utilizzato per separare spettralmente i segnali TIRF e IRM e proiettarli su metà separate dello stesso chip della fotocamera. Impieghiamo anche un sistema microfluidico che consente il rapido scambio di reagenti durante l'imaging. Questo protocollo descrive come questa configurazione può essere utilizzata per l'immagine di microtubuli dinamici e MAP. La capacità dell'apparato è dimostrata presentando la prima visualizzazione delle proteine kinesin-1 che camminano su microtubuli restringenti, che viene catturata ad un frame rate di 10 s-1.
Protocollo
1. Preparazione delle camere di flusso
NOTA: Le camere di flusso microfluidiche saranno costruite aderendo microcanali di polidimetilsilossano (PDMS) a un vetro di copertura pulito e funzionalizzato. I microcanali saranno fusi in uno stampo master.
-
Preparazione dei canali PDMS
- Preparare vetri di copertura puliti e/o funzionalizzati con chimica superficiale appropriata al test specifico da fotografare.
NOTA: per i saggi di motilità della kinesina, vengono utilizzati vetri di copertura silanizzati puliti con piranha. Questi sono preparati come descritto in Gell et. al.1 In alternativa, una procedura più semplice consiste nel sonicare gli occhiali di copertura in isopropanolo seguito da metanolo per 3 cicli di 20 minuti. - Per preparare uno stampo master, tagliare strisce di nastro fisso su un solo lato alla dimensione del canale di flusso desiderata. Far aderire le strisce sul fondo di una capsula di Petri di 10 cm, disponendole da un lato all'altro con una distanza di almeno 1 cm tra le strisce.
NOTA: se sono richieste dimensioni precise del canale, lo stampo può essere fabbricato su wafer di silicio utilizzando la fotolitografia14. - Per preparare il polimero PDMS, combinare l'agente polimerizzante e l'elastomero di base in un rapporto di massa 1:10. Mescolare per 2 min.
NOTA: Questo rapporto di miscelazione può essere variato per regolare la rigidità del polimero. Un rapporto più elevato tra base e agente polimerizzante si traduce in un polimero più morbido. - Degassare la miscela in una camera a vuoto fino a quando tutte le bolle scompaiono.
- Versare il composto sullo stampo master in uno strato di circa 0,5 cm di spessore, avendo cura di evitare di creare bolle.
- Cuocere il composto in forno preriscaldato a 70 °C per 40 min.
NOTA: potrebbe essere necessario un tempo di polimerizzazione più lungo se il blocco PDMS è spesso (>1 cm). Continuare a riscaldare con incrementi di 5 minuti fino a quando non è completamente indurito. - Ritaglia le regioni strutturate del polimero. Forare i fori a ciascuna estremità del canale utilizzando un punzonatore PDMS.
NOTA: in questo protocollo, il diametro del foro è impostato su 0,75 mm e può essere regolato in base alle portate richieste. I canali PDMS possono essere conservati in ambienti asciutti per periodi prolungati, ma devono essere puliti prima dell'uso. - Pulire il lato strutturato del blocco PDMS. Utilizzare nastro adesivo per rimuovere particelle di grandi dimensioni. Risciacquare con isopropanolo e poi metanolo. Ripeti questi risciacqui 3 volte, risciacqua con acqua ultrapura e asciuga la superficie.
- Il plasma pulisce il PDMS usando ossigeno o plasma d'aria.
NOTA: in questo protocollo viene utilizzato plasma d'aria da 18 W. - Posizionare il PDMS pulito al plasma su un vetro di copertura opportunamente pulito e riscaldare su una piastra calda a 80 °C per 15 minuti.
NOTA: La resina epossidica può essere applicata ai lati del blocco PDMS per aderire meglio al vetro di copertura. - Inserire tubi in polietilene a bassa densità (LDPE) di dimensioni appropriate nei fori. Collegare il tubo di uscita a una siringa da 0,5 ml.
NOTA: in questo protocollo, i tubi con un diametro interno di 0,023 pollici sono collegati al PDMS tramite un adattatore metallico di diametro esterno di 0,025 pollici. - Convogliare le soluzioni nei microcanali immergendo il tubo di ingresso nella soluzione e disegnando il volume richiesto con la siringa.
- Preparare vetri di copertura puliti e/o funzionalizzati con chimica superficiale appropriata al test specifico da fotografare.
2. Configurazione ottica
-
Modifica del microscopio (Figura 1)
- Modificare un microscopio TIRF per abilitare l'imaging IRM13. Sostituire lo splitter del fascio 50/50 (Reflectance (R)/Transmission (T)) utilizzato nella ruota filtrante del microscopio con uno splitter a fascio 10/90 (R/T).
- Inserire uno splitter di immagini tra la fotocamera e il microscopio.
- Nel cubo di filtro dello splitter dell'immagine, inserire uno splitter del fascio 10/90 (R/T). Posizionare un filtro long-pass da 600 nm davanti al fascio riflesso e un filtro di emissione di fluorescenza appropriato davanti al fascio trasmesso.
NOTA: gli splitter a fascio con diversi rapporti R/T possono essere utilizzati per regolare le frazioni della luce di emissione IRM e TIRF che vengono raccolte. - Allineare lo splitter di immagini in base alle specifiche del produttore per separare spazialmente i segnali TIRF e IRM sul chip della fotocamera.
NOTA: la separazione spaziale dei segnali è necessaria perché il segnale TIRF dei fluorofori tipici è molto più debole del segnale IRM di un microtubulo e non sarebbe rilevabile se i due segnali fossero sovrapposti.
3. Imaging di microtubuli dinamici e singole molecole di Kinesin
- Funzionalizzazione e passivazione delle superfici
- Flusso tampone BRB80 (80 mM Na-PIPES, 1 mM EGTA, 1 mM MgCl2, titolato a pH 7,8 con NaOH) nella camera di reazione.
- Flusso soluzione di antibiotina diluita a 0,025 mg/mL in BRB80 e incubare a temperatura ambiente per 10 min.
- Lavare il canale con BRB80.
- Flusso in soluzione F-127 (1% Pluronic F-127 (p/v) disciolto in BRB80 durante la notte) e incubazione per almeno 20 minuti per la passivazione superficiale.
NOTA: Se al posto dei vetri di copertura silanizzati silanizzati silanati si passivate con caseina in BRB80 per >20 minuti a temperatura ambiente. - Lavare il canale con BRB80.
- Preparazione per l'imaging
- Se è necessario il controllo della temperatura, utilizzare un riscaldatore obiettivo e impostarlo alla temperatura corretta.
NOTA: In questo protocollo, tutti gli esperimenti vengono eseguiti a 28 °C. - Posizionare il campione sullo stadio del microscopio e accendere la sorgente luminosa di epiilluminazione (>600 nm) per l'imaging IRM.
NOTA: in questo protocollo, viene utilizzata una sorgente luminosa a LED bianca con un filtro long-pass da 600 nm. - Focalizzare il microscopio sulla superficie del campione. Cercare il piano focale corretto vicino all'interfaccia PDMS-solution.
NOTA: in IRM, l'interno acquoso del canale dovrebbe apparire molto più luminoso del polimero PDMS. - Scegliete un campo visivo vicino al centro del canale.
- Preparare una soluzione di microsfere fluorescenti da 0,1 μm in BRB80 (densità: 109 perline/mL, corrispondente a una diluizione di 200 volte per le perline utilizzate in questo protocollo).
- Flusso in almeno un volume di canale della soluzione di microsfere.
- Monitorare la reazione tramite IRM. Attendere che le microsfere atterrino gradualmente sulla superficie. Quando viene raggiunta la densità desiderata delle microsfere, lavare via l'eccesso con BRB80.
- Se è necessario il controllo della temperatura, utilizzare un riscaldatore obiettivo e impostarlo alla temperatura corretta.
- Semi di microtubulo stabilizzati con guanililil 5'-α,β-metilendifosfonato (GMPCPP) in crescita
- In un tubo di centrifuga da 0,6 mL, preparare 50 μL di una soluzione contenente 1 mM GMPCPP, 1 mM MgCl2 e 2 μM di tubulina biotinilata (stechiometria di etichettatura al 5-10%) in BRB80.
NOTA: La corretta stechiometria di etichettatura può essere ottenuta combinando la tubulina biotinilata ad alta densità con la tubulina bovina non etichettata nel rapporto corretto. - Incubare la soluzione su ghiaccio per 5 minuti, quindi incubare a 37 °C per 12,5 minuti.
NOTA: La lunghezza dei semi può essere controllata regolando il tempo di polimerizzazione. - Interrompere la polimerizzazione aggiungendo 100 μL di BRB80 a temperatura ambiente.
- Girare la soluzione in un ultracentrifuga a temperatura ambiente (126.000 x g, 5 min). Scartare il surnatante usando una pipetta per rimuovere la tubulina non polimerizzata.
NOTA: in questo protocollo viene utilizzato un ultracentrifuga pneumatico. - Aggiungere 200 μL di BRB80 a temperatura ambiente al pellet. Risospesciare il pellet pipettando delicatamente ma accuratamente. Utilizzare una pipetta da 200 μL con una punta tagliata per ridurre la cesoiatura dei microtubuli.
- In un tubo di centrifuga da 0,6 mL, preparare 50 μL di una soluzione contenente 1 mM GMPCPP, 1 mM MgCl2 e 2 μM di tubulina biotinilata (stechiometria di etichettatura al 5-10%) in BRB80.
- Crescente guanosina difosfato dinamico (GDP)-tubulina "estensioni"
NOTA: I semi saranno immobilizzati sulla superficie antibiotina del canale di flusso. Le "estensioni" dinamiche GTP/PIL saranno coltivate dalle estremità dei semi immobilizzati.- Diluire i semi 20 volte in BRB80. Far scorrere i semi diluiti nella camera di reazione.
- Monitorare la reazione tramite IRM. Attendi che i semi gradualmente "atterrino" sulla superficie e si leghino ad essa. Quando viene raggiunta la densità desiderata dei semi, lavare via l'eccesso con BRB80.
- Preparare una miscela di estensione di microtubuli: 12 μM di tubulina non etichettata, 1 mM GTP, 5 mM di ditiotreitolo (DTT) nel tampone BRB80.
- Flusso in almeno un volume di canale della miscela di estensione. Assicurarsi che la temperatura di reazione sia di 28 °C.
- Attendere che le estensioni dei microtubuli crescano dai semi nel tempo.
NOTA: la lunghezza dello stato stazionario viene solitamente raggiunta in meno di 20 minuti. - Utilizzare i microtubuli dinamici per l'imaging. Aggiungere e visualizzare MAP fluorescenti sui microtubuli, come descritto nel passaggio 3.5 per kinesin-1.
NOTA: poiché i microtubuli sono legati alla superficie, sono facilmente visibili da TIRF.
- Saggio di motilità della kinesina
NOTA: questo passaggio descrive un protocollo per la visualizzazione della kinesin-1 marcata con proteina fluorescente verde mobile (GFP) su microtubuli restringenti. Un costrutto troncato di kinesin-1 di ratto fuso con eGFP (rKin430-eGFP) è stato espresso e purificato, come descritto in precedenza15,16.- Preparare il tampone di motilità: 1 mM di ATP e 0,2 mg/mL di caseina in BRB80.
- Diluire kinesin-eGFP in tampone di motilità a 10 nM.
- Preparare una soluzione di scavenger di ossigeno 2x per contrastare il fotosbiancamento ossidativo (80 mM di glucosio, 80 mg/mL di glucosio ossidasi, 32 mg/mL di catalasi, 0,2 mg/mL di caseina, 20 mM di DTT) integrata con 2 mM di ATP.
- Combinare 10 parti di scavenger di ossigeno, 9 parti di BRB80 e 1 parte di 10 nM kinesin-eGFP per una concentrazione finale di kinesina di 0,5 nM.
NOTA: il volume totale deve essere almeno 1,5 volte più grande del volume del canale. - Impostare le impostazioni di imaging sul software del microscopio.
NOTA: in questo protocollo, i video vengono registrati a 10 fps con un tempo di esposizione di 100 ms. L'intensità del laser è ~0,05 kW/cm2. - Iniziare l'imaging e far fluire la soluzione di kinesina nella camera.
- Al termine della misurazione, registrare un breve video (~5 s) in cui il palco viene lentamente tradotto in un movimento circolare o laterale. Usa la proiezione mediana di questo video come immagine di sfondo e sottraila dalle misurazioni grezze.
4. Elaborazione e analisi delle immagini
NOTA: l'elaborazione delle immagini è stata effettuata utilizzando NIH ImageJ2 (imagej.nih.gov/ij/). È stata sviluppata una macro per automatizzare la suddivisione e l'allineamento dei canali TIRF e IRM. Questa macro richiede l'installazione del plug-in GaussFit_OnSpot (disponibile nel repository dei plugin ImageJ).
- Dalla registrazione di sfondo, crea una proiezione mediana in ImageJ facendo clic su Image | Stack | Progetto Z.
- Sottrarre la proiezione di sfondo mediana dai dati dell'immagine grezza facendo clic su Elabora | Calcolatore di immagini.
NOTA: assicurarsi di selezionare l'opzione "Risultato a 32 bit (float)". - Per la registrazione delle immagini, scegliere una raccolta di microsfere vicino al microtubulo di interesse e utilizzarle per allineare le immagini TIRF e IRM.
- Per ogni tallone di questa raccolta, utilizzare lo strumento di selezione multipunto per contrassegnare la posizione approssimativa nel canale TIRF e quindi la posizione corrispondente nel canale IRM.
NOTA: ad esempio, se sono presenti due perline (1 e 2), la selezione multipunto avrà quattro punti nell'ordine seguente: (1) perla 1 in TIRF, (2) perla 1 in IRM, (3) perla 2 in TIRF, (4) perla 2 in IRM. - Eseguire la macro ImageJ fornita (ImageSplitterRegistration.ijm).
NOTA: questo automatizza i seguenti passaggi: i) stimare la posizione centrale di ciascun tallone adattandola a un gaussiano; ii) per ogni tallone, calcolando il vettore di spostamento che separa il centro nel canale TIRF dal centro nel canale IRM; iii) fare la media di questo vettore di spostamento su tutte le perline; iv) suddividere i canali TIRF e IRM in immagini separate; v) tradurre l'immagine TIRF con il vettore di spostamento medio calcolato in iii; vi) sovrapposizione delle immagini TIRF e IRM in un file di .tiff multicanale.
Risultati
La configurazione ottica è schematizzata nella Figura 1. Sia l'illuminazione IRM che la luce di eccitazione TIRF sono dirette all'apertura posteriore dell'obiettivo (100x, NA: 1,49) tramite uno splitter a fascio 10/90 (R/T) (BS1). Il segnale emesso passa attraverso lo stesso beam splitter (BS1) e viene riflesso allo splitter dell'immagine tramite uno specchio (M1). I componenti dello splitter di immagini (racchiusi con linee tratteggiate nella Figura 1) separano i segnali IRM e TIRF tramite uno splitter a fascio 90/10 (R/T) (BS2) insieme a filtri spettrali appropriati. Infine, le immagini divise vengono proiettate sul chip della fotocamera per la visualizzazione. L'allineamento dello splitter di immagine è tale che i segnali TIRF e IRM vengono proiettati su metà separate del chip.
In un microscopio ben allineato, l'immagine della fotocamera dovrebbe visualizzare un'immagine divisa a metà, come illustrato nella Figura 2. I microtubuli legati alla superficie dovrebbero essere facilmente visibili nel canale IRM13 e la kinesina fluorescente dovrebbe essere visibile nel canale TIRF.
Le microsfere utilizzate per allineare e registrare i due canali appaiono come punti luminosi nelle immagini TIRF e punti scuri nelle immagini IRM. Sebbene le perline siano visibili nei dati grezzi, la sottrazione dello sfondo migliora significativamente il contrasto (Figura 2). L'immagine di sfondo utilizzata per la sottrazione è la mediana temporale di un video registrato con un palcoscenico in movimento. Come descritto nel protocollo, l'allineamento delle immagini è stato eseguito selezionando una raccolta di perline vicino alla regione di interesse ed eseguendo la macro fornita (imageSplitterRegistration.ijm). La macro adatta i punti ai gaussiani e allinea le immagini riducendo al minimo la distanza media tra i punti centrali degli adattamenti in ciascun canale. Questo processo è rappresentato nella Figura 2, che mostra un buon allineamento delle microsfere fluorescenti (verde nel canale TIRF, nero nel canale IRM).
Infine, le capacità di questa configurazione di imaging simultaneo sono dimostrate osservando singole molecole di chinesina che camminano verso le estremità restringenti dei microtubuli. La Figura 3 mostra un kymograph di molecole di kinesina marcate con eGFP (verde) che camminano su un microtubulo che si restringe (grigio). Viene inoltre presentata una serie di istantanee della registrazione da cui è stato generato il kymograph.
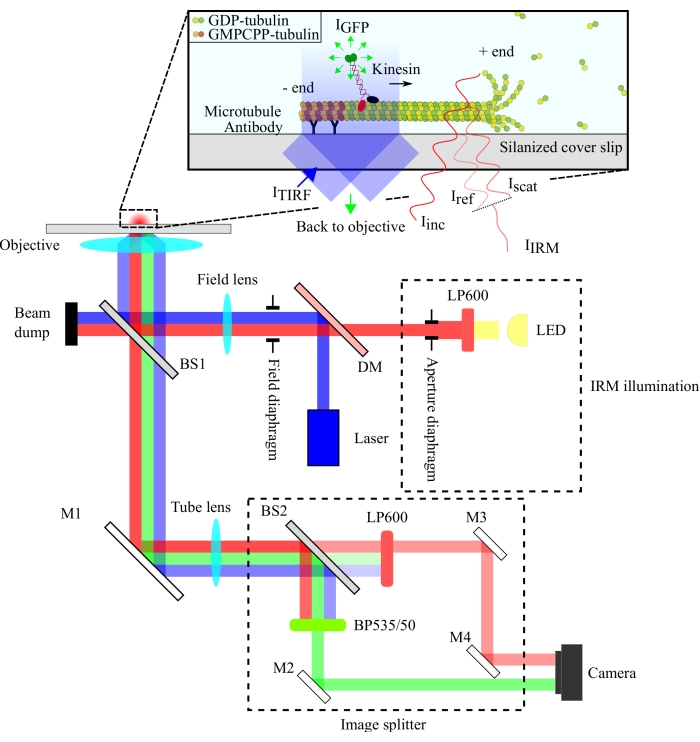
Figura 1: Rappresentazione schematica del setup ottico per l'imaging simultaneo IRM e TIRF della motilità della kinesina. L'epiilluminazione da una sorgente luminosa a LED passa attraverso il diaframma di apertura e raggiunge lo splitter del fascio 10/90 (R/T) (BS1). Lo splitter del fascio riflette parzialmente la luce rossa dell'illuminazione IRM e la luce di eccitazione TIRF da 488 nm fino all'obiettivo di illuminare il campione. Il segnale del campione viene raccolto dallo stesso obiettivo e diretto all'assemblaggio di divisione dell'immagine dove le immagini IRM e TIRF sono separate spazialmente dallo splitter del fascio 90/10 (R/T) (BS2). I segnali vengono quindi filtrati spettralmente prima di raggiungere il chip della telecamera. Abbreviazioni: IRM = microscopia a riflessione di interferenza; TIRF = fluorescenza totale-interna-riflessione; LED = diodo emettitore di luce; ITIRF = illuminazione TIRF; IGFP = fluorescenza GFP; Iinc = illuminazione IRM; Iref = luce diffusa all'interfaccia vetro/acqua; Iscat = luce diffusa dal microtubulo; IIRM = segnale IRM (Interferenza di Iref e Iscat); R/T = riflesso/trasmesso; LP600: filtro a passaggio lungo (600 nm); DM = specchio dicroico; BS1 e BS2 = spaccafasci 1 e 2; M1, M2, M3, M4 = specchi; BP535/50 = passaggio di banda (535/50 nm); GFP = proteina fluorescente verde; GMPCPP = guanilil 5'-α,β-metilendifosfonato; PIL = guanosina difosfato. Fare clic qui per visualizzare una versione più grande di questa figura.
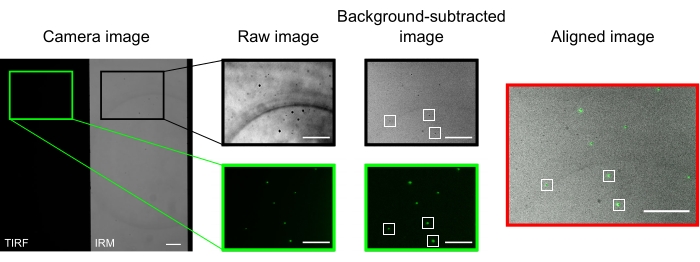
Figura 2: Sottrazione dello sfondo e allineamento dell'immagine. Le immagini TIRF (metà sinistra) e IRM (metà destra) vengono visualizzate contemporaneamente su due metà dello stesso chip della fotocamera (immagine della fotocamera). La sottrazione di sfondo mediana temporale aumenta il contrasto delle perline (immagine sottratta dallo sfondo), che appaiono scure in IRM e luminose nelle immagini TIRF. Le immagini IRM e TIRF sono allineate mediante traduzione (a destra) in base alla localizzazione di perline selezionate (rettangoli bianchi). Barre della scala = 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Kymograph e istantanee del movimento di Kinesins durante il restringimento dei microtubuli. Il kymograph (a sinistra) mostra eGFP-kinesin-1 (verde) che cammina verso l'estremità più del microtubulo (grigio scuro). Vengono visualizzate le istantanee delle serie temporali corrispondenti (a destra). Le frecce bianche mostrano singole molecole di chinesina-1. Fare clic qui per visualizzare una versione più grande di questa figura.
ImageSplitterRegistration File: Fare clic qui per scaricare questo file.
Discussione
Lo studio della regolazione della dinamica dei microtubuli da parte delle proteine associate ai microtubuli (MAP) richiede spesso l'imaging simultaneo di microtubuli e MAP. Le tecniche di microscopia a fluorescenza come TIRF sono tipicamente impiegate per questo scopo. Tuttavia, sono limitati dagli svantaggi dell'imaging a fluorescenza, che includono fotosbiancamento, fotodanne e la necessità di etichettatura fluorofora. I metodi senza etichetta, come l'IRM, sono adatti per visualizzare i microtubuli ma non sono in grado di eseguire l'imaging di singoli fluorofori. Questo protocollo combina l'imaging IRM senza etichetta e la microscopia TIRF per l'imaging simultaneo di microtubuli dinamici e MAP.
La configurazione IRM utilizza una sorgente di illuminazione a LED filtrata a >600 nm, mentre la configurazione TIRF utilizza un laser a 488 nm. Abbiamo utilizzato uno splitter a fascio di piastre economico per riflettere la luce di illuminazione sul campione e trasmettere il segnale raccolto al rilevatore (Figura 1). È stato scelto uno splitter a fascio con il 10% di riflettanza e il 90% di trasmissione per ridurre al minimo la perdita del segnale a singola molecola. La perdita del 90% dell'intensità luminosa dell'illuminazione viene compensata aumentando la potenza del laser e del LED di illuminazione.
La separazione spettrale dei segnali è stata ottenuta utilizzando uno splitter a fascio 90/10 (R/T) e due filtri spettrali (long-pass 600 nm per IRM e band-pass 535/50 nm per TIRF). I segnali IRM e TIRF separati spettralmente vengono proiettati su due metà di un singolo chip della telecamera utilizzando un gruppo splitter di immagini. L'utilizzo di uno splitter a fascio 90/10 sacrifica il 90% del segnale IRM, ma questo viene compensato aumentando l'intensità della sorgente di illuminazione a LED. Uno specchio dicroico potrebbe anche essere utilizzato qui per separare i segnali IRM e TIRF in modo più efficiente. Le microsfere fluorescenti incluse nei test consentono un allineamento accurato delle immagini TIRF e IRM e fungono da riferimento per focalizzare l'obiettivo.
L'elemento ottico più critico in questo protocollo è l'obiettivo ad alta apertura numerica (NA). Questo è essenziale non solo per ottenere una riflessione interna totale, ma anche per massimizzare l'efficienza della collezione e il contrasto dell'immagine. La qualità delle immagini ottenute dipende anche dalla pulizia della superficie del vetro e dall'acquisizione di un'immagine di sfondo chiara per correggere l'illuminazione non uniforme e rimuovere le caratteristiche statiche. Per l'imaging IRM, si consiglia di utilizzare l'illuminazione a lunghezza d'onda lunga (>600 nm) per ridurre al minimo il fotodanno di microtubuli e proteine. Ciò è particolarmente importante se si utilizza una sorgente luminosa a LED bianca, nel qual caso è necessario includere un filtro passa-lungo per rimuovere la luce UV.
Questo protocollo consente l'imaging ad alta velocità senza etichette di microtubuli dinamici e la visualizzazione simultanea ad alta risoluzione di MAP fluorescenti17. Rispetto alla tecnica di commutazione del cubo del filtro, che alterna l'acquisizione di immagini di microtubuli e MAP, questa configurazione è in grado di frame rate molto più elevati perché non dipende dalla rotazione fisica di un cubo filtrante. Rispetto alle tecniche di imaging TIRF a due colori, questa tecnica impiega una configurazione ottica meno impegnativa ed elude la necessità di etichettare i microtubuli con fluorofori. Le principali limitazioni di questa configurazione sono dovute all'imaging TIRF delle MAP; il frame rate è limitato dal tempo di esposizione di un fluoroforo e la fotosbiancamento dei fluorofori rimane una possibilità. Tuttavia, questo protocollo migliora le tecniche esistenti perché utilizza TIRF solo quando necessario (cioè per visualizzare MAP ma non microtubuli) e raggiunge la massima velocità possibile entro i limiti di TIRF. Ulteriori miglioramenti sono possibili solo se sia i microtubuli che i MAP sono visualizzati tramite una tecnica interferometrica, ma ciò richiede l'etichettatura delle MAP con nanoparticelle metalliche, che ha i suoi limiti e sfide sperimentali.
Per dimostrare le capacità di questa tecnica, abbiamo visualizzato contemporaneamente due processi dinamici veloci tramite IRM e TIRF: il restringimento di un microtubulo e la camminata di una molecola di chinesina fluorescente. Questa tecnica è stata precedentemente impiegata per visualizzare la rapida diffusione della spastin sui microtubuli5 che si restringono. Oltre a questa applicazione a MAP e microtubuli, questo protocollo può essere utilizzato per visualizzare singole molecole fluorescenti contemporaneamente a qualsiasi struttura macromolecolare abbastanza massiccia da essere visualizzata tramite IRM, come una membrana cellulare o un filamento di actina.
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Ringraziamo il laboratorio di Thierry Emonet per aver condiviso le attrezzature delle camere bianche. Ringraziamo Yin-Wei Kuo per aver preparato la eGFP-kinesin purificata utilizzata in questo studio. Y.T. riconosce il sostegno della Fondazione Alexander von Humboldt attraverso la Feodor Lynen Research Fellowship. Questo lavoro è stato supportato da NIH Grant R01 GM139337 (a J.H.).
Materiali
| Name | Company | Catalog Number | Comments |
| 10/90 (R/T) beam splitter | Thorlabs | BSN10R | Plane beam splitter used in the excitation beam path |
| 90/10 (R/T) beam splitter | Thorlabs | BSX10R | Plane beam splitter used in the image splitter |
| Anti-biotin antibody | Sigma-Aldrich | B3640 | Used to functionalize surface for bonding biotinylated microtubules |
| ATP | Sigma-Aldrich | FLAAS | Used for preparing the motility buffer |
| Band-pass filter | Newport | HPM535-50 | Hard-coated band-pas filter is used in image splitter to image GFP signal |
| Biotinylated tubulin | Cytoskeleton, Inc. | T333P-A | Used to bind microtubule seeds to the surface of the flow channel |
| Casein | Sigma-Aldrich | C8654 | Casein is used to block nonspesific interactions |
| Catalase | Sigma-Aldrich | C9322 | Used for preparing the oxygen scavenger solution |
| Desiccator chamber | Southern Labware | 55207 | Desiccator is used for degasing the resin |
| DTT | Sigma-Aldrich | D0632 | Used for preparing the oxygen scavenger solution |
| EGTA | Sigma-Aldrich | E4378 | Used for preparing the BRB80 buffer |
| Glucose | Sigma-Aldrich | G7528 | Used for preparing the oxygen scavenger solution |
| Glucose oxidase | Sigma-Aldrich | G7016 | Used for preparing the oxygen scavenger solution |
| GMPCPP nucleotides | Jena Bioscience | NU-405L | Used for the polymerization of stabilized microtubules |
| Image splitter | Teledyne-Photometrics Imaging | OptoSplit II | An image splitter is used to split the images spatially. When buying, make sure about the compatibility with the microscope |
| ImajeJ2 | NIH | ImageJ2 is used for image analysis | |
| Kinesin | prepared in house (see references in text) | ||
| LDPE tubing | Thomas Scientific | 9565S22 | Non-toxic, lower density polyethylene micro bore tubing is used for fluid transfers |
| LED light source | Lumencor | Lumencor sola light engine | Used for IRM imaging |
| Long-pass filters | Thorlabs | FELH0600 | Hard-coated long pass filters. One is used as an excitation filter, other is used in image splitter to image IRM signal |
| Magnesium chloride | Sigma-Aldrich | 63068 | Used for preparing the BRB80 buffer |
| Micoscope objective heater | okolab | H401-T-DUAL-BL | Used to keep sample temperature constant via heating the objective |
| Microscope | Nikon | Ti-Eclipse | An inverted microscope that is used in the experiments |
| Na-PIPES | Sigma-Aldrich | P2949 | Used for preparing the BRB80 buffer |
| Nikon CFI Apochromat TIRF 100XC Oil objective | Nikon | MRD01991 | The imaging objective has 1.49 numerical aperture |
| PDMS and curing agent | Electron Microscopy Sciences | Sylgard 184 (24236-10) | Used for contructing the flow channels |
| PDMS puncher | World Precision Instruments LLC | 504529 | Used to punch hole into the PDMS |
| Plasma cleaner | Harrick Plasma | DPC-32G | The air plasma is used to remove organic contamination from the PDMS surface |
| Poloxamer 407 (commercial name Pluronic F-127) | Sigma-aldrich | P2443 | Used for channel surface passivation to minimize nonspecific binding |
| Sodium hydroxide | Sigma-Aldrich | 567530 | Used for preparing the BRB80 buffer |
| Stabilized microtubules | prepared in house (see references in text) | ||
| Table-top ultracentrifuge | Beckman Coulter | 340400 | Used to spin down microtubule seeds |
| TetraSpeck beads | ThermoFisher Scientific | T7279 | Used as a reference for aligning images |
| Zyla 4.2 camera | Andor | Zyla 4.2 | Scientific CMOS camera with spesifications: 2048 x 2048 pixels (6.5 μm pixel size) with quantum efficiency of 72% and 16 bit dynamic range |
Riferimenti
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biology. 95, 221-245 (2010).
- Axelrod, D. Chapter 7: Total internal reflection fluorescence microscopy. Methods in Cell Biology. 89, 169-221 (2008).
- Kuo, Y. -. W., Trottier, O., Mahamdeh, M., Howard, J. Spastin is a dual-function enzyme that severs microtubules and promotes their regrowth to increase the number and mass of microtubules. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5533-5541 (2019).
- Hinrichs, M. H., et al. Tau protein diffuses along the microtubule lattice. The Journal of Biological Chemistry. 287 (46), 38559-38568 (2012).
- Al-Hiyasat, A., Tuna, Y., Kuo, Y. -. W., Howard, J. Herding of proteins by the ends of shrinking polymers. arXiv:. , (2021).
- Guo, H., et al. Mechanism and dynamics of breakage of fluorescent microtubules. Biophysical Journal. 90 (6), 2093-2098 (2006).
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Taylor, R. W., Sandoghdar, V., Astratov, V. . Interferometric scattering (iSCAT) microscopy and related techniques. in Label-free super-resolution microscopy. , 25-65 (2019).
- Young, G., Kukura, P. Interferometric scattering microscopy). Annual Review of Physical Chemistry. 70 (1), 301-322 (2019).
- Koch, M. D., Rohrbach, A. Label-free imaging and bending analysis of microtubules by ROCS microscopy and optical trapping. Biophysical Journal. 114 (1), 168-177 (2018).
- Kandel, M. E., Teng, K. W., Selvin, P. R., Popescu, G. Label-free imaging of single microtubule dynamics using spatial light interference microscopy. ACS Nano. 11 (1), 647-655 (2017).
- Mahamdeh, M., Simmert, S., Luchniak, A., Schäffer, E., Howard, J. Label-free high-speed wide-field imaging of single microtubules using interference reflection microscopy. Journal of Microscopy. 272 (1), 60-66 (2018).
- Mahamdeh, M., Howard, J. Implementation of interference reflection microscopy for label-free, high-speed imaging of microtubules. Journal of Visualized Experiments: JoVE. (150), e59520 (2019).
- Voldman, J., Gray, M. L., Schmidt, M. A. Microfabrication in biology and medicine. Annual Review of Biomedical Engineering. 1, 401-425 (1999).
- Rogers, K. R., et al. KIF1D is a fast non-processive kinesin that demonstrates novel K-loop-dependent mechanochemistry. The EMBO Journal. 20 (18), 5101-5113 (2001).
- Leduc, C., Ruhnow, F., Howard, J., Diez, S. Detection of fractional steps in cargo movement by the collective operation of kinesin-1 motors. Proceedings of the National Academy of Sciences of the United States of America. 104 (26), 10847-10852 (2007).
- Tuna, Y., Al-Hiyasat, A., Howard, J. Imaging dynamic microtubules and associated proteins by Simultaneous Interference-Reflection and Total-Internal-Reflection-Fluorescence Microscopy. arXiv. , (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon