A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحليل الطيفي لقوة المجموعة بواسطة قوى القص
In This Article
Summary
التحليل الطيفي لقوة المجموعة (EFS) هو تقنية قوية للتكشف الميكانيكي والاستشعار في الوقت الفعلي لمجموعة من الهياكل الجزيئية الحيوية في المجالات الفيزيائية الحيوية والاستشعار الحيوي.
Abstract
توفر تقنيات الجزيء الواحد القائمة على مبادئ التألق والميكانوكيميائية حساسية فائقة في الاستشعار البيولوجي. ومع ذلك ، نظرا لعدم وجود قدرات إنتاجية عالية ، فإن تطبيق هذه التقنيات محدود في الفيزياء الحيوية. أظهر التحليل الطيفي لقوة المجموعة (EFS) إنتاجية عالية في التحقيق في مجموعة ضخمة من الهياكل الجزيئية عن طريق تحويل الدراسات الميكانيكية الكيميائية للجزيئات الفردية إلى دراسات المجموعات الجزيئية. في هذا البروتوكول ، تم الكشف عن الهياكل الثانوية للحمض النووي (i-motifs) في تدفق القص بين الدوار والجزء الثابت لطرف مجانس بمعدلات قص تصل إلى 77796 / ثانية. تم توضيح آثار معدلات التدفق والأحجام الجزيئية على قوى القص التي تعاني منها i-motif. كشفت تقنية EFS أيضا عن تقارب الارتباط بين زخارف الحمض النووي i-motifs والأربطة. علاوة على ذلك ، أظهرنا تفاعل كيمياء النقر الذي يمكن تشغيله بواسطة قوة القص (أي كيمياء النقر الميكانيكي). تثبت هذه النتائج فعالية استخدام قوة القص للتحكم في تشكيل الهياكل الجزيئية.
Introduction
في التحليل الطيفي لقوة الجزيء الواحد1 (SMFS) ، تمت دراسة الخواص الميكانيكية للهياكل الجزيئية الفردية بواسطة أدوات متطورة مثل مجهر القوة الذرية والملقط البصري والملقط المغناطيسي2،3،4. مقيدة بنفس متطلبات الاتجاه للجزيئات في إعدادات توليد / اكتشاف القوة أو مجال الرؤية الصغير في الملقط المغناطيسي ومجهر قوة الطرد المركزي المصغر (MCF) 5،6،7،8 ، يمكن التحقيق في عدد محدود فقط من الجزيئات في وقت واحد باستخدام SMFS. تمنع الإنتاجية المنخفضة ل SMFS تطبيقه على نطاق واسع في مجال التعرف الجزيئي ، مما يتطلب مشاركة مجموعة كبيرة من الجزيئات.
يوفر تدفق القص حلا محتملا لتطبيق القوى على مجموعة ضخمة من الجزيئات9. في تدفق السائل داخل القناة ، كلما اقتربت من سطح القناة ، كلما كان معدل التدفق أبطأ10. يسبب تدرج سرعة التدفق هذا إجهاد قص مواز لسطح الحدود. عندما يتم وضع جزيء في تدفق القص هذا ، يعيد الجزيء توجيه نفسه بحيث يتوافق محوره الطويل مع اتجاه التدفق ، حيث يتم تطبيق قوة القص على المحور الطويل11. نتيجة لإعادة التوجيه هذه ، من المتوقع أن تتماشى جميع الجزيئات من نفس النوع (حجم وطول المقابض) في نفس الاتجاه بينما تواجه نفس قوة القص.
يصف هذا العمل بروتوكولا لاستخدام تدفق القص هذا لممارسة قوة القص على مجموعة ضخمة من الهياكل الجزيئية ، كما يتضح من الحمض النووي i-motif. في هذا البروتوكول ، يتم إنشاء تدفق قص بين الدوار والجزء الثابت في طرف مجانس. وجدت هذه الدراسة أن بنية الحمض النووي المطوية i-motif يمكن أن تتكشف من خلال معدلات القص 9724-97245 s−1. إلى جانب ذلك ، تم العثور على ثابت تفكك يبلغ 36 ميكرومتر بين الرباط L2H2-4OTD و i-motif. وتتفق هذه القيمة مع قيمة 31 ميكرومتر المقاسة بمقايسة إزاحة الهلام12. علاوة على ذلك ، يتم استخدام التقنية الحالية لكشف شكل i-motif ، والذي يمكن أن يعرض النحاس المخلبي (I) لتحفيز تفاعل النقر. وبالتالي يسمح هذا البروتوكول للمرء بالكشف عن مجموعة كبيرة من هياكل i-motif مع أدوات منخفضة التكلفة في وقت معقول (أقصر من 30 دقيقة). بالنظر إلى أن تقنية قوة القص تزيد بشكل كبير من إنتاجية التحليل الطيفي للقوة ، فإننا نسمي هذه التقنية التحليل الطيفي لقوة مجموعة (EFS). يهدف هذا البروتوكول إلى توفير مبادئ توجيهية تجريبية لتسهيل تطبيق نظام EFS القائم على قوة القص.
Protocol
ملاحظة: يتم سرد جميع المخازن المؤقتة والكواشف الكيميائية المستخدمة في هذا البروتوكول في مواد الجدول.
1. إعداد مجهر قوة القص
ملاحظة: يحتوي مجهر قوة القص على جزأين، وحدة تفاعل (مجانس) ووحدة كشف (مجهر فلوري). تكبير العدسة هو 10x ، وتكبير العدسة الموضوعية (الهواء) هو 4x.
- قم بتجميع المجانس والمجهر على طاولة تركيب. ارتد نظارات واقية وقم بتشغيل المجهر الفلوري ، ثم اضبط المجانس للتأكد من أن شعاع ضوء الإثارة ذي الطول الموجي المناسب (هنا ، تم استخدام 488 نانومتر) يمر عبر مركز طرف التشتت للمجانس.
- قم بإعداد غرفة تفاعل مسطحة القاع يبلغ ارتفاعها 5 سم و 1.5 سم 2 × 1.5 سم2 في المقطع العرضي. لتقليل الخلفية ، تأكد من أن مادة الغرفة المحددة لا تتألق ، مثل النظارات (بعض المواد البلاستيكية لها تألق).
- اختر طرف تشتيت مجانس مناسب يمكنه توفير قوة القص المطلوبة.
ملاحظة: يعتمد معدل القص على المسافة بين الدوار والجزء الثابت بسرعة دوران ثابتة11 وفقا للمعادلة التالية: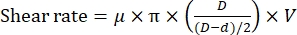
حيث μ هي اللزوجة الديناميكية للمياه عند 20 درجة مئوية ؛ D هو القطر الداخلي للجزء الثابت. d هو القطر الخارجي للدوار ، و V هو سرعة القص (دورة في الدقيقة / ثانية). - قم بتثبيت غرفة التفاعل في مرحلة العينة من المجهر الفلوري ، ثم اضبط الغرفة لتثبيت طرف التشتت للمجانس (الشكل 1). تأكد من أن طرف التشتت أعلى قليلا (~ 1 مم) من السطح السفلي لغرفة التفاعل.
- اضبط الوضع الرأسي للمجانس والغرفة معا لضمان تركيز المجهر على سطح طرف التشتت. بعد ذلك، اضبط الموضع الأفقي لطرف التشتت للتأكد من تعيين منطقة الكشف (مجال الرؤية) بين الدوار والجزء الثابت (الشكل 1).
- قم بتشغيل قنوات التألق وفقا لصبغة الفلورسنت المستخدمة في التجربة.
- قبل تجربة القص عالية السرعة، استخدم الماء منزوع الأيونات (DI) لاختبار القص بسرعة قص منخفضة (على سبيل المثال، 2000 دورة في الدقيقة) لضمان عمل طرف التشتت بشكل مناسب دون لمس غرفة التفاعل.
2. تتكشف i-motifs مع وبدون روابط
- قم بإعداد الحمض النووي البشري للتيلوميريك i-motif (جدول المواد) الموسوم بصبغة ومبرد في طرفيه ، على التوالي ، في مياه DI ، كما هو موضح في Hu et al.11.
ملاحظة: I-MOMOTIF يحتوي على تسلسل: 5'-TAA CCC TAA CCC TAA CCC TAA CCC TAA. - قم بتخفيف الحمض النووي إلى 5 ميكرومتر في المخزن المؤقت MES 30 mM عند درجة الحموضة 5.5 أو الرقم الهيدروجيني 7.4. إلى محلول الحمض النووي ، أضف الليغاند L2H2-4OTD ، الذي تم تصنيعه وفقا ل Abraham Punnoose et al.13 ، في نطاق تركيز يتراوح بين 0-60 ميكرومتر.
- تحقق من شدة التألق الخلفية لغرفة التفاعل المملوءة بماء DI منزوع الأيونات وقلل من شدته باستخدام المجهر الفلورسنت دون قص. طريقة سهلة لتقليل التألق في الخلفية هي غسل غرفة التفاعل بماء DI. يجب طرح قيمة التألق الخلفية في تحليلات البيانات لاحقا.
ملاحظة: يجب تجنب الضوء الضال من هذه الخطوة فصاعدا. - قم بتعيين معلمات كاميرا CCD باستخدام البرنامج. المعلمات الموصى بها هي كما يلي: وقت التعرض = 0.5 ثانية ، حساسية CCD = 1600 ، ووقت التسجيل = 20 دقيقة.
- باستخدام ماصة طويلة ، أضف محلول الحمض النووي إلى غرفة التفاعل الفارغة والنظيفة. قم بتغطية غرفة التفاعل بصندوق أسود. بعد ذلك، ابدأ تشغيل المجانس لإجراء القص بمعدل قص محدد يتراوح من 9,724 s−1 إلى 97,245 s−1 (تم تحديده باستخدام البرنامج المرتبط بالمجانس) لمدة 20 دقيقة مع تشغيل كاميرا CCD لتسجيل البيانات.
- بعد التجربة ، قم بإزالة الغرفة واغسلها بماء DI.
3. تفاعل النقر الذي يتم تشغيله بقوة القص
- تحضير الحمض النووي i-motif في الماء DI. احتضان 10 ميكرومتر من الحمض النووي i-motif في 300 ميكرولتر من 30 mM Tris buffer (الرقم الهيدروجيني 7.4) مع استكمال 150 μM CuCl و 300 μM حمض الأسكوربيك لمدة 10 دقائق لطي هياكل i-motif (جميع التركيزات هي تركيزات نهائية في المحلول).
ملاحظة: CuCl هو محفز تفاعل النقر. حمض الأسكوربيك سيمنع أكسدة النحاس (I). - قم بترشيح المحلول باستخدام جهاز الترشيح الفائق بقوة طرد مركزي تبلغ 14,300 × جم. قم بتجديد المحلول إلى ~ 500 ميكرولتر باستخدام مخزن مؤقت Tris 30 mM (الرقم الهيدروجيني 7.4) مع استكمال حمض الأسكوربيك 300 ميكرومتر بعد كل ترشيح.
- كرر الترشيح 3x.
- جمع الحل المتبقي وجعل حجم نهائي من 300 ميكرولتر عن طريق إضافة 30 mM Tris (الرقم الهيدروجيني 7.4) مع استكمال حمض الأسكوربيك 300 μM جنبا إلى جنب مع 20 μM Calfluor 488 azide ، 20 μM HPG ، و 10 μM TBTA. بمجرد إضافة الكواشف ، انقل المحلول إلى الغرفة المظلمة.
ملاحظة: يجب تجنب الضوء بعد هذه الخطوة. - تحقق من شدة التألق الخلفية لغرفة التفاعل المملوءة بماء DI وقللها إلى الحد الأدنى باستخدام المجهر قبل تجارب القص. طريقة سهلة لتقليل التألق في الخلفية هي غسل غرفة التفاعل بماء DI.
- أضف محلول الحمض النووي إلى غرفة التفاعل الفارغة باستخدام ماصة طويلة، ثم ابدأ قص المجانس بمعدل قص 63,209 s−1 لمدة 20 دقيقة مع تشغيل كاميرا CCD.
- بعد التجربة ، قم بإزالة الغرفة واغسلها بماء DI.
النتائج
يوضح الشكل 1 التكشف الميكانيكي والاستشعار في الوقت الفعلي لجزيئات المجموعة في EFS. في الشكل 1B، لوحظ أن شدة التألق للحمض النووي i-motif تزداد مع معدل القص الذي يتراوح من 9,724 s−1 إلى 97,245 s−1 في مخزن مؤقت للأس الهيدروجيني 5.5 MES. كعنصر تحكم ، لم يتم...
Discussion
يسمح البروتوكول الموصوف في هذه المخطوطة بالتحقيق في الوقت الفعلي في تكشف مجموعة من الهياكل الجزيئية الحيوية بواسطة قوة القص. تؤكد النتائج المعروضة هنا أن هياكل الحمض النووي i-motif يمكن أن تتكشف بواسطة قوة القص. كان الكشف عن i-motif المرتبط بالرباط وتفاعلات النقر التي تحركها قوة القص تطبيقات إث...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل البحثي من قبل المؤسسة الوطنية للعلوم [CBET-1904921] والمعاهد الوطنية للصحة [NIH R01CA236350] إلى H. M.
Materials
| Name | Company | Catalog Number | Comments |
| 3K MWCO Amicon | Millipore Sigma | ufc900324 | |
| Ascorbic acid | VWR | VWRC0143-100G | |
| Calfluor 488 azide | Click Chemistry Tools | 1369-1 | |
| CuCl | Thermo | ACRO270525000 | |
| Dispersion tip | Switzerland | PT-DA07/2EC-B101 | |
| DNA oligos | IDT | ||
| Dye | IDT | /5Cy5/ | |
| Fluorescence microscope | Janpan | Nikon TE2000-U | |
| Homogenizer | Switzerland | PT 3100D | |
| HPG | Santa Cruz Biotechnology | cs-295271 | |
| KCl | VWR | VWRC26760.295 | |
| MES | VWR | VWRCE169-500G | |
| Quencher | IDT | /3IAbRQSp/ | |
| TBTA | Tokyo Chemical Industry | T2993 | |
| Tris | VWR | VWRCE133-100G |
References
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: Optical tweezers, magnetic tweezers and atomic force microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Woodside, M. T., et al. Nanomechanical measurements of the sequence-dependent folding landscapes of single nucleic acid hairpins. Proceedings of the National Academy of Sciences of the United States of America. 103 (16), 6190-6195 (2006).
- Grandbois, M., Beyer, M., Rief, M., Clausen-Schaumann, H., Gaub, H. E. How strong is a covalent bond. Science. 283 (5408), 1727-1730 (1999).
- Strick, T. R., Allemand, J. F., Bensimon, D., Croquette, V. Behavior of supercoiled DNA. Biophysical Journal. 74 (4), 2016-2028 (1998).
- Yang, D., Ward, A., Halvorsen, K., Wong, W. P. Multiplexed single-molecule force spectroscopy using a centrifuge. Nature Communications. 7, 11026 (2016).
- Su, H., et al. Light-responsive polymer particles as force clamps for the mechanical unfolding of target molecules. Nano Letters. 18 (4), 2630-2636 (2018).
- Kirkness, M. W. H., Forde, N. R. Single-molecule assay for proteolytic susceptibility: Force-induced collagen destabilization. Biophysical Journal. 114 (3), 570-576 (2018).
- Astumian, R. D. Thermodynamics and kinetics of molecular motors. Biophysical Journal. 98 (11), 2401-2409 (2010).
- Bekard, I. B., Asimakis, P., Bertolini, J., Dunstan, D. E. The effects of shear flow on protein structure and function. Biopolymers. 95 (11), 733-745 (2011).
- Chistiakov, D. A., Orekhov, A. N., Bobryshev, Y. V. Effects of shear stress on endothelial cells: go with the flow. Acta Physiologica. 219 (2), 382-408 (2017).
- Hu, C., Jonchhe, S., Pokhrel, P., Karna, D., Mao, H. Mechanical unfolding of ensemble biomolecular structures by shear force. Chemical Science. 12 (30), 10159-10164 (2021).
- Sedghi Masoud, S., et al. Analysis of interactions between telomeric i-motif DNA and a cyclic tetraoxazole compound. ChemBioChem. 19 (21), 2268-2272 (2018).
- Abraham Punnoose, J., et al. Adaptive and specific recognition of telomeric G-quadruplexes via polyvalency induced unstacking of binding units. Journal of the American Chemical Society. 139 (22), 7476-7484 (2017).
- Dhakal, S., et al. Coexistence of an ILPR i-motif and a partially folded structure with comparable mechanical stability revealed at the single-molecule level. Journal of the American Chemical Society. 132 (26), 8991-8997 (2010).
- Hu, C., Tahir, R., Mao, H. Single-molecule mechanochemical sensing. Accounts of Chemical Research. 55 (9), 1214-1225 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved