Method Article
توليد البيئات الدقيقة الخلوية متعددة الإشارات عن طريق التنميط الضوئي بالأشعة فوق البنفسجية لركائز زراعة الخلايا ثلاثية الأبعاد
In This Article
Summary
تقليديا ، يتم إجراء زراعة الخلايا على ركائز مستوية تحاكي بشكل سيئ البيئة الطبيعية للخلايا في الجسم الحي. هنا نصف طريقة لإنتاج ركائز زراعة الخلايا مع الهندسة المنحنية ذات الصلة من الناحية الفسيولوجية والبروتينات خارج الخلية ذات النمط المجهري ، مما يسمح بإجراء تحقيقات منهجية في الاستشعار الخلوي لهذه الإشارات خارج الخلية.
Abstract
المصفوفة خارج الخلية هي منظم مهم لوظيفة الخلية. وقد ثبت بشكل متزايد أن الإشارات البيئية الموجودة في البيئة الدقيقة الخلوية ، مثل توزيع الليغاند وهندسة الأنسجة ، تلعب أدوارا حاسمة في التحكم في النمط الظاهري للخلية وسلوكها. ومع ذلك ، غالبا ما تتم دراسة هذه الإشارات البيئية وآثارها على الخلايا بشكل منفصل باستخدام منصات في المختبر تعزل الإشارات الفردية ، وهي استراتيجية تبالغ في تبسيط الوضع المعقد في الجسم الحي للإشارات المتعددة. يمكن أن تكون النهج الهندسية مفيدة بشكل خاص لسد هذه الفجوة ، من خلال تطوير إعدادات تجريبية تلتقط تعقيد البيئة الدقيقة في الجسم الحي ، مع الحفاظ على درجة الدقة وقابلية التلاعب بالأنظمة في المختبر .
تسلط هذه الدراسة الضوء على نهج يجمع بين نمط البروتين القائم على الأشعة فوق البنفسجية (UV) والتصنيع الدقيق للركيزة القائم على الطباعة الحجرية ، والتي تمكن معا من التحقيق عالي الإنتاجية في سلوكيات الخلايا في بيئات متعددة الإشارات. من خلال التنميط الضوئي للأشعة فوق البنفسجية بدون قناع ، من الممكن إنشاء توزيعات بروتين معقدة ولاصقة على ركائز زراعة الخلايا ثلاثية الأبعاد (3D) على رقائق تحتوي على مجموعة متنوعة من الإشارات الهندسية المحددة جيدا. يمكن استخدام التقنية المقترحة لركائز الاستزراع المصنوعة من مواد بوليمرية مختلفة ودمجها مع مناطق لاصقة منقوشة لمجموعة واسعة من البروتينات. مع هذا النهج ، يمكن أن تخضع الخلايا المفردة ، وكذلك الطبقات الأحادية ، لمجموعات من الإشارات الهندسية وإشارات توجيه الاتصال التي تقدمها الركائز المنقوشة. وبالتالي ، يمكن أن يوفر البحث المنهجي باستخدام مجموعات من مواد الرقائق وأنماط البروتين وأنواع الخلايا رؤى أساسية حول الاستجابات الخلوية للبيئات متعددة الإشارات.
Introduction
في الجسم الحي ، تخضع الخلايا لمجموعة واسعة من الإشارات البيئية التي يمكن أن تكون ذات طبيعة ميكانيكية وفيزيائية وكيميائية حيوية تنشأ من المصفوفة خارج الخلية (ECM). تم تحديد العديد من الإشارات البيئية للعب أدوار حيوية في تنظيم سلوك الخلايا ، مثل الانتشار والتمايز والهجرة1،2،3،4،5. واحدة من أكثر الظواهر التي تم التحقيق فيها على نطاق واسع هي توجيه الاتصال ، حيث تصف محاذاة الخلايا بوساطة الالتصاق على طول الأنماط الكيميائية الحيوية أو الطبوغرافية غير المتجانسة الموجودة على الركيزة خارج الخلية6،7،8،9،10،11. بالإضافة إلى توجيه محاذاة الخلايا ، فقد ثبت أيضا أن إشارات توجيه الاتصال تؤثر على خصائص الخلايا الأخرى مثل هجرة الخلايا ، وتنظيم البروتينات داخل الخلايا ، وشكل الخلية ، ومصير الخلية12،13،14،15. بالإضافة إلى ذلك ، تم الاعتراف أيضا بالبنية الهندسية للبيئة الخلوية ثلاثية الأبعاد لتأثيرها التنظيمي على سلوك الخلية16,17. في جسم الإنسان ، تتعرض الخلايا لمجموعة من الأشكال الهندسية المنحنية ، بدءا من ألياف الكولاجين الدقيقة ، والشعيرات الدموية ، والكبيبات ، وصولا إلى الحويصلات الهوائية المتوسطة والشرايين18،19. ومن المثير للاهتمام أن الدراسات الحديثة في المختبر أظهرت أن الخلايا يمكن أن تستشعر وتستجيب لمثل هذه الإشارات الفيزيائية ، من النانو إلى المقياس المتوسط 20،21،22،23.
حتى الآن ، تم إجراء معظم الدراسات التي تبحث في استجابة الخلايا للإشارات البيئية إلى حد كبير باستخدام الإعدادات التجريبية التي تعزل الإشارات الفردية. في حين أن هذا النهج قد سمح بإحراز تقدم هائل في فهم الآليات الأساسية وراء الاستشعار الخلوي للإشارات البيئية ، إلا أنه يلخص بشكل سيئ البيئة في الجسم الحي التي تقدم في وقت واحد إشارات متعددة. ولسد هذه الفجوة، من المفيد تطوير منصات ثقافية يمكن من خلالها التحكم في إشارات بيئية متعددة بشكل مستقل وفي وقت واحد. اكتسب هذا المفهوم قوة جذب متزايدة في الآونة الأخيرة 24,25 ، مع دراسات تجمع بين صلابة المصفوفة وكثافة الرباط 26,27,28,29 ، وصلابة الركيزة والمسامية 30 ، وصلابة الركيزة وحجم microniche 3D 31 ، وتضاريس السطح وإشارات توجيه الاتصال 32,33,34 ، وإشارات توجيه التلامس النانوية مع إشارات توجيه الانحناء متوسطة الحجم23. ومع ذلك ، لا يزال من الصعب الجمع بين إشارات توجيه الاتصال مع مجموعة متنوعة من الهندسة 3D بطريقة خاضعة للرقابة وعالية الإنتاجية.
يعالج بروتوكول البحث هذا هذا التحدي ويقدم طريقة لإنشاء ركائز زراعة الخلايا مع مزيج خاضع للرقابة من المناطق اللاصقة المنقوشة من بروتينات ECM (إشارات توجيه الاتصال) وانحناء الركيزة (الإشارات الهندسية). يسمح هذا النهج بتشريح استجابة الخلايا في بيئة متعددة الإشارات المحاكاة الحيوية بطريقة منهجية وعالية الإنتاجية. يمكن أن تساعد المعرفة المكتسبة في زيادة فهم سلوك الخلية في البيئات المعقدة ويمكن استخدامها لتصميم مواد مفيدة ذات خصائص توجه استجابات الخلايا إلى النتيجة المرجوة.
3D البروتين الضوئي
يمكن إنشاء مناطق لاصقة من بروتينات ECM (إشارات توجيه الاتصال) على مواد زراعة الخلايا باستخدام مجموعة متنوعة من التقنيات ، على سبيل المثال ، عن طريق نقش الأشعة فوق البنفسجية العميقة (الأشعة فوق البنفسجية العميقة) أو الطباعة الدقيقة35,36. يستخدم نمط الأشعة فوق البنفسجية العميقة ضوء الأشعة فوق البنفسجية الذي يتم إسقاطه من خلال قناع على مادة بوليمرية لتحلل بوليمرات التخميل في مواقع محددة على ركيزة زراعة الخلايا. ثم يتم احتضان الركيزة المنقوشة برباط ذي أهمية ، مما يؤدي إلى مناطق لاصقة تدعم ارتباط الخلايا وثقافتها في مواقع محددة مسبقا12،37،38. هناك طريقة بديلة لإدخال أنماط البروتين عن طريق الطباعة الدقيقة ، حيث يتم طلاء الطوابع المطاطية التي تحتوي على الشكل المطلوب ببروتين من اختيارك ويتم ضغطها على ركيزة مزرعة الخلايا ، وبالتالي نقل طلاء البروتين الذي يمكن للخلايا الالتصاق به35,37,39,40 . لسوء الحظ ، نظرا لأن كلتا التقنيتين تعتمدان على إعداد القناع وطرق الطباعة الحجرية الناعمة ، فإن التجارب تستغرق وقتا طويلا وتتطلب عمالة كثيفة ، فضلا عن أنها محدودة من حيث مرونة الأنماط. بالإضافة إلى ذلك ، فإن كلا من النقش العميق للأشعة فوق البنفسجية والطباعة الدقيقة هي الأكثر ملاءمة للمواد المستوية وهي صعبة تقنيا ، إن لم تكن مستحيلة ، لنقش الأربطة في بيئة 3D.
لتحسين هذه الطرق التقليدية ، قام Waterkotte et al. بدمج الطباعة الحجرية بدون قناع ، وترسب البخار الكيميائي ، والتشكيل الحراري لتوليد ركائز بوليمرية 3D 3D ذات الأنماط الدقيقة41. ومع ذلك ، تعتمد هذه التقنية على استخدام أفلام البوليمر القابلة للتشكيل الحراري وتوفر دقة منخفضة لنمط البروتين (7.5 ميكرومتر) ، في حين تم الإبلاغ عن استجابة الخلايا لأنماط البروتين الهندسية الصغيرة مثل 0.1 ميكرومتر 2,42. وصف Sevcik et al. طريقة واعدة أخرى لروابط ECM النانوية على ركائز تحتوي على طبوغرافيات نانوية وميكرومتر43. باستخدام الطباعة المتناغمة الدقيقة ، تم نقل بروتينات ECM من طوابع polydimethylsiloxane (PDMS) إلى ركيزة متعددة الاستجابة للحرارة (N-isopropylacrylamide) (pNIPAM). في وقت لاحق ، سمحت خاصية الاستجابة الحرارية لشبكة pNIPAM لهم بنقل نمط البروتين ثنائي الأبعاد (2D) إلى ركيزة PDMS الطبوغرافية (الأخاديد العميقة 10-100 ميكرومتر) ، وبالتالي التحكم في توطين مواقع الالتصاق على الميزات الطبوغرافية. ومع ذلك ، لا يمكن نقش جميع الطوبوغرافيات المجهرية الممكنة لأن انخفاض مشكلات قابلية البلل يجعل من الصعب تصميم ركائز طبوغرافية أعمق. تم الإبلاغ عن أن الخنادق ذات نسبة العرض إلى الارتفاع من العمق إلى العرض 2.4 هي الحد النهائي لنقل النمط بنجاح إلى الركيزة الطبوغرافية43. بالإضافة إلى ذلك ، فإن مرونة الأنماط المختلفة ودقة الأنماط التي تم إنشاؤها ضعيفة بسبب متطلبات الطباعة الدقيقة.
تصف هذه الورقة طريقة تتغلب على الاختناقات المذكورة أعلاه وتقدم طريقة مرنة وعالية الإنتاجية لإنشاء ركائز متعددة الإشارات يمكن استخدامها لزراعة الخلايا (انظر الشكل 1). الهندسة ذات الصلة من الناحية الفسيولوجية (الأسطوانات والقباب والقطع الناقص وأسطح السرج) مع الانحناءات التي تتراوح من ĸ = 1/2500 إلى ĸ = 1/125 μm-1 مصممة مسبقا ودقيقة في رقائق PDMS. في وقت لاحق ، يتم إنشاء إشارات توجيه الاتصال على رأس الهندسة ثلاثية الأبعاد باستخدام مجموعة متنوعة من تصميمات الأنماط الرقمية من خلال استخدام تقنية التنميط الضوئي بدقة صغيرة تصل إلى 1.5 ميكرومتر44. تحقيقا لهذه الغاية ، يتم تخميل رقائق PDMS في البداية لمنع الخلايا والبروتينات من الالتصاق ؛ يمكن بعد ذلك إزالة طبقة التخميل هذه عن طريق الجمع بين البادئ الضوئي 4-benzoylbenzyl-trimethylammonium chloride (PLPP) والتعرض للأشعة فوق البنفسجية45. تم تصميم قناع رقمي لتحديد مواقع التعرض للأشعة فوق البنفسجية ، وبالتالي المنطقة التي تتم فيها إزالة طبقة التخميل. يمكن للبروتينات أن تلتصق لاحقا بهذه المناطق ، مما يتيح ربط الخلايا. نظرا لأن النقش يتم باستخدام قناع رقمي (بدلا من قناع مادي) ، يمكن إنشاء مجموعة متنوعة من الأنماط بسرعة دون المتاعب والتكلفة المرتبطة بتصميم وتصنيع أقنعة ضوئية إضافية. بالإضافة إلى ذلك ، يمكن تصميم مجموعة متنوعة من بروتينات ECM (على سبيل المثال ، الكولاجين من النوع الأول والجيلاتين والفيبرونيكتين) على الركيزة. على الرغم من أن هذا البروتوكول يتم تنفيذه باستخدام رقائق زراعة الخلايا المصنوعة من PDMS ، إلا أنه يمكن تطبيق المبدأ على أي مادة أخرى ذات أهمية46.
Protocol
في الدراسات الموصوفة في هذا البروتوكول ، تم استخدام الخلايا القرنية البشرية الأولية. تم إجراء هذا البحث وفقا لمبادئ إعلان هلسنكي. تم عزل الخلايا القرنية الأولية من الأنسجة القرنية الصلبة البشرية المتبقية من جراحة رأب القرنية البطانية الغشائية Descemet ، والتي تم الحصول عليها من قسم القرنية في مركز ETB-BISLIFE متعدد الأنسجة (Beverwijk ، هولندا) بعد الحصول على موافقة من أقرب الأقرباء لجميع المتبرعين المتوفين.
ملاحظة: راجع جدول المواد للحصول على تفاصيل حول جميع المواد والكواشف والمعدات والبرامج المستخدمة في هذا البروتوكول.
1. تصنيع ركائز زراعة الخلايا 3D
- قم بإنشاء قالب زجاجي سلبي يحتوي على جميع الميزات المثيرة للاهتمام ، في هذه الحالة ، مصنوع من الزجاج باستخدام تقنية الكتابة المباشرة ليزر الفيمتو ثانية (انظر الشكل 2).
- ضع بعناية القالب الزجاجي السلبي رقم (# 1) في الجزء السفلي من طبق بتري.
- قم بإعداد بوليمر PDMS عن طريق وضع أنبوب مخروطي فارغ سعة 50 مل على مقياس ، وقم بتعرية الميزان ، وصب الكمية المطلوبة من قاعدة مطاط السيليكون الصناعي في الأنبوب.
- أضف عامل معالجة باستخدام ماصة باستور بحيث تكون النسبة النهائية لقاعدة المطاط الصناعي وعامل المعالجة 10: 1 (ث / ث).
- اخلط المكونات جيدا في الأنبوب المخروطي باستخدام ملعقة.
- جهاز طرد مركزي عند 2000 × جم لمدة 70 ثانية لإزالة جميع فقاعات الهواء.
- صب PDMS prepolymer فوق القالب الزجاجي السلبي (# 1) في طبق بتري لتغطيته بالكامل.
- ضع طبق بتري مع القالب الزجاجي السلبي رقم (# 1) والبوليمر المسبق PDMS في مجفف الفراغ وابدأ تشغيل مضخة التفريغ. بمجرد الوصول إلى فراغ ، انتظر لمدة 5 دقائق لإزالة جميع الفقاعات الموجودة في الواجهة بين سطح القالب والبوليمر المسبق PDMS.
- أزل الفراغ وأخرج طبق بتري من المجفف.
- علاج PDMS prepolymer بين عشية وضحاها في الفرن على حرارة 65 درجة مئوية.
- قم بإزالة رقاقة PDMS الإيجابية المعالجة حديثا بعناية من القالب الزجاجي السلبي رقم (# 1) عن طريق رفع حواف PDMS باستخدام ملعقة. إذا كانت رقاقة PDMS الإيجابية (# 2) تميل إلى الالتصاق بالقالب الزجاجي السلبي رقم (# 1) ، أضف الإيثانول أو الماء إلى حواف البصمة أثناء الرفع.
ملاحظة: سيتم تشغيل السائل بين الطبقتين ويسهل فصل القالب الزجاجي السلبي (# 1) وشريحة PDMS الإيجابية (# 2). - باستخدام شفرة ، اقطع جوانب شريحة PDMS الإيجابية (# 2) بحيث تبقى شريحة مستطيلة.
- ضع شريحة PDMS الإيجابية (# 2) في مجفف بجوار قارورة صغيرة مع قطرة من tridecafluoro (1,1,2,2-tetrahydrooctyl) trichlorosilane ، وهو عامل سيلان ، واتركه تحت الفراغ بين عشية وضحاها.
ملاحظة: سيتأكد Silanization من أن البصمة لن ترتبط بطبقات PDMS الأخرى لاحقا في البروتوكول. قد تعمل عوامل و / أو طرق السيلان الأخرى أيضا على ضمان عدم التصاق أسطح رقائق PDMS بطبقات PDMS الأخرى.
تحذير: ثلاثي كلوروزيلان ثلاثي كلوروسيلورو (1،1،2،2-رباعي هيدرو أوكتيل) قابل للاشتعال (H226) ويسبب حروقا جلدية شديدة وتلفا في العين (H314). ارتداء معدات الحماية الشخصية ، والعمل في غطاء الدخان ، وغسل اليدين جيدا بعد المناولة. حافظ على عامل السيلان بعيدا عن الحرارة والأسطح الساخنة والشرر واللهب المكشوف ومصادر الاشتعال الأخرى. تخزين ما بين 15 و 30 درجة مئوية (P280 ، P210 ، P240 ، P403 ، P235 ، P310). - قم بإزالة الفراغ ووضع شريحة PDMS الإيجابية (# 2) في الجزء السفلي من طبق بتري. صب PDMS prepolymer (10: 1) في الأعلى لإنتاج قوالب PDMS سلبية متعددة (# 3).
- ضع طبق بتري تحت الفراغ في المجفف لمدة 15 دقيقة لإزالة جميع الفقاعات.
- علاج PDMS prepolymer عند 65 درجة مئوية بين عشية وضحاها ، وبعد ذلك يمكن تقشير قالب PDMS السلبي (# 3) من شريحة PDMS الإيجابية (# 2) باستخدام ملعقة.
- صقل قالب PDMS السلبي النهائي (# 3) باستخدام عامل silanization في مجفف فراغ بين عشية وضحاها.
- قم بإنتاج رقائق متعددة لزراعة الخلايا (# 4 ، انظر الشكل 2) بسماكة 5 مم تقريبا عن طريق صب PDMS prepolymer في قالب PDMS السلبي (# 3) ، وإزالة الفقاعات باستخدام المجفف والمعالجة لمدة 3 ساعات عند 65 درجة مئوية. باستخدام شفرة حلاقة ، قم بقطع الشريحة إلى الحجم النهائي كما هو موضح في الشكل 2. تخزين الرقائق في درجة حرارة الغرفة.
ملاحظة: قد تؤثر خشونة السطح على الاستجابة الخلوية. إذا لزم الأمر ، يمكن استخدام طبقة رقيقة إضافية من PDMS كطلاء على شريحة PDMS الإيجابية (# 2) لتنعيم السطح. للقيام بذلك ، صب قطرة صغيرة من PDMS prepolymer على الشريحة ونشرها على الشريحة الكاملة باستخدام الهواء المضغوط. عالج الشريحة المطلية عند 65 درجة مئوية لمدة 3 ساعات واستمر في الخطوة 1.12.
2. تصنيع عينات PDMS المسطحة (عينات التحكم)
- تحضير PDMS prepolymer (10: 1) وفقا للخطوات 1.3-1.6.
- ضع غطاء زجاجي على عمود التفريغ المستدير في وسط طبقة التعبئة.
- قم بتشغيل الفراغ لتوصيل الغطاء الزجاجي بالماكينة وقم بسحب قطرة من PDMS في منتصف الغطاء باستخدام ماصة باستور.
- قم بتوزيع البوليمر المسبق PDMS على الركيزة الزجاجية باستخدام البروتوكول التالي للحصول على طبقة بسمك 10 ميكرومتر تقريبا.
- سبينكوت لمدة 10 ثوان عند 0.45 × جم ، التسارع: 0.2 × جم / ثانية.
- سبينكوت لمدة 50 ثانية عند 44.8 × جم ، التسارع: 0.54 × جم / ثانية.
- أطفئي الفراغ، وأزيلي الغطاء من طبقة المعطف باستخدام الملقط، وضعيه في طبق بتري. عالج PDMS طوال الليل في الفرن على درجة حرارة 65 درجة مئوية وخزنه في درجة حرارة الغرفة بعد ذلك.
3. تخميل الركيزة من ركائز زراعة الخلايا 3D
- قم بتنشيط مجموعات الهيدروكسيل على سطح رقاقة PDMS (# 4) باستخدام O2-plasma. باستخدام ملاقط ، ضع الشريحة في سلة آشر البلازما.
- قم بتشغيل دورة رماد باستخدام قوة 20 واط لمدة 30 ثانية. تنفيس غرفة الرماد باستخدام N2.
- أخرج الشريحة من السلة وضعها في حاوية PDMS صغيرة (انظر الشكل 1).
- باستخدام ماصة باستور ، أضف 500 ميكرولتر من Poly-L-lysine (PLL ، 0.01٪) على الجزء العلوي من الشريحة بحيث يتم غمر السطح الكامل في محلول PL. احتضان لمدة 30 دقيقة في درجة حرارة الغرفة.
- قم بإزالة 450 ميكرولتر من PLL من شريحة زراعة الخلايا باستخدام ماصة وشطف سطح الشريحة ثلاث مرات باستخدام 500 ميكرولتر من المخزن المؤقت HEPES 0.1 M (8 < درجة الحموضة < 8.5). اترك دائما كمية صغيرة من السائل على شريحة PDMS لتجنب جفاف العينة ، مما يقلل من جودة النمط النهائي.
- اصنع 500 ميكرولتر من 50 ملغم/مل ميثوكسي بولي إيثيلين غليكول-سكسينيميديل فاليرات (mPEG-SVA; MW 5,000 Da) الحل في 0.1 M HEPES المخزن المؤقت (8 < درجة الحموضة < 8.5) لكل شريحة زراعة الخلايا والسماح لها باحتضان العينة لمدة 60 دقيقة. نظرا لأن عمر النصف ل mPEG-SVA يبلغ 15 دقيقة ، تأكد من إعداد الكمية المطلوبة قبل الاستخدام مباشرة.
ملاحظة: يتم حل mPEG-SVA عندما يكون الحل شفافا تماما. - قم بإزالة 450 ميكرولتر من محلول mPEG-SVA باستخدام ماصة دقيقة ، واغسل سطح الشريحة خمس مرات بمحلول ملحي مخزن بالفوسفات (PBS). تأكد من سحب السحب لأعلى ولأسفل عدة مرات لكل غسلة لضمان إزالة جميع mPEG-SVA غير المقيدة. لمنع العينة من الجفاف ، قلل من الوقت بين خطوات الغسيل وتأكد من استخدام فائض (500 ميكرولتر أو أكثر) من PBS للغسيل.
- قم بتخزين العينات عن طريق غمرها في PBS أو المتابعة إلى خطوة النقش الخاصة بالبروتوكول.
ملاحظة: إذا رغبت في ذلك ، يمكن إجراء التخميل في ظل ظروف معقمة عند العمل في خزانة الثقافة والعمل مع حلول ومعدات معقمة.
4. تخزين ركائز زراعة الخلايا المنقوشة
ملاحظة: يمكن تخزين ركائز زراعة الخلايا 3D خلال خطوات مختلفة في هذه العملية.
- تخزين رقائق زراعة خلايا PDMS المعالجة تحت ظروف جافة في درجة حرارة الغرفة.
- قم بتخزين رقائق زراعة الخلايا المخملة بإحدى الطريقتين التاليتين:
- يخزن في PBS على درجة حرارة 4 درجات مئوية لمدة تصل إلى 7 أيام.
- يخزن في ظروف جافة لمدة تصل إلى عدة أشهر. للحصول على عينات جافة ، قم بإزالة PBS وشطفها عدة مرات باستخدام الماء المقطر المزدوج (ddH2O). تجفيف الشعر باستخدام مسدس النيتروجين أو الهواء.
5. تصميم الأقنعة الرقمية المستخدمة في التنميط الضوئي
ملاحظة: يمكن إجراء نقش الركائز ثلاثية الأبعاد باستخدام مستوى بؤري واحد أو عدة مستويات (انظر الشكل 3). يمكن استخدام مستوى بؤري واحد على الميزات التي لا يزيد حجمها عن جهاز مرآة رقمية واحد (DMD ، حوالي 300 ميكرومتر × 500 ميكرومتر) والتي ليست طويلة جدا (50-100 ميكرومتر). في هذه الحالة ، قم بتصميم نمط رقمي باستخدام وضع TIFF. بالنسبة للميزات التي تتجاوز أبعاد DMD واحد وطويلة نسبيا ، قسم نمط الركيزة إلى خطوات متعددة. في هذه الحالة، يتم تصميم أنماط متعددة باستخدام صيغة PDF التي تركز جميعها بشكل فردي على مستويات بؤرية واحدة.
- تصميم قناع رقمي باستخدام أدوات برامج التصميم.
- النقش في وضع TIFF (بكسل): قم بإنشاء لوح رسم أسود بالكامل بحجم 1,140 × 1,824 بكسل (الحجم الدقيق ل 1 DMD، حوالي 300 ميكرومتر × 500 ميكرومتر) واملأ لوح الرسم بالأشكال محل الاهتمام. تصدير لوح الرسم كملف TIFF 8 بت.
ملاحظة: تحدد المستويات الرمادية المختلفة في تصميم النمط مقدار التعرض الذي سيتم إجراؤه في هذا الموقع. - الحشو في صيغة PDF (الوحدات المترية): قم بإنشاء لوح رسم أسود بالحجم المطلوب بالملليمتر وقم بتعبئة لوح الرسم بأي شكل من أشكال الاهتمام. قسم النمط إلى ملفات متعددة إذا كانت الركيزة 3D بحاجة إلى نقش باستخدام مستويات بؤرية متعددة. احفظ لوح الرسم كملف PDF.
ملاحظة: تحدد المستويات الرمادية المختلفة في تصميم النمط مقدار التعرض الذي سيتم إجراؤه في هذا الموقع.
- النقش في وضع TIFF (بكسل): قم بإنشاء لوح رسم أسود بالكامل بحجم 1,140 × 1,824 بكسل (الحجم الدقيق ل 1 DMD، حوالي 300 ميكرومتر × 500 ميكرومتر) واملأ لوح الرسم بالأشكال محل الاهتمام. تصدير لوح الرسم كملف TIFF 8 بت.
6. الأشعة فوق البنفسجية الضوئية من ركائز زراعة الخلايا 3D
- المعايره
ملاحظة: تتم معايرة الليزر للحصول على التركيز المناسب على المواد ذات الاهتمام. نظرا لأن ركائز زراعة خلايا PDMS سميكة جدا بحيث لا يمكن التنميط من خلالها ، استخدم شريحة زجاجية يتم وضع الشريحة عليها رأسا على عقب. نظرا لأن الليزر يواجه الشريحة الزجاجية أولا ، استخدم الزجاج لمعايرة الليزر.- ضع هايلايزر الفلورسنت على غطاء زجاجي وضع الغطاء الزجاجي في مرحلة المجهر الفلورسنت. تأكد من أن السطح المميز متجه لأعلى.
- قم بتشغيل المجهر ومعدات PRIMO وافتح Micro-manager للوصول إلى برنامج Leonardo ضمن "المكونات الإضافية".
- اختر المعايرة في القائمة الأولية ، متبوعا بتحديد هدف 20x على كل من المجهر وفي البرنامج. انقر فوق التالي.
- ضع الشريحة الزجاجية مع هايلايتر الفلورسنت في المسار البصري للمجهر. قم بالتبديل إلى وضع الفلورسنت وركز بعناية على صورة PRIMO التي تظهر ، مع التأكد من أن كل من الشعار والنص في وضع التركيز البؤري. انقر فوق التالي لإنهاء إجراء المعايرة.
- اكتب موقع Z للمرحلة عند المعايرة واستخدم هذا الموقع كمرجع لاحقا في البروتوكول.
ملاحظة: يجب أن تتطابق مادة المعايرة مع المادة المستخدمة للنقش لاحقا في البروتوكول. تصف الخطوات المذكورة أعلاه المعايرة اللازمة لركائز زراعة الخلايا. لمعايرة عينات التحكم في PDMS المسطحة، ضع أداة تمييز الفلورسنت أعلى عينة PDMS مسطحة إضافية وقم بالمعايرة باستخدام الخطوات 6.1.2-6.1.5.
- ميزات النقش 3D باستخدام مستوى بؤري واحد
ملاحظة: يتم إجراء النقش باستخدام مستوى بؤري واحد على ميزات 3D التي لا تتجاوز أبعاد DMD واحد (حوالي 300 ميكرومتر × 500 ميكرومتر). يوضح الشكل 3 مخططا لإعداد المستوى البؤري.- قم بإزالة شريحة المعايرة من المرحلة ووضع شريحة زجاجية تحتوي على قطرة (~ 50 ميكرولتر) من البادئ الضوئي (PLPP) في المرحلة.
تنبيه: PLPP مزعج للعينين والجهاز التنفسي والجلد (R36-38). ارتد معدات الحماية الشخصية ، واحفظها بعيدا عن المواد المتفجرة ، ولا تضيف الماء أبدا إلى هذا المنتج ، واتخذ تدابير احترازية ضد التصريفات الثابتة ، وتجنب الصدمات والاحتكاك (S26-36). - ضع ركيزة زراعة الخلايا PDMS رأسا على عقب في قطرة البادئ الضوئي. تأكد من أن ميزات 3D على سطح الركيزة ثقافة الخلية تواجه الشريحة الزجاجية ومغمورة بالكامل في PLPP لضمان النقش المناسب.
- حدد نمط في البرنامج.
- قم بالتبديل إلى وضع brightfield على المجهر ونقل المرحلة إلى الميزة المثيرة للاهتمام.
- ركز على الجزء العلوي أو السفلي من الهياكل المحدبة والمقعرة على التوالي (الشكل 3).
- حدد PRIMO لإدراج نمط من الاختيار. راقب معاينة النمط باللون البرتقالي أعلى صورة برايتفيلد الحية.
- اضبط إعدادات النقش وفقا للميزة (الموقع والزاوية والتكرار) وحدد جرعة 1000 mJ / mm2.
- انقر فوق قفل وقم بتبديل المجهر إلى وضع الفلورسنت .
- انقر فوق الزر " تشغيل" في الجزء السفلي الأيمن من الشاشة لبدء النقش. بمجرد الانتهاء ، لاحظ النمط المعروض باللون الأخضر.
- بمجرد الانتهاء من جميع الميزات الموجودة على شريحة زراعة الخلايا ، قم بإزالة الشريحة من شريحة النقش وتخزينها في PBS عند 4 درجات مئوية.
- قم بإزالة شريحة المعايرة من المرحلة ووضع شريحة زجاجية تحتوي على قطرة (~ 50 ميكرولتر) من البادئ الضوئي (PLPP) في المرحلة.
- ميزات النقش 3D باستخدام مستويات بؤرية متعددة
ملاحظة: يتم إجراء النقش باستخدام مستويات بؤرية متعددة على ميزات ثلاثية الأبعاد أكبر من DMD واحد (حوالي 300 ميكرومتر × 500 ميكرومتر) أو طويلة نسبيا. في هذه الحالة ، يجب نقش ميزات 3D في خطوات متعددة ، أي أنه يجب تكييف تصميم النمط وفقا للمثال الوارد في الشكل 3.- قم بإزالة شريحة المعايرة من المرحلة ووضع شريحة زجاجية تحتوي على قطرة (~ 50 ميكرولتر) من البادئ الضوئي (PLPP) في المرحلة.
- ضع رقاقة زراعة الخلايا PDMS رأسا على عقب في قطرة البادئ الضوئي باستخدام ملاقط.
- حدد نمط في البرنامج. قم بالتبديل إلى وضع brightfield على المجهر ونقل المرحلة إلى الميزة المثيرة للاهتمام.
- ركز على مساحة الشريحة في الموقع الصحيح. نظرا لأن النقش يتم تنفيذه في مستوى بؤري واحد وتكون الميزات أكبر من DMD واحد ، استخدم مستويات بؤرية متعددة وبالتالي جولات متعددة من النقش لكل ركيزة ثلاثية الأبعاد لضمان دقة نمط كافية على طول الارتفاع والعرض الكاملين للميزة (انظر الشكل 3). على سبيل المثال، بالنسبة لميزة يبلغ ارتفاعها 150 ميكرومتر، قم بتصميم الميزة في ثلاث جولات (± 1 مستوى بؤري لكل 50 ميكرومتر من Z-travel)، مع التركيز على حوالي 25 ميكرومتر و75 ميكرومتر و125 ميكرومتر من أسفل الميزة. تأكد من أن الجزء السفلي من الميزة حول القيمة المكتوبة في الخطوة 6.1.5.
- حدد PRIMO لإدراج نمط الاختيار. راقب معاينة النمط المعروضة باللون البرتقالي أعلى صورة الحقل الساطع الحية.
- اضبط إعدادات النقش وفقا للميزة (الموقع والزاوية) وحدد جرعة 1000 mJ/mm2.
- انقر فوق قفل وقم بتبديل المجهر إلى وضع الفلورسنت .
- انقر فوق الزر " تشغيل" في الجزء السفلي الأيمن من الشاشة لبدء النقش. بمجرد الانتهاء ، لاحظ النمط المعروض باللون الأخضر.
- كرر الخطوات 6.3.4-6.3.8 على ميزة الاهتمام عند استخدام مستويات بؤرية متعددة.
- بمجرد الانتهاء من جميع الميزات الموجودة على شريحة زراعة الخلايا ، قم بإزالة الشريحة من شريحة النقش وتخزينها في PBS عند 4 درجات مئوية.
ملاحظة: إذا رغبت في ذلك ، قم بتطبيق النمط الضوئي للأشعة فوق البنفسجية في ظل ظروف معقمة ، مع الاستفادة من أطباق بتري ذات القاع الزجاجي وإعداد جميع الركائز في خزانات الثقافة المعقمة. قم بتخزين العينات المنقوشة في PBS لمدة تصل إلى أسبوعين. عند غسلها باستخدام ddH2O وتجفيفها باستخدام الهواء المضغوط ، يمكن تخزين العينات حتى بضعة أشهر عند 4 درجات مئوية.
7. حضانة البروتين
ملاحظة: ينصح باستخدام ركائز محتضنة بالبروتين الطازج لزراعة الخلايا. انتقل فقط إلى هذا الجزء من البروتوكول إذا تم إجراء بذر الخلايا (الخطوة 8) بعد ذلك مباشرة.
- انقل رقاقة زراعة الخلايا المنقوشة إلى حاويات PDMS معقمة في خزانة الثقافة.
- اغسل رقائق زراعة الخلايا المنقوشة 3x مع وجود فائض من PBS المعقم إذا لم يتم إجراء النقش في ظل ظروف معقمة.
- تحضير محلول البروتين الطازج في PBS.
- Fibronectin: أضف 2 مل من PBS باستخدام ماصة دقيقة إلى قارورة من 20 ميكروغرام من الفيبرونيكتين المسمى بالرودامين للحصول على تركيز 10 ميكروغرام / مل. Pipet بلطف لتجنب تشكيل كتل البروتين والحماية من الضوء.
- الجيلاتين: إذابة أليكوت 200 ميكرولتر من الجيلاتين الفلوريسين المذاب. حماية من الضوء.
- أضف 200-500 ميكرولتر من محلول البروتين إلى رقاقة زراعة الخلايا باستخدام ماصة دقيقة. اضبط وقت الحضانة ودرجة الحرارة اعتمادا على البروتين الذي تختاره: Fibronectin: 5 دقائق في درجة حرارة الغرفة ، الجيلاتين: 15 دقيقة عند 37 درجة مئوية. تأكد من تغطية العينة (على سبيل المثال ، مع رقائق الألومنيوم).
- قم بإزالة محلول البروتين واغسل 5x ب 500 ميكرولتر من PBS المعقم. تأكد من سحب PBS لأعلى ولأسفل عدة مرات فوق كل الميزات ذات الصلة لشريحة زراعة الخلايا لإزالة أي بروتين غير مقيد.
ملاحظة: أثناء خطوات الغسيل، من الأهمية بمكان ألا تجف العينة أبدا. عند إزالة محلول البروتين أو PBS أثناء الغسيل ، أضف PBS جديدا على الفور لمنع تشكل كتل البروتين (انظر الشكل 4). ميزات محدبة حساسة بشكل خاص للجفاف لأنها مرتفعة فوق سطح الركيزة. - اختياري: مراجعة أنماط البروتين تحت المجهر الفلوري. حافظ على العينات معقمة ومغمورة في PBS.
8. بذر الخلايا
ملاحظة: يستخدم هذا البروتوكول الخلايا القرنية الأولية البشرية والخلايا الليفية الجلدية البشرية. تم حصاد الخلايا القرنية من أنسجة القرنية البشرية من المرضى ، تمشيا مع المبادئ التوجيهية الهولندية للاستخدام الثانوي للمواد ، وكانت تسمى سابقا باسم القرنية47. يتم استزراع هذه الخلايا في DMEM مع 5 ٪ مصل البقر الجنين (FBS) ، 1 ٪ البنسلين / الستربتومايسين (P / S) ، و 1 mM L-ascorbic acid 2-phosphate sesquimagnesium ملح هيدرات (فيتامين C) عند 37 درجة مئوية لمدة أقصاها أربعة ممرات. تم شراء الخلايا الليفية الجلدية البشرية وزراعتها في DMEM مع استكمال 10٪ FBS و 1٪ P / S عند 37 درجة مئوية بحد أقصى 15 ممر. لبذر كل من الخلايا القرنية والخلايا الليفية الجلدية على رقاقة زراعة الخلايا ذات النمط الضوئي ، تم استخدام 20000 خلية لكل رقاقة.
- افصل الخلايا ذات الأهمية (على سبيل المثال ، باستخدام التربسين) وقم بإعداد 1 مل من تعليق الخلية من ± 10000-50000 خلية / مل في وسط الثقافة لكل رقاقة. اضبط العدد الدقيق للخلايا المضافة لكل ركيزة اعتمادا على حجم الخلية والقراءة المطلوبة.
- قم بإزالة PBS من شريحة زراعة الخلايا وأضف 1 مل من تعليق الخلية.
- انقل رقاقة زراعة الخلايا بلطف مع الخلايا إلى الحاضنة واحتضنها لمدة 60 دقيقة عند 37 درجة مئوية.
- تحقق من التصاق الخلايا على رقاقة زراعة الخلايا المنقوشة تحت مجهر برايتفيلد. ابحث عن مورفولوجيات الخلايا الممدودة في حالة أنماط الخطوط (انظر الشكل 5). إذا بدأت الخلايا أيضا في الالتصاق خارج المنطقة المنقوشة ، فقم بإزالتها عن طريق سحب الوسط لأعلى ولأسفل مباشرة فوق الخلايا الموجودة على الركيزة.
ملاحظة: ستظل الخلايا المتصلة بالمنطقة المنقوشة متصلة، بينما ستنفصل الخلايا خارج المناطق المنقوشة. - قم بإزالة شريحة زراعة الخلايا من حاوية PDMS واستخدم ملاقط معقمة لوضعها في لوحة من 6 آبار مليئة ب ~ 5 مل من وسط الثقافة.
- زراعة الخلايا لطول الفترة الزمنية المطلوبة. استبدال وسط زراعة الخلايا كل 2-3 أيام. لضمان تصور نمط البروتين بعد زراعة الخلايا ، قلل من كمية تعرض العينة للضوء أثناء الزرع.
9. تلطيخ ، والحصول على الصور ، وتحليلها
- التثبيت والتلطيخ
- بعد الطول المطلوب للثقافة ، قم بإزالة جميع الوسائط تقريبا واغسلها ثلاث مرات باستخدام PBS الزائد. بعد ذلك ، احتضان مع 3.7 ٪ من الفورمالين لمدة 15 دقيقة في درجة حرارة الغرفة تليها ثلاث خطوات غسيل مع PBS لمدة 5 دقائق لكل غسل في درجة حرارة الغرفة. لا تدع العينة تجف أبدا.
تحذير: الفورمالين ضار إذا تم ابتلاعه أو استنشاقه (H302 ، H332) ، وقد يسبب رد فعل تحسسي للجلد (H317) ، ويشتبه في أنه يسبب عيوبا وراثية (H341) ، وقد يسبب السرطان (H350). ارتداء معدات الحماية الشخصية والعمل في غطاء الدخان. - وصمة عار الركيزة ثقافة الخلية مع عوامل تلطيخ المطلوبة أو الأجسام المضادة. لتقليل أحجام عوامل التلطيخ ، ضع رقائق زراعة الخلايا رأسا على عقب في قطرة من محلول التلطيخ المنصوب على شريحة زجاجية.
- قم بتخزين العينات في PBS (على المدى القصير) أو متصلة بغطاء باستخدام متوسط التركيب (طويل الأجل) عند 4 درجات مئوية.
- بعد الطول المطلوب للثقافة ، قم بإزالة جميع الوسائط تقريبا واغسلها ثلاث مرات باستخدام PBS الزائد. بعد ذلك ، احتضان مع 3.7 ٪ من الفورمالين لمدة 15 دقيقة في درجة حرارة الغرفة تليها ثلاث خطوات غسيل مع PBS لمدة 5 دقائق لكل غسل في درجة حرارة الغرفة. لا تدع العينة تجف أبدا.
- الحصول على الصور
- ضع العينة الملونة رأسا على عقب في قطرة من PBS على شريحة زجاجية. ضع العينة في مرحلة المجهر البؤري.
- اعتمادا على المستوى المطلوب من التفاصيل، قم بعمل مكدسات Z بهدف مناسب (10x أو 20x أو 40x) وتباعد Z لضمان الحصول على الصورة بشكل صحيح.
- تحليل الصور والتصور
- افتح ملفات الصور الخام في برنامج تحليل الصور وتحقق من صحة خصائص الصورة (مثل الأبعاد والدقة).
- اضبط السطوع والتباين لكل قناة إذا لزم الأمر.
- اقتصاص المنطقة ذات الأهمية التي تحتوي على النمط والخلايا.
- اختياري: قم بإجراء خطوة فك الالتفاف إذا لزم الأمر.
- قم بإنشاء عرض ثلاثي الأبعاد ل Z-stack باستخدام برنامج تقديم 3D.
- يمكنك تحسين التباين واكتساب الإعدادات لكل قناة على حدة.
- لإنشاء صورة لعرض 3D ، قم بإنشاء لقطة وتصديرها ك . ملف TIFF.
- لإنشاء فيلم من عرض 3D ، اضبط البداية والإطار النهائي بالإضافة إلى الإطار الزمني قبل تسجيل الفيلم. تصدير كما .avi.
النتائج
عن طريق البروتوكول الموصوف ، يمكن أن تكون ركائز زراعة الخلايا 3D PDMS منقوشة بالأشعة فوق البنفسجية لإنشاء مناطق لاصقة دقيقة وعالية الإنتاجية مناسبة لمرفق الخلية. وبهذه الطريقة ، تخضع الخلايا لكل من هندسة الركيزة ذات الصلة وأنماط الرباط اللاصق في وقت واحد. يمكن بسهولة مراقبة خصائص الخلية مثل الاتجاه ومنطقة الخلية وعدد الالتصاقات البؤرية واستخدامها لفهم سلوك الخلية بشكل أفضل في البيئات المعقدة الشبيهة بالجسم الحي.
للتحقق من أحداث النقش على ركائز PDMS 3D ، تم قياس التراكيب السطحية الذرية للمادة في مراحل مختلفة من البروتوكول باستخدام التحليل الطيفي للأشعة السينية الذرية (XPS)48. باختصار ، أظهرت قياسات XPS وجود سلاسل PEG مع زيادة إشارة الكربون على العينات المخملة ، والتي تم تقليلها بعد التنميط الضوئي. أدت الحضانة باستخدام الفيبرونيكتين إلى زيادة إشارة الكربون ، مما يشير مرة أخرى إلى نجاح التصاق البروتين على سطح رقاقة زراعة الخلايا. بعد ذلك ، تم تمييز دقة النمط والمحاذاة على ميزات 3D على مجموعة متنوعة من الحفر المقعرة ذات النقوش الدائرية (ĸ = 1/250 μm-1 ، ĸ = 1/1000 μm-1 ، و ĸ = 1/3750 μm-1 ، انظر الشكل 6). من توقعات الحد الأقصى للكثافة ، يمكن استنتاج أن نمط البروتين تم تصميمه بنجاح على جميع ميزات 3D الثلاثة. يوضح ملف تعريف الكثافة في الشكل 6A دقة عالية للنمط مع انتقالات حادة بين المناطق المنقوشة وغير المنقوشة. بالإضافة إلى ذلك ، تم الحصول على كثافة بروتين متسقة عبر النمط الكامل في الحفرة.
تم نقش الحفرة المقعرة التي تحتوي على ĸ = 1/250 μm-1 باستخدام طريقة المستوى البؤري الواحد (نمط واحد) ، في حين تم نقش الحفر التي تحتوي على ĸ = 1/1000 μm-1 و ĸ = 1/3750 μm-1 باستخدام مستويين وثلاثة مستويات بؤرية (أنماط) ، على التوالي. وكما يتضح من إسقاطات الكثافة القصوى في الشكل 6، فإن كلتا الطريقتين تؤديان إلى محاذاة تامة للأنماط الموجودة أعلى الميزات. لا يمكن ملاحظة أي انتقالات غير محاذاة بين المستويين البؤريين والأنماط المختلفة.
باستخدام البروتوكول الموصوف ، يمكن تطبيق مجموعة واسعة من تصميمات أنماط البروتين على مجموعة متنوعة من الأشكال الهندسية (انظر الشكل 7 والفيديو 1). لتوضيح براعة هذه الطريقة ، تم نقش أشباه الأسطوانات (محدبة ومقعرة) ، وسطح السرج ، والحفرة باستخدام خطوط ودوائر ذات عروض مختلفة. يمكن استخدام المواد ذات الأنماط الضوئية لاحقا لزراعة الخلايا (انظر الشكل 7 والشكل 8 والفيديو 2 والفيديو 3 والفيديو 4). يظهر مثال على الخلايا الليفية الجلدية المستزرعة على شكل منقوش (خطوط الفيبرونيكتين ، الأحمر ، بعرض 5 ميكرومتر ، وفجوات 5 ميكرومتر) مقعرة في الشكل 8 والشكل 9 والفيديو 4. أثناء التجربة ، تستشعر الخلايا وتلتصق بركيزة زراعة الخلايا متعددة الإشارات وتظل قابلة للحياة بمرور الوقت. كما يتضح من تلطيخ الفلورسنت المناعي في الشكل 8 ، تشكل الخلايا التصاقات بؤرية (مجموعات فينكولين) بشكل رئيسي على خطوط الفيبرونيكتين.
مثال آخر على الدراسة التي تستخدم مواد زراعة الخلايا هذه تم نشرها مؤخرا من قبل مجموعتنا48. في هذه الدراسة ، خضعت الخلايا الليفية العضلية البشرية والخلايا البطانية لمزيج من إشارات توجيه الاتصال والطوبوغرافيا الهندسية. في الجسم الحي ، يعاني كلا النوعين من الخلايا من إشارات توجيه الانحناء والتلامس في الأنسجة الأصلية مثل الأوعية الدموية البشرية. من خلال إخضاع الخلايا في المختبر لبيئة تجمع بين كل من الإشارات البيئية ، يمكن تلخيص الوضع في الجسم الحي ، مما يوفر فهما أعمق لدور البيئة الدقيقة في سلوك الخلايا. وقد تبين أن الخلايا الليفية العضلية البشرية تتماشى مع إشارات توجيه التلامس (خطوط الفيبرونيكتين المتوازية) على الركائز الأسطوانية المقعرة48. ومع ذلك ، في الهياكل المحدبة ذات الانحناءات المتزايدة ، ألغت الإشارات الهندسية الإشارات الكيميائية الحيوية ، مما يشير إلى أن الخلايا الليفية العضلية يمكن أن تستشعر كل من درجة وعلامة الانحناء. ومن المثير للاهتمام أن الخلايا البطانية يمكن أن تلتصق فقط بالركائز المتعددة المقعرة وليس بركائز PDMS المحدبة. على الركائز المقعرة ذات النمط البروتيني ، يتم توجيه الخلايا البطانية في اتجاه إشارة توجيه الاتصال. هذه المعرفة الأساسية في المختبر لها أهمية فسيولوجية في مجال هندسة الأنسجة الوعائية ويمكن أن تساعد في نهاية المطاف في تصميم هياكل هندسة الأنسجة الذكية.
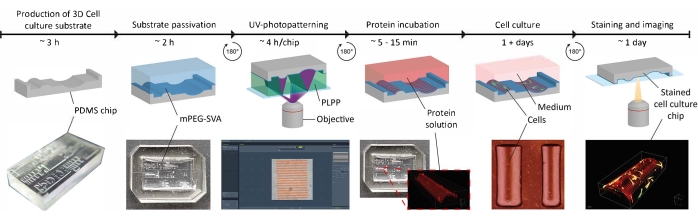
الشكل 1: الجدول الزمني التجريبي لتطبيق إشارات توجيه الاتصال على ركائز زراعة الخلايا ثلاثية الأبعاد. أولا ، يتم إنتاج رقائق زراعة الخلايا الإيجابية من قالب PDMS سلبي يحتوي على مجموعة من الهندسات. يتم سكب PDMS غير المعالج في القالب وعلاجه لمدة 3 ساعات عند 65 درجة مئوية. في وقت لاحق ، يتم التعامل مع PDMS مع O2-plasma وتحضينها مع PLL و mPEG-SVA (الأزرق ، الموسوم) لتخميل سطح ركيزة زراعة الخلية. بعد الغسيل ، يتم قلب الركيزة رأسا على عقب في قطرة من photoinitiator (PLPP ، خضراء ، ملصقة) والأشعة فوق البنفسجية باستخدام نهج LIMAP. هنا ، يتم استخدام قناع رقمي بنمط معرف من قبل المستخدم لشق طبقة التخميل في مواقع محددة. بعد ذلك ، يمكن احتضان محلول البروتين (أحمر ، ملصق) ولن يلتصق إلا بالمواقع التي تتم فيها إزالة طبقة التخميل. تخضع الخلايا المزروعة على الركيزة لكل من الهندسة وأنماط البروتين ، مما يتيح البحث في سلوك الخلايا في بيئات معقدة ، في بيئات تحاكي الجسم الحي. الاختصارات: PDMS = بولي ثنائي ميثيل سيلوكسان; mPEG-SVA = ميثوكسي بولي إيثيلين غليكول-سكسينيميديل فاليرات; PLPP = 4-بنزيل-ثلاثي ميثيل الأمونيوم كلوريد; LIMAP = الامتزاز الجزيئي الناجم عن الضوء للبروتينات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: مراحل مختلفة أثناء إنتاج وتخميل الركيزة 3D ثقافة الخلايا. تم تصميم القالب الزجاجي السلبي (# 1) باستخدام برنامج تصميم بمساعدة الكمبيوتر ويتم إنتاجه باستخدام تقنية الكتابة المباشرة ليزر الفيمتو ثانية. يستخدم هذا القالب لإنتاج رقاقة PDMS الإيجابية الوسيطة (# 2) وقالب PDMS السلبي (# 3) ، والتي تستخدم لاحقا لإنتاج رقاقة زراعة الخلايا النهائية (# 4). اختصار: PDMS = بولي ثنائي ميثيل سيلوكسان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: رسم تخطيطي لطريقتي النقش. على اليسار: يتم إجراء النمط الضوئي للأشعة فوق البنفسجية على ميزات أصغر (DMD واحد تقريبا) باستخدام مستوى بؤري واحد ونمط. نتيجة لذلك ، يتم نقش الميزة الكاملة دفعة واحدة. على اليمين: عند استخدام ميزات أكبر (أكبر من DMD واحد)، يتم تقسيم النقش على مستويات وأنماط بؤرية متعددة. اختصار: DMD = جهاز مرآة رقمية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
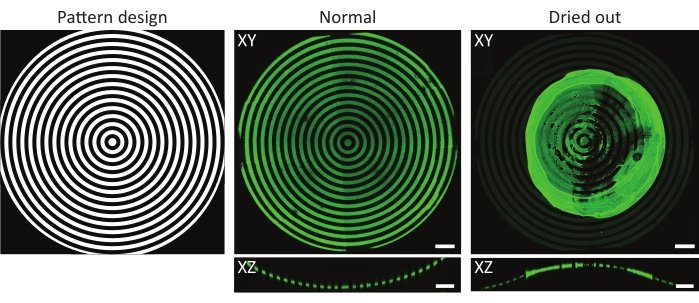
الشكل 4: مثال نموذجي على ركيزة طبيعية ومجففة محتضنة بالبروتين. إسقاطات الكثافة القصوى (XY) والمناظر المتعامدة (XZ) للركائز الطبيعية والمجففة المحتضنة للبروتين. عند غسل ركيزة زراعة الخلايا المنقوشة بعد الحضانة بمحلول بروتيني ، من الأهمية بمكان إبقاء العينة رطبة دائما. على الرغم من أن النمط متطابق في جميع الصور على المعالم (ĸ = 1/1000 ميكرومتر-1) ، إلا أن الجيلاتين والفلوريسين (الأخضر) تجمع لتشكيل كتلة كبيرة عندما تركت العينة لتجف لبضع ثوان. إذا ظلت العينة رطبة دائما ، فيمكن ملاحظة أنماط البروتين الصحيحة. أشرطة المقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: صور برايتفيلد بعد البذر. الخلايا القرنية الأولية (يسار) والخلايا الليفية الجلدية (يمين) 4 ساعات بعد البذر على ميزات هندسية ثلاثية الأبعاد (حفرة مقعرة من ĸ = 1/1000 ميكرومتر-1 وشبه أسطوانات من ĸ = 1/500 ، 1/375 ، 1/250 ، 1/175 ، و 1/125 ميكرومتر -1). تمثل الإدخالات العلوية اليسرى نمط الخط المستخدم في نقش الهندسات. تشير الأسهم البيضاء إلى الخلايا المنتشرة التي تظهر محاذاة بالفعل. أشرطة المقياس = 250 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
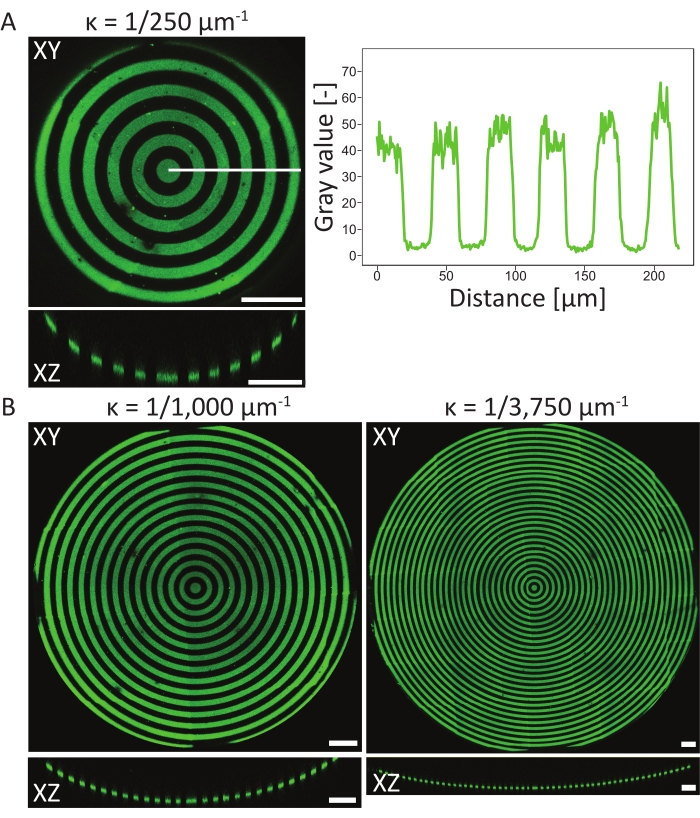
الشكل 6: توصيف الأنماط الدائرية على الحفر المقعرة. (أ) الإسقاط الأقصى للكثافة (XY) والرؤية المتعامدة (XZ) للحفرة المقعرة (ĸ = 1/250 ميكرومتر-1) منقوشة باستخدام LIMAP (عرض الخط: 20 ميكرومتر ، عرض الفجوة: 20 ميكرومتر) ومحتضنة بالجيلاتين الفلوريسين (الأخضر). يتم رسم ملف تعريف الكثافة على طول الخط الأبيض مقابل المسافة ، مما يدل على جودة نمط ثابت ودقة. (ب) النقش الإضافي الذي يتم إجراؤه على الحفر المقعرة مع ĸ = 1/1000 μm-1 و ĸ = 1/3750 μm-1 ، مما يدل على المرونة من حيث الميزات الهندسية التي يمكن استخدامها للنقش. مرة أخرى ، يتم تصور كل من إسقاطات الكثافة القصوى (XY) وطرق العرض المتعامدة (XZ). أشرطة المقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
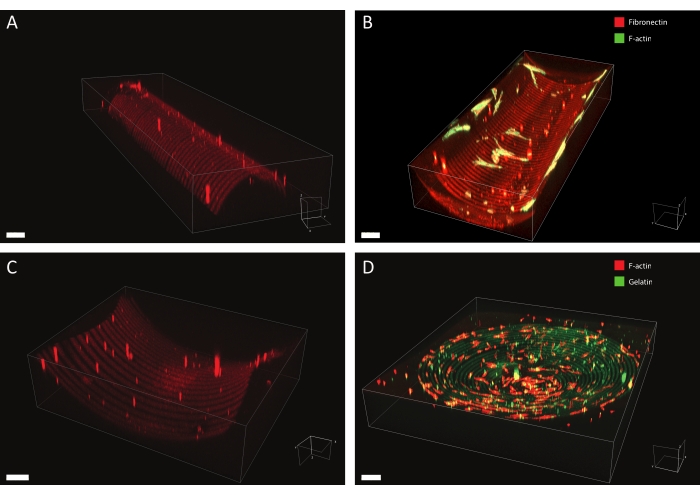
الشكل 7: بيانات الفحص المجهري ثلاثي الأبعاد للهياكل المنقوشة. أمثلة نموذجية لمواد زراعة الخلايا المنقوشة ثلاثية الأبعاد بعد التنميط الضوئي وثقافة الخلايا ، والتي تم تصورها باستخدام برنامج تقديم 3D. (أ) نصف أسطوانة محدبة منقوشة بخطوط عريضة 10 ميكرومتر (الرودامين-الفيبرونيكتين ، الأحمر) وفجوات واسعة 10 ميكرومتر. شريط المقياس = 5 ميكرومتر (B) الخلايا الليفية الجلدية الملطخة ب F-actin (الأخضر) المستزرعة على نصف أسطوانة مقعرة منقوشة بخطوط عريضة 20 ميكرومتر (الرودامين-الفيبرونيكتين ، الأحمر) وفجوات واسعة 20 ميكرومتر. شريط المقياس = 5 ميكرومتر (C) سطح السرج منقوش بخطوط عريضة 20 ميكرومتر (رودامين - فيبرونيكتين ، أحمر) وفجوات واسعة 20 ميكرومتر. شريط المقياس = 5 ميكرومتر (D) حفرة مقعرة منقوشة بدوائر متحدة المركز من خطوط عريضة 20 ميكرومتر (الجيلاتين والفلوريسين ، الأخضر) وفجوات واسعة 20 ميكرومتر. الهيكل الخلوي F-actin للخلايا القرنية البشرية ملطخ باستخدام phalloidin وتصوره باللون الأحمر. شريط المقياس = 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: تلطيخ الفلورسنت المناعي للخلايا الليفية الجلدية البشرية على نصف أسطوانة مقعرة منقوشة ضوئيا. (أ) الإسقاط الأقصى للكثافة (XY) والمقاطع المتعامدة (XZ و YZ) للخلايا الليفية الجلدية البشرية المستزرعة لمدة 24 ساعة على نصف أسطوانة مقعرة منقوشة (خطوط الفيبرونيكتين ، حمراء ، بعرض 5 ميكرومتر ، وفجوات 5 ميكرومتر). الخلايا ملطخة بالأكتين F-actin (أرجواني) ، فينكولين (أخضر) ، ونوى (أزرق). شريط المقياس = 100 ميكرومتر (ب) تكبير خلية تلتصق ببيئة متعددة الجوانب. أشرطة المقياس = 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 9: صور الفاصل الزمني لبرايت فيلد للخلايا الليفية الجلدية البشرية على أسطوانة مقعرة منقوشة. تم نقش نصف الأسطوانة المقعرة (ĸ = 1/250 ميكرومتر-1) بخطوط متوازية (فجوات بعرض 5 ميكرومتر وفجوات 5 ميكرومتر) واحتضانها بالرودامين-فيبرونيكتين قبل بذر الخلايا. يبدأ تصوير الفاصل الزمني بعد 1 ساعة من البذر الأولي للخلايا (يسار ، 0 دقيقة) ، عندما لا تزال الخلايا مستديرة وغير ملتصقة (الأسهم). بعد حوالي 24 ساعة (في الوسط ، 1420 دقيقة) ، التزمت الخلايا بالركيزة متعددة الإشارات وتظهر استجابة محاذاة وفقا لنمط توجيه الاتصال. يتم الحفاظ على كل من استجابة المحاذاة وجدوى الخلية طوال مدة المزرعة بأكملها (على اليمين، 3,180 دقيقة). أشرطة المقياس = 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو 1: مثال نمط على ركيزة أسطوانية ثلاثية الأبعاد. تمثيل 3D لأسطوانة محدبة منقوشة مع الرودامين-فيبرونيكتين (أحمر). يرجى النقر هنا لتنزيل هذا الفيديو.
الفيديو 2: تمثيل ثلاثي الأبعاد للخلايا الليفية الجلدية المستزرعة على ركيزة أسطوانية ثلاثية الأبعاد منقوشة (ĸ = 1/500 μm-1). الخلايا الليفية الجلدية المستزرعة لمدة 24 ساعة على شكل منقوش (خطوط الفيبرونيكتين ، الأحمر ، 10 ميكرومتر واسعة ، وفجوات 10 ميكرومتر) نصف أسطوانة محدبة. الخلايا ملطخة بالأكتين F-actin (أرجواني) ، فينكولين (أخضر) ، ونوى (أزرق). يرجى النقر هنا لتنزيل هذا الفيديو.
فيديو 3: تمثيل ثلاثي الأبعاد للخلايا القرنية البشرية المستزرعة على حفرة ثلاثية الأبعاد منقوشة (ĸ = 1/3,750 ميكرومتر-1). تمثيل ثلاثي الأبعاد للخلايا القرنية البشرية المستزرعة لمدة 24 ساعة في حفرة مقعرة ومنقوشة (دوائر الجيلاتين ، خضراء ، بعرض 20 ميكرومتر ، وفجوات 20 ميكرومتر). الخلايا ملطخة ب F-actin (أحمر). يرجى النقر هنا لتنزيل هذا الفيديو.
الفيديو 4: تصوير الفاصل الزمني Brightfield للخلايا الليفية الجلدية البشرية على أسطوانة مقعرة منقوشة. تم نقش نصف الأسطوانة المقعرة (ĸ = 1/250 ميكرومتر-1) بخطوط متوازية (فجوات بعرض 5 ميكرومتر وفجوات 5 ميكرومتر) واحتضانها بالرودامين-فيبرونيكتين قبل بذر الخلايا. يبدأ التصوير بالفاصل الزمني بعد 1 ساعة من البذر الأولي للخلايا ، عندما تظهر الخلايا الالتزام الأولي بالبيئة متعددة الجوانب. خلال الفاصل الزمني الكامل ، يتم توجيه الخلايا في الغالب على طول إشارات توجيه الاتصال ، مع الحفاظ على صلاحية الخلية. يرجى النقر هنا لتنزيل هذا الفيديو.
Discussion
في الوقت الحاضر ، غالبا ما يتم دراسة سلوك الخلية على ركائز المزارع المسطحة التي تفتقر إلى تعقيد البيئة الدقيقة للخلية الأصلية. يتم استخدام بيئات 3D مثل السقالات والمواد الهلامية المائية كبديل. على الرغم من أن بيئات زراعة الخلايا هذه تحسن من أهمية الجسم الحي ، إلا أن كل من الدراسات المنهجية لسلوك الخلية وجدوى طرق القراءة لا تزال صعبة. للتحقيق بشكل منهجي في سلوك الخلية على ركائز الثقافة التمثيلية ، هناك حاجة إلى ركائز متعددة الإشارات متسقة تسمح بالقراءة المجهرية. لذلك ، في هذا البروتوكول ، نصف طريقة لإنشاء ركائز زراعة الخلايا متعددة الإشارات مع الهندسة ذات الصلة من الناحية الفسيولوجية وبروتينات ECM المنقوشة. التحدي الرئيسي في الجمع بين الإشارات البيئية مثل هندسة الأنسجة وإشارات توجيه الاتصال على منصات المختبر هو إلى حد كبير ذو طبيعة تكنولوجية. تم تحسين الطرق التقليدية لتطبيق إشارات توجيه التلامس (مثل الطباعة الحجرية الناعمة ، والنقش العميق للأشعة فوق البنفسجية ، والطباعة الدقيقة 35,36) على مواد زراعة الخلايا للركائز المستوية. أبرزت الحاجة إلى مواد زراعة الخلايا 3D جنبا إلى جنب مع إشارات توجيه الاتصال العديد من التحديات التكنولوجية ، مثل سوء محاذاة النمط والدقة والمرونة. للتغلب على هذه التحديات ، يمكن استخدام طريقة نقش عالية الإنتاجية وغير مقنعة وقائمة على الضوء45,49. هنا ، يتيح المجهر الضوئي محاذاة دقيقة للنمط ودقة في ترتيب الميكرومتر (انظر الشكل 6). علاوة على ذلك ، فإن استخدام قناع رقمي يمكن الباحثين من دراسة سلوك الخلايا على مجموعة واسعة من الأنماط دون الحاجة إلى تصنيع أقنعة جسدية كثيفة العمالة.
يمكن استخدام نهج التصوير الضوئي بالأشعة فوق البنفسجية مع مجموعة متنوعة من الهندسة 3D (على سبيل المثال ، الأسطوانات والسروج والقباب والحفر) المنتجة من مجموعة من المواد48. الركائز زراعة الخلايا 3D المستخدمة في هذه الدراسة مصنوعة من PDMS. ومع ذلك ، يمكن استخدام مواد أخرى أيضا. قد يتطلب ذلك خطوات مختلفة لإنتاج الركيزة النهائية لزراعة الخلايا التي تحتوي على الميزات المثيرة للاهتمام. نظرا لأن الخلايا قد ثبت أنها حساسة لخشونة سطح مواد زراعة الخلايا ، فمن المهم إنشاء رقائق زراعة الخلايا بسطح أملس بحيث يمكن أن تعزى استجابة الخلايا المرصودة بالكامل إلى الهندسة ثلاثية الأبعاد وإشارات توجيه الاتصال50,51. يمكن استخدام طرق القياس مثل التنميط البصري أو المجهر الإلكتروني الماسح أو مجهر القوة الذرية لقياس خشونة السطح. بعد تصنيع مادة زراعة الخلايا ، يمكن للمرء اختيار طريقة نقش تستند إلى مستوى بؤري واحد أو عدة مستويات تعتمد على الأبعاد المحددة للميزة ذات الاهتمام (انظر الشكل 3). عادة ، يتم استخدام مستوى بؤري واحد لنمط منطقة داخل نطاق Z يبلغ حوالي 50 ميكرومتر. وتبين أن دقة النمط متسقة باستخدام هذه القاعدة الأساسية (انظر الشكل 6). ومع ذلك ، فإن الجانب السلبي لهذه الطريقة هو زيادة وقت التنميط مع إدخال مستويات وأنماط بؤرية متعددة. في أيدينا ، باستخدام مستويات بؤرية متعددة ، تم تصميم الميزات الهندسية ثلاثية الأبعاد التي تصل إلى 16 مم × 16 مم × 0.17 مم (X x Y × Z) بنجاح بجودة عالية النمط.
بالإضافة إلى ذلك ، من المهم الإشارة إلى أن الارتفاع (Z-axis) للميزات الهندسية التي يمكن استخدامها مع هذا البروتوكول محدود. نظرا لأن كلا من النمط الضوئي للأشعة فوق البنفسجية والعديد من القراءات الخلوية تعتمد على إعداد الفحص المجهري ، فإن مسافة العمل للأهداف تحدد الحد الأقصى لارتفاع الميزة. في أيدينا ، لا يزال من الممكن أن تكون الأشكال الهندسية التي يتجاوز ارتفاعها 300 ميكرومتر منقوشة بالأشعة فوق البنفسجية ، وقد تم إجراء القراءات باستخدام مجهر متحد البؤرة بأهداف 40x. وبالتالي ، فإن البحوث الميكانيكية البيولوجية التي تتراوح من داخل الخلايا إلى المقاييس الخلوية والأنسجة ممكنة باستخدام البروتوكول الموصوف.
عامل آخر يجب مراعاته هو خطر جفاف العينات أثناء أو بعد التصوير الضوئي للأشعة فوق البنفسجية49. هذا مهم بشكل خاص عند استخدام هندسات 3D ، حيث غالبا ما تتعرض التحدبات خارج مواد زراعة الخلايا. كما هو موضح في الشكل 4 ، قد يؤدي ذلك إلى أنماط غير متساوية مع تشكل مجاميع البروتين فوق ميزة الاهتمام. غسل رقائق زراعة الخلايا بعد حضانة البروتين وأثناء زراعة الخلايا أمر بالغ الأهمية للطلاء السليم للهندسة 3D. لذلك ، ينصح دائما بترك كميات صغيرة من محلول العمل (PBS ، PLPP ، محلول البروتين ، وسط زراعة الخلايا) فوق شريحة زراعة الخلايا.
حتى الآن ، تم استخدام العديد من طلاءات البروتين (الفيبرونيكتين ، الكولاجين من النوع الأول والرابع ، الجيلاتين ، FNC) وأنواع الخلايا (الخلايا اللحمية لنخاع العظم البشري ، الخلايا الليفية العضلية البشرية ، الخلايا البطانية البشرية ، الخلايا القرنية البشرية ، والخلايا الليفية الجلدية) بالاقتران مع نهج التنميط الضوئي الموصوف على مواد زراعة الخلايا المنظمة. كما هو موضح في دراسة سابقة48 ، فإن تحسين معلمات حضانة البروتين هو المفتاح للتحقيق المنهجي في أنواع الخلايا الجديدة. لذلك ، قبل إجراء تجربة جديدة مع بروتينات أو خلايا جديدة ، ينصح باختبار مجموعة من تركيزات البروتين ودرجات حرارة الحضانة وأوقات الحضانة. من خلال مقارنة مورفولوجيا الخلية بعد الالتصاق الأولي في مناطق مسطحة متجانسة ومنقوشة مع مورفولوجيا الخلية في ظل ظروف زراعة الخلايا "الطبيعية" ، يمكن الحصول على مجموعة محسنة من المعلمات التجريبية. بالإضافة إلى ذلك ، قد يتطلب كل نوع من الخلايا فترة زمنية مختلفة بعد البذر لإظهار مورفولوجيا التصاق يمكن التعرف عليها في بيئة محددة متعددة الإشارات (انظر الشكل 5). تحقيقا لهذه الغاية ، من الأهمية بمكان تحسين الوقت اللازم لكل نوع خلية لتقديم أحداث الاتصال على المنطقة المنقوشة أثناء الغسيل في الخطوة 8.4. على سبيل المثال ، لاحظنا أنه على أنماط الخط ، تظهر الخلايا القرنية البشرية مورفولوجيا ممدودة خلال أول 30 دقيقة بعد البذر ، في حين تتطلب الخلايا البطانية والخلايا الليفية الجلدية عدة ساعات قبل إظهار تغيير في مورفولوجيا الالتصاق. وبالتالي فإن المعلمات التجريبية المطلوبة لحضانة البروتين (الخطوة 7) وبذر الخلايا (الخطوة 8) قد تعتمد على البروتين ونوع الخلية المختارة.
يمكن أن يساعد النهج المقدم لتطبيق إشارات توجيه الاتصال على هندسة 3D في خلق فهم أعمق لسلوك الخلية في بيئات معقدة متعددة الإشارات. يمكن أن يشمل ذلك التحقيقات في المكونات داخل الخلايا ، مثل الالتصاقات البؤرية والنوى ، ويمكن أن يشمل أيضا تجارب أجريت على نطاق أكبر أو خلية أو نسيج باستخدام الطريقة المقترحة. في نهاية المطاف، من المتوقع أن المعرفة المكتسبة يمكن استخدامها في تصميم تطبيقات هندسة الأنسجة، حيث تم تصميم البيئات الخلوية المعقدة لتوجيه سلوك الخلايا نحو النتيجة المرجوة.
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نشكر الدكتور نيلو فورميسانو (معهد MERLN للطب التجديدي المستوحى من التكنولوجيا) على توفير خلايا القرنية الأولية البشرية. وقد تم دعم هذا العمل من قبل Chemelot InSciTe (المشروع BM3.02)؛ مجلس البحوث الأوروبي (منحة 851960)؛ ووزارة التربية والتعليم والثقافة والعلوم لبرنامج الجاذبية 024.003.013 "التجديد المدفوع بالمواد". يود المؤلفون أن يشكروا Alvéole على مراسلاتهم ومساعدتهم واستكشاف الأخطاء وإصلاحها.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-vinculin antibody, mouse monoclonal IgG1 | Sigma | V9131 | Dilution: 1/600 |
| Bovine Serum albumin, Fraction V | Roche | 10735086001 | |
| DMEM, high glucose, pyruvate | Gibco | 41966029 | |
| DMEM/F-12 + GlutaMAX (1x) | Gibco | 10565018 | |
| DMi8 epifluorescent microscope | Leica Microsystems | ||
| Ethanol | Biosolve | 0005250210BS | |
| Fetal Bovine Serum | Serana | 758093 | |
| Fiji/ImageJ, version v1.53k | www.imageJ.nih.gov | ||
| Fluorescent highlighter | Stabilo | 4006381333627 | |
| Fluorescin-labeled gelatin | Invitrogen | G13187 | Concentration: 0.01% |
| Formaldehyde solution | Merck | F8775 | |
| Glass coverslips 24 x 60 mm, #1 | VWR | 631-1575 | |
| Glass coverslips, ø = 32 mm, #1 | Menzel-Gläser | ||
| HCX PL fluotar L 20X/0.40na microscope objective | Leica | 11506242 | |
| HEPES | Gibco | 15630080 | |
| Human dermal fibroblasts | Lonza | CC-2511 | |
| Human primary keratocytes | MERLN Institute for Technology-Inspired Regenerative Medicine | ||
| Illustrator, Version 26.0.1 | Adobe | ||
| Laboratory oven | Carbolite | ||
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960 | |
| Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Leonardo software, version 4.16 | Alvéole | ||
| Micro-manager, version 1.4.23 | Open imaging | ||
| Mowiol 4-88 | Sigma-Aldrich | 81381 | mounting medium |
| mPEG-succinimidyl valerate MW 5,000 Da | Laysan Bio | MPEG-SVA-5000 | Concentration: 50 mg/mL |
| Negative glass mold | FEMTOprint | ||
| NucBlue Live Readyprobes Reagent (Hoechst 33342) | Invitrogen | R37605 | 2 drops/mL |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140163 | |
| Petri dish (ø=100 mm) | Greiner Bio-one | 664160 | |
| Phalloidin Atto 647N | Sigma | 65906 | Dilution: 1/250 |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Plasma asher | Emitech | K1050X | |
| PLPP (photoinitiator) | Alvéole | ||
| Poly-L-lysine, sterile-filtered | Sigma-Aldrich | P4707 | Concentration: 0.01% |
| PRIMO | Alvéole | ||
| Rhodamine-labeled fibronectin | Cytoskeletn, Inc. | FNR01 | Concentration: 10 µg/mL |
| Secondary antibody with Alexa 488, Goat anti-mouse IgG1 (H) | Molecular Probes | A21121 | Dilution: 1/300 |
| Secondary antibody with Alexa 555, Goat anti-mouse IgG1 (H) | Molecular Probes | A21127 | Dilution: 1/300 |
| Spin coater | Leurell Technologies Corporation | model WS-650MZ-23NPPB | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 1673921 | |
| TCS SP8X confocal microscope | Leica Microsystems | ||
| tridecafluoro(1,1,2,2-tetrahydrooctyl)trichlorosilane | ABCR | AB111444 | |
| TrypLE Express Enzyme (1x), no phenol red | Gibco | 12604013 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 |
References
- Wang, Y., Wang, G., Luo, X., Qiu, J., Tang, C. Substrate stiffness regulates the proliferation, migration, and differentiation of epidermal cells. Burns. 38, 414-420 (2012).
- Viswanathan, P., et al. 3D surface topology guides stem cell adhesion and differentiation. Biomaterials. 52, 140-147 (2015).
- Peyton, S. R., et al. Marrow-derived stem cell motility in 3D synthetic scaffold is governed by geometry along with adhesivity and stiffness. Biotechnology and Bioengineering. 108 (5), 1181-1193 (2011).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nature Reviews Molecular Cell Biology. 18 (12), 728-742 (2017).
- Chaudhuri, O., Cooper-White, J., Janmey, P. A., Mooney, D. J., Shenoy, V. B. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584, 535-546 (2020).
- Guido, S., Tranquillo, R. T. A methodology for the systematic and quantitative study of cell contact guidance in oriented collagen gels. Correlation of fibroblast orientation and gel birefringence. Journal of Cell Science. 105 (2), 317-331 (1993).
- Teixeira, A. I., Abrams, G. A., Bertics, P. J., Murphy, C. J., Nealey, P. F. Epithelial contact guidance on well-defined micro- and nanostructured substrates. Journal of Cell Science. 116, 1881-1892 (2003).
- Driscoll, M. K., Sun, X., Guven, C., Fourkas, J. T., Losert, W. Cellular contact guidance through dynamic sensing of nanotopography. ACS Nano. 8 (4), 3546-3555 (2014).
- Buskermolen, A. B. C., et al. Cellular contact guidance emerges from gap avoidance. Cell Reports Physical Science. 1 (5), 100055 (2020).
- Thrivikraman, G., et al. Cell contact guidance via sensing anisotropy of network mechanical resistance. Proceedings of the National Academy of Sciences of the United States of America. 118 (29), 1-11 (2021).
- Buskermolen, A. B. C., et al. Entropic forces drive cellular contact guidance. Biophysical Journal. 116 (10), 1994-2008 (2019).
- Vignaud, T., et al. Reprogramming cell shape with laser nano-patterning. Journal of Cell Science. 125 (9), 2134-2140 (2012).
- Pouthas, F., et al. In migrating cells, the Golgi complex and the position of the centrosome depend on geometrical constraints of the substratum. Journal of Cell Science. 121 (14), 2406-2414 (2008).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Théry, M., et al. Anisotropy of cell adhesive microenvironment governs cell internal organization and orientation of polarity. Proceedings of the National Academy of Sciences of the United States of America. 103 (52), 19771-19776 (2006).
- Huang, G., et al. Functional and biomimetic materials for engineering of the three-dimensional cell microenvironment. Chemical Reviews. 117 (20), 12764-12850 (2017).
- Callens, S. J. P., Uyttendaele, R. J. C., Fratila-Apachitei, L. E., Zadpoor, A. A. Substrate curvature as a cue to guide spatiotemporal cell and tissue organization. Biomaterials. 232, 119739 (2020).
- Yilmaz, C. O., Xu, Z. S., Gracias, D. H. Curved and Folded Micropatterns in 3D Cell Culture and Tissue Engineering. Methods in Cell Biology. 121, (2014).
- Silver, F. H., Freeman, J. W., Seehra, G. P. Collagen self-assembly and the development of tendon mechanical properties. Journal of Biomechanics. 36 (10), 1529-1553 (2003).
- Werner, M., Kurniawan, N. A., Bouten, C. V. C. Cellular geometry sensing at different length scales and its implications for scaffold design. Materials. 13 (4), 963 (2020).
- Di Cio, S., Bøggild, T. M. L., Connelly, J., Sutherland, D. S., Gautrot, J. E. Differential integrin expression regulates cell sensing of the matrix nanoscale geometry. Acta Biomaterialia. 50, 280-292 (2017).
- Fioretta, E. S., Simonet, M., Smits, A. I. P. M., Baaijens, F. P. T., Bouten, C. V. C. Differential response of endothelial and endothelial colony forming cells on electrospun scaffolds with distinct microfiber diameters. Biomacromolecules. 15 (3), 821-829 (2014).
- Werner, M., Kurniawan, N. A., Korus, G., Bouten, C. V. C., Petersen, A. Mesoscale substrate curvature overrules nanoscale contact guidance to direct bone marrow stromal cell migration. Journal of The Royal Society Interface. 15 (145), 20180162 (2018).
- Ruprecht, V., et al. How cells respond to environmental cues - insights from bio-functionalized substrates. Journal of Cell Science. 130 (1), 51-61 (2017).
- Bao, M., Xie, J., Huck, W. T. S. Recent advances in engineering the stem cell microniche in 3D. Advanced Science. 5 (1800448), 1-16 (2018).
- Zhan, X. Effect of matrix stiffness and adhesion ligand density on chondrogenic differentiation of mesenchymal stem cells. Journal of Biomedical Materials Research - Part A. 108 (3), 675-683 (2020).
- Jiang, T., et al. Untangling the response of bone tumor cells and bone forming cells to matrix stiffness and adhesion ligand density by means of hydrogels. Biomaterials. 188, 130-143 (2019).
- Choi, J. S., Harley, B. A. C. The combined influence of substrate elasticity and ligand density on the viability and biophysical properties of hematopoietic stem and progenitor cells. Biomaterials. 33, 4460-4468 (2012).
- Rape, A. D., Zibinsky, M., Murthy, N., Kumar, S. A synthetic hydrogel for the high-throughput study of cell-ECM interactions. Nature Communications. 6 (8129), 1-9 (2015).
- Camarero-Espinosa, S., et al. 3D printed dual-porosity scaffolds: the combined effect of stiffness and porosity in the modulation of macrophage polarization. Advanced Healthcare Materials. 11 (2101415), 1-16 (2022).
- Bao, M., et al. Cellular volume and matrix stiffness direct stem cell behavior in a 3D microniche. ACS Applied Materials and Interfaces. 11 (2), 1754-1759 (2019).
- Charest, J. L., Eliason, M. T., García, A. J., King, W. P. Combined microscale mechanical topography and chemical patterns on polymer cell culture substrates. Biomaterials. 27, 2487-2494 (2006).
- Bilem, I., et al. Interplay of Geometric Cues and RGD/BMP-2 crosstalk in directing stem cell fate. ACS Biomaterials Science and Engineering. 3 (10), 2514-2523 (2017).
- Nam, K. -. H., et al. Multiscale cues drive collective cell migration. Scientific Reports. 6, 29749 (2016).
- Alom Ruiz, S., Chen, C. S. Microcontact printing: A tool to pattern. Soft Matter. 3 (2), 168-177 (2007).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Protein Micropatterns. A Direct Printing Protocol Using Deep UVs. Methods in Cell Biology. 97, (2010).
- Kane, R. S., Takayama, S., Ostuni, E., Ingber, D. E., Whitesides, G. M. Patterning proteins and cells using soft lithography. Biomaterials. 20 (23-24), 2363-2376 (1999).
- Azioune, A., Storch, M., Bornens, M., Théry, M., Piel, M. Simple and rapid process for single cell micro-patterning. Lab on a Chip. 9 (11), 1640 (2009).
- Offenhäusser, A., et al. Microcontact printing of proteins for neuronal cell guidance. Soft Matter. 3 (3), 290-298 (2007).
- Ricoult, S. G., Sanati Nezhad, A., Knapp-Mohammady, M., Kennedy, T. E., Juncker, D. Humidified microcontact printing of proteins: universal patterning of proteins on both low and high energy surfaces. Langmuir. 30 (40), 12002-12010 (2014).
- Waterkotte, B., et al. Biofunctional Micropatterning of Thermoformed 3D Substrates. Advanced Functional Materials. 24 (4), 442-450 (2014).
- Lehnert, D., et al. Cell behaviour on micropatterned substrata: Limits of extracellular matrix geometry for spreading and adhesion. Journal of Cell Science. 117 (1), 41-52 (2004).
- Sevcik, E. N., Szymanski, J. M., Jallerat, Q., Feinberg, A. W. Patterning on topography for generation of cell culture substrates with independent nanoscale control of chemical and topographical extracellular matrix cues. Current Protocols in Cell Biology. 75, 1-25 (2017).
- Micropatterning: Surface functionalization. Alvéole Available from: https://www.alveolelab.com/technology/micropatterning-surface-functionalization/ (2022)
- Strale, P. O., et al. Multiprotein printing by light-induced molecular adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- van Gaal, R. C., Miltenburg, R. P. R. S., Kurniawan, N. A., Bouten, C. V. C., Dankers, P. Y. W. Renal epithelial cell responses to supramolecular thermoplastic elastomeric concave and convex structures. Advanced Materials Interfaces. 8 (1), 2001490 (2021).
- Foster, J. W., Gouveia, R. M., Connon, C. J. Low-glucose enhances keratocyte-characteristic phenotype from corneal stromal cells in serum-free conditions. Scientific Reports. 5, 1-16 (2015).
- Van Der Putten, C., et al. Protein micropatterning in 2.5D: an approach to investigate cellular responses in multi-cue environments. ACS Applied Materials and Interfaces. 13 (22), 25589-25598 (2021).
- Melero, C., et al. Light-induced molecular adsorption of proteins using the primo system for micro-patterning to study cell responses to extracellular matrix proteins. Journal of Visualized Experiments. (152), e60092 (2019).
- Hou, Y., et al. Surface roughness gradients reveal topography-specific mechanosensitive responses in human mesenchymal stem cells. Small. 16 (10), 1905422 (2020).
- Bourkoula, A., et al. Roughness threshold for cell attachment and proliferation on plasma micro-nanotextured polymeric surfaces: The case of primary human skin fibroblasts and mouse immortalized 3T3 fibroblasts. Journal of Physics D: Applied Physics. 49 (30), 304002 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved