Method Article
Генерация многоклеточных клеточных микросред путем УФ-фотоструктурирования трехмерных субстратов клеточных культур
В этой статье
Резюме
Традиционно клеточную культуру выполняют на планарных субстратах, которые плохо имитируют естественную среду клеток in vivo. Здесь мы описываем метод получения субстратов клеточных культур с физиологически значимой изогнутой геометрией и микроструктурированными внеклеточными белками, что позволяет систематически исследовать клеточное восприятие этих внеклеточных сигналов.
Аннотация
Внеклеточный матрикс является важным регулятором клеточной функции. Все чаще показано, что сигналы окружающей среды, существующие в клеточной микросреде, такие как распределение лигандов и геометрия тканей, играют решающую роль в управлении фенотипом и поведением клеток. Тем не менее, эти экологические сигналы и их влияние на клетки часто изучаются отдельно с использованием платформ in vitro , которые изолируют отдельные сигналы, стратегия, которая сильно упрощает сложную ситуацию in vivo с несколькими сигналами. Инженерные подходы могут быть особенно полезны для преодоления этого разрыва путем разработки экспериментальных установок, которые отражают сложность микросреды in vivo , но сохраняют степень точности и управляемости систем in vitro .
В этом исследовании подчеркивается подход, сочетающий в себе структурирование белка на основе ультрафиолета (УФ) и микрофабрикацию субстрата на основе литографии, которые вместе позволяют проводить высокопроизводительные исследования поведения клеток в многоклеточных средах. С помощью безмаскировочного УФ-фотоструктурирования можно создавать сложные, адгезивные распределения белка на трехмерных (3D) субстратах клеточных культур на чипах, которые содержат множество четко определенных геометрических сигналов. Предложенная методика может быть использована для культивирования подложек, изготовленных из различных полимерных материалов и сочетаемых с клеевыми узорчатыми участками широкого спектра белков. При таком подходе одиночные ячейки, а также монослои могут подвергаться воздействию комбинаций геометрических сигналов и контактных направляющих сигналов, представленных узорчатыми субстратами. Таким образом, систематические исследования с использованием комбинаций материалов чипов, белковых паттернов и типов клеток могут дать фундаментальное представление о клеточных реакциях на мультикюйные среды.
Введение
In vivo клетки подвергаются воздействию широкого спектра сигналов окружающей среды, которые могут иметь механическую, физическую и биохимическую природу, которые происходят из внеклеточного матрикса (ECM). Было выявлено, что многочисленные экологические сигналы играют жизненно важную роль в регуляции поведения клеток, такие как пролиферация, дифференциация и миграция 1,2,3,4,5. Одним из наиболее широко исследованных явлений является контактное руководство, описывающее адгезионно-опосредованное выравнивание клеток по анизотропным биохимическим или топографическим паттернам, присутствующим на внеклеточном субстрате 6,7,8,9,10,11. Помимо направления выравнивания клеток, контактные направляющие сигналы также влияют на другие свойства клеток, такие как миграция клеток, организация внутриклеточных белков, форма клеток и судьба клеток 12,13,14,15. Кроме того, геометрическая архитектура 3D-клеточной среды также была признана за ее регуляторное влияние на поведение клеток16,17. В организме человека клетки подвергаются воздействию ряда изогнутых геометрий, начиная от микромасштабных коллагеновых волокон, капилляров и клубочков, до мезомасштабных альвеол и артерий 18,19. Интересно, что недавние исследования in vitro показали, что клетки могут ощущать и реагировать на такие физические сигналы, от нано- до мезомасштаба 20,21,22,23.
На сегодняшний день большинство исследований, изучающих реакцию клеток на сигналы окружающей среды, в основном проводились с использованием экспериментальных установок, которые изолируют одиночные сигналы. Хотя этот подход позволил добиться огромного прогресса в понимании основных механизмов, лежащих в основе клеточного зондирования сигналов окружающей среды, он плохо повторяет среду in vivo, которая одновременно представляет несколько сигналов. Чтобы преодолеть этот разрыв, полезно разработать культурные платформы, с помощью которых можно будет независимо и одновременно контролировать несколько экологических сигналов. Эта концепция приобрела все большую популярность в последнее время24,25, с исследованиями, сочетающими жесткость матрицы и плотность лигандов 26,27,28,29, жесткость и пористость подложки30, жесткость подложки и объем 3D-микронича 31, топографию поверхности и контактные сигналы 32,33,34 , и наноразмерные контактные направляющие сигналы с мезомасштабной кривизной23. Тем не менее, по-прежнему сложно комбинировать контактные подсказки с различными 3D-геометриями контролируемым и высокопроизводительным способом.
Этот протокол исследования решает эту проблему и вводит метод создания субстратов клеточной культуры с контролируемой комбинацией узорчатых адгезивных областей белков ECM (контактные сигналы) и кривизны субстрата (геометрические сигналы). Этот подход позволяет проводить рассечение клеточного ответа в биомиметической мультикуэтической среде систематическим и высокопроизводительным образом. Полученные знания могут помочь в дальнейшем понимании поведения клеток в сложных средах и могут быть использованы для разработки поучительных материалов со свойствами, которые направляют клеточные реакции в желаемый результат.
3D-фотоструктурирование белка
Создание адгезивных участков белков ECM (контактно-направляющих сигналов) на материалах клеточной культуры может быть выполнено с использованием различных методов, например, методом глубоко-ультрафиолетового (глубокого УФ) паттернирования или микроконтактной печати35,36. Глубокое УФ-моделирование использует ультрафиолетовый свет, который проецируется через маску на полимерный материал для разложения пассивирующих полимеров в определенных местах на подложке клеточной культуры. Затем узорчатый субстрат инкубируют с интересующим лигандом, в результате чего образуются адгезивные области, которые поддерживают прикрепление клеток и культивирование в предопределенных местах 12,37,38. Альтернативным способом введения белковых паттернов является микроконтактная печать, где эластомерные штампы, содержащие желаемую форму, покрываются белком выбора и прессуются на подложке клеточной культуры, тем самым перенося белковое покрытие, к которому клетки могут прилипать 35,37,39,40 . К сожалению, поскольку обе методики опираются на подготовку масок и методы мягкой литографии, эксперименты являются трудоемкими и трудоемкими, а также ограниченными с точки зрения гибкости рисунка. Кроме того, как глубокое УФ-моделирование, так и микроконтактная печать наиболее подходят для планарных материалов и технически сложны, если не невозможны, для моделирования лигандов в 3D-среде.
Чтобы улучшить эти традиционные методы, Waterkotte et al. объединили безмаскочную литографию, химическое осаждение из паров и термоформование для получения микроструктурированных 3D-полимерных подложек41. Тем не менее, этот метод основан на использовании термоформуемых полимерных пленок и предлагает низкое разрешение белкового паттерна (7,5 мкм), в то время как клетки, как сообщается, реагируют на геометрические белковые паттерны размером до 0,1 мкм 2,42. Sevcik et al. описали еще один многообещающий способ наношаблонирования лигандов ECM на подложках, содержащих нано- и микрометровые топографии43. Используя микроконтактную печать, белки ECM переносили с полидиметилсилоксановых (PDMS) марок на термочувствительную поли(N-изопропилакриламидную) (pNIPAM) подложку. Впоследствии термочувствительное свойство сети pNIPAM позволило им перенести двумерный (2D) белковый рисунок на топографическую подложку PDMS (глубокие канавки 10-100 мкм), тем самым контролируя локализацию участков адгезии по топографическим признакам. Однако не все возможные микротопографии могут быть структурированы, поскольку снижение проблем смачиваемости затрудняет моделирование более глубоких топографических подложек. Сообщалось, что траншеи с соотношением глубины к ширине 2,4 являются конечным пределом для успешной передачи рисунка на топографическую подложку43. Кроме того, гибкость различных шаблонов и разрешение генерируемых шаблонов являются низкими из-за требований микроконтактной печати.
В данной работе описывается метод, который преодолевает вышеупомянутые узкие места и предлагает гибкий и высокопроизводительный метод создания многопроходных субстратов, которые могут быть использованы для клеточной культуры (см. Рисунок 1). Физиологически значимые геометрии (цилиндры, купола, эллипсы и седловидные поверхности) с кривизнами в диапазоне от ĸ = 1/2500 до ĸ = 1/125 мкм-1 предварительно спроектированы и микрофабрикованы в чипах PDMS. Впоследствии контактные подсказки создаются поверх 3D-геометрии с использованием различных цифровых шаблонов с использованием техники фотоструктурирования с разрешением всего 1,5 мкм44. С этой целью чипы PDMS изначально пассивируются, чтобы предотвратить прилипание клеток и белков; этот пассивационный слой затем может быть удален комбинацией фотоинициатора 4-бензоилбензил-триметиламмония хлорида (PLPP) и воздействия ультрафиолетового света45. Цифровая маска предназначена для указания мест УФ-экспозиции, и, таким образом, области, где удаляется пассивационный слой. Белки могут впоследствии прилипать к этим областям, обеспечивая прикрепление клеток. Поскольку моделирование выполняется с использованием цифровой (а не физической) маски, различные узоры могут быть созданы быстро без хлопот и затрат, связанных с проектированием и изготовлением дополнительных фотошаблонов. Кроме того, разнообразный спектр белков ECM (например, коллаген типа I, желатин и фибронектин) может быть структурирован на субстрате. Хотя этот протокол выполняется с использованием чипов клеточной культуры, изготовленных из PDMS, этот принцип может быть применен к любому другому материалу, представляющему интерес46.
протокол
В исследованиях, описанных в этом протоколе, использовались первичные кератоциты человека. Это исследование проводилось в соответствии с принципами Хельсинкской декларации. Первичные кератоциты были выделены из оставшихся трупных корнеосклеральных тканей человека из операции Descemet Membrane Endothelial Keratoplasty, которые были получены из отделения роговицы Многотканевого центра ETB-BISLIFE (Бевервейк, Нидерланды) после получения согласия от ближайших родственников всех умерших доноров.
ПРИМЕЧАНИЕ: Смотрите Таблицу материалов для получения подробной информации обо всех материалах, реагентах, оборудовании и программном обеспечении, используемых в этом протоколе.
1. Изготовление субстратов для 3D клеточных культур
- Создайте отрицательную стеклянную форму (No 1), содержащую все интересующие признаки, в данном случае изготовленную из стекла с использованием фемтосекундно-лазерной техники прямой записи (см. Рисунок 2).
- Аккуратно поместите негативную стеклянную форму (No1) на дно чашки Петри.
- Подготовьте преполимер PDMS, поместив пустую коническую трубку объемом 50 мл на весы, протрите шкалу и налейте нужное количество силиконового эластомерного основания в трубку.
- Добавьте отверждающий агент с помощью пипетки Пастера таким образом, чтобы конечное соотношение основания эластомера и отверждающего агента составляло 10:1 (w/w).
- Тщательно перемешайте компоненты в конической трубке с помощью шпателя.
- Центрифуга при 2000 × г в течение 70 с для удаления всех пузырьков воздуха.
- Вылейте преполимер PDMS поверх отрицательной стеклянной формы (No 1) в чашку Петри, чтобы полностью покрыть ее.
- Поместите чашку Петри с отрицательной стеклянной формой (No1) и преполимером PDMS в вакуумный осушитель и запустите вакуумный насос. Как только вакуум будет достигнут, подождите 5 минут, чтобы удалить все пузырьки, присутствующие на границе раздела между поверхностью формы и преполимером PDMS.
- Снимите вакуум и выньте чашку Петри из осушителя.
- Отверните преполимер PDMS на ночь в духовке при 65 °C.
- Осторожно извлеките недавно отвержденный положительный чип PDMS (No 2) из отрицательной стеклянной формы (No 1), подняв края PDMS с помощью шпателя. Если положительный чип PDMS (# 2) имеет тенденцию прилипать к отрицательной стеклянной форме (# 1), добавьте этанол или воду к краям отпечатка во время подъема.
ПРИМЕЧАНИЕ: Жидкость будет проходить между двумя слоями и облегчит разделение отрицательной стеклянной формы (# 1) и положительного чипа PDMS (# 2). - Используя лезвие, отрежьте стороны положительного чипа PDMS (# 2), чтобы остался прямоугольный чип.
- Поместите положительный чип PDMS (No 2) в адсикатор рядом с небольшим флаконом с капелькой тридекафтор(1,1,2,2-тетрагидрооктил)трихлорсилана, силанизирующего агента, и оставьте под вакуумом на ночь.
ПРИМЕЧАНИЕ: Силанизация гарантирует, что отпечаток не будет привязан к другим слоям PDMS позже в протоколе. Другие силанизирующие агенты и/или методы также могут работать для обеспечения того, чтобы поверхности чипов PDMS не прилипали к другим слоям PDMS.
ВНИМАНИЕ: Тридекафтор(1,1,2,2-тетрагидрооктил)трихлорсилан легковоспламеняется (H226) и вызывает тяжелые ожоги кожи и повреждения глаз (H314). Носите средства индивидуальной защиты, работайте в вытяжном капюшоне и тщательно мойте руки после обработки. Держите силанизирующий агент вдали от тепла, горячих поверхностей, искр, открытого пламени и других источников воспламенения. Хранить при температуре от 15 до 30 °C (P280, P210, P240, P403, P235, P310). - Удалите вакуум и поместите положительный чип PDMS (#2) на дно чашки Петри. Налейте сверху преполимер PDMS (10: 1) для получения нескольких отрицательных форм PDMS (# 3).
- Поместите чашку Петри под вакуум в осушитель на 15 минут, чтобы удалить все пузырьки.
- Отверните преполимер PDMS при 65 °C в течение ночи, после чего отрицательная форма PDMS (#3) может быть отслоена от положительного чипа PDMS (#2) с помощью шпателя.
- Силанизуйте окончательную отрицательную форму PDMS (No3) с помощью силанизационного агента в вакуумном осушителе на ночь.
- Производят несколько чипов клеточной культуры (#4, см. Рисунок 2) толщиной около 5 мм, заливая преполимер PDMS в отрицательную форму PDMS (#3), удаляя пузырьки с помощью осушителя и отверждая в течение 3 ч при 65 °C. Лезвием бритвы отрежьте чип до окончательного размера, как показано на рисунке 2. Храните чипсы при комнатной температуре.
ПРИМЕЧАНИЕ: Шероховатость поверхности может влиять на клеточный ответ. При необходимости дополнительный тонкий слой PDMS может быть использован в качестве покрытия на положительном чипе PDMS (#2) для сглаживания поверхности. Для этого налейте небольшую каплю преполимера PDMS на чип и распределите его по всему чипу, используя воздух под давлением. Отвержьте чипс с покрытием при 65 °C в течение 3 ч и продолжайте с шагом 1.12.
2. Изготовление плоских образцов PDMS (контрольных образцов)
- Готовят преполимер PDMS (10:1) согласно шагам 1.3-1.6.
- Поместите стеклянную крышку на закругленный вакуумный столб в центре спин-коатера.
- Включите вакуум, чтобы прикрепить стеклянную крышку к машине и пипеткой капельку PDMS в середине крышки с помощью пипетки Пастера.
- Распределите преполимер PDMS по стеклянной подложке, используя следующий протокол, чтобы получить слой толщиной около 10 мкм.
- Спинкоут в течение 10 с при 0,45 × g, ускорение: 0,2 × г/с.
- Спинкоут в течение 50 с при 44,8 × g, ускорение: 0,54 × g/s.
- Выключите вакуум, снимите крышку со спин-коатера с помощью пинцета и поместите ее в чашку Петри. Отверните PDMS на ночь в духовке при 65 °C и храните при комнатной температуре.
3. Пассивация субстратов 3D клеточных культур
- Активируйте гидроксильные группы на поверхности чипа PDMS (#4) с помощью O2-плазмы. Используя пинцет, поместите чип в корзину плазменного ашера.
- Запустите цикл зудения, используя мощность 20 Вт в течение 30 с. Вентиляционная камера с использованием N2.
- Выньте чип из корзины и поместите его в небольшой контейнер PDMS (см. рисунок 1).
- Используя пипетку Пастера, добавьте 500 мкл поли-L-лизина (ФАПЧ, 0,01%) в верхнюю часть чипа, чтобы вся поверхность была погружена в раствор ФАПЧ. Инкубировать в течение 30 мин при комнатной температуре.
- Удалите 450 мкл ФАПЧ из чипа клеточной культуры пипеткой и трижды промойте поверхность чипа 500 мкл буфера HEPES 0,1 М (8 < рН < 8,5). Всегда оставляйте небольшой объем жидкости на чипе PDMS, чтобы избежать высыхания образца, что снизит качество конечного рисунка.
- Получают 500 мкл метоксиполиэтиленгликоля-сукцинимидил валерата (mPEG-SVA; MW 5,000 Da) раствор в буфере HEPES 0,1 М (8 < рН < 8,5) на чип клеточной культуры и дайте ему инкубироваться на образце в течение 60 мин. Поскольку mPEG-SVA имеет период полувыведения 15 мин, обязательно подготовьте необходимое количество непосредственно перед использованием.
ПРИМЕЧАНИЕ: mPEG-SVA растворяют, когда раствор полностью прозрачен. - Удалите 450 мкл раствора mPEG-SVA с помощью микропипета и промойте поверхность чипа пять раз фосфатно-буферным физиологическим раствором (PBS). Убедитесь, что пипетка вверх и вниз несколько раз за одну промывку, чтобы убедиться, что все несвязанные mPEG-SVA удалены. Чтобы предотвратить высыхание образца, сведите к минимуму время между этапами стирки и обязательно используйте избыток (500 мкл или более) PBS для стирки.
- Сохраните образцы, погрузив их в PBS, или перейдите к этапу создания шаблона протокола.
ПРИМЕЧАНИЕ: При желании пассивация может быть выполнена в стерильных условиях при работе в культурном кабинете и работе со стерильными растворами и оборудованием.
4. Хранение субстратов с узорчатыми клеточными культурами
ПРИМЕЧАНИЕ: Субстраты 3D клеточной культуры могут храниться на разных этапах процесса.
- Храните отвержденные чипсы pdms клеточной культуры в сухих условиях при комнатной температуре.
- Храните пассивированные чипсы клеточной культуры одним из следующих двух способов:
- Хранить в PBS при температуре 4 °C до 7 дней.
- Хранить в сухих условиях до нескольких месяцев. Чтобы получить сухие образцы, удалите PBS и промывайте несколько раз, используя двойную дистиллированную воду (ddH2O). Сушка феном с помощью азотного или пневматического пистолета.
5. Дизайн цифровых масок, используемых для фотоструктурирования
ПРИМЕЧАНИЕ: Моделирование 3D-подложек может быть выполнено с использованием одной или нескольких фокальных плоскостей (см. Рисунок 3). Одна фокальная плоскость может быть использована на объектах, которые не больше одного цифрового зеркального устройства (DMD, приблизительно 300 мкм х 500 мкм) и которые не слишком высоки (50-100 мкм). В этом случае спроектируйте цифровой шаблон с помощью TIFF-режима. Для объектов, которые превышают размеры одного МДД и являются относительно высокими, разделите рисунок подложки на несколько шагов. При этом несколько паттернов проектируются с использованием PDF-режима, который все по отдельности фокусируются на отдельных фокальных плоскостях.
- Создайте цифровую маску с помощью программных средств проектирования.
- Узоры в TIFF-режиме (пиксели): Создайте полностью черную монтажную область размером 1 140 x 1 824 пикселя (точный размер 1 DMD, приблизительно 300 мкм x 500 мкм) и заполните монтажную область интересующими фигурами. Экспортируйте монтажную область в виде 8-битного TIFF-файла.
ПРИМЕЧАНИЕ: Различные уровни серого в дизайне шаблона определяют величину экспозиции, которая будет выполнена в этом месте. - Создание узоров в режиме PDF (метрические единицы): создайте черную монтажную область нужного размера в мм и заполните монтажную область любой фигурой, представляющей интерес. Разделите узор на несколько файлов, если 3D-подложка должна быть структурирована с использованием нескольких фокальных плоскостей. Сохраните монтажную область в виде PDF-файла.
ПРИМЕЧАНИЕ: Различные уровни серого в дизайне шаблона определяют величину экспозиции, которая будет выполнена в этом месте.
- Узоры в TIFF-режиме (пиксели): Создайте полностью черную монтажную область размером 1 140 x 1 824 пикселя (точный размер 1 DMD, приблизительно 300 мкм x 500 мкм) и заполните монтажную область интересующими фигурами. Экспортируйте монтажную область в виде 8-битного TIFF-файла.
6. УФ-фотоструктурирование субстратов 3D клеточных культур
- Калибровка
ПРИМЕЧАНИЕ: Калибровка лазера выполняется для получения правильной фокусировки на интересующем материале. Поскольку субстраты для клеточных культур PDMS слишком толстые, чтобы их можно было проложить, используйте стеклянный слайд, на котором чип помещается вверх ногами. Поскольку лазер сначала сталкивается со стеклом, используйте стекло для калибровки лазера.- Нанесите люминесцентный хайлайтер на стеклянную крышку и поместите стеклянную крышку в стадии флуоресцентного микроскопа. Убедитесь, что выделенная поверхность обращена вверх.
- Включите микроскоп и оборудование PRIMO и откройте Micro-manager для доступа к программному обеспечению Leonardo в разделе «плагины».
- Выберите «Калибровка» в начальном меню, а затем выберите 20-кратный объектив как на микроскопе, так и в программном обеспечении. Нажмите кнопку Далее.
- Поместите стеклянный слайд с флуоресцентным маркером в оптический контур микроскопа. Переключитесь в флуоресцентный режим и внимательно сосредоточьтесь на появившемся изображении PRIMO, убедившись, что и логотип, и текст находятся в фокусе. Нажмите кнопку Далее, чтобы завершить процедуру калибровки.
- Запишите Z-местоположение каскада при калибровке и используйте это местоположение в качестве ссылки позже в протоколе.
ПРИМЕЧАНИЕ: Калибровочный материал должен соответствовать материалу, который используется для моделирования далее в протоколе. Описанные выше этапы описывают калибровку, необходимую для субстратов клеточной культуры. Для калибровки плоских контрольных образцов PDMS нанесите флуоресцентный маркер поверх дополнительного плоского образца PDMS и откалибруйте с помощью шагов 6.1.2-6.1.5.
- Создание 3D-объектов с использованием одной фокальной плоскости
ПРИМЕЧАНИЕ: Моделирование с использованием одной фокальной плоскости выполняется на 3D-объектах, которые не превышают размеры одного DMD (приблизительно 300 мкм х 500 мкм). Схема установки фокальной плоскости проиллюстрирована на рисунке 3.- Извлеките калибровочный слайд из рабочей области и поместите в сцену стеклянную горку, содержащую каплю (~50 мкл) фотоинициатора (PLPP).
ВНИМАНИЕ: PLPP раздражает глаза, дыхательную систему и кожу (R36-38). Носите средства индивидуальной защиты, держите их подальше от взрывчатых веществ, никогда не добавляйте воду в этот продукт, принимайте меры предосторожности против статических сбросов и избегайте ударов и трения (S26-36). - Поместите субстрат клеточной культуры PDMS вверх ногами в каплю фотоинициатора. Убедитесь, что 3D-элементы на поверхности подложки клеточной культуры обращены к стеклянному слайду и полностью погружены в PLPP для обеспечения правильного рисунка.
- Выберите Шаблон в программном обеспечении.
- Переключитесь в режим яркого поля на микроскопе и переместите сцену к интересующей функции.
- Сосредоточьтесь на верхней или нижней части выпуклых и вогнутых структур соответственно (рисунок 3).
- Выберите PRIMO , чтобы вставить выбранный шаблон. Наблюдайте за предварительным просмотром узора оранжевым цветом поверх живого изображения яркого поля.
- Отрегулируйте параметры рисунка в соответствии с функцией (расположение, угол, повторения) и выберите дозу 1000 мДж/мм2.
- Нажмите « Блокировка» и переключите микроскоп в флуоресцентный режим.
- Нажмите кнопку «Воспроизвести » в правой нижней части экрана, чтобы начать создание шаблона. После завершения наблюдайте за рисунком, отображаемым зеленым цветом.
- После того, как все функции на чипе клеточной культуры, извлеките чип из слайда шаблона и сохраните в PBS при 4 °C.
- Извлеките калибровочный слайд из рабочей области и поместите в сцену стеклянную горку, содержащую каплю (~50 мкл) фотоинициатора (PLPP).
- Моделирование 3D-объектов с использованием нескольких фокальных плоскостей
ПРИМЕЧАНИЕ: Моделирование с использованием нескольких фокальных плоскостей выполняется на 3D-объектах, которые больше одного DMD (приблизительно 300 мкм x 500 мкм) или относительно высоки. В этом случае 3D-объекты должны быть структурированы в несколько этапов, то есть дизайн шаблона должен быть адаптирован в соответствии с примером на рисунке 3.- Извлеките калибровочный слайд из рабочей области и поместите в сцену стеклянную горку, содержащую каплю (~50 мкл) фотоинициатора (PLPP).
- Поместите чип культуры клеток PDMS вверх ногами в каплю фотоинициатора с помощью пинцета.
- Выберите Шаблон в программном обеспечении. Переключитесь в режим яркого поля на микроскопе и переместите сцену к интересующей функции.
- Сосредоточьтесь на области чипа в правильном месте. Поскольку моделирование выполняется в одной фокальной плоскости, а объекты больше, чем один DMD, используйте несколько фокальных плоскостей и, следовательно, несколько раундов узора на 3D-подложку, чтобы обеспечить достаточное разрешение узора вдоль всей высоты и ширины объекта (см. Рисунок 3). Например, для объекта высотой 150 мкм задайте рисунок в три раунда (± 1 фокальной плоскости на 50 мкм Z-хода), фокусируясь около 25 мкм, 75 мкм и 125 мкм от нижней части объекта. Убедитесь, что нижняя часть функции находится рядом со значением, записанным на шаге 6.1.5.
- Выберите PRIMO , чтобы вставить выбранный шаблон. Наблюдайте за предварительным просмотром узора, показанного оранжевым цветом поверх живого изображения яркого поля.
- Отрегулируйте параметры рисунка в соответствии с функцией (местоположение, угол) и выберите дозу 1000 мДж/мм2.
- Нажмите « Блокировка» и переключите микроскоп в флуоресцентный режим.
- Нажмите кнопку «Воспроизвести » в правой нижней части экрана, чтобы начать создание шаблона. После завершения наблюдайте за рисунком, отображаемым зеленым цветом.
- Повторите шаги 6.3.4-6.3.8 по интересующему признаку при использовании нескольких фокальных плоскостей.
- После завершения работы со всеми функциями на чипе клеточной культуры извлеките чип из слайда шаблона и сохраните его в PBS при 4 °C.
ПРИМЕЧАНИЕ: При желании нанесите УФ-фотоструктурирование в стерильных условиях, используя чашки Петри со стеклянным дном и подготовьте все субстраты в стерильных культуральных шкафах. Храните узорчатые образцы в PBS в течение нескольких недель. При промывке ddH2O и сушке с использованием воздуха под давлением образцы могут храниться до нескольких месяцев при температуре 4 °C.
7. Инкубация белка
ПРИМЕЧАНИЕ: Для клеточной культуры рекомендуется использовать свежеиспеченные белковые субстраты. Приступайте к этой части протокола только в том случае, если заполнение клеток (шаг 8) выполняется непосредственно после этого.
- Переложите узорчатый чип клеточной культуры в стерильные контейнеры PDMS в культуральном шкафу.
- Промыть узорчатые чипы клеточной культуры в 3 раза с избытком стерильной PBS, если рисунок не был выполнен в стерильных условиях.
- Приготовьте свежий белковый раствор в PBS.
- Фибронектин: добавьте 2 мл PBS с использованием микропипета во флакон 20 мкг меченого родамином фибронектина для получения концентрации 10 мкг / мл. Пипетируйте осторожно, чтобы избежать образования белковых комочков и защитить от света.
- Желатин: разморозить 200 мкл аликвоты растворенного желатина-флуоресцеина. Защита от света.
- Добавьте 200-500 мкл белкового раствора в чип клеточной культуры с помощью микропипета. Отрегулируйте время инкубации и температуру в зависимости от выбранного белка: фибронектин: 5 мин при комнатной температуре, желатин: 15 мин при 37 °C. Обязательно накройте образец (например, алюминиевой фольгой).
- Удалить белковый раствор и промыть 5 раз 500 мкл стерильного PBS. Убедитесь, что PBS несколько раз поднимается и опускается выше всех соответствующих функций чипа клеточной культуры, чтобы удалить любой несвязанный белок.
ПРИМЕЧАНИЕ: Во время этапов промывки крайне важно, чтобы образец никогда не высыхал. При удалении белкового раствора или PBS во время промывки немедленно добавляйте новый PBS, чтобы предотвратить образование белковых сгустков (см. Рисунок 4). Выпуклые особенности особенно чувствительны к высыханию, так как они приподняты над поверхностью подложки. - Необязательно: просмотрите белковые паттерны под флуоресцентным микроскопом. Держите образцы стерильными и погруженными в PBS.
8. Посев клеток
ПРИМЕЧАНИЕ: Этот протокол использует первичные кератоциты человека и дермальные фибробласты человека. Кератоциты были собраны из ткани роговицы человека у пациентов в соответствии с голландскими рекомендациями по вторичному использованию материалов и ранее характеризовались как кератоциты47. Эти клетки культивируются в DMEM, дополненном 5% фетальной бычьей сывороткой (FBS), 1% пенициллином / стрептомицином (P / S) и 1 мМ L-аскорбиновой кислоты 2-фосфата сесквиманья соля гидрата (витамин С) при 37 ° C для максимум четырех проходов. Человеческие кожные фибробласты были приобретены и культивированы в DMEM с добавлением 10% FBS и 1% P / S при 37 ° C в течение максимум 15 проходов. Для посева как кератоцитов, так и дермальных фибробластов на чипе фотоструктурированной культуры клеток было использовано 20 000 клеток на чип.
- Отсоедините интересующие клетки (например, с помощью трипсина) и приготовьте 1 мл клеточной суспензии ± 10 000-50 000 клеток/мл в питательной среде на чип. Отрегулируйте точное количество ячеек, добавленных на подложку, в зависимости от размера ячейки и требуемого считывания.
- Удалите PBS из чипа клеточной культуры и добавьте 1 мл клеточной суспензии.
- Осторожно транспортируйте чип клеточной культуры с клетками в инкубатор и инкубируйте в течение 60 мин при 37 °C.
- Проверьте адгезию клеток на чипе культуры клеток с рисунком под микроскопом яркого поля. Ищите удлиненные морфологии клеток в случае линейных паттернов (см. рисунок 5). Если клетки также начали прилипать за пределами узорчатой области, удалите их, пипетируя среду вверх и вниз непосредственно над клетками на подложке.
ПРИМЕЧАНИЕ: Ячейки, прикрепленные к узорчатой области, останутся прикрепленными, в то время как ячейки за пределами узорчатых областей будут отделяться. - Извлеките чип клеточной культуры из контейнера PDMS и используйте стерильный пинцет, чтобы поместить его в 6-луночную пластину, заполненную ~ 5 мл питательной среды.
- Культивируйте клетки в течение нужного периода времени. Заменяйте клеточную культуральную среду каждые 2-3 дня. Чтобы обеспечить визуализацию белкового рисунка после клеточной культуры, уменьшите количество воздействия на образец света во время культивирования.
9. Окрашивание, получение и анализ изображений
- Фиксация и окрашивание
- После нужной длины культуры удаляют почти всю среду и трижды промывают с избытком ПБС. Затем инкубируют с 3,7% формалином в течение 15 мин при комнатной температуре с последующим тремя шагами промывки с PBS в течение 5 мин на стирку при комнатной температуре. Никогда не позволяйте образцу высохнуть.
ВНИМАНИЕ: Формалин вреден при проглатывании или вдыхании (H302, H332), может вызвать аллергическую реакцию кожи (H317), подозревается в возникновении генетических дефектов (H341) и может вызвать рак (H350). Носите средства индивидуальной защиты и работайте в вытяжном капюшоне. - Окрашивайте субстрат клеточной культуры желаемыми окрашивающими агентами или антителами. Чтобы уменьшить объемы окрашивающих агентов, поместите чипы клеточной культуры вверх ногами в каплю красильного раствора, нанесенную на стеклянную горку.
- Храните образцы в PBS (кратковременном) или прикрепленном к крышке с помощью монтажной среды (долгосрочной) при температуре 4 °C.
- После нужной длины культуры удаляют почти всю среду и трижды промывают с избытком ПБС. Затем инкубируют с 3,7% формалином в течение 15 мин при комнатной температуре с последующим тремя шагами промывки с PBS в течение 5 мин на стирку при комнатной температуре. Никогда не позволяйте образцу высохнуть.
- Получение изображений
- Поместите витражный образец вверх ногами в каплю PBS на стеклянной горке. Поместите образец в стадию конфокального микроскопа.
- В зависимости от требуемого уровня детализации изготавливайте Z-стеки с подходящей целью (10x, 20x или 40x) и Z-интервалом для обеспечения правильного получения изображения.
- Анализ и визуализация изображений
- Откройте файлы необработанных изображений в программном обеспечении для анализа изображений и проверьте правильность свойств изображения (например, размеры, разрешение).
- При необходимости отрегулируйте яркость и контрастность для каждого канала.
- Обрежьте интересующую область, содержащую узор и ячейки.
- Необязательно: при необходимости выполните этап деконволюции.
- Создайте 3D-рендер Z-стека с помощью программного обеспечения для 3D-рендеринга.
- Оптимизируйте настройки контрастности и усиления для каждого отдельного канала.
- Чтобы сделать изображение 3D-рендеринга, создайте снимок и экспортируйте как . TIFF файл.
- Чтобы создать фильм 3D-рендеринга, установите начальный и конечный кадры, а также временные рамки перед регистрацией фильма. Экспортировать как .avi.
Результаты
С помощью описанного протокола субстраты для клеточных культур 3D PDMS могут быть УФ-фотоструктурированы для создания точных и высокопроизводительных адгезивных областей, подходящих для прикрепления клеток. Таким образом, клетки подвергаются воздействию как соответствующей геометрии субстрата, так и адгезивных лигандных паттернов одновременно. Свойства клеток, такие как ориентация, площадь ячейки и количество очаговых спаек, можно легко контролировать и использовать для лучшего понимания поведения клеток в сложных, in vivo-подобных средах.
Для проверки событий паттернирования на подложках 3D PDMS с помощью атомной рентгеновской фотоэлектронной спектроскопии (XPS)48 были измерены атомные поверхностные составы материала на разных стадиях протокола. Таким образом, измерения XPS показали наличие цепей PEG с повышенным углеродным сигналом на пассивированных образцах, который был уменьшен после фотоструктурирования. Инкубация с фибронектином приводила к увеличению углеродного сигнала, что опять же указывает на успешную адгезию белка на поверхности чипа клеточной культуры. Далее разрешение и выравнивание рисунка на 3D-объектах характеризовались на различных круговых вогнутых ямах (ĸ = 1/250 мкм-1, ĸ = 1/1000 мкм-1 и ĸ = 1/3 750 мкм-1, см. Рисунок 6). Из проекций максимальной интенсивности можно сделать вывод, что белковый паттерн был успешно структурирован по всем трем 3D-объектам. Профиль интенсивности на рисунке 6A показывает высокое разрешение паттерна с резкими переходами между узорчатыми и нешаблонными областями. Кроме того, была получена постоянная интенсивность белка по всему паттерну в яме.
Вогнутая яма с ĸ = 1/250 мкм-1 была построена с использованием метода одной фокальной плоскости (один паттерн), тогда как ямы с ĸ = 1/1000 мкм-1 и ĸ = 1/3 750 мкм-1 были построены с использованием двух и трех фокальных плоскостей (паттернов) соответственно. Как видно из проекций максимальной интенсивности на рисунке 6, оба метода приводят к идеальному выравниванию узоров поверх объектов. Не наблюдается смещенных переходов между двумя различными фокальными плоскостями и паттернами.
Используя описанный протокол, широкий спектр дизайнов белковых паттернов может быть применен к различным геометриям (см. Рисунок 7 и Видео 1). Чтобы проиллюстрировать универсальность этого метода, полуцилиндры (выпуклые и вогнутые), поверхность седла и яма были вылеплены с использованием линий и кругов различной ширины. Фотоструктурированные материалы впоследствии могут быть использованы для культивирования клеток (см. Рисунок 7, Рисунок 8, Видео 2, Видео 3 и Видео 4). Пример кожных фибробластов, культивируемых на узорчатом (фибронектиновые линии, красный, шириной 5 мкм и 5 мкм промежутками) вогнутом полуцилиндре, показан на рисунке 8, рисунке 9 и видео 4. Во время эксперимента клетки чувствуют и прилипают к субстрату мультикюйной клеточной культуры и остаются жизнеспособными с течением времени. Как видно из иммунофлуоресцентного окрашивания на рисунке 8, клетки образуют очаговые спайки (винкулиновые кластеры) преимущественно на фибронектиновых линиях.
Другой пример исследования с использованием этих материалов клеточной культуры был недавно опубликован нашей группой48. В этом исследовании миофибробласты человека и эндотелиальные клетки подвергались комбинации контактных направляющих сигналов и геометрических топографий. In vivo оба типа клеток испытывают кривизно-контактные сигналы в нативных тканях, таких как сосудистая система человека. Подвергая клетки in vitro среде, которая сочетает в себе оба сигнала окружающей среды, ситуация in vivo может быть повторена, обеспечивая более глубокое понимание роли микросреды в поведении клеток. Было показано, что миофибробласты человека выравниваются с контактными направляющими сигналами (параллельными фибронектиновыми линиями) на вогнутых цилиндрических субстратах48. Однако на выпуклых структурах с увеличением кривизны геометрические сигналы превосходили биохимические сигналы, предполагая, что миофибробласты могут ощущать как степень, так и признак искривления. Интересно, что эндотелиальные клетки могли прилипать только к вогнутым многокюйным субстратам, а не к выпуклым субстратам PDMS. На вогнутых субстратах с белковым паттерном эндотелиальные клетки ориентированы в направлении контактного направляющего сигнала. Эти фундаментальные знания in vitro имеют физиологическое значение в области сосудистой тканевой инженерии и могут в конечном итоге помочь в разработке интеллектуальных тканевых инженерных конструкций.
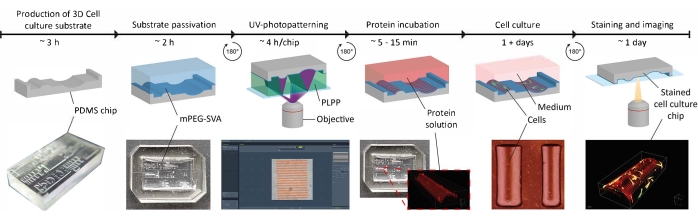
Рисунок 1: Экспериментальная временная шкала применения контактных направляющих сигналов на субстратах 3D клеточной культуры. Во-первых, чипы с положительными клеточными культурами производятся из отрицательной формы PDMS, содержащей ряд геометрий. Неотвержденный PDMS выливается в форму и отверждается в течение 3 ч при 65 °C. Впоследствии PDMS обрабатываютO2-плазмой и инкубируют с ФАПЧ и mPEG-SVA (синим, меченым) для пассивации поверхности субстрата клеточной культуры. После промывки подложка переворачивается вверх дном в капле фотоинициатора (PLPP, зеленый, с маркировкой) и УФ-фотоструктурируется с использованием подхода LIMAP. Здесь цифровая маска с пользовательским узором используется для расщепления слоя пассивации в определенных местах. Далее белковый раствор (красный, маркированный) может быть инкубирован и будет прилипать только к местам, где удаляется пассивационный слой. Клетки, посеянные на субстрате, подвергаются как геометрии, так и белковым паттернам, что позволяет исследовать поведение клеток в сложных, в vivo-имитирующих средах. Сокращения: PDMS = полидиметилсилоксан; mPEG-SVA = метоксиполиэтиленгликоль-сукцинимидил валерат; PLPP = 4-бензоилбензил-триметиламмонийхлорид; LIMAP = Светоиндуцированная молекулярная адсорбция белков. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Различные этапы производства и пассивации субстрата 3D клеточной культуры. Отрицательная стеклянная форма (No 1) разработана с помощью программного обеспечения для автоматизированного проектирования и изготовлена с использованием фемтосекундно-лазерной техники прямой записи. Эта форма используется для производства промежуточного положительного чипа PDMS (No 2) и отрицательной формы PDMS (No 3), которые впоследствии используются для получения окончательного чипа клеточной культуры (No 4). Аббревиатура: PDMS = полидиметилсилоксан. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Схематическая иллюстрация двух методов формирования шаблонов. Слева: УФ-фотоструктурирование выполняется на более мелких объектах (примерно один МДД) с использованием одной фокальной плоскости и рисунка. В результате полная функция создается за один раз. Справа: когда используются более крупные объекты (больше одного DMD), шаблон разделен на несколько фокальных плоскостей и шаблонов. Аббревиатура: DMD = цифровое зеркальное устройство. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
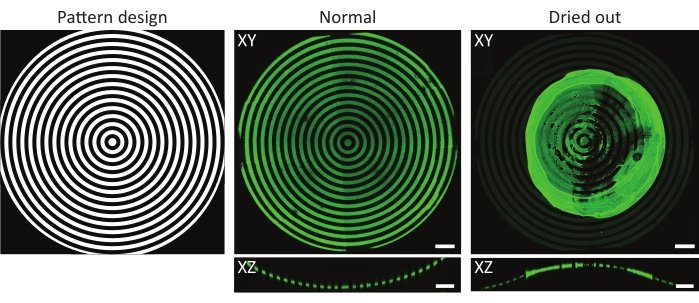
Рисунок 4: Типичный пример нормального и высушенного инкубированного белка субстрата. Проекции максимальной интенсивности (XY) и ортогональные виды (XZ) нормальных и высушенных инкубированных белком субстратов. При промывке субстрата с узорчатой клеточной культурой после инкубации с белковым раствором крайне важно всегда держать образец влажным. Хотя рисунок идентичен на всех изображениях по признакам (ĸ = 1/1000 мкм-1), желатино-флуоресцеин (зеленый) агрегировался, образуя большой сгусток, когда образец оставляли сохнуть в течение нескольких секунд. Если образец всегда остается влажным, можно наблюдать правильные белковые паттерны. Шкала = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Изображения Brightfield после посева. Первичные кератоциты (слева) и дермальные фибробласты (справа) через 4 ч после посева на 3D геометрические признаки (вогнутая яма ĸ = 1/1000 мкм-1 и полуцилиндры ĸ = 1/500, 1/375, 1/250, 1/175 и 1/125 мкм-1). Вставки в левом верхнем углу представляют собой линейный узор, используемый для формирования геометрии. Белые стрелки указывают на рассредоточенные ячейки, которые уже показывают выравнивание. Шкала = 250 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
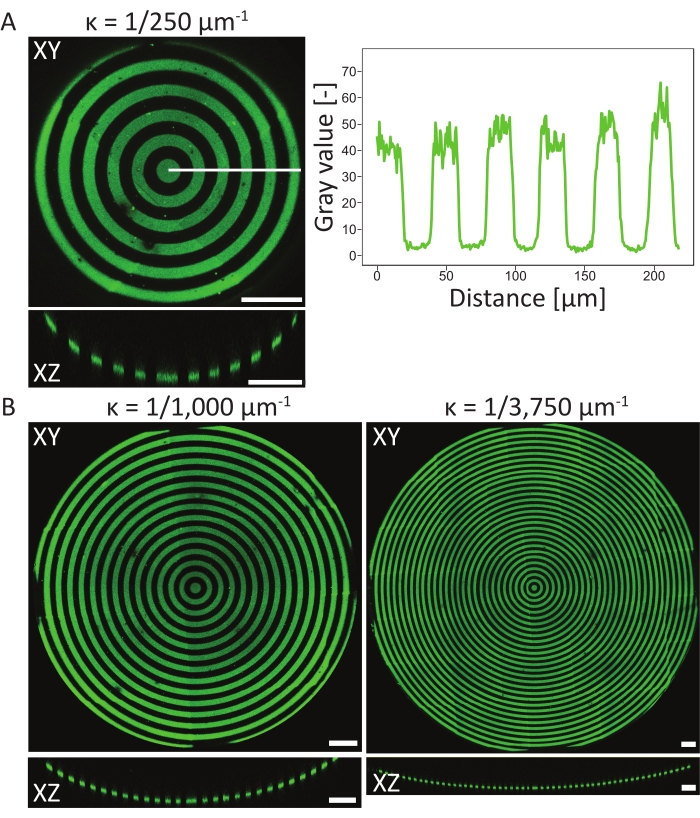
Рисунок 6: Характеристика круговых узоров на вогнутых ямах. (A) Проекция максимальной интенсивности (XY) и ортогональный вид (XZ) котлованной ямы (ĸ = 1/250 мкм-1) с использованием LIMAP (ширина линии: 20 мкм, ширина зазора: 20 мкм) и инкубированная желатино-флуоресцеином (зеленый). Профиль интенсивности вдоль белой линии строится по отношению к расстоянию, показывая согласованное качество и разрешение рисунка. (B) Дополнительное моделирование, выполненное на вогнутых ямах с ĸ = 1/1000 мкм-1 и ĸ = 1/3750 мкм-1, демонстрирующее гибкость с точки зрения геометрических особенностей, которые могут быть использованы для моделирования. Опять же, визуализируются как проекции максимальной интенсивности (XY), так и ортогональные виды (XZ). Шкала = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
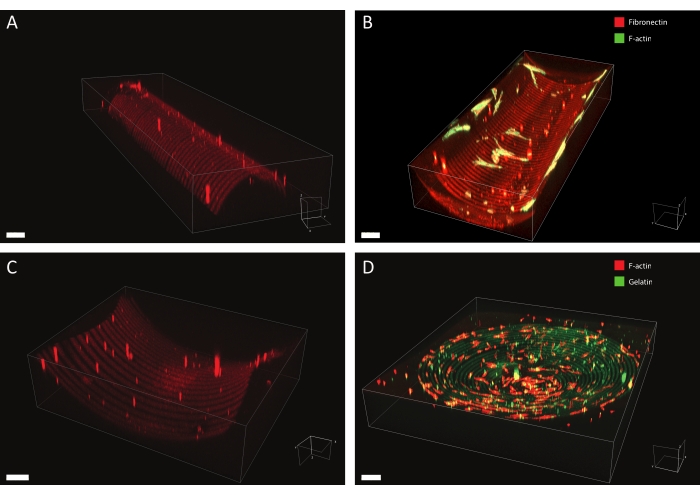
Рисунок 7: Данные 3D-микроскопии узорчатых структур. Типичные примеры 3D-структурированных материалов для клеточной культуры после фотоструктурирования и культивирования клеток, визуализированных с помощью программного обеспечения для 3D-рендеринга. (A) Выпуклый полуцилиндр с узорчатыми линиями шириной 10 мкм (родамин-фибронектин, красный) и зазорами шириной 10 мкм. Шкала бара = 5 мкм. (B) Дермальные фибробласты, окрашенные для F-актина (зеленого), культивируемого на вогнутом полуцилиндре с узором шириной 20 мкм (родамин-фибронектин, красный) и зазорами шириной 20 мкм. Шкала = 5 мкм. (C) Поверхность седла с узором шириной 20 мкм линий (родамин-фибронектин, красный) и зазорами шириной 20 мкм. Шкала бара = 5 мкм. (D) Вогнутая яма с концентрическими кругами шириной 20 мкм линий (желатин-флуоресцеин, зеленый) и зазорами шириной 20 мкм. F-актиновый цитоскелет кератоцитов человека окрашивается с помощью фаллоидина и визуализируется красным цветом. Шкала = 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8: Иммунофлуоресцентное окрашивание кожных фибробластов человека на фотоструктурированном, вогнутом полуцилиндре. (A) Проекция максимальной интенсивности (XY) и ортогональные срезы (XZ и YZ) кожных фибробластов человека культивируются в течение 24 ч на узорчатом (фибронектиновые линии, красные, шириной 5 мкм и 5 мкм промежутками) вогнутом полуцилиндре. Клетки окрашиваются на F-актин (пурпурный), винкулин (зеленый) и ядра (синий). Шкала = 100 мкм. (B) Увеличение ячейки, придерживающейся среды multicue. Шкала = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 9: Изображения таймлапсов Brightfield с дермальными фибробластами человека на узорчатом, вогнутом цилиндре. Вогнутый полуцилиндр (ĸ = 1/250 мкм-1) узорили параллельными линиями (шириной 5 мкм и зазорами 5 мкм) и инкубировали с родамином-фибронектином перед посевом клеток. Таймлапсная визуализация начинается через 1 ч после начального посева клеток (слева, 0 мин), когда клетки еще округлые и неадгезивные (стрелки). Примерно через 24 ч (середина, 1 420 мин) клетки прилипают к мультикюйной подложке и показывают реакцию выравнивания в соответствии с контактным ориентиром. Как реакция выравнивания, так и жизнеспособность клеток поддерживаются на протяжении всей продолжительности культивирования (справа, 3 180 мин). Шкала = 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Видео 1: Пример рисунка на 3D-цилиндрической подложке. 3D-изображение выпуклого цилиндра с рисунком родамин-фибронектин (красный). Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Видео 2: 3D-изображение дермальных фибробластов, культивируемых на узорчатой 3D-цилиндрической подложке (ĸ = 1/500 мкм-1). Дермальные фибробласты культивируют в течение 24 ч на узорчатом (фибронектиновые линии, красный, шириной 10 мкм и 10 мкм промежутками) выпуклом полуцилиндре. Клетки окрашиваются на F-актин (пурпурный), винкулин (зеленый) и ядра (синий). Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Видео 3: 3D-представление кератоцитов человека, культивируемых на узорчатой 3D-яме (ĸ = 1/3 750 мкм-1). 3D-изображение кератоцитов человека, культивируемых в течение 24 ч в вогнутой узорчатой яме (желатиновые круги, зеленый, шириной 20 мкм и промежутками 20 мкм). Клетки окрашиваются на F-актин (красный). Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Видео 4: Визуализация таймлапса Брайтфилда кожных фибробластов человека на узорчатом, вогнутом цилиндре. Вогнутый полуцилиндр (ĸ = 1/250 мкм-1) узорили параллельными линиями (шириной 5 мкм и зазорами 5 мкм) и инкубировали с родамином-фибронектином перед посевом клеток. Таймлапсная визуализация начинается через 1 ч после начального посева клеток, когда клетки демонстрируют начальную приверженность к мультикюйной среде. Во время полного таймлапса клетки преимущественно ориентируются вдоль контактных направляющих сигналов, при этом жизнеспособность клеток сохраняется. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Обсуждение
В настоящее время поведение клеток часто изучается на плоских культуральных субстратах, которым не хватает сложности микроокружения нативной клетки. В качестве альтернативы используются 3D-среды, такие как строительные леса и гидрогели. Хотя эти среды клеточных культур улучшают релевантность in vivo, как систематические исследования поведения клеток, так и осуществимость методов считывания остаются сложными. Для систематического исследования поведения клеток на репрезентативных субстратах культуры необходимы последовательные многокюйные субстраты, которые позволяют микроскопическое считывание. Поэтому в этом протоколе мы описываем способ создания субстратов мультикюйной клеточной культуры с физиологически значимой геометрией и узорчатыми белками ECM. Основная проблема в сочетании экологических сигналов, таких как геометрия тканей и контактные сигналы на платформах in vitro, в значительной степени носит технологический характер. Традиционные методы применения контактных сигналов (например, мягкая литография, глубокое УФ-моделирование и микроконтактная печать35,36) к материалам клеточных культур были оптимизированы для планарных подложек. Потребность в материалах для 3D-культивирования клеток в сочетании с контактными направляющими сигналами выявила несколько технологических проблем, таких как плохое выравнивание шаблона, разрешение и гибкость. Для преодоления этих проблем можно использовать высокопроизводительный, бесмасковый, основанный на свете метод моделирования45,49. Здесь оптический микроскоп обеспечивает точное выравнивание рисунка и разрешение в порядке микрометров (см. Рисунок 6). Кроме того, использование цифровой маски позволяет исследователям изучать поведение клеток на широком спектре паттернов без необходимости изготовления трудоемких физических масок.
УФ-фотоструктурный подход может использоваться в сочетании с различными 3D-геометриями (например, цилиндрами, седлами, куполами, ямами), изготовленными из ряда материалов48. Субстраты 3D клеточной культуры, используемые в этом исследовании, изготовлены из PDMS; однако могут использоваться и другие материалы. Это может потребовать различных этапов для получения окончательного субстрата клеточной культуры, содержащего интересующие особенности. Поскольку было показано, что клетки чувствительны к шероховатости поверхности материалов клеточных культур, важно создать чипы клеточной культуры с гладкой поверхностью, чтобы наблюдаемый ответ клеток мог быть полностью отнесен к 3D-геометрии и контактным сигналам50,51. Методы измерения, такие как оптическая профилометрия, сканирующая электронная микроскопия или атомно-силовая микроскопия, могут использоваться для измерения шероховатости поверхности. После изготовления материала клеточной культуры можно выбрать метод паттернирования, основанный на одной или нескольких фокальных плоскостях, зависящих от конкретных размеров интересующего объекта (см. Рисунок 3). Как правило, одна фокальная плоскость используется для формирования области в пределах Z-диапазона приблизительно 50 мкм. Было показано, что разрешение шаблона является согласованным с использованием этого эмпирического правила (см. рисунок 6). Однако недостатком этого метода является увеличение времени паттернирования с введением нескольких фокальных плоскостей и паттернов. В нашей руке, используя несколько фокальных плоскостей, 3D-геометрические объекты размером до 16 мм x 16 мм x 0,17 мм (X x Y x Z) были успешно вылеплены с высоким качеством рисунка.
Кроме того, важно отметить, что высота (ось Z) геометрических объектов, которые могут использоваться в сочетании с этим протоколом, ограничена. Поскольку как УФ-фотоструктурирование, так и многие клеточные показания зависят от настройки микроскопии, рабочее расстояние объективов определяет максимальную высоту объекта. В нашей руке геометрия, превышающая высоту 300 мкм, все еще может быть УФ-фотоструктурирована, а показания были выполнены с использованием конфокального микроскопа с 40-кратными объективами. Таким образом, механобиологические исследования в диапазоне от внутриклеточных до клеточных и тканевых масштабов возможны с использованием описанного протокола.
Другим фактором, который необходимо учитывать, является риск высыхания образцов во время или после УФ-фотоструктурирования49. Это особенно актуально при использовании 3D-геометрии, так как выпуклости часто подвергаются воздействию вне материалов для культивирования клеток. Как показано на рисунке 4, это может привести к неравномерным паттернам с белковыми агрегатами, формирующимися поверх интересующей особенности. Промывка чипов клеточной культуры после инкубации белка и во время клеточной культуры имеет решающее значение для правильного покрытия 3D-геометрии. Поэтому рекомендуется всегда оставлять небольшие объемы рабочего раствора (PBS, PLPP, белковый раствор, клеточная культуральная среда) поверх чипа клеточной культуры.
До сих пор несколько белковых покрытий (фибронектин, коллаген типа I и IV, желатин, FNC) и типы клеток (стромальные клетки костного мозга человека, миофибробласты человека, эндотелиальные клетки человека, кератоциты человека и дермальные фибробласты) использовались в сочетании с описанным подходом фотоструктурирования на структурированных материалах клеточной культуры. Как показано в предыдущем исследовании48, оптимизация параметров инкубации белка является ключевой для систематического исследования новых типов клеток. Поэтому перед проведением нового эксперимента с новыми белками или клетками рекомендуется проверить диапазон концентраций белка, температуры инкубации и времени инкубации. Сравнивая морфологию клеток после начальной адгезии на однородных, узорчатых плоских участках с морфологией клеток в «нормальных» условиях клеточной культуры, можно получить оптимизированный набор экспериментальных параметров. Кроме того, каждому типу клеток может потребоваться разное количество времени после посева, чтобы показать узнаваемую морфологию адгезии в определенной среде multicue (см. Рисунок 5). С этой целью крайне важно оптимизировать время, необходимое для каждого типа ячейки для представления контактных событий на узорчатой области во время промывки на этапе 8.4. Например, мы заметили, что на линейных паттернах кератоциты человека показывают удлиненные морфологии в течение первых 30 минут после посева, в то время как эндотелиальные клетки и дермальные фибробласты требуют несколько часов, прежде чем показать изменение морфологии адгезии. Таким образом, экспериментальные параметры, необходимые для инкубации белка (стадия 7) и посева клеток (стадия 8), могут зависеть от выбора белка и типа клетки.
Представленный подход к применению контактных направляющих сигналов на 3D-геометрии может помочь в создании более глубокого понимания поведения клеток в сложных многопросветных средах. Это может включать исследования внутриклеточных компонентов, таких как очаговые спайки и ядра, а также может включать эксперименты, выполненные на более крупном, клеточном или тканевом масштабе с использованием предлагаемого способа. В конце концов, ожидается, что полученные знания могут быть использованы при разработке приложений тканевой инженерии, где сложные клеточные среды предназначены для направления поведения клеток к желаемому результату.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Мы благодарим доктора Нелло Формисано (Институт регенеративной медицины, вдохновленный технологиями MERLN) за предоставление первичных кератоцитов человека. Эта работа была поддержана Chemelot InSciTe (проект BM3.02); Европейский исследовательский совет (грант 851960); и Министерство образования, культуры и науки по программе гравитации 024.003.013 «Регенерация на основе материалов». Авторы хотели бы поблагодарить Alvéole за их переписку, помощь и устранение неполадок.
Материалы
| Name | Company | Catalog Number | Comments |
| Anti-vinculin antibody, mouse monoclonal IgG1 | Sigma | V9131 | Dilution: 1/600 |
| Bovine Serum albumin, Fraction V | Roche | 10735086001 | |
| DMEM, high glucose, pyruvate | Gibco | 41966029 | |
| DMEM/F-12 + GlutaMAX (1x) | Gibco | 10565018 | |
| DMi8 epifluorescent microscope | Leica Microsystems | ||
| Ethanol | Biosolve | 0005250210BS | |
| Fetal Bovine Serum | Serana | 758093 | |
| Fiji/ImageJ, version v1.53k | www.imageJ.nih.gov | ||
| Fluorescent highlighter | Stabilo | 4006381333627 | |
| Fluorescin-labeled gelatin | Invitrogen | G13187 | Concentration: 0.01% |
| Formaldehyde solution | Merck | F8775 | |
| Glass coverslips 24 x 60 mm, #1 | VWR | 631-1575 | |
| Glass coverslips, ø = 32 mm, #1 | Menzel-Gläser | ||
| HCX PL fluotar L 20X/0.40na microscope objective | Leica | 11506242 | |
| HEPES | Gibco | 15630080 | |
| Human dermal fibroblasts | Lonza | CC-2511 | |
| Human primary keratocytes | MERLN Institute for Technology-Inspired Regenerative Medicine | ||
| Illustrator, Version 26.0.1 | Adobe | ||
| Laboratory oven | Carbolite | ||
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960 | |
| Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Leonardo software, version 4.16 | Alvéole | ||
| Micro-manager, version 1.4.23 | Open imaging | ||
| Mowiol 4-88 | Sigma-Aldrich | 81381 | mounting medium |
| mPEG-succinimidyl valerate MW 5,000 Da | Laysan Bio | MPEG-SVA-5000 | Concentration: 50 mg/mL |
| Negative glass mold | FEMTOprint | ||
| NucBlue Live Readyprobes Reagent (Hoechst 33342) | Invitrogen | R37605 | 2 drops/mL |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140163 | |
| Petri dish (ø=100 mm) | Greiner Bio-one | 664160 | |
| Phalloidin Atto 647N | Sigma | 65906 | Dilution: 1/250 |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Plasma asher | Emitech | K1050X | |
| PLPP (photoinitiator) | Alvéole | ||
| Poly-L-lysine, sterile-filtered | Sigma-Aldrich | P4707 | Concentration: 0.01% |
| PRIMO | Alvéole | ||
| Rhodamine-labeled fibronectin | Cytoskeletn, Inc. | FNR01 | Concentration: 10 µg/mL |
| Secondary antibody with Alexa 488, Goat anti-mouse IgG1 (H) | Molecular Probes | A21121 | Dilution: 1/300 |
| Secondary antibody with Alexa 555, Goat anti-mouse IgG1 (H) | Molecular Probes | A21127 | Dilution: 1/300 |
| Spin coater | Leurell Technologies Corporation | model WS-650MZ-23NPPB | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 1673921 | |
| TCS SP8X confocal microscope | Leica Microsystems | ||
| tridecafluoro(1,1,2,2-tetrahydrooctyl)trichlorosilane | ABCR | AB111444 | |
| TrypLE Express Enzyme (1x), no phenol red | Gibco | 12604013 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 |
Ссылки
- Wang, Y., Wang, G., Luo, X., Qiu, J., Tang, C. Substrate stiffness regulates the proliferation, migration, and differentiation of epidermal cells. Burns. 38, 414-420 (2012).
- Viswanathan, P., et al. 3D surface topology guides stem cell adhesion and differentiation. Biomaterials. 52, 140-147 (2015).
- Peyton, S. R., et al. Marrow-derived stem cell motility in 3D synthetic scaffold is governed by geometry along with adhesivity and stiffness. Biotechnology and Bioengineering. 108 (5), 1181-1193 (2011).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nature Reviews Molecular Cell Biology. 18 (12), 728-742 (2017).
- Chaudhuri, O., Cooper-White, J., Janmey, P. A., Mooney, D. J., Shenoy, V. B. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584, 535-546 (2020).
- Guido, S., Tranquillo, R. T. A methodology for the systematic and quantitative study of cell contact guidance in oriented collagen gels. Correlation of fibroblast orientation and gel birefringence. Journal of Cell Science. 105 (2), 317-331 (1993).
- Teixeira, A. I., Abrams, G. A., Bertics, P. J., Murphy, C. J., Nealey, P. F. Epithelial contact guidance on well-defined micro- and nanostructured substrates. Journal of Cell Science. 116, 1881-1892 (2003).
- Driscoll, M. K., Sun, X., Guven, C., Fourkas, J. T., Losert, W. Cellular contact guidance through dynamic sensing of nanotopography. ACS Nano. 8 (4), 3546-3555 (2014).
- Buskermolen, A. B. C., et al. Cellular contact guidance emerges from gap avoidance. Cell Reports Physical Science. 1 (5), 100055 (2020).
- Thrivikraman, G., et al. Cell contact guidance via sensing anisotropy of network mechanical resistance. Proceedings of the National Academy of Sciences of the United States of America. 118 (29), 1-11 (2021).
- Buskermolen, A. B. C., et al. Entropic forces drive cellular contact guidance. Biophysical Journal. 116 (10), 1994-2008 (2019).
- Vignaud, T., et al. Reprogramming cell shape with laser nano-patterning. Journal of Cell Science. 125 (9), 2134-2140 (2012).
- Pouthas, F., et al. In migrating cells, the Golgi complex and the position of the centrosome depend on geometrical constraints of the substratum. Journal of Cell Science. 121 (14), 2406-2414 (2008).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Théry, M., et al. Anisotropy of cell adhesive microenvironment governs cell internal organization and orientation of polarity. Proceedings of the National Academy of Sciences of the United States of America. 103 (52), 19771-19776 (2006).
- Huang, G., et al. Functional and biomimetic materials for engineering of the three-dimensional cell microenvironment. Chemical Reviews. 117 (20), 12764-12850 (2017).
- Callens, S. J. P., Uyttendaele, R. J. C., Fratila-Apachitei, L. E., Zadpoor, A. A. Substrate curvature as a cue to guide spatiotemporal cell and tissue organization. Biomaterials. 232, 119739 (2020).
- Yilmaz, C. O., Xu, Z. S., Gracias, D. H. Curved and Folded Micropatterns in 3D Cell Culture and Tissue Engineering. Methods in Cell Biology. 121, (2014).
- Silver, F. H., Freeman, J. W., Seehra, G. P. Collagen self-assembly and the development of tendon mechanical properties. Journal of Biomechanics. 36 (10), 1529-1553 (2003).
- Werner, M., Kurniawan, N. A., Bouten, C. V. C. Cellular geometry sensing at different length scales and its implications for scaffold design. Materials. 13 (4), 963 (2020).
- Di Cio, S., Bøggild, T. M. L., Connelly, J., Sutherland, D. S., Gautrot, J. E. Differential integrin expression regulates cell sensing of the matrix nanoscale geometry. Acta Biomaterialia. 50, 280-292 (2017).
- Fioretta, E. S., Simonet, M., Smits, A. I. P. M., Baaijens, F. P. T., Bouten, C. V. C. Differential response of endothelial and endothelial colony forming cells on electrospun scaffolds with distinct microfiber diameters. Biomacromolecules. 15 (3), 821-829 (2014).
- Werner, M., Kurniawan, N. A., Korus, G., Bouten, C. V. C., Petersen, A. Mesoscale substrate curvature overrules nanoscale contact guidance to direct bone marrow stromal cell migration. Journal of The Royal Society Interface. 15 (145), 20180162 (2018).
- Ruprecht, V., et al. How cells respond to environmental cues - insights from bio-functionalized substrates. Journal of Cell Science. 130 (1), 51-61 (2017).
- Bao, M., Xie, J., Huck, W. T. S. Recent advances in engineering the stem cell microniche in 3D. Advanced Science. 5 (1800448), 1-16 (2018).
- Zhan, X. Effect of matrix stiffness and adhesion ligand density on chondrogenic differentiation of mesenchymal stem cells. Journal of Biomedical Materials Research - Part A. 108 (3), 675-683 (2020).
- Jiang, T., et al. Untangling the response of bone tumor cells and bone forming cells to matrix stiffness and adhesion ligand density by means of hydrogels. Biomaterials. 188, 130-143 (2019).
- Choi, J. S., Harley, B. A. C. The combined influence of substrate elasticity and ligand density on the viability and biophysical properties of hematopoietic stem and progenitor cells. Biomaterials. 33, 4460-4468 (2012).
- Rape, A. D., Zibinsky, M., Murthy, N., Kumar, S. A synthetic hydrogel for the high-throughput study of cell-ECM interactions. Nature Communications. 6 (8129), 1-9 (2015).
- Camarero-Espinosa, S., et al. 3D printed dual-porosity scaffolds: the combined effect of stiffness and porosity in the modulation of macrophage polarization. Advanced Healthcare Materials. 11 (2101415), 1-16 (2022).
- Bao, M., et al. Cellular volume and matrix stiffness direct stem cell behavior in a 3D microniche. ACS Applied Materials and Interfaces. 11 (2), 1754-1759 (2019).
- Charest, J. L., Eliason, M. T., García, A. J., King, W. P. Combined microscale mechanical topography and chemical patterns on polymer cell culture substrates. Biomaterials. 27, 2487-2494 (2006).
- Bilem, I., et al. Interplay of Geometric Cues and RGD/BMP-2 crosstalk in directing stem cell fate. ACS Biomaterials Science and Engineering. 3 (10), 2514-2523 (2017).
- Nam, K. -. H., et al. Multiscale cues drive collective cell migration. Scientific Reports. 6, 29749 (2016).
- Alom Ruiz, S., Chen, C. S. Microcontact printing: A tool to pattern. Soft Matter. 3 (2), 168-177 (2007).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Protein Micropatterns. A Direct Printing Protocol Using Deep UVs. Methods in Cell Biology. 97, (2010).
- Kane, R. S., Takayama, S., Ostuni, E., Ingber, D. E., Whitesides, G. M. Patterning proteins and cells using soft lithography. Biomaterials. 20 (23-24), 2363-2376 (1999).
- Azioune, A., Storch, M., Bornens, M., Théry, M., Piel, M. Simple and rapid process for single cell micro-patterning. Lab on a Chip. 9 (11), 1640 (2009).
- Offenhäusser, A., et al. Microcontact printing of proteins for neuronal cell guidance. Soft Matter. 3 (3), 290-298 (2007).
- Ricoult, S. G., Sanati Nezhad, A., Knapp-Mohammady, M., Kennedy, T. E., Juncker, D. Humidified microcontact printing of proteins: universal patterning of proteins on both low and high energy surfaces. Langmuir. 30 (40), 12002-12010 (2014).
- Waterkotte, B., et al. Biofunctional Micropatterning of Thermoformed 3D Substrates. Advanced Functional Materials. 24 (4), 442-450 (2014).
- Lehnert, D., et al. Cell behaviour on micropatterned substrata: Limits of extracellular matrix geometry for spreading and adhesion. Journal of Cell Science. 117 (1), 41-52 (2004).
- Sevcik, E. N., Szymanski, J. M., Jallerat, Q., Feinberg, A. W. Patterning on topography for generation of cell culture substrates with independent nanoscale control of chemical and topographical extracellular matrix cues. Current Protocols in Cell Biology. 75, 1-25 (2017).
- Micropatterning: Surface functionalization. Alvéole Available from: https://www.alveolelab.com/technology/micropatterning-surface-functionalization/ (2022)
- Strale, P. O., et al. Multiprotein printing by light-induced molecular adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- van Gaal, R. C., Miltenburg, R. P. R. S., Kurniawan, N. A., Bouten, C. V. C., Dankers, P. Y. W. Renal epithelial cell responses to supramolecular thermoplastic elastomeric concave and convex structures. Advanced Materials Interfaces. 8 (1), 2001490 (2021).
- Foster, J. W., Gouveia, R. M., Connon, C. J. Low-glucose enhances keratocyte-characteristic phenotype from corneal stromal cells in serum-free conditions. Scientific Reports. 5, 1-16 (2015).
- Van Der Putten, C., et al. Protein micropatterning in 2.5D: an approach to investigate cellular responses in multi-cue environments. ACS Applied Materials and Interfaces. 13 (22), 25589-25598 (2021).
- Melero, C., et al. Light-induced molecular adsorption of proteins using the primo system for micro-patterning to study cell responses to extracellular matrix proteins. Journal of Visualized Experiments. (152), e60092 (2019).
- Hou, Y., et al. Surface roughness gradients reveal topography-specific mechanosensitive responses in human mesenchymal stem cells. Small. 16 (10), 1905422 (2020).
- Bourkoula, A., et al. Roughness threshold for cell attachment and proliferation on plasma micro-nanotextured polymeric surfaces: The case of primary human skin fibroblasts and mouse immortalized 3T3 fibroblasts. Journal of Physics D: Applied Physics. 49 (30), 304002 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены