Method Article
삼차원 세포 배양 기질의 UV-광패터닝에 의한 다큐 세포 미세환경 생성
요약
전통적으로, 세포 배양은 생체 내에서 세포의 자연 환경을 잘 모방하지 못하는 평면 기질에서 수행됩니다. 여기서 우리는 생리적으로 관련된 곡선 기하학과 미세 패턴화 된 세포 외 단백질을 가진 세포 배양 기질을 생산하는 방법을 설명하여 이러한 세포 외 단서의 세포 감지에 대한 체계적인 조사를 가능하게합니다.
초록
세포외 매트릭스는 세포 기능의 중요한 조절자이다. 리간드 분포 및 조직 기하학과 같은 세포 미세 환경에 존재하는 환경 신호는 세포 표현형 및 행동을 관리하는 데 중요한 역할을하는 것으로 점점 더 많이 나타났습니다. 그러나, 이러한 환경 단서 및 세포에 대한 그들의 효과는 종종 개별 단서를 분리하는 시험관내 플랫폼을 사용하여 개별적으로 연구되며, 이는 다중 단서의 복잡한 생체내 상황을 크게 단순화하는 전략이다. 엔지니어링 접근법은 생체 내 미세 환경의 복잡성을 포착하면서도 시험관 내 시스템의 정밀도 및 조작성을 유지하는 실험 설정을 개발함으로써 이러한 격차를 해소하는 데 특히 유용 할 수 있습니다.
이 연구는 자외선 (UV) 기반 단백질 패터닝과 리소그래피 기반 기판 미세 제작을 결합한 접근 방식을 강조하여 다중 큐 환경에서 세포 거동에 대한 고처리량 조사를 가능하게합니다. 마스크리스 UV-광패터닝을 통해 잘 정의된 다양한 기하학적 단서를 포함하는 칩의 3차원(3D) 세포 배양 기질에 복잡하고 접착적인 단백질 분포를 만들 수 있습니다. 제안된 기술은 상이한 중합체 물질로부터 제조되고 광범위한 단백질의 접착 패턴화된 영역과 결합된 배양 기질에 사용될 수 있다. 이러한 접근법으로, 단층뿐만 아니라 단일 셀은 패턴화된 기판에 의해 제시된 기하학적 단서와 접촉 안내 단서의 조합을 받을 수 있다. 따라서 칩 물질, 단백질 패턴 및 세포 유형의 조합을 사용한 체계적인 연구는 다중 큐 환경에 대한 세포 반응에 대한 근본적인 통찰력을 제공 할 수 있습니다.
서문
생체내에서, 세포는 세포외 매트릭스(ECM)로부터 기원되는 기계적, 물리적, 생화학적 성질을 가질 수 있는 매우 다양한 환경 단서를 받게 된다. 수많은 환경 단서가 증식, 분화 및 이동 1,2,3,4,5와 같은 세포 행동의 조절에 중요한 역할을하는 것으로 확인되었습니다. 가장 널리 조사된 현상 중 하나는 접촉 안내이며, 세포외 기질 6,7,8,9,10,11에 존재하는 이방성 생화학적 또는 지형적 패턴을 따른 부착-매개된 세포 정렬을 기술한다. 세포의 정렬을 지시하는 것 외에도, 접촉 안내 단서는 또한 세포 이동, 세포 내 단백질의 조직, 세포 모양 및 세포 운명12,13,14,15와 같은 다른 세포 특성에 영향을 미치는 것으로 나타났습니다. 또한, 3D 세포 환경의 기하학적 구조는 또한 세포 거동16,17에 대한 조절 영향으로 인정 받았다. 인체에서 세포는 마이크로 스케일 콜라겐 섬유, 모세 혈관 및 사구체에서부터 중규모 폐포 및 동맥18,19에 이르기까지 다양한 곡선 기하학에 노출됩니다. 흥미롭게도, 최근의 시험관내 연구는 세포가 나노-규모에서 메 조스케일20,21,22,23에 이르기까지 그러한 물리적 단서를 감지하고 이에 반응할 수 있음을 보여주었다.
현재까지 환경 신호에 대한 세포 반응을 조사하는 대부분의 연구는 주로 단일 단서를 분리하는 실험 설정을 사용하여 수행되었습니다. 이 접근법은 환경 단서의 세포 감지 뒤에있는 기본 메커니즘을 이해하는 데 엄청난 진전을 가져 왔지만 동시에 여러 단서를 제시하는 생체 내 환경을 제대로 되풀이하지 못합니다. 이러한 격차를 해소하기 위해서는 여러 환경 단서를 독립적으로 동시에 제어 할 수있는 문화 플랫폼을 개발하는 것이 유용합니다. 이 개념은 매트릭스 강성과 리간드 밀도 26,27,28,29, 기판 강성 및 다공도 30, 기판 강성 및 3D 마이크로 틈새 볼륨 31, 표면 지형 및 접촉 유도 큐 32,33,34를 결합한 연구를 통해 최근 24,25의 견인력을 얻었습니다. 및 나노스케일 접촉-유도 단서와 메조스케일 곡률 안내 단서(23). 그러나 접촉 유도 단서와 다양한 3D 형상을 제어되고 높은 처리량의 방식으로 결합하는 것은 여전히 어려운 일입니다.
이 연구 프로토콜은 이러한 과제를 해결하고 ECM 단백질의 패턴화 된 접착 영역 (접촉 유도 신호)과 기질 곡률 (기하학적 단서)의 제어 된 조합으로 세포 배양 기질을 만드는 방법을 소개합니다. 이러한 접근법은 체계적이고 높은 처리량 방식으로 생체모방 멀티큐 환경에서 세포 반응의 해부를 허용한다. 습득 한 지식은 복잡한 환경에서 세포 행동에 대한 이해를 도울 수 있으며 세포 반응을 원하는 결과로 유도하는 특성을 가진 유익한 자료를 설계하는 데 사용할 수 있습니다.
3D 단백질 포토패터닝
세포 배양 물질 상의 ECM 단백질의 접착 영역(접촉-안내 큐)의 생성은 다양한 기술, 예를 들어 딥-자외선(deep-UV) 패터닝 또는 마이크로컨택트 프린팅(35,36)에 의해 달성될 수 있다. 딥-UV 패터닝은 고분자 물질의 마스크를 통해 투사되는 자외선을 사용하여 세포 배양 기질의 특정 위치에서 패시베이션 폴리머를 분해합니다. 이어서, 패터닝된 기질은 관심있는 리간드와 함께 인큐베이션되고, 그 결과 세포 부착을 지지하는 접착 영역이 생성되고 미리 정의된 위치(12,37,38) 상에서 배양된다. 단백질 패턴을 도입하는 또 다른 방법은 원하는 모양을 포함하는 엘라스토머 스탬프를 원하는 단백질로 코팅하고 세포 배양 기판에 압착하여 세포가 부착 할 수있는 단백질 코팅을 전달하는 마이크로 접촉 인쇄를 사용하는 것입니다35,37,39,40 . 불행히도, 두 기술 모두 마스크 준비 및 소프트 리소그래피 방법에 의존하기 때문에 실험은 시간이 많이 걸리고 노동 집약적이며 패턴 유연성 측면에서 제한적입니다. 또한 딥 UV 패터닝과 마이크로 컨택트 프린팅은 평면 재료에 가장 적합하며 3D 환경에서 리간드를 패터닝하는 데 불가능하지는 않더라도 기술적으로 어렵습니다.
이러한 종래의 방법들을 개선하기 위해, Waterkotte et al. 결합된 마스크리스 리소그래피, 화학 기상 증착, 및 열성형은 마이크로패턴화된 3D 폴리머 기판(41)을 생성한다. 그러나이 기술은 열 성형 가능한 폴리머 필름의 사용에 의존하고 낮은 단백질 패턴 분해능 (7.5 μm)을 제공하는 반면, 세포는 0.1 μm2,42만큼 작은 기하학적 단백질 패턴에 반응하는 것으로보고되었습니다. Sevcik 등은 나노- 및 마이크로미터 지형43을 함유하는 기질 상의 ECM 리간드를 나노패턴화하는 또 다른 유망한 방법을 기술하였다. 마이크로컨택트 프린팅을 사용하여, ECM 단백질을 폴리디메틸실록산(PDMS) 스탬프로부터 열반응성 폴리(N-이소프로필아크릴아미드)(pNIPAM) 기판으로 옮겼다. 이어서, pNIPAM 네트워크의 열반응성 특성은 이들이 2차원(2D) 단백질 패턴을 지형학적 PDMS 기질(10-100 μm 깊은 홈)으로 전달할 수 있게 하여, 지형학적 특징에 대한 부착 부위의 국소화를 제어한다. 그러나, 모든 가능한 미세 토포그래피가 패턴화될 수 있는 것은 아니며, 이는 감소된 습윤성 문제로 인해 더 깊은 지형 기판을 패터닝하는 것이 더 어려워지기 때문이다. 깊이 대 폭 종횡비가 2.4인 트렌치는 패턴을 지형 기판(43)으로 성공적으로 전달하는 데 궁극적인 한계인 것으로 보고되었다. 또한 다양한 패턴의 유연성과 생성 된 패턴의 해상도는 마이크로 접촉 인쇄의 요구 사항으로 인해 열악합니다.
이 백서에서는 위에서 언급한 병목 현상을 극복하는 방법을 설명하고 세포 배양에 사용할 수 있는 멀티큐 기판을 만드는 유연하고 높은 처리량 방법을 제공합니다( 그림 1 참조). ĸ = 1/2500에서 ĸ = 1/125 μm-1 사이의 곡률을 갖는 생리학적으로 관련된 형상(실린더, 돔, 타원 및 안장 표면)은 PDMS 칩에서 사전 설계되고 미세 제작됩니다. 그 후, 접촉 유도 단서는 1.5μm(44)만큼 작은 해상도의 포토패터닝 기술을 사용하여 다양한 디지털 패턴 설계를 사용하여 3D 형상 위에 생성됩니다. 이를 위해, PDMS 칩은 세포 및 단백질이 부착되는 것을 방지하기 위해 초기에 패시베이션된다; 이 패시베이션 층은 이어서 광개시제 4-벤조일벤질트리메틸암모늄 클로라이드(PLPP) 및 UV-광 노출(45)의 조합에 의해 제거될 수 있다. 디지털 마스크는 UV 노출의 위치, 따라서 패시베이션 층이 제거되는 영역을 지정하도록 설계되었습니다. 단백질은 후속적으로 이러한 영역에 부착되어 세포 부착을 가능하게합니다. 패터닝은 물리적 마스크가 아닌 디지털 마스크를 사용하여 수행되기 때문에 추가 포토 마스크를 설계하고 제작하는 것과 관련된 번거 로움과 비용없이 다양한 패턴을 신속하게 만들 수 있습니다. 또한, 다양한 범위의 ECM 단백질(예를 들어, 콜라겐 타입 I, 젤라틴, 및 피브로넥틴)이 기질 상에 패터닝될 수 있다. 이 프로토콜이 PDMS로 제조된 세포 배양 칩을 사용하여 수행되지만, 그 원리는 관심있는 임의의 다른 물질(46)에 적용될 수 있다.
프로토콜
이 프로토콜에 기술된 연구에서, 원발성 인간 각질세포가 사용되었다. 이 연구는 헬싱키 선언의 교리에 따라 수행되었습니다. 원발성 각질세포는 Descemet Membrane Endothelial Keratoplasty surgery로부터 남은 인간 사체 각막 각막 각막 외막 외래 세포로부터 분리되었고, 이는 모든 사망한 공여자의 친족으로부터 동의를 얻은 후 ETB-BISLIFE Multi-Tissue Center (Beverwijk, 네덜란드)의 각막부로부터 입수하였다.
참고: 이 프로토콜에 사용되는 모든 재료, 시약, 장비 및 소프트웨어에 대한 자세한 내용은 재료 표를 참조하십시오.
1. 3D 세포배양기질 제작
- 이 경우 펨토초-레이저 직접 쓰기 기술을 사용하여 유리로 만든 관심있는 모든 기능을 포함하는 네거티브 유리 몰드 (1 번)를 만듭니다 ( 그림 2 참조).
- 조심스럽게 네거티브 유리 몰드 (3 번)를 페트리 접시 바닥에 놓습니다.
- 빈 50 mL 원뿔형 튜브를 스케일 상에 위치시키고, 스케일을 겹쳐서 PDMS 프레폴리머를 제조하고, 원하는 양의 실리콘 엘라스토머 베이스를 튜브에 부어준다.
- 파스퇴르 피펫을 사용하여 경화제를 추가하여 엘라스토머 베이스와 경화제의 최종 비율이 10:1(w/w)가 되도록 합니다.
- 주걱을 사용하여 원뿔형 튜브에 성분을 완전히 혼합하십시오.
- 2,000 × g 에서 70초 동안 원심분리하여 모든 기포를 제거하였다.
- PDMS 프리폴리머를 페트리 접시의 네거티브 유리 몰드 위에 붓고 완전히 덮으십시오.
- 네거티브 유리 몰드 (1 번)와 PDMS 프레 폴리머가있는 페트리 접시를 진공 데시케이터에 놓고 진공 펌프를 시작하십시오. 진공에 도달하면 5 분 동안 기다렸다가 몰드 표면과 PDMS 예비중합체 사이의 계면에 존재하는 모든 기포를 제거하십시오.
- 진공을 제거하고 페트리 접시를 건조기에서 꺼냅니다.
- PDMS 프레폴리머를 65°C의 오븐에서 하룻밤 동안 경화시킨다.
- 주걱을 이용하여 PDMS의 가장자리를 들어올려 네거티브 유리 몰드 (5)로부터 새로 경화된 포지티브 PDMS 칩 5번을 조심스럽게 제거하였다. 포지티브 PDMS 칩 (2)이 네거티브 유리 몰드 (3)에 달라 붙는 경향이 있다면, 들어 올리는 동안 임프린트의 가장자리에 에탄올 또는 물을 첨가하십시오.
참고 : 유체는 두 층 사이에서 작동하며 네거티브 유리 몰드 (1 번)와 포지티브 PDMS 칩 (2 번)의 분리를 용이하게합니다. - 블레이드를 사용하여 포지티브 PDMS 칩 (2)의 측면을 잘라 직사각형 칩이 남아 있도록하십시오.
- 포지티브 PDMS 칩 2번을 실란화제인 트리데카플루오로(1,1,2,2-테트라하이드로옥틸)트리클로로실란의 액적이 있는 작은 바이알 옆에 데시케이터에 넣고 밤새 진공 하에 두어라.
참고: Silanization은 임프린트가 프로토콜의 뒷부분에 있는 다른 PDMS 계층에 바인딩되지 않도록 합니다. 다른 실란화제 및/또는 방법들은 또한 PDMS 칩들의 표면들이 다른 PDMS 층들에 달라붙지 않도록 하기 위해 작용할 수 있다.
주의: 트리데카플루오로(1,1,2,2-테트라하이드로옥틸)트리클로로실란은 가연성(H226)이며 심한 피부 화상과 눈 손상을 일으킵니다(H314). 개인 보호 장비를 착용하고, 흄 후드에서 작업하고, 취급 후 손을 깨끗이 씻으십시오. 실란화 제를 열, 뜨거운 표면, 불꽃, 화염 및 기타 점화원으로부터 멀리하십시오. 15~30°C(P280, P210, P240, P403, P235, P310) 사이에 보관하십시오. - 진공을 제거하고 페트리 접시의 바닥에 포지티브 PDMS 칩 (2 번)을 놓습니다. PDMS 프리폴리머(10:1)를 위에 붓고 여러 개의 네거티브 PDMS 몰드(3)를 생성합니다.
- 페트리 접시를 데시케이터에 진공 상태에서 15 분 동안 넣어 모든 거품을 제거하십시오.
- PDMS 프레폴리머를 65°C에서 하룻밤 동안 경화시키고, 그 후 네거티브 PDMS 몰드 3번을 주걱을 사용하여 포지티브 PDMS 칩 (2)로부터 박리할 수 있다.
- 최종 네거티브 PDMS 몰드 3번을 진공 데시케이터에서 실란화제를 사용하여 하룻밤 사이에 실란화한다.
- PDMS 프레폴리머를 네거티브 PDMS 몰드 3번에 붓고, 데시케이터를 사용하여 기포를 제거하고, 65°C에서 3시간 동안 경화시킴으로써 대략 5 mm 두께의 다중 세포 배양 칩(#4, 도 2 참조)을 생성한다. 면도날을 사용하여 그림 2에서 시각화한 대로 칩을 최종 크기로 자릅니다. 칩을 실온에서 보관하십시오.
참고: 표면 거칠기는 세포 반응에 영향을 줄 수 있습니다. 필요한 경우, PDMS의 추가적인 얇은 층이 표면을 평활화시키기 위해 포지티브 PDMS 칩 (2) 상의 코팅으로서 사용될 수 있다. 이렇게하려면 PDMS 프리폴리머의 작은 물방울을 칩에 붓고 가압 된 공기를 사용하여 전체 칩 위에 퍼뜨립니다. 코팅된 칩을 65°C에서 3시간 동안 경화시키고 단계 1.12로 계속한다.
2. 편평한 PDMS 표본의 제작 (통제 표본)
- 단계 1.3-1.6에 따라 PDMS 프레폴리머(10:1)를 제조한다.
- 스핀 코터의 중앙에 있는 둥근 진공 포스트에 유리 커버슬립을 놓습니다.
- 진공을 켜서 유리 커버슬립을 기계에 부착하고 파스퇴르 피펫을 사용하여 커버슬립 중간에 PDMS 방울을 피펫으로 만듭니다.
- PDMS 프레폴리머를 다음 프로토콜을 사용하여 유리 기판 위에 분배하여 대략 10 μm 두께의 층을 얻는다.
- 0.45 × g에서 10 초 동안 스핀 코트, 가속도 : 0.2 × g / s.
- 44.8 × g에서 50 초 동안 스핀 코트, 가속도 : 0.54 × g / s.
- 진공을 끄고 핀셋을 사용하여 스핀 코터에서 커버 슬립을 제거한 다음 페트리 접시에 넣으십시오. PDMS를 65°C의 오븐에서 하룻밤 동안 경화시키고 이후 실온에서 보관한다.
3. 3D 세포 배양 기질의 기질 패시베이션
- O2 플라즈마를 사용하여 PDMS 칩 (4)의 표면에서 히드록실기를 활성화시킨다. 핀셋을 사용하여 칩을 플라즈마 어셔의 바구니에 넣으십시오.
- 30초 동안 20W의 전력을 사용하여 애쉬 사이클을 실행합니다. N2를 사용하여 회분 챔버를 환기시킨다.
- 칩을 바구니에서 꺼내 작은 PDMS 컨테이너에 넣습니다( 그림 1 참조).
- 파스퇴르 피펫을 사용하여 칩 상단에 500μL의 Poly-L-라이신(PLL, 0.01%)을 첨가하여 완전한 표면이 PLL 용액에 침지되도록 합니다. 실온에서 30분 동안 인큐베이션한다.
- 피펫으로 세포 배양 칩으로부터 450 μL의 PLL을 제거하고 0.1 M HEPES 완충액 (pH < 8.5의 500 μL로 칩 표면을 세 번 헹구<다. 샘플에서 건조되지 않도록 항상 소량의 액체를 PDMS 칩에 남겨 두면 최종 패턴 품질이 저하됩니다.
- 500 μL를 50 mg/mL 메톡시폴리에틸렌 글리콜-숙신이미딜 발레레이트(mPEG-SVA; MW 5,000 Da) 용액을 세포 배양 칩 당 0.1 M HEPES 완충액 (8 < pH < 8.5) 중의 60분 동안 샘플 상에서 인큐베이션하게 하였다. mPEG-SVA는 15분의 반감기를 갖기 때문에, 사용 직전에 필요한 양을 준비해야 한다.
참고: mPEG-SVA는 용액이 완전히 투명할 때 용해됩니다. - 마이크로피펫을 이용하여 mPEG-SVA 용액 450 μL를 제거하고, 칩 표면을 포스페이트 완충 식염수(PBS)로 다섯 번 세척하였다. 모든 결합되지 않은 mPEG-SVA가 제거되도록 세척 당 여러 번 위아래로 피펫을 피펫하십시오. 샘플이 건조되는 것을 방지하려면, 세척 단계 사이의 시간을 최소화하고 세척을 위해 과량(500 μL 이상)의 PBS를 사용해야 한다.
- 샘플을 PBS에 침지하여 저장하거나 프로토콜의 패터닝 단계를 계속한다.
참고 : 원하는 경우 문화 캐비닛에서 작업하고 멸균 용액 및 장비로 작업 할 때 멸균 조건에서 패시베이션을 수행 할 수 있습니다.
4. 패턴화된 세포 배양 기질의 저장
참고: 3D 세포 배양 기질은 공정의 다른 단계 동안 저장될 수 있다.
- 경화된 PDMS 세포 배양 칩을 실온에서 건조 조건 하에 보관한다.
- 패시베이션된 세포 배양 칩을 다음 두 가지 방법 중 하나로 저장합니다.
- 최대 7일 동안 4°C에서 PBS에 보관한다.
- 최대 몇 달 동안 건조한 조건에서 보관하십시오. 건조 샘플을 얻으려면 PBS를 제거하고 이중 증류수 (ddH2O)를 사용하여 여러 번 헹구십시오. 질소 또는 에어건을 사용하여 블로우 드라이.
5. 사진 패터닝에 사용되는 디지털 마스크 디자인
참고: 3D 기판의 패터닝은 단일 또는 다중 초점면을 사용하여 수행할 수 있습니다( 그림 3 참조). 단일 초점면은 하나의 디지털 미러 장치(DMD, 약 300μm x 500μm)보다 크지 않고 너무 크지 않은(50-100μm) 피처에 사용할 수 있습니다. 이 경우 TIFF 모드를 사용하여 디지털 패턴을 설계합니다. 하나의 DMD의 치수를 초과하고 상대적으로 큰 피쳐의 경우, 기판의 패터닝을 여러 단계로 나눕니다. 이 경우 여러 패턴은 모두 개별적으로 단일 초점면에 초점을 맞추는 PDF 모드를 사용하여 설계되었습니다.
- 디자인 소프트웨어 도구를 사용하여 디지털 마스크를 디자인합니다.
- TIFF 모드(픽셀)에서 패터닝: 1,140 x 1,824픽셀(DMD 1DMD의 정확한 크기, 약 300μm x 500μm)의 완전히 검은색 대지를 만들고 대지를 원하는 모양으로 채웁니다. 대지를 8비트 TIFF 파일로 내보냅니다.
참고: 패턴 디자인의 회색 레벨에 따라 해당 위치에서 수행될 노출량이 결정됩니다. - PDF 모드(미터법 단위)에서 패터닝: 원하는 크기의 검은색 대지를 mm(mm)로 만들고 대지를 원하는 모양으로 채웁니다. 3D 기판을 여러 초점면을 사용하여 패턴화해야 하는 경우 패턴을 여러 파일로 나눕니다. 대지를 PDF 파일로 저장합니다.
참고: 패턴 디자인의 회색 레벨에 따라 해당 위치에서 수행될 노출량이 결정됩니다.
- TIFF 모드(픽셀)에서 패터닝: 1,140 x 1,824픽셀(DMD 1DMD의 정확한 크기, 약 300μm x 500μm)의 완전히 검은색 대지를 만들고 대지를 원하는 모양으로 채웁니다. 대지를 8비트 TIFF 파일로 내보냅니다.
6. 3D 세포 배양 기질의 UV 광패터닝
- 교정
참고 : 레이저의 교정은 관심있는 재료에 적절한 초점을 맞추기 위해 수행됩니다. PDMS 세포 배양 기질이 너무 두꺼워서 패턴을 통과할 수 없기 때문에, 칩이 거꾸로 배치되는 유리 슬라이드를 사용한다. 레이저가 먼저 유리 슬라이드와 마주 치므로 유리를 사용하여 레이저를 교정하십시오.- 유리 커버슬립에 형광 형광 형광펜을 바르고 유리 커버슬립을 형광 현미경 무대에 놓습니다. 강조 표시된 서피스가 위쪽을 향하고 있는지 확인합니다.
- 현미경과 PRIMO 장비를 켜고 마이크로 관리자를 열어 '플러그인'에서 Leonardo 소프트웨어에 액세스하십시오.
- 초기 메뉴에서 교정 을 선택한 다음 현미경과 소프트웨어 모두에서 20x 목표를 선택합니다. 다음을 클릭하십시오.
- 형광 형광 형광펜이 있는 유리 슬라이드를 현미경의 광학 경로에 놓습니다. 형광 모드로 전환하고 나타나는 PRIMO 이미지에 신중하게 초점을 맞추어 로고와 텍스트에 모두 초점을 맞춥니다. 다음을 클릭하여 교정 절차를 완료합니다.
- 보정할 때 스테이지의 Z-위치를 기록하고 이 위치를 프로토콜의 뒷부분에 참조로 사용합니다.
참고: 교정 재료는 프로토콜의 뒷부분에 있는 패터닝에 사용되는 재료와 일치해야 합니다. 상기 단계들은 세포 배양 기질에 필요한 교정을 설명한다. 플랫 PDMS 제어 샘플의 교정을 위해 추가 플랫 PDMS 샘플 위에 형광 형광 형광펜을 적용하고 6.1.2-6.1.5단계를 사용하여 보정하십시오.
- 단일 초점면을 사용하여 3D 피쳐 패터닝
참고: 단일 초점면을 사용한 패터닝은 하나의 DMD의 치수(약 300μm x 500μm)를 초과하지 않는 3D 피쳐에서 수행됩니다. 초점면 설정의 회로도는 그림 3에 설명되어 있습니다.- 스테이지에서 교정 슬라이드를 제거하고 스테이지에 광개시제(PLPP)의 액적(∼50 μL)이 들어있는 유리 슬라이드를 배치합니다.
주의: PLPP는 눈, 호흡기 및 피부에 자극을 줍니다(R36-38). 개인 보호 장비를 착용하고, 폭발성 물질로부터 멀리하고,이 제품에 물을 추가하지 말고, 정전기 방전에 대한 예방 조치를 취하고, 충격과 마찰을 피하십시오 (S26-36). - PDMS 세포 배양 기질을 광개시제의 액적에 거꾸로 놓는다. 세포 배양 기판 표면의 3D 피쳐가 유리 슬라이드를 향하고 PLPP에 완전히 잠겨 적절한 패터닝을 보장하는지 확인하십시오.
- 소프트웨어에서 패턴을 선택합니다.
- 현미경에서 브라이트 필드 모드로 전환하고 스테이지를 관심 있는 기능으로 이동합니다.
- 볼록한 구조물과 오목한 구조물의 위쪽 또는 아래쪽에 각각 초점을 맞춥니다(그림 3).
- PRIMO를 선택하여 선택한 패턴을 삽입합니다. 라이브 브라이트필드 이미지 위에 주황색으로 패턴 미리보기를 관찰합니다.
- 기능(위치, 각도, 반복)에 따라 패터닝 설정을 조정하고 1,000mJ/mm2의 용량을 선택합니다.
- 잠금을 클릭하고 현미경을 형광 모드로 전환하십시오.
- 화면 오른쪽 하단에 있는 재생 버튼을 클릭하여 패터닝을 시작합니다. 완료되면 녹색으로 표시된 패턴을 관찰하십시오.
- 일단 세포 배양 칩 상의 모든 기능을 완료하면, 패터닝 슬라이드로부터 칩을 제거하고 4°C에서 PBS에 저장한다.
- 스테이지에서 교정 슬라이드를 제거하고 스테이지에 광개시제(PLPP)의 액적(∼50 μL)이 들어있는 유리 슬라이드를 배치합니다.
- 여러 초점면을 사용하여 3D 피쳐 패터닝
참고: 여러 초점면을 사용한 패터닝은 하나의 DMD(약 300μm x 500μm)보다 크거나 상대적으로 높은 3D 피쳐에서 수행됩니다. 이 경우 3D 피쳐는 여러 단계로 패터닝되어야 하며, 즉, 패턴 설계는 그림 3의 예에 따라 조정되어야 합니다.- 스테이지에서 교정 슬라이드를 제거하고 스테이지에 광개시제(PLPP)의 액적(∼50 μL)이 들어있는 유리 슬라이드를 배치합니다.
- PDMS 세포 배양 칩을 핀셋을 사용하여 광개시제의 액적에 거꾸로 놓습니다.
- 소프트웨어에서 패턴을 선택합니다. 현미경에서 브라이트 필드 모드로 전환하고 스테이지를 관심 있는 기능으로 이동합니다.
- 올바른 위치에 있는 칩 영역에 초점을 맞춥니다. 패터닝은 단일 초점면에서 수행되고 피쳐는 단일 DMD보다 크기 때문에 여러 초점 평면을 사용하여 3D 기판당 여러 라운드의 패터닝을 사용하여 피쳐의 전체 높이와 너비를 따라 충분한 패턴 분해능을 보장합니다( 그림 3 참조). 예를 들어, 높이가 150μm인 피쳐의 경우 피쳐 하단에서 약 25μm, 75μm 및 125μm에 초점을 맞춘 세 라운드(Z 트래블 50μm 당 1초점 평면 ±)로 피쳐를 패턴화합니다. 기능의 맨 아래가 6.1.5단계에서 기록한 값 주위에 있는지 확인합니다.
- PRIMO를 선택하여 선택한 패턴을 삽입합니다. 라이브 브라이트필드 이미지 위에 주황색으로 표시된 패턴 미리보기를 관찰합니다.
- 특징(위치, 각도)에 따라 패터닝 설정을 조정하고 1,000mJ/mm2의 용량을 선택합니다.
- 잠금을 클릭하고 현미경을 형광 모드로 전환하십시오.
- 화면 오른쪽 하단에 있는 재생 버튼을 클릭하여 패터닝을 시작합니다. 완료되면 녹색으로 표시된 패턴을 관찰하십시오.
- 여러 초점면을 사용할 때 관심 있는 기능에 대해 6.3.4-6.3.8단계를 반복합니다.
- 일단 세포 배양 칩 상의 모든 기능을 완료하면, 패터닝 슬라이드로부터 칩을 제거하고 이를 4°C에서 PBS에 저장한다.
참고 : 원하는 경우 멸균 조건에서 UV 광 패터닝을 적용하고 유리 바닥 페트리 접시를 사용하고 멸균 배양 캐비닛에 모든 기질을 준비하십시오. 패턴화된 샘플을 최대 몇 주 동안 PBS에 보관한다. ddH2O로 세척하고 가압된 공기를 사용하여 건조시킬 때, 샘플은 4°C에서 수개월까지 저장될 수 있다.
7. 단백질 배양
참고 : 세포 배양을 위해 갓 단백질 배양 된 기질을 사용하는 것이 좋습니다. 프로토콜 중 이 부분만 진행하여 셀 시딩(단계 8)이 바로 이후에 수행되는 경우에만 진행한다.
- 패터닝된 세포 배양 칩을 배양 캐비닛 내의 멸균 PDMS 용기로 옮긴다.
- 패터닝된 세포 배양 칩을 3x 과량의 멸균 PBS로 세척하고 패터닝이 멸균 조건 하에서 수행되지 않은 경우 세척하였다.
- PBS에 신선한 단백질 용액을 준비한다.
- 피브로넥틴: 마이크로피펫을 사용하여 PBS 2mL를 로다민 표지된 피브로넥틴 20μg의 바이알에 첨가하여 10μg/mL의 농도를 얻었다. 단백질 덩어리의 형성을 피하고 빛으로부터 보호하기 위해 부드럽게 피펫하십시오.
- 젤라틴: 용해된 젤라틴-플루오레세인의 200 μL 분취량을 해동시킨다. 빛으로부터 보호하십시오.
- 200-500 μL의 단백질 용액을 마이크로피펫을 사용하여 세포 배양 칩에 첨가한다. 선택한 단백질에 따라 배양 시간 및 온도를 조정하십시오 : 피브로넥틴 : 실온에서 5 분, 젤라틴 : 37 °C에서 15 분. 샘플을 덮으십시오 (예 : 알루미늄 호일 사용).
- 단백질 용액을 제거하고 5x 멸균 PBS로 500 μL로 세척하였다. PBS를 세포 배양 칩의 모든 관련 기능 위에 여러 번 위아래로 피펫팅하여 결합되지 않은 단백질을 제거해야 한다.
참고: 세척 단계 중에는 시료가 마르지 않는 것이 중요합니다. 세척 중에 단백질 용액 또는 PBS를 제거할 때, 단백질 덩어리가 형성되는 것을 방지하기 위해 즉시 새로운 PBS를 첨가한다( 도 4 참조). 볼록한 특징은 기판 표면 위로 상승하기 때문에 건조에 특히 민감합니다. - 선택 사항: 형광 현미경으로 단백질 패턴을 검토합니다. 샘플을 멸균 상태로 유지하고 PBS에 침지시킨다.
8. 세포 파종
참고: 이 프로토콜은 인간 원발성 각질세포와 인간 진피 섬유아세포를 사용합니다. 각질세포는 물질의 이차 사용에 대한 네덜란드 지침에 따라 환자로부터 인간 각막 조직으로부터 수확되었으며, 이전에는 각질세포47로 특성화되었다. 이들 세포는 5% 소 태아 혈청(FBS), 1% 페니실린/스트렙토마이신(P/S) 및 1 mM L-아스코르빈산 2-포스페이트 세스퀴마그네슘염 수화물(비타민 C)이 보충된 DMEM에서 37°C에서 최대 4개의 계대 동안 배양된다. 인간 진피 섬유아세포를 구입하고 최대 15계대 동안 37°C에서 10% FBS 및 1% P/S가 보충된 DMEM에서 배양하였다. 광패턴화된 세포 배양 칩 상에 각질세포와 진피 섬유아세포 둘 다의 시딩을 위해, 칩 당 20,000개의 세포가 사용되었다.
- 관심있는 세포를 분리하고(예를 들어, 트립신 사용) 칩당 배지에 ± 10,000-50,000 cells/mL의 세포 현탁액 1mL를 준비한다. 셀 크기와 원하는 판독값에 따라 기질당 추가된 정확한 셀 수를 조정합니다.
- 세포 배양 칩으로부터 PBS를 제거하고 세포 현탁액 1 mL를 첨가한다.
- 세포와 함께 세포 배양 칩을 인큐베이터로 부드럽게 수송하고 37°C에서 60분 동안 인큐베이션한다.
- 패터닝된 세포 배양 칩 상의 세포의 부착을 브라이트필드 현미경으로 확인하였다. 선 패턴의 경우 길쭉한 세포 형태를 찾습니다( 그림 5 참조). 세포가 또한 패턴화된 영역 밖에서 부착되기 시작하면, 기질 상의 세포 바로 위에 배지를 위아래로 피펫팅하여 이들을 제거한다.
참고: 패턴화된 영역에 부착된 셀은 연결된 상태로 유지되고 패턴화된 영역 외부의 셀은 분리됩니다. - PDMS 용기에서 세포 배양 칩을 제거하고 멸균 핀셋을 사용하여 ~5 mL의 배양 배지로 채워진 6-웰 플레이트에 넣는다.
- 원하는 시간 동안 세포를 배양한다. 세포 배양액을 2-3일마다 교체한다. 세포 배양 후 단백질 패턴의 시각화를 보장하려면 배양 중에 빛에 대한 샘플의 노출량을 줄이십시오.
9. 염색, 이미지 획득 및 분석
- 고정 및 염색
- 원하는 배양 길이 후에, 거의 모든 배지를 제거하고 과량의 PBS로 세 번 세척하였다. 다음에, 실온에서 15분 동안 3.7% 포르말린과 함께 인큐베이션하고, 실온에서 세척당 5분 동안 PBS로 3개의 세척 단계를 거친다. 샘플이 마르지 않도록하십시오.
주의: 포르말린은 삼키거나 흡입할 경우(H302, H332), 알레르기성 피부 반응을 일으킬 수 있고(H317), 유전적 결함(H341)을 일으키는 것으로 의심되며, 암을 유발할 수 있습니다(H350). 개인 보호 장비를 착용하고 흄 후드에서 작업하십시오. - 세포 배양 기질을 원하는 염색제 또는 항체로 염색한다. 염색제의 부피를 줄이려면 세포 배양 칩을 유리 슬라이드에 파이프 된 염색 용액 방울에 거꾸로 놓습니다.
- 샘플을 PBS(단기)에 보관하거나 4°C에서 장착 매체(장기)를 사용하여 커버슬립에 부착한다.
- 원하는 배양 길이 후에, 거의 모든 배지를 제거하고 과량의 PBS로 세 번 세척하였다. 다음에, 실온에서 15분 동안 3.7% 포르말린과 함께 인큐베이션하고, 실온에서 세척당 5분 동안 PBS로 3개의 세척 단계를 거친다. 샘플이 마르지 않도록하십시오.
- 이미지 수집
- 염색된 샘플을 유리 슬라이드 상의 PBS 액적에 거꾸로 놓는다. 샘플을 공초점 현미경의 단계에 넣는다.
- 필요한 디테일 레벨에 따라 적절한 목표(10x, 20x 또는 40x) 및 Z 간격으로 Z-스택을 만들어 적절한 이미지 수집을 보장합니다.
- 이미지 분석 및 시각화
- 이미지 분석 소프트웨어에서 원시 이미지 파일을 열고 이미지 속성(예: 치수, 해상도)이 올바른지 확인합니다.
- 필요한 경우 채널당 밝기와 대비를 조정합니다.
- 패턴과 셀을 포함하는 관심 영역을 자릅니다.
- 선택 사항: 필요한 경우 디컨볼루션 단계를 수행합니다.
- 3D 렌더링 소프트웨어를 사용하여 Z 스택의 3D 렌더링을 만듭니다.
- 각 개별 채널의 대비 및 게인 설정을 최적화합니다.
- 3D 렌더링의 이미지를 만들려면 스냅숏을 만들고 로 내보냅니다. TIFF 파일.
- 3D 렌더링의 동영상을 만들려면 동영상을 등록하기 전에 시작 프레임과 마지막 프레임, 시간대를 설정합니다. .avi로 내보냅니다.
결과
설명된 프로토콜에 의해, 3D PDMS 세포 배양 기판은 UV-광패터닝되어 세포 부착에 적합한 정밀하고 높은 처리량의 접착 영역을 생성할 수 있다. 이러한 방식으로, 세포는 관련 기질 기하학적 및 접착 리간드 패턴을 동시에 받게 된다. 배향, 세포 영역 및 초점 부착의 수와 같은 세포 특성은 복잡한 생체 유사 환경에서 세포 거동을 더 잘 이해하기 위해 쉽게 모니터링하고 사용할 수 있습니다.
3D PDMS 기판 상의 패터닝 이벤트를 검증하기 위해, 프로토콜의 상이한 단계에서 물질의 원자 표면 조성은 원자 X선 광전자 분광법(XPS)48을 사용하여 측정되었다. 요약하면, XPS 측정은 패시베이션 샘플에서 증가된 탄소 신호와 함께 PEG 사슬의 존재를 보여주었고, 이는 광패터닝 후에 감소되었다. 피브로넥틴을 사용한 인큐베이션은 탄소 신호의 증가를 가져왔고, 이는 다시 세포 배양 칩의 표면에서의 성공적인 단백질 부착을 나타낸다. 다음으로, 3D 피쳐에 대한 패턴 분해능 및 정렬은 다양한 원형 패턴화된, 오목한 구덩이 상에서 특성화되었다(ĸ = 1/250 μm-1, ĸ = 1/1,000 μm-1, 및 ĸ = 1/3,750 μm-1, 도 6 참조). 최대 강도 예측으로부터, 단백질 패턴이 세 가지 3D 특징 모두에서 성공적으로 패턴화되었다고 결론 지을 수 있습니다. 그림 6A의 강도 프로파일은 패턴화된 영역과 패턴화되지 않은 영역 사이의 날카로운 전환과 함께 높은 패턴 분해능을 보여줍니다. 추가적으로, 구덩이 내의 완전한 패턴을 가로질러 일관된 단백질 강도가 얻어졌다.
ĸ = 1/250 μm-1인 오목한 구덩이는 단일 초점면 방법(1개의 패턴)을 사용하여 패터닝된 반면, ĸ = 1/1,000 μm-1 및 ĸ = 1/3,750 μm-1인 구덩이는 각각 2개와 3개의 초점면(패턴)을 사용하여 패터닝되었다. 그림 6의 최대 강도 투영에서 볼 수 있듯이 두 방법 모두 피쳐 위에 있는 패턴의 완벽한 정렬을 초래합니다. 두 개의 서로 다른 초점면과 패턴 사이에 잘못 정렬된 전환은 관찰할 수 없습니다.
설명된 프로토콜을 사용하여, 광범위한 단백질 패턴 설계가 다양한 형상에 적용될 수 있다( 도 7 및 비디오 1 참조). 이 방법의 다양성을 설명하기 위해 반실린더 (볼록하고 오목함), 안장 표면 및 구덩이는 다양한 너비의 선과 원을 사용하여 패턴화되었습니다. 광패턴화된 물질은 후속적으로 세포 배양에 사용될 수 있다(도 7, 도 8, 비디오 2, 비디오 3 및 비디오 4 참조). 오목한 세미실린더(피브로넥틴 라인, 적색, 5 μm 폭, 및 5 μm 갭) 상에서 배양된 진피 섬유아세포의 예가 도 8, 도 9, 및 비디오 4에 도시되어 있다. 실험 동안, 세포는 다중 큐 세포 배양 기질을 감지하고 부착하며 시간이 지남에 따라 생존 가능한 상태를 유지한다. 도 8의 면역형광 염색에서 알 수 있는 바와 같이, 세포는 주로 피브로넥틴 라인 상에서 초점 부착(빈큘린 클러스터)을 형성한다.
이러한 세포 배양 물질을 사용하는 또 다른 예시적인 연구는 최근 우리 그룹48에 의해 출판되었다. 본 연구에서, 인간 근섬유아세포와 내피 세포는 접촉 안내 단서와 기하학적 지형의 조합을 실시하였다. 생체 내에서, 두 유형의 세포 모두 인간 혈관 구조에서와 같은 천연 조직에서 곡률 및 접촉 유도 신호를 경험합니다. 세포를 두 가지 환경 단서가 결합된 환경에 시험관 내에서 적용함으로써, 생체내 상황을 되짚어볼 수 있고, 세포 거동에 대한 미세환경의 역할에 대한 더 깊은 이해를 제공한다. 인간 근섬유아세포는 오목한 원통형 기질(48) 상의 접촉 안내 단서(평행 피브로넥틴 라인)와 정렬하는 것으로 나타났다. 그러나 곡률이 증가하는 볼록한 구조에서는 기하학적 단서가 생화학 적 단서를 무시하여 근섬유아세포가 곡률의 정도와 기호를 모두 감지 할 수 있음을 시사합니다. 흥미롭게도, 내피 세포는 오목한 다중 큐 기질에만 부착 할 수 있었고 볼록한 PDMS 기질에는 부착 할 수 없었습니다. 오목한, 단백질-패턴화된 기질 상에서, 내피 세포는 접촉 안내 큐의 방향으로 배향된다. 이 기본적인 시험관 내 지식은 혈관 조직 공학 분야에서 생리적 관련성을 가지며 궁극적으로 스마트 조직 공학 구축물의 설계에 도움이 될 수 있습니다.
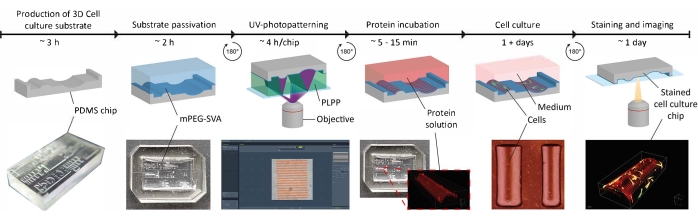
그림 1: 3D 세포 배양 기질에 접촉 유도 신호를 적용하는 실험 타임라인. 먼저, 양성 세포 배양 칩은 다양한 기하학적 구조를 함유하는 네거티브 PDMS 주형으로부터 생산된다. 경화되지 않은 PDMS를 주형에 붓고 65°C에서 3시간 동안 경화시킨다. 이어서, PDMS를O2-플라즈마로 처리하고, 세포 배양 기질의 표면을 부동태화시키기 위해 PLL 및 mPEG-SVA (파란색, 표지된)와 함께 인큐베이션한다. 세척 후, 기판은 광개시제 액적(PLPP, 녹색, 라벨링됨)에서 거꾸로 뒤집히고 LIMAP 접근법을 사용하여 UV-포토패터닝된다. 여기서, 사용자 정의 패턴을 갖는 디지털 마스크는 정의된 위치에서 패시베이션 층을 절단하는데 사용된다. 다음으로, 단백질 용액 (적색, 라벨링)이 인큐베이션 될 수 있고 패시베이션 층이 제거 된 위치에만 부착됩니다. 기질에 시딩된 세포는 기하학적 구조와 단백질 패턴 모두를 겪게 되며, 이는 생체 내 모방 환경에서 복잡한 세포 거동 에 대한 연구를 가능하게 한다. 약어: PDMS = 폴리디메틸실록산; mPEG-SVA = 메톡시폴리에틸렌 글리콜-숙신이미딜 발레레이트; PLPP = 4-벤조일벤질트리메틸암모늄 클로라이드; LIMAP = 단백질의 광유도 분자 흡착. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 3D 세포 배양 기질의 생산 및 패시베이션 동안의 상이한 단계. 네거티브 유리 몰드 (1)는 컴퓨터 지원 설계 소프트웨어로 설계되었으며 펨토 초 레이저 직접 쓰기 기술을 사용하여 생산됩니다. 이 주형은 중간 양성 PDMS 칩 (2) 및 네거티브 PDMS 몰드 (3)를 생산하는데 이용되며, 이는 이어서 최종 세포 배양 칩 (4)을 생산하는데 사용된다. 약어: PDMS = 폴리디메틸실록산. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 두 패터닝 방법의 개략적인 그림. 왼쪽: UV-포토패터닝은 단일 초점면과 패턴을 사용하여 더 작은 피처(약 하나의 DMD)에서 수행됩니다. 결과적으로 전체 기능은 한 번에 패턴화됩니다. 오른쪽: 더 큰 피쳐가 사용되는 경우(DMD보다 큼) 패터닝이 여러 초점면과 패턴으로 나뉩니다. 약어 : DMD = 디지털 미러 장치. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
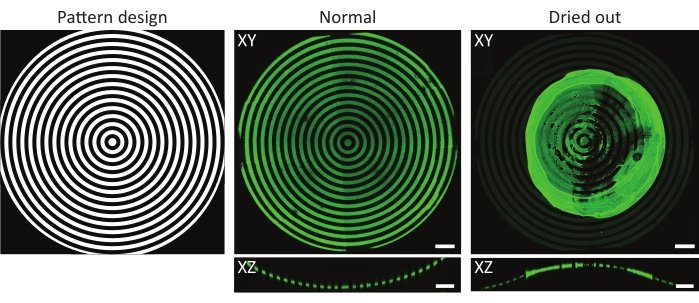
도 4: 정상 및 건조된 단백질-인큐베이션된 기질의 전형적인 예. 정상 및 건조된 단백질-인큐베이션된 기질의 최대 강도 투사(XY) 및 직교 뷰(XZ). 단백질 용액으로 인큐베이션한 후 패턴화된 세포 배양 기질을 세척할 때, 샘플을 항상 젖은 상태로 유지하는 것이 중요하다. 패턴이 특징 상의 모든 이미지에서 동일하지만(ĸ=1/1,000 μm-1), 젤라틴-플루오레세인(녹색) 응집체는 샘플을 몇 초 동안 건조시키도록 방치했을 때 큰 덩어리를 형성한다. 샘플이 항상 젖은 상태로 유지되면 올바른 단백질 패턴을 관찰 할 수 있습니다. 배율 막대 = 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 시드 후 밝은 필드 이미지. 1차 각질세포(왼쪽) 및 진피 섬유아세포(오른쪽)를 3D 기하학적 특징(ĸ = 1/1,000 μm-1의 오목한 구덩이 및 ĸ=1 /500, 1/375, 1/250, 1/175 및 1/125 μm-1의 반실린더)에 시딩한 후 4시간 동안 시딩하였다. 왼쪽 위 삽입은 지오메트리의 패터닝에 사용되는 선 패턴을 나타냅니다. 흰색 화살표는 이미 정렬을 보여주는 확산 세포를 나타냅니다. 배율 막대 = 250μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
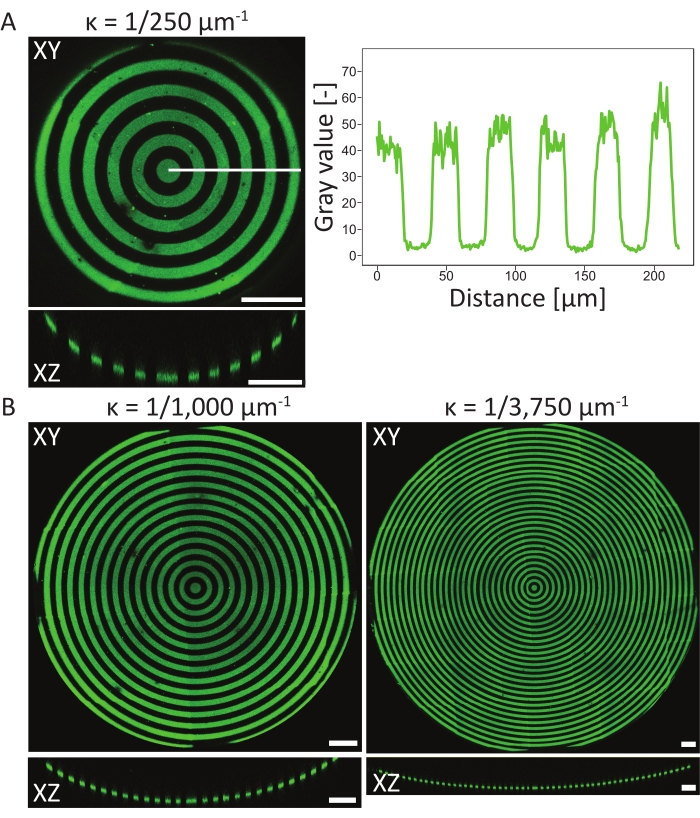
그림 6: 오목한 구덩이에서의 원형 패턴의 특성화. (A) LIMAP(선폭: 20μm, 간격폭: 20μm)을 사용하여 패턴화하고 젤라틴-플루오레세인(녹색)과 함께 인큐베이션한 오목한 구덩이(ĸ = 1/250 μm-1)의 최대 강도 투영(XY) 및 직교도(XZ)를 포함한다. 흰색 선을 따른 강도 프로파일은 거리에 대해 플롯되어 일관된 패턴 품질과 해상도를 보여줍니다. (B) ĸ = 1/1,000 μm-1 및 ĸ = 1/3750 μm-1의 오목한 구덩이에서 수행된 추가 패터닝은 패터닝에 사용될 수 있는 기하학적 특징의 측면에서 유연성을 보여준다. 다시 말하지만, 최대 강도 투영(XY)과 직교 뷰(XZ)가 모두 시각화됩니다. 배율 막대 = 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
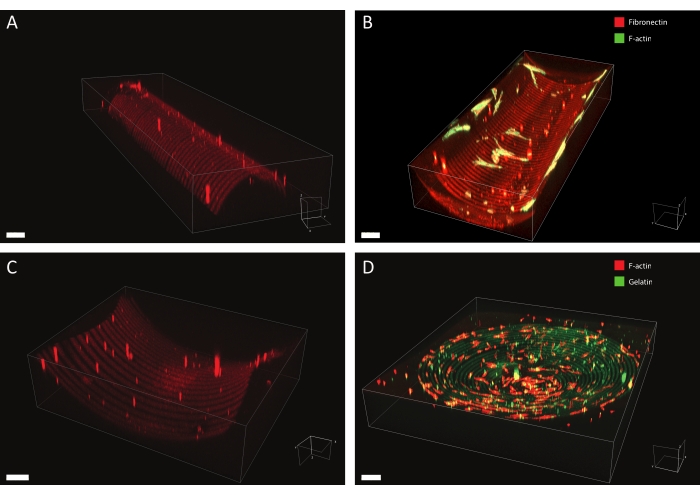
그림 7: 패턴화된 구조물의 3D 현미경 데이터. 3D 렌더링 소프트웨어를 사용하여 시각화된 광패터닝 및 세포 배양 후 3D 패턴화된 세포 배양 물질의 전형적인 예. (A) 10 μm 폭 라인(로다민-피브로넥틴, 적색) 및 10 μm 폭 틈새로 패턴화된 볼록 세미실린더. 스케일 바 = 5 μm. (B) F-액틴(녹색)에 대해 염색된 진피 섬유아세포는 20 μm 넓은 라인(로다민-피브로넥틴, 적색) 및 20 μm 넓은 틈새로 패턴화된 오목한 세미실린더 상에서 배양하였다. 스케일 바 = 5 μm. (C) 20 μm 와이드 라인(로다민-피브로넥틴, 레드) 및 20 μm 와이드 갭으로 패턴화된 안장 표면. 스케일 바 = 5 μm. (D) 20 μm 폭 라인(젤라틴-플루오레세인, 녹색)과 20 μm 폭 간격의 동심원으로 패턴화된 오목한 구덩이. 인간 각질세포의 F-액틴 세포 골격은 팔로이드인을 사용하여 염색되고 적색으로 가시화된다. 배율 막대 = 200μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 8: 광패턴화된, 오목한 반실린더 상의 인간 진피 섬유아세포의 면역형광 염색. (A) 오목한 반실린더 상에서 24시간 동안 배양된 인간 진피 섬유아세포의 최대 강도 돌기(XY) 및 직교 절편(XZ 및 YZ)을 패턴화된(피브로넥틴 라인, 적색, 5 μm 폭, 및 5 μm 갭) 상에서 배양하였다. 세포는 F-액틴 (자홍색), 빈큘린 (녹색) 및 핵 (파란색)에 대해 염색됩니다. 스케일 바 = 100 μm. (B) 멀티큐 환경에 부착되는 셀의 줌인. 배율 막대 = 50μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 9: 패턴화된 오목한 실린더 상의 인간 진피 섬유아세포의 브라이트필드 타임랩스 이미지. 오목한 반실린더 (ĸ = 1/250 μm-1)를 평행선 (5 μm 폭 및 5 μm 갭)으로 패터닝하고, 세포 시딩 전에 로다민-피브로넥틴과 함께 인큐베이션하였다. 타임랩스 이미징은 초기 세포 시딩 후 1시간 후(왼쪽, 0분) 시작되며, 세포가 여전히 둥글고 부착되지 않은 경우(화살표). 대략 24 h (중간, 1,420 분) 후에, 세포는 멀티큐 기판에 부착되고 접촉 안내 패턴에 따라 정렬 반응을 나타낸다. 정렬 반응 및 세포 생존력 모두는 전체 배양 기간 (오른쪽, 3,180 분)에 걸쳐 유지된다. 배율 막대 = 200μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
비디오 1: 3D 원통형 기판의 패턴 예제. 로다민-피브로넥틴(적색)으로 패턴화된 볼록한 실린더의 3D 표현. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
비디오 2: 패턴화된 3D 원통형 기질 상에서 배양된 진피 섬유아세포의 3D 표현 (ĸ = 1/500 μm-1). 진피 섬유아세포를 볼록한 반실린더(피브로넥틴 라인, 적색, 10 μm 폭, 및 10 μm 갭) 상에서 24시간 동안 배양하였다. 세포는 F-액틴 (자홍색), 빈큘린 (녹색) 및 핵 (파란색)에 대해 염색됩니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
비디오 3: 패턴화된 3D 피트 상에서 배양된 인간 각질세포의 3D 표현 (ĸ = 1/3,750 μm-1). 오목하고 패턴화된 구덩이(젤라틴 원, 녹색, 20μm 폭, 및 20μm 갭)에서 24시간 동안 배양된 인간 각질세포의 3D 표현. 세포는 F-액틴(적색)에 대해 염색된다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
비디오 4 : 패턴화되고 오목한 실린더에서 인간 진피 섬유 아세포의 브라이트 필드 타임랩스 이미징. 오목한 반실린더 (ĸ = 1/250 μm-1)를 평행선 (5 μm 폭 및 5 μm 갭)으로 패터닝하고, 세포 시딩 전에 로다민-피브로넥틴과 함께 인큐베이션하였다. 타임랩스 이미징은 초기 세포 시딩 후 1시간 후에 시작되며, 이때 세포는 멀티큐 환경에 대한 초기 부착을 보인다. 완전한 타임랩스 동안, 세포는 주로 접촉 안내 단서를 따라 방향을 잡는 반면, 세포 생존력은 유지된다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
요즘, 세포 거동은 종종 네이티브 세포 미세 환경의 복잡성이 부족한 평평한 배양 기질에서 연구됩니다. 스캐폴드 및 하이드로젤과 같은 3D 환경이 대안으로 사용됩니다. 이러한 세포 배양 환경이 생체 내 관련성을 개선하지만, 세포 거동에 대한 체계적인 연구와 판독 방법의 타당성 모두 여전히 도전적입니다. 대표적인 배양 기질 상에서 세포 거동을 체계적으로 조사하기 위해서는 현미경 판독을 허용하는 일관된 멀티큐 기질이 필요하다. 따라서, 이 프로토콜에서, 우리는 생리학적으로 관련된 기하학적 및 패턴화된 ECM 단백질로 다큐 세포 배양 기질을 만드는 방법을 기술한다. 시험관 내 플랫폼에서 조직 기하학 및 접촉 안내 단서와 같은 환경 신호를 결합하는 데있어 주요 과제는 주로 기술적 인 성격입니다. 접촉-유도 큐(예를 들어, 소프트 리소그래피, 딥-UV 패터닝, 및 마이크로컨택트 프린팅(35,36))를 세포 배양 재료에 적용하기 위한 종래의 방법들은 평면 기판에 대해 최적화되었다. 접촉 안내 단서와 결합 된 3D 세포 배양 재료의 필요성은 불량한 패턴 정렬, 해상도 및 유연성과 같은 몇 가지 기술적 과제를 강조했습니다. 이러한 과제를 극복하기 위해 고처리량, 마스크리스, 광 기반 패터닝 방법45,49를 사용할 수 있습니다. 여기서 광학 현미경은 마이크로미터 단위로 정밀한 패턴 정렬과 분해능을 가능하게 합니다(그림 6 참조). 또한 디지털 마스크를 사용하면 연구원이 노동 집약적 인 물리적 마스크를 제작할 필요없이 광범위한 패턴에서 세포 행동을 연구 할 수 있습니다.
UV-광패터닝 접근법은 다양한 재료(48)로부터 생성된 다양한 3D 형상(예를 들어, 실린더, 안장, 돔, 구덩이)과 조합하여 사용될 수 있다. 본 연구에 사용된 3D 세포 배양 기질은 PDMS로부터 제조된다; 그러나 다른 재료도 사용할 수 있습니다. 이는 관심있는 특징을 포함하는 최종 세포 배양 기질을 생산하기 위해 상이한 단계들을 필요로 할 수 있다. 세포는 세포 배양 물질의 표면 거칠기에 민감한 것으로 나타났기 때문에, 관찰된 세포의 반응이 3D 기하학적 구조 및 접촉 유도 단서(50,51)에 완전히 기인할 수 있도록 매끄러운 표면을 갖는 세포 배양 칩을 만드는 것이 중요하다. 광학 프로파일 로메트리, 주사 전자 현미경 또는 원자력 현미경과 같은 측정 방법을 사용하여 표면 거칠기를 측정 할 수 있습니다. 세포 배양 물질의 제조 후, 관심있는 특징의 특정 치수에 의존하는 하나 또는 다수의 초점면에 기초한 패터닝 방법을 선택할 수 있다(도 3 참조). 전형적으로, 단일 초점면은 대략 50μm의 Z 범위 내의 영역을 패턴화하는데 사용된다. 패턴 해상도는 이 엄지 손가락 규칙을 사용하여 일관되게 표시되었습니다(그림 6 참조). 그러나이 방법의 단점은 여러 초점면과 패턴의 도입으로 패터닝 시간이 증가한다는 것입니다. 여러 초점면을 사용하여 최대 16mm x 16mm x 0.17mm(X x Y x Z)의 3D 기하학적 기능이 높은 패턴 품질로 성공적으로 패터닝되었습니다.
추가적으로, 이 프로토콜과 조합하여 사용될 수 있는 기하학적 특징들의 높이(Z축)가 제한된다는 것을 언급하는 것이 중요하다. UV-photopatterning과 많은 세포 판독 모두 현미경 설정에 의존하기 때문에 목표의 작동 거리에 따라 피쳐의 최대 높이가 결정됩니다. 우리 손에는 높이가 300μm를 초과하는 형상이 여전히 UV 광패턴화 될 수 있으며 판독은 40x 목표의 공초점 현미경을 사용하여 수행되었습니다. 따라서, 세포내 및 조직 스케일에 이르는 메카노생물학적 연구는 기술된 프로토콜을 사용하여 가능하다.
고려될 필요가 있는 또 다른 인자는 UV-광패터닝(49) 동안 또는 그 이후에 샘플이 건조될 위험이다. 이것은 볼록함이 종종 세포 배양 재료 외부에 노출되기 때문에 3D 지오메트리를 사용할 때 특히 관련이 있습니다. 그림 4에 나타난 바와 같이, 이것은 관심있는 특징의 상부에 단백질 응집체가 형성되는 고르지 않은 패턴을 초래할 수 있다. 단백질 배양 후 및 세포 배양 중 세포 배양 칩의 세척은 3D 형상의 적절한 코팅을 위해 매우 중요합니다. 따라서 항상 세포 배양 칩의 상부에 소량의 작업 용액 (PBS, PLPP, 단백질 용액, 세포 배양 배지)을 남겨 두는 것이 좋습니다.
지금까지, 몇몇 단백질 코팅 (피브로넥틴, 콜라겐 유형 I 및 IV, 젤라틴, FNC) 및 세포 유형 (인간 골수 기질 세포, 인간 근섬유아세포, 인간 내피 세포, 인간 각질세포, 및 진피 섬유아세포)이 구조화된 세포 배양 물질 상에 기술된 광패터닝 접근법과 조합하여 사용되어 왔다. 이전 연구(48)에서 보여진 바와 같이, 단백질 인큐베이션 파라미터의 최적화는 새로운 세포 유형에서의 체계적인 조사를 위한 핵심이다. 따라서 새로운 단백질 또는 세포에 대한 새로운 실험을 수행하기 전에 다양한 단백질 농도, 배양 온도 및 배양 시간을 테스트하는 것이 좋습니다. 동질적이고 패턴화된 평평한 영역에 대한 초기 부착 후의 세포 형태학을 '정상적인' 세포 배양 조건 하에서의 세포 형태학과 비교함으로써, 최적화된 실험 파라미터 세트를 얻을 수 있다. 또한 각 세포 유형은 특정 멀티큐 환경에서 인식 가능한 접착 형태를 표시하기 위해 시드 후 다른 시간이 필요할 수 있습니다( 그림 5 참조). 이를 위해, 단계 8.4에서 세척 동안 패턴화된 영역 상에 접촉 이벤트를 제시하기 위해 세포 유형당 필요한 시간을 최적화하는 것이 중요하다. 예를 들어, 우리는 라인 패턴에서 인간 각질 세포가 시딩 후 처음 30 분 이내에 길쭉한 형태를 보이는 반면, 내피 세포와 진피 섬유 아세포는 접착 형태학의 변화를 나타내기 전에 여러 시간이 필요하다는 것을 관찰했습니다. 따라서 단백질 배양(단계 7) 및 세포 시딩(단계 8)에 필요한 실험 파라미터는 선택한 단백질 및 세포 유형에 따라 달라질 수 있다.
3D 형상에 접촉 안내 신호를 적용하기 위해 제시된 접근 방식은 복잡한 다중 큐 환경에서 셀 거동에 대한 더 깊은 이해를 창출하는 데 도움이 될 수 있습니다. 여기에는 초점 부착 및 핵과 같은 세포 내 구성 요소에 대한 조사가 포함될 수 있으며 제안 된 방법을 사용하여 더 큰, 세포 또는 조직 규모에서 수행되는 실험도 포함될 수 있습니다. 결국, 얻은 지식은 복잡한 세포 환경이 원하는 결과를 향해 세포 행동을 유도하도록 설계된 조직 공학 응용 프로그램의 설계에 사용될 수 있다고 예상됩니다.
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
인간의 원발성 각화세포를 제공해주신 Nello Formisano 박사(MERLN Institute for Technology-Inspired Regenerative Medicine)에게 감사드립니다. 이 작업은 Chemelot InSciTe (프로젝트 BM3.02)의 지원을 받았습니다. 유럽 연구위원회 (보조금 851960); 중력 프로그램을위한 교육, 문화 과학부 024.003.013 "재료 주도 재생". 저자는 Alvéole에게 서신, 도움 및 문제 해결에 대해 감사하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| Anti-vinculin antibody, mouse monoclonal IgG1 | Sigma | V9131 | Dilution: 1/600 |
| Bovine Serum albumin, Fraction V | Roche | 10735086001 | |
| DMEM, high glucose, pyruvate | Gibco | 41966029 | |
| DMEM/F-12 + GlutaMAX (1x) | Gibco | 10565018 | |
| DMi8 epifluorescent microscope | Leica Microsystems | ||
| Ethanol | Biosolve | 0005250210BS | |
| Fetal Bovine Serum | Serana | 758093 | |
| Fiji/ImageJ, version v1.53k | www.imageJ.nih.gov | ||
| Fluorescent highlighter | Stabilo | 4006381333627 | |
| Fluorescin-labeled gelatin | Invitrogen | G13187 | Concentration: 0.01% |
| Formaldehyde solution | Merck | F8775 | |
| Glass coverslips 24 x 60 mm, #1 | VWR | 631-1575 | |
| Glass coverslips, ø = 32 mm, #1 | Menzel-Gläser | ||
| HCX PL fluotar L 20X/0.40na microscope objective | Leica | 11506242 | |
| HEPES | Gibco | 15630080 | |
| Human dermal fibroblasts | Lonza | CC-2511 | |
| Human primary keratocytes | MERLN Institute for Technology-Inspired Regenerative Medicine | ||
| Illustrator, Version 26.0.1 | Adobe | ||
| Laboratory oven | Carbolite | ||
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960 | |
| Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Leonardo software, version 4.16 | Alvéole | ||
| Micro-manager, version 1.4.23 | Open imaging | ||
| Mowiol 4-88 | Sigma-Aldrich | 81381 | mounting medium |
| mPEG-succinimidyl valerate MW 5,000 Da | Laysan Bio | MPEG-SVA-5000 | Concentration: 50 mg/mL |
| Negative glass mold | FEMTOprint | ||
| NucBlue Live Readyprobes Reagent (Hoechst 33342) | Invitrogen | R37605 | 2 drops/mL |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140163 | |
| Petri dish (ø=100 mm) | Greiner Bio-one | 664160 | |
| Phalloidin Atto 647N | Sigma | 65906 | Dilution: 1/250 |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Plasma asher | Emitech | K1050X | |
| PLPP (photoinitiator) | Alvéole | ||
| Poly-L-lysine, sterile-filtered | Sigma-Aldrich | P4707 | Concentration: 0.01% |
| PRIMO | Alvéole | ||
| Rhodamine-labeled fibronectin | Cytoskeletn, Inc. | FNR01 | Concentration: 10 µg/mL |
| Secondary antibody with Alexa 488, Goat anti-mouse IgG1 (H) | Molecular Probes | A21121 | Dilution: 1/300 |
| Secondary antibody with Alexa 555, Goat anti-mouse IgG1 (H) | Molecular Probes | A21127 | Dilution: 1/300 |
| Spin coater | Leurell Technologies Corporation | model WS-650MZ-23NPPB | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 1673921 | |
| TCS SP8X confocal microscope | Leica Microsystems | ||
| tridecafluoro(1,1,2,2-tetrahydrooctyl)trichlorosilane | ABCR | AB111444 | |
| TrypLE Express Enzyme (1x), no phenol red | Gibco | 12604013 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 |
참고문헌
- Wang, Y., Wang, G., Luo, X., Qiu, J., Tang, C. Substrate stiffness regulates the proliferation, migration, and differentiation of epidermal cells. Burns. 38, 414-420 (2012).
- Viswanathan, P., et al. 3D surface topology guides stem cell adhesion and differentiation. Biomaterials. 52, 140-147 (2015).
- Peyton, S. R., et al. Marrow-derived stem cell motility in 3D synthetic scaffold is governed by geometry along with adhesivity and stiffness. Biotechnology and Bioengineering. 108 (5), 1181-1193 (2011).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nature Reviews Molecular Cell Biology. 18 (12), 728-742 (2017).
- Chaudhuri, O., Cooper-White, J., Janmey, P. A., Mooney, D. J., Shenoy, V. B. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584, 535-546 (2020).
- Guido, S., Tranquillo, R. T. A methodology for the systematic and quantitative study of cell contact guidance in oriented collagen gels. Correlation of fibroblast orientation and gel birefringence. Journal of Cell Science. 105 (2), 317-331 (1993).
- Teixeira, A. I., Abrams, G. A., Bertics, P. J., Murphy, C. J., Nealey, P. F. Epithelial contact guidance on well-defined micro- and nanostructured substrates. Journal of Cell Science. 116, 1881-1892 (2003).
- Driscoll, M. K., Sun, X., Guven, C., Fourkas, J. T., Losert, W. Cellular contact guidance through dynamic sensing of nanotopography. ACS Nano. 8 (4), 3546-3555 (2014).
- Buskermolen, A. B. C., et al. Cellular contact guidance emerges from gap avoidance. Cell Reports Physical Science. 1 (5), 100055 (2020).
- Thrivikraman, G., et al. Cell contact guidance via sensing anisotropy of network mechanical resistance. Proceedings of the National Academy of Sciences of the United States of America. 118 (29), 1-11 (2021).
- Buskermolen, A. B. C., et al. Entropic forces drive cellular contact guidance. Biophysical Journal. 116 (10), 1994-2008 (2019).
- Vignaud, T., et al. Reprogramming cell shape with laser nano-patterning. Journal of Cell Science. 125 (9), 2134-2140 (2012).
- Pouthas, F., et al. In migrating cells, the Golgi complex and the position of the centrosome depend on geometrical constraints of the substratum. Journal of Cell Science. 121 (14), 2406-2414 (2008).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Théry, M., et al. Anisotropy of cell adhesive microenvironment governs cell internal organization and orientation of polarity. Proceedings of the National Academy of Sciences of the United States of America. 103 (52), 19771-19776 (2006).
- Huang, G., et al. Functional and biomimetic materials for engineering of the three-dimensional cell microenvironment. Chemical Reviews. 117 (20), 12764-12850 (2017).
- Callens, S. J. P., Uyttendaele, R. J. C., Fratila-Apachitei, L. E., Zadpoor, A. A. Substrate curvature as a cue to guide spatiotemporal cell and tissue organization. Biomaterials. 232, 119739 (2020).
- Yilmaz, C. O., Xu, Z. S., Gracias, D. H. Curved and Folded Micropatterns in 3D Cell Culture and Tissue Engineering. Methods in Cell Biology. 121, (2014).
- Silver, F. H., Freeman, J. W., Seehra, G. P. Collagen self-assembly and the development of tendon mechanical properties. Journal of Biomechanics. 36 (10), 1529-1553 (2003).
- Werner, M., Kurniawan, N. A., Bouten, C. V. C. Cellular geometry sensing at different length scales and its implications for scaffold design. Materials. 13 (4), 963 (2020).
- Di Cio, S., Bøggild, T. M. L., Connelly, J., Sutherland, D. S., Gautrot, J. E. Differential integrin expression regulates cell sensing of the matrix nanoscale geometry. Acta Biomaterialia. 50, 280-292 (2017).
- Fioretta, E. S., Simonet, M., Smits, A. I. P. M., Baaijens, F. P. T., Bouten, C. V. C. Differential response of endothelial and endothelial colony forming cells on electrospun scaffolds with distinct microfiber diameters. Biomacromolecules. 15 (3), 821-829 (2014).
- Werner, M., Kurniawan, N. A., Korus, G., Bouten, C. V. C., Petersen, A. Mesoscale substrate curvature overrules nanoscale contact guidance to direct bone marrow stromal cell migration. Journal of The Royal Society Interface. 15 (145), 20180162 (2018).
- Ruprecht, V., et al. How cells respond to environmental cues - insights from bio-functionalized substrates. Journal of Cell Science. 130 (1), 51-61 (2017).
- Bao, M., Xie, J., Huck, W. T. S. Recent advances in engineering the stem cell microniche in 3D. Advanced Science. 5 (1800448), 1-16 (2018).
- Zhan, X. Effect of matrix stiffness and adhesion ligand density on chondrogenic differentiation of mesenchymal stem cells. Journal of Biomedical Materials Research - Part A. 108 (3), 675-683 (2020).
- Jiang, T., et al. Untangling the response of bone tumor cells and bone forming cells to matrix stiffness and adhesion ligand density by means of hydrogels. Biomaterials. 188, 130-143 (2019).
- Choi, J. S., Harley, B. A. C. The combined influence of substrate elasticity and ligand density on the viability and biophysical properties of hematopoietic stem and progenitor cells. Biomaterials. 33, 4460-4468 (2012).
- Rape, A. D., Zibinsky, M., Murthy, N., Kumar, S. A synthetic hydrogel for the high-throughput study of cell-ECM interactions. Nature Communications. 6 (8129), 1-9 (2015).
- Camarero-Espinosa, S., et al. 3D printed dual-porosity scaffolds: the combined effect of stiffness and porosity in the modulation of macrophage polarization. Advanced Healthcare Materials. 11 (2101415), 1-16 (2022).
- Bao, M., et al. Cellular volume and matrix stiffness direct stem cell behavior in a 3D microniche. ACS Applied Materials and Interfaces. 11 (2), 1754-1759 (2019).
- Charest, J. L., Eliason, M. T., García, A. J., King, W. P. Combined microscale mechanical topography and chemical patterns on polymer cell culture substrates. Biomaterials. 27, 2487-2494 (2006).
- Bilem, I., et al. Interplay of Geometric Cues and RGD/BMP-2 crosstalk in directing stem cell fate. ACS Biomaterials Science and Engineering. 3 (10), 2514-2523 (2017).
- Nam, K. -. H., et al. Multiscale cues drive collective cell migration. Scientific Reports. 6, 29749 (2016).
- Alom Ruiz, S., Chen, C. S. Microcontact printing: A tool to pattern. Soft Matter. 3 (2), 168-177 (2007).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Protein Micropatterns. A Direct Printing Protocol Using Deep UVs. Methods in Cell Biology. 97, (2010).
- Kane, R. S., Takayama, S., Ostuni, E., Ingber, D. E., Whitesides, G. M. Patterning proteins and cells using soft lithography. Biomaterials. 20 (23-24), 2363-2376 (1999).
- Azioune, A., Storch, M., Bornens, M., Théry, M., Piel, M. Simple and rapid process for single cell micro-patterning. Lab on a Chip. 9 (11), 1640 (2009).
- Offenhäusser, A., et al. Microcontact printing of proteins for neuronal cell guidance. Soft Matter. 3 (3), 290-298 (2007).
- Ricoult, S. G., Sanati Nezhad, A., Knapp-Mohammady, M., Kennedy, T. E., Juncker, D. Humidified microcontact printing of proteins: universal patterning of proteins on both low and high energy surfaces. Langmuir. 30 (40), 12002-12010 (2014).
- Waterkotte, B., et al. Biofunctional Micropatterning of Thermoformed 3D Substrates. Advanced Functional Materials. 24 (4), 442-450 (2014).
- Lehnert, D., et al. Cell behaviour on micropatterned substrata: Limits of extracellular matrix geometry for spreading and adhesion. Journal of Cell Science. 117 (1), 41-52 (2004).
- Sevcik, E. N., Szymanski, J. M., Jallerat, Q., Feinberg, A. W. Patterning on topography for generation of cell culture substrates with independent nanoscale control of chemical and topographical extracellular matrix cues. Current Protocols in Cell Biology. 75, 1-25 (2017).
- Micropatterning: Surface functionalization. Alvéole Available from: https://www.alveolelab.com/technology/micropatterning-surface-functionalization/ (2022)
- Strale, P. O., et al. Multiprotein printing by light-induced molecular adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- van Gaal, R. C., Miltenburg, R. P. R. S., Kurniawan, N. A., Bouten, C. V. C., Dankers, P. Y. W. Renal epithelial cell responses to supramolecular thermoplastic elastomeric concave and convex structures. Advanced Materials Interfaces. 8 (1), 2001490 (2021).
- Foster, J. W., Gouveia, R. M., Connon, C. J. Low-glucose enhances keratocyte-characteristic phenotype from corneal stromal cells in serum-free conditions. Scientific Reports. 5, 1-16 (2015).
- Van Der Putten, C., et al. Protein micropatterning in 2.5D: an approach to investigate cellular responses in multi-cue environments. ACS Applied Materials and Interfaces. 13 (22), 25589-25598 (2021).
- Melero, C., et al. Light-induced molecular adsorption of proteins using the primo system for micro-patterning to study cell responses to extracellular matrix proteins. Journal of Visualized Experiments. (152), e60092 (2019).
- Hou, Y., et al. Surface roughness gradients reveal topography-specific mechanosensitive responses in human mesenchymal stem cells. Small. 16 (10), 1905422 (2020).
- Bourkoula, A., et al. Roughness threshold for cell attachment and proliferation on plasma micro-nanotextured polymeric surfaces: The case of primary human skin fibroblasts and mouse immortalized 3T3 fibroblasts. Journal of Physics D: Applied Physics. 49 (30), 304002 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유