Method Article
通过三维细胞培养基质的紫外光图案化产生多库细胞微环境
摘要
传统上,细胞培养是在平面底物上进行的,这些底物与 体内细胞的自然环境模仿较差。在这里,我们描述了一种生产具有生理学相关弯曲几何形状和微图案细胞外蛋白的细胞培养底物的方法,从而可以系统地研究这些细胞外线索的细胞传感。
摘要
细胞外基质是细胞功能的重要调节剂。存在于细胞微环境中的环境线索,如配体分布和组织几何形状,已越来越多地被证明在控制细胞表型和行为中起着关键作用。然而,这些环境线索及其对细胞的影响通常使用分离单个线索 的体外 平台单独研究,这种策略严重简化了多个线索的复杂 体内 情况。工程方法对于弥合这一差距特别有用,通过开发实验装置来捕获 体内 微环境的复杂性,同时保持 体外 系统的精确度和可操作性。
本研究重点介绍了一种将基于紫外线(UV)的蛋白质图案化和基于光刻的底物微细加工相结合的方法,它们共同实现了对多库环境中细胞行为的高通量研究。通过无掩模UV光图案化,可以在包含各种明确定义的几何线索的芯片上的三维(3D)细胞培养基质上创建复杂的粘性蛋白质分布。所提出的技术可用于由不同聚合物材料制成的培养基质,并与各种蛋白质的粘合图案区域相结合。通过这种方法,单细胞以及单层可以受到图案化基板呈现的几何线索和接触引导线索的组合。因此,使用芯片材料,蛋白质模式和细胞类型组合的系统研究可以为细胞对多库环境的反应提供基本见解。
引言
在体内,细胞受到各种环境线索的影响,这些线索可能具有源自细胞外基质(ECM)的机械,物理和生化性质。已经确定许多环境线索在细胞行为的调节中起着至关重要的作用,例如增殖,分化和迁移1,2,3,4,5。研究最广泛的现象之一是接触引导,描述粘附介导的细胞沿着细胞外底物上存在的各向异性生化或地形模式排列6,7,8,9,10,11。除了指导细胞的排列外,接触引导线索还被证明会影响其他细胞特性,例如细胞迁移,细胞内蛋白质的组织,细胞形状和细胞命运12,13,14,15。此外,3D细胞环境的几何结构也因其对细胞行为的调节影响而受到认可16,17。在人体中,细胞暴露于一系列弯曲的几何形状,从微尺度胶原纤维,毛细血管和肾小球,到中尺度肺泡和动脉18,19。有趣的是,最近的体外研究表明,细胞可以感知和响应这种物理线索,从纳米到中尺度20,21,22,23。
迄今为止,大多数研究细胞对环境线索反应的研究主要是使用分离单个线索的实验装置进行的。虽然这种方法在理解环境线索的细胞传感背后的基本机制方面取得了巨大进展,但它很难概括同时呈现多个线索的体内环境。为了弥合这一差距,开发培养平台是有用的,这样就可以独立并同时控制多个环境线索。这一概念最近获得了越来越多的关注,其中结合了基体刚度和配体密度26,27,28,29,基底刚度和孔隙率30,基底刚度和3D微细孔体积31,表面形貌和接触引导线索32,33,34和具有中尺度曲率引导线索的纳米级接触引导线索23。然而,以受控和高通量的方式将接触式引导提示与各种3D几何形状相结合仍然具有挑战性。
该研究方案解决了这一挑战,并引入了一种创建细胞培养基质的方法,该方法具有ECM蛋白(接触引导线索)和底物曲率(几何线索)的图案化粘合区域受控组合。这种方法允许在仿生多库环境中以系统和高通量的方式解剖细胞反应。获得的知识可以帮助进一步了解复杂环境中的细胞行为,并可用于设计具有将细胞反应引导到所需结果的特性的指导性材料。
3D 蛋白质光图案化
在细胞培养材料上创建ECM蛋白的粘附区域(接触引导线索)可以使用各种技术完成,例如,通过深紫外(深紫外)图案化或微接触打印35,36。深紫外图案化利用通过聚合物材料上的掩膜投射的紫外光来降解细胞培养基质上特定位置的钝化聚合物。然后将图案化的基质与感兴趣的配体一起孵育,从而产生支持细胞附着和在预定义位置12,37,38上培养的粘合区域。引入蛋白质图案的另一种方法是通过微接触印刷,其中含有所需形状的弹性图章被涂覆所选的蛋白质并压在细胞培养基板上,从而转移蛋白质涂层,细胞可以粘附35,37,39,40.不幸的是,由于这两种技术都依赖于掩模制备和软光刻方法,因此实验既耗时又费力,并且在图案灵活性方面受到限制。此外,深紫外图案化和微接触打印都最适合平面材料,并且在技术上很难(如果不是不可能的话)在3D环境中图案化配体。
为了改进这些常规方法,Waterkotte等人将无掩模光刻、化学气相沉积和热成型相结合,以生成微图案化的3D聚合物基板41。然而,该技术依赖于使用可热成型的聚合物薄膜,并提供低蛋白质模式分辨率(7.5μm),而据报道细胞对小至0.1μm2,42的几何蛋白质模式做出反应。Sevcik等人描述了另一种有希望的方法,即在含有纳米和微米形图的基板上将纳米图案ECM配体43。使用微接触印刷,将ECM蛋白从聚二甲基硅氧烷(PDMS)邮票转移到热响应性聚(N-异丙基丙烯酰胺)(pNIPAM)基板上。随后,pNIPAM网络的热响应特性允许它们将二维(2D)蛋白质图案转移到地形PDMS基板(10-100μm深沟)上,从而控制粘附位点在地形特征上的定位。然而,并非所有可能的微地形图都可以图案化,因为润湿性降低的问题使得图案化更深的地形基板变得更加困难。据报道,深宽长比为2.4的沟渠是成功将图案转移到地形基板43的最终极限。此外,由于需要微接触印刷,不同图案的灵活性和生成的图案的分辨率很差。
本文介绍了一种克服上述瓶颈的方法,并提供了一种灵活且高通量的方法来创建可用于细胞培养的多库底物(见 图1)。曲率范围为 ĸ = 1/2500 至 ĸ = 1/125 μm-1 的生理相关几何形状(圆柱体、圆顶、椭圆形和鞍座表面)在 PDMS 芯片中预先设计并微加工。随后,通过使用分辨率小至1.5 μm44的光图案技术,使用各种数字图案设计在3D几何形状之上创建接触引导线索。为此,PDMS芯片最初被钝化以防止细胞和蛋白质粘附;然后可以通过光引发剂4-苯甲酰基苄基三甲基氯化铵(PLPP)和紫外光暴露45的组合来除去该钝化层。数字掩模旨在指定紫外线照射的位置,从而指定去除钝化层的区域。蛋白质随后可以粘附在这些区域,从而实现细胞附着。由于图案化是使用数字(而不是物理)掩模执行的,因此可以快速创建各种图案,而无需设计和制造其他光掩模的麻烦和成本。此外,可以在底物上图案化各种ECM蛋白(例如I型胶原,明胶和纤连蛋白)。尽管该协议是使用由PDMS制成的细胞培养芯片进行的,但该原理可以应用于感兴趣的任何其他材料46。
研究方案
在该方案中描述的研究中,使用了原发性人角质形成细胞。这项研究是根据《赫尔辛基宣言》的原则进行的。原发性角质形成细胞是从Descemet膜内皮角膜成形术中剩余的人类尸体角膜组织中分离出来的,这些手术是在获得所有已故供体的近亲同意后从ETB-BISLIFE多组织中心(荷兰贝弗韦克)的角膜科获得的。
注意:有关本实验方案中使用的所有材料、试剂、设备和软件的详细信息,请参阅 材料表 。
1. 3D细胞培养基质的制备
- 创建一个包含所有感兴趣特征的负极玻璃模具(#1),在这种情况下,使用飞秒激光直写技术由玻璃制成(见 图2)。
- 小心地将负玻璃模具(#1)放在培养皿的底部。
- 通过将空的50 mL锥形管放在刻度上来制备PDMS预聚物,去皮,然后将所需量的有机硅弹性体基质倒入管中。
- 使用巴斯德移液管加入固化剂,使弹性体基底和固化剂的最终比例为10∶1(w/w)。
- 使用刮刀彻底混合锥形管中的成分。
- 以2,000× g 离心70秒以除去所有气泡。
- 将PDMS预聚物倒在培养皿中的负极玻璃模具(#1)顶部以完全覆盖它。
- 将培养皿与负极玻璃模具(#1)和PDMS预聚物一起放入真空干燥器中,然后启动真空泵。一旦达到真空,等待5分钟以除去存在于模具表面和PDMS预聚物之间界面的所有气泡。
- 取出真空,将培养皿从干燥器中取出。
- 将PDMS预聚物在65°C的烘箱中固化过夜。
- 使用刮刀抬起 PDMS 的边缘,小心地从负极玻璃模具 (#1) 中取出新固化的正 PDMS 芯片 (#2)。如果正性PDMS芯片(#2)倾向于粘附在负极玻璃模具(#1)上,则在提升时向压印的边缘添加乙醇或水。
注意:流体将在两层之间流动,并简化负极玻璃模具(#1)和正极PDMS芯片(#2)的分离。 - 使用刀片,切断正 PDMS 芯片(#2)的侧面,以便保留矩形芯片。
- 将阳性PDMS芯片(#2)放入干燥器中,旁边是装有三十二氟(1,1,2,2-四氢辛基)三氯氢硅(硅烷化剂)的液滴的小瓶,并在真空下放置过夜。
注意:硅烷化将确保版本说明不会绑定到协议后面的其他 PDMS 层。其他硅烷化剂和/或方法也可以确保PDMS芯片的表面不会粘附在其他PDMS层上。
注意:十三氟(1,1,2,2-四氢辛基)三氯氢硅是易燃的(H226),并导致严重的皮肤灼伤和眼睛损伤(H314)。穿戴个人防护装备,在通风橱中工作,并在处理后彻底洗手。使硅烷化剂远离热源、热表面、火花、明火和其他火源。储存在 15 至 30 °C(P280、P210、P240、P403、P235、P310)之间。 - 取出真空并将正 PDMS 芯片 (#2) 放在培养皿的底部。将 PDMS 预聚物 (10:1) 倒在上面以产生多个负 PDMS 模具 (#3)。
- 将培养皿置于干燥器中的真空下15分钟以除去所有气泡。
- 将 PDMS 预聚物在 65 °C 下固化过夜,之后可以使用刮刀将负 PDMS 霉菌 (#3) 从正 PDMS 芯片 (#2) 上剥离。
- 在真空干燥器中使用硅烷化剂对最终的负PDMS模具(#3)进行硅烷化过夜。
- 通过将PDMS预聚物倒入负性PDMS模具(#3),使用干燥器除去气泡并在65°C下固化3小时,产生约5mm厚的多个细胞培养芯片(#4,见 图2)。 使用剃须刀片,将芯片切割成最终尺寸, 如图2所示。将芯片储存在室温下。
注意:表面粗糙度可能会影响细胞反应。如果需要,可以在正PDMS芯片(#2)上使用额外的薄层PDMS涂层,以平滑表面。为此,将一小滴PDMS预聚物倒在芯片上,并使用加压空气将其散布在整个芯片上。将涂层芯片在65°C下固化3小时,并继续执行步骤1.12。
2. 平面 PDMS 样品(对照样品)的制备
- 按照步骤1.3-1.6制备PDMS预聚物(10:1)。
- 将玻璃盖玻片放在旋涂机中心的圆形真空柱上。
- 打开真空吸尘器将玻璃盖玻片连接到机器上,并使用巴斯德移液器在盖玻片中间移取一滴PDMS。
- 使用以下方案将PDMS预聚物分布在玻璃基板上,以获得约10μm厚的层。
- 旋涂在 0.45 × g 下旋转涂层 10 s,加速度:0.2 × g/s。
- 旋涂在 44.8 × g 下旋转涂层 50 秒,加速度:0.54 × g/s。
- 关闭真空,使用镊子从旋涂机上取下盖玻片,然后将其放入培养皿中。将PDMS在65°C的烤箱中固化过夜,然后在室温下储存。
3. 3D细胞培养基质的底物钝化
- 使用O2-等离子体激活PDMS芯片(#4)表面的羟基。使用镊子,将芯片放入等离子体灰泥的篮子中。
- 使用 20 W 的功率运行灰化循环,持续 30 秒。使用N2排出灰化室。
- 从篮子中取出芯片并将其放入一个小的PDMS容器中(见 图1)。
- 使用巴斯德移液管,在芯片顶部加入500μL聚-L-赖氨酸(PLL,0.01%),使整个表面浸入PLL溶液中。在室温下孵育30分钟。
- 用移液管从细胞培养芯片中取出450μLPLL,并用500μL0.1M HEPES缓冲液(8
- 制成500微升50毫克/毫升甲氧基聚乙二醇-琥珀酰亚胺基戊酸酯(mPEG-SVA;每个细胞培养芯片在0.1M HEPES缓冲液(8注意:当溶液完全透明时,mPEG-SVA溶解。
- 使用微量烟斗除去450μLmPEG-SVA溶液,并用磷酸盐缓冲盐水(PBS)洗涤芯片表面五次。确保每次洗涤上下移液多次,以确保去除所有未结合的mPEG-SVA。为防止样品变干,请尽量减少洗涤步骤之间的时间,并确保使用过量(500μL或更多)的PBS进行洗涤。
- 通过将样本浸入 PBS 中来存储样本,或继续执行协议的模式化步骤。
注意:如果需要,在培养柜中工作并使用无菌溶液和设备时,可以在无菌条件下进行钝化。
4. 图案化细胞培养基质的储存
注意:3D细胞培养基质可以在过程的不同步骤中储存。
- 在室温下的干燥条件下储存固化的PDMS细胞培养芯片。
- 以以下两种方式之一存储钝化的细胞培养芯片:
- 在4°C的PBS中储存长达7天。
- 在干燥条件下储存长达数月。要获得干燥的样品,请取出PBS并使用双蒸馏水(ddH2O)冲洗多次。使用氮气枪或气枪吹干。
5. 用于照片图案化的数字掩模设计
注:可以使用单个或多个焦平面进行3D基板的图案化(见 图3)。单个焦平面可用于不大于一个数字反射镜设备(DMD,约300μm x 500μm)且不太高(50-100μm)的特征。在这种情况下,请使用 TIFF 模式设计数字图案。对于超过一个 DMD 尺寸且相对较高的特征,请将基板的图案化划分为多个步骤。在这种情况下,使用PDF模式设计多个图案,所有模式都单独聚焦在单个焦平面上。
- 使用设计软件工具设计数字掩模。
- TIFF 模式下的图案化(像素):创建一个 1,140 x 1,824 像素的完全黑色画板(精确大小为 1 DMD,约 300 μm x 500 μm),并用感兴趣的形状填充画板。将画板导出为 8 位 TIFF 文件。
注意:图案设计中的不同灰度级别决定了将在该位置执行的曝光量。 - 在 PDF 模式下制作图案(公制单位):创建所需大小的黑色画板(以 mm 为单位),并用任何感兴趣的形状填充美工板。如果需要使用多个焦平面对 3D 基板进行图案化,则将图案划分为多个文件。将美工板另存为 PDF 文件。
注意:图案设计中的不同灰度级别决定了将在该位置执行的曝光量。
- TIFF 模式下的图案化(像素):创建一个 1,140 x 1,824 像素的完全黑色画板(精确大小为 1 DMD,约 300 μm x 500 μm),并用感兴趣的形状填充画板。将画板导出为 8 位 TIFF 文件。
6. 3D细胞培养基质的紫外光图案化
- 校准
注意:对激光器进行校准是为了正确聚焦感兴趣的材料。由于 PDMS 细胞培养基质太厚而无法穿孔,因此请使用将芯片倒置放置的载玻片。由于激光首先遇到载玻片,因此请使用玻璃来校准激光。- 将荧光高光笔涂在玻璃盖玻片上,并将玻璃盖玻片置于荧光显微镜的载物台中。确保加亮的表面朝上。
- 打开显微镜和PRIMO设备,打开微型管理器以访问"插件"下的莱昂纳多软件。
- 在初始菜单中选择 校准 ,然后在显微镜和软件中选择20x物镜。单击" 下一步"。
- 将带有荧光高光的载玻片置于显微镜的光路中。切换到 荧光 模式并仔细对焦于出现的PRIMO图像,确保徽标和文本都对焦。单击 "下一步"以完成校准过程。
- 校准时记下载物台的 Z 位置,并在协议的后面部分将此位置用作参考。
注意:校准材料应与协议后期用于图案化的材料相匹配。上述步骤描述了细胞培养基质所需的校准。要校准扁平 PDMS 对照样品,请在其他扁平 PDMS 样品上涂抹荧光荧光笔,并使用步骤 6.1.2-6.1.5 进行校准。
- 使用单个焦平面对 3D 特征进行图案化
注意:使用单个焦平面的图案化是在不超过一个 DMD 尺寸(约 300 μm x 500 μm)的 3D 特征上完成的。焦平面设置示意图如图 3所示。- 从载物台上取下校准载玻片,并将含有液滴(~50μL)光引发剂(PLPP)的载玻片放在载物台中。
注意:肝细胞增生蛋白(PLPP)刺激眼睛、呼吸系统和皮肤(R36-38)。穿戴个人防护装备,远离易爆物品,切勿向本产品加水,采取防静电预防措施,避免冲击和摩擦(S26-36)。 - 将PDMS细胞培养基质倒置在光引发剂的液滴中。确保细胞培养基质表面的3D特征面向载玻片,并完全浸没在PLPP中,以确保正确的图案化。
- 在软件中选择 模式 。
- 在显微镜上切换到 明场 模式,并将载物台移动到感兴趣的特征。
- 分别关注凸结构和凹结构的顶部或底部(图3)。
- 选择 "PRIMO "以插入所选模式。观察实时明场图像顶部的橙色图案预览。
- 根据特征(位置、角度、重复)调整图案设置,并选择 1,000 mJ/mm2 的剂量。
- 单击 锁定 并将显微镜切换到 荧光 模式。
- 单击屏幕右下角的" 播放 "按钮以开始图案化。完成后,观察绿色显示的图案。
- 在细胞培养芯片上完成所有特征后,从图案化载玻片中取出芯片并储存在4°C的PBS中。
- 从载物台上取下校准载玻片,并将含有液滴(~50μL)光引发剂(PLPP)的载玻片放在载物台中。
- 使用多个焦平面对 3D 特征进行图案化
注意:使用多个焦平面的图案化是在大于一个 DMD(约 300 μm x 500 μm)或相对较高的 3D 特征上完成的。在这种情况下,3D特征需要分多个步骤进行图案化,也就是说,图案设计应根据 图3中的示例进行调整。- 从载物台上取下校准载玻片,并将含有液滴(~50μL)光引发剂(PLPP)的载玻片放在载物台中。
- 使用镊子将PDMS细胞培养芯片倒置在光引发剂的液滴中。
- 在软件中选择 模式 。在显微镜上切换到 明场 模式,并将载物台移动到感兴趣的特征。
- 将重点放在芯片的正确位置的区域。由于图案化是在单个焦平面中执行的,并且特征大于单个DMD,因此每个3D基板使用多个焦平面,从而使用多轮图案化,以确保沿特征的完整高度和宽度有足够的图案分辨率(见 图3)。例如,对于高度为 150 μm 的特征,将特征分成三轮(每 50 μm Z 行程± 1 个焦平面),从特征底部聚焦约 25 μm、75 μm 和 125 μm。确保功能的底部与步骤 6.1.5 中记下的值相关。
- 选择" 普里莫 "以插入所选模式。观察实时明场图像顶部以橙色显示的图案预览。
- 根据特征(位置、角度)调整图案设置,并选择 1,000 mJ/mm2 的剂量。
- 单击 锁定 并将显微镜切换到 荧光 模式。
- 单击屏幕右下角的" 播放 "按钮以开始图案化。完成后,观察绿色显示的图案。
- 使用多个焦平面时,对感兴趣的特征重复步骤 6.3.4-6.3.8。
- 在细胞培养芯片上完成所有特征后,从图案化载玻片中取出芯片并将其储存在4°C的PBS中。
注意:如果需要,在无菌条件下应用UV光图案,利用玻璃底培养皿并在无菌培养柜中准备所有基质。将图案化的样品在PBS中储存长达几周。当用ddH2O洗涤并使用加压空气干燥时,样品可以在4°C下储存长达几个月。
7. 蛋白质孵育
注意:建议使用新鲜蛋白质孵育的底物进行细胞培养。如果细胞接种(步骤8)在之后直接完成,则仅继续进行实验方案的这一部分。
- 将图案化的细胞培养芯片转移到培养柜中的无菌PDMS容器中。
- 如果图案化不是在无菌条件下进行的,则用过量的无菌PBS洗涤图案化的细胞培养芯片3x。
- 在PBS中制备新鲜的蛋白质溶液。
- 纤连蛋白:使用微量管将2 mL PBS加入20μg罗丹明标记的纤连蛋白小瓶中,以获得10μg/ mL的浓度。轻轻移液以避免蛋白质团块的形成并防止光照。
- 明胶:解冻200μL等分试样的溶解明胶 - 荧光素。避光。
- 使用微量烟斗将200-500μL蛋白质溶液加入细胞培养芯片中。根据所选蛋白质调整孵育时间和温度:纤连蛋白:室温下5分钟,明胶:37°C下15分钟。 确保覆盖样品(例如,用铝箔)。
- 取出蛋白质溶液,用500μL无菌PBS洗涤5x。确保在细胞培养芯片的所有相关特征之上多次上下移液PBS,以去除任何未结合的蛋白质。
注意:在洗涤步骤中,样品永不干燥至关重要。在洗涤过程中除去蛋白质溶液或PBS时,立即添加新的PBS以防止蛋白质团块形成(见 图4)。凸特征对干燥特别敏感,因为它们位于基板表面上方。 - 可选:在荧光显微镜下查看蛋白质模式。保持样品无菌并浸入PBS中。
8. 细胞接种
注意:该方案使用人类原发性角质形成细胞和人真皮成纤维细胞。角质形成细胞是从患者的人类角膜组织中收获的,符合荷兰二次使用材料的指南,并且以前被描述为角质形成细胞47。这些细胞在DMEM中培养,补充5%胎牛血清(FBS),1%青霉素/链霉素(P / S)和1mM L-抗坏血酸2-磷酸倍半镁盐水合物(维生素C),在37°C下最多传代四次。购买人真皮成纤维细胞并在DMEM中培养,在37°C下补充10%FBS和1%P / S,最多15次传代。为了在光图案细胞培养芯片上接种角质形成细胞和真皮成纤维细胞,每个芯片使用20,000个细胞。
- 分离感兴趣的细胞(例如,使用胰蛋白酶)并在每个芯片的培养基中制备1mL±10,000-50,000个细胞/ mL的细胞悬浮液。根据电池尺寸和所需读数调整每个基板添加的确切细胞数。
- 从细胞培养芯片中取出PBS,加入1 mL细胞悬浮液。
- 将细胞培养芯片与细胞一起轻轻运输到培养箱中,并在37°C下孵育60分钟。
- 在明场显微镜下检查图案化细胞培养芯片上的细胞粘附。在线型的情况下寻找细长的细胞形态(见 图5)。如果细胞也开始粘附在图案区域之外,则通过在基质上直接上方和向下移液培养基来去除这些细胞。
注意:附着在图案区域上的单元格将保持附着状态,而图案区域外的单元格将分离。 - 从PDMS容器中取出细胞培养芯片,并使用无菌镊子将其放入装有约5mL培养基的6孔板中。
- 培养细胞所需的时间长度。每2-3天更换一次细胞培养基。为确保细胞培养后蛋白质模式的可视化,请减少培养过程中样品暴露在光下的量。
9. 染色、图像采集和分析
- 固定和染色
- 培养所需长度后,除去几乎所有培养基,并用过量的PBS洗涤三次。接下来,在室温下与3.7%福尔马林一起孵育15分钟,然后在室温下用PBS洗涤三个步骤5分钟。切勿让样品变干。
注意:福尔马林如果吞咽或吸入(H302,H332)是有害的,可能引起过敏性皮肤反应(H317),怀疑引起遗传缺陷(H341),并可能导致癌症(H350)。穿戴个人防护装备,在通风橱中工作。 - 用所需的染色剂或抗体对细胞培养基质进行染色。为了减少染色剂的体积,将细胞培养芯片倒置在载玻片上输送的染色溶液液滴中。
- 将样品储存在PBS(短期)中,或在4°C下使用安装介质(长期)连接到盖玻片上。
- 培养所需长度后,除去几乎所有培养基,并用过量的PBS洗涤三次。接下来,在室温下与3.7%福尔马林一起孵育15分钟,然后在室温下用PBS洗涤三个步骤5分钟。切勿让样品变干。
- 图像采集
- 将染色的样品倒置在载玻片上的PBS液滴中。将样品置于共聚焦显微镜的载物台中。
- 根据所需的细节水平,制作具有合适物镜(10x、20x或40x)和Z间距的Z轴堆栈,以确保正确的图像采集。
- 图像分析和可视化
- 在图像分析软件中打开原始图像文件,并检查图像属性(例如,尺寸,分辨率)是否正确。
- 如果需要,调整每个通道的亮度和对比度。
- 裁剪包含图案和单元格的感兴趣区域。
- 可选:如果需要,执行反卷积步骤。
- 使用 3D 渲染软件创建 Z 堆栈的 3D 渲染。
- 优化每个通道的对比度和增益设置。
- 要制作 3D 渲染的图像,请创建快照并导出为 。断续器文件。
- 要创建 3D 渲染的影片,请在注册影片之前设置开始帧和最终帧以及时间范围。导出为.avi。
结果
通过所述方案,3D PDMS细胞培养基质可以进行紫外光图案化,以创建适合细胞附着的精确和高通量粘合区域。通过这种方式,细胞同时受到相关基质几何形状和粘合剂配体图案的影响。细胞属性,如取向、细胞面积和局灶性粘附的数量,可以很容易地被监测出来,并用于更好地了解复杂的体内类似环境中 的细胞行为。
为了验证3D PDMS基板上的图案化事件,使用原子X射线光电子能谱(XPS)48测量了材料在不同阶段的原子表面组成。总之,XPS测量显示,钝化样品上存在碳信号增加的PEG链,在光图案化后碳信号减少。与纤连蛋白孵育导致碳信号增加,再次表明蛋白质成功粘附在细胞培养芯片表面。接下来,在各种圆形图案的凹坑(ĸ = 1/250 μm-1,ĸ = 1/1,000 μm-1,ĸ = 1/3,750 μm-1,见图6)上表征3D特征的图案分辨率和对准。从最大强度投影中,可以得出结论,蛋白质图案在所有三个3D特征上都成功地图案化。图6A中的强度曲线显示了高图案分辨率,图案化和非图案化区域之间具有清晰的过渡。此外,在坑中获得了整个模式的一致蛋白质强度。
使用单焦平面方法(一个图案)对ĸ = 1/250 μm-1 的凹坑进行图案化,而使用两个和三个焦平面(图案)分别对ĸ = 1/1,000 μm-1 和ĸ = 1/3,750 μm-1 的凹坑进行图案化。从 图6中的最大强度投影中可以看出,这两种方法都可以使特征顶部的图案完美对齐。不会观察到两个不同焦平面和图案之间的未对齐过渡。
使用所描述的方案,可以将广泛的蛋白质图案设计应用于各种几何形状(见 图7 和 视频1)。为了说明这种方法的多功能性,使用各种宽度的线条和圆圈对半圆柱体(凸面和凹面),鞍座表面和凹坑进行了图案化。光图案材料随后可用于细胞培养(参见 图7、 图8、 视频2、视频3和 视频4)。图 8, 图9和 视频4显示了在图案化(纤连蛋白线,红色,5μm宽和5μm间隙)凹陷半圆柱体上培养的真皮成纤维细胞的示例。在实验过程中,细胞感知并粘附在多cue细胞培养基质上,并随着时间的推移保持活力。从 图8中的免疫荧光染色可以看出,细胞主要在纤连蛋白系上形成局灶性粘连(长春花苷簇)。
利用这些细胞培养材料的另一项示例研究最近由我们的48组发表。在这项研究中,人肌成纤维细胞和内皮细胞接受了接触引导线索和几何地形的组合。 在体内,这两种类型的细胞在天然组织(如人类脉管系统中)中经历曲率和接触引导线索。通过将 体外 细胞置于结合两种环境线索的环境中,可以概括 体内 情况,从而更深入地了解微环境对细胞行为的作用。显示人肌成纤维细胞与凹圆柱形底物上的接触引导线索(平行纤连蛋白线)对齐48。然而,在曲率增加的凸结构上,几何线索推翻了生化线索,表明肌成纤维细胞可以感知曲率的程度和符号。有趣的是,内皮细胞只能粘附在凹面的多库底物上,而不能粘附在凸面的PDMS底物上。在凹面的蛋白质图案底物上,内皮细胞朝向接触引导提示的方向。这种基本的 体外知识在 血管组织工程领域具有生理相关性,最终可以帮助设计智能组织工程结构。
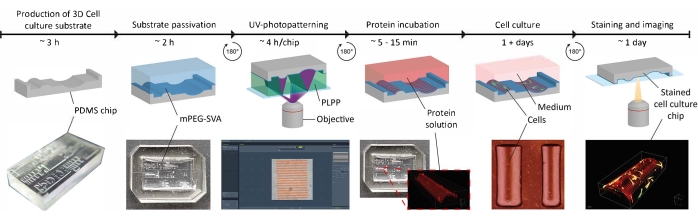
图1:在3D细胞培养基质上应用接触引导线索的实验时间表。 首先,阳性细胞培养芯片由包含一系列几何形状的负PDMS模具生产。将未固化的PDMS倒入模具中并在65°C下固化3小时。 随后,用O2-等离子体处理PDMS,并用PLL和mPEG-SVA(蓝色,标记)孵育以钝化细胞培养基质的表面。洗涤后,基板在一滴光引发剂(PLPP,绿色,标记)中倒置,并使用LIMAP方法进行UV光图案化。在这里,使用具有用户定义图案的数字掩模在定义的位置切割钝化层。接下来,蛋白质溶液(红色,标记)可以孵育,并且只会粘附在去除钝化层的位置。接种在底物上的细胞受到几何形状和蛋白质模式的影响,这使得能够研究复杂的体内模拟环境中 的细胞行为。缩写: PDMS = 聚二甲基硅氧烷;mPEG-SVA = 甲氧基聚乙二醇-琥珀酰亚胺基戊酸酯;PLPP = 4-苯甲酰基苄基三甲基氯化铵;LIMAP = 光诱导的蛋白质分子吸附。 请点击此处查看此图的大图。

图2:3D细胞培养基质生产和钝化过程中的不同阶段。 负极玻璃模具(#1)是用计算机辅助设计软件设计的,并使用飞秒激光直写技术生产。该模具用于生产中间正PDMS芯片(#2)和负PDMS模具(#3),随后用于生产最终的细胞培养芯片(#4)。简称:PDMS = 聚二甲基硅氧烷。 请点击此处查看此图的大图。

图 3:两种图案化方法的示意图。 左图:使用单个焦平面和图案在较小的特征(大约一个 DMD)上执行 UV 光图案化。因此,整个特征一次性完成图案化。右图:当使用较大的特征(大于一个 DMD)时,图案将划分为多个焦平面和图案。缩写:DMD = 数字镜像设备。 请点击此处查看此图的大图。
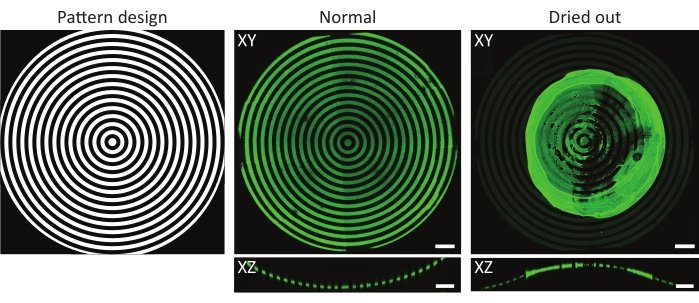
图 4:正常和干燥的蛋白质孵育底物的典型示例。正常和干燥的蛋白质孵育底物的最大强度投影(XY)和正交视图(XZ)。在与蛋白质溶液孵育后洗涤图案化的细胞培养基质时,始终保持样品湿润至关重要。尽管特征上的所有图像中的图案相同(ĸ = 1/1,000μm-1),但当样品干燥几秒钟时,明胶 - 荧光素(绿色)聚集形成一个主要团块。如果样品始终保持湿润,则可以观察到正确的蛋白质模式。比例尺 = 100 μm.请点击此处查看此图的大图。

图 5:播种后的明场图像。原代角质形成细胞(左)和真皮成纤维细胞(右)在3D几何特征上接种4小时后(ĸ的凹坑= 1/1,000μm-1和ĸ = 1/500,1/375,1/250,1/175和1/125μm-1的半圆柱体)。左上角的插入表示用于阵列化几何图形的线图案。白色箭头表示已显示对齐的展开单元格。比例尺 = 250 μm 请点击此处查看此图的大图。
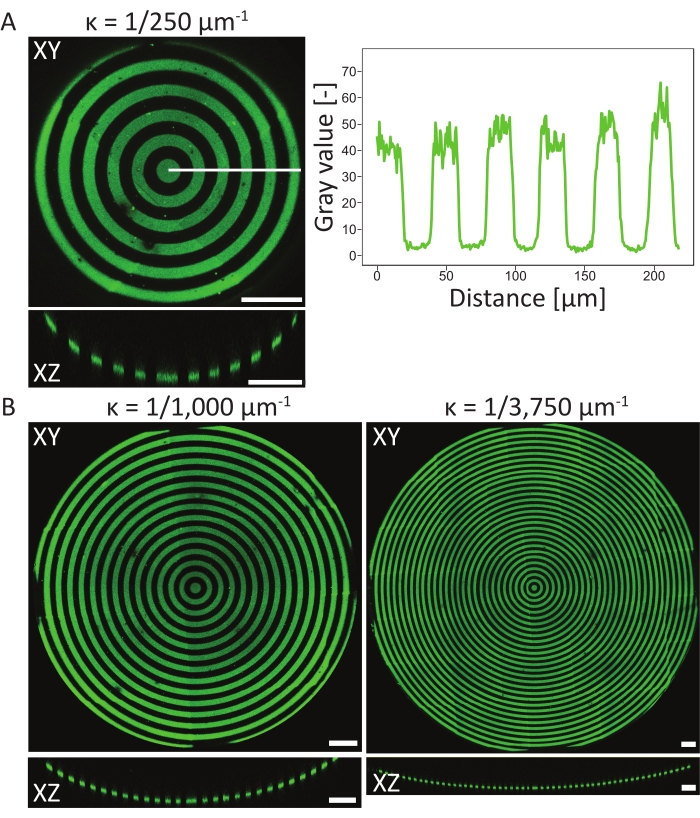
(A)凹坑(ĸ = 1/250μm-1)的最大强度投影(XY)和正交视图(XZ)使用LIMAP(线宽:20μm,间隙宽度:20μm)并用明胶 - 荧光素(绿色)孵育。沿白线的强度分布与距离相对绘制,显示一致的图案质量和分辨率。(B) 在凹坑上进行的额外图案化,ĸ = 1/1,000 μm-1 和 ĸ = 1/3750 μm-1,在可用于图案化的几何特征方面表现出灵活性。同样,最大强度投影 (XY) 和正交视图 (XZ) 都是可视化的。比例尺 = 100 μm.请点击此处查看此图的大图。
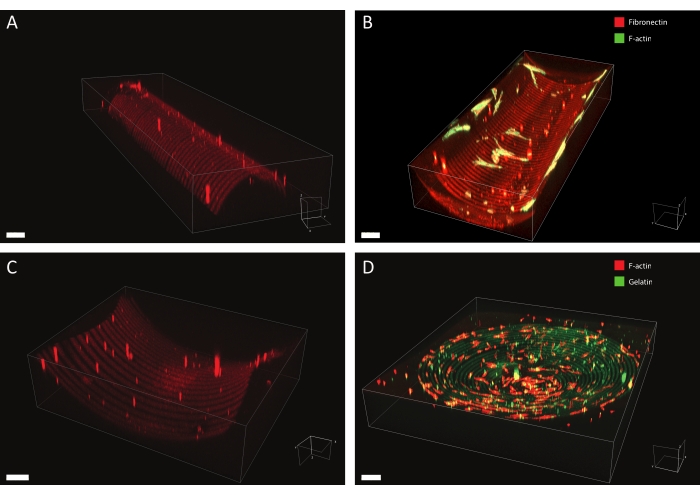
图 7:图案化结构的 3D 显微镜数据。 在光图案化和细胞培养后进行3D图案化细胞培养材料的典型示例,使用3D渲染软件进行可视化。(A)凸半圆柱体图案,具有10μm宽的线条(罗丹明 - 纤连蛋白,红色)和10μm宽的间隙。比例尺= 5μm.(B)在凹陷的半圆柱体上培养的F-肌动蛋白(绿色)染色的真皮成纤维细胞,该半圆柱体具有20μm宽的线条(罗丹明 - 纤连蛋白,红色)和20μm宽的间隙。比例尺 = 5 μm. (C) 马鞍表面图案,线条宽 20 μm(罗丹明-纤连蛋白,红色)和 20 μm 宽的间隙。比例尺= 5μm(D)凹坑图案,同心圆为20μm宽的线(明胶 - 荧光素,绿色)和20μm宽的间隙。使用鬼笔小球染色人角质细胞的F-肌动蛋白细胞骨架,并以红色显示。比例尺 = 200 μm .请点击此处查看此图的大图。

图8:在光图案化的凹形半圆柱体上对人真皮成纤维细胞进行免疫荧光染色 (A)在图案化(纤连蛋白线,红色,5μm宽和5μm间隙)上培养24小时的人真皮成纤维细胞的最大强度投影(XY)和正交切片(XZ和YZ)。对细胞进行F-肌动蛋白(洋红色)、长春花素(绿色)和细胞核(蓝色)染色。比例尺 = 100 μm. (B) 放大附着在多cue 环境中的细胞。比例尺 = 50 μm 请点击此处查看此图的大图。

图9:人类真皮成纤维细胞在图案凹圆柱体上的明场延时图像。将凹形半圆柱体(ĸ = 1/250μm-1)图案化为平行线(5μm宽和5μm间隙),并在细胞接种前与罗丹明 - 纤连蛋白一起孵育。在初始细胞接种后1小时开始延时成像(左,0分钟),当细胞仍然圆且不贴壁(箭头)时。大约24小时后(中间,1,420分钟),细胞粘附在多cue基质上,并根据接触引导模式显示对准响应。在整个培养期间(右,3,180分钟),对准反应和细胞活力均保持。比例尺 = 200 μm.请点击此处查看此图的大图。
视频 1:在 3D 圆柱形基板上绘制图案示例。 用罗丹明-纤连蛋白(红色)图案化的凸圆柱体的 3D 表示。 请按此下载此影片。
视频2:在图案化的3D圆柱形底物上培养的真皮成纤维细胞的3D表示(ĸ = 1/500μm-1)。 真皮成纤维细胞在图案化(纤连蛋白线,红色,10μm宽和10μm间隙)凸半圆柱体上培养24小时。对细胞进行F-肌动蛋白(洋红色)、长春花素(绿色)和细胞核(蓝色)染色。请按此下载此影片。
视频3:在图案化3D坑(ĸ = 1/3,750μm-1)上培养的人角质形成细胞的3D表示。 在凹陷的图案坑(明胶圆圈,绿色,20μm宽和20μm间隙)中培养24小时的人角质形成细胞的3D表示。细胞染色为F-肌动蛋白(红色)。请按此下载此影片。
视频4:在图案凹圆柱体上对人体真皮成纤维细胞进行明场延时成像。 将凹形半圆柱体(ĸ = 1/250μm-1)图案化为平行线(5μm宽和5μm间隙),并在细胞接种前与罗丹明 - 纤连蛋白一起孵育。在初始细胞接种后1小时开始延时成像,当细胞显示对多cue环境的初始粘附时。在完全延时摄影期间,细胞主要沿着接触引导线索定向,同时保持细胞活力。请按此下载此影片。
讨论
如今,细胞行为通常在缺乏天然细胞微环境复杂性的扁平培养基质上进行研究。3D环境,如脚手架和水凝胶被用作替代品。虽然这些细胞培养环境提高了 体内 相关性,但细胞行为的系统研究和读出方法的可行性仍然具有挑战性。为了系统地研究代表性培养基质上的细胞行为,需要一致的多cue底物,允许微观读数。因此,在该协议中,我们描述了一种创建具有生理学相关几何形状和图案化ECM蛋白的多cue细胞培养基质的方法。在 体外 平台上结合组织几何形状和接触引导线索等环境线索的主要挑战主要是技术性质的。将接触引导线索(例如,软光刻、深紫外图案化和微接触印刷35,36)应用于细胞培养材料的常规方法已针对平面基材进行了优化。对3D细胞培养材料与接触引导线索相结合的需求突出了几个技术挑战,例如模式对齐,分辨率和灵活性差。为了克服这些挑战,可以使用高通量、无掩模、基于光的图案化方法45,49。在这里,光学显微镜可以精确地对准图案,分辨率达到微米的数量级(见 图6)。此外,数字掩模的使用使研究人员能够研究各种图案上的细胞行为,而无需制造劳动密集型物理掩模。
紫外光图案化方法可与由一系列材料48产生的各种3D几何形状(例如,圆柱体、鞍座、圆顶、凹坑)结合使用。本研究中使用的3D细胞培养基质由PDMS制成;但是,也可以使用其他材料。这可能需要不同的步骤来生产包含感兴趣特征的最终细胞培养基质。由于细胞已被证明对细胞培养材料的表面粗糙度敏感,因此创建具有光滑表面的细胞培养芯片非常重要,以便观察到的细胞的反应可以完全归因于3D几何形状和接触引导线索50,51。光学轮廓测量,扫描电子显微镜或原子力显微镜等测量方法可用于测量表面粗糙度。在制造细胞培养材料后,可以根据目标特征的特定尺寸选择基于一个或多个焦平面的图案化方法(见 图3)。通常,单个焦平面用于在大约50μm的Z范围内绘制区域。使用此经验法则,图案分辨率被证明是一致的(参见 图6)。然而,这种方法的缺点是,随着多个焦平面和图案的引入,图案化时间增加。在我们手中,使用多个焦平面,最大16 mm x 16 mm x 0.17 mm(X x Y x Z)的3D几何特征已成功以高图案质量进行图案化。
此外,值得一提的是,可与此协议结合使用的几何特征的高度(Z轴)是有限的。由于紫外光图案和许多蜂窝读数都依赖于显微镜设置,因此物镜的工作距离决定了特征的最大高度。在我们手中,高度超过300μm的几何形状仍然可以进行紫外光图案化,并且已经使用具有40倍物镜的共聚焦显微镜进行了读数。因此,可以使用所描述的方案进行从细胞内到细胞和组织鳞片的机械生物学研究。
需要考虑的另一个因素是在UV光图案化期间或之后样品干燥的风险49。这在使用3D几何形状时尤其重要,因为凸面经常暴露在细胞培养材料之外。如图 4所示,这可能导致在感兴趣的特征上形成蛋白质聚集体的不均匀模式。在蛋白质孵育后和细胞培养过程中清洗细胞培养芯片对于3D几何形状的正确涂层至关重要。因此,建议始终在细胞培养芯片的顶部保留少量的工作溶液(PBS,PLPP,蛋白质溶液,细胞培养基)。
到目前为止,几种蛋白质包衣(纤连蛋白,I型和IV型胶原蛋白,明胶,FNC)和细胞类型(人骨髓基质细胞,人肌成纤维细胞,人内皮细胞,人角质形成细胞和真皮成纤维细胞)已经与所述的光图案方法组合用于结构化细胞培养材料上。如之前的研究48所示,蛋白质孵育参数的优化是新细胞类型系统研究的关键。因此,在对新蛋白质或细胞进行新实验之前,建议测试一系列蛋白质浓度,孵育温度和孵育时间。通过在"正常"细胞培养条件下,将均匀的图案状平坦区域的初始粘附后的细胞形态与细胞形态进行比较,可以获得一组优化的实验参数。此外,每种细胞类型在接种后可能需要不同的时间才能在特定的多库环境中显示可识别的粘附形态(见 图5)。为此,在步骤8.4的洗涤过程中,优化每种细胞类型在图案化区域上显示接触事件所需的时间至关重要。例如,我们观察到,在线性模式上,人角质形成细胞在接种后的前30分钟内显示出细长的形态,而内皮细胞和真皮成纤维细胞需要数小时才能显示出粘附形态的变化。因此,蛋白质孵育(步骤7)和细胞接种(步骤8)所需的实验参数可能取决于所选择的蛋白质和细胞类型。
在3D几何体上应用接触引导线索的方法有助于更深入地了解复杂多库环境中的细胞行为。这可能包括对细胞内成分的研究,例如局灶性粘连和细胞核,也可以涉及使用所提出的方法在更大的细胞或组织尺度上进行的实验。最终,预计所获得的知识可用于组织工程应用的设计,其中复杂的细胞环境旨在将细胞行为引向预期的结果。
披露声明
作者没有利益冲突要披露。
致谢
我们感谢Nello Formisano博士(MERLN技术研究所启发的再生医学)提供人类原发性角质形成细胞。这项工作得到了切梅洛特研究所(项目BM3.02)的支持。欧洲研究理事会(拨款851960);以及教育,文化和科学部的重力计划024.003.013"材料驱动的再生"。作者要感谢Alveole的通信,帮助和故障排除。
材料
| Name | Company | Catalog Number | Comments |
| Anti-vinculin antibody, mouse monoclonal IgG1 | Sigma | V9131 | Dilution: 1/600 |
| Bovine Serum albumin, Fraction V | Roche | 10735086001 | |
| DMEM, high glucose, pyruvate | Gibco | 41966029 | |
| DMEM/F-12 + GlutaMAX (1x) | Gibco | 10565018 | |
| DMi8 epifluorescent microscope | Leica Microsystems | ||
| Ethanol | Biosolve | 0005250210BS | |
| Fetal Bovine Serum | Serana | 758093 | |
| Fiji/ImageJ, version v1.53k | www.imageJ.nih.gov | ||
| Fluorescent highlighter | Stabilo | 4006381333627 | |
| Fluorescin-labeled gelatin | Invitrogen | G13187 | Concentration: 0.01% |
| Formaldehyde solution | Merck | F8775 | |
| Glass coverslips 24 x 60 mm, #1 | VWR | 631-1575 | |
| Glass coverslips, ø = 32 mm, #1 | Menzel-Gläser | ||
| HCX PL fluotar L 20X/0.40na microscope objective | Leica | 11506242 | |
| HEPES | Gibco | 15630080 | |
| Human dermal fibroblasts | Lonza | CC-2511 | |
| Human primary keratocytes | MERLN Institute for Technology-Inspired Regenerative Medicine | ||
| Illustrator, Version 26.0.1 | Adobe | ||
| Laboratory oven | Carbolite | ||
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960 | |
| Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Leonardo software, version 4.16 | Alvéole | ||
| Micro-manager, version 1.4.23 | Open imaging | ||
| Mowiol 4-88 | Sigma-Aldrich | 81381 | mounting medium |
| mPEG-succinimidyl valerate MW 5,000 Da | Laysan Bio | MPEG-SVA-5000 | Concentration: 50 mg/mL |
| Negative glass mold | FEMTOprint | ||
| NucBlue Live Readyprobes Reagent (Hoechst 33342) | Invitrogen | R37605 | 2 drops/mL |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140163 | |
| Petri dish (ø=100 mm) | Greiner Bio-one | 664160 | |
| Phalloidin Atto 647N | Sigma | 65906 | Dilution: 1/250 |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Plasma asher | Emitech | K1050X | |
| PLPP (photoinitiator) | Alvéole | ||
| Poly-L-lysine, sterile-filtered | Sigma-Aldrich | P4707 | Concentration: 0.01% |
| PRIMO | Alvéole | ||
| Rhodamine-labeled fibronectin | Cytoskeletn, Inc. | FNR01 | Concentration: 10 µg/mL |
| Secondary antibody with Alexa 488, Goat anti-mouse IgG1 (H) | Molecular Probes | A21121 | Dilution: 1/300 |
| Secondary antibody with Alexa 555, Goat anti-mouse IgG1 (H) | Molecular Probes | A21127 | Dilution: 1/300 |
| Spin coater | Leurell Technologies Corporation | model WS-650MZ-23NPPB | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 1673921 | |
| TCS SP8X confocal microscope | Leica Microsystems | ||
| tridecafluoro(1,1,2,2-tetrahydrooctyl)trichlorosilane | ABCR | AB111444 | |
| TrypLE Express Enzyme (1x), no phenol red | Gibco | 12604013 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 |
参考文献
- Wang, Y., Wang, G., Luo, X., Qiu, J., Tang, C. Substrate stiffness regulates the proliferation, migration, and differentiation of epidermal cells. Burns. 38, 414-420 (2012).
- Viswanathan, P., et al. 3D surface topology guides stem cell adhesion and differentiation. Biomaterials. 52, 140-147 (2015).
- Peyton, S. R., et al. Marrow-derived stem cell motility in 3D synthetic scaffold is governed by geometry along with adhesivity and stiffness. Biotechnology and Bioengineering. 108 (5), 1181-1193 (2011).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nature Reviews Molecular Cell Biology. 18 (12), 728-742 (2017).
- Chaudhuri, O., Cooper-White, J., Janmey, P. A., Mooney, D. J., Shenoy, V. B. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584, 535-546 (2020).
- Guido, S., Tranquillo, R. T. A methodology for the systematic and quantitative study of cell contact guidance in oriented collagen gels. Correlation of fibroblast orientation and gel birefringence. Journal of Cell Science. 105 (2), 317-331 (1993).
- Teixeira, A. I., Abrams, G. A., Bertics, P. J., Murphy, C. J., Nealey, P. F. Epithelial contact guidance on well-defined micro- and nanostructured substrates. Journal of Cell Science. 116, 1881-1892 (2003).
- Driscoll, M. K., Sun, X., Guven, C., Fourkas, J. T., Losert, W. Cellular contact guidance through dynamic sensing of nanotopography. ACS Nano. 8 (4), 3546-3555 (2014).
- Buskermolen, A. B. C., et al. Cellular contact guidance emerges from gap avoidance. Cell Reports Physical Science. 1 (5), 100055 (2020).
- Thrivikraman, G., et al. Cell contact guidance via sensing anisotropy of network mechanical resistance. Proceedings of the National Academy of Sciences of the United States of America. 118 (29), 1-11 (2021).
- Buskermolen, A. B. C., et al. Entropic forces drive cellular contact guidance. Biophysical Journal. 116 (10), 1994-2008 (2019).
- Vignaud, T., et al. Reprogramming cell shape with laser nano-patterning. Journal of Cell Science. 125 (9), 2134-2140 (2012).
- Pouthas, F., et al. In migrating cells, the Golgi complex and the position of the centrosome depend on geometrical constraints of the substratum. Journal of Cell Science. 121 (14), 2406-2414 (2008).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Théry, M., et al. Anisotropy of cell adhesive microenvironment governs cell internal organization and orientation of polarity. Proceedings of the National Academy of Sciences of the United States of America. 103 (52), 19771-19776 (2006).
- Huang, G., et al. Functional and biomimetic materials for engineering of the three-dimensional cell microenvironment. Chemical Reviews. 117 (20), 12764-12850 (2017).
- Callens, S. J. P., Uyttendaele, R. J. C., Fratila-Apachitei, L. E., Zadpoor, A. A. Substrate curvature as a cue to guide spatiotemporal cell and tissue organization. Biomaterials. 232, 119739 (2020).
- Yilmaz, C. O., Xu, Z. S., Gracias, D. H. Curved and Folded Micropatterns in 3D Cell Culture and Tissue Engineering. Methods in Cell Biology. 121, (2014).
- Silver, F. H., Freeman, J. W., Seehra, G. P. Collagen self-assembly and the development of tendon mechanical properties. Journal of Biomechanics. 36 (10), 1529-1553 (2003).
- Werner, M., Kurniawan, N. A., Bouten, C. V. C. Cellular geometry sensing at different length scales and its implications for scaffold design. Materials. 13 (4), 963 (2020).
- Di Cio, S., Bøggild, T. M. L., Connelly, J., Sutherland, D. S., Gautrot, J. E. Differential integrin expression regulates cell sensing of the matrix nanoscale geometry. Acta Biomaterialia. 50, 280-292 (2017).
- Fioretta, E. S., Simonet, M., Smits, A. I. P. M., Baaijens, F. P. T., Bouten, C. V. C. Differential response of endothelial and endothelial colony forming cells on electrospun scaffolds with distinct microfiber diameters. Biomacromolecules. 15 (3), 821-829 (2014).
- Werner, M., Kurniawan, N. A., Korus, G., Bouten, C. V. C., Petersen, A. Mesoscale substrate curvature overrules nanoscale contact guidance to direct bone marrow stromal cell migration. Journal of The Royal Society Interface. 15 (145), 20180162 (2018).
- Ruprecht, V., et al. How cells respond to environmental cues - insights from bio-functionalized substrates. Journal of Cell Science. 130 (1), 51-61 (2017).
- Bao, M., Xie, J., Huck, W. T. S. Recent advances in engineering the stem cell microniche in 3D. Advanced Science. 5 (1800448), 1-16 (2018).
- Zhan, X. Effect of matrix stiffness and adhesion ligand density on chondrogenic differentiation of mesenchymal stem cells. Journal of Biomedical Materials Research - Part A. 108 (3), 675-683 (2020).
- Jiang, T., et al. Untangling the response of bone tumor cells and bone forming cells to matrix stiffness and adhesion ligand density by means of hydrogels. Biomaterials. 188, 130-143 (2019).
- Choi, J. S., Harley, B. A. C. The combined influence of substrate elasticity and ligand density on the viability and biophysical properties of hematopoietic stem and progenitor cells. Biomaterials. 33, 4460-4468 (2012).
- Rape, A. D., Zibinsky, M., Murthy, N., Kumar, S. A synthetic hydrogel for the high-throughput study of cell-ECM interactions. Nature Communications. 6 (8129), 1-9 (2015).
- Camarero-Espinosa, S., et al. 3D printed dual-porosity scaffolds: the combined effect of stiffness and porosity in the modulation of macrophage polarization. Advanced Healthcare Materials. 11 (2101415), 1-16 (2022).
- Bao, M., et al. Cellular volume and matrix stiffness direct stem cell behavior in a 3D microniche. ACS Applied Materials and Interfaces. 11 (2), 1754-1759 (2019).
- Charest, J. L., Eliason, M. T., García, A. J., King, W. P. Combined microscale mechanical topography and chemical patterns on polymer cell culture substrates. Biomaterials. 27, 2487-2494 (2006).
- Bilem, I., et al. Interplay of Geometric Cues and RGD/BMP-2 crosstalk in directing stem cell fate. ACS Biomaterials Science and Engineering. 3 (10), 2514-2523 (2017).
- Nam, K. -. H., et al. Multiscale cues drive collective cell migration. Scientific Reports. 6, 29749 (2016).
- Alom Ruiz, S., Chen, C. S. Microcontact printing: A tool to pattern. Soft Matter. 3 (2), 168-177 (2007).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Protein Micropatterns. A Direct Printing Protocol Using Deep UVs. Methods in Cell Biology. 97, (2010).
- Kane, R. S., Takayama, S., Ostuni, E., Ingber, D. E., Whitesides, G. M. Patterning proteins and cells using soft lithography. Biomaterials. 20 (23-24), 2363-2376 (1999).
- Azioune, A., Storch, M., Bornens, M., Théry, M., Piel, M. Simple and rapid process for single cell micro-patterning. Lab on a Chip. 9 (11), 1640 (2009).
- Offenhäusser, A., et al. Microcontact printing of proteins for neuronal cell guidance. Soft Matter. 3 (3), 290-298 (2007).
- Ricoult, S. G., Sanati Nezhad, A., Knapp-Mohammady, M., Kennedy, T. E., Juncker, D. Humidified microcontact printing of proteins: universal patterning of proteins on both low and high energy surfaces. Langmuir. 30 (40), 12002-12010 (2014).
- Waterkotte, B., et al. Biofunctional Micropatterning of Thermoformed 3D Substrates. Advanced Functional Materials. 24 (4), 442-450 (2014).
- Lehnert, D., et al. Cell behaviour on micropatterned substrata: Limits of extracellular matrix geometry for spreading and adhesion. Journal of Cell Science. 117 (1), 41-52 (2004).
- Sevcik, E. N., Szymanski, J. M., Jallerat, Q., Feinberg, A. W. Patterning on topography for generation of cell culture substrates with independent nanoscale control of chemical and topographical extracellular matrix cues. Current Protocols in Cell Biology. 75, 1-25 (2017).
- Micropatterning: Surface functionalization. Alvéole Available from: https://www.alveolelab.com/technology/micropatterning-surface-functionalization/ (2022)
- Strale, P. O., et al. Multiprotein printing by light-induced molecular adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- van Gaal, R. C., Miltenburg, R. P. R. S., Kurniawan, N. A., Bouten, C. V. C., Dankers, P. Y. W. Renal epithelial cell responses to supramolecular thermoplastic elastomeric concave and convex structures. Advanced Materials Interfaces. 8 (1), 2001490 (2021).
- Foster, J. W., Gouveia, R. M., Connon, C. J. Low-glucose enhances keratocyte-characteristic phenotype from corneal stromal cells in serum-free conditions. Scientific Reports. 5, 1-16 (2015).
- Van Der Putten, C., et al. Protein micropatterning in 2.5D: an approach to investigate cellular responses in multi-cue environments. ACS Applied Materials and Interfaces. 13 (22), 25589-25598 (2021).
- Melero, C., et al. Light-induced molecular adsorption of proteins using the primo system for micro-patterning to study cell responses to extracellular matrix proteins. Journal of Visualized Experiments. (152), e60092 (2019).
- Hou, Y., et al. Surface roughness gradients reveal topography-specific mechanosensitive responses in human mesenchymal stem cells. Small. 16 (10), 1905422 (2020).
- Bourkoula, A., et al. Roughness threshold for cell attachment and proliferation on plasma micro-nanotextured polymeric surfaces: The case of primary human skin fibroblasts and mouse immortalized 3T3 fibroblasts. Journal of Physics D: Applied Physics. 49 (30), 304002 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。