Method Article
Génération de microenvironnements cellulaires multicue par photomodèlement UV de substrats de culture cellulaire tridimensionnels
Dans cet article
Résumé
Traditionnellement, la culture cellulaire est réalisée sur des substrats planaires qui imitent mal l’environnement naturel des cellules in vivo. Nous décrivons ici une méthode pour produire des substrats de culture cellulaire avec des géométries courbes physiologiquement pertinentes et des protéines extracellulaires micromotifs, permettant des recherches systématiques sur la détection cellulaire de ces signaux extracellulaires.
Résumé
La matrice extracellulaire est un régulateur important de la fonction cellulaire. Il a été de plus en plus démontré que les indices environnementaux existant dans le microenvironnement cellulaire, tels que la distribution des ligands et la géométrie des tissus, jouent un rôle essentiel dans la gouvernance du phénotype et du comportement cellulaires. Cependant, ces indices environnementaux et leurs effets sur les cellules sont souvent étudiés séparément à l’aide de plates-formes in vitro qui isolent des indices individuels, une stratégie qui simplifie fortement la situation complexe in vivo de plusieurs indices. Les approches d’ingénierie peuvent être particulièrement utiles pour combler cette lacune, en développant des configurations expérimentales qui capturent la complexité du microenvironnement in vivo , tout en conservant le degré de précision et de manipulabilité des systèmes in vitro .
Cette étude met en évidence une approche combinant le modelage protéique à base d’ultraviolets (UV) et la microfabrication de substrats à base de lithographie, qui, ensemble, permettent une étude à haut débit des comportements cellulaires dans des environnements multicue. Grâce au photomodèlement UV sans masque, il est possible de créer des distributions de protéines adhésives complexes sur des substrats de culture cellulaire tridimensionnels (3D) sur des puces contenant une variété d’indices géométriques bien définis. La technique proposée peut être utilisée pour des substrats de culture fabriqués à partir de différents matériaux polymères et combinés avec des zones à motifs adhésifs d’un large éventail de protéines. Avec cette approche, les cellules individuelles, ainsi que les monocouches, peuvent être soumises à des combinaisons d’indices géométriques et de repères de guidage de contact présentés par les substrats à motifs. La recherche systématique utilisant des combinaisons de matériaux de puces, de modèles de protéines et de types de cellules peut ainsi fournir des informations fondamentales sur les réponses cellulaires aux environnements multicues.
Introduction
In vivo, les cellules sont soumises à une grande variété d’indices environnementaux qui peuvent être de nature mécanique, physique et biochimique et qui proviennent de la matrice extracellulaire (ECM). De nombreux indices environnementaux ont été identifiés pour jouer un rôle vital dans la régulation du comportement cellulaire, tels que la prolifération, la différenciation et la migration 1,2,3,4,5. L’un des phénomènes les plus étudiés est le guidage par contact, décrivant l’alignement cellulaire médié par l’adhésion le long de modèles biochimiques ou topographiques anisotropes présents sur le substrat extracellulaire 6,7,8,9,10,11. En plus de diriger l’alignement des cellules, il a également été démontré que les signaux de guidage par contact influencent d’autres propriétés cellulaires telles que la migration cellulaire, l’organisation des protéines intracellulaires, la forme cellulaire et le devenir cellulaire 12,13,14,15. En outre, l’architecture géométrique de l’environnement cellulaire 3D a également été reconnue pour son influence régulatrice sur le comportement cellulaire16,17. Dans le corps humain, les cellules sont exposées à une gamme de géométries incurvées, allant des fibres de collagène à l’échelle microscopique, des capillaires et des glomérules, jusqu’aux alvéoles et artères à méso-échelle18,19. Fait intéressant, des études in vitro récentes ont montré que les cellules peuvent détecter et répondre à de tels signaux physiques, de l’échelle nanométrique à la méso-échelle 20,21,22,23.
À ce jour, la plupart des études portant sur la réponse des cellules aux signaux environnementaux ont été en grande partie réalisées à l’aide de configurations expérimentales qui isolent des signaux uniques. Bien que cette approche ait permis d’énormes progrès dans la compréhension des mécanismes de base de la détection cellulaire des signaux environnementaux, elle récapitule mal l’environnement in vivo qui présente simultanément plusieurs indices. Pour combler ce fossé, il est utile de développer des plates-formes de culture permettant de contrôler indépendamment et simultanément plusieurs indices environnementaux. Ce concept a gagné en popularité ces derniers temps 24,25, avec des études combinant la rigidité de la matrice et la densité du ligand 26,27,28,29, la rigidité et la porosité du substrat30, la rigidité du substrat et le volume de microniche 3D31, la topographie de surface et les indices de guidage par contact 32,33,34 , et des signaux de guidage de contact à l’échelle nanométrique avec des indices de guidage de courbure à méso-échelle23. Cependant, il reste difficile de combiner des repères de guidage de contact avec une variété de géométries 3D de manière contrôlée et à haut débit.
Ce protocole de recherche répond à ce défi et introduit une méthode pour créer des substrats de culture cellulaire avec une combinaison contrôlée de zones adhésives à motifs de protéines ECM (signaux de guidage par contact) et de courbure du substrat (indices géométriques). Cette approche permet la dissection de la réponse cellulaire dans un environnement biomimétique multicue de manière systématique et à haut débit. Les connaissances acquises peuvent aider à mieux comprendre le comportement des cellules dans des environnements complexes et peuvent être utilisées pour concevoir des matériaux instructifs avec des propriétés qui orientent les réponses cellulaires vers un résultat souhaité.
Photomodèlement de protéines 3D
La création de zones adhésives de protéines ECM (signaux de guidage par contact) sur des matériaux de culture cellulaire peut être réalisée à l’aide de diverses techniques, par exemple par modelage ultraviolet profond (UV profond) ou impression par microcontact35,36. Le motif UV profond utilise la lumière UV projetée à travers un masque sur un matériau polymère pour dégrader les polymères de passivation à des endroits spécifiques sur le substrat de culture cellulaire. Le substrat à motifs est ensuite incubé avec un ligand d’intérêt, ce qui donne des zones adhésives qui soutiennent la fixation cellulaire et la culture sur des emplacements prédéfinis 12,37,38. Une autre façon d’introduire des motifs protéiques consiste à imprimer par microcontact, où des tampons élastomères contenant une forme souhaitée sont recouverts d’une protéine de choix et sont pressés sur un substrat de culture cellulaire, transférant ainsi le revêtement protéique auquel les cellules peuvent adhérer 35,37,39,40 . Malheureusement, étant donné que les deux techniques reposent sur la préparation du masque et les méthodes de lithographie douce, les expériences prennent beaucoup de temps et de main-d’œuvre, ainsi que sont limitées en termes de flexibilité du motif. En outre, les motifs UV profonds et l’impression par microcontact sont les plus adaptés aux matériaux planaires et sont techniquement difficiles, voire impossibles, pour les ligands de motifs dans un environnement 3D.
Pour améliorer ces méthodes conventionnelles, Waterkotte et al. ont combiné la lithographie sans masque, le dépôt chimique en phase vapeur et le thermoformage pour générer des substrats polymères 3D micromotifs41. Cependant, cette technique repose sur l’utilisation de films polymères thermoformables et offre une faible résolution de motif protéique (7,5 μm), tandis que les cellules ont été rapportées pour répondre à des motifs protéiques géométriques aussi petits que 0,1 μm 2,42. Sevcik et al. ont décrit une autre méthode prometteuse pour nanomotif des ligands ECM sur des substrats contenant des topographies nanométriques et micrométriques43. À l’aide de l’impression par microcontact, les protéines ECM ont été transférées des tampons de polydiméthylsiloxane (PDMS) vers un substrat de poly(N-isopropylacrylamide) (pNIPAM) thermoréactif. Par la suite, la propriété thermorésensible du réseau pNIPAM leur a permis de transférer le motif protéique bidimensionnel (2D) sur un substrat PDMS topographique (rainures profondes de 10 à 100 μm), contrôlant ainsi la localisation des sites d’adhésion sur les caractéristiques topographiques. Cependant, toutes les microtopographies possibles ne peuvent pas être modélisées, car la diminution des problèmes de mouillabilité rend plus difficile le modelage de substrats topographiques plus profonds. Les tranchées avec un rapport d’aspect profondeur/largeur de 2,4 ont été signalées comme étant la limite ultime pour transférer avec succès le motif sur le substrat topographique43. De plus, la flexibilité des différents motifs et la résolution des motifs générés sont médiocres en raison de l’exigence de l’impression par microcontact.
Cet article décrit une méthode qui surmonte les goulots d’étranglement mentionnés ci-dessus et offre une méthode flexible et à haut débit pour créer des substrats multicue pouvant être utilisés pour la culture cellulaire (voir Figure 1). Les géométries physiologiquement pertinentes (cylindres, dômes, ellipses et surfaces de selle) avec des courbures allant de ĸ = 1/2500 à ĸ = 1/125 μm-1 sont préconçues et microfabriquées dans des puces PDMS. Par la suite, des repères de guidage de contact sont créés au-dessus des géométries 3D à l’aide d’une variété de conceptions de motifs numériques en utilisant une technique de photomotérision avec une résolution aussi petite que 1,5 μm44. À cette fin, les puces PDMS sont initialement passivées pour empêcher les cellules et les protéines d’adhérer; cette couche de passivation peut ensuite être éliminée par combinaison du photoinitiateur chlorure de 4-benzoylbenzyl-triméthylammonium (PLPP) et de l’exposition aux rayons UV45. Un masque numérique est conçu pour spécifier les emplacements d’exposition aux UV et, par conséquent, la zone où la couche de passivation est retirée. Les protéines peuvent ensuite adhérer à ces zones, ce qui permet la fixation cellulaire. Étant donné que le motif est effectué à l’aide d’un masque numérique (plutôt que physique), une variété de motifs peut être créée rapidement sans les tracas et les coûts associés à la conception et à la fabrication de photomasques supplémentaires. En outre, une gamme variée de protéines ECM (par exemple, le collagène de type I, la gélatine et la fibronectine) peut être modelée sur le substrat. Bien que ce protocole soit réalisé à l’aide de puces de culture cellulaire en PDMS, le principe peut être appliqué à tout autre matériau d’intérêt46.
Protocole
Dans les études décrites dans ce protocole, des kératocytes humains primaires ont été utilisés. Cette recherche a été réalisée conformément aux principes de la Déclaration d’Helsinki. Les kératocytes primaires ont été isolés à partir de restes de tissus cornéoscléraux cadavériques humains provenant de la chirurgie de kératoplastie endothéliale à membrane descemets, qui ont été obtenus auprès du département de cornée du Centre multi-tissus ETB-BISLIFE (Beverwijk, Pays-Bas) après avoir obtenu le consentement du plus proche parent de tous les donneurs décédés.
REMARQUE : Consultez le tableau des matériaux pour plus de détails sur tous les matériaux, réactifs, équipements et logiciels utilisés dans ce protocole.
1. Fabrication de substrats de culture cellulaire 3D
- Créez un moule en verre négatif (#1) contenant toutes les caractéristiques d’intérêt, dans ce cas, fabriqué à partir de verre à l’aide d’une technique d’écriture directe au laser femtoseconde (voir Figure 2).
- Placez soigneusement le moule en verre négatif (#1) sur le fond d’une boîte de Pétri.
- Préparez un prépolymère PDMS en plaçant un tube conique vide de 50 mL sur une balance, tarez la balance et versez la quantité souhaitée de base d’élastomère de silicone dans le tube.
- Ajouter l’agent de durcissement à l’aide d’un pipet Pasteur de sorte que le rapport final de la base d’élastomère et de l’agent de durcissement soit de 10:1 (p / p).
- Bien mélanger les composants dans le tube conique à l’aide d’une spatule.
- Centrifuger à 2 000 × g pendant 70 s pour éliminer toutes les bulles d’air.
- Versez le prépolymère PDMS sur le moule en verre négatif (#1) dans la boîte de Petri pour le recouvrir complètement.
- Placez la boîte de Petri avec le moule en verre négatif (#1) et le prépolymère PDMS dans le dessiccateur sous vide et démarrez la pompe à vide. Une fois le vide atteint, attendez 5 minutes pour éliminer toutes les bulles présentes à l’interface entre la surface du moule et le prépolymère PDMS.
- Retirez le vide et sortez la boîte de Petri du dessiccateur.
- Durcir le prépolymère PDMS pendant la nuit au four à 65 °C.
- Retirez soigneusement la puce PDMS positive nouvellement durcie (n ° 2) du moule en verre négatif (n ° 1) en soulevant les bords du PDMS à l’aide d’une spatule. Si la puce PDMS positive (#2) a tendance à coller au moule en verre négatif (#1), ajoutez de l’éthanol ou de l’eau sur les bords de l’empreinte pendant le levage.
REMARQUE: Le fluide s’écoulera entre les deux couches et facilitera la séparation du moule en verre négatif (n ° 1) et de la puce PDMS positive (n ° 2). - À l’aide d’une lame, coupez les côtés de la puce PDMS positive (#2) afin qu’une puce rectangulaire reste.
- Placez la puce PDMS positive (#2) dans un dessiccateur à côté d’un petit flacon avec une gouttelette de tridécafluoro(1,1,2,2-tétrahydrooctyl)trichlorosilane, un agent de silanisation, et laissez-la sous vide pendant la nuit.
REMARQUE: Silanization s’assurera que l’empreinte ne se liera pas à d’autres couches PDMS plus tard dans le protocole. D’autres agents et/ou méthodes de silanisation peuvent également fonctionner pour s’assurer que les surfaces des puces PDMS ne colleront pas à d’autres couches PDMS.
ATTENTION : Le tridécafluoro(1,1,2,2-tétrahydrooctyl)trichlorosilane est inflammable (H226) et provoque de graves brûlures cutanées et des lésions oculaires (H314). Portez un équipement de protection individuelle, travaillez dans une hotte et lavez-vous soigneusement les mains après la manipulation. Gardez l’agent de silanisation à l’écart de la chaleur, des surfaces chaudes, des étincelles, des flammes nues et d’autres sources d’inflammation. Conserver entre 15 et 30 °C (P280, P210, P240, P403, P235, P310). - Retirez le vide et placez la puce PDMS positive (#2) sur le fond d’une boîte de Pétri. Versez le prépolymère PDMS (10:1) sur le dessus pour produire plusieurs moules PDMS négatifs (#3).
- Mettez la boîte de Petri sous vide dans le dessiccateur pendant 15 minutes pour enlever toutes les bulles.
- Durcissez le prépolymère PDMS à 65 °C pendant la nuit, après quoi le moule PDMS négatif (#3) peut être décollé de la puce PDMS positive (#2) à l’aide d’une spatule.
- Silaniser le moule PDMS négatif final (#3) en utilisant un agent de silanisation dans un dessiccateur sous vide pendant la nuit.
- Produire plusieurs puces de culture cellulaire (#4, voir Figure 2) d’environ 5 mm d’épaisseur en versant du prépolymère PDMS dans le moule PDMS négatif (#3), en enlevant les bulles à l’aide du dessiccateur et en durcissant pendant 3 h à 65 °C. À l’aide d’une lame de rasoir, coupez la puce à la taille finale telle que visualisée à la figure 2. Conservez les copeaux à température ambiante.
REMARQUE: La rugosité de surface peut influencer la réponse cellulaire. Si nécessaire, une fine couche supplémentaire de PDMS peut être utilisée comme revêtement sur la puce PDMS positive (#2) pour lisser la surface. Pour ce faire, versez une petite gouttelette de prépolymère PDMS sur la puce et étalez-la sur la puce complète à l’aide d’air sous pression. Durcir la puce enduite à 65 °C pendant 3 h et continuer avec l’étape 1.12.
2. Fabrication d’échantillons PDMS plats (échantillons témoins)
- Préparez le prépolymère PDMS (10:1) conformément aux étapes 1.3-1.6.
- Placez un couvercle en verre sur le poteau d’aspiration arrondi au centre de l’enrobeur de spin.
- Allumez le vide pour fixer le couvercle en verre à la machine et pipetez une gouttelette de PDMS au milieu du couvercle à l’aide d’un tuyau Pasteur.
- Répartir le prépolymère PDMS sur le substrat de verre en utilisant le protocole suivant pour obtenir une couche d’environ 10 μm d’épaisseur.
- Spincoat pendant 10 s à 0,45 × g, accélération : 0,2 × g/s.
- Spincoat pendant 50 s à 44,8 × g, accélération : 0,54 × g/s.
- Éteignez l’aspirateur, retirez le couvercle du revêtement à l’aide d’une pince à épiler et placez-le dans une boîte de Pétri. Durcissez le PDMS pendant la nuit au four à 65 °C et conservez-le ensuite à température ambiante.
3. Passivation du substrat des substrats de culture cellulaire 3D
- Activez les groupes hydroxyles à la surface de la puce PDMS (#4) à l’aide du plasma O2. À l’aide d’une pince à épiler, placez la puce dans le panier de l’asher plasma.
- Exécutez un cycle de cendres en utilisant une puissance de 20 W pendant 30 s. Ventilez la chambre de cendres à l’aide de N2.
- Sortez la puce du panier et placez-la dans un petit récipient PDMS (voir Figure 1).
- À l’aide d’un pipet Pasteur, ajouter 500 μL de poly-L-lysine (PLL, 0,01%) sur le dessus de la puce afin que toute la surface soit immergée dans la solution PLL. Incuber pendant 30 min à température ambiante.
- Retirer 450 μL de la LPL de la puce de culture cellulaire à l’aide d’une pipette et rincer la surface de la puce trois fois avec 500 μL de tampon HEPES de 0,1 M (8 < pH < 8,5). Laissez toujours un petit volume de liquide sur la puce PDMS pour éviter le dessèchement de l’échantillon, ce qui réduira la qualité finale du motif.
- Produire 500 μL d’un valérate de méthoxypolyéthylène glycol-succinimidyle de 50 mg/mL (mPEG-SVA; MW 5 000 Da) dans un tampon HEPES de 0,1 M (8 < pH < 8,5) par puce de culture cellulaire et laisser incuber sur l’échantillon pendant 60 min. Étant donné que le mPEG-SVA a une demi-vie de 15 min, assurez-vous de préparer la quantité requise juste avant utilisation.
REMARQUE: Le mPEG-SVA est dissous lorsque la solution est complètement transparente. - Retirer 450 μL de la solution mPEG-SVA à l’aide d’un micropipet et laver la surface de la puce cinq fois avec une solution saline tamponnée au phosphate (PBS). Assurez-vous de pipeter de haut en bas plusieurs fois par lavage pour vous assurer que tout mPEG-SVA non lié est retiré. Pour éviter que l’échantillon ne se dessèche, minimisez le temps entre les étapes de lavage et assurez-vous d’utiliser un excès (500 μL ou plus) de PBS pour le lavage.
- Stockez les échantillons en les immergeant dans PBS ou passez à l’étape de modélisation du protocole.
REMARQUE: Si vous le souhaitez, la passivation peut être effectuée dans des conditions stériles lorsque vous travaillez dans une armoire de culture et que vous travaillez avec des solutions et des équipements stériles.
4. Stockage de substrats de culture cellulaire à motifs
REMARQUE: Les substrats de culture cellulaire 3D peuvent être stockés à différentes étapes du processus.
- Conservez les puces de culture cellulaire PDMS durcies dans des conditions sèches à température ambiante.
- Stockez les puces de culture cellulaire passivées de l’une des deux manières suivantes :
- Conserver dans PBS à 4 °C jusqu’à 7 jours.
- Conserver dans des conditions sèches jusqu’à plusieurs mois. Pour obtenir des échantillons secs, retirer le PBS et rincer plusieurs fois à l’eau distillée double (ddH2O). Sécher à l’aide d’un pistolet à azote ou à air.
5. Conception de masques numériques utilisés pour le photomodèlement
REMARQUE: La modélisation des substrats 3D peut être effectuée à l’aide d’un ou de plusieurs plans focaux (voir Figure 3). Un seul plan focal peut être utilisé sur des entités qui ne sont pas plus grandes qu’un dispositif de miroir numérique (DMD, environ 300 μm x 500 μm) et qui ne sont pas trop hautes (50-100 μm). Dans ce cas, concevez un motif numérique à l’aide du mode TIFF. Pour les caractéristiques qui dépassent les dimensions d’un DMD et sont relativement hautes, divisez le motif du substrat en plusieurs étapes. Dans ce cas, plusieurs motifs sont conçus à l’aide du mode PDF qui se concentrent tous individuellement sur des plans focaux uniques.
- Concevez un masque numérique à l’aide d’outils logiciels de conception.
- Motifs en mode TIFF (pixels) : Créez un plan de travail entièrement noir de 1 140 x 1 824 pixels (la taille exacte de 1 DMD, environ 300 μm x 500 μm) et remplissez le plan de travail avec les formes d’intérêt. Exportez le plan de travail sous la forme d’un fichier TIFF 8 bits.
REMARQUE: Différents niveaux de gris dans la conception du motif déterminent la quantité d’exposition qui sera effectuée à cet endroit. - Motifs en mode PDF (unités métriques) : Créez un plan de travail noir de la taille souhaitée en mm et remplissez le plan de travail avec n’importe quelle forme d’intérêt. Divisez le motif en plusieurs fichiers si le substrat 3D doit être modelé à l’aide de plusieurs plans focaux. Enregistrez le plan de travail en tant que fichier PDF.
REMARQUE: Différents niveaux de gris dans la conception du motif déterminent la quantité d’exposition qui sera effectuée à cet endroit.
- Motifs en mode TIFF (pixels) : Créez un plan de travail entièrement noir de 1 140 x 1 824 pixels (la taille exacte de 1 DMD, environ 300 μm x 500 μm) et remplissez le plan de travail avec les formes d’intérêt. Exportez le plan de travail sous la forme d’un fichier TIFF 8 bits.
6. Photomodèlement UV de substrats de culture cellulaire 3D
- Étalonnage
REMARQUE: L’étalonnage du laser est effectué pour obtenir une mise au point appropriée sur le matériau d’intérêt. Étant donné que les substrats de culture cellulaire PDMS sont trop épais pour être modelés, utilisez une lame de verre sur laquelle la puce est placée à l’envers. Puisque le laser rencontre la lame de verre en premier, utilisez du verre pour calibrer le laser.- Appliquez un surligneur fluorescent sur un couvercle en verre et placez le couvercle en verre dans la scène du microscope fluorescent. Assurez-vous que la surface en surbrillance est orientée vers le haut.
- Allumez le microscope et l’équipement PRIMO et ouvrez Micro-manager pour accéder au logiciel Leonardo sous 'plugins'.
- Choisissez Calibration dans le menu initial, puis sélectionnez l’objectif 20x à la fois sur le microscope et dans le logiciel. Cliquez sur Suivant.
- Placez la lame de verre avec un surligneur fluorescent dans le chemin optique du microscope. Passez en mode fluorescent et concentrez-vous soigneusement sur l’image PRIMO qui apparaît, en vous assurant que le logo et le texte sont au point. Cliquez sur Suivant pour terminer la procédure d’étalonnage.
- Notez l’emplacement Z de la scène lors de l’étalonnage et utilisez cet emplacement comme référence plus loin dans le protocole.
REMARQUE: Le matériau d’étalonnage doit correspondre au matériau utilisé pour le modelage plus tard dans le protocole. Les étapes ci-dessus décrivent l’étalonnage nécessaire pour les substrats de culture cellulaire. Pour l’étalonnage des échantillons de contrôle PDMS plats, appliquez un surligneur fluorescent sur un échantillon PDMS plat supplémentaire et étalonnez-le à l’aide des étapes 6.1.2 à 6.1.5.
- Modelage d’entités 3D à l’aide d’un seul plan focal
REMARQUE: La modélisation à l’aide d’un seul plan focal est effectuée sur des entités 3D qui ne dépassent pas les dimensions d’une DMD (environ 300 μm x 500 μm). Un schéma de la configuration du plan focal est illustré à la figure 3.- Retirez la lame d’étalonnage de la scène et placez une lame de verre contenant une gouttelette (~50 μL) de photoinitiateur (PLPP) dans la scène.
ATTENTION : Le PLPP est irritant pour les yeux, le système respiratoire et la peau (R36-38). Portez un équipement de protection individuelle, tenez-le à l’écart des matières explosives, n’ajoutez jamais d’eau à ce produit, prenez des mesures de précaution contre les décharges statiques et évitez les chocs et les frottements (S26-36). - Placez le substrat de culture cellulaire PDMS à l’envers dans la gouttelette du photoinitiateur. Assurez-vous que les caractéristiques 3D à la surface du substrat de culture cellulaire font face à la lame de verre et sont complètement immergées dans le PLPP pour assurer un motif approprié.
- Sélectionnez Modèle dans le logiciel.
- Passez en mode champ clair sur le microscope et déplacez la scène vers la fonction d’intérêt.
- Concentrez-vous respectivement sur le haut ou le bas des structures convexes et concaves (Figure 3).
- Sélectionnez PRIMO pour insérer un motif de votre choix. Observez l’aperçu du motif en orange au-dessus de l’image en plein champ lumineux.
- Ajustez les paramètres de motif en fonction de la fonction (emplacement, angle, répétitions) et sélectionnez une dose de 1 000 mJ/mm2.
- Cliquez sur Verrouiller et basculez le microscope en mode fluorescent .
- Cliquez sur le bouton Lecture en bas à droite de l’écran pour lancer le motif. Une fois terminé, observez le motif affiché en vert.
- Une fois que vous avez terminé avec toutes les caractéristiques d’une puce de culture cellulaire, retirez la puce de la lame de motif et stockez-la dans PBS à 4 ° C.
- Retirez la lame d’étalonnage de la scène et placez une lame de verre contenant une gouttelette (~50 μL) de photoinitiateur (PLPP) dans la scène.
- Modelage de fonctions 3D à l’aide de plusieurs plans focaux
REMARQUE: La modélisation à l’aide de plusieurs plans focaux est effectuée sur des entités 3D plus grandes qu’une DMD (environ 300 μm x 500 μm) ou relativement hautes. Dans ce cas, les caractéristiques 3D doivent être modelées en plusieurs étapes, c’est-à-dire que la conception du motif doit être adaptée selon l’exemple de la figure 3.- Retirez la lame d’étalonnage de la scène et placez une lame de verre contenant une gouttelette (~50 μL) de photoinitiateur (PLPP) dans la scène.
- Placez la puce de culture cellulaire PDMS à l’envers dans la gouttelette du photoinitiateur à l’aide d’une pince à épiler.
- Sélectionnez Modèle dans le logiciel. Passez en mode champ clair sur le microscope et déplacez la scène vers la fonction d’intérêt.
- Concentrez-vous sur la zone de la puce au bon endroit. Étant donné que le motif est effectué dans un seul plan focal et que les caractéristiques sont plus grandes qu’un seul DMD, utilisez plusieurs plans focaux et donc plusieurs tours de motif par substrat 3D pour assurer une résolution de motif suffisante sur toute la hauteur et la largeur de la fonction (voir Figure 3). Par exemple, pour une entité d’une hauteur de 150 μm, motifz la fonction en trois tours (± 1 plan focal pour 50 μm de course Z), en focalisant autour de 25 μm, 75 μm et 125 μm à partir du bas de la fonction. Assurez-vous que le bas de la fonction se trouve autour de la valeur écrite à l’étape 6.1.5.
- Sélectionnez PRIMO pour insérer le motif de votre choix. Observez l’aperçu du motif affiché en orange au-dessus de l’image en champ lumineux en direct.
- Ajustez les paramètres de motif en fonction de la fonction (emplacement, angle) et sélectionnez une dose de 1 000 mJ/mm2.
- Cliquez sur Verrouiller et basculez le microscope en mode fluorescent .
- Cliquez sur le bouton Lecture en bas à droite de l’écran pour lancer le motif. Une fois terminé, observez le motif affiché en vert.
- Répétez les étapes 6.3.4 à 6.3.8 sur la caractéristique d’intérêt lorsque plusieurs plans focaux sont utilisés.
- Une fois que vous avez terminé avec toutes les caractéristiques d’une puce de culture cellulaire, retirez la puce de la lame de motif et stockez-la dans PBS à 4 ° C.
REMARQUE: Si vous le souhaitez, appliquez le photomodèle UV dans des conditions stériles, en utilisant des boîtes de Petri à fond de verre et préparez tous les substrats dans des armoires de culture stériles. Conservez les échantillons à motifs dans PBS jusqu’à quelques semaines. Lorsqu’ils sont lavés avec du ddH2O et séchés à l’air sous pression, les échantillons peuvent être conservés jusqu’à quelques mois à 4 °C.
7. Incubation des protéines
REMARQUE: Il est conseillé d’utiliser des substrats fraîchement incubés de protéines pour la culture cellulaire. Ne passez à cette partie du protocole que si l’ensemencement cellulaire (étape 8) est effectué directement après.
- Transférez la puce de culture cellulaire à motifs dans des conteneurs PDMS stériles dans l’armoire de culture.
- Lavez les puces de culture cellulaire à motifs 3x avec un excès de PBS stérile si le motif n’a pas été effectué dans des conditions stériles.
- Préparez une solution protéique fraîche dans PBS.
- Fibronectine : ajouter 2 mL de PBS à l’aide d’un micropipet à un flacon de 20 μg de fibronectine marquée à la rhodamine pour obtenir une concentration de 10 μg/mL. Pipetez doucement pour éviter la formation d’amas de protéines et protéger de la lumière.
- Gélatine : décongeler une aliquote de 200 μL de gélatine-fluorescéine dissoute. Protéger de la lumière.
- Ajouter 200-500 μL de la solution protéique à la puce de culture cellulaire à l’aide d’un micropipet. Ajustez le temps d’incubation et la température en fonction de la protéine de choix : Fibronectine : 5 min à température ambiante, Gélatine : 15 min à 37°C. Assurez-vous de couvrir l’échantillon (p. ex., avec du papier d’aluminium).
- Retirer la solution protéique et laver 5x avec 500 μL de PBS stérile. Assurez-vous de pipeter le PBS de haut en bas plusieurs fois au-dessus de toutes les caractéristiques pertinentes de la puce de culture cellulaire pour éliminer toute protéine non liée.
REMARQUE: Pendant les étapes de lavage, il est crucial que l’échantillon ne sèche jamais. Lorsque vous retirez la solution protéique ou le PBS pendant le lavage, ajoutez immédiatement un nouveau PBS pour éviter la formation d’amas de protéines (voir la figure 4). Les caractéristiques convexes sont particulièrement sensibles au dessèchement car elles sont élevées au-dessus de la surface du substrat. - Facultatif : examiner les profils protéiques sous un microscope à fluorescence. Gardez les échantillons stériles et immergés dans PBS.
8. Ensemencement cellulaire
REMARQUE: Ce protocole utilise des kératocytes primaires humains et des fibroblastes dermiques humains. Les kératocytes ont été prélevés dans le tissu cornéen humain de patients, conformément aux directives néerlandaises pour l’utilisation secondaire de matériaux, et précédemment caractérisés comme des kératocytes47. Ces cellules sont cultivées dans du DMEM complété par 5 % de sérum fœtal bovin (FBS), 1 % de pénicilline/streptomycine (P/S) et 1 mM d’hydrate de sel de sesquimagnésium (vitamine C) de l’acide L-ascorbique 2-phosphate (vitamine C) à 37 °C pendant un maximum de quatre passages. Les fibroblastes dermiques humains ont été achetés et cultivés dans du DMEM complété par 10% de FBS et 1% de P / S à 37 ° C pour un maximum de 15 passages. Pour l’ensemencement des kératocytes et des fibroblastes dermiques sur la puce de culture cellulaire photomoulu, 20 000 cellules par puce ont été utilisées.
- Détachez les cellules d’intérêt (p. ex., à l’aide de trypsine) et préparez 1 mL d’une suspension cellulaire de ± 10 000 à 50 000 cellules/mL dans un milieu de culture par puce. Ajustez le nombre exact de cellules ajoutées par substrat en fonction de la taille de la cellule et de la lecture souhaitée.
- Retirez le PBS de la puce de culture cellulaire et ajoutez 1 mL de suspension cellulaire.
- Transporter doucement la puce de culture cellulaire avec les cellules jusqu’à l’incubateur et incuber pendant 60 min à 37 °C.
- Vérifiez l’adhérence des cellules sur la puce de culture cellulaire à motifs sous un microscope à fond clair. Recherchez les morphologies cellulaires allongées dans le cas de motifs linéaires (voir la figure 5). Si les cellules ont également commencé à adhérer à l’extérieur de la zone à motifs, retirez-les en pipetant le milieu de haut en bas directement au-dessus des cellules sur le substrat.
Remarque : Les cellules attachées à la zone à motifs resteront attachées, tandis que les cellules situées en dehors des zones à motifs se détacheront. - Retirez la puce de culture cellulaire du récipient PDMS et utilisez une pince à épiler stérile pour la placer dans une plaque de 6 puits remplie d’environ 5 mL de milieu de culture.
- Cultivez les cellules pendant la durée souhaitée. Remplacez le milieu de culture cellulaire tous les 2-3 jours. Pour assurer la visualisation du profil protéique après la culture cellulaire, réduisez la quantité d’exposition de l’échantillon à la lumière pendant la culture.
9. Coloration, acquisition et analyse d’images
- Fixation et coloration
- Après la durée de culture souhaitée, retirez presque tout le milieu et lavez trois fois avec un excès de PBS. Ensuite, incuber avec 3,7% de formol pendant 15 min à température ambiante suivi de trois étapes de lavage avec PBS pendant 5 min par lavage à température ambiante. Ne laissez jamais l’échantillon sécher.
ATTENTION : Le formol est nocif s’il est avalé ou inhalé (H302, H332), peut provoquer une réaction allergique cutanée (H317), est soupçonné de causer des anomalies génétiques (H341) et peut causer le cancer (H350). Portez un équipement de protection individuelle et travaillez dans une hotte aspirante. - Colorez le substrat de culture cellulaire avec les agents colorants ou les anticorps souhaités. Pour réduire les volumes d’agents colorants, placez les puces de culture cellulaire à l’envers dans une gouttelette de solution de coloration canalisée sur une lame de verre.
- Stocker les échantillons dans pbS (à court terme) ou fixés à un couvercle à l’aide d’un support de montage (à long terme) à 4 °C.
- Après la durée de culture souhaitée, retirez presque tout le milieu et lavez trois fois avec un excès de PBS. Ensuite, incuber avec 3,7% de formol pendant 15 min à température ambiante suivi de trois étapes de lavage avec PBS pendant 5 min par lavage à température ambiante. Ne laissez jamais l’échantillon sécher.
- Acquisition d’images
- Placez l’échantillon coloré à l’envers dans une gouttelette de PBS sur une lame de verre. Mettez l’échantillon au stade d’un microscope confocal.
- En fonction du niveau de détail requis, créez des piles Z avec un objectif approprié (10x, 20x ou 40x) et un espacement Z pour assurer une acquisition d’image correcte.
- Analyse et visualisation d’images
- Ouvrez les fichiers image bruts dans le logiciel d’analyse d’image et vérifiez que les propriétés de l’image (par exemple, les dimensions, la résolution) sont correctes.
- Ajustez la luminosité et le contraste par couche si nécessaire.
- Recadrez la région d’intérêt contenant le motif et les cellules.
- Facultatif : effectuez une étape de déconvolution si nécessaire.
- Créez un rendu 3D de la pile Z à l’aide d’un logiciel de rendu 3D.
- Optimisez les paramètres de contraste et de gain pour chaque canal individuel.
- Pour créer une image du rendu 3D, créez un instantané et exportez-le en tant que . Fichier TIFF.
- Pour créer un film du rendu 3D, définissez l’image de début et de fin ainsi que la période avant d’enregistrer le film. Exporter au .avi.
Résultats
Grâce au protocole décrit, les substrats de culture cellulaire 3D PDMS peuvent être photomotifs UV pour créer des zones adhésives précises et à haut débit adaptées à la fixation des cellules. De cette façon, les cellules sont soumises simultanément à des géométries de substrat pertinentes et à des motifs de ligands adhésifs. Les propriétés cellulaires telles que l’orientation, la surface cellulaire et le nombre d’adhérences focales peuvent facilement être surveillées et utilisées pour mieux comprendre le comportement cellulaire dans des environnements complexes de type in vivo.
Pour vérifier les événements de motif sur les substrats PDMS 3D, les compositions de surface atomique du matériau à différentes étapes du protocole ont été mesurées à l’aide de la spectroscopie photoélectronique atomique à rayons X (XPS)48. En résumé, les mesures XPS ont montré la présence de chaînes PEG avec un signal de carbone accru sur les échantillons passivés, qui a été réduit après photomodèlement. L’incubation avec la fibronectine a entraîné une augmentation du signal carbone, indiquant à nouveau une adhésion réussie des protéines à la surface de la puce de culture cellulaire. Ensuite, la résolution et l’alignement des motifs sur les entités 3D ont été caractérisés sur une variété de fosses concaves à motifs circulaires (ĸ = 1/250 μm-1, ĸ = 1/1 000 μm-1 et ĸ = 1/3 750 μm-1, voir la figure 6). D’après les projections d’intensité maximale, on peut conclure que le modèle protéique a été modelé avec succès sur les trois caractéristiques 3D. Le profil d’intensité de la figure 6A montre une résolution de motif élevée avec des transitions nettes entre les zones à motifs et les zones non modelées. De plus, une intensité protéique constante sur l’ensemble du schéma dans la fosse a été obtenue.
La fosse concave avec ĸ = 1/250 μm-1 a été modelée à l’aide de la méthode du plan focal unique (un motif), tandis que les fosses avec ĸ = 1/1 000 μm-1 et ĸ = 1/3 750 μm-1 ont été modelées à l’aide de deux et trois plans focaux (motifs), respectivement. Comme on peut le voir dans les projections d’intensité maximale de la figure 6, les deux méthodes permettent d’aligner parfaitement les motifs sur les caractéristiques. Aucune transition désalignée entre les deux plans focaux et modèles différents ne peut être observée.
En utilisant le protocole décrit, un large éventail de modèles de protéines peut être appliqué à une variété de géométries (voir la figure 7 et la vidéo 1). Pour illustrer la polyvalence de cette méthode, des demi-cylindres (convexes et concaves), une surface de selle et une fosse ont été modelés à l’aide de lignes et de cercles de différentes largeurs. Les matériaux photomotifs peuvent ensuite être utilisés pour la culture cellulaire (voir Figure 7, Figure 8, Vidéo 2, Vidéo 3 et Vidéo 4). Un exemple de fibroblastes dermiques cultivés sur un demi-cylindre concave à motifs (lignes de fibronectine, rouge, 5 μm de large et intervalles de 5 μm) est illustré à la figure 8, à la figure 9 et à la vidéo 4. Au cours de l’expérience, les cellules détectent et adhèrent au substrat de culture cellulaire multicue et restent viables au fil du temps. Comme le montre la coloration immunofluorescente de la figure 8, les cellules forment des adhérences focales (grappes de vinculine) principalement sur les lignées de fibronectine.
Un autre exemple d’étude utilisant ces matériaux de culture cellulaire a été récemment publié par notre groupe48. Dans cette étude, les myofibroblastes humains et les cellules endothéliales ont été soumis à la combinaison d’indices de guidage de contact et de topographies géométriques. In vivo, les deux types de cellules subissent des signaux de guidage de courbure et de contact dans les tissus natifs tels que le système vasculaire humain. En soumettant les cellules in vitro à un environnement qui combine les deux indices environnementaux, la situation in vivo peut être récapitulée, ce qui permet de mieux comprendre le rôle du microenvironnement sur le comportement cellulaire. Il a été démontré que les myofibroblastes humains s’alignent avec les signaux de guidage de contact (lignes de fibronectine parallèles) sur des substrats cylindriques concaves48. Cependant, sur les structures convexes avec des courbures croissantes, les indices géométriques ont annulé les indices biochimiques, suggérant que les myofibroblastes peuvent sentir à la fois le degré et le signe de courbure. Fait intéressant, les cellules endothéliales ne pouvaient adhérer qu’aux substrats multicues concaves et non aux substrats PDMS convexes. Sur des substrats concaves à motifs protéiques, les cellules endothéliales sont orientées dans la direction du repère de guidage de contact. Ces connaissances fondamentales in vitro ont une pertinence physiologique dans le domaine de l’ingénierie des tissus vasculaires et peuvent éventuellement aider à la conception de constructions d’ingénierie tissulaire intelligente.
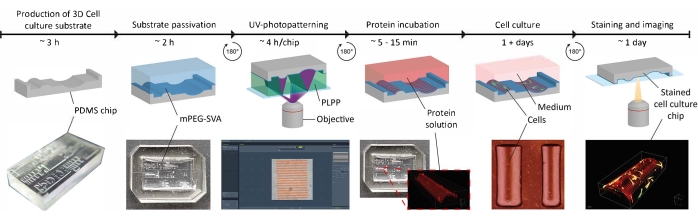
Figure 1 : Chronologie expérimentale de l’application d’indices de guidage de contact sur des substrats de culture cellulaire 3D. Tout d’abord, les puces de culture cellulaire positive sont produites à partir d’un moule PDMS négatif contenant une gamme de géométries. Le PDMS non durci est versé dans le moule et durci pendant 3 h à 65 °C. Par la suite, le PDMS est traité avec du plasma O2 et incubé avec de la LPL et du mPEG-SVA (bleu, marqué) pour passiver la surface du substrat de culture cellulaire. Après le lavage, le substrat est retourné à l’envers dans une gouttelette de photoinitiateur (PLPP, vert, étiqueté) et uv-photomotif en utilisant l’approche LIMAP. Ici, un masque numérique avec un motif défini par l’utilisateur est utilisé pour cliver la couche de passivation à des endroits définis. Ensuite, une solution protéique (rouge, étiquetée) peut être incubée et n’adhérera qu’aux endroits où la couche de passivation est enlevée. Les cellules ensemencées sur le substrat sont soumises à la fois à la géométrie et aux modèles protéiques, ce qui permet de rechercher le comportement cellulaire dans des environnements complexes imitant in vivo. Abréviations : PDMS = polydiméthylsiloxane; mPEG-SVA = valérate de méthoxypolyéthylène glycol-succinimidyle; PLPP = chlorure de 4-benzoylbenzyl-triméthylammonium; LIMAP = Adsorption moléculaire des protéines induite par la lumière. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Différentes étapes de la production et de la passivation du substrat de culture cellulaire 3D. Le moule en verre négatif (#1) est conçu avec un logiciel de conception assistée par ordinateur et produit à l’aide d’une technique d’écriture directe au laser femtoseconde. Ce moule est utilisé pour produire la puce PDMS positive intermédiaire (n ° 2) et la moisissure PDMS négative (n ° 3), qui sont ensuite utilisées pour produire la puce de culture cellulaire finale (n ° 4). Abréviation : PDMS = polydiméthylsiloxane. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Illustration schématique des deux méthodes de modélisation. Gauche : Le photomodèlement UV est effectué sur des caractéristiques plus petites (environ une DMD) à l’aide d’un seul plan focal et d’un seul motif. En conséquence, la fonctionnalité complète est modelée en une seule fois. Droite : Lorsque des entités plus grandes sont utilisées (plus grandes qu’une DMD), le motif est divisé sur plusieurs plans focaux et motifs. Abréviation : DMD = dispositif miroir numérique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
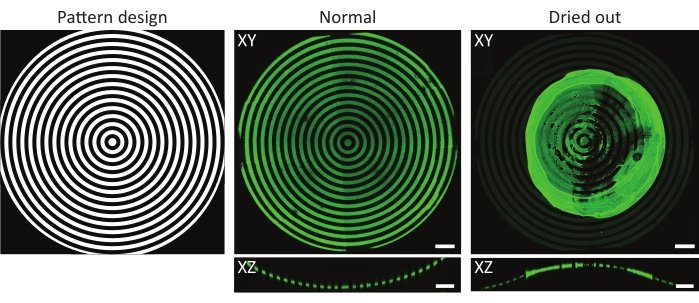
Figure 4 : Exemple typique d’un substrat incubé de protéines normal et desséché. Projections d’intensité maximale (XY) et vues orthogonales (XZ) de substrats incubés de protéines normaux et desséchés. Lors du lavage d’un substrat de culture cellulaire à motifs après incubation avec une solution protéique, il est crucial de toujours garder l’échantillon humide. Bien que le motif soit identique dans toutes les images sur les caractéristiques (ĸ = 1/1 000 μm-1), la gélatine-fluorescéine (verte) agrégée formant une touffe majeure lorsque l’échantillon a été laissé à sécher pendant quelques secondes. Si l’échantillon reste toujours humide, des profils protéiques corrects peuvent être observés. Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 5 : Images en champ clair après l’ensemencement. Kératocytes primaires (à gauche) et fibroblastes dermiques (à droite) 4 h après l’ensemencement sur des caractéristiques géométriques 3D (fosse concave de ĸ = 1/1 000 μm-1 et demi-cylindres de ĸ = 1/500, 1/375, 1/250, 1/175 et 1/125 μm-1). Les insertions en haut à gauche représentent le motif de ligne utilisé pour la modélisation des géométries. Les flèches blanches indiquent les cellules qui se propagent et qui montrent déjà un alignement. Barres d’échelle = 250 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
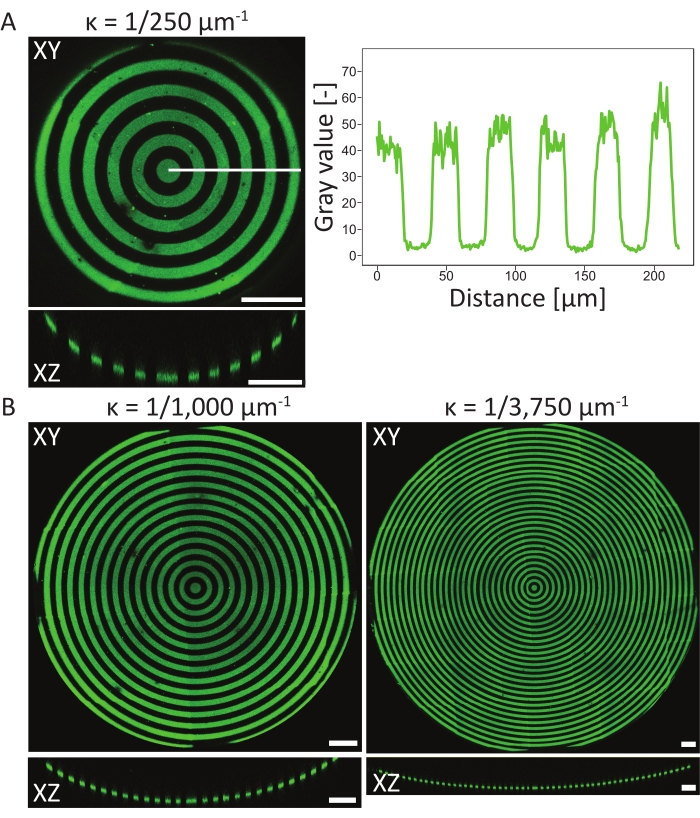
Figure 6 : Caractérisation des motifs circulaires sur les fosses concaves. (A) Projection d’intensité maximale (XY) et vue orthogonale (XZ) de la fosse d’aconcave (ĸ = 1/250 μm-1) modelée à l’aide de LIMAP (largeur de ligne: 20 μm, largeur de l’espace: 20 μm) et incubée avec de la gélatine-fluorescéine (vert). Le profil d’intensité le long de la ligne blanche est tracé par rapport à la distance, montrant une qualité et une résolution de motif cohérentes. (B) Motif supplémentaire effectué sur des fosses concaves avec ĸ = 1/1 000 μm-1 et ĸ = 1/3750 μm-1, montrant une flexibilité en termes de caractéristiques géométriques pouvant être utilisées pour le motif. Encore une fois, les projections d’intensité maximale (XY) et les vues orthogonales (XZ) sont visualisées. Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
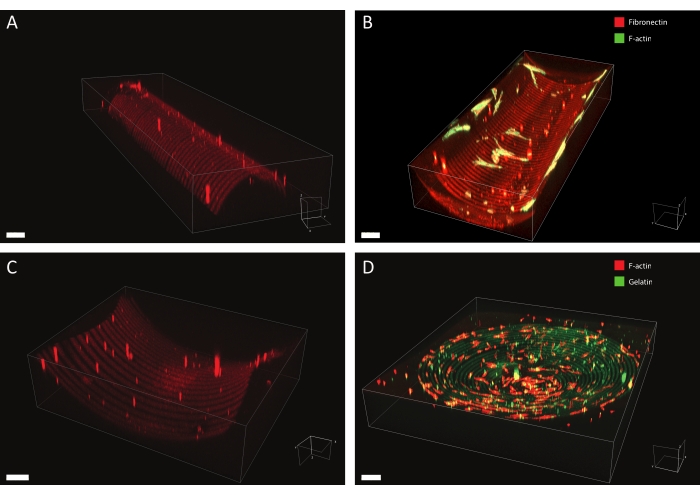
Figure 7 : Données de microscopie 3D de structures à motifs. Exemples typiques de matériaux de culture cellulaire à motifs 3D après photomotif et culture cellulaire, visualisés à l’aide d’un logiciel de rendu 3D. (A) Semicylindre convexe à motifs de lignes de 10 μm de large (rhodamine-fibronectine, rouge) et d’espaces de 10 μm de large. Barre d’échelle = 5 μm. (B) Fibroblastes dermiques colorés pour la F-actine (vert) cultivés sur des demi-cylindres concaves à motifs de lignes larges de 20 μm (rhodamine-fibronectine, rouge) et de 20 μm de larges espaces. Barre d’échelle = 5 μm. (C) Surface de la selle avec des lignes de 20 μm de large (rhodamine-fibronectine, rouge) et des espaces de 20 μm de large. Barre d’échelle = 5 μm. (D) Fosse concave à motifs de cercles concentriques de lignes de 20 μm de large (gélatine-fluorescéine, vert) et d’espaces de 20 μm de large. Le cytosquelette F-actine des kératocytes humains est coloré à l’aide de phalloïdine et visualisé en rouge. Barre d’échelle = 200 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 8 : Coloration immunofluorescente de fibroblastes dermiques humains sur un semicylindre concave photomotif. (A) Projection d’intensité maximale (XY) et sections orthogonales (XZ et YZ) de fibroblastes dermiques humains cultivés pendant 24 h sur un demi-cylindre concave à motifs (lignes de fibronectine, rouge, 5 μm de large et intervalles de 5 μm). Les cellules sont colorées pour la F-actine (magenta), la vinculine (vert) et les noyaux (bleu). Barre d’échelle = 100 μm. (B) Zoom avant d’une cellule adhérant à l’environnement multicue. Barres d’échelle = 50 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 9 : Images en champ continu en champ clair de fibroblastes dermiques humains sur un cylindre concave à motifs. Le semicylindre concave (ĸ = 1/250 μm-1) a été modelé avec des lignes parallèles (5 μm de large et 5 μm d’intervalles) et incubé avec de la rhodamine-fibronectine avant l’ensemencement cellulaire. L’imagerie timelapse est commencée 1 h après l’ensemencement initial des cellules (à gauche, 0 min), lorsque les cellules sont encore arrondies et non adhérentes (flèches). Après environ 24 h (milieu, 1 420 min), les cellules ont adhéré au substrat multicue et ont montré une réponse d’alignement selon le modèle de guidage de contact. La réponse d’alignement et la viabilité cellulaire sont maintenues pendant toute la durée de la culture (à droite, 3 180 min). Barres d’échelle = 200 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Vidéo 1 : Exemple de motif sur un substrat cylindrique 3D. Représentation 3D d’un cylindre convexe à motif de rhodamine-fibronectine (rouge). Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 2 : Représentation 3D de fibroblastes dermiques cultivés sur un substrat cylindrique 3D à motifs (ĸ = 1/500 μm-1). Fibroblastes dermiques cultivés pendant 24 h sur un demi-cylindre convexe à motifs (lignes de fibronectine, rouge, 10 μm de large et intervalles de 10 μm). Les cellules sont colorées pour la F-actine (magenta), la vinculine (vert) et les noyaux (bleu). Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 3 : Représentation 3D de kératocytes humains cultivés sur une fosse 3D à motifs (ĸ = 1/3 750 μm-1). Représentation 3D de kératocytes humains cultivés pendant 24 h dans une fosse concave à motifs (cercles de gélatine, verts, écarts de 20 μm de large et de 20 μm). Les cellules sont colorées pour la F-actine (rouge). Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 4 : Imagerie en timelapse en champ clair de fibroblastes dermiques humains sur un cylindre concave à motifs. Le semicylindre concave (ĸ = 1/250 μm-1) a été modelé avec des lignes parallèles (5 μm de large et 5 μm d’intervalles) et incubé avec de la rhodamine-fibronectine avant l’ensemencement cellulaire. L’imagerie timelapse est commencée 1 h après l’ensemencement initial des cellules, lorsque les cellules montrent une adhérence initiale à l’environnement multicue. Pendant le timelapse complet, les cellules s’orientent principalement le long des signaux de guidage de contact, tandis que la viabilité cellulaire est maintenue. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
De nos jours, le comportement cellulaire est souvent étudié sur des substrats de culture plats qui n’ont pas la complexité du microenvironnement cellulaire natif. Les environnements 3D tels que les échafaudages et les hydrogels sont utilisés comme alternative. Bien que ces environnements de culture cellulaire améliorent la pertinence in vivo, les études systématiques du comportement cellulaire et la faisabilité des méthodes de lecture restent difficiles. Pour étudier systématiquement le comportement cellulaire sur des substrats de culture représentatifs, des substrats multicue cohérents permettant une lecture microscopique sont nécessaires. Par conséquent, dans ce protocole, nous décrivons une méthode pour créer des substrats de culture cellulaire multicue avec des géométries physiologiquement pertinentes et des protéines ECM à motifs. Le principal défi dans la combinaison d’indices environnementaux tels que la géométrie des tissus et les signaux de guidage de contact sur des plates-formes in vitro est en grande partie de nature technologique. Les méthodes conventionnelles d’application d’indices de guidage par contact (p. ex., lithographie douce, motif UV profond et impression par microcontact35,36) aux matériaux de culture cellulaire ont été optimisées pour les substrats planaires. Le besoin de matériaux de culture cellulaire 3D combinés à des indices de guidage par contact a mis en évidence plusieurs défis technologiques, tels qu’un mauvais alignement des motifs, une résolution et une flexibilité. Pour surmonter ces défis, une méthode de motif à haut débit, sans masque et basée sur la lumière peut être utilisée45,49. Ici, un microscope optique permet un alignement précis du motif et une résolution de l’ordre du micromètre (voir figure 6). En outre, l’utilisation d’un masque numérique permet aux chercheurs d’étudier le comportement cellulaire sur un large éventail de modèles sans avoir besoin de fabriquer des masques physiques à forte intensité de main-d’œuvre.
L’approche UV-photomodèlement peut être utilisée en combinaison avec une variété de géométries 3D (par exemple, cylindres, selles, dômes, fosses) produites à partir d’une gamme de matériaux48. Les substrats de culture cellulaire 3D utilisés dans cette étude sont fabriqués à partir de PDMS; cependant, d’autres matériaux peuvent également être utilisés. Cela peut nécessiter différentes étapes pour produire le substrat de culture cellulaire final contenant les caractéristiques d’intérêt. Étant donné qu’il a été démontré que les cellules sont sensibles à la rugosité de surface des matériaux de culture cellulaire, il est important de créer les puces de culture cellulaire avec une surface lisse afin que la réponse des cellules observées puisse être entièrement attribuable à la géométrie 3D et aux signaux de guidage par contact50,51. Des méthodes de mesure telles que la profilométrie optique, la microscopie électronique à balayage ou la microscopie à force atomique peuvent être utilisées pour mesurer la rugosité de surface. Après la fabrication du matériau de culture cellulaire, on peut sélectionner une méthode de modelage basée sur un ou plusieurs plans focaux en fonction des dimensions spécifiques de la caractéristique d’intérêt (voir figure 3). En règle générale, un seul plan focal est utilisé pour modeler une zone dans une plage Z d’environ 50 μm. La résolution du modèle s’est avérée cohérente à l’aide de cette règle empirique (voir la figure 6). Cependant, un inconvénient de cette méthode est l’augmentation du temps de modélisation avec l’introduction de plusieurs plans et motifs focaux. Dans notre main, en utilisant plusieurs plans focaux, des caractéristiques géométriques 3D allant jusqu’à 16 mm x 16 mm x 0,17 mm (X x Y x Z) ont été modelées avec succès avec une qualité de motif élevée.
De plus, il est important de mentionner que la hauteur (axe Z) des caractéristiques géométriques qui peuvent être utilisées en combinaison avec ce protocole est limitée. Étant donné que le photomodèlement UV et de nombreuses lectures cellulaires reposent sur une configuration de microscopie, la distance de travail des objectifs détermine la hauteur maximale d’une caractéristique. Dans notre main, les géométries dépassant une hauteur de 300 μm peuvent toujours être photo-modelées UV, et les lectures ont été effectuées à l’aide d’un microscope confocal avec des objectifs 40x. Ainsi, la recherche mécanobiologique allant de l’intracellulaire à l’échelle cellulaire et tissulaire est possible en utilisant le protocole décrit.
Un autre facteur à prendre en compte est le risque de dessèchement des échantillons pendant ou après le photomodèlement UV49. Ceci est particulièrement pertinent lors de l’utilisation de géométries 3D, car les convexités sont souvent exposées en dehors des matériaux de culture cellulaire. Comme le montre la figure 4, cela pourrait entraîner des modèles inégaux avec des agrégats de protéines se formant au-dessus de la caractéristique d’intérêt. Le lavage des puces de culture cellulaire après l’incubation des protéines et pendant la culture cellulaire est essentiel pour le revêtement approprié des géométries 3D. Par conséquent, il est conseillé de toujours laisser de petits volumes d’une solution de travail (PBS, PLPP, solution protéique, milieu de culture cellulaire) sur la puce de culture cellulaire.
Jusqu’à présent, plusieurs revêtements protéiques (fibronectine, collagène de type I et IV, gélatine, FNC) et types de cellules (cellules stromales de la moelle osseuse humaine, myofibroblastes humains, cellules endothéliales humaines, kératocytes humains et fibroblastes dermiques) ont été utilisés en combinaison avec l’approche de photomodélisme décrite sur des matériaux de culture cellulaire structurés. Comme l’a montré une étude précédente48, l’optimisation des paramètres d’incubation des protéines est essentielle pour l’étude systématique de nouveaux types de cellules. Par conséquent, avant d’effectuer une nouvelle expérience avec de nouvelles protéines ou cellules, il est conseillé de tester une gamme de concentrations de protéines, de températures d’incubation et de temps d’incubation. En comparant la morphologie cellulaire après l’adhésion initiale sur des zones plates homogènes et à motifs avec la morphologie cellulaire dans des conditions de culture cellulaire « normales », un ensemble optimisé de paramètres expérimentaux peut être obtenu. De plus, chaque type de cellule peut nécessiter un temps différent après l’ensemencement pour montrer une morphologie d’adhérence reconnaissable sur un environnement multicue spécifique (voir la figure 5). À cette fin, il est crucial d’optimiser le temps nécessaire par type de cellule pour présenter les événements de contact sur la zone à motifs pendant le lavage à l’étape 8.4. Par exemple, nous avons observé que sur les modèles en ligne, les kératocytes humains présentent des morphologies allongées dans les 30 premières minutes après l’ensemencement, tandis que les cellules endothéliales et les fibroblastes dermiques nécessitent plusieurs heures avant de montrer un changement dans la morphologie d’adhésion. Les paramètres expérimentaux requis pour l’incubation des protéines (étape 7) et l’ensemencement cellulaire (étape 8) pourraient donc dépendre de la protéine et du type de cellule de choix.
L’approche présentée pour appliquer des repères de guidage de contact sur des géométries 3D peut aider à créer une compréhension plus profonde du comportement des cellules dans des environnements multicue complexes. Cela peut inclure des études sur les composants intracellulaires, tels que les adhérences focales et les noyaux, et peut également impliquer des expériences effectuées à l’échelle d’une cellule ou d’un tissu plus grand en utilisant la méthode proposée. Finalement, on s’attend à ce que les connaissances acquises puissent être utilisées dans la conception d’applications d’ingénierie tissulaire, où des environnements cellulaires complexes sont conçus pour orienter le comportement cellulaire vers un résultat souhaité.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous remercions le Dr Nello Formisano (MERLN Institute for Technology-Inspired Regenerative Medicine) d’avoir fourni des kératocytes primaires humains. Ce travail a été soutenu par le Chemelot InSciTe (projet BM3.02); le Conseil européen de la recherche (subvention 851960); et le Ministère de l’éducation, de la culture et des sciences pour le programme de gravitation 024.003.013 « Régénération axée sur les matériaux ». Les auteurs tiennent à remercier Alvéole pour leur correspondance, leur aide et leur dépannage.
matériels
| Name | Company | Catalog Number | Comments |
| Anti-vinculin antibody, mouse monoclonal IgG1 | Sigma | V9131 | Dilution: 1/600 |
| Bovine Serum albumin, Fraction V | Roche | 10735086001 | |
| DMEM, high glucose, pyruvate | Gibco | 41966029 | |
| DMEM/F-12 + GlutaMAX (1x) | Gibco | 10565018 | |
| DMi8 epifluorescent microscope | Leica Microsystems | ||
| Ethanol | Biosolve | 0005250210BS | |
| Fetal Bovine Serum | Serana | 758093 | |
| Fiji/ImageJ, version v1.53k | www.imageJ.nih.gov | ||
| Fluorescent highlighter | Stabilo | 4006381333627 | |
| Fluorescin-labeled gelatin | Invitrogen | G13187 | Concentration: 0.01% |
| Formaldehyde solution | Merck | F8775 | |
| Glass coverslips 24 x 60 mm, #1 | VWR | 631-1575 | |
| Glass coverslips, ø = 32 mm, #1 | Menzel-Gläser | ||
| HCX PL fluotar L 20X/0.40na microscope objective | Leica | 11506242 | |
| HEPES | Gibco | 15630080 | |
| Human dermal fibroblasts | Lonza | CC-2511 | |
| Human primary keratocytes | MERLN Institute for Technology-Inspired Regenerative Medicine | ||
| Illustrator, Version 26.0.1 | Adobe | ||
| Laboratory oven | Carbolite | ||
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960 | |
| Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Leonardo software, version 4.16 | Alvéole | ||
| Micro-manager, version 1.4.23 | Open imaging | ||
| Mowiol 4-88 | Sigma-Aldrich | 81381 | mounting medium |
| mPEG-succinimidyl valerate MW 5,000 Da | Laysan Bio | MPEG-SVA-5000 | Concentration: 50 mg/mL |
| Negative glass mold | FEMTOprint | ||
| NucBlue Live Readyprobes Reagent (Hoechst 33342) | Invitrogen | R37605 | 2 drops/mL |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140163 | |
| Petri dish (ø=100 mm) | Greiner Bio-one | 664160 | |
| Phalloidin Atto 647N | Sigma | 65906 | Dilution: 1/250 |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Plasma asher | Emitech | K1050X | |
| PLPP (photoinitiator) | Alvéole | ||
| Poly-L-lysine, sterile-filtered | Sigma-Aldrich | P4707 | Concentration: 0.01% |
| PRIMO | Alvéole | ||
| Rhodamine-labeled fibronectin | Cytoskeletn, Inc. | FNR01 | Concentration: 10 µg/mL |
| Secondary antibody with Alexa 488, Goat anti-mouse IgG1 (H) | Molecular Probes | A21121 | Dilution: 1/300 |
| Secondary antibody with Alexa 555, Goat anti-mouse IgG1 (H) | Molecular Probes | A21127 | Dilution: 1/300 |
| Spin coater | Leurell Technologies Corporation | model WS-650MZ-23NPPB | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 1673921 | |
| TCS SP8X confocal microscope | Leica Microsystems | ||
| tridecafluoro(1,1,2,2-tetrahydrooctyl)trichlorosilane | ABCR | AB111444 | |
| TrypLE Express Enzyme (1x), no phenol red | Gibco | 12604013 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 |
Références
- Wang, Y., Wang, G., Luo, X., Qiu, J., Tang, C. Substrate stiffness regulates the proliferation, migration, and differentiation of epidermal cells. Burns. 38, 414-420 (2012).
- Viswanathan, P., et al. 3D surface topology guides stem cell adhesion and differentiation. Biomaterials. 52, 140-147 (2015).
- Peyton, S. R., et al. Marrow-derived stem cell motility in 3D synthetic scaffold is governed by geometry along with adhesivity and stiffness. Biotechnology and Bioengineering. 108 (5), 1181-1193 (2011).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nature Reviews Molecular Cell Biology. 18 (12), 728-742 (2017).
- Chaudhuri, O., Cooper-White, J., Janmey, P. A., Mooney, D. J., Shenoy, V. B. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584, 535-546 (2020).
- Guido, S., Tranquillo, R. T. A methodology for the systematic and quantitative study of cell contact guidance in oriented collagen gels. Correlation of fibroblast orientation and gel birefringence. Journal of Cell Science. 105 (2), 317-331 (1993).
- Teixeira, A. I., Abrams, G. A., Bertics, P. J., Murphy, C. J., Nealey, P. F. Epithelial contact guidance on well-defined micro- and nanostructured substrates. Journal of Cell Science. 116, 1881-1892 (2003).
- Driscoll, M. K., Sun, X., Guven, C., Fourkas, J. T., Losert, W. Cellular contact guidance through dynamic sensing of nanotopography. ACS Nano. 8 (4), 3546-3555 (2014).
- Buskermolen, A. B. C., et al. Cellular contact guidance emerges from gap avoidance. Cell Reports Physical Science. 1 (5), 100055 (2020).
- Thrivikraman, G., et al. Cell contact guidance via sensing anisotropy of network mechanical resistance. Proceedings of the National Academy of Sciences of the United States of America. 118 (29), 1-11 (2021).
- Buskermolen, A. B. C., et al. Entropic forces drive cellular contact guidance. Biophysical Journal. 116 (10), 1994-2008 (2019).
- Vignaud, T., et al. Reprogramming cell shape with laser nano-patterning. Journal of Cell Science. 125 (9), 2134-2140 (2012).
- Pouthas, F., et al. In migrating cells, the Golgi complex and the position of the centrosome depend on geometrical constraints of the substratum. Journal of Cell Science. 121 (14), 2406-2414 (2008).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Théry, M., et al. Anisotropy of cell adhesive microenvironment governs cell internal organization and orientation of polarity. Proceedings of the National Academy of Sciences of the United States of America. 103 (52), 19771-19776 (2006).
- Huang, G., et al. Functional and biomimetic materials for engineering of the three-dimensional cell microenvironment. Chemical Reviews. 117 (20), 12764-12850 (2017).
- Callens, S. J. P., Uyttendaele, R. J. C., Fratila-Apachitei, L. E., Zadpoor, A. A. Substrate curvature as a cue to guide spatiotemporal cell and tissue organization. Biomaterials. 232, 119739 (2020).
- Yilmaz, C. O., Xu, Z. S., Gracias, D. H. Curved and Folded Micropatterns in 3D Cell Culture and Tissue Engineering. Methods in Cell Biology. 121, (2014).
- Silver, F. H., Freeman, J. W., Seehra, G. P. Collagen self-assembly and the development of tendon mechanical properties. Journal of Biomechanics. 36 (10), 1529-1553 (2003).
- Werner, M., Kurniawan, N. A., Bouten, C. V. C. Cellular geometry sensing at different length scales and its implications for scaffold design. Materials. 13 (4), 963 (2020).
- Di Cio, S., Bøggild, T. M. L., Connelly, J., Sutherland, D. S., Gautrot, J. E. Differential integrin expression regulates cell sensing of the matrix nanoscale geometry. Acta Biomaterialia. 50, 280-292 (2017).
- Fioretta, E. S., Simonet, M., Smits, A. I. P. M., Baaijens, F. P. T., Bouten, C. V. C. Differential response of endothelial and endothelial colony forming cells on electrospun scaffolds with distinct microfiber diameters. Biomacromolecules. 15 (3), 821-829 (2014).
- Werner, M., Kurniawan, N. A., Korus, G., Bouten, C. V. C., Petersen, A. Mesoscale substrate curvature overrules nanoscale contact guidance to direct bone marrow stromal cell migration. Journal of The Royal Society Interface. 15 (145), 20180162 (2018).
- Ruprecht, V., et al. How cells respond to environmental cues - insights from bio-functionalized substrates. Journal of Cell Science. 130 (1), 51-61 (2017).
- Bao, M., Xie, J., Huck, W. T. S. Recent advances in engineering the stem cell microniche in 3D. Advanced Science. 5 (1800448), 1-16 (2018).
- Zhan, X. Effect of matrix stiffness and adhesion ligand density on chondrogenic differentiation of mesenchymal stem cells. Journal of Biomedical Materials Research - Part A. 108 (3), 675-683 (2020).
- Jiang, T., et al. Untangling the response of bone tumor cells and bone forming cells to matrix stiffness and adhesion ligand density by means of hydrogels. Biomaterials. 188, 130-143 (2019).
- Choi, J. S., Harley, B. A. C. The combined influence of substrate elasticity and ligand density on the viability and biophysical properties of hematopoietic stem and progenitor cells. Biomaterials. 33, 4460-4468 (2012).
- Rape, A. D., Zibinsky, M., Murthy, N., Kumar, S. A synthetic hydrogel for the high-throughput study of cell-ECM interactions. Nature Communications. 6 (8129), 1-9 (2015).
- Camarero-Espinosa, S., et al. 3D printed dual-porosity scaffolds: the combined effect of stiffness and porosity in the modulation of macrophage polarization. Advanced Healthcare Materials. 11 (2101415), 1-16 (2022).
- Bao, M., et al. Cellular volume and matrix stiffness direct stem cell behavior in a 3D microniche. ACS Applied Materials and Interfaces. 11 (2), 1754-1759 (2019).
- Charest, J. L., Eliason, M. T., García, A. J., King, W. P. Combined microscale mechanical topography and chemical patterns on polymer cell culture substrates. Biomaterials. 27, 2487-2494 (2006).
- Bilem, I., et al. Interplay of Geometric Cues and RGD/BMP-2 crosstalk in directing stem cell fate. ACS Biomaterials Science and Engineering. 3 (10), 2514-2523 (2017).
- Nam, K. -. H., et al. Multiscale cues drive collective cell migration. Scientific Reports. 6, 29749 (2016).
- Alom Ruiz, S., Chen, C. S. Microcontact printing: A tool to pattern. Soft Matter. 3 (2), 168-177 (2007).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Protein Micropatterns. A Direct Printing Protocol Using Deep UVs. Methods in Cell Biology. 97, (2010).
- Kane, R. S., Takayama, S., Ostuni, E., Ingber, D. E., Whitesides, G. M. Patterning proteins and cells using soft lithography. Biomaterials. 20 (23-24), 2363-2376 (1999).
- Azioune, A., Storch, M., Bornens, M., Théry, M., Piel, M. Simple and rapid process for single cell micro-patterning. Lab on a Chip. 9 (11), 1640 (2009).
- Offenhäusser, A., et al. Microcontact printing of proteins for neuronal cell guidance. Soft Matter. 3 (3), 290-298 (2007).
- Ricoult, S. G., Sanati Nezhad, A., Knapp-Mohammady, M., Kennedy, T. E., Juncker, D. Humidified microcontact printing of proteins: universal patterning of proteins on both low and high energy surfaces. Langmuir. 30 (40), 12002-12010 (2014).
- Waterkotte, B., et al. Biofunctional Micropatterning of Thermoformed 3D Substrates. Advanced Functional Materials. 24 (4), 442-450 (2014).
- Lehnert, D., et al. Cell behaviour on micropatterned substrata: Limits of extracellular matrix geometry for spreading and adhesion. Journal of Cell Science. 117 (1), 41-52 (2004).
- Sevcik, E. N., Szymanski, J. M., Jallerat, Q., Feinberg, A. W. Patterning on topography for generation of cell culture substrates with independent nanoscale control of chemical and topographical extracellular matrix cues. Current Protocols in Cell Biology. 75, 1-25 (2017).
- Micropatterning: Surface functionalization. Alvéole Available from: https://www.alveolelab.com/technology/micropatterning-surface-functionalization/ (2022)
- Strale, P. O., et al. Multiprotein printing by light-induced molecular adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- van Gaal, R. C., Miltenburg, R. P. R. S., Kurniawan, N. A., Bouten, C. V. C., Dankers, P. Y. W. Renal epithelial cell responses to supramolecular thermoplastic elastomeric concave and convex structures. Advanced Materials Interfaces. 8 (1), 2001490 (2021).
- Foster, J. W., Gouveia, R. M., Connon, C. J. Low-glucose enhances keratocyte-characteristic phenotype from corneal stromal cells in serum-free conditions. Scientific Reports. 5, 1-16 (2015).
- Van Der Putten, C., et al. Protein micropatterning in 2.5D: an approach to investigate cellular responses in multi-cue environments. ACS Applied Materials and Interfaces. 13 (22), 25589-25598 (2021).
- Melero, C., et al. Light-induced molecular adsorption of proteins using the primo system for micro-patterning to study cell responses to extracellular matrix proteins. Journal of Visualized Experiments. (152), e60092 (2019).
- Hou, Y., et al. Surface roughness gradients reveal topography-specific mechanosensitive responses in human mesenchymal stem cells. Small. 16 (10), 1905422 (2020).
- Bourkoula, A., et al. Roughness threshold for cell attachment and proliferation on plasma micro-nanotextured polymeric surfaces: The case of primary human skin fibroblasts and mouse immortalized 3T3 fibroblasts. Journal of Physics D: Applied Physics. 49 (30), 304002 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon