Method Article
Geração de Microambientes Celulares Multicue por UV-Fotopatterning de Substratos de Cultura Celular Tridimensional
Neste Artigo
Resumo
Tradicionalmente, a cultura celular é realizada em substratos planares que imitam mal o ambiente natural das células in vivo. Aqui descrevemos um método para produzir substratos de cultura celular com geometrias curvas fisiologicamente relevantes e proteínas extracelulares micropatteradas, permitindo investigações sistemáticas sobre o sensoriamento celular dessas pistas extracelulares.
Resumo
A matriz extracelular é um importante regulador da função celular. As pistas ambientais existentes no microambiente celular, como distribuição de ligantes e geometria tecidual, têm sido cada vez mais demonstradas para desempenhar papéis críticos no fenótipo e comportamento das células governantes. No entanto, essas pistas ambientais e seus efeitos sobre as células são frequentemente estudados separadamente usando plataformas in vitro que isolam pistas individuais, uma estratégia que simplifica fortemente a complexa situação in vivo de múltiplas pistas. Abordagens de engenharia podem ser particularmente úteis para preencher essa lacuna, desenvolvendo configurações experimentais que capturam a complexidade do microambiente in vivo , mas retêm o grau de precisão e manipulabilidade de sistemas in vitro .
Este estudo destaca uma abordagem que combina padronização de proteínas baseadas em ultravioleta (UV) e microfabização de substrato à base de litografia, que, juntas, permitem a investigação de alto rendimento sobre comportamentos celulares em ambientes multicue. Por meio de fotopatterning UV sem máscara, é possível criar distribuições complexas e adesêsivas de proteínas em substratos de cultura celular tridimensional (3D) em chips que contêm uma variedade de pistas geométricas bem definidas. A técnica proposta pode ser empregada para substratos de cultura feitos de diferentes materiais poliméricos e combinados com áreas padronizadas com adesivos de uma ampla gama de proteínas. Com essa abordagem, células únicas, assim como monocamadas, podem ser submetidas a combinações de pistas geométricas e dicas de orientação de contato apresentadas pelos substratos padronizados. Pesquisas sistemáticas usando combinações de materiais de chip, padrões de proteínas e tipos de células podem, assim, fornecer insights fundamentais sobre as respostas celulares a ambientes multicue.
Introdução
In vivo, as células são submetidas a uma grande variedade de pistas ambientais que podem ser de natureza mecânica, física e bioquímica que se originam da matriz extracelular (ECM). Inúmeras pistas ambientais têm sido identificadas para desempenhar papéis vitais na regulação do comportamento celular, como a proliferação, a diferenciação e a migração 1,2,3,4,5. Um dos fenômenos mais investigados é a orientação de contato, descrevendo o alinhamento celular mediado pela adesão ao longo de padrões bioquímicos ou topográficos anisotrópicos presentes no substrato extracelular 6,7,8,9,10,11. Além de direcionar o alinhamento das células, também foram mostrados sinais de orientação de contato para influenciar outras propriedades celulares, como migração celular, organização de proteínas intracelulares, forma celular e destino celular 12,13,14,15. Além disso, a arquitetura geométrica do ambiente celular 3D também foi reconhecida por sua influência regulatória no comportamento celular16,17. No corpo humano, as células são expostas a uma gama de geometrias curvas, que vão desde fibras de colágeno de microescala, capilares e glomeruli, até alvéolos de mesocala e artérias18,19. Curiosamente, estudos in vitro recentes mostraram que as células podem sentir e responder a tais sinais físicos, da nano-escala 20,21,22,23.
Até o momento, a maioria dos estudos que investigam a resposta celular a sinais ambientais tem sido realizada em grande parte usando configurações experimentais que isolam pistas únicas. Embora essa abordagem tenha permitido um tremendo progresso na compreensão dos mecanismos básicos por trás do sensoriamento celular de pistas ambientais, ela recapitula mal o ambiente in vivo que apresenta simultaneamente múltiplas pistas. Para preencher essa lacuna, é útil desenvolver plataformas culturais pelas quais várias pistas ambientais podem ser controladas de forma independente e simultânea. Esse conceito ganhou tração crescente ultimamente24,25, com estudos que combinam rigidez matricial e densidade de ligantes 26,27,28,29, rigidez de substrato e porosidade30, rigidez do substrato e volume de microniche31, topografia superficial e dicas de orientação de contato 32,33,34 e pistas de orientação de contato nanoescala com as dicas de orientação de curvatura de mesoescala23. No entanto, continua sendo desafiador combinar pistas de orientação de contato com uma variedade de geometrias 3D de forma controlada e de alto rendimento.
Este protocolo de pesquisa aborda esse desafio e introduz um método para criar substratos de cultura celular com uma combinação controlada de áreas adesivas padronizadas de proteínas ECM (pistas de orientação de contato) e curvatura de substrato (pistas geométricas). Essa abordagem permite a dissecção da resposta celular em um ambiente multicue biomimético de forma sistemática e de alto rendimento. O conhecimento adquirido pode auxiliar na compreensão do comportamento celular em ambientes complexos e pode ser usado para projetar materiais instrutivos com propriedades que direcionam as respostas celulares para um desfecho desejado.
Fotopatterning de proteína 3D
A criação de áreas adesivas de proteínas ECM (sinais de orientação de contato) em materiais de cultura celular pode ser realizada utilizando uma variedade de técnicas, por exemplo, por padronização de ultravioleta profunda (deep-UV) ou impressão demicrocontatos 35,36. A padronização profunda-UV faz uso de luz UV que é projetada através de uma máscara em um material polimérico para degradar polímeros de passivação em locais específicos do substrato de cultura celular. O substrato padronizado é então incubado com um ligante de interesse, resultando em áreas adesivas que suportam o apego celular e a cultura em locais predefinidos 12,37,38. Uma maneira alternativa de introduzir padrões proteicos é por meio da impressão de microcontatos, onde selos elastoméricos contendo uma forma desejada são revestidos com uma proteína de escolha e são pressionados em um substrato de cultura celular, transferindo assim o revestimento proteico ao qual as células podem aderir 35,37,39,40 . Infelizmente, uma vez que ambas as técnicas dependem da preparação da máscara e dos métodos de litografia suave, os experimentos são demorados e intensivos em mão-de-obra, bem como limitados em termos de flexibilidade de padrão. Além disso, tanto a padronização UV profunda quanto a impressão de microcontatos são mais adequadas para materiais planares e são tecnicamente difíceis, se não impossíveis, para ligarntes de padronagem em um ambiente 3D.
Para melhorar esses métodos convencionais, Waterkotte et al. combinaram litografia sem máscara, deposição de vapor químico e termoformação para gerar substratos poliméricos 3D micropatterados41. No entanto, essa técnica conta com o uso de filmes de polímeros termoformáveis e oferece baixa resolução de padrão proteico (7,5 μm), enquanto as células têm sido relatadas para responder a padrões de proteínas geométricas tão pequenos quanto 0,1 μm 2,42. Sevcik et al. descreveram outro método promissor para nanopattern ligantes ECM em substratos contendo topografias de nano e micímetro43. Utilizando impressão de microcontato, as proteínas ECM foram transferidas de selos de polidimetilsiloxano (PDMS) para um substrato termoresponsivo de poli(N-isopropylacrylamida) (pNIPAM). Posteriormente, a propriedade termoresponsiva da rede pNIPAM permitiu que transferissem o padrão de proteína bidimensional (2D) para um substrato PDMS topográfico (ranhuras profundas de 10-100 μm), controlando assim a localização de locais de adesão em características topográficas. No entanto, nem todas as microtopografias possíveis podem ser padronizadas, uma vez que problemas de wettability reduzidos tornam mais difícil padronizar substratos topográficos mais profundos. Trincheiras com uma proporção de profundidade para largura de 2,4 foram relatadas como sendo o limite final para transferir com sucesso o padrão para o substrato topográfico43. Além disso, a flexibilidade de padrões variados e a resolução dos padrões gerados são ruins devido à exigência de impressão de microcontatos.
Este artigo descreve um método que supera os gargalos acima mencionados e oferece um método flexível e de alto rendimento para criar substratos multicue que podem ser usados para a cultura celular (ver Figura 1). Geometrias fisiologicamente relevantes (cilindros, cúpulas, elipses e superfícies de sela) com curvaturas que variam de ĸ = 1/2500 a ĸ = 1/125 μm-1 são pré-assinadas e microfabridas em chips PDMS. Posteriormente, as pistas de orientação de contato são criadas em cima das geometrias 3D usando uma variedade de desenhos de padrões digitais, empregando uma técnica de fotopatterning com uma resolução tão pequena quanto 1,5 μm44. Para isso, os chips PDMS são inicialmente passivados para evitar que células e proteínas adunizassem; esta camada de passivação pode então ser removida por combinação do fotoinitiador 4-benzoylbenzyl-trimethylammonium cloreto (PLPP) e exposição à luz UV45. Uma máscara digital foi projetada para especificar os locais de exposição uv e, assim, a área onde a camada de passivação é removida. As proteínas podem posteriormente aderir a essas áreas, permitindo o apego celular. Uma vez que a padronização é realizada usando uma máscara digital (em vez de física), uma variedade de padrões pode ser criada rapidamente sem o incômodo e o custo associado ao desenho e fabricação de fotomasks adicionais. Além disso, uma variedade diversificada de proteínas ECM (por exemplo, colágeno tipo I, gelatina e fibronectina) pode ser padronizada no substrato. Embora este protocolo seja realizado utilizando chips de cultura celular feitos de PDMS, o princípio pode ser aplicado a qualquer outro material de interesse46.
Protocolo
Nos estudos descritos neste protocolo, foram utilizados ceratocitos humanos primários. Esta pesquisa foi realizada em conformidade com os princípios da Declaração de Helsinque. Os ceratocitos primários foram isolados das sobras de tecidos cetroclerales cadavéricos humanos da cirurgia de ceratoplastia endotelial da membrana descemet, que foram obtidos do Departamento de Córnea do Centro Multi-tecido ETB-BISLIFE (Beverwijk, Países Baixos) após obter o consentimento dos parentes mais próximos de todos os doadores falecidos.
NOTA: Consulte a Tabela de Materiais para obter detalhes sobre todos os materiais, reagentes, equipamentos e softwares utilizados neste protocolo.
1. Fabricação de substratos de cultura celular 3D
- Crie um molde de vidro negativo (#1) contendo todas as características de interesse, neste caso, feito de vidro usando uma técnica de escrita direta femtosegundo-laser (ver Figura 2).
- Coloque cuidadosamente o molde de vidro negativo (nº 1) no fundo de uma placa de Petri.
- Prepare um prepolímero PDMS colocando um tubo cônico vazio de 50 mL em uma escala, renasça a balança e despeje a quantidade desejada de base de elastômero de silicone no tubo.
- Adicione o agente de cura usando uma pipet Pasteur de modo que a razão final da base de elastômero e do agente de cura seja 10:1 (w/w).
- Misture bem os componentes do tubo cônico usando uma espátula.
- Centrifugar a 2.000 × g por 70 s para remover todas as bolhas de ar.
- Despeje o prepolímero PDMS em cima do molde de vidro negativo (#1) na placa de Petri para cobri-lo completamente.
- Coloque a placa de Petri com o molde de vidro negativo (#1) e o prepolímero PDMS no desiccador de vácuo e inicie a bomba de vácuo. Uma vez alcançado um vácuo, espere por 5 minutos para remover todas as bolhas presentes na interface entre a superfície do molde e o prepolímero PDMS.
- Retire o vácuo e retire a placa de Petri do dessedificador.
- Cure o prepolímero PDMS durante a noite no forno a 65 °C.
- Remova cuidadosamente o chip PDMS positivo recém-curado (#2) do molde de vidro negativo (#1) levantando as bordas do PDMS usando uma espátula. Se o chip PDMS positivo (nº 2) tende a grudar no molde de vidro negativo (#1), adicione etanol ou água às bordas da marca durante o levantamento.
NOTA: O fluido funcionará entre as duas camadas e facilitará a separação do molde de vidro negativo (#1) e do chip PDMS positivo (#2). - Usando uma lâmina, corte as laterais do chip PDMS positivo (#2) para que um chip retangular permaneça.
- Coloque o chip PDMS positivo (#2) em um dessecante ao lado de um pequeno frasco com uma gota de tridecafluoro (1,1,2,2-tetrahidrooctil)tricloroosilano, um agente de silanização, e deixe sob vácuo durante a noite.
NOTA: A silanização garantirá que a impressão não se ligue a outras camadas PDMS mais tarde no protocolo. Outros agentes de silanização e/ou métodos também podem funcionar para garantir que as superfícies dos chips PDMS não grudem em outras camadas PDMS.
ATENÇÃO: Tridecafluoro (1,1,2,2-tetrahidrooctil)trichlorosilane é inflamável (H226) e causa queimaduras graves na pele e danos oculares (H314). Use equipamentos de proteção pessoal, trabalhe em um capô de fumaça e lave bem as mãos após o manuseio. Mantenha o agente de silanização longe do calor, superfícies quentes, faíscas, chamas abertas e outras fontes de ignição. Armazenar entre 15 e 30 °C (P280, P210, P240, P403, P235, P310). - Remova o vácuo e coloque o chip PDMS positivo (#2) na parte inferior de uma placa de Petri. Despeje o prepolymer PDMS (10:1) no topo para produzir múltiplos moldes PDMS negativos (#3).
- Coloque a placa de Petri sob vácuo no desiccator por 15 minutos para remover todas as bolhas.
- Cure o prepolímero PDMS a 65 °C durante a noite, após o qual o molde PDMS negativo (#3) pode ser retirado do chip PDMS positivo (#2) usando uma espátula.
- Silanize o molde PDMS negativo final (#3) usando agente de silanização em um desiccator a vácuo durante a noite.
- Produzir vários chips de cultura celular (#4, ver Figura 2) de aproximadamente 5 mm de espessura, derramando prepolímero PDMS no molde PDMS negativo (#3), removendo bolhas usando o dessecanteador e curando por 3h a 65 °C. Com uma lâmina de barbear, corte o chip para o tamanho final como visualizado na Figura 2. Guarde os chips em temperatura ambiente.
NOTA: A rugosidade da superfície pode influenciar a resposta celular. Se necessário, uma camada fina adicional de PDMS pode ser usada como um revestimento no chip PDMS positivo (#2) para suavizar a superfície. Para isso, despeje uma pequena gota de prepolímerO PDMS no chip e espalhe-o sobre o chip completo usando ar pressurizado. Cure o chip revestido a 65 °C por 3h e continue com a etapa 1.12.
2. Fabricação de amostras PDMS planas (amostras de controle)
- Prepare o prepolímero PDMS (10:1) de acordo com as etapas 1.3-1.6.
- Coloque uma mancha de vidro no poste de vácuo arredondado no centro do revestimento de spin.
- Ligue o vácuo para anexar a tampa de vidro à máquina e encoste uma gota de PDMS no meio da tampa usando uma tubulação Pasteur.
- Distribua o prepolímero PDMS sobre o substrato de vidro usando o seguinte protocolo para obter uma camada de aproximadamente 10 μm de espessura.
- Spincoat para 10 s a 0,45 × g, aceleração: 0,2 × g/s.
- Spincoat para 50 s a 44,8 × g, aceleração: 0,54 × g/s.
- Desligue o vácuo, remova a tampa do revestimento de spin usando pinças e coloque-a em uma placa de Petri. Cure o PDMS durante a noite no forno a 65 °C e armazene em temperatura ambiente depois.
3. Passivação de substratos de substratos de cultura celular 3D
- Ative os grupos de hidroxil na superfície do chip PDMS (#4) usando O2-plasma. Usando pinças, coloque o chip na cesta do asher de plasma.
- Execute um ciclo de ashing usando uma potência de 20 W para 30 s. Desabafe a câmara de ashing usando n2.
- Tire o chip da cesta e coloque-o em um pequeno recipiente PDMS (ver Figura 1).
- Usando uma pipet Pasteur, adicione 500 μL de Poli-L-lysine (PLL, 0,01%) na parte superior do chip para que a superfície completa esteja imersa na solução PLL. Incubar por 30 minutos à temperatura ambiente.
- Remova 450 μL do PLL do chip de cultura celular com uma tubulação e enxágue a superfície do chip três vezes com 500 μL de tampão HEPES de 0,1 M (8 < pH < 8,5). Deixe sempre um pequeno volume de líquido no chip PDMS para evitar a secagem da amostra, o que reduzirá a qualidade final do padrão.
- Faça 500 μL de um metoxixipolyetileno de 50 mg/mL valerate glicol-succinimidyl (mPEG-SVA; MW 5.000 Da) solução em tampão HEPES de 0,1 M (8 < pH < 8,5) por chip de cultura celular e deixá-lo incubar na amostra por 60 minutos. Uma vez que o mPEG-SVA tem uma meia-vida de 15 minutos, certifique-se de preparar a quantidade necessária pouco antes do uso.
NOTA: O mPEG-SVA é dissolvido quando a solução é completamente transparente. - Remova 450 μL da solução mPEG-SVA usando um micropipet e lave a superfície do chip cinco vezes com soro fisiológico tamponado com fosfato (PBS). Certifique-se de encanar várias vezes por lavagem para garantir que todos os mPEG-SVA não vinculados sejam removidos. Para evitar que a amostra seque, minimize o tempo entre as etapas de lavagem e certifique-se de usar um excesso (500 μL ou mais) de PBS para lavagem.
- Armazene as amostras imergindo-as na PBS ou continue a etapa de padronização do protocolo.
NOTA: Se desejar, a passivação pode ser realizada em condições estéreis ao trabalhar em um armário de cultura e trabalhar com soluções e equipamentos estéreis.
4. Armazenamento de substratos de cultura celular padronizados
NOTA: Substratos de cultura celular 3D podem ser armazenados durante diferentes etapas do processo.
- Armazene chips de cultura de células PDMS curados em condições secas à temperatura ambiente.
- Armazene os chips de cultura celular passivado de uma dessas duas maneiras:
- Guarde na PBS a 4 °C por até 7 dias.
- Armazene em condições secas por até vários meses. Para obter amostras secas, remova o PBS e enxágue várias vezes usando água dupla destilada (ddH2O). Seque o sopro usando um nitrogênio ou pistola de ar.
5. Design de máscaras digitais usadas para fotopatterning
NOTA: A padronização de substratos 3D pode ser realizada usando um único ou múltiplos planos focais (ver Figura 3). Um único plano focal pode ser usado em recursos que não são maiores que um dispositivo espelho digital (DMD, aproximadamente 300 μm x 500 μm) e que não são muito altos (50-100 μm). Nesse caso, projete um padrão digital usando o modo TIFF. Para características que excedem as dimensões de um DMD e são relativamente altas, divida a padronização do substrato em múltiplas etapas. Neste caso, vários padrões são projetados usando o modo PDF que todos se concentram individualmente em planos focais únicos.
- Projete uma máscara digital usando ferramentas de software de design.
- Padronização no modo TIFF (pixels): Crie uma prancheta completamente preta de 1.140 x 1.824 pixels (o tamanho exato de 1 DMD, aproximadamente 300 μm x 500 μm) e preencha a prancheta com as formas de interesse. Exporte a prancheta como um arquivo TIFF de 8 bits.
NOTA: Diferentes níveis cinzentos no desenho do padrão determinam a quantidade de exposição que será realizada naquele local. - Padronização no modo PDF (unidades métricas): Crie uma prancheta preta do tamanho desejado em mm e preencha a prancheta com qualquer forma de interesse. Divida o padrão em vários arquivos se o substrato 3D precisar ser padronizado usando vários planos focais. Salve a prancheta como um arquivo PDF.
NOTA: Diferentes níveis cinzentos no desenho do padrão determinam a quantidade de exposição que será realizada naquele local.
- Padronização no modo TIFF (pixels): Crie uma prancheta completamente preta de 1.140 x 1.824 pixels (o tamanho exato de 1 DMD, aproximadamente 300 μm x 500 μm) e preencha a prancheta com as formas de interesse. Exporte a prancheta como um arquivo TIFF de 8 bits.
6. Fotopatterning UV de substratos de cultura celular 3D
- Calibração
NOTA: A calibração do laser é feita para obter o foco adequado no material de interesse. Uma vez que os substratos de cultura celular PDMS são muito espessos para padronizar, use um slide de vidro no qual o chip é colocado de cabeça para baixo. Uma vez que o laser encontra o deslizamento de vidro primeiro, use vidro para calibrar o laser.- Aplique o marcador fluorescente em uma mancha de vidro e coloque a mancha de vidro no estágio do microscópio fluorescente. Certifique-se de que a superfície destacada está voltada para cima.
- Ligue o microscópio e o equipamento PRIMO e abra o Micro-gerente para acessar o software Leonardo em 'plugins'.
- Escolha calibração no menu inicial, seguido de selecionar o objetivo de 20x tanto no microscópio quanto no software. Clique em Next.
- Coloque o slide de vidro com marcador fluorescente no caminho óptico do microscópio. Mude para o modo fluorescente e concentre-se cuidadosamente na imagem PRIMO que aparece, certificando-se de que tanto o logotipo quanto o texto estejam em foco. Clique em Next para terminar o procedimento de calibração.
- Anote a localização Z do estágio ao calibrar e use este local como referência mais tarde no protocolo.
NOTA: O material de calibração deve corresponder ao material usado para padronização posteriormente no protocolo. Os passos acima descrevem a calibração necessária para os substratos da cultura celular. Para calibração de amostras de controle PDMS planas, aplique o marcador fluorescente em cima de uma amostra adicional de PDMS plana e calibrar usando as etapas 6.1.2-6.1.5.
- Padronizando recursos 3D usando um único plano focal
NOTA: A padronização usando um único plano focal é feita em recursos 3D que não excedem as dimensões de um DMD (aproximadamente 300 μm x 500 μm). Um esquema da configuração do plano focal é ilustrado na Figura 3.- Remova o slide de calibração do palco e coloque um slide de vidro contendo uma gota (~50 μL) do fotoinitidor (PLPP) no estágio.
ATENÇÃO: O PLPP é irritante para os olhos, o sistema respiratório e a pele (R36-38). Use equipamentos de proteção individual, mantenha-o longe de materiais explosivos, nunca adicione água a este produto, tome medidas de precaução contra descargas estáticas e evite choques e atritos (S26-36). - Coloque o substrato de cultura celular PDMS de cabeça para baixo na gota do fotoinitidor. Certifique-se de que as características 3D na superfície do substrato de cultura celular encarem o slide de vidro e estejam totalmente submersas em PLPP para garantir a padronização adequada.
- Selecione Padrão no software.
- Mude para o modo brightfield no microscópio e mova o palco para o recurso de interesse.
- Concentre-se na parte superior ou inferior das estruturas convexas e côncavas, respectivamente (Figura 3).
- Selecione PRIMO para inserir um padrão de escolha. Observe a visualização padrão em laranja em cima da imagem de brightfield ao vivo.
- Ajuste as configurações de padronização de acordo com o recurso (localização, ângulo, repetições) e selecione uma dose de 1.000 mJ/mm2.
- Clique em Bloquear e mude o microscópio para o modo fluorescente .
- Clique no botão Reproduzir na parte inferior direita da tela para iniciar a padronização. Uma vez terminado, observe o padrão exibido em verde.
- Uma vez terminado com todas as características em um chip de cultura celular, remova o chip do slide de padronização e armazene em PBS a 4 °C.
- Remova o slide de calibração do palco e coloque um slide de vidro contendo uma gota (~50 μL) do fotoinitidor (PLPP) no estágio.
- Padronização de recursos 3D usando vários planos focais
NOTA: A padronização usando vários planos focais é feita em recursos 3D que são maiores que um DMD (aproximadamente 300 μm x 500 μm) ou são relativamente altos. Neste caso, os recursos 3D precisam ser padronizados em várias etapas, ou seja, o design de padrão deve ser adaptado de acordo com o exemplo na Figura 3.- Remova o slide de calibração do palco e coloque um slide de vidro contendo uma gota (~50 μL) do fotoinitidor (PLPP) no estágio.
- Coloque o chip de cultura celular PDMS de cabeça para baixo na gota do fotoinitiador usando pinças.
- Selecione Padrão no software. Mude para o modo brightfield no microscópio e mova o palco para o recurso de interesse.
- Concentre-se na área do chip no local certo. Uma vez que a padronização é realizada em um único plano focal e as características são maiores que um único DMD, use vários planos focais e, portanto, várias rodadas de padronização por substrato 3D para garantir resolução de padrão suficiente ao longo da altura e largura completas do recurso (ver Figura 3). Por exemplo, para um recurso com uma altura de 150 μm, padrone o recurso em três rodadas (± plano focal de 50 μm de Z-viagem), focando em torno de 25 μm, 75 μm e 125 μm da parte inferior do recurso. Certifique-se de que a parte inferior do recurso está em torno do valor anotou na etapa 6.1.5.
- Selecione PRIMO para inserir o padrão de escolha. Observe a visualização de padrão mostrada em laranja em cima da imagem live brightfield.
- Ajuste as configurações de padronização de acordo com o recurso (localização, ângulo) e selecione uma dose de 1.000 mJ/mm2.
- Clique em Bloquear e mude o microscópio para o modo fluorescente .
- Clique no botão Reproduzir na parte inferior direita da tela para iniciar a padronização. Uma vez terminado, observe o padrão exibido em verde.
- Repetição de passos 6.3.4-6.3.8 na característica de interesse quando vários planos focais são usados.
- Uma vez terminado com todas as características em um chip de cultura celular, remova o chip do slide de padronização e armazene-o em PBS a 4 °C.
NOTA: Se desejar, aplique o fotopatterning UV em condições estéreis, fazendo uso de placas de Petri de fundo de vidro e prepare todos os substratos em armários de cultura estéreis. Armazene as amostras padronizadas na PBS por até algumas semanas. Quando lavadas com ddH2O e secas com ar pressurizado, as amostras podem ser armazenadas até alguns meses a 4 °C.
7. Incubação de proteínas
NOTA: É aconselhável usar substratos recém-incubados por proteínas para a cultura celular. Só prossiga para esta parte do protocolo se a semeadura celular (etapa 8) for feita diretamente depois.
- Transfira o chip de cultura celular padronizado para recipientes PDMS estéreis no armário de cultura.
- Lave os chips de cultura celular padronizados 3x com um excesso de PBS estéril se a padronização não for realizada em condições estéreis.
- Prepare uma solução de proteína fresca na PBS.
- Fibronectina: adicione 2 mL de PBS usando um micropipet a um frasco de 20 μg de fibronectina rotulada por rhodamina para obter uma concentração de 10 μg/mL. Pipeta suavemente para evitar a formação de aglomerados de proteínas e proteger da luz.
- Gelatina: descongele uma alíquota de 200 μL de gelatina-fluoresceína dissolvida. Proteja-se contra a luz.
- Adicione 200-500 μL da solução proteica ao chip de cultura celular usando um micropipet. Ajuste o tempo e a temperatura da incubação dependendo da proteína escolhida: Fibronectina: 5 min a temperatura ambiente, Gelatina: 15 min a 37 °C. Certifique-se de cobrir a amostra (por exemplo, com papel alumínio).
- Remova a solução proteica e lave 5x com 500 μL de PBS estéril. Certifique-se de pipetar o PBS para cima e para baixo várias vezes acima de todas as características relevantes do chip de cultura celular para remover qualquer proteína não ligada.
NOTA: Durante as etapas de lavagem, é crucial que a amostra nunca se ele se doe. Ao remover a solução proteica ou PBS durante a lavagem, adicione novo PBS imediatamente para evitar que aglomerados de proteínas se formem (ver Figura 4). As características convexas são especialmente sensíveis à secagem, pois são elevadas acima da superfície do substrato. - Opcional: revise os padrões proteicos sob um microscópio de fluorescência. Mantenha as amostras estéreis e imersas em PBS.
8. Semeadura celular
NOTA: Este protocolo usa ceratocitos primários humanos e fibroblastos dérmicos humanos. Os ceratocitos foram colhidos a partir de tecido córnea humano de pacientes, em consonância com as diretrizes holandesas para uso secundário de materiais, e anteriormente caracterizados como ceratocitos47. Essas células são cultivadas em DMEM suplementadas com 5% de soro bovino fetal (FBS), 1% penicilina/estreptomicina (P/S) e 1 mM de ácido L-ascórbico 2-fosfato sesagnequimsium hidratado sal (vitamina C) a 37 °C para um máximo de quatro passagens. Os fibroblastos dérmicos humanos foram adquiridos e cultivados no DMEM complementados com 10% de FBS e 1% P/S a 37 °C para um máximo de 15 passagens. Para a semeadura de ceratocitos e fibroblastos dérmicos no chip de cultura celular fotopatterada, foram utilizadas 20.000 células por chip.
- Retire as células de interesse (por exemplo, usando trippsina) e prepare 1 mL de suspensão celular de ± 10.000-50.000 células/mL em meio de cultura por chip. Ajuste o número exato de células adicionadas por substrato dependendo do tamanho da célula e da leitura desejada.
- Remova o PBS do chip de cultura celular e adicione 1 mL da suspensão da célula.
- Transporte suavemente o chip de cultura celular com as células para a incubadora e incubar por 60 min a 37 °C.
- Verifique a adesão das células no chip de cultura celular padronizado sob um microscópio de campo brilhante. Procure por morfologias celulares alongadas no caso de padrões de linha (ver Figura 5). Se as células também começaram a aderir fora da área padronizada, remova-as por meio de tubulação para cima e para baixo diretamente acima das células do substrato.
NOTA: As células anexadas à área padronizada permanecerão anexadas, enquanto as células fora das áreas padronizadas se desprenderão. - Remova o chip de cultura celular do recipiente PDMS e use pinças estéreis para colocá-lo em uma placa de 6 poços cheia de ~5 mL de meio de cultura.
- Cultume as células para o tempo desejado. Substitua o meio de cultura celular a cada 2-3 dias. Para garantir a visualização do padrão proteico após a cultura celular, reduza a quantidade de exposição da amostra à luz durante a cultura.
9. Coloração, aquisição de imagens e análise
- Fixação e coloração
- Após o comprimento desejado da cultura, remova quase todo o meio e lave três vezes com excesso de PBS. Em seguida, incubar com 3,7% de formalina para 15 min à temperatura ambiente, seguido por três etapas de lavagem com PBS para 5 min por lavagem em temperatura ambiente. Nunca deixe a amostra secar.
ATENÇÃO: A formalina é prejudicial se ingerida ou se inalada (H302, H332), pode causar uma reação alérgica da pele (H317), é suspeita de causar defeitos genéticos (H341) e pode causar câncer (H350). Use equipamentos de proteção individual e trabalhe em um capô de fumaça. - Colora o substrato da cultura celular com os agentes de coloração ou anticorpos desejados. Para reduzir os volumes de agentes de coloração, coloque os chips de cultura celular de cabeça para baixo em uma gotícula de solução de coloração esbofiada em um escorregador de vidro.
- Armazene as amostras em PBS (curto prazo) ou anexadas a uma tampa usando meio de montagem (longo prazo) a 4 °C.
- Após o comprimento desejado da cultura, remova quase todo o meio e lave três vezes com excesso de PBS. Em seguida, incubar com 3,7% de formalina para 15 min à temperatura ambiente, seguido por três etapas de lavagem com PBS para 5 min por lavagem em temperatura ambiente. Nunca deixe a amostra secar.
- Aquisição de imagens
- Coloque a amostra manchada de cabeça para baixo em uma gota de PBS em um slide de vidro. Coloque a amostra no estágio de um microscópio confocal.
- Dependendo do nível de detalhe necessário, faça pilhas Z com um objetivo adequado (10x, 20x ou 40x) e espaçamento Z para garantir a aquisição adequada de imagem.
- Análise e visualização de imagens
- Abra os arquivos de imagem bruta no software de análise de imagens e verifique se as propriedades da imagem (por exemplo, dimensões, resolução) estão corretas.
- Ajuste o brilho e o contraste por canal, se necessário.
- Lavo a região de interesse contendo o padrão e as células.
- Opcional: realize uma etapa de desconvolução, se necessário.
- Crie uma renderização 3D da pilha Z usando software de renderização 3D.
- Otimize o contraste e ganhe configurações para cada canal individual.
- Para fazer uma imagem da renderização 3D, crie um instantâneo e exporte como . Arquivo TIFF.
- Para criar um filme da renderização 3D, defina o quadro inicial e final, bem como o prazo antes de registrar o filme. Exportar como .avi.
Resultados
Por meio do protocolo descrito, substratos de cultura celular 3D PDMS podem ser fotopatterados UV para criar áreas adesivas precisas e de alto rendimento adequadas para o apego celular. Desta forma, as células são submetidas a geometrias substrato relevantes e padrões de ligantes adesivos simultaneamente. Propriedades celulares como orientação, área celular e número de aderências focais podem ser facilmente monitoradas e usadas para entender melhor o comportamento celular em ambientes complexos e in vivo.
Para verificar os eventos de padronização nos substratos 3D PDMS, as composições de superfície atômica do material em diferentes estágios do protocolo foram medidas utilizando espectroscopia de fotoeletrões atômicas de raios-X (XPS)48. Em resumo, as medições do XPS mostraram a presença de cadeias de PEG com um aumento do sinal de carbono em amostras passivadas, que foi reduzida após a fotopattersão. A incubação com fibronectina resultou em um aumento do sinal de carbono, indicando novamente a adesão proteica bem sucedida na superfície do chip de cultura celular. Em seguida, a resolução de padrões e o alinhamento em características 3D foram caracterizados em uma variedade de poços côncavas padronizados em círculos (ĸ = 1/250 μm-1, ĸ = 1/1.000 μm-1, e ĸ = 1/3.750 μm-1, ver Figura 6). A partir das projeções de intensidade máxima, pode-se concluir que o padrão proteico foi padronizado com sucesso em todas as três características 3D. O perfil de intensidade na Figura 6A mostra alta resolução de padrão com transições acentuadas entre áreas padronizadas e não padronizadas. Além disso, obteve-se uma intensidade proteica consistente em todo o padrão completo no poço.
O poço côncavo com ĸ = 1/250 μm-1 foi padronizado utilizando-se o método plano focal único (um padrão), enquanto os poços com ĸ = 1/1.000 μm-1 e ĸ = 1/3.750 μm-1 foram padronizados usando dois e três focal (padrões), respectivamente. Como pode ser visto nas projeções de intensidade máxima na Figura 6, ambos os métodos resultam em alinhamento perfeito dos padrões em cima das características. Não podem ser observadas transições desalinhadas entre os dois planos focais diferentes e padrões.
Usando o protocolo descrito, uma ampla gama de desenhos de padrões proteicos pode ser aplicada a uma variedade de geometrias (ver Figura 7 e Vídeo 1). Para ilustrar a versatilidade deste método, semiciclinders (convexo e côncavo), uma superfície de sela e poço foram padronizados usando linhas e círculos de várias larguras. Os materiais fotopatterados podem ser posteriormente usados para cultura celular (ver Figura 7, Figura 8, Vídeo 2, Vídeo 3 e Vídeo 4). Um exemplo de fibroblastos dérmicos cultivados em um padrão (linhas de fibronectina, vermelho, 5 μm de largura e 5 μm de lacunas) é mostrado na Figura 8, Figura 9 e Vídeo 4. Durante o experimento, as células sentem e aderem ao substrato da cultura celular multicue e permanecem viáveis ao longo do tempo. Como pode ser visto a partir da coloração imunofluorescente na Figura 8, as células formam aderências focais (aglomerados de vinculina) principalmente nas linhas de fibronectina.
Outro exemplo de estudo que fez uso desses materiais de cultura celular foi publicado recentemente pelo nosso grupo48. Neste estudo, miofibroblasts humanos e células endoteliais foram submetidos à combinação de pistas de orientação de contato e topografias geométricas. In vivo, ambos os tipos de células experimentam sinais de curvatura e orientação de contato em tecidos nativos, como na vasculatura humana. Ao submeter as células in vitro a um ambiente que combina ambas as pistas ambientais, a situação in vivo pode ser recapitulada, proporcionando uma compreensão mais profunda do papel do microambiente no comportamento celular. Myofibroblasts humanos mostraram-se alinhados com pistas de orientação de contato (linhas paralelas de fibronectina) em substratos cilíndricos côncavos48. No entanto, em estruturas convexas com curvaturas crescentes, os sinais geométricos anularam as pistas bioquímicas, sugerindo que os miofibroblasts podem sentir tanto o grau quanto o sinal de curvatura. Curiosamente, as células endoteliais só podiam aderir aos substratos multicues côncavos e não aos substratos convexos PDMS. Em substratos côncavas e padronizados por proteínas, as células endoteliais são orientadas na direção da sugestão de orientação de contato. Esse conhecimento in vitro fundamental tem relevância fisiológica no campo da engenharia de tecidos vasculares e pode eventualmente auxiliar na concepção de construções de engenharia de tecidos inteligentes.
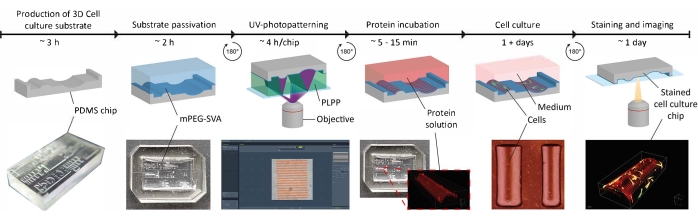
Figura 1: A linha do tempo experimental da aplicação de dicas de orientação de contato em substratos de cultura celular 3D. Em primeiro lugar, chips de cultura celular positivo são produzidos a partir de um molde PDMS negativo contendo uma gama de geometrias. PDMS não curado é derramado no molde e curado por 3h a 65 °C. Posteriormente, o PDMS é tratado com O2-plasma e incubado com PLL e mPEG-SVA (azul, rotulado) para passivar a superfície do substrato de cultura celular. Após a lavagem, o substrato é virado de cabeça para baixo em uma gotícula de fotoinitiador (PLPP, verde, rotulado) e fotopatterado UV usando a abordagem LIMAP. Aqui, uma máscara digital com um padrão definido pelo usuário é usada para cortar a camada de passivação em locais definidos. Em seguida, uma solução proteica (vermelha, rotulada) pode ser incubada e só vai aderir aos locais onde a camada de passivação é removida. As células semeadas no substrato são submetidas tanto a padrões de geometria quanto de proteínas, o que permite a pesquisa sobre o comportamento celular em ambientes complexos e imitadores in vivo. Abreviaturas: PDMS = polidimimetilsiloxano; mPEG-SVA = metoxioxilotileno glicol-succinimidyl valerate; PLPP = 4-benzoilbenzyl-trimetilamônio cloreto; LIMAP = Adsorção Molecular Induzida por Luz de Proteínas. Clique aqui para ver uma versão maior desta figura.

Figura 2: Diferentes estágios durante a produção e passivação do substrato de cultura celular 3D. O molde de vidro negativo (#1) é projetado com software de design assistido por computador e produzido usando uma técnica de escrita direta femtosegundo-laser. Este molde é utilizado para produzir o chip PDMS positivo intermediário (#2) e o molde PDMS negativo (#3), que são posteriormente usados para produzir o chip de cultura celular final (#4). Abreviação: PDMS = polidimtilsiloxano. Clique aqui para ver uma versão maior desta figura.

Figura 3: Ilustração esquemática dos dois métodos de padronização. Esquerda: O fotopatterning UV é realizado em características menores (aproximadamente um DMD) usando um único plano focal e padrão. Como resultado, o recurso completo é padronizado de uma só vez. Certo: Quando características maiores são usadas (maiores que um DMD), a padronização é dividida em vários planos e padrões focais. Abreviação: DMD = dispositivo espelho digital. Clique aqui para ver uma versão maior desta figura.
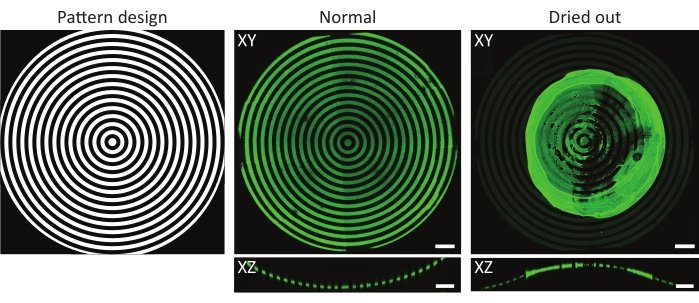
Figura 4: Um exemplo típico de um substrato normal e seco incubado por proteínas. Projeções de intensidade máxima (XY) e vistas ortogonais (XZ) de substratos normales e secos incubados por proteínas. Ao lavar um substrato de cultura celular padronizada após a incubação com uma solução proteica, é crucial manter sempre a amostra molhada. Embora o padrão seja idêntico em todas as imagens das características (ĸ = 1/1.000 μm-1), a gelatina-fluoresceína (verde) agregado formando um grande clump quando a amostra foi deixada para secar por alguns segundos. Se a amostra permanecer sempre molhada, padrões de proteínas corretos podem ser observados. Barras de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.

Figura 5: Imagens de Brightfield após a semeadura. Ceratócitos primários (esquerda) e fibroblastos dérmicos (direita) 4h após semeadura em características geométricas 3D (poço côncavo de ĸ = 1/1.000 μm-1 e semiciclinders de ĸ = 1/500, 1/375, 1/250, 1/175 e 1/125 μm-1). As pastilhas superiores representam o padrão de linha utilizado para a padronização das geometrias. Setas brancas indicam a disseminação de células que já mostram alinhamento. Barras de escala = 250 μm. Clique aqui para ver uma versão maior desta figura.
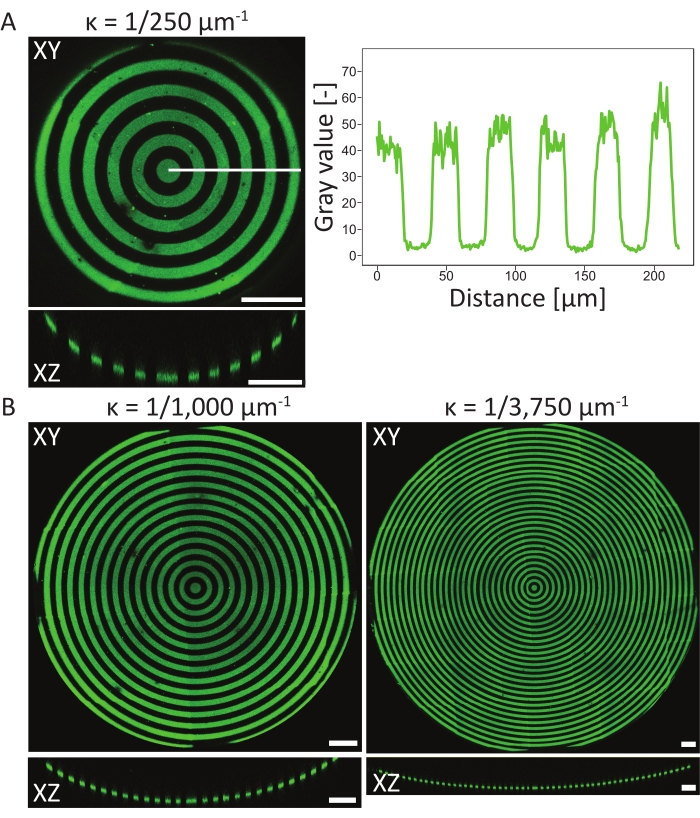
Figura 6: Caracterização de padrões circulares em poços côncavos. (A) A projeção de intensidade máxima (XY) e visão ortogonal (XZ) do poço de aconcava (ĸ = 1/250 μm-1) padronizadas usando LIMAP (largura de linha: 20 μm, largura de lacuna: 20 μm) e incubadas com gelatina fluoreceina (verde). O perfil de intensidade ao longo da linha branca é traçado contra a distância, mostrando uma qualidade e resolução padrão consistentes. (B) Padronização adicional realizada em poços côncavos com ĸ = 1/1.000 μm-1 e ĸ = 1/3750 μm-1, mostrando flexibilidade em termos de características geométricas que podem ser utilizadas para padronização. Novamente, tanto as projeções de intensidade máxima (XY) quanto as vistas ortogonais (XZ) são visualizadas. Barras de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
Figura 7: dados de microscopia 3D de estruturas padronizadas. Exemplos típicos de materiais de cultura celular padronizados em 3D após fotopatterning e cultura celular, visualizados usando software de renderização 3D. (A) Semiciclídeo convexo padronizado com linhas largas de 10 μm (rhodamina-fibronectina, vermelho) e 10 μm de largura. Barra de escala = 5 μm. (B) Fibroblastos dérmicos manchados para F-actin (verde) cultivados em semiciladura côncavo padronizado com linhas wide de 20 μm (rhodamina-fibronectina, vermelho) e 20 μm de largura gaps. Barra de escala = 5 μm. (C) Superfície de sela padronizada com linhas largas de 20 μm (romuma-fibronectina, vermelha) e 20 μm de largura. Barra de escala = 5 μm. (D) Poço côncavo padronizado com círculos concêntricos de linhas largas de 20 μm (gelatin-fluoresceína, verde) e 20 μm de largura. O citoesqueleto F-actin dos queratócitos humanos é manchado usando falooidina e visualizado em vermelho. Barra de escala = 200 μm. Clique aqui para ver uma versão maior desta figura.

Figura 8: Mancha imunofluorescente de fibroblastos dérmicos humanos em um fotopatterado, semiciladôdula côncavo. (A) Projeção de intensidade máxima (XY) e seções ortogonais (XZ e YZ) de fibroblastos dérmicos humanos cultivados por 24 h em um semiciclídeo padronizado (linhas de fibronectina, vermelho, 5 μm de largura e 5 μm de distância) semicilas côncavas. As células estão manchadas para F-actin (magenta), vinculina (verde) e núcleos (azul). Barra de escala = 100 μm. (B) Zoom-in de uma célula aderindo ao ambiente multicue. Barras de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.

Figura 9: Imagens de timelapse de Brightfield de fibroblastos dérmicos humanos em um cilindro côncavo padronizado. O semiciclar concavo (ĸ = 1/250 μm-1) foi padronizado com linhas paralelas (5 μm de largura e 5 μm de lacunas) e incubado com rhodamina-fibronectina antes da semeadura celular. A imagem timelapse é iniciada 1h após a semeadura inicial de células (esquerda, 0 min), quando as células ainda estão arredondadas e não aderentes (setas). Após aproximadamente 24 horas (médio, 1.420 min), as células aderiram ao substrato multicue e mostram uma resposta de alinhamento de acordo com o padrão de orientação de contato. Tanto a resposta de alinhamento quanto a viabilidade celular são mantidas durante toda a duração da cultura (à direita, 3.180 min). Barras de escala = 200 μm. Clique aqui para ver uma versão maior desta figura.
Vídeo 1: Exemplo de padrão em um substrato cilíndrico 3D. Representação 3D de um cilindro convexo padronizado com rhodamina-fibronectina (vermelho). Clique aqui para baixar este vídeo.
Vídeo 2: Representação 3D de fibroblastos dérmicos cultivados em um substrato cilíndrico 3D padronizado (ĸ = 1/500 μm-1). Fibroblastos dérmicos cultivados por 24 h em um semiciclídeo padronizado (linhas de fibronectina, vermelho, 10 μm de largura e 10 μm de lacunas) convexo semiciclídeo. As células estão manchadas para F-actin (magenta), vinculina (verde) e núcleos (azul). Clique aqui para baixar este vídeo.
Vídeo 3: Representação 3D de ceratocitos humanos cultivados em um poço 3D padronizado (ĸ = 1/3.750 μm-1). Representação 3D de ceratocitos humanos cultivados por 24 h em um poço côncavo e padronizado (círculos de gelatina, verde, 20 μm de largura e 20 μm de lacunas). As células estão manchadas para F-actin (vermelho). Clique aqui para baixar este vídeo.
Vídeo 4: Imagens de timelapse brightfield de fibroblastos dérmicos humanos em um cilindro côncavo padronizado. O semiciclar concavo (ĸ = 1/250 μm-1) foi padronizado com linhas paralelas (5 μm de largura e 5 μm de lacunas) e incubado com rhodamina-fibronectina antes da semeadura celular. A imagem timelapse é iniciada 1h após a semeadura inicial de células, quando as células mostram a adesão inicial ao ambiente multicue. Durante o timelapse completo, as células predominantemente orientam ao longo das pistas de orientação de contato, enquanto a viabilidade celular é mantida. Clique aqui para baixar este vídeo.
Discussão
Atualmente, o comportamento celular é frequentemente estudado em substratos de cultura plana que não têm a complexidade do microambiente celular nativo. Ambientes 3D como andaimes e hidrogéis são usados como alternativa. Embora esses ambientes de cultura celular melhorem a relevância in vivo, tanto os estudos sistemáticos do comportamento celular quanto a viabilidade dos métodos de leitura permanecem desafiadores. Para investigar sistematicamente o comportamento celular em substratos de cultura representativa, são necessários substratos multicue consistentes que permitem leitura microscópica. Portanto, neste protocolo, descrevemos um método para criar substratos de cultura celular multicue com geometrias fisiologicamente relevantes e proteínas ECM padronizadas. O principal desafio na combinação de pistas ambientais, como geometria tecidual e dicas de orientação de contato em plataformas in vitro, é em grande parte de natureza tecnológica. Métodos convencionais para aplicar pistas de orientação de contato (por exemplo, litografia macia, padronização UV profunda e impressãode microcontatos 35,36) em materiais de cultura celular foram otimizados para substratos planares. A necessidade de materiais de cultura celular 3D combinados com dicas de orientação de contato destacou diversos desafios tecnológicos, como alinhamento de padrões, resolução e flexibilidade. Para superar esses desafios, um método de padronização de alto rendimento, sem máscaras e à base de luz pode ser usado45,49. Aqui, um microscópio óptico permite um alinhamento preciso do padrão e uma resolução na ordem dos micrômetros (ver Figura 6). Além disso, o uso de uma máscara digital permite que os pesquisadores estudem o comportamento celular em uma ampla gama de padrões sem a necessidade de fabricar máscaras físicas intensivas em mão-de-obra.
A abordagem de fotopatterning UV pode ser usada em combinação com uma variedade de geometrias 3D (por exemplo, cilindros, selas, cúpulas, poços) produzidos a partir de uma gama de materiais48. Os substratos de cultura celular 3D utilizados neste estudo são feitos de PDMS; no entanto, outros materiais também podem ser usados. Isso pode exigir diferentes passos para produzir o substrato final da cultura celular contendo as características de interesse. Uma vez que as células têm se mostrado sensíveis à rugosidade superficial dos materiais de cultura celular, é importante criar os chips de cultura celular com uma superfície lisa para que a resposta das células observadas possa ser totalmente atribuível à geometria 3D e aos sinais de orientação de contato50,51. Métodos de medição como profilometria óptica, microscopia eletrônica de varredura ou microscopia de força atômica podem ser usados para medir a rugosidade superficial. Após a fabricação do material de cultura celular, pode-se selecionar um método de padronização baseado em um ou múltiplos planos focais dependentes das dimensões específicas do recurso de interesse (ver Figura 3). Normalmente, um único plano focal é usado para padronizar uma área dentro de um alcance Z de aproximadamente 50 μm. A resolução do padrão mostrou-se consistente usando esta regra de ouro (ver Figura 6). No entanto, uma desvantagem deste método é o aumento do tempo de padronização com a introdução de múltiplos planos e padrões focais. Em nossa mão, usando vários planos focais, características geométricas 3D de até 16 mm x 16 mm x 0,17 mm (X x Y x Z) foram padronizadas com sucesso com alta qualidade de padrão.
Além disso, é importante mencionar que a altura (eixo Z) das características geométricas que podem ser usadas em combinação com este protocolo é limitada. Uma vez que tanto o uv-fotopatterning quanto muitas leituras celulares dependem de uma configuração de microscopia, a distância de trabalho dos objetivos determina a altura máxima de um recurso. Em nossa mão, geometrias superiores a uma altura de 300 μm ainda podem ser fotopatriadas por UV, e leituras foram realizadas usando um microscópio confocal com objetivos de 40x. Assim, pesquisas mecanobiológicas que vão de escalas intracelulares a celulares e tecidos são possíveis utilizando o protocolo descrito.
Outro fator que precisa ser levado em conta é o risco de as amostras secarem durante ou após o49 fotopatterning UV. Isso é especialmente relevante ao usar geometrias 3D, pois convexidades são frequentemente expostas fora de materiais de cultura celular. Como mostrado na Figura 4, isso pode resultar em padrões desiguais com agregados proteicos se formando em cima da característica de interesse. A lavagem dos chips de cultura celular após a incubação de proteínas e durante a cultura celular é fundamental para o revestimento adequado de geometrias 3D. Por isso, é aconselhável sempre deixar pequenos volumes de uma solução de trabalho (PBS, PLPP, solução proteica, meio de cultura celular) em cima do chip de cultura celular.
Até agora, vários revestimentos proteicos (fibronectina, colágeno tipo I e IV, gelatina, FNC) e tipos de células (células estrômicas de medula óssea humana, miofibroblasts humanos, células endoteliais humanas, ceratocitos humanos e fibroblastos dérmicos) têm sido usados em combinação com a abordagem fotopatterning descrita em materiais estruturados de cultura celular. Como mostrado em um estudo anterior48, a otimização dos parâmetros de incubação de proteínas é fundamental para a investigação sistemática em novos tipos celulares. Portanto, antes de realizar um novo experimento com novas proteínas ou células, é aconselhável testar uma série de concentrações proteicas, temperaturas de incubação e tempos de incubação. Comparando a morfologia celular após a adesão inicial em áreas planas homogêneas e padronizadas com morfologia celular em condições de cultura celular 'normal', um conjunto otimizado de parâmetros experimentais pode ser obtido. Além disso, cada tipo de célula pode exigir uma quantidade diferente de tempo após a semeadura para mostrar uma morfologia de adesão reconhecível em um ambiente multicue específico (ver Figura 5). Para isso, é fundamental otimizar o tempo necessário por tipo de célula para apresentar eventos de contato na área padronizada durante a lavagem na etapa 8.4. Por exemplo, observamos que em padrões de linha, os ceratocitos humanos apresentam morfologias alongadas nos primeiros 30 minutos após a semeadura, enquanto as células endoteliais e os fibroblastos dérmicos requerem várias horas antes de mostrar uma mudança na morfologia da adesão. Os parâmetros experimentais necessários para a incubação de proteínas (etapa 7) e a semeadura celular (etapa 8) podem, portanto, depender do tipo de proteína e célula de escolha.
A abordagem apresentada para aplicar dicas de orientação de contato sobre geometrias 3D pode ajudar a criar uma compreensão mais profunda do comportamento celular em ambientes multicue complexos. Isso pode incluir investigações sobre componentes intracelulares, como aderências focais e núcleos, e também pode envolver experimentos realizados em uma escala maior, celular ou tecidual usando o método proposto. Eventualmente, prevê-se que o conhecimento adquirido possa ser usado no projeto de aplicações de engenharia de tecidos, onde ambientes celulares complexos são projetados para direcionar o comportamento celular para um desfecho desejado.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Agradecemos ao Dr. Nello Formisano (Instituto MERLN de Medicina Regenerativa Inspirada em Tecnologia) por fornecer ceratocitos primários humanos. Este trabalho foi apoiado pelo Chemelot InSciTe (projeto BM3.02); o Conselho Europeu de Pesquisa (bolsa 851960); e o Ministério da Educação, Cultura e Ciência para o Programa gravitação 024.003.013 "Regeneração Orientada por Materiais". Os autores gostariam de agradecer a Alvéole por sua correspondência, ajuda e solução de problemas.
Materiais
| Name | Company | Catalog Number | Comments |
| Anti-vinculin antibody, mouse monoclonal IgG1 | Sigma | V9131 | Dilution: 1/600 |
| Bovine Serum albumin, Fraction V | Roche | 10735086001 | |
| DMEM, high glucose, pyruvate | Gibco | 41966029 | |
| DMEM/F-12 + GlutaMAX (1x) | Gibco | 10565018 | |
| DMi8 epifluorescent microscope | Leica Microsystems | ||
| Ethanol | Biosolve | 0005250210BS | |
| Fetal Bovine Serum | Serana | 758093 | |
| Fiji/ImageJ, version v1.53k | www.imageJ.nih.gov | ||
| Fluorescent highlighter | Stabilo | 4006381333627 | |
| Fluorescin-labeled gelatin | Invitrogen | G13187 | Concentration: 0.01% |
| Formaldehyde solution | Merck | F8775 | |
| Glass coverslips 24 x 60 mm, #1 | VWR | 631-1575 | |
| Glass coverslips, ø = 32 mm, #1 | Menzel-Gläser | ||
| HCX PL fluotar L 20X/0.40na microscope objective | Leica | 11506242 | |
| HEPES | Gibco | 15630080 | |
| Human dermal fibroblasts | Lonza | CC-2511 | |
| Human primary keratocytes | MERLN Institute for Technology-Inspired Regenerative Medicine | ||
| Illustrator, Version 26.0.1 | Adobe | ||
| Laboratory oven | Carbolite | ||
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960 | |
| Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Leonardo software, version 4.16 | Alvéole | ||
| Micro-manager, version 1.4.23 | Open imaging | ||
| Mowiol 4-88 | Sigma-Aldrich | 81381 | mounting medium |
| mPEG-succinimidyl valerate MW 5,000 Da | Laysan Bio | MPEG-SVA-5000 | Concentration: 50 mg/mL |
| Negative glass mold | FEMTOprint | ||
| NucBlue Live Readyprobes Reagent (Hoechst 33342) | Invitrogen | R37605 | 2 drops/mL |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140163 | |
| Petri dish (ø=100 mm) | Greiner Bio-one | 664160 | |
| Phalloidin Atto 647N | Sigma | 65906 | Dilution: 1/250 |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Plasma asher | Emitech | K1050X | |
| PLPP (photoinitiator) | Alvéole | ||
| Poly-L-lysine, sterile-filtered | Sigma-Aldrich | P4707 | Concentration: 0.01% |
| PRIMO | Alvéole | ||
| Rhodamine-labeled fibronectin | Cytoskeletn, Inc. | FNR01 | Concentration: 10 µg/mL |
| Secondary antibody with Alexa 488, Goat anti-mouse IgG1 (H) | Molecular Probes | A21121 | Dilution: 1/300 |
| Secondary antibody with Alexa 555, Goat anti-mouse IgG1 (H) | Molecular Probes | A21127 | Dilution: 1/300 |
| Spin coater | Leurell Technologies Corporation | model WS-650MZ-23NPPB | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 1673921 | |
| TCS SP8X confocal microscope | Leica Microsystems | ||
| tridecafluoro(1,1,2,2-tetrahydrooctyl)trichlorosilane | ABCR | AB111444 | |
| TrypLE Express Enzyme (1x), no phenol red | Gibco | 12604013 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 |
Referências
- Wang, Y., Wang, G., Luo, X., Qiu, J., Tang, C. Substrate stiffness regulates the proliferation, migration, and differentiation of epidermal cells. Burns. 38, 414-420 (2012).
- Viswanathan, P., et al. 3D surface topology guides stem cell adhesion and differentiation. Biomaterials. 52, 140-147 (2015).
- Peyton, S. R., et al. Marrow-derived stem cell motility in 3D synthetic scaffold is governed by geometry along with adhesivity and stiffness. Biotechnology and Bioengineering. 108 (5), 1181-1193 (2011).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nature Reviews Molecular Cell Biology. 18 (12), 728-742 (2017).
- Chaudhuri, O., Cooper-White, J., Janmey, P. A., Mooney, D. J., Shenoy, V. B. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584, 535-546 (2020).
- Guido, S., Tranquillo, R. T. A methodology for the systematic and quantitative study of cell contact guidance in oriented collagen gels. Correlation of fibroblast orientation and gel birefringence. Journal of Cell Science. 105 (2), 317-331 (1993).
- Teixeira, A. I., Abrams, G. A., Bertics, P. J., Murphy, C. J., Nealey, P. F. Epithelial contact guidance on well-defined micro- and nanostructured substrates. Journal of Cell Science. 116, 1881-1892 (2003).
- Driscoll, M. K., Sun, X., Guven, C., Fourkas, J. T., Losert, W. Cellular contact guidance through dynamic sensing of nanotopography. ACS Nano. 8 (4), 3546-3555 (2014).
- Buskermolen, A. B. C., et al. Cellular contact guidance emerges from gap avoidance. Cell Reports Physical Science. 1 (5), 100055 (2020).
- Thrivikraman, G., et al. Cell contact guidance via sensing anisotropy of network mechanical resistance. Proceedings of the National Academy of Sciences of the United States of America. 118 (29), 1-11 (2021).
- Buskermolen, A. B. C., et al. Entropic forces drive cellular contact guidance. Biophysical Journal. 116 (10), 1994-2008 (2019).
- Vignaud, T., et al. Reprogramming cell shape with laser nano-patterning. Journal of Cell Science. 125 (9), 2134-2140 (2012).
- Pouthas, F., et al. In migrating cells, the Golgi complex and the position of the centrosome depend on geometrical constraints of the substratum. Journal of Cell Science. 121 (14), 2406-2414 (2008).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Théry, M., et al. Anisotropy of cell adhesive microenvironment governs cell internal organization and orientation of polarity. Proceedings of the National Academy of Sciences of the United States of America. 103 (52), 19771-19776 (2006).
- Huang, G., et al. Functional and biomimetic materials for engineering of the three-dimensional cell microenvironment. Chemical Reviews. 117 (20), 12764-12850 (2017).
- Callens, S. J. P., Uyttendaele, R. J. C., Fratila-Apachitei, L. E., Zadpoor, A. A. Substrate curvature as a cue to guide spatiotemporal cell and tissue organization. Biomaterials. 232, 119739 (2020).
- Yilmaz, C. O., Xu, Z. S., Gracias, D. H. Curved and Folded Micropatterns in 3D Cell Culture and Tissue Engineering. Methods in Cell Biology. 121, (2014).
- Silver, F. H., Freeman, J. W., Seehra, G. P. Collagen self-assembly and the development of tendon mechanical properties. Journal of Biomechanics. 36 (10), 1529-1553 (2003).
- Werner, M., Kurniawan, N. A., Bouten, C. V. C. Cellular geometry sensing at different length scales and its implications for scaffold design. Materials. 13 (4), 963 (2020).
- Di Cio, S., Bøggild, T. M. L., Connelly, J., Sutherland, D. S., Gautrot, J. E. Differential integrin expression regulates cell sensing of the matrix nanoscale geometry. Acta Biomaterialia. 50, 280-292 (2017).
- Fioretta, E. S., Simonet, M., Smits, A. I. P. M., Baaijens, F. P. T., Bouten, C. V. C. Differential response of endothelial and endothelial colony forming cells on electrospun scaffolds with distinct microfiber diameters. Biomacromolecules. 15 (3), 821-829 (2014).
- Werner, M., Kurniawan, N. A., Korus, G., Bouten, C. V. C., Petersen, A. Mesoscale substrate curvature overrules nanoscale contact guidance to direct bone marrow stromal cell migration. Journal of The Royal Society Interface. 15 (145), 20180162 (2018).
- Ruprecht, V., et al. How cells respond to environmental cues - insights from bio-functionalized substrates. Journal of Cell Science. 130 (1), 51-61 (2017).
- Bao, M., Xie, J., Huck, W. T. S. Recent advances in engineering the stem cell microniche in 3D. Advanced Science. 5 (1800448), 1-16 (2018).
- Zhan, X. Effect of matrix stiffness and adhesion ligand density on chondrogenic differentiation of mesenchymal stem cells. Journal of Biomedical Materials Research - Part A. 108 (3), 675-683 (2020).
- Jiang, T., et al. Untangling the response of bone tumor cells and bone forming cells to matrix stiffness and adhesion ligand density by means of hydrogels. Biomaterials. 188, 130-143 (2019).
- Choi, J. S., Harley, B. A. C. The combined influence of substrate elasticity and ligand density on the viability and biophysical properties of hematopoietic stem and progenitor cells. Biomaterials. 33, 4460-4468 (2012).
- Rape, A. D., Zibinsky, M., Murthy, N., Kumar, S. A synthetic hydrogel for the high-throughput study of cell-ECM interactions. Nature Communications. 6 (8129), 1-9 (2015).
- Camarero-Espinosa, S., et al. 3D printed dual-porosity scaffolds: the combined effect of stiffness and porosity in the modulation of macrophage polarization. Advanced Healthcare Materials. 11 (2101415), 1-16 (2022).
- Bao, M., et al. Cellular volume and matrix stiffness direct stem cell behavior in a 3D microniche. ACS Applied Materials and Interfaces. 11 (2), 1754-1759 (2019).
- Charest, J. L., Eliason, M. T., García, A. J., King, W. P. Combined microscale mechanical topography and chemical patterns on polymer cell culture substrates. Biomaterials. 27, 2487-2494 (2006).
- Bilem, I., et al. Interplay of Geometric Cues and RGD/BMP-2 crosstalk in directing stem cell fate. ACS Biomaterials Science and Engineering. 3 (10), 2514-2523 (2017).
- Nam, K. -. H., et al. Multiscale cues drive collective cell migration. Scientific Reports. 6, 29749 (2016).
- Alom Ruiz, S., Chen, C. S. Microcontact printing: A tool to pattern. Soft Matter. 3 (2), 168-177 (2007).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Protein Micropatterns. A Direct Printing Protocol Using Deep UVs. Methods in Cell Biology. 97, (2010).
- Kane, R. S., Takayama, S., Ostuni, E., Ingber, D. E., Whitesides, G. M. Patterning proteins and cells using soft lithography. Biomaterials. 20 (23-24), 2363-2376 (1999).
- Azioune, A., Storch, M., Bornens, M., Théry, M., Piel, M. Simple and rapid process for single cell micro-patterning. Lab on a Chip. 9 (11), 1640 (2009).
- Offenhäusser, A., et al. Microcontact printing of proteins for neuronal cell guidance. Soft Matter. 3 (3), 290-298 (2007).
- Ricoult, S. G., Sanati Nezhad, A., Knapp-Mohammady, M., Kennedy, T. E., Juncker, D. Humidified microcontact printing of proteins: universal patterning of proteins on both low and high energy surfaces. Langmuir. 30 (40), 12002-12010 (2014).
- Waterkotte, B., et al. Biofunctional Micropatterning of Thermoformed 3D Substrates. Advanced Functional Materials. 24 (4), 442-450 (2014).
- Lehnert, D., et al. Cell behaviour on micropatterned substrata: Limits of extracellular matrix geometry for spreading and adhesion. Journal of Cell Science. 117 (1), 41-52 (2004).
- Sevcik, E. N., Szymanski, J. M., Jallerat, Q., Feinberg, A. W. Patterning on topography for generation of cell culture substrates with independent nanoscale control of chemical and topographical extracellular matrix cues. Current Protocols in Cell Biology. 75, 1-25 (2017).
- Micropatterning: Surface functionalization. Alvéole Available from: https://www.alveolelab.com/technology/micropatterning-surface-functionalization/ (2022)
- Strale, P. O., et al. Multiprotein printing by light-induced molecular adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- van Gaal, R. C., Miltenburg, R. P. R. S., Kurniawan, N. A., Bouten, C. V. C., Dankers, P. Y. W. Renal epithelial cell responses to supramolecular thermoplastic elastomeric concave and convex structures. Advanced Materials Interfaces. 8 (1), 2001490 (2021).
- Foster, J. W., Gouveia, R. M., Connon, C. J. Low-glucose enhances keratocyte-characteristic phenotype from corneal stromal cells in serum-free conditions. Scientific Reports. 5, 1-16 (2015).
- Van Der Putten, C., et al. Protein micropatterning in 2.5D: an approach to investigate cellular responses in multi-cue environments. ACS Applied Materials and Interfaces. 13 (22), 25589-25598 (2021).
- Melero, C., et al. Light-induced molecular adsorption of proteins using the primo system for micro-patterning to study cell responses to extracellular matrix proteins. Journal of Visualized Experiments. (152), e60092 (2019).
- Hou, Y., et al. Surface roughness gradients reveal topography-specific mechanosensitive responses in human mesenchymal stem cells. Small. 16 (10), 1905422 (2020).
- Bourkoula, A., et al. Roughness threshold for cell attachment and proliferation on plasma micro-nanotextured polymeric surfaces: The case of primary human skin fibroblasts and mouse immortalized 3T3 fibroblasts. Journal of Physics D: Applied Physics. 49 (30), 304002 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados